Projekt UPGOW współfinansowany przez
Unię Europejską w ramach
Europejskiego Funduszu Społecznego
Uniwersytet Śląski w Katowicach, ul. Bankowa 12, 40-007 Katowice, http://www.us.edu.pl
UNIWERSYTET ŚLĄSKI
Wydział Matematyki, Fizyki i Chemii
ECTS Europejski System Transferu i Akumulacji
Punktów
Kierunek:
C
C
H
H
E
E
M
M
I
I
A
A
Specjalność:
C
C
H
H
E
E
M
M
I
I
A
A
L
L
E
E
K
K
Ó
Ó
W
W
Z
Z
E
E
L
L
E
E
M
M
E
E
N
N
T
T
A
A
M
M
I
I
K
K
O
O
S
S
M
M
E
E
T
T
O
O
L
L
O
O
G
G
I
I
I
I
Rodzaj studiów
I stopnia, stacjonarne
Czas trwania
3 lata
Rekrutacja
Konkurs świadectw maturalnych
Tytuł zawodowy/naukowy
Licencjat
Kontynuacja
Studia II stopnia
Koordynator ECTS
dr Aleksandra Tyl
Sylwetka absolwenta:
Absolwent studiów I stopnia posiada wiedzę z zakresu chemii oraz świadomość miejsca
chemii w dziedzinie nauk matematyczno-przyrodniczych. Ma kwalifikacje fachowe do
pracy na stanowisku chemika i przygotowany jest do ich systematycznego podnoszenia.
Umie samodzielnie zdobywać informacje potrzebne do rozwiązywania problemów
zawodowych. Potrafi selekcjonować informacje i przetwarzać je dla potrzeb własnych
i innych osób w formie pisemnej i ustnej. Jest przygotowany do pracy zespołowej
i indywidualnej. Absolwent rozumie sens przestrzegania zasad prawnych i etycznych, w
tym reguł dobrej praktyki laboratoryjnej i produkcyjnej. Cechuje go świadomość
ekologiczna. Absolwent ma wiedzę z informatyki pozwalającą na posługiwanie się
typowymi programami użytkowymi, korzystanie z baz danych, obsługiwanie
skomputeryzowanych przyrządów pomiarowych. Zna język obcy w sposób
umożliwiający porozumiewanie się i korzystanie z literatury fachowej. Absolwent
znajdzie pracę jako chemik w laboratorium badawczym lub kontroli jakości, ponadto np.
w administracji państwowej i samorządowej (wydziały ochrony środowiska) oraz
przedsiębiorstwach
produkcyjnych
i handlowych,
zwłaszcza
farmaceutycznych,
chemicznych lub związanych z przemysłem spożywczym. Absolwent ma uprawnienia do
podjęcia studiów II stopnia na kierunku chemia lub pokrewnych.

Strona 2 z 40
SPIS TREŚCI
SPIS TREŚCI ........................................................................................................................ 2
ECTS – WPROWADZENIE............................................................................................... 3
Informacje o Uniwersytecie Śląskim............................................................................ 5
Informacje o Instytucie Chemii..................................................................................... 9
Informacje o kierunku.............................................................................................. 11
Siatka studiów............................................................................................................... 12
GRUPA TREŚCI PODSTAWOWYCH........................................................................... 15
Matematyka A............................................................................................................... 15
Biochemia i biologia ..................................................................................................... 17
Biomakromolekuły ....................................................................................................... 18
Podstawy chemii........................................................................................................... 19
Chemia analityczna ...................................................................................................... 21
Laboratorium badań materiałów ............................................................................... 22
Krystalografia................................................................................................................ 23
Chemia nieorganiczna A ............................................................................................. 24
Chemia kwantowa........................................................................................................ 25
Chemia fizyczna A ....................................................................................................... 26
Chemia organiczna A................................................................................................... 27
GRUPA TREŚCI KIERUNKOWYCH. ........................................................................... 28
Chemia materiałów i zarządzanie chemikaliami..................................................... 28
Technologia chemiczna................................................................................................ 29
INNE WYMAGANIA ...................................................................................................... 30
Technologia informacyjna ........................................................................................... 30
Przedmiot interdyscyplinarny:................................................................................... 31
Matematyka B ............................................................................................................... 32
Matematyka stosowana z chemometrią.................................................................... 33
Fizyka B.......................................................................................................................... 34
Chemia nieorganiczna B .............................................................................................. 35
Chemia fizyczna B ........................................................................................................ 36
Chemia organiczna B ................................................................................................... 37
Analiza leków i kosmetyków...................................................................................... 38
Surowce farmaceutyczne i kosmetyczne. ................................................................. 39
Wstęp do projektowania leków.................................................................................. 40

ECTS – WPROWADZENIE Strona 3 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
ECTS – WPROWADZENIE
Komisja Europejska promuje współprace pomiędzy uczelniami, uznając jej
znaczenie dla podnoszenia poziomu kształcenia - tak z myślą o studentach, jak
i instytucji szkolnictwa wyższego - a dominującym elementem tej współpracy są
wyjazdy studentów na studia zagraniczne. W tym celu opracowany został tzw.
Europejski System Transferu Punktów (European Credit Transfer System ECTS),
mający się przyczynić do udoskonalenia procedur i szerszego uznawania studiów
odbywanych za granicą. Podstawą systemu ECTS są trzy elementy „rdzeniowe”:
informacja (o programie zajęć i osiągnięciach studenta w nauce), porozumienie
o programie zajęć (pomiędzy współpracującymi uczelniami i studentem) oraz
stosowanie punktów ECTS (określających „ilość pracy”, jaką student musi
wykonać, aby uzyskać zaliczenie). Punkty ECTS są wartością liczbową od 1 do 60.
Odzwierciedlają one ilość pracy, jakiej wymaga każdy przedmiot w stosunku do
całkowitej ilości pracy, jaką musi wykonać student, aby zaliczyć pełny rok
akademicki w danej uczelni. a zatem obejmuje: wykłady, ćwiczenia, laboratoria,
prace terenowe, seminaria, pracę indywidualną - w bibliotece lub w domu oraz
egzaminy lub inne formy oceny. Do uzyskania tytułu licencjata (I stopień
studiów) konieczne jest uzyskanie 180, natomiast do otrzymania tytuł magistra
(II stopień studiów) - 120 punktów. Punkty z danego przedmiotu przyznaje się,
jeśli student uzyska z niego ocenę pozytywną. Oceny
ECTS
i
ich
polskie
odpowiedniki liczbowe podane są poniżej.
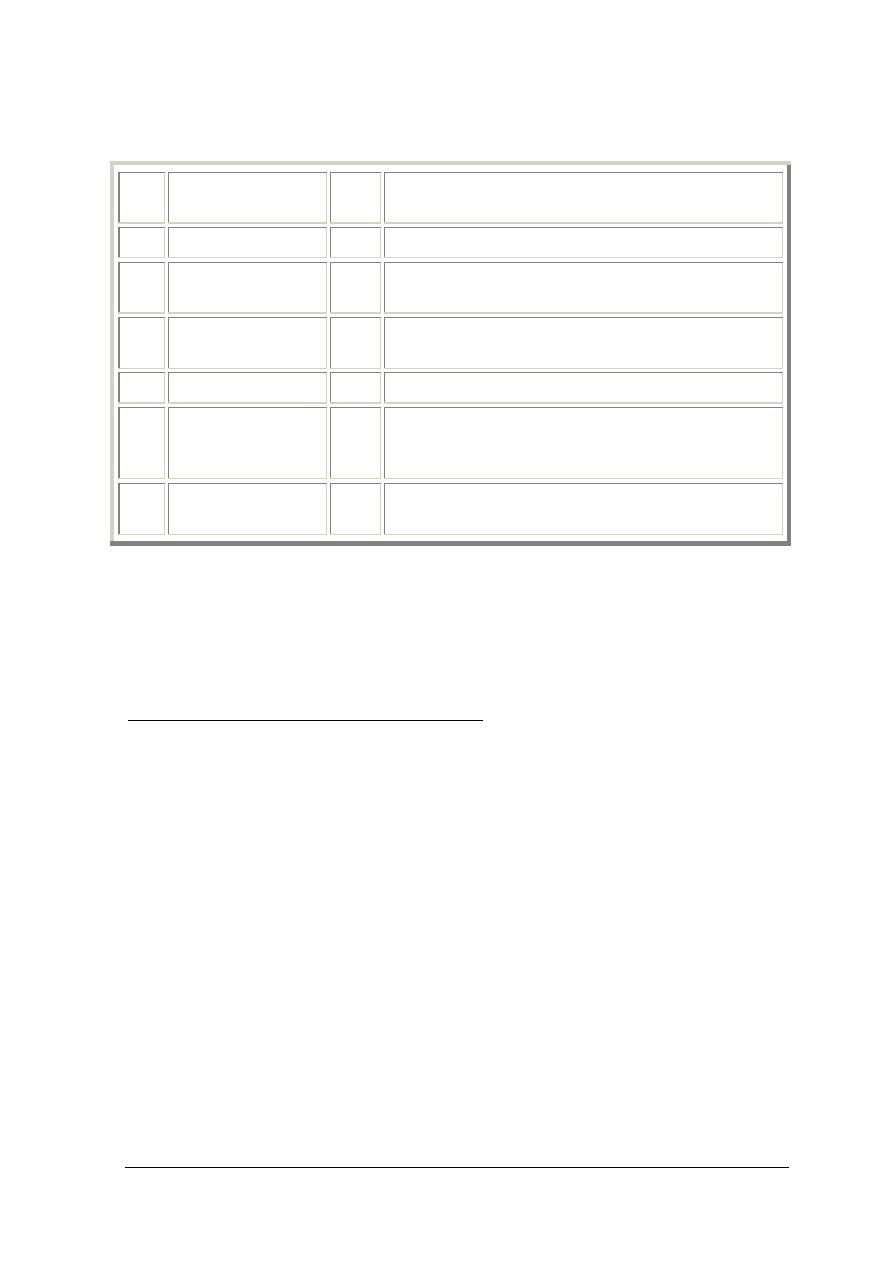
ECTS – WPROWADZENIE Strona 4 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Skala stopni ECTS
A
celujący
5.0
wybitne osiągnięcia / wyniki z dopuszczeniem
jedynie drugorzędnych błędów
B
bardzo dobry
4.5
powyżej średniego standardu, z pewnymi błędami
C
dobry
4.0
generalnie solidna praca z szeregiem zauważalnych
błędów
D
zadowalający
3.5
zadowalający, ale ze znaczącymi / istotnymi
błędami
E
dostateczny
3.0
praca/wyniki spełniają minimalne kryteria
FX
niedostateczny
-
punkty będzie można przyznać, gdy student
uzupełni podstawowe braki w opanowaniu
materiału
F
niedostateczny
-
punkty będzie można przyznać, gdy student
gruntownie przygotuje całość materiału
Osoby odpowiedzialne za program ECTS w Uniwersytecie Śląskim:
Koordynator d/s ECTS w Instytucie Chemii:
dr Aleksandra Tyl
Instytut Chemii UŚl
40-006 Katowice
ul. Szkolna 9
tel.: +48 32 359 1562,
e-mail: atyl@us.edu.pl

ECTS – WPROWADZENIE Strona 5 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Informacje o Uniwersytecie Śląskim
Uniwersytet Śląski powstał w roku 1968 jako dziewiąty uniwersytet w kraju.
Dzisiaj ma swoje wydziały w kilku miastach regionu: Katowicach, Sosnowcu,
Chorzowie, Cieszynie, Rybniku i Jastrzębiu Zdroju. Większość obiektów UŚl
znajduje się w Katowicach. Uniwersytet składa się z 12 wydziałów:
•
Artystycznego
•
Biologii i Ochrony Środowiska
•
Etnologii i Nauk o Edukacji
•
Filologicznego
•
Informatyki i Nauki o Materiałach
•
Matematyki, Fizyki i Chemii
•
Nauk Społecznych
•
Nauk o Ziemi
•
Pedagogiki i Psychologii
•
Prawa i Administracji
•
Radia i Telewizji
•
Teologicznego.
Ponadto w Uniwersytecie działają następujące jednostki dydaktyczne:
•
Międzywydziałowe Indywidualne Studia Matematyczno – Przyrodnicze
(MISMP)
•
Międzywydziałowe Indywidualne Studia Humanistyczne (MISH)
•
Studium Wychowania Fizycznego i Sportu
•
Szkoła Języka i Kultury Polskiej
•
Szkoła Zarządzania
•
Studium Praktycznej Nauki Języków Obcych
•
Uniwersytet Trzeciego Wieku
•
Międzynarodowa Szkoła Nauk Politycznych
•
Centrum Studiów nad Człowiekiem i Środowiskiem

ECTS – WPROWADZENIE Strona 6 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
•
Studium Intensywnej Nauki Języka Angielskiego – English Language
Centre
•
Ośrodek Polskiego Komitetu Współpracy z Alliance Française przy
Uniwersytecie Śląskim
•
Międzywydziałowa Pracownia Badań Strukturalnych
•
Ośrodek Działalności Dydaktycznej w Jastrzębiu
•
Dydaktyczny w Rybniku
•
Centrum Technik Kształcenia na Odległość w Uniwersytecie Śląskim
•
Wszechnica Śląska - Uniwersyteckie Centrum Umiejętności
oraz jednostka wspólna:
•
Śląska Międzynarodowa Szkoła Handlowa
Zasoby Biblioteki Uniwersytetu to ponad 1 000 000 książek i ponad 2 313
prenumerowanych na bieżąco czasopism dostępnych w 15 bibliotekach
specjalistycznych. Biblioteka wyposażona jest w sieć komputerów PC, dostępnych
jest 58 baz danych i ok. 16 tysięcy czasopism elektronicznych. W Internecie
udostępniony jest
katalog online (OPAC)
zbiorów bibliotecznych zakupionych po
1996 roku oraz zeskanowane katalogi tradycyjne umożliwiający zamawianie
nowych pozycji oraz przedłużanie wypożyczonych na czas określony.
Szczegółowe informacje dotyczące funkcjonowania biblioteki można znaleźć pod
adresem:
www.bg.us.edu.pl
Na Uniwersytecie studiuje łącznie ok. 41000 studentów studiów stacjonarnych,
niestacjonarnych, podyplomowych oraz uczestników studium doktoranckiego.
Informacje związane z naborem na studia można uzyskać w Dziale
Kształcenia UŚl, (40-007 Katowice, ul. Bankowa 12; tel. (32) 359 20
47) lub na stronie
www.us.edu.pl
w zakładce Rekrutacja

ECTS – WPROWADZENIE Strona 7 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Rektor Uniwersytetu (i prorektorzy) oraz dziekani wydziałów (i prodziekani)
wyłaniani są w wyborach, które odbywają się co cztery lata. Obecnie funkcje
pełnią:
REKTOR
prof. zw. dr hab.
Wiesław Banyś
40-007 Katowice
ul. Bankowa 12,
tel. (32) 258 71 19
fax (32) 259 96 05
Prorektor ds. Finansów
i Rozwoju
prof. zw. dr hab.
Stanisław Kucharski
tel .: (32) 359 14 50
fax: (32) 359 20 40
Prorektor ds. Nauki
i Współpracy z Gospodarką
prof. dr hab.
Andrzej Kowalczyk
tel.: (32) 258 65 51
fax: (32) 259 73 98
Prorektor ds. Studenckich,
Promocji i Współpracy z
Zagranicą
prof. dr hab.
Barbara Kożusznik
tel.: (32) 258 97 39
fax: (32) 259 73 99
Prorektor ds. Kształcenia
prof. dr hab.
Czesław Martysz
tel.: (32) 258 97 39
fax: (32) 259 73 99
Dziekan Wydziału Matematyki,
Fizyki i Chemii
prof. UŚ, dr hab.
Maciej Sablik
40-007 Katowice
ul. Bankowa 14,
tel. (32) 258 44 12
Prodziekan kierunku Chemia
dr hab. Piotr Kuś
tel. (32) 258 15 50
Rok akademicki reguluje zarządzenie Rektora Uniwersytetu Śląskiego w sprawie
organizacji roku akademickiego – ostatnie: nr 38/2008 z 20 czerwca 2008r.
Podzielony jest na dwa semestry. Semestr zimowy rozpoczyna się pierwszego
października i trwa do połowy stycznia, kiedy to zaczyna się sesja egzaminacyjna.
Semestr letni trwa od połowy lutego do początku czerwca. W czasie roku
akademickiego występują dwie krótkie przerwy: jedna w grudniu (Święta Bożego
Narodzenia i Nowy Rok), a druga w okresie Świąt Wielkanocnych. Od połowy
czerwca do końca sierpnia studenci nie mają zajęć dydaktycznych, mogą jednak
brać udział w organizowanych dla nich kursach letnich.

ECTS – WPROWADZENIE Strona 8 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Uniwersytet Śląski dysponuje ok. 3400 miejscami zakwaterowania w 12 domach
studenta (w większości w pokojach dwuosobowych). Opłatę za zakwaterowanie
reguluje się co miesiąc.
Wszyscy studenci zarówno polscy jak i zagraniczni mają zapewnioną bezpłatną
opiekę medyczną.
W Uniwersytecie Śląskim działają również aktywnie koła naukowe zrzeszające
studentów danego wydziału lub kierunku.
Wolny czas studenci mogą spędzać w klubach studenckich takich jak: „Straszny
dwór”, „Antidotum” oraz „Panopticum”, które oferują zainteresowanym muzykę,
taniec, sport i inne rozrywki. Na terenie Katowic i Sosnowca funkcjonują dwie
studenckie rozgłośnie radiowe: „Egida” nadająca na zasadzie radiowęzła
o zasięgu osiedla akademickiego w Katowicach - Ligocie oraz „Rezonans”
nadające na częstotliwości 99,1 MHz.
Przydatne informacje:
Informacje ogólne o Uniwersytecie Śląskim:
www.us.edu.pl
a.
strukturze - zakładka Struktura
b.
rekrutacji - zakładka Rekrutacja
c.
ogłoszenia i informacje dla studentów - zakładka Student
d.
informacje o programach stypendialnych, w tym o programie
LLP/ERASMUS - zakładka Nauka
2.
Informacje o bibliotece:
www.bg.us.edu.pl
katalog biblioteki online - zakładka Katalog

ECTS – WPROWADZENIE Strona 9 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Informacje o Instytucie Chemii
(Instytut Chemii, 40-006 Katowice, ul. Szkolna 9, tel. +48 32 359 1545, fax.+48 32
259 9978,
www.chemia.us.edu.pl
)
Pracownicy samodzielni Instytutu Chemii: H. Flakus, M. Jaworska, E. John,
T. Kowalska, S. Krompiec (zastępca Dyrektora), S. Kucharski, P. Kuś, B. Machura,
W. Marczak, M. Matlengewicz, H. Mrowiec, W. Pisarski, J. Polański (Dyrektor
Instytutu)
, W. Sułkowski, B. Walczak. Instytut zatrudnia 55 pracowników
z doktoratem, 25 pracowników technicznych. Studiuje ponad 400 studentów.
W Instytucie działa 12 grup badawczych (zakładów).
Zakład Dydaktyki Chemii
Zakład Chemometrii
Zakład Chemii Ogólnej i Chromatografii
Zakład Chemii Organicznej
Pracownia Projektowania Związków Biologicznie Aktywnych
Zakład Chemii Nieorganicznej i Koordynacyjnej
Zakład Chemii Analitycznej
Zakład Chemii Fizycznej
Pracownia Elektrochemii
Zakład Fizyki Chemicznej
Zakład Chemii i Technologii Środowiska
Zakład Chemii Teoretycznej
Pracownia Komputerowa ICh
Zakład Krystalografii
Zakład Syntezy Organicznej
Pracownia Techniczna

ECTS – WPROWADZENIE Strona 10 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Szczegółowa
charakterystyka
działalności
naukowej
i
dydaktycznej
poszczególnych zakładów jest dostępna na stronie:
www.chemia.us.edu.pl
Wszystkie grupy badawcze Instytutu Chemii są zaangażowane w problematykę
chemii środowiska.
Od 31 lat Instytut organizuje coroczne sympozja chromatograficzne nt.
„Chromatograficzne Metody Badania Związków Organicznych”.
Od 1992 Instytut Chemii wydaje międzynarodowe czasopismo Acta
Chromatographica znajdujące się na Liście Filadelfijskiej (IF=1,109), poświęcone
wszystkim aspektom chromatografii.
Przy Instytucie od wielu lat działa Koło Naukowe Chemików, w ramach którego
studenci (wszystkich roczników) mają możliwość prowadzenia swoich
indywidualnych programów badawczych. Informacje o działalności Koła
Naukowego Chemików można znaleźć pod adresem:
www.knch.us.edu.pl
.
Instytut
Chemii
organizuje
Konkurs
Chemiczny
dla
uczniów
szkół
ponadgimnazjalnych. Współorganizatorami Konkursu są: Oddział Katowicki
Polskiego Towarzystwa Chemicznego oraz Pałac Młodzieży w Katowicach.
W 2008 Instytut Chemii już po raz drugi uczestniczył w organizowaniu imprezy
popularyzującej nauki ścisłe o nazwie Święto Liczby Pi odbywającej się w obrębie
Wydziału Matematyki Fizyki i Chemii. Uczestnicy tej imprezy - wszyscy
zainteresowani naukami ścisłymi bez względu na poziom mogli wysłuchać
wykładów popularnonaukowych, uczestniczyć w pokazach eksperymentów
fizycznych i chemicznych oraz zwiedzić wybrane pracownie naukowe.

ECTS – WPROWADZENIE Strona 11 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Informacje o kierunku
Na kierunku chemia można studiować w następujących specjalnościach – studia I
(licencjackie) i II (magisterskie) stopnia, stacjonarne (3 + 2 lata):
•
chemia w zakresie chemii podstawowej,
•
chemia leków z elementami kosmetologii,
•
chemia informatyczna oraz
•
chemia środowiska,
Dyplom
: mgr chemii, licencjat
Niniejszy opis dotyczy programu realizowanego w ramach studiów I stopnia
(licencjackich), 3-letnich, stacjonarnych w specjalnościach chemia leków
z elementami kosmetologii.
W ramach przedmiotu interdyscyplinarnego, student może wybrać w semestrze 1
wykłady z „Filozofii” lub „Wstęp do przedsiębiorczości”, natomiast w semestrze 2
dla studentów specjalizacji Chemia leków z elementami kosmetologii, oraz
Chemia informatyczna, zaleca się wybór wykładu „Prawo własności
intelektualnej”, poruszający aspekty prawa patentowego, prawa autorskiego
(a Internet).
Poniżej przedstawiono siatki studiów I stopnia dla specjalności chemia leków
z elementami kosmetologii.
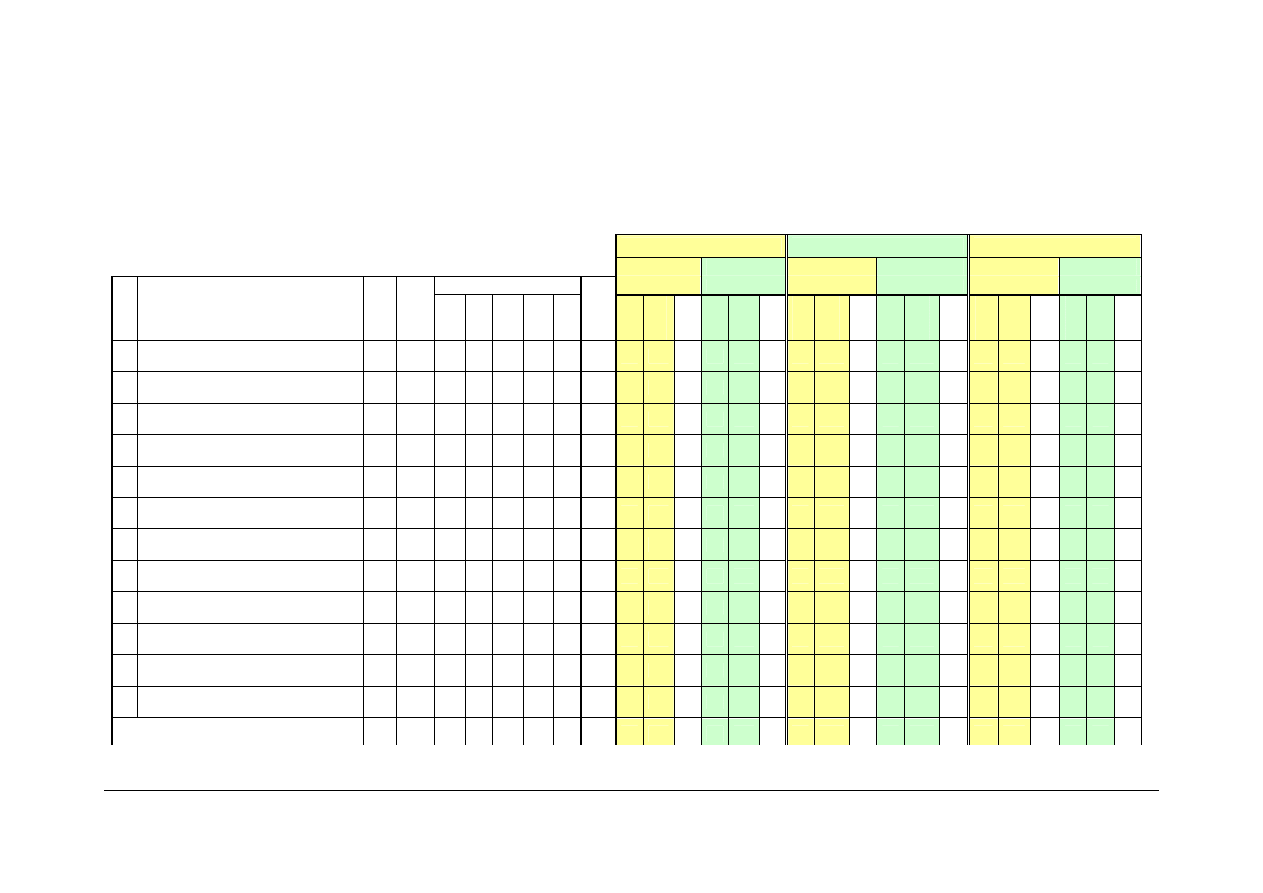
SIATKA STUDIÓW Strona 12 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Siatka studiów
Wydział Matematyki, Fizyki i Chemii
studia I stopnia
Kierunek chemia
studia stacjonarne
Specjalność chemia leków z elementami kosmetologii
od roku akademickiego 2009/10
I rok
II rok
III rok
A GRUPA TREŚCI PODSTAWOWYCH
semestr 1
semestr 2
semestr 3
semestr 4
semestr 5
semestr 6
w tym
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
Lp
Nazwa przedmiotu
E/Z
R
az
em
w
y
k
ła
d
y
ćw
ic
z.
la
b
o
ra
t.
k
o
n
w
er
.
se
m
in
.
R
az
em
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
1 Matematyka A
E
120
60
60
15
60
60
15
2 Fizyka A
E
75
30
30
15
7
30
45
7
3 Biochemia i biologia
E
45
45
4
45
4
4 Biomakromolekuły
E
15
15
2
15
2
5 Podstawy chemii
E
180
45
90
15
30
17
30 105
13
15
30
4
6 Chemia analityczna
E
120
15
90
15
7
15 105
7
7 Laboratorium badań materiałów
E
75
15
45
15
5
15
60
5
8 Krystalografia
E
30
15
15
2
15
15
2
9 Chemia nieorganiczna A
E
105
30
60
15
8
30
75
8
10 Chemia kwantowa
E
45
15
30
5
15
30
5
11 Chemia fizyczna A
E
135
30
60
45
10
30
105
10
12 Chemia organiczna A
E
150
45
90
15
13
45
105
13
RAZEM A:
1095 360 0 510 195 30
95
90 165
28
60 180
18
60 150
15
45 135
15
45 105
13
60
0
6
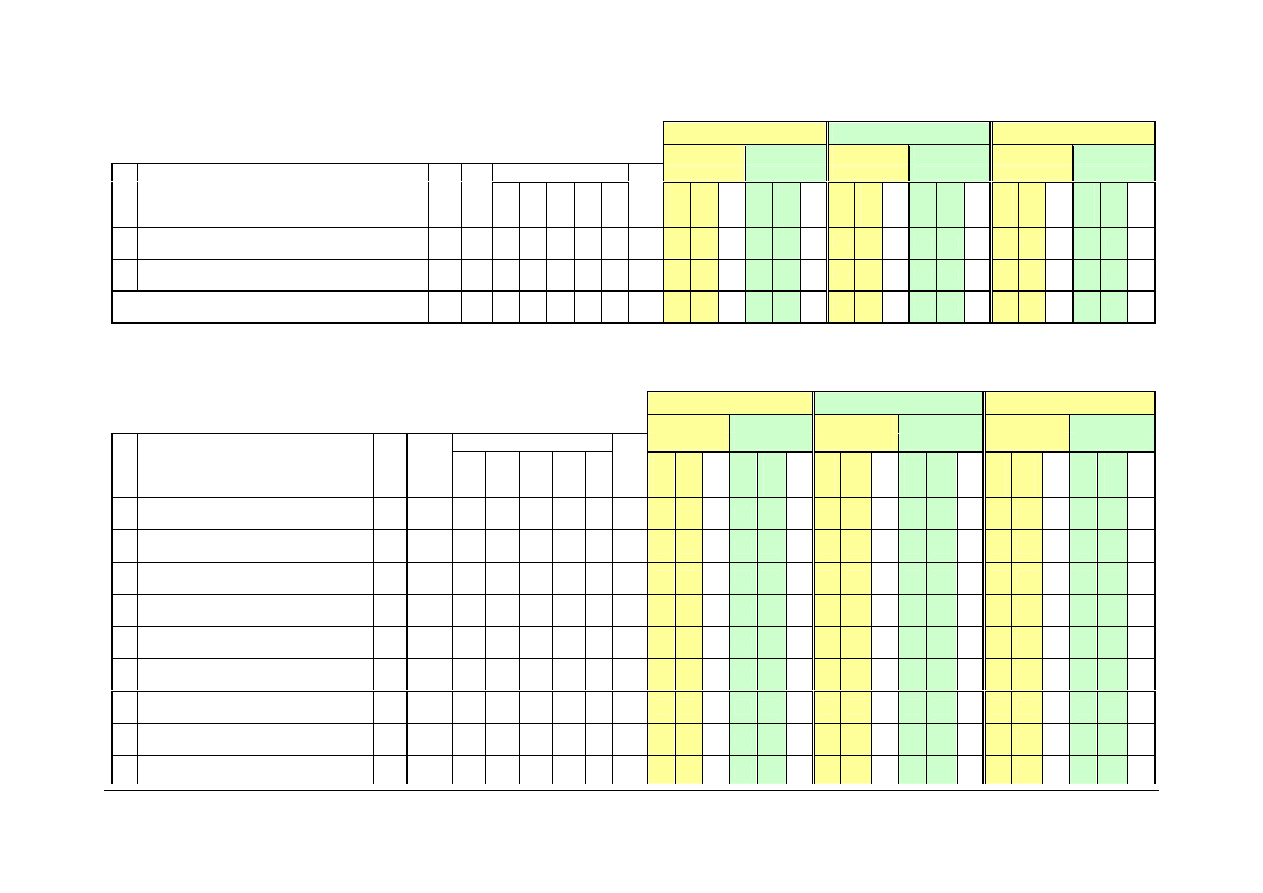
SIATKA STUDIÓW Strona 13 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
I rok
II rok
III rok
B GRUPA TREŚCI KIERUNKOWYCH
semestr 1
semestr 2
semestr 3
semestr 4
semestr 5
semestr 6
w tym
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
Lp
Nazwa przedmiotu
E/Z
R
az
em
w
y
k
ła
d
y
ćw
ic
z.
la
b
o
ra
t.
k
o
n
w
er
.
se
m
in
.
R
az
em
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
13 Chemia materiałów i zarządzanie chemikaliami
E
30
15
15
4
15 15
4
14 Technologia chemiczna
E
90
45
45
6
45 45
6
RAZEM B:
120 60
0
60
0
0
10
0
0
0
0
0
0
0
0
0
0
0
0
15 15
4
45 45
6
I rok
II rok
III rok
C INNE WYMAGANIA
semestr 1
semestr 2
semestr 3
semestr 4
semestr 5
semestr 6
w tym
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
Lp
Nazwa przedmiotu
E/Z
R
az
em
w
y
k
ła
d
y
ćw
ic
z.
la
b
o
ra
t.
k
o
n
w
er
.
se
m
in
.
R
az
em
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
15 Wychowanie fizyczne
Z
60
60
0
30
0
30
0
16 Język angielski
Z
180
180
7
60
2
60
3
60
2
17 Technologia informacyjna
E
75
30
45
2
30
45
2
18 Przedmiot interdyscyplinarny
E
60
60
4
30
2
30
2
19 Matematyka B
E
90
45
45
8
45
45
8
20 Matematyka stosowana z chemometrią
E
45
15
15
15
5
15
30
5
21 Fizyka B
E
45
30
15
5
30
15
5
22 Chemia nieorganiczna B
E
45
30
15
5
30
15
5
23 Chemia fizyczna B
E
105
15
60
30
9
15
90
9
SIATKA STUDIÓW Strona 14 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
I rok
II rok
III rok
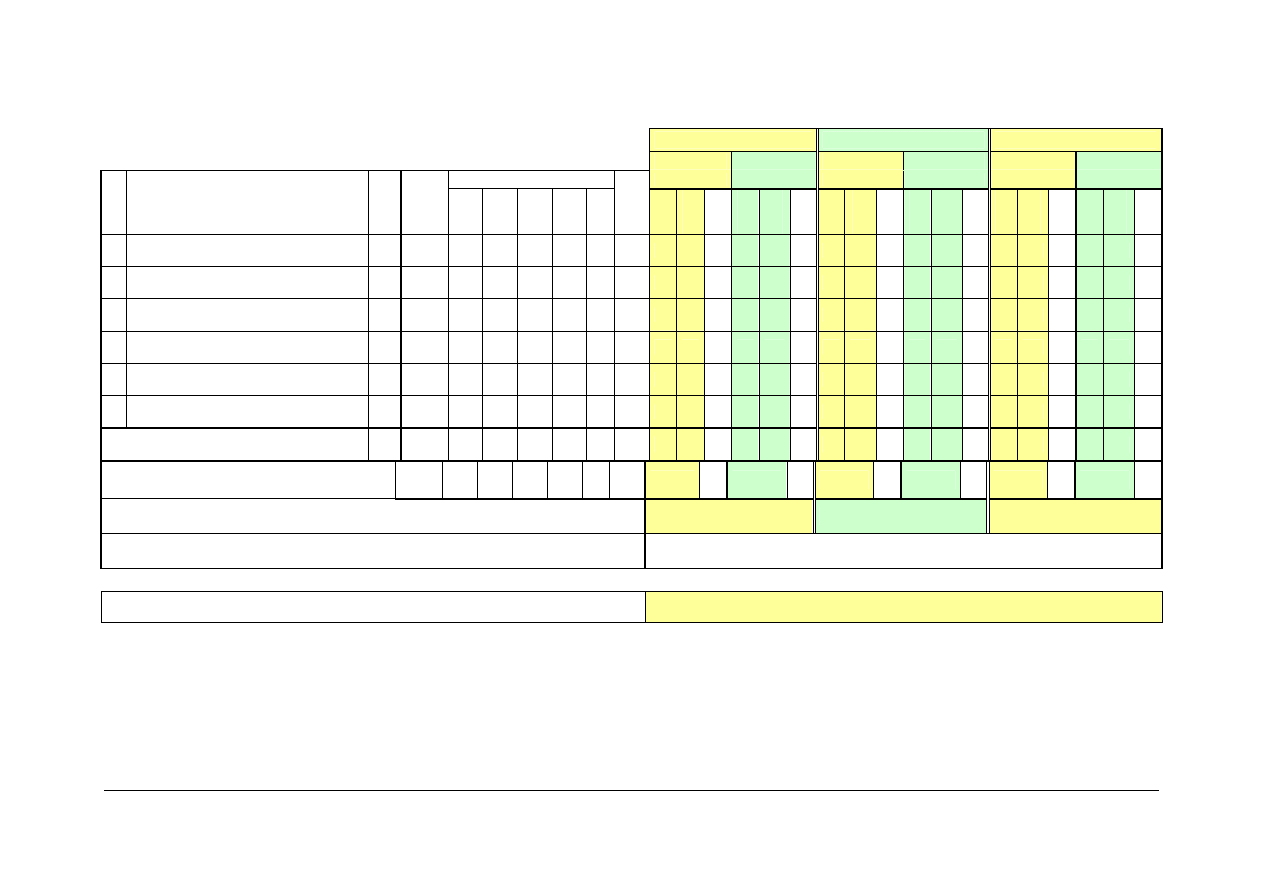
C INNE WYMAGANIA cd.
semestr 1
semestr 2
semestr 3
semestr 4
semestr 5
semestr 6
w tym
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
15 tyg.
Lp
Nazwa przedmiotu
E/Z
R
az
em
w
y
k
ła
d
y
ćw
ic
z.
la
b
o
ra
t.
k
o
n
w
er
.
se
m
in
.
R
az
em
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
w
y
k
ł.
ćw
ic
z.
E
C
T
S
24 Chemia organiczna B
E
120
15
90
15
8
15 105
8
25 Analiza leków i kosmetyków
E
30
15
15
4
15
15
4
26 Surowce farmaceutyczne i kosmetyczne
E
30
15
15
4
15
15
4
27 Wstęp do projektowania leków
E
30
15
15
4
15
15
4
28 Pracownia licencjacka
Z
120
120
7
120
7
29 Seminarium licencjackie
Z
30
30
3
30
3
RAZEM C:
1065
285 240 360 150 30
75
30 30
2
75 135
12
75 150
15
60 105
15
30 105
13
15 255
18
RAZEM SEMESTRY
(A+B+C)
2 280 705 240 930 345 60
180
315
30
450
30
435
30
345
30
315
30
420
30
RAZEM ROCZNIE
765
780
735
OGÓŁEM
2 280
P R A K T Y K I
trzy tygodnie praktyk w czasie trwania studiów/praktyki odbywają się po I lub II roku

GRUPA TREŚCI PODSTAWOWYCH. Strona 15 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
GRUPA TREŚCI PODSTAWOWYCH.
Numer w siatce studiów: 1
Kod przedmiotu:
0310-1.03.1.001
ECTS: 15
Matematyka A
Forma zajęć:
wykład + konwersatorium
Semestr:
zimowy (1)
Liczba godzin:
60+60 = 120
Wykładowca:
dr Joanna Ger
Forma egzaminu: pisemny
Treści merytoryczne:
Elementy logiki matematycznej i teorii mnogości. Definicja funkcji, złożenie funkcji,
funkcja odwracalna. Własności zbiorów liczb rzeczywistych i zespolonych. Zasada
indukcji matematycznej. Kres górny i kres dolny zbioru. Funkcje elementarne – własności
i wykresy. Algebra liniowa: macierze, układy równań liniowych, wyznaczniki, wartości
własne i wektory własne. Elementy geometrii analitycznej. Elementy of geometrii
przestrzennej. Grupa liniowych przekształceń płaszczyzny. Ciągi liczbowe: zbieżność
w zbiorze liczb rzeczywistych i zbieżność do nieskończoności. Twierdzenia o zbieżności.
Szeregi, kryteria zbieżności szeregów, szeregi potęgowe. Granica funkcji, własności
granic. Ciągłość funkcji, własności funkcji ciągłych. Ciągłość funkcji elementarnych.
Pojęcia pochodnej i różniczki funkcji rzeczywistej. Twierdzenia o wartości średniej oraz
ich konsekwencje. Szereg Taylora. Reguła De l’Hopitala obliczania granic. Całka
nieoznaczona, funkcja pierwotna. Całka Riemanna, metody obliczania całek.
Zastosowanie rachunku różniczkowego i całkowego do rozwiązywania zagadnień
chemicznych.
Cele przedmiotu: Wprowadzenie podstawowych pojęć matematyki współczesnej: liczby
rzeczywiste i zespolone, funkcje, ciągi i szeregi, algebra liniowa, geometria, rachunek
różniczkowy i całkowy. Przedstawienie możliwych zastosowań matematyki w chemii
i fizyce. Efekty kształcenia: Po ukończeniu kursu student powinien posiadać wiedzę na
temat podstawowych pojęć matematyki wyższej. Student powinien posiadać umiejętność
obliczania wykonywania obliczeń granic, pochodnych i całek, jak również rozwiązywania
układów równań liniowych. Student powinien umieć zastosować metody matematyczne
do rozwiązywania zagadnień pochodzących z chemii i fizyki.
Zalecana literatura:
1.
J. Ger, Kurs matematyki dla chemików, Wyd. Uniwersytetu Śląskiego, Katowice 2005.

GRUPA TREŚCI PODSTAWOWYCH. Strona 16 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 2
Kod przedmiotu:
0310-1.03.1.006
ECTS: 7
Fizyka
Fizyka
Fizyka
Fizyka A
A
A
A
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
letni (2)
Liczba godzin:
30 + 15 + 30 = 75
Wykładowca:
prof. dr hab. Ewa Talik
Forma egzaminu: pisemny
Treści merytoryczne:
Istota Fizyki. Wzorce i jednostki miar. Pomiar wielkości fizycznych. Modele
matematyczne w fizyce. Wektory. Wielkości skalarne i wektorowe. Dodawanie
wektorów. Iloczyn skalarny i wektorowy. Kinematyka. Układ odniesienia. Zjawisko
ruchu. Ruch jednowymiarowy i ruch w przestrzeni. Pojęcie przemieszczenia, prędkości i
przyśpieszenia. Rzuty. Ruch po torze krzywoliniowym. Ruch względny. Dynamika
punktu materialnego. Masa, pęd i siła. Zasady dynamiki Newtona. Zastosowanie zasad
dynamiki Newtona. Siły kontaktowe i bezkontaktowe. Tarcie. Opory ruchu w płynie.
Oddziaływania fundamentalne. Praca. Praca wykonywana przez siłę stałą i zmienną.
Energia kinetyczna. Moc. Energia potencjalna. Zasada zachowania energii. Siły
zachowawcze i niezachowawcze. Zasada zachowania pędu. Środek masy. Ruch środka
masy. Zderzenia. Mechanika bryły sztywnej. Moment bezwładności. Moment siły.
Energia i praca w ruchu obrotowym. Moment pędu. Zasada zachowania momentu pędu.
śyroskop i precesja. Warunki równowagi. Moduł sprężystości. Moduł ściśliwości.
Grawitacja. Prawo powszechnego ciążenia. Doświadczenie Cavendisha. Prawa Keplera
ruchu planet. Ciężar. Pole grawitacyjne. Czarne dziury. Ruch drgający. Siła harmoniczna.
Wahadła. Energia ruchu harmonicznego. Oscylator harmoniczny tłumiony. Drgania
wymuszone i rezonans. Mechanika cieczy. Ciśnienie i gęstość. Prawo Pascala. Pomiar
ciśnienia. Prawo Archimedesa. Napięcie powierzchniowe. Włoskowatość. Ciecz w ruchu.
Równanie ciągłości. Równanie Bernoulliego i jego zastosowania. Fale w ośrodkach
sprężystych. Fale mechaniczne. Rozchodzenie się fal. Prędkość fal. Przenoszenie energii
przez fale. Dźwięk. Natężenie dźwięku. Percepcja dźwięku. Fale stojące. Postacie drgań.
Interferencja. Dudnienia. Efekt Dopplera. Fala uderzeniowa.
Cele przedmiotu
: Przedstawienie podstawowych zagadnień z zakresu kursu
uniwersyteckiego z fizyki.
Efekty kształcenia:
Po ukończeniu kursu student powinien
opanować wiedzę z zakresu podstawowych pojęć z fizyki, posiadać umiejętność
pomiarów podstawowych wielkości fizycznych, zrozumienia procesów i zjawisk
fizycznych w przyrodzie, wykorzystywać prawa przyrody w technice i życiu
codziennym.
Zalecana literatura:
1.
D.Halliday, R. Resnick,J.Walker, Podstawy Fizyki, PWN 2003 tomy 1-5.

GRUPA TREŚCI PODSTAWOWYCH. Strona 17 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Molekularne podłoże życia. Teoria powstania życia na Ziemi. Poziomy organizacji życia –
formy bezkomórkowe, komórki, tkanki, narządy. Organizmy jedno- i wielokomórkowe.
Biologiczne pojęcie gatunku, procesy powstawania i wymierania gatunków. Budowa
i fizjologia organizmów prokariotycznych i eukariotycznych. Biochemia a inne nauki
biologiczne. Hierarchia molekularna organizacji komórki. Wiązania kowalencyjne i słabe
wiązania struktur przestrzennych. Reakcje ważne w biochemii. Aminokwasy – budowa,
własności, klasyfikacja. Peptydy naturalne. Białka –budowa, własności, funkcje
w organizmie. Budowa kwasów nukleinowych ich rodzaje i funkcje. Przekazywanie
informacji genetycznej. Replikacja, transkrypcja i translacja. Modyfikacje potranslacyjne
i kierowanie białek. Enzymy i koenzymy. Mechanizmu działania enzymów. Przemiany
związków azotu. Struktura, funkcja i metabolizm mono- di- i polisacharydów. Struktura
i funkcja kwasów tłuszczowych. Metabolizm kwasów tłuszczowych. Lipidy sterydowe.
Budowa i własności błon biologicznych. Rodzaje transportu w poprzek błon
biologicznych. Uzyskiwanie i przechowywanie energii. Łańcuch oddechowy i fosforylacja
oksydacyjna. Główne etapy regulacji podstawowych szlaków metabolicznych (glikoliza,
cykl kwasów trójkarboksylowcyh, cykl
pentozofosforanowy, cykl mocznikowy).
Mechanizmy fotosyntezy. Metabolity wtórne
.
Organizacja komórkowa procesów
metabolicznych oraz ich powiązania funkcjonalne i strukturalne. Regulacja hormonalna.
Cele przedmiotu: Przedstawienie podstaw budowy i funkcji związków organicznych
w organizmach żywych. Wykazanie współzależności metabolizmu i przemian
energetycznych u różnych organizmów. Poznanie podstawowych szlaków i cykli
metabolicznych u Prokaryota i Eukaryota oraz ich regulacji w komórkach, tkankach,
organizmach. Efekty kształcenia: Po ukończeniu kursu student powinien opanować
wiedzę dotyczącą rozkładu i syntezy makromolekuł budujących organizmy żywe,
zdobywania przez nie energii i możliwości regulacji metabolizmu dla właściwego
funkcjonowania organizmów żywych. Da to studentowi podstawy do opanowania
innych nauk biologicznych, medycznych i dziedzin pokrewnych.
Zalecana literatura:
1.
Berg J.M., Tymoszko J.L., Stryer L. Biochemia. PWN. Warszawa. 2007,
2.
Hames B.D., Hooper N.M., Hougton J.D. Biochemia – krótkie wykłady. PWN. Warszawa. 2002.
Numer w siatce studiów: 4
Numer w siatce studiów: 3
Kod przedmiotu:
0310-1.03.1.032
ECTS: 4
Biochemia i biologia
Forma zajęć:
wykład
Semestr:
letni (6)
Liczba godzin:
45
Wykładowca:
prof. dr hab. Sylwia Łabużek,
dr Agnieszka Mrozik
Forma egzaminu:
zaliczenie

GRUPA TREŚCI PODSTAWOWYCH. Strona 18 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Kod przedmiotu:
0310-1.03.1.033
ECTS: 2
Biomakromolekuły
Forma zajęć:
wykład
Semestr:
letni (6)
Liczba godzin:
15
Wykładowca:
dr hab. Piotr Kuś
Forma egzaminu: pisemny
Treści merytoryczne:
Budowa i funkcje błon biologicznych. Lipidy: kwasy tłuszczowe, sterole, fosfolipidy,
glikolipidy, sfingolipidy. Transport przez błony biologiczne. Kanały jonowe. Liposomy.
Monosacharydy, disacharydy, polisacharydy. Formy cykliczne monosacharydów.
Anomeryzacja. Mutarotacja. Cyklodekstryny. Celuloza. Chityna. Skrobia. Glikogen.
Amyloza. Pektyna. Aminokwasy, peptydy, polipeptydy. Wiązanie peptydowe.
Otrzymywanie polipeptydów i białek. Metoda SPPS. Białka - budowa i funkcje
biologiczne. Enzymy: budowa i ich rola biologiczna. Nukleozydy. Nukleotydy. Budowa i
funkcje biologiczne kwasów nukleinowych. DNA. RNA. Witaminy rozpuszczalne w
wodzie. Witaminy rozpuszczalne w tłuszczach. Zależność między strukturą a funkcją
biologiczną związków.
Cele
przedmiotu:
Przedstawienie
podstawowych
pojęć
związanych
z biomakromolekułami: budowa podstawowych składników biomakromolekuł, ich
otrzymywanie, ich właściwości; struktura makromolekuł i ich funkcje biologiczne.
Efekty kształcenia: W czasie trwania kursu student powinien opanować wiedzę
z zakresu budowy i znaczenia podstawowych biomakromolekuł oraz posiadać
umiejętność wykorzystania jej do opisu znaczenia makrocząsteczek w przyrodzie jak
również umiejętność opisu ich właściwości w relacji do ich budowy.
Zalecana literatura:
1.
R.K.Murray, D.K.Granner, P.A.Mayes, V.W.Rodwell, "Biochemia Harpera", PZWL, Warszawa 1995,
2.
K.Dołowy, A.Szewczyk, S.Pikuła, "Błony biologiczne", Wyd "Śląsk", Katowice 2001,
3.
S.Doonan, "Białka i peptydy", Wyd. Naukowe PWN, 2008.

GRUPA TREŚCI PODSTAWOWYCH. Strona 19 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Pierwiastki, związki, roztwory i fazy. Symbole i wzory. Reakcje chemiczne i równania
chemiczne. Energia, ciepło i temperatura. Jednostki miar. Precyzja i dokładność.
Wewnętrzna budowa atomu. Badania doświadczalne nad elektryczną naturą atomu.
Ładunek i masa elektronu. Spektroskopia atomowa. Odkrycie jądra atomowego.
Odkrycie liczby atomowej. Izotopy. Trwałość jądra atomowego. Promieniotwórczość
naturalna i sztuczna. Model atomu Bohra. Budowa atomów a model Bohra. Falowa
natura elektronu. Spin elektronowy. Liczby kwantowe. Elektrony w cząsteczkach.
Wiązania jonowe. Wiązania kowalencyjne. Wiązania koordynacyjne. Polarność wiązań.
Elektroujemność. Energia wiązań i skala elektroujemności. Nasycenie wartościowości.
Rezonans. Kształty cząsteczek i orbitale zhybrydyzowane. Powłoka wartościowości
i odpychanie par elektronów. Stan gazowy. Objętość, temperatura i ciśnienie. Ciśnienia
cząstkowe. Zasada Avogadra. Równanie stanu. Dyfuzja. Teoria kinetyczna gazów.
Odchylenia gazów rzeczywistych od zachowania się gazu doskonałego. Temperatura
krytyczna. Chłodzenie przez rozprężanie. Właściwości cieczy. Ciśnienie pary nasyconej.
Temperatura wrzenia. Właściwości ciał stałych. Sieć przestrzenna kryształów. Ciekłe
kryształy. Upakowanie atomów w sieci krystalicznej. Defekty sieci krystalicznej. Wiązania
w ciałach stałych. Energie spójności kryształów. Krzywe ogrzewania i krzywe chłodzenia.
Przegrzanie i przechłodzenie cieczy. Wykresy fazowe.
Cele przedmiotu:
Rekapitulacja wiedzy chemicznej, wyniesionej z wcześniejszych
etapów nauczania oraz znaczące rozbudowanie tej wiedzy. Szczególny nacisk jest
kładziony na zagadnienia dotyczące budowy materii, typów reakcji chemicznych,
podstawowych praw chemicznych, na znajomość nomenklatury chemicznej oraz na
sprawne wykorzystywanie podstawowych praw chemicznych w rachunku chemicznym
i przy układaniu równań stechiometrycznych.
Efekty kształcenia:
Po ukończeniu kursu
student powinien opanować wiedzę z zakresu podstawowych pojęć i praw chemicznych,
posiadać jej zrozumienie i umiejętność czynnego wykorzystania do przeprowadzenia
podstawowych obliczeń chemicznych, a także posiadać wystarczającą orientację, co do
istoty prostych reakcji chemicznych i elementarnych zjawisk fizycznych, jednocześnie
umiejąc rozróżniać pomiędzy nimi.
Zalecana literatura:
1.
Michell J. Sienko, Robert A. Plane, Chemia – podstawy i zastosowania, PWN, Warszawa, 1999,
2.
G. Grygierczyk, M. Podgórna, Materiały pomocnicze do zajęć dydaktycznych z podstaw chemii, Wyd.
Uniwersytetu Śląskiego, Katowice, 2007,
3.
Obliczenia chemiczne – zbiór zadań z chemii nieorganicznej i analitycznej wraz z podstawami
teoretycznymi, pod red. A. Śliwy, PWN, Warszawa, 1979.
Numer w siatce studiów: 5
Kod przedmiotu:
0310-1.03.1.002
ECTS:
13
Podstawy chemii
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
zimowy (1)
Liczba godzin:
30 + 15 + 90 = 180
Wykładowca:
prof. dr hab. Teresa Kowalska
Forma egzaminu: pisemny

GRUPA TREŚCI PODSTAWOWYCH. Strona 20 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Kinetyka chemiczna. Właściwości i stężenie substancji reagujących. Temperatura.
Kataliza. Teoria zderzeń. Reakcje wielostopniowe (następcze). Reakcje łańcuchowe.
Równowaga chemiczna. Prawo działania mas. Stała równowagi. Równowaga w układach
wielofazowych. Przesunięcia równowagi. Zasada Le Châteliera. Typy roztworów.
Obniżenie temperatury krzepnięcia i podwyższenie temperatury wrzenia roztworów.
Ciśnienie osmotyczne. Wykorzystanie ebulioskopii, krioskopii i ciśnienia osmotycznego
do wyznaczania ciężaru cząsteczkowego substancji. Koloidy. Kwasy i zasady.
Zobojętnianie. Kwasy wieloprotonowe. Równoważniki kwasów i zasad. Reakcje
utleniania
–
redukcji
w
roztworach.
Stechiometria
roztworów.
Hydroliza
i amfoteryczność.
Równowagi
dysocjacji
w
roztworze
wodnym.
Obliczenia
z wykorzystaniem K
dys
. Dysocjacja wody; pH. Miareczkowanie i wskaźniki. Roztwory
buforowe. Dysocjacja jonów kompleksowych w roztworach wodnych. Strącanie.
Równowagi złożone. Przewodność elektryczna. Elektroliza. Ilościowe aspekty elektrolizy.
Ogniwa galwaniczne. Potencjały elektrodowe. Równanie Nernsta.
Cele przedmiotu:
W drugim semestrze zajęć z przedmiotu ‘podstawy chemii’
poruszane są przede wszystkim zagadnienia należące do szerokiego obszaru kinetyki
oraz statyki chemicznej. Właściwe zrozumienie podstaw tych dwóch bardzo istotnych
działów chemii fizycznej stanowi dobre przygotowanie do dalszego studiowania takich
przedmiotów kierunkowych, jak chemia analityczna, chemia nieorganiczna i chemia
organiczna (w których reakcje chemiczne odgrywają kluczową rolę).
Efekty kształcenia:
Głównym celem bloku przedmiotów ‘podstawy chemii’ w drugim semestrze nauczania
jest poznanie opisu podstawowych typów reakcji chemicznych oraz ich mechanizmów,
a także określanie podstawowych właściwości związków w aspekcie termodynamicznym
i kinetycznym.
Zalecana literatura:
1.
Michell J. Sienko, Robert A. Plane, Chemia – podstawy i zastosowania, PWN, Warszawa, 1999,
2.
G. Grygierczyk, M. Podgórna, Materiały pomocnicze do zajęć dydaktycznych z podstaw chemii, Wyd.
Uniwersytetu Śląskiego, Katowice, 2007,
3.
Obliczenia chemiczne – zbiór zadań z chemii nieorganicznej i analitycznej wraz z podstawami
teoretycznymi, pod red. A. Śliwy, PWN, Warszawa, 1979.
Numer w siatce studiów: 5
Kod przedmiotu:
0310-1.03.1.007
ECTS:
4
Podstawy chemii
Forma zajęć:
wykład + seminarium
Semestr:
letni (2)
Liczba godzin:
15 +30
Wykładowca:
prof. dr hab. Teresa Kowalska
Forma egzaminu: pisemny

GRUPA TREŚCI PODSTAWOWYCH. Strona 21 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Rola i zadania współczesnej chemii analitycznej. Analiza jakościowa kationów i anionów.
Podstawy analizy ilościowej. Analiza grawimetryczna, podstawy teoretyczne: warunki
strącania osadów, iloczyn rozpuszczalności, mechanizmy towarzyszące tworzeniu
osadów. Analiza miareczkowa – podział metod wg typu reakcji zachodzących podczas
miareczkowania. Równowagi kwasowo – zasadowe, jonowe i redoksowe. Krzywe
miareczkowania i detekcja punktu końcowego.
Alkacymetria, redoksometria, kompleksometria, precypitometria – podstawy teoretyczne
i przykłady oznaczeń. Analiza próbek złożonych rzeczywistych. Pobór i przygotowanie
próbek do analizy oraz opracowanie wyników analizy. Rozdzielanie i zatężanie analitów.
Zastosowanie
wybranych
metod
instrumentalnych
do
oznaczania
makro-
i mikroskładników: spektrometria UV-VIS, Potencjometria, konduktometria, elektroliza,
kulometria. Walidacja metod analitycznych. Warunki akredytacji laboratoriów
analitycznych.
Cele przedmiotu
: Absolwent studiów licencjackich powinien posiąść podstawową
wiedzę i umiejętności praktyczne w zakresie chemii analitycznej i podstawowych technik
instrumentalnych. Powinien swobodnie wykonywać podstawowe obliczenia analityczne
i poprawnie interpretować wyniki przeprowadzonych analiz.
Efekty kształcenia:
Po
ukończeniu kursu student powinien opanować podstawową wiedzę i umiejętności
praktyczne z zakresu chemii analitycznej, co umożliwi mu wykonanie określonego
zadania analitycznego.
Zalecana literatura:
1.
J. Minczewski, Z. Marczenko, Chemia analityczna t. 1 i 2, PWN, W-wa 2007,
2.
D. A. Skoog, D. M. West, F. J. Holler, S. P. Crouch, Podstawy chemii analitycznej, PWN, W-wa 2006,
3.
A. Hulanicki, Współczesna chemia analityczna. Wybrane zagadnienia, PWN, W-wa 2001.
Numer w siatce studiów: 6
Kod przedmiotu:
0310-1.03.1.008
ECTS: 7
Chemia analityczna
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
letni (2)
Liczba godzin:
15 + 15 + 90 = 120
Wykładowca:
prof. UŚ, dr hab. Ewa John
Forma egzaminu: pisemny
i ustny

GRUPA TREŚCI PODSTAWOWYCH. Strona 22 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 7
Kod przedmiotu:
0310-1.03.1.039
ECTS: 5
Laboratorium badań materiałów
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
zimowy (3)
Liczba godzin:
15 + 15 + 45 = 75
Wykładowca:
prof. UŚ, dr hab. Ewa John
Forma egzaminu: pisemny
Treści merytoryczne:
Analiza próbek rzeczywistych (przemysłowe, biologiczne, spożywcze itp.). Pobieranie
próbki reprezentatywnej materiałów stałych, ciekłych i gazowych. Przygotowanie próbek
do analizy w zależności od charakteru próbki, zawartości oznaczanego składnika oraz
stosowanej metody analitycznej. Techniki roztwarzania i mineralizacji. Metody
wzbogacania składników próbki. Wybór właściwego pomiaru z zastosowaniem
odpowiednich technik fizycznych lub chemicznych w zależności od zadania
analitycznego. Przydatność metod klasycznych i instrumentalnych w analizie próbek
rzeczywistych.
Cele przedmiotu
: Absolwent powinien poznać znajomość poszczególnych etapów
procesu analitycznego, specyfikę problemu analitycznego, wykonanie pomiaru
i interpretację jego wyniku.
Efekty kształcenia:
Umiejętność posługiwania się
opracowaniami monograficznymi, normatywnymi oraz literaturą oryginalną. Po
ukończeniu kursu student powinien potrafić zaproponować pełną procedurą analityczną
do wykonania analizy próbek rzeczywistych i zinterpretować jej wyniki.
Zalecana literatura:
1.
J. Minczewski, Z. Marczenko, Chemia analityczna t. 1 i 2, PWN, W-wa 2007,
2.
J. Namieśnik, W. Chrzanowski, P. Szpinek, Nowe horyzonty i wyzwania w analityce i monitoringu
środowiskowym, Centrum Doskonałości Analityki i Monitoringu Środowiska, Gdańsk 2003,
3.
W. Szczepaniak, Metody instrumentalne w analizie chemicznej, PWN, W-wa 2002.

GRUPA TREŚCI PODSTAWOWYCH. Strona 23 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Podstawowe pojęcia i podział krystalografii. Kryształ jako faza uporządkowana. Układy
krystalograficzne. Wybór komórki elementarnej. Sieć przestrzenna a sieć krystaliczna.
Podstawowe pojęcia opisujące sieć przestrzenną: węzły, prosta sieciowa, płaszczyzna
sieciowa. Rodzina i pas płaszczyzn sieciowych. Sieci translacyjne Bravais’go. Projekcja
sferyczna, cyklograficzna i stereograficzna. Operacje na siatce Wulfa. Podstawowe pojęcia
teorii symetrii. Klasyfikacja przekształceń symetrycznych w sieciach krystalicznych.
Makroskopowe elementy symetrii. Symetria względem punktu, prostej i płaszczyzny.
Osie przemienne i inwersyjne. Symbole i projekcje elementów symetrii. Elementy symetrii
w ujęciu macierzowym. Kombinacje elementów symetrii. Grupy punktowe. Klasy
symetrii a układy krystalograficzne. Przegląd postaci kryształów w układach
krystalograficznych. Strukturalne elementy symetrii. Translacja. Osie śrubowe.
Płaszczyzny ślizgowe osiowe, diagonalne i diamentowe. Osie śrubowe i osiowe
płaszczyzny ślizgowe w ujęciu macierzowym. Wtórne elementy symetrii. Grupy
przestrzenne:
symbole
grup
przestrzennych,
zespoły
pozycji
symetrycznie
równoważnych, graficzne przedstawianie zespołów pozycji symetrycznie równoważnych
i elementów symetrii grup przestrzennych. Charakterystyka grup przestrzennych
w „Międzynarodowych tablicach krystalograficznych” Podstawy krystalochemii.
Klasyfikacja ciał krystalicznych oparta na: wiązaniach chemicznych, składzie chemicznym
i stosunkach stechiometrycznych. Klasyfikacja struktur według symboliki Pearsona.
Zależność niektórych właściwości kryształów od ich klasy symetrii
Cele przedmiotu: Zaznajomienie studentów z podstawowymi pojęciami krystalografii
geometrycznej, w szczególności z elementami symetrii makroskopowej i strukturalnej
w ujęciu geometrycznym i analitycznym. Omówienie krystalograficznych grup
przestrzennych będących podstawą klasyfikacji ciał krystalicznych. Skrótowe
przedstawienie zależności wybranych właściwości fizykochemicznych kryształów od
symetrii. Efekty kształcenia: Po zakończeniu przedmiotu student powinien wykazać się
zrozumieniem podstawowych pojęć krystalografii geometrycznej, posiadać umiejętność
określania symetrii kryształów i wykonywania projekcji stereograficznej kryształu,
prawidłowo stosować międzynarodową symbolikę grup punktowych i przestrzennych,
posiadać umiejętność interpretacji symbolu i graficznej prezentacji symetrii grupy
przestrzennej, jak również korzystać z międzynarodowych tablic krystalograficznych.
Zalecana literatura:
1.
Z. Trzaska Durski i H. Trzaska Durska, Podstawy krystalografii,
Oficyna Wydawnicza Politechniki
Warszawskiej, Warszawa, 2003,
2.
Z. Bojarski, M. Gigla, K. Stróż i M. Surowiec, Krystalografia. Podręcznik wspomagany komputerowo,
Wydawnictwo Naukowe PWN, Warszawa, 2001,
3.
Z. Kosturkiwicz, Metody krystalografii,
Wydawnictwo Naukowe UAM, Poznań 2004.
Numer w siatce studiów: 8
Kod przedmiotu:
0310-1.03.1.040
ECTS: 2
Krystalografia
Forma zajęć:
wykład + laboratorium
Semestr:
zimowy (3)
Liczba godzin:
15 + 15 = 30
Wykładowca:
dr hab. Barbara Machura
Forma egzaminu: pisemny

GRUPA TREŚCI PODSTAWOWYCH. Strona 24 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Klasyfikacja, budowa, nazewnictwo, właściwości, reaktywność i zastosowania związków
nieorganicznych w różnych działach nauki, techniki i w medycynie. Wiązania chemiczne
w związkach i substancjach nieorganicznych, w tym w związkach koordynacyjnych
i metaloorganicznych. Klasy związków i substancji nieorganicznych, budowa, wiązania,
charakterystyka. Okresowość właściwości pierwiastków i związków nieorganicznych.
Kwasy i zasady w chemii nieorganicznej, teorie kwasów i zasad. Elementy chemii
koordynacyjnej i metaloorganicznej, wiązanie metal ligand, izomeria i nazewnictwo
wybranych połączeń. Szczegółowa chemia pierwiastków bloków s i p; budowa
i właściwości pierwiastków i ich związków. Ogólna charakterystyka pierwiastków
bloków d i f; specyfika pierwiastków przejściowych, wybrane klasy związków
pierwiastków przejściowych. Typy reakcji związków nieorganicznych i kompleksowych.
Równowagi chemiczne w chemii związków nieorganicznych i kompleksowych.
Otrzymywanie pierwiastków, metody laboratoryjne i przemysłowe, wybrane przykłady,
metody ogólne. Preparatyka wybranych związków nieorganicznych i koordynacyjnych;
metody laboratoryjne i przemysłowe, elementy technologii nieorganicznej. Wybrane
przykłady zastosowań pierwiastków i ich związków nieorganicznych, koordynacyjnych i
metaloorganicznych w różnych działach chemii i technologii chemicznej, w elektronice,
medycynie, metalurgii i innych dziedzinach nauki i techniki.
Cele przedmiotu: Przedstawienie właściwości fizykochemicznych pierwiastków
chemicznych i ich związków nieorganicznych, koordynacyjnych i metaloorganicznych
w świetle prawa okresowości. Przedstawienie budowy, nazewnictwa i metod
otrzymywania wybranych klas związków i substancji nieorganicznych. Pokazanie
znaczenia chemii nieorganicznej w różnych działach nauki i techniki. Efekty kształcenia:
Po ukończeniu kursu student powinien znać właściwości pierwiastków i wybranych klas
związków nieorganicznych, umieć je analizować w kontekście prawa okresowości.
Powinien umieć zastosować tę wiedzę do rozwiązywania problemów związanych
z budową, reaktywnością oraz otrzymywaniem związków i substancji nieorganicznych
a także interpretacją prostych mechanizmów reakcji.
Zalecana literatura:
1.
F. A. Cotton, G. Wilkinson, P. L. Gaus, Chemia nieorganiczna, PWN, W-wa 1995,
2.
L. Kolditz, Chemia nieorganiczna, PWN, W-wa 1994,
3.
A. Bielański, Chemia Nieorganiczna, PWN, W-wa 1999.
Numer w siatce studiów: 9
Kod przedmiotu:
0310-1.03.1.014
ECTS: 8
Chemia nieorganiczna A
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
zimowy (3)
Liczba godzin:
30 + 15 + 60 = 105
Wykładowca:
prof. UŚ, dr hab. inż. Stanisław Krompiec
Forma egzaminu: pisemny

GRUPA TREŚCI PODSTAWOWYCH. Strona 25 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 10
Kod przedmiotu:
0310-1.03.1.019
ECTS: 5
Chemia kwantowa
Forma zajęć:
wykład + laboratorium
Semestr:
letni (4)
Liczba godzin:
15 + 30 = 45
Wykładowca:
prof. dr hab. Stanisław Kucharski
Forma egzaminu: ustny
Treści merytoryczne:
Przesłanki doświadczalne mechaniki kwantowej: promieniowanie ciała doskonale
czarnego, zjawisko fotoelektryczne, zjawisko Comptona. Dualizm korpuskularno-falowy.
Hipoteza de Broglie. Fale materii. Zasada nieoznaczoności Heisenberga, wielkości
sprzężone: pęd - położenie, energia - czas. Teoria Bohra budowy atomu wodoru.
Aksjomatyczna konstrukcja mechaniki kwantowej. Postulaty. Pierwszy postulat
mechaniki kwantowej: funkcja falowa, porządność, normalizacja. Drugi postulat
mechaniki kwantowej: operatory kwantowo-mechaniczne. Liniowość i hermitowskość.
Przykłady operatorów kwantowomechanicznych. Trzeci postulat mechaniki kwantowej:
równanie Schroedingera zależne od czasu. Stany stacjonarne. Zależność od czasu funkcji
falowej w stanach stacjonarnych. Równanie Schroedingera nie zawierające czasu. Czwarty
postulat mechaniki kwantowej: równanie własne operatora, wartości własne i funkcje
własne, ortogonalność funkcji własnych operatora hermitowskiego, rzeczywiste wartości
własne. Rozwijanie funkcji falowej na układ zupełny funkcji własnych. Notacja Diraca.
Równanie Schroedingera dla cząstki swobodnej. Funkcje własne. Równanie
Schroedingera dla cząstki w pudle potencjału. Wartości i funkcje własne. Kwantowanie
wartości własnych. Rozkład poziomów energii translacyjnej. Równanie Schroedingera dla
oscylatora harmonicznego. Wartości własne. Oscylacyjne funkcje własne. Stany
oscylacyjne cząsteczek dwuatomowych. Przejścia oscylacyjne. Równanie Schroedingera
dla rotatora sztywnego. Wartości własne. Degeneracja. Przejścia rotacyjne, rozkład
intensywności. Równanie Schroedingera dla atomu wodoru. Wartości własne. Funkcja
falowa dla pojedynczego elektronu. Spin, orbitale i spinorbitale. Korelacja z teorią Bohra.
Jony wodoropodobne. Atomy wieloelektronowe. Zabudowa elektronowa atomu,
powłoki, podpowłoki, konfiguracje elektronowe. Termy atomowe. Zasada i metoda
wariacyjna. Metoda Ritza. Przybliżenie jednoelektronowe. Funkcje jednoelektronowe
w atomach i cząsteczkach. Pojęcie energii korelacji. Wiązanie chemiczne, orbitale
i spinorbitale
molekularne.
Cząsteczka
wodoru.
Idea
metody
Hartree-Focka.
Hybrydyzacja orbitali atomowych, cząsteczki wieloatomowe, bazy funkcyjne, przykłady
obliczeń kwantowochemicznych. Metoda funkcjonałów gęstości (DFT).Cele przedmiotu:
Zapoznanie studenta z podstawowymi pojęciami mechaniki i chemii kwantowej,
przedstawienie najważniejszych możliwości wykorzystania chemii kwantowej do opisu
struktury i własności cząsteczek chemicznych oraz zjawisk spektroskopowych. Efekty
kształcenia: Student powinien rozumieć i stosować podstawowe pojęcia mechaniki
kwantowej,
umieć
wyjaśnić
strukturę
elektronową
cząsteczek
organicznych
i nieorganicznych, przeprowadzić proste obliczenia kwantowochemiczne.
Zalecana literatura:
1.
A.Gołębiewski, Elementy mechaniki i chemii kwantowej, PWN, Warszawa 1982,
2.
L. Piela, Idee chemii kwantowej, PWN, Warszawa, 2004,
3.
D.O. Hayward, Mechanika kwantowa dla chemików, PWN, Warszawa, 2006.

GRUPA TREŚCI PODSTAWOWYCH. Strona 26 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 11
Kod przedmiotu:
0310-1.03.1.020
ECTS: 10
Chemia fizyczna A
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
letni (4)
Liczba godzin:
30 + 45 + 60 = 135
Wykładowca:
dr hab. Wojciech Marczak
Forma egzaminu: ustny
Treści merytoryczne:
Zasady termodynamiki. Potencjały termodynamiczne. Układy wieloskładnikowe
jednofazowe – roztwory. Wielkości intensywne i ekstensywne. Wielkości cząstkowe
molowe. Potencjał chemiczny. Aktywność i współczynnik aktywności. Reguła faz Gibbsa.
Układy wieloskładnikowe wielofazowe. Równowagi fazowe w układach binarnych ciecz
– gaz i ciecz – ciało stałe. Prawo podziału Nernsta, ekstrakcja. Efekt cieplny reakcji
chemicznej, prawo Hessa. Pojemność cieplna. Prawo Kirchhoffa. Warunki samorzutności
reakcji chemicznej. Powinowactwo chemiczne. Stan równowagi, prawo działania mas.
Podstawy elektrochemii: wzór Nernsta. Procesy potencjałotwórcze na granicy faz.
Korozja. Układy koloidalne. Zjawiska powierzchniowe. Napięcie powierzchniowe.
Zwilżanie powierzchni ciała stałego, adhezja, kohezja. Adsorpcja. Kinetyka chemiczna.
Rzędowość, cząsteczkowość i mechanizm reakcji. Równanie Arrheniusa, energia
aktywacji. Teoria kompleksu aktywnego. Kataliza. Procesy foto- radio- i sonochemiczne.
Właściwości elektryczne substancji. Elektryczny moment dipolowy. Polaryzowalność.
Dielektryk w zmiennym polu elektrycznym. Podstawy spektroskopii rezonansowej.
Ładunek elektryczny w polu magnetycznym. Spektrometr mas. Efekt Zeemana. Związek
właściwości magnetycznych ze strukturą elektronową atomów, jonów i cząsteczek.
Klasyfikacja
substancji
ze
względu
na
podatność
magnetyczną.
Histereza
namagnesowania. Stan krystaliczny. Elementy krystalografii geometrycznej. Pojęcie siły
termodynamicznej (bodźca) i przepływu – lepkość, dyfuzja, przepływ ciepła.
Cele przedmiotu
: Przedstawienie chemii fizycznej jako dyscypliny opisującej
podstawowe prawa przyrody oraz związki i zależności wykorzystywane w innych
dziedzinach chemii. Zwrócenie uwagi na relacje pomiędzy rzeczywistością
fizykochemiczną a opisem matematycznym zjawisk. Zapoznanie z charakterystycznym
dla chemii fizycznej rygorystycznym wnioskowaniem opartym na mocnym fundamencie
empirycznym i modelach fizycznych.
Efekty kształcenia:
Po ukończeniu kursu student
zna podstawowe pojęcia i prawa fizykochemiczne, wynikające zarówno z termodynamiki
jak i podejścia nietermodynamicznego. Dostrzega fundamenty fizykochemiczne w innych
gałęziach chemii. Umie rozwiązywać problemy i zadania korzystając z pojęć z zakresu
chemii fizycznej. Potrafi posługiwać się podstawowym sprzętem laboratoryjnym do
wyznaczania wybranych wielkości fizykochemicznych. Opanował podstawy rachunku
błędów i statystyki matematycznej jako metod pozwalających ocenić wiarygodność
wyników.
Zalecana literatura:
1.
P. W. Atkins, Chemia fizyczna, Wyd. Naukowe PWN, Warszawa 2007,
2.
H. Buchowski, W. Ufnalski, Podstawy termodynamiki, WNT, Warszawa 1998,
3.
L. Sobczyk, A. Kisza, K. Gatner, A. Koll, Eksperymentalna chemia fizyczna, PWN, Warszawa 1982.

GRUPA TREŚCI PODSTAWOWYCH. Strona 27 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 10
Kod przedmiotu:
0310-1.03.1.027
ECTS: 13
Chemia organiczna A
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
zimowy (5)
Liczba godzin:
45 + 15 + 90 = 150
Wykładowca:
prof. dr hab. inż. Jarosław Polański
Forma egzaminu: pisemny
Treści merytoryczne:
Nomenklatura, grupy funkcyjne. Izomeria. Wiązania chemiczne. Struktury elektronowe.
Karbokationy,
karboaniony,
wolne
rodniki,
karbeny.
Stereochemia.
Analiza
konformacyjna. Konfiguracja absolutna i względna. Chiralność a czynność optyczna.
Efekty elektronowe i steryczne. Pojecie rezonansu. Hiperkoniugacja. Spektroskopia IR,
1
H
NMR, MS, UV-VIS. Typy reakcji organicznych. Homolityczny/heterolityczny rozpad
wiązania. Energia aktywacji i stan przejściowy. Alkany, cykloalkany, halogenowanie
związki Grignarda, kwasowość zasadowość, nukleofilowość, elektrofilowość. Alkeny.
Reakcja dehydrohalogenacji, reakcja dehydratacji alkoholi, mechanizmy eliminacji E1 i E2,
reguła Zajcewa i Hofmanna. Reakcje alkenów. Addycja elektrofilowa, reguła
Markownikowa, efekt nadtlenkowy. Pojęcia stereospecyficzności, stereoselektywności
reakcji. Halogenki alkilu. Reakcje substytucji nukleofilowej S
N
1 S
N
2. Konkurencyjność
substytucji i eliminacji. Alkiny. Dieny. Addycja 1,2 i 1,4. Związki aromatyczne. Reguła
Hückla. Alotropowe odmiany węgla, fulereny. Aromatyczne związki heterocykliczne.
Aromatyczna substytucja elektrofilowa. Aromatyczna substytucja nukleofilowa
(chlorobenzen, pirydyna). Alkohole fenole i etery. Aldehydy i ketony. Reakcje addycji
nukleofilowej do wiązania karbonylowego. Kwasy karboksylowe i pochodne, reakcje
pochodnych kwasów karboksylowych, kondensacja Claisena. Amidy. Aminy, Sole
diazoniowe. Barwniki azowe. Alkaloidy. Związki nitrowe. Analiza retrosyntetyczna,
Dioksyny. Wstęp do kontynuacji w części B: Mono-, disacharydy, aminokwasy,
polipeptydy, kwasy nukleinowe.
Cele przedmiotu
: Przedstawienie podstawowych pojęć chemii organicznej: grupy
funkcyjne, klasyfikacja, nomenklatura, budowa związków organicznych ich właściwości,
otrzymywanie i reaktywność, podstawowe mechanizmy reakcji organicznych oraz metod
identyfikacji związków organicznych.
Efekty kształcenia:
Po ukończeniu kursu student
powinien opanować wiedzę z zakresu podstawowych pojęć chemii organicznej oraz
posiadać jej zrozumienie i umiejętność wykorzystania do rozwiązywania problemów
związanych z budową, reaktywnością oraz otrzymywaniem związków organicznych
a także interpretacją prostych mechanizmów reakcji.
Zalecana literatura:
1.
J. McMurry, Chemia organiczna, Wyd. Naukowe PWN, Warszawa, 2005, tomy 1-5,
2.
R. T. Morrison, R. N. Boyd „Chemia organiczna”, Wyd. Naukowe PWN, Warszawa 1985.

GRUPA TREŚCI KIERUNKOWYCH. Strona 28 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
GRUPA TREŚCI KIERUNKOWYCH.
Numer w siatce studiów: 13
Kod przedmiotu:
0310-1.03.2.028
ECTS: 4
Chemia materiałów i zarządzanie chemikaliami
Forma zajęć:
wykład + laboratorium
Semestr:
zimowy (5)
Liczba godzin:
15 + 15 = 30
Wykładowca:
prof. UŚ, dr hab. inż. Stanisław Krompiec
Forma egzaminu: pisemny
Treści merytoryczne:
Polimery: rodzaje, metody otrzymywania, budowa, właściwości i zastosowania. śywice
fenolowe, epoksydowe i poliestrowe, polimery biodegradowalne, polimery przewodzące.
Elementy chemii supramolekuł, bio-supramolekuły. Materiały metaliczne, stopy -
obróbka cieplna, korozja, erozja. Materiały ceramiczne, szkło - otrzymywanie,
właściwości, stosowanie. Materiały specjalnego przeznaczenia, specjalnej czystości,
materiały dla technologii elektronowej. Nanomateriały, materiały mezoporowate,
znaczenie tych materiałów dla katalizy. Koncepcja zrównoważonego rozwoju - chemia
przyjazna człowiekowi i otoczeniu (zielona chemia). Główne zasady zielonej chemii w
technologii chemicznej. Dodatki do produktów spożywczych, skutki zdrowotne. Środki
piorące i czyszczące - stosowanie, oddziaływanie na środowisko, utylizacja odpadów.
Środki ochrony roślin - stosowanie, szkodliwość, zabezpieczenia w trakcie stosowania.
Materiały budowlane, powłoki malarskie, paliwa, oleje, rozpuszczalniki - zabezpieczenia
w trakcie stosowania, postępowanie z odpadami. Chemikalia w laboratoriach naukowych
i dydaktycznych – magazynowanie, dystrybucja, recykling. Zasady postępowania
z chemikaliami w laboratoriach, środki ostrożności – ogólne zasady. Odpady powstające
w laboratoriach naukowych i dydaktycznych – środki ostrożności w trakcie operowania
odpadami, selekcja, przechowywanie, utylizacja odpadów.
Cele przedmiotu: Zapoznanie studentów z różnymi klasami materiałów – szczególnie
najnowocześniejszymi, ich właściwościami, metodami otrzymywania, zastosowaniami w
chemii i poza nią. Przedstawienie idei przyjaznej człowiekowi i środowisku chemii
i technologii chemicznej. Przedstawienie zasad postępowania z chemikaliami- zgodnie
z wymogami współczesnej technologii, ochrony zdrowia i środowiska. Efekty
kształcenia: Po ukończeniu kursu student powinien znać różne rodzaje współcześnie
produkowanych materiałów – stosowanych powszechnie i przez specjalistów. Powinien
znać i umieć zastosować idee zrównoważonego rozwoju oraz zielonej chemii, a także
metody i zasady bezpiecznego postępowania z chemikaliami.
Zalecana literatura:
1.
L. Kolditz, Chemia nieorganiczna, PWN, W-wa 1994,
2.
M. Blicharski, Wstęp do inżynierii materiałowej, WNT, W-wa 2006,
3.
L.A. Dobrzański, Materiały inżynierskie i projektowanie materiałowe. Podstawy nauki o materiałach
i metaloznawstwo, WNT, W-wa 2006.

GRUPA TREŚCI KIERUNKOWYCH. Strona 29 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 14
Kod przedmiotu:
0310-1.03.2.034
ECTS:
6
Technologia chemiczna
Forma zajęć:
wykład + laboratorium
Semestr:
letni (6)
Liczba godzin:
45 + 45 = 90
Wykładowca:
dr hab. Wojciech Pisarski lub
prof. UŚ, dr hab. Wiesław Sułkowski
*
Forma egzaminu:
pisemny
* - Kursy prowadzone równolegle, do wyboru przez studentów
Treści merytoryczne:
Surowce pierwotne. Surowce wtórne: naturalne źródła do produkcji surowców wtórnych,
przemysłowe metody produkcji surowców wtórnych, syntezy oparte na surowcach
wtórnych, przemysłowe zastosowanie surowców wtórnych. Gaz syntezowy. Wodór.
Alkeny (etylen, propylen, buten i butadien). Acetylen. Węglowodory aromatyczne
(benzen, toluen, ksylen). Inne surowce wtórne: tlen, azot, chlor. Surowce kopalne: ropa
naftowa i gaz ziemny. Składniki gazu ziemnego. Kryteria podziału gazy ziemnego.
Zasoby gazu ziemnego. Metody wydobywania gazu ziemnego. Transport, gazociągi,
magazynowanie i dystrybucja. Procesy chemiczne. Podział procesów chemicznych.
Procesy homogeniczne i heterogeniczne. Przebieg reakcji w warunkach homogenicznych
i heterogenicznych. Podstawy kinetyki w technologii chemicznej. Kinetyka reakcji
chemicznej. Reakcja chemiczna i dyfuzja. Typy procesów i operacji w technologii
chemicznej: absorpcja, adsorpcja i desorpcja, odparowanie, sublimacja. Krystalizacja,
kondensacja, prażenie, rozpuszczanie, destylacja, topienie, rektyfikacja, piroliza,
ekstrakcja.
Reaktory
chemiczne.
Reaktory
okresowe
(periodyczne).
Reaktory
przepływowe (ciągłe). Wymiana ciepła. Wymiana masy. Mieszanie, rozdrabnianie,
filtracja, suszenie. Modele reaktorów chemicznych. Reaktory kaskadowe. Kataliza
i procesy katalityczne. Katalizatory. Kataliza homogeniczna i heterogeniczna. Reaktory do
procesów katalitycznych. Schematy technologiczne. Zasady technologiczne. Zasada
wykorzystania surowców. Zasada wykorzystania energii. Zasada wykorzystania
aparatury. Utylizacja odpadów. Ocena jakości surowców i produktów. Metody i techniki
eksperymentalne analizy produktów. Aspekty ekonomiczne i normy prawne. Wybrane
zagadnienia technologii materiałów nieorganicznych (kryształy, szkła, ceramika),
związków organicznych, polimerów i kompozytów. Wstęp do nanotechnologii.
Cele przedmiotu
: Przedstawienie podstawowych pojęć technologii chemicznej: surowce
przemysłu chemicznego, procesy technologiczne, kataliza przemysłowa, zasady
technologiczne, schematy technologiczne.
Efekty kształcenia:
Po ukończeniu kursu
student powinien opanować wiedzę z zakresu podstawowych pojęć technologii
chemicznej w stopniu umożliwiającym (a) ocenę realizacji procesu w skali przemysłowej,
(b) dobór optymalnych surowców (c) kontrolę procesu technologicznego, (d) stosowanie
metod analitycznych, (e) określenie jakości produktu, oraz (f) znajomość aspektów
ekonomicznych i norm prawnych.
Zalecana literatura:
1.
E. Grzywa, J. Molenda, Technologia podstawowych syntez organicznych, WNT 2008, tomy 1-2,
2.
K. Schmidt-Szałowski, J. Sentek, J. Raabe, E. Bobryk, Podstawy technologii chemicznej. Procesy
w przemyśle nieorganicznym, Oficyna Wydawnicza Politechniki Warszawskiej 2005,
3.
J. Pielichowski, A. Puszyński, Technologia tworzyw sztucznych, WNT 2003.

INNE WYMAGANIA Strona 30 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
INNE WYMAGANIA
Numer w siatce studiów: 17
Kod przedmiotu:
0310-1.03.3.016
ECTS: 2
Technologia informacyjna
Forma zajęć:
wykład + laboratorium
Semestr:
zimowy (3)
Liczba godzin:
30 + 45 = 75
Wykładowca:
dr Joachim Włodarz
Forma egzaminu:
pisemny
Treści merytoryczne:
Wstęp: informatyka w nauce i technologii, podstawowe pojęcia i metodologia. Podstawy:
dane, przetwarzanie danych, algorytmy, koncepcja języka programowania, paradygmaty
programowania, abstrakcja i modelowanie, obliczenia numeryczne i symboliczne. Systemy
komputerowe: koncepcja, organizacja i funkcjonowanie, wybrane realizacje, komputery
osobiste. Oprogramowanie: klasyfikacja, systemy operacyjne i oprogramowanie systemowe,
narzędziowe i użytkowe, aplikacje użytkownika, interfejs programisty, interfejs
użytkownika. Dane: organizacja, zagadnienia wymiany i udostępniania, rekordy, pliki
i systemy plikowe, bazy danych i ich eksploracja, udostępnianie sieciowe, bezpieczeństwo
danych. Technologie sieciowe: organizacja i funkcjonowanie sieci komputerowych, sieci
lokalne i rozległe, Internet, typowe usługi sieciowe, zagrożenia bezpieczeństwa. Typowe
oprogramowanie użytkowe: edytory i procesory tekstów, arkusze kalkulacyjne, aplikacje
bazodanowe, grafika prezentacyjna, przygotowywanie publikacji, narzędzia programisty.
Technologie
informatyczne
a otoczenie:
normalizacja
i
standardy,
ergonomia,
bezpieczeństwo i higiena pracy, wpływ na środowisko naturalne. Technologie
informatyczne a prawo: własność intelektualna, patentowanie, ochrona danych,
przestępstwa z wykorzystaniem komputera, regulacje prawne.
Cele przedmiotu: Prezentacja najbardziej istotnych zagadnień z zakresu technologii
informacyjnej, ze szczególnym uwzględnieniem ich dalszego praktycznego zastosowania.
Dyskusja bieżących problemów związanych z prezentowanymi zagadnieniami.
Wprowadzenie do efektywnego wykorzystania systemów komputerowych i sieciowych.
Efekty kształcenia: Wiedza odnośnie najbardziej istotnych zagadnień z zakresu technologii
informacyjnej. Rozumienie problematyki związanej z tymi zagadnieniami. Podstawowe
umiejętności w zakresie efektywnego wykorzystania systemów komputerowych
i sieciowych.
Zalecana literatura:
1.
A. Kisielewicz, Wprowadzenie do informatyki, Helion 2002,
2.
A.S. Tanenbaum, Strukturalna organizacja systemów komputerowych, Wyd.5, Helion 2006 (wersja
oryginalna: Structured Computer Organization, 5th Ed., Pearson Education Inc. 2006),
3.
B.K. Williams, Using Information Technology, 7th Ed., Career Education 2007.

INNE WYMAGANIA Strona 31 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 18
Kod przedmiotu:
0310-1.03.3.011
ECTS:
2
Przedmiot interdyscyplinarny: Prawo własności intelektualnej
Forma zajęć:
wykład
Semestr:
letni (2)
Liczba godzin:
30
Wykładowca:
mgr Jakub Piotrowski
Forma egzaminu: zaliczenie
Treści merytoryczne:
Ogólne wprowadzenie do nauki prawa. Źródła prawa powszechnie obowiązującego w RP.
Źródła prawa wspólnotowego. Podstawowe pojęcia języka prawnego. Ogólna
charakterystyka prawa własności intelektualnej. Specyfika aparatu pojęciowego
funkcjonującego w obrębie prawa własności intelektualnej. Polskie i europejskie placówki
naukowe specjalizujące się w prawie własności intelektualnej. Źródła prawa własności
intelektualnej w ogólności, ze szczególnym uwzględnieniem praw dotyczących dóbr
niematerialnych, powstających jako wynik pracy badawczo – twórczej prowadzonej przez
specjalistów w dziedzinie chemii leków i chemii informatycznej (patenty, dodatkowe
świadectwa ochronne, prawa autorskie, prawa z rejestracji znaków towarowych).
Charakterystyka poszczególnych w/w praw na dobrach niematerialnych: ich treść, funkcje,
podtypy, sposób uzyskania ochrony i jej zakres. Wynalazki pracownicze: przykłady.
Potrzeba ochrony dóbr niematerialnych: przykłady zaniechań w tym względzie. Specyfika
pracy rzeczników patentowych. Wygaśnięcie i „wyczerpanie” omawianych praw
wyłącznych. Wpływ ochrony własności intelektualnej na swobodę międzynarodowego
obrotu handlowego. Problematyka „importu równoległego” na przykładzie branży
farmaceutycznej. Specyfika prawnoautorskiej ochrony programów komputerowych.
Ochrona prawnoautorska a Internet: zarys problematyki kolizyjnoprawnej. Umowy
cywilnoprawne w Internecie. Podpis elektroniczny. Ochrona baz danych. Rodzaje
i charakterystyka umów licencyjnych ze szczególnym uwzględnieniem licencji na programy
komputerowe. Sposoby dochodzenia roszczeń majątkowych i niemajątkowych z tytułu
naruszeń poszczególnych praw wyłącznych w ujęciu teoretycznym i praktycznym.
Zagrożenia wynikające ze stosowania ochrony praw na dobrach niematerialnych: przykłady.
Kultura „dzielenia się”: „kryzys prawa autorskiego”.
Cele przedmiotu: Zapoznanie studentów z najważniejszymi elementami prawa własności
intelektualnej
i
zachęcenie
ich
do
korzystania
z
ochrony
prawnej
w odniesieniu do efektów ich pracy naukowej. Efekty kształcenia: Uzyskanie przez
słuchaczy stosownego poziomu „świadomości prawnej” w dziedzinie prawa własności
intelektualnej. Nabycie umiejętności samodzielnego wyszukiwania potrzebnych aktów
prawnych oraz przyswojenie w stopniu podstawowym specyfiki języka prawnego.
Zalecana literatura:
1.
A. Nowicka, M. Poźniak – Niedzielska, U. Promińska, H. śakowska – Henzler, Prawo własności
przemysłowej, Difin, Warszawa 2005,
2.
M. Kondrat, H. Dreszer – Lichańska, Własność przemysłowa w Unii Europejskiej, Gdańsk 2004,
3.
3. P. Podrecki, Z. Okoń, P.Litwiński, D. Kasprzycki, M. Swierczyński, T. Targasz, M. Smycz, Prawo Internetu,
Lexis Nexis, Warszawa 2006.

INNE WYMAGANIA Strona 32 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Rachunek różniczkowy funkcji wielu zmiennych: różniczka funkcji wielu zmiennych,
pochodne cząstkowe oraz ich związek z różniczką. Działania na różniczkach
i pochodnych cząstkowych, zastosowania w chemii. Pochodne cząstkowe wyższych
rzędów. Zastosowania rachunku różniczkowego funkcji wielu zmiennych do
wyznaczania ekstremów funkcji. Twierdzenie o funkcji uwikłanej. Ekstrema warunkowe.
Całka funkcji wielu zmiennych. Całki iterowane oraz ich związek z całką wielokrotną.
Własności całki. Całki w obszarach normalnych na płaszczyźnie i w przestrzeni. Krzywe
i powierzchnie w przestrzeniach skończenie wymiarowych. Całki krzywoliniowe
i powierzchniowe
funkcji
wielu
zmiennych.
Twierdzenia
Greena,
Gaussa-
Ostrogradskiego i Stokesa oraz ich zastosowania w chemii i fizyce. Elementy teorii
równań różniczkowych: równani liniowe, równanie jednorodne, równanie Bernoulliego,
równanie o zmiennych rozdzielonych; zastosowania w chemii. Układy liniowych równań
różniczkowych. Równania n-tego rzędu o stałych współczynnikach; zastosowania w
fizyce.
Równanie
Schroedingera.
Szeregi
Fouriera.
Elementy
rachunku
prawdopodobieństwa i statystyki.
Cele przedmiotu: Wprowadzenie podstawowych pojęć współczesnej matematyki:
różniczki i całki funkcji wielu zmiennych. Podstawowy wykład teorii równań
różniczkowych zwyczajnych. Zastosowania rachunku różniczkowego i całkowego oraz
równań różniczkowych w chemii i fizyce. Przedstawienie elementów teorii
prawdopodobieństwa i statystyki. Efekty kształcenia: Po ukończeniu zajęć student
powinien posiadać wiedzę na temat metod rachunku różniczkowego i całkowego funkcji
wielu zmiennych oraz podstawowych metod stochastycznych. Student powinien nabyć
umiejętność rozwiązywania niektórych klas równań różniczkowych zwyczajnych.
Student powinien również umieć stosować metody matematyczne do rozwiązywania
zagadnień chemicznych oraz fizycznych.
Zalecana literatura:
1.
J. Ger, Kurs matematyki dla chemików, Wyd. Uniwersytetu Śląskiego, Katowice 2005.
Numer w siatce studiów: 19
Kod przedmiotu:
0310-1.03.3.012
ECTS: 8
Matematyka B
Forma zajęć:
wykład + konwersatorium
Semestr:
letni(2)
Liczba godzin:
45 + 45 = 90
Wykładowca:
dr Joanna Ger
Forma egzaminu: pisemny

INNE WYMAGANIA Strona 33 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Podstawowe pojęcia statystyczne, skale pomiarowe. Statystyka opisowa: średnia,
mediana, moda, odchylenie standardowe. Funkcje rozkładu: rozkład normalny,
parametry populacji i ich estymatory, momenty rozkładu, tabele, przedział ufności
średniej, test normalności rozkładu, transformacje danych do rozkładu normalnego.
Rozkład t. Testowanie hipotez: porównywanie dwóch średnich i wariacji, porównywanie
wielokrotne, testy rozkładu, przedziały ufności, poziom istotności, błędy I i II rodzaju.
ANOVA: założenia, przykłady. Testy nieparametryczne. Regresja wieloraka: istotność
regresji, przedziały ufności współczynników regresji. Korelacja: istotność korelacji,
istotność różnic pomiędzy dwoma współczynnikami korelacji. Obiekty odległe.
Elastyczne metody regresji. Wprowadzenie do planowania eksperymentu: plany
poznawcze i plany optymalne.
Cele przedmiotu
: Przedstawienie podstawowych pojęć statystyki: rozkład normalny,
parametry populacji i ich estymatory, rozkład t, testowanie hipotez, regresja wieloraka,
ANOVA, elementy statystyki stabilnej, planowanie eksperymentu.
Efekty kształcenia:
Po ukończeniu kursu student powinien opanować podstawową wiedzę z zakresu
statystyki, a w szczególności powinien zrozumieć i praktycznie stosować podstawowe
pojęcia statystyczne do rozwiązywania prostych problemów, z jakimi spotyka się w
chemii analitycznej, tj.: obliczanie przedziałów ufności średniej, testowanie hipotez,
konstrukcja modeli kalibracyjnych i planowanie eksperymentu.
Zalecana literatura:
1.
J. Jóźwiak, J. Podgórski, Statystyka od podstaw, Polskie Wydawnictwo Ekonomiczne, Warszawa, 2006,
2.
D.L. Massart, B.G.M.Vandeginste, L.M.C.Buydens, S. de Jong, P.J. Lewi, J. Smeyers-Verbeke, Handbook of
Chemometrics and Qualimetrics; Part A, Elsevier, Amsterdam 1998,
3.
M. Korzyński, Metodyka eksperymentu, WNT, 2006.
Numer w siatce studiów: 20
Kod przedmiotu:
0310-1.03.3.041
ECTS: 5
Matematyka stosowana z chemometrią
Forma zajęć:
wykład + labolatorium+konwersatorium
Semestr:
zimowy (3)
Liczba godzin:
15 + 15 +15 = 45
Wykładowca:
dr Michał Daszykowski
Forma egzaminu: pisemny

INNE WYMAGANIA Strona 34 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 21
Kod przedmiotu:
0310-1.03.3.018
ECTS: 5
Fizyka B
Forma zajęć:
wykład + konwersatorium
Semestr:
zimowy (3)
Liczba godzin:
30 + 15 = 45
Wykładowca:
prof. dr hab. Ewa Talik
Forma egzaminu: pisemny
Treści merytoryczne:
Termodynamika. Ciepło i temperatura. Zerowa zasada termodynamiki. Termometria.
Rozszerzalność termiczna. Ciepło właściwe. Ciepło przemiany fazowej. Transport ciepła.
Gaz doskonały i gaz rzeczywisty. Molekularne własności materii. Kinetyczny model gazu
doskonałego. Ciepło właściwe gazów i ciał stałych. Fazy materii. Pierwsza zasada
termodynamiki. Praca i energia wewnętrzna. Rodzaje procesów termodynamicznych.
Druga zasada termodynamiki. Silniki cieplne. Cykl Carnota. Entropia. Elektrostatyka.
Budowa materii. Ładunek elektryczny. Przewodniki i izolatory. Prawo Coulomba. Pole
elektryczne. Dipol elektryczny. Prawo Gaussa i jego zastosowania. Klatka Faradaya.
Potencjał elektryczny. Pomiar różnicy potencjałów. Lampa Browna. Pojemność. Energia
pola elektrycznego. Dielektryki. Polaryzacja dielektryka. Prąd, opór elektryczny. Prawo
Ohma. Siła elektromotoryczna Obwody elektryczne. Pole magnetyczne. Magnetyzm
ziemski. Doświadczenie Oersteda. Wzór Lorenza. Prawo Ampera. Strumień
magnetyczny. Prawo Biota – Savarta. Indukcja elektromagnetyczna. Widmo fal
elektromagnetycznych. Równania Maxwella. Natura światła. Dualizm korpuskularno-
falowy. Widmo fal elektromagnetycznych. Współczynnik załamania. Prawa odbicia i
załamania. Dyspersja. Optyka geometryczna. Dyfrakcja i interferencja. Doświadczenie
Younga. Siatki dyfrakcyjne. Polaryzacja. Kąt Brewstra. Dwójłomność. Elementy fizyki
kwantowej. Efekt fotoelektryczny. Zjawisko Comptona. Materia skondensowana.
Elementy fizyki jądrowej. Definicje wstępne. Rozpady i reakcje jądrowe. Kosmologia.
Powstanie i budowa Wszechświata.
Cele przedmiotu: Przedstawienie podstawowych pojęć z zakresu kursu uniwersyteckiego
z fizyki. Efekty kształcenia: Po ukończeniu kursu student powinien opanować wiedzę z
zakresu podstawowych pojęć z fizyki, posiadać umiejętność pomiarów podstawowych
wielkości fizycznych, zrozumienia procesów i zjawisk fizycznych w przyrodzie,
wykorzystywać prawa przyrody w technice i życiu codziennym.
Zalecana literatura:
1.
D. Halliday, R. Resnick,J. Walker „Podstawy Fizyki” PWN 2003 tomy 1-5.

INNE WYMAGANIA Strona 35 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Chemia pierwiastków grup głównych, wybrane klasy związków nieorganicznych.
Szczegółowa chemia pierwiastków bloków d i f. Właściwości fizykochemiczne
wybranych klas związków metali przejściowych. Mechanizmy reakcji z udziałem
związków nieorganicznych i koordynacyjnych. Równowagi chemiczne w chemii
związków nieorganicznych i kompleksowych. Roztwory, rozpuszczalniki, równowagi
kwasowo-zasadowe, jonowe i redoksowe. Związki nieorganiczne, kompleksowe
i metaloorganiczne w syntezie organicznej i nieorganicznej oraz w katalizie homo-
i heterogenicznej – wybrane przykłady. Metale, w tym metale przejściowe i ich związki:
kompleksowe i metaloorganiczne – wybrane przykłady, metody syntezy, zastosowania.
Teoria orbitali molekularnych i teoria pola ligandów w zastosowaniu do opisu budowy
związków kompleksowych i metaloorganicznych pierwiastków przejściowych. Metody
określania struktury związków nieorganicznych, kompleksowych i metaloorganicznych.
Metody elektrochemiczne w syntezie nieorganicznej: otrzymywanie o oczyszczanie
metali, synteza związków nieorganicznych. Elektryczne, fotofizyczne i magnetyczne
właściwości substancji nieorganicznych. Elementy fotochemii i radiochemii związków
kompleksowych. Wybrane zastosowania metali przejściowych i ich związków: jako
substratów w syntezie, jako katalizatorów, w technologii materiałowej, w medycynie
i innych dziedzinach nauki, techniki.
Cele przedmiotu: Poszerzenie wiedzy o wiązaniach chemicznych – teoria rezonansu
i teoria pola ligandów. Uzupełnienie wiedzy z kursu A, na temat pierwiastków bloków s
i p. Przedstawienie szczegółowej chemii pierwiastków bloku elektronowego d i f. Chemia
koordynacyjna i metaloorganiczna pierwiastków bloku d i f. Efekty kształcenia: Po
ukończeniu kursu student powinien znać chemię wszystkich pierwiastków, umieć
analizować i przewidywać właściwości i reaktywność substancji nieorganicznych,
koordynacyjnych i metaloorganicznych. Powinien znać metody syntezy wybranych
związków nieorganicznych i ich zastosowania w różnych działach chemii i poza nią.
Zalecana literatura:
1.
F. A. Cotton, G. Wilkinson, P. L. Gaus, „Chemia nieorganiczna”, PWN, W-wa 1995,
2.
L. Kolditz, „Chemia nieorganiczna”, PWN, W-wa 1994,
3.
A. Bielański, „Chemia Nieorganiczna”, PWN, W-wa 1999.
Numer w siatce studiów: 22
Kod przedmiotu:
0310-1.03.3.022
ECTS: 5
Chemia nieorganiczna B
Forma zajęć:
wykład + konwersatorium
Semestr:
letni(4)
Liczba godzin:
30 + 15 = 45
Wykładowca:
prof. UŚ, dr hab. inż. Stanisław Krompiec
Forma egzaminu: pisemny

INNE WYMAGANIA Strona 36 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 23
Kod przedmiotu:
0310-1.03.3.029
ECTS: 9
Chemia fizyczna B
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
zimowy (5)
Liczba godzin:
15 + 30 + 60 = 105
Wykładowca:
dr hab. Wojciech Marczak
Forma egzaminu: ustny
Treści merytoryczne:
Momenty elektryczne jako źródło oddziaływań międzycząsteczkowych. Związek energii
oddziaływań z rzędami momentów elektrycznych. Oddziaływania międzycząsteczkowe
uniwersalne: oddziaływania van der Waalsa (Keesoma, Debye’a i Londona), odpychanie
(potencjał Borna-Mayera). Potencjały oddziaływań międzycząsteczkowych: potencjał
sztywnych kul, prostokątna studnia potencjału, potencjał Lennarda-Jonesa, potencjał exp-
6. Oddziaływania specyficzne. Wiązanie wodorowe – klasyfikacja ze względu na energię;
kooperatywność. Stany skupienia substancji. Przejścia fazowe I i II rodzaju wg klasyfikacji
Ehrenfesta. Diagramy fazowe układów jednoskładnikowych. Równanie Clausiusa-
Clapeyrona. Krystaliczne i amorficzne ciała stałe. Mono- i enancjotropia. Gazy. Równania
stanu: van der Waalsa, wirialne. Współczynnik kompresji. Zasada stanów
odpowiadających sobie. Współczynnik Joule’a-Thomsona. Temperatura inwersji. Płyn
nadkrytyczny, ekstrakcja nadkrytyczna. Ekstrakcja rozpuszczalnikami o niskich
prężnościach par – ciecze jonowe. Ciecze. Zjawiska transportu w cieczach. Ciecze
newtonowskie i nienewtonowskie. Lepkosprężystość. Procesy relaksacyjne – przykłady:
relaksacja mechaniczna i dielektryczna. Spektroskopia relaksacyjna. Termodynamika
roztworów: funkcje mieszania i nadmiarowe. Cząstkowe wielkości molowe. Wielkości
gibbsowskie i niegibbsowskie oraz lewisowskie i nielewisowskie. Stabilność układu
względem dyfuzji. Separacja układu jednofazowego na dwie fazy: binodalna
i spinodalna. Temperaturowa i ciśnieniowa zależność mieszalności wzajemnej cieczy.
Układy z zamkniętą luką mieszalności. Molekularna interpretacja ograniczonej
mieszalności – przykłady.
Cele przedmiotu
: Ukazanie związku pomiędzy makroskopowymi właściwościami
fizykochemicznymi
substancji
i
oddziaływaniami
międzycząsteczkowymi.
Przedstawienie specyfiki opisu właściwości faz skondensowanych i gazów wynikającej
z relacji energii kinetycznej molekuł do ich energii potencjalnej.
Efekty kształcenia:
Oparty na podstawowym kursie chemii fizycznej A, kurs umożliwia pogłębienie wiedzy
poza wymagania określone w standardach nauczania chemii fizycznej. Po ukończeniu
kursu student zna podstawy teorii oddziaływań międzycząsteczkowych. Umie powiązać
właściwości substancji z energią tych oddziaływań. Potrafi rozwiązywać zadania, które
wymagają kojarzenia informacji z różnych działów chemii fizycznej. Potrafi zbudować
prosty zestaw do pomiaru wielkości fizykochemicznych wykorzystując sprzęt dostępny
w laboratorium.
Zalecana literatura:
1.
P. W. Atkins, Chemia fizyczna, Wyd. Naukowe PWN, Warszawa 2007,
2.
H. Buchowski, W. Ufnalski, Podstawy termodynamiki, WNT, Warszawa 1998,
3.
L. Sobczyk, A. Kisza, K. Gatner, A. Koll, Eksperymentalna chemia fizyczna, PWN, Warszawa 1982.

INNE WYMAGANIA Strona 37 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 24
Kod przedmiotu:
0310-1.03.3.035
ECTS: 8
Chemia organiczna B
Forma zajęć:
wykład + konwersatorium + laboratorium
Semestr:
letni (6)
Liczba godzin:
15 + 15 + 90 = 120
Wykładowca:
dr hab. Piotr Kuś
Forma egzaminu: pisemny
Treści merytoryczne:
Kwasy i zasady organiczne; karboaniony; karbeny; karbokationy. Addycja elektrofilowa,
addycja nukleofilowa. Metody otrzymywania α,β-nienasyconych związków. Kondensacja
aldolowa. Kondensacja Knoevenagela. Kondensacja Perkina. α,β-Nienasycone związki –
reakcje. Reakcja metatezy alkenów. Katalizatory reakcji metatezy. Reakcja Dielsa-Aldera.
Organiczne związki siarki. Tiole. Sulfidy. Ylidy siarkowe. Sulfotlenki. Sulfony. Kwasy
sulfonowe. Organiczne związki fosforu. Reakcja Wittiga. Związki boroorganiczne.
Reakcja Suzuki. Związki metaloorganiczne. Katalizatory palladowe. Reakcja Ullmanna.
Reakcja Stilla. Reakcja Kumady. Reakcja sprzęgania krzyżowego Buchwalda-Hartwiga.
Estry kwasu acetylooctowego i kwasu malonowego w syntezie organicznej. Elementy
planowania syntezy organicznej. Synteza totalna. Wstęp do chemii supramolekularnej.
Chemia ‘gość-gospodarz”. Kompleksowanie kationów. Kompleksowanie anionów.
Wiązanie cząsteczek neutralnych. Etery koronowe. Podandy. Kryptandy. Sferandy.
Kaliksareny. Dendrymery. Cyklodekstryny. Nanocząsteczki.
Cele przedmiotu: Przedstawienie pojęć chemii organicznej związanych z zagadnieniami
przedstawionymi na wykładzie. Rozszerzenie pojęć związanych z budową związków
organicznych, ich właściwościami, otrzymywaniem i reaktywnością, mechanizmami
reakcji organicznych. Efekty kształcenia: Po ukończeniu kursu student powinien
opanować wiedzę z zakresu pojęć chemii organicznej oraz posiadać jej zrozumienie
i umiejętność wykorzystania do rozwiązywania problemów związanych z budową,
reaktywnością i otrzymywaniem związków organicznych, a także interpretacją
mechanizmów reakcji.
Zalecana literatura:
1.
J. McMurry, Chemia organiczna, Wyd. Naukowe PWN, Warszawa, 2005, tomy 1-5,
2.
R. T. Morrison, R. N. Boyd „Chemia organiczna”, Wyd. Naukowe PWN, Warszawa 1985
3.
J. Gawroński, K. Gawrońska, K. Kacprzak, M. Kwit, „Współczesna synteza organiczna”, Wyd. Naukowe
PWN, 2004.

INNE WYMAGANIA Strona 38 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Analiza jakościowa i ilościowa wybranych leków i środków kosmetycznych.
Zastosowanie metod analizy instrumentalnej do oceny jakości i stopnia czystości środków
farmaceutycznych. Chemotaksonomia jako metoda identyfikacyjna roślin leczniczych.
Zastosowanie właściwych metod analitycznych w analizie preparatów kosmetycznych
i farmaceutycznych. Metody przygotowania próbek do analizy instrumentalnej – metody
ekstrakcyjne, wstępne oczyszczanie i zagęszczanie próbek. Przegląd metod analitycznych,
używanych w analizie kosmetyków i leków. Analiza składników aktywnych.
LABORATORIUM:
Zastosowanie metod ekstrakcyjnych – ekstrakcja w aparacie Soxhleta, przyspieszona
ekstrakcja rozpuszczalnikowa (ASE), ekstrakcja ultradźwiękowa. Zagęszczanie
i wydzielanie frakcji – ekstrakcja do ciała stałego (SPE), chromatografia „flash”.
Oznaczanie wody i alkoholu w preparatach kosmetycznych. Analiza jakościowa
i ilościowa substancji stosowanych w preparatach kosmetycznych techniką GC-MS.
Zastosowanie równowagi w fazie nadpowierzchniowej (head space) do oznaczania
składników lotnych w lekach i kosmetykach. Analiza elementarna surowców. Ocena
poziomu zawartości metali ciężkich w surowcach kosmetycznych techniką ASA i ICP.
Zastosowanie techniki wysokosprawnej chromatografii cieczowej z detekcją diodową
i detektorem masowym do analizy jakościowej i ilościowej leków i kosmetyków.
Cele przedmiotu: Przedstawienie podstawowych pojęć z zakresu metod analitycznych
stosowanych w analizie leków i kosmetyków. Omówienie metod przygotowania próbek
do analizy chemicznej. Przedstawienie metod identyfikacji związków czynnych
w preparatach i ich ilościowe oznaczenie. Walidacja metody. Efekty kształcenia: Po
ukończeniu kursu student powinien opanować wiedzę i wykazać się zrozumieniem
przedstawionych metod analitycznych; posiąść umiejętności doboru odpowiedniej
metody przygotowania próbki i techniki analitycznej dla odpowiednich substancji
oznaczanych w matrycy; uzyskać informacje na temat dozowania i bezpieczeństwa
stosowanych preparatów.
Zalecana literatura:
1.
R. Kocjan (red.) Chemia analityczna. Tom 2. Analiza instrumentalna, Warszawa 2002,
2.
Rozporządzenia Ministra Zdrowia z dn. 23.12.2002 w sprawie określenia procedur pobierania próbek
kosmetyków oraz procedur przeprowadzania badań laboratoryjnych (Dz. U. Nr 9, poz. 107 oraz zmiany
z dn. 16.07.2004 r.; Dz. U. Nr 206, poz. 2106),
3.
Farmakopea Polska.
Numer w siatce studiów: 25
Kod przedmiotu:
0310-1.05.3.044
ECTS: 4
Analiza leków i kosmetyków
Forma zajęć:
wykład + labolatorium
Semestr:
letni (4)
Liczba godzin:
15 + 15 = 30
Wykładowca:
dr Mieczysław Sajewicz
Forma egzaminu: pisemny

INNE WYMAGANIA Strona 39 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Treści merytoryczne:
Anatomia i fizjologia skóry. Przenikanie przez skórę kosmetyku, farmaceutyku. Definicja
kosmetyku/farmaceutyku,
bezpieczeństwo
ich
stosowania
(testy).
Formy
fizykochemiczne (definicja i podział). Toniki, lotiony (rozpuszczalniki, środki
powierzchniowo –czynne, odczyn pH). Mleczka, maseczki (def., składniki,
otrzymywanie), pojęcie emulsji typu O/W, W/O, stabilizacja emulsji, dobór
emulgatorów). Płynne formy (rozpuszczalniki, substancje pomocnicze). Półstałe formy
(żele, pasty, kremy), definicja, podział, systemy nośnikowe. Pojęcie roztworu
koloidalnego, zjawiska tiksotropii, NMF. Stałe formy (mydła, pudry, zasypki), barwniki
nieorganiczne i organiczne. Pojęcie nośnika. Pojęcie adhezji. Kosmetyka kolorowa
(podział i otrzymywanie, barwniki). Preparaty do pielęgnacji włosów. Szampony,
odżywki, preparaty kondycjonujące. Dezodoranty, antyperspiranty. Środki do pielęgnacji
jamy ustnej. Sporządzanie odwarów, naparów, maceratów. Naturalne surowce
kosmetyczne (odżywcze, nawilżające). Barwniki pochodzenia roślinnego. Pojęcie
fitokosmetyku. Transdermalne systemy terapeutyczne. Roślinne substancje aromatyczne
wykorzystywane w perfumerii i kosmetyce. Rośliny i substancje olejkowe. Barwne glinki,
algi w kosmetyce. Związki antybakteryjne i antyutleniacze stosowane w preparatach.
Regulacje prawne dotyczące surowców i wyrobów kosmetycznych.
Cele przedmiotu: Zapoznanie z budową skóry oraz procesami zachodzącymi w skórze w
skutek zadziałania produktów kosmetycznych/farmaceutycznych. Zaznajomienie
z podstawowymi pojęciami typu: emulsje, emulgator, roztwory koloidalne, zjawisko
tiksotropii, NMF. Omówienie technologii wytwarzania różnych typów emulsji,
mikroemulsji, roztworów koloidalnych. Przedstawienie istotnych substancji biologicznie
czynnych, fitozwiązków, barwników naturalnych. Efekty kształcenia: Opanowanie
wiedzy z zakresu podstawowych pojęć z zakresu podstawowych technologii i surowców
kosmetycznych/farmaceutycznych. Nabycie umiejętności dostosowania kosmetyku
/farmaceutyku do potrzeb skóry, czy celów terapeutycznych z wykorzystując wiedzę
z zakresu fizjologii i transportu kosmetyku/farmaceutyku przez skórę.
Zalecana literatura:
1.
M.C. Martini, red. wyd pol. W. Placek,Kosmetologia i farmakologia skóry, Wydawnictwo Lekarskei
PZWL, Warszawa 2006, wyd. 1,
2.
W. Brud, Ryszrd Glinka, Technologia kosmetyków, ISBN, Łódź, 2001,
3.
S. Jurkowska, Surowce kosmetyczne, Ekoprzem, Dąbrowa Górnicza, 1999.
Numer w siatce studiów: 26
Kod przedmiotu:
0310-1.05.3.045
ECTS: 4
Surowce farmaceutyczne i kosmetyczne.
Forma zajęć:
wykład + konwersatorium
Semestr:
letni (4)
Liczba godzin:
15 + 15 = 30
Wykładowca:
dr Aleksandra Drozd - Rzoska
Forma egzaminu: pisemny

INNE WYMAGANIA Strona 40 z 40
Chemia leków z elementami kosmetologii. Studia I stopnia
Numer w siatce studiów: 27
Kod przedmiotu:
0310-1.05.3.047
ECTS: 4
Wstęp do projektowania leków
Forma zajęć:
wykład + labolatorium
Semestr:
zimowy (5)
Liczba godzin:
15 + 15 = 30
Wykładowca:
prof. dr hab. Jarosław Polański
dr Halina Niedbała
Forma egzaminu:
ustny
Treści merytoryczne:
Przedmiot i podstawowe pojęcia projektowania leków. Metody syntezy znanych leków.
Aminowanie redukcyjnie, jako przykład mechanizmu w chemii biologicznej.
Poszukiwanie VS projektowanie leków. Farmaceutyk (lekarstwo) VS lek. Bioefektor.
Docelowe struktury receptorowe. Biomolekuły. Enzymy. Koenzymy. Aminokwasy.
Pierwszo-, drugo-, trzecio- i czwartorzędowa struktura białek. Metody syntezy białek.
Chemia kombinatoryczna. NMR, MS, i krystalograficzne metody badania struktury
białek. Wstęp do chemii produktów naturalnych. Poszukiwanie, projektowanie
i komercjalizacja nowych leków. Oddziaływania ligand-receptor. Optymalizacja
oddziaływań ligand-receptor. Optymalizacja biodostępności. Prolek. Inhibitor. Agonista.
Antagonista. Częściowy agonista. Odwrotny agonista. Grupy wiążące. Typy, podtypy,
rodziny receptorów. Racjonalne metody projektowania leków. Histamina. Leki
przeciwhistaminowe. Agoniści i antagoniści receptorów H
1
i H
2
. Farmakodynamika
i farmakokinetyka. Absorpcja, dystrybucja, (krew, tkanki, komórki), wydalanie,
podawanie (doustne, doodbytnicze, miejscowe, inhalacja, iniekcja, implant), dawkowanie
leku. Bariera mózg-krew. Badanie jakościowych zależność struktura – aktywność (SAR).
Skrining z siłową procedurą brut force oraz strategie wysokowydajne w poszukiwaniu
leków. Metody obliczeniowe w projektowaniu leków. Modelowanie molekularne.
Dokowanie molekularne. Badanie jakościowych zależność struktura – aktywność (QSAR).
Równanie Hammetta i Hanscha. Patenty w projektowaniu leków. Badania kliniczne.
Uregulowania prawne. Agencja Food and Drug Administration (FDA). Sektor badawczo-
wdrożeniowy w przemyśle i biznesie farmaceutycznym. Klasyfikacja leków.
Cele przedmiotu: Przedstawienie przedmiotu i podstawowych pojęć poszukiwania
i projektowania leków, podstawowych informacji na temat struktur biomolekularnych
celów działania leków, oddziaływania leków z docelowymi receptorami w organizmach,
metod badania takich oddziaływań oraz podstawowych technologii poszukiwania leków
in vitro
oraz in silico. Efekty kształcenia: Po ukończeniu kursu student powinien posiadać
podstawową wiedzę na temat podstawowych zjawisk determinujących działanie leków
w żywych organizmach oraz metod ich testowania in vitro oraz in silico jak również
powinien znać podstawy zastosowań metod komputerowych w tym zakresie.
Zalecana literatura:
1.
J. McMurry, Organic Chemistry. A Biological Approach, Thomson, Belmont, USA, 2007,
2.
G. Patrick, Chemia medyczna, WNT, W-wa, 2003,
3.
R. Silverman, Chemia organiczna w projektowaniu leków, WNT, W-wa 2004.
Wyszukiwarka
Podobne podstrony:
pytania leki, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
Narkotyczne leki przeciwbólowe, Farmacja, III rok farmacji, Chemia leków
Chemia Leków leki przeciwhistaminowe
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
1a, Farmacja, III rok farmacji, Chemia leków
kolo 1 podzial, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kolo 1
Ostre zatrucia, TECHNIK FARMACEUTYCZNY, TECHNIK FARMACEUTYCZNY, FARMAKOLOGIA, Chemia leków (gabi2204
lekiwsp, Farmacja, III rok farmacji, Chemia leków
pytania leki 3 kolo sem 914, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kol
chemia leków 13 egzamin pytania
chemia leków pytania egzamin
STERYDY, Farmacja, chemia lekow
Sulfonamidy i chemioterapeutyki, Farmacja, chemia lekow
un, Farmacja, III rok farmacji, Chemia leków
chemia lekow wyklad1
prezentacja chemia leków
więcej podobnych podstron