wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
WYKŁAD 1
Zagadnienia z wykładu:
1. Sposoby zwiększania rozpuszczalności leków
2. Mechanizmy działania leków
Chemia leków zajmuje się:
§
badaniem właściwości fizycznych i chemicznych związków farmakologicznie czynnych (związki
farmakologicznie czynne – specyficzne substancje chemiczne wywierające efekt farmakologiczny zawarte
w określonych, ściśle do tego przystosowanych postaciach leku: np. tabletka aspiryny zawiera porcję
kwasu acetylosalicylowego)
§
oznaczaniem ilościowym oraz jakościowym środków farmakologicznie czynnych
§
procesach przemian leków w organizmie (procesami biotransformacji)
§
przemianami, jakim ulegają leki poza organizmem człowieka (czynnikami wpływającymi na trwałość
leków)
§
sposobami otrzymywania leków
§
procesami zachodzącymi podczas przechowywania (trwałość leków)
§
powiązaniami pomiędzy budową leków a ich działaniem farmakologicznym
Budowa chemiczna a działanie farmakologiczne
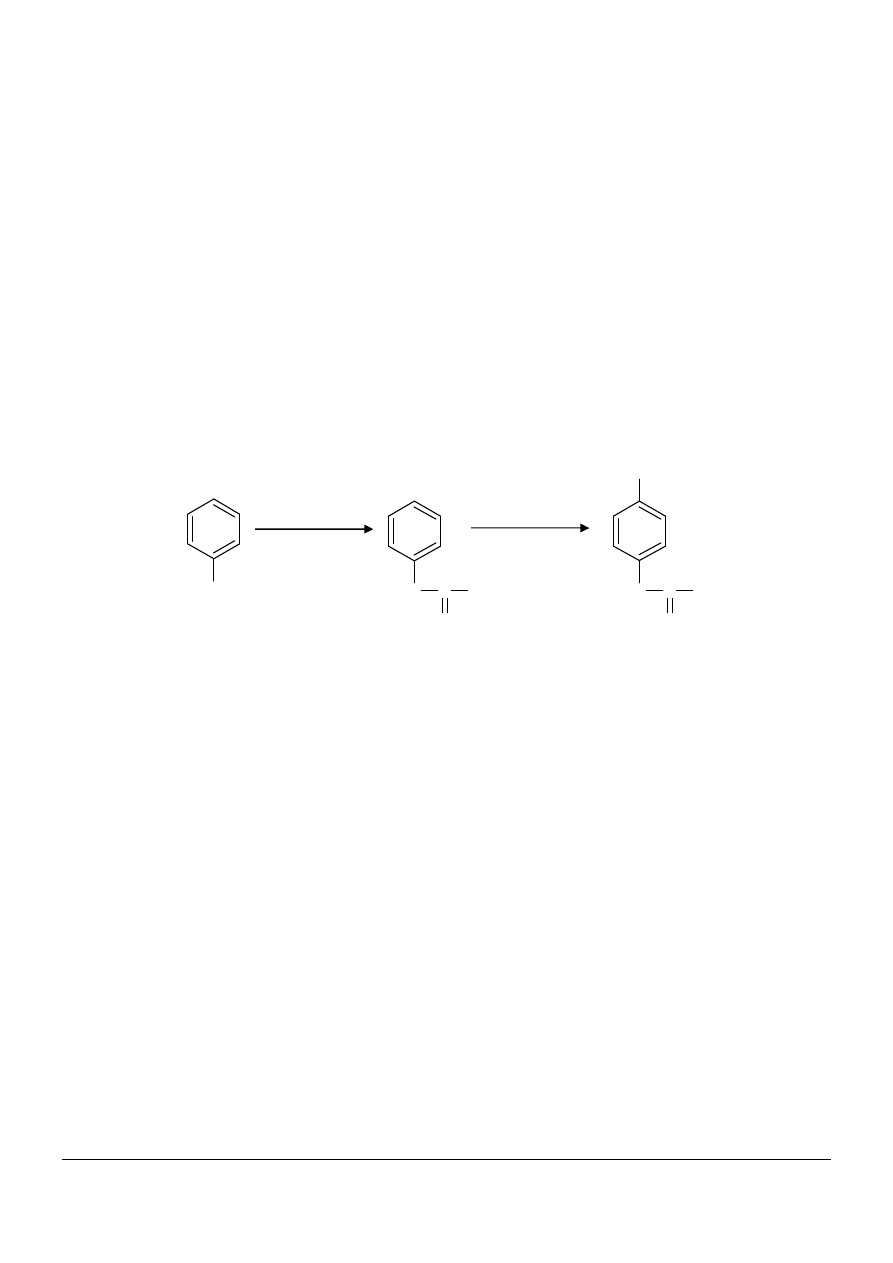
Powiązanie pomiędzy budową leku a jego działaniem widoczne jest na przykładzie aniliny, leku o działaniu
przeciwgorączkowym stosowanym niegdyś w weterynarii:
anilina acetanilid paracetamol
W miarę, jak anilina, będąca lekiem toksycznym była poddawana kolejnym przemianom chemicznym traciła
swoją toksyczność i jednocześnie zwiększało się działanie przeciwbólowe leku. Ostateczny produkt przemian –
paracetamol jest już mało toksyczny i ma silne właściwości p/gorączkowe oraz p/bólowe (największa siła
działania)
QSAR = badania nad powiązaniami budowy związku chemicznego a jego działaniem farmakologicznym
Do badań tego typu wykorzystuje:
§
rozpuszczalność leków w wodzie
Substancje rozpuszczalne w wodzie mają działanie głównie obwodowe, natomiast
substancje rozpuszczalne w tłuszczach – działanie ośrodkowe, gdyż są w stanie przenikać
przez lipidową barierę mózgu tworzoną przez komórki nerwowe
§
stosunek podziału olej/woda
Stosunek podziału jest miarą rozpuszczalności związków w lipidach – im większy się
współczynnik, tym łatwiej lek rozpuszcza się w lipidach błonowych i tym lepiej przenika
przez błony biologiczne
§
wartość Rf (współczynnik wykorzystywany w badaniach chromatograficznych)
§
różnego typu stałe charakterystyczne w analizie instrumentalnej: widma NMR (magnetyczny rezonans
jądrowy), IR (podczerwień), IV (ultrafiolet)
§
badania krystalograficzne
Rozpuszczalność a działanie farmakologiczne
Jest to jedna z podstawowych właściwości substancji leczniczych rozpatrywana w odniesieniu do płynów
ustrojowych oraz substancji lipidowych. Lek wprowadzony do organizmu drogą pozajelitową musi się
wchłonąć i przeniknąć przez odpowiednie błony półprzepuszczalne.
NH
2
N
H
C
O
CH
3
N
H
C
O
CH
3
OH
acetylacja
hydroksylacja

wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
Aby lek mógł prawidłowo zadziałać konieczne jest pokonanie barier fizjologicznych organizmu (np. bariera
lipidowa krew-mózg) – nadrzędnym warunkiem jest jego dobra rozpuszczalność w płynach ustrojowych
Przenikanie substancji rozpuszczalnych w wodzie – lek rozpuszczony w fazie wodnej przenoszony jest przez
błony lipidowe do fazy wodnej znajdującej się po drugie stronie (do płynu wewnątrzkomórkowego, osocza
lub chłonki) – szybkość procesu uzależniona jest od rozpuszczalności w lipidach błonowych i różnicy stężeń
po obu stronach błony.
Przez błony lipidowe najłatwiej przenikają substancje lecznicze oraz niezjonizowane formy elektrolitów
Zależności pomiędzy budową związku chemicznego a jego rozpuszczalnością w płynach ustrojowych:
Zwiększanie hydrofobowości związku leczniczego:
(1) Substancje lecznicze, które nie ulegają jonizacji charakteryzuje na ogół dobra rozpuszczalność w lipidach.
Łatwo się wchłaniają i są transportowane w organizmie, gromadząc się przede wszystkim w komórkach
bogatych w substancje lipidowe np. tkance nerwowej
Np. wziewne środki znieczulające ogólnie
Substancje hydrofobowe (lipofilne) wchłaniają się do tkanki tłuszczowej i przenikają przez błonę
biologiczną kumulując się w tkance nerwowej oraz tłuszczowej.
Wzrost liofilowości, czyli zwiększenie współczynnika podziału można uzyskać poprzez
wprowadzenie do struktury macierzystej rodników alkilowych lub arylowych. Podobne skutki
uzyskuje się po estryfikacji grup hydroksylowych lub karboksylowych obecnych w związku
macierzystym.
Np. pochodne kwasu barbiturowego:
barbital
Barbital jest środkiem nasennym o działaniu hydrofobowym. Jeżeli jednak zwiększy się jego
hydrofobowość poprzez dodanie dodatkowej grupy metylowej wówczas uzyska się jego pochodną o
właściwościach jeszcze bardziej hydrofobowych – ma ona działanie psychotropowe, neuroleptyczne.
Łatwiej penetruje do tkanki nerwowej, gdyż jest bardziej lipofilna (bardziej tłusta).
(2) Leki o dużej masie cząsteczkowej, bądź zawierające dużą procentowo zawartość grup polarnych, mogą się
słabo wchłaniać, mimo występowania w środowisku formy niezjonizowanej
Zwiększenie hydrofilowości związku leczniczego:
§
zwiększenie rozpuszczalności w wodzie danego związku chemicznego można uzyskać poprzez
dodanie do niego takich grup jak: -SO
3
Na, -COONa, -OH, -NH
2
§
rozpuszczalność zależy od izomerii łańcuchowej cis-trans
§
wpływa na nią izomeria optycznej
§
rozpuszczalność zależy również od izomerii strukturalnej (S,R)
np.
1. tylko estry kwasy 4-hydroksybenzoesowego są aktywne aseptycznie, natomiast kwas 3-
hydroksybenzoesowy nie ma działania przeciwbakteryjnego
2. tylko izomer para kwas aminosalicylowego (PAS) ma działanie tuberkulostatyczne (formy
meta oraz orto nie są już tak aktywne)
3. wyłącznie L-adrenalina jest aktywna (D-adrenalina ma aktywność mniejszą 20-30 razy)
Przykłady:
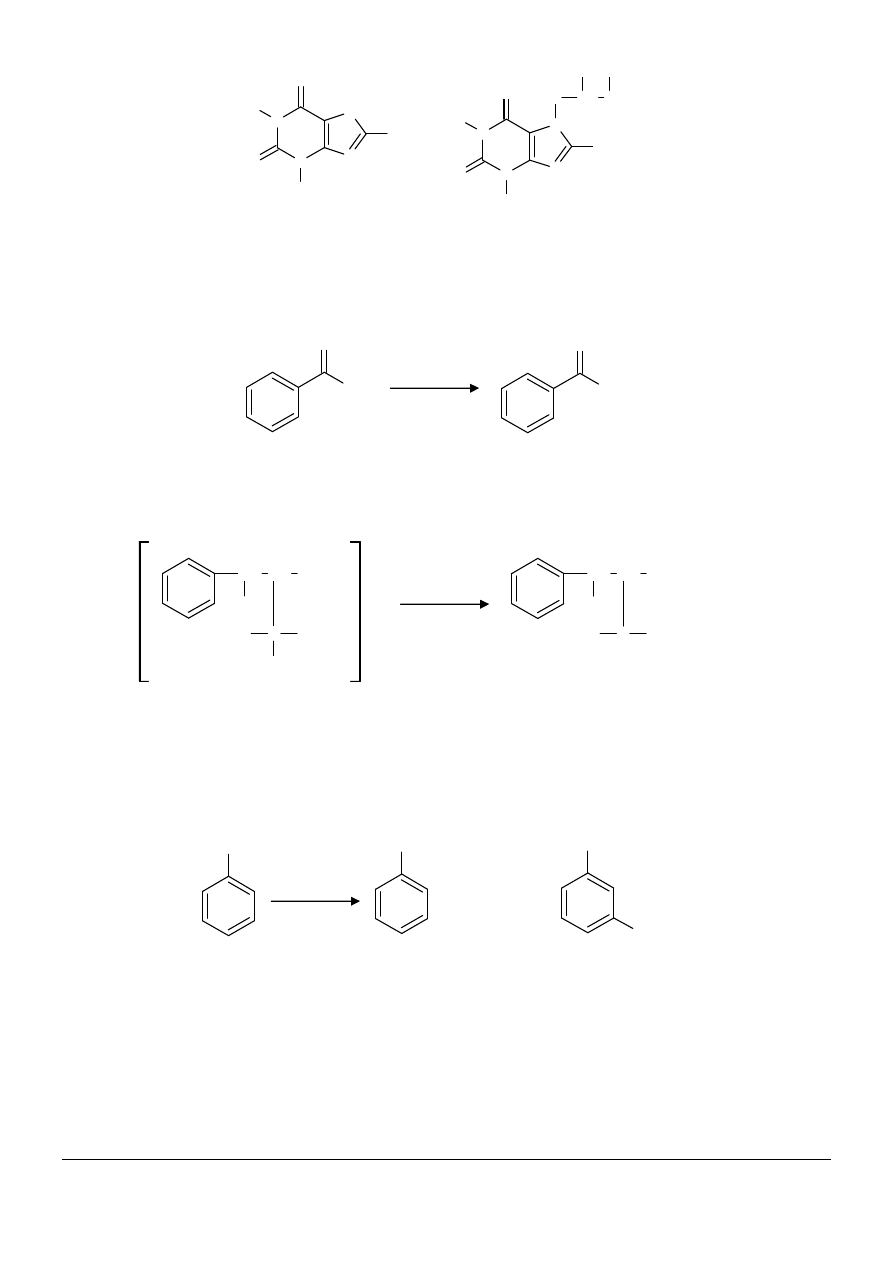
(1) Teofilina jest środkiem zwiększającym przepływ krwi. Jest ona słabo rozpuszczalna w wodzie. Jednak po
dodaniu do niej podstawnika hydroksyalkilowego w położeniu 7 (powstaje diprofilina) zwiększają się jej
właściwości hydrofilowe, lepiej rozpuszcza się w wodzie i ma lepsze działanie na naczynia krwionośne:
N
H
N
H
O
O
O
R
1
R
2
N
N
H
O
O
O
R
1
R
2
CH
3
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
teofilina diprofilina (teofilina+rodnik propandiolowy)
(2) Bardzo dobrze rozpuszczalne w wodzie są preparat metaloorganiczne metali alkalicznych, dlatego też
duże ilości leków są stosowane w postaci soli
§
np. zwiększenie rozpuszczalności kwasu benzoesowego opiera się na przekształceniu go w sól sodową,
czyli benzoesan sodu
benzoesan sodu (rozpuszczalny w wodzie) kwas benzoesowy (nierozpuszczalny w wodzie)
(3) Dobrze rozpuszczalne w wodzie są chlorowodorki amin
§
wyjątek stanowi tutaj chlorowodorek efedryny, który aby był rozpuszczalny, musi zostać pozbawiony
reszty chlorkowej
chlorowodorek efedryny nierozpuszczalny rozpuszczalna w wodzie
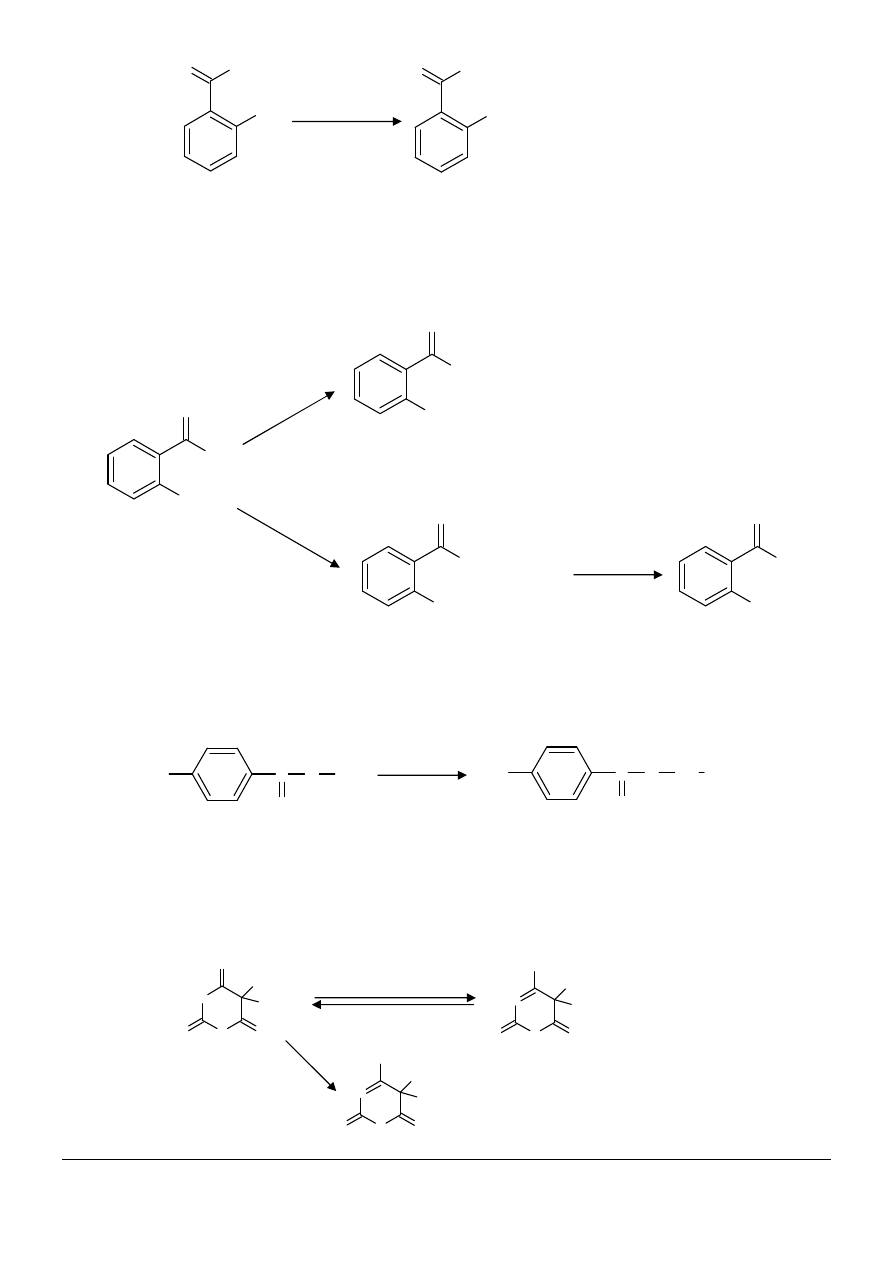
(4) Zwiększenie rozpuszczalności można uzyskać poprzez wprowadzenie dodatkowych grup
hydroksylowych do związku chemicznego
§
fenol jest nierozpuszczalny w wodzie, podobnie jak jego sól sodowa – fenolan sodu, mimo iż zawiera w
swojej budowie metal alkaliczny.
§
Rozpuszczalność fenolanów jest uzależniona od ilości grup hydroksylowych – poprzez zwiększenie ich
ilości poprawia się rozpuszczalność w wodzie
fenol (nierozp) fenolan sodu (nierozp) rezorcyna (rozp)
Jak odróżnić fenole od kwasów?
Aby odróżnić fenole od kwasów należy wykorzystać różnice w ich charakterze kwasowym – fenole są
słabymi kwasami, ale silniejszymi od kwasu węglowego, czyli najsłabszego kwasu nieorganicznego. Będą
wypierały z węglanów dwutlenek węgla oraz wodę:
N
N
N
H
N
H
CH
3
C
H
3
O
O
N
N
N
N
H
CH
3
C
H
3
O
O
H
2
C
CH CH
2
OH
OH
CH CH CH
3
OH
N
+
H
H
CH
3
Cl
-
O
OH
O
ONa
HCl
NaoH
NaOH
CH CH CH
3
OH
N
H
CH
3
OH
ONa
OH
OH
NaOH
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
+ H
2
CO
3
(H
2
O + CO
2
)
kwas salicylowy salicylan sodowy rozpuszczalny
Alkohole aromatyczne, alifatyczne nie tworzą soli w wodzie, a jedynie w środowisku bezwodnym!
(5) Amidy kwasowe tworzą rozpuszczalne sole sodowe. W środowisku kwaśnym powstaje jednak
nierozpuszczalny w wodzie kwas salicylowy – jego rozpuszczalność zwiększa się poprzez
przeprowadzenie go w rozpuszczalny salicylan sodu (sól sodowa kwasu organicznego)
+
NH
3
rozpuszczalny salicylan sodu amoniak
amid kwasu salicylowego
+ NH
4
Cl
nierozpuszczalny kwas salicylowy rozp. salicylan sodu
(6) Pochodne kwasów sulfonowych rozpuszczalne są jedynie po przeprowadzeniu ich w sole metali
alkalicznych (pod wpływem zasad)
§
sulfanilamid jest słabo rozpuszczalny w wodzie, jednak po potraktowaniu go zasadą sodową jego
rozpuszczalność rośnie na skutek powstawania soli sodowej, która jest rozpuszczalna w wodzie:
sulfanilamid (słabo rozpuszczalny w wodzie) sól sodowa rozpuszczalna
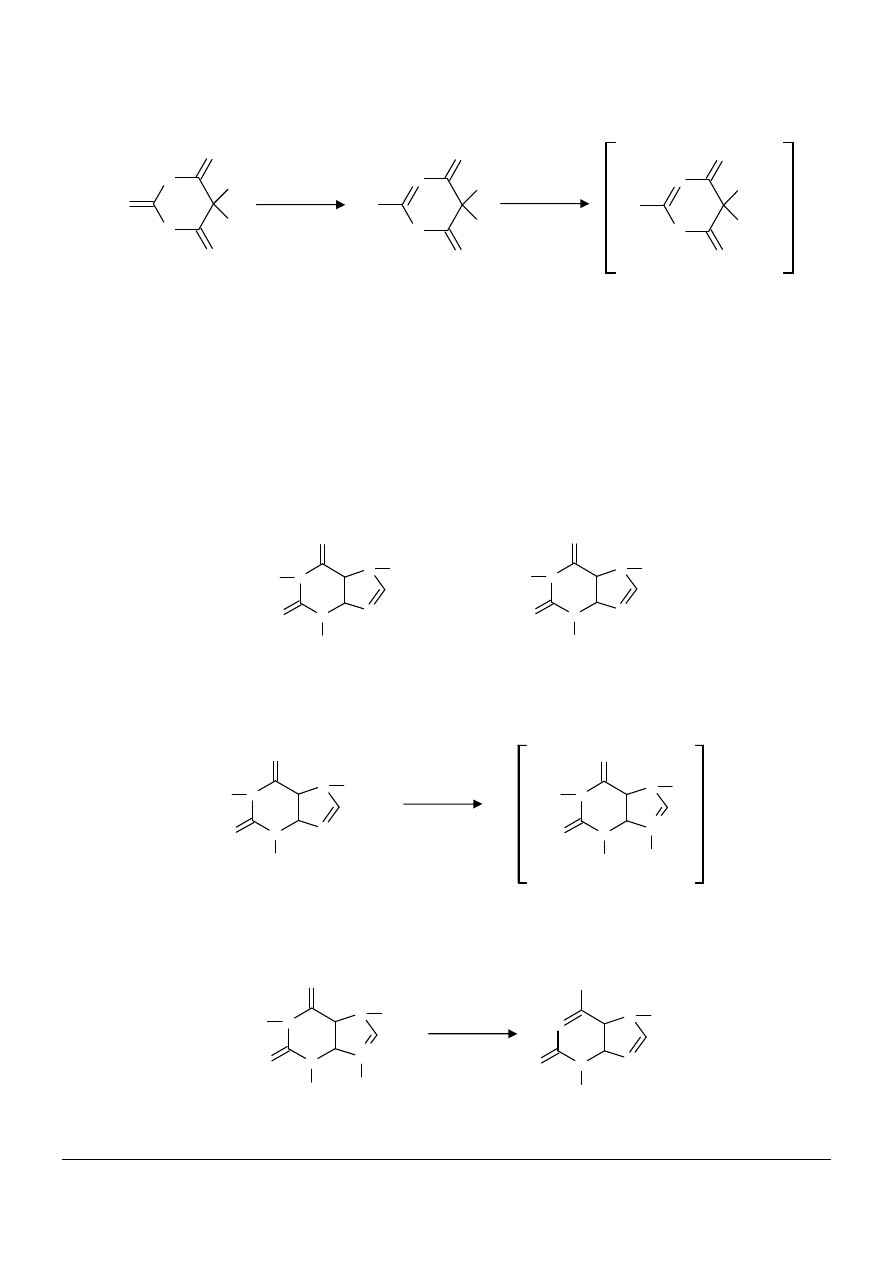
(7) Tworzenie soli sodowych rozpuszczalnych w wodzie po przemianach tautomerycznych związku
farmakologicznie czynnego
§
barbital (luminal) tworzy sól sodową po uprzedniej tautomeryzacji pierścienia aromatycznego
tautomeria – przechodzenie cząsteczek danego związku w jego izomery bez jakiegokolwiek wpływu
innych związków chemicznych, bez naruszenia struktury cząsteczki macierzystej
barbital
sól sodowa barbitalu
O
OH
OH
O
ONa
OH
+ NaHCO
3
O
NH
2
OH
O
ONa
OH
O
ONa
OH
NaOH
HCl
O
OH
OH
NaOH
+
NH
3
+
NaCl
N
H
2
S
O
O
NH
2
N
H
2
S
O
O
NH ONa
NaOH
N
H
N
H
O
O
O
C
2
H
5
C
2
H
5
N
H
N
OH
O
O
C
2
H
5
C
2
H
5
N
H
N
ONa
O
O
C
2
H
5
C
2
H
5
Przekształcenie
tautomeryczne
NaOH
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
(8) Również pochodne kwasu tiobarbiturowego lepiej rozpuszczają się po przekształceniu ich w sole sodowe
kwasu tiobarbiturowego. Aby powstała rozpuszczalna sól konieczne jest dwukrotne potraktowanie
kwasu tiobarbiturowego zasadą sodową (NaOH) – pierwsza porcja doprowadza do przemian
tautomerycznych, natomiast druga – tworzy właściwą sól
kwas tiobarbiturowy tautomeryczna forma kwasu sól sodowa kwasu rozpuszczalna
Barbiturany przechowujemy w formie suchej. Pochodne są bardzo nietrwałe i bardzo łatwo, nawet w
obecności CO
2
z powietrza, następuje utrata właściwości soli
(9) Za pomocą wytwarzanych soli można również kontrolować rozpuszczalność związków
amfoterycznych
Rozpuszczalność pochodnych zasad purynowych zależy w znacznym stopniu od możliwości tworzenia
przez nie soli sodowych czy też soli amonowych.
§
kofeina (1,3,7-trójmetyloksantyna) jest bardzo trudno rozpuszczalna w wodzie (mało grup
zwiększających hydrofilowość)
§
teofilina (1,3-dimetyloksantyna) tworzy sole zarówno sodowe, jak amonowe znakomicie zwiększają
rozpuszczalność
kofeina teofilina
§
teofilina zaliczana jest do amfoterów, gdyż rozpuszcza się zarówno w kwasach, jak i zasadach (w
kwasach powstają chlorowodorki)
§
teobromina, w przeciwieństwie do teofiliny, tworzy jedynie sole sodowe, nie tworzy natomiast soli
amonowych. Podobnie jak teofilina rozpuszcza się kwasach i zasadach, czyli zaliczana jest do
amfoterów
Różnica w możliwości tworzenia soli przez pochodne zasad purynowych może być wykorzystywana do
ich identyfikacji!
teobromina
S
N
H
N
H
O
O
R
1
R
2
S
H
N
N
H
O
O
R
1
R
2
S
-
N
N
H
O
O
R
1
R
2
Na
+
NaOH
NaOH
N
N
N
N
CH
3
C
H
3
CH
3
O
O
N
N
N
N
H
C
H
3
CH
3
O
O
N
N
N
N
+
H
C
H
3
CH
3
O
O
H
Cl
-
N
N
N
N
H
C
H
3
CH
3
O
O
N
N
N
N
+
CH
3
H
CH
3
O
O
H
N
N
N
N
CH
3
ONa
O
CH
3
NaOH
HCl
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
(10) Związkami amfoterycznymi są również sulfonamidy, rozpuszczające się zarówno w kwasach, jak i
zasadach.
Zwiększenie rozpuszczalności tych związków można zwiększyć poprzez wytwarzanie chlorowodorków
(po reakcji z HCl), jak i przekształcanie w sole sodowe (po zadziałaniu zasadą sodową NaOH)
chlorowodorek
sulfatiazol
sól sodowa
(11) Rozpuszczalność amin można zwiększyć jedynie poprzez rozpuszczanie ich w kwasach.
§
aminy I-rzędowe tworzą chlorowodorki po rozpuszczeniu ich w kwasach nieorganicznych np. w
kwasie chlorowodorowym.
Przykładem jest anestezyna (środek znieczulający) przechodzący w lepiej rozpuszczalny w wodzie
chlorowodorek anestezyny:
anestezyna chlorowodorek anestezyny
§
aminy II-rzędowe trudniej rozpuszczają się w kwasach nieorganicznych i trudniej tworzą
chlorowodorki niż aminy I-rzędowe
Przykładem aminy II-rzędowej jest prokaina, która po rozpuszczeniu w kwasie chlorowodorowym
przechodzi w chlorowodorek prokainy o wzorze:
§
w aminach posiadających atom azotu o wyższej rzędowości niż II nie powstają chlowodorki, a
jedynie chlorki
Aminy IV-rzędowe nie tworzą chlorowodorków, gdyż zachowują się jak kationy – azot IV-rzędowy
nie jest w stanie przyłączyć jonu wodorowego. Trwałość takich chlorków jest stosunkowo niewiela.
Chlorek tworzy w ten sposób m.in. acetylocholina:
N
H
2
S
O
O
NH
S
N
N
H
3
+
S
O
O
NH
S
N
Cl
-
N
H
2
S
O
O
NNa
S
N
HCl
NaOH
O
O
C
2
H
5
NH
2
O
O
C
2
H
5
NH
3
+
Cl
-
HCl
O
O
CH
2
NH
2
CH
2
N
+
C
2
H
5
C
2
H
5
H
Cl
-

wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
chlorowodorek acetylocholiny
Mechanizmy działania leków:
Podział leków ze względu na mechanizm ich działania:
Nie występuje jedna teoria określająca mechanizm działania leków w organizmie człowieka. Jednak
analizując większość stosowanych obecnie substancji leczniczych można wyróżnić:
(1) leki, których działanie zależy wyłącznie od ich właściwości fizykochemicznych – ich działanie jest
strukturalnie nieswoiste
Przeważnie są to związki mało aktywne chemicznie, są natomiast obdarzone określonymi
właściwościami fizykochemicznymi np. litofilnością, aktywnością powierzchniową, zdolnością zmian
przepuszczalności błon komórkowych etc.
np. wziewne środki stosowane do znieczulenia ogólnego
(2) leki bardzo aktywne chemicznie o swoistym działaniu uzależnionym od ich budowy chemicznej.
Działanie to jest wynikiem chemicznego łączenia się cząsteczek leku z określonymi mikrostrukturami
komórkowymi, które nazwano receptorami
Podział leków ze względu na sposoby ich oddziaływania:
(1) leki hamujące lub aktywujące czynność enzymów organizmu
(2) leki wpływające na procesy transportu lub biosyntezy
(3) leki działające jako antymetabolity hamujące metabolizm komórkowy
(4) leki, których działanie jest wynikiem bezpośrednich reakcji chemicznych np. reakcji zobojętnienia
I.
Mechanizm fizykochemiczny działania leków:
Przykładem leków opierających swoje działanie na właściwościach fizykochemicznych są środki znieczulenia
ogólnego np. eter dietylowy czy cyklopropan (gazy).
Działanie środka znieczulającego jest tym większe im środek jest bardziej lipofilny, czyli im lepiej rozpuszcza się
w tłuszczach – jest to ściśle powiązane ze współczynnikiem podziału n-oktanol/woda (mierzonego przez pomiar
stężenia substancji czynnej w fazie lipofilowej oraz wodnej) – im współczynnik ten jest wyższy tym środek
znieczulający wykazuje większe działanie.
Związki, których współczynnik podziału jest mniejszy od 1 są słabymi środkami znieczulenia ogólnego –
związki takie przechodzą zbyt wolno z płynów tkankowych do mózgu. Zwiększenie współczynnika podziału,
poprzez zwiększenie rozpuszczalności substancji aktywnej farmakologicznie w tłuszczach nasila działanie
znieczulające
Mechanizm działania środków znieczulających wyjaśnia teoria Paulinga:
Wg niej aktywność środków znieczulających jest uwarunkowana ich zdolnością do wywoływania zmian w
procesach biochemicznych tkanki mózgowej, polegających na tworzeniu się klatratów (swoisty typ połączeń
przeważnie dwóch substancji, mających niewielkie, wzajemne powinowactwo – np. wody i chloroformu). W
określonych warunkach substancje te, pod wpływem uczynnionych sił van der Waalsa mogą połączyć się
tworząc za pomocą cząsteczek wody „klatkę”, wewnątrz której występują cząsteczki innych substancji np.
chloroformu (zostają one związane w sposób czysto mechaniczny, bez wytwarzania jakichkolwiek wiązań
chemicznych). Powstaje w ten sposób struktura zmieniająca rozkład wody w synapsie, zaburzająca procesy
rozkładu elektrolitów oraz zwalniająca przebieg niektórych procesów enzymatycznych
Struktura klatratowa jest strukturą nietrwałą szybko rozpadającą się, gdy w ustroju będzie występowało
zbyt mało środka znieczulającego. Procesy biochemiczne wracają do stanu początkowego, a pacjent
wybudza się z tzw. narkozy chirurgicznej
N
+
C
H
3
CH
3
CH
3
CH
2
CH
2
O
C
O
CH
3
Cl
-

wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
II. Mechanizm chemiczny (teoria receptorowa)
Mechanizm chemiczny działania leków odbywa się na poziomie receptora. Lek wiąże się wówczas z receptorem
zewnątrz- lub wewnątrzcząsteczkowym, co z kolei zakłóca metabolizm komórkowy.
Między receptorem a lekiem dochodzi do następujących oddziaływań (typy wiązań lek-receptor):
wiązanie elektrowalentne (jon-jon) wiązanie kowalentne wiązanie jon-dipol
mostki wodorowe
siły van der Waalsa (wiązanie spolaryzowane)
Oddziaływanie lek-receptor możliwe jest dzięki siłom Columbowskim wynikającym z praw wzajemnego
oddziaływania ładunków, które umożliwiają właściwą orientację w przestrzeni cząsteczki leku w stosunku do
receptora oraz decydują o sprzęganiu leku z receptorem.
Powstawanie takich sił jest możliwe z jednej strony dzięki obecności grup kwasowych lub zasadowych w
białkach (-COOH, -NH
2
), fosfolipidach, kwasach nukleinowych (grupa fosforanowa) oraz
glikozoaminoglikanach (-SO
3
H). Aby mógł wystąpić określony skutek farmakologiczny, w następnych fazach
reakcji między lekiem a receptorem powstają dodatkowe siły fizyczne, umożliwiające dokładne dopasowanie
się cząsteczki leku do receptora. Może to być spowodowane oddziaływaniem między jonem a dipolem,
między dipolami, wreszcie między jonami a indukowanymi dipolami. Powstawanie mostków wodorowych,
obecność ugrupowań protobiorczych i protonodawczych w cząsteczce leku, uczynnione siły van der Waalsa,
hydrofilność i hydrofobowość to następne elementy odgrywające rolę w reakcji leku z receptorem
Mechanizm działania leków na przykładzie receptora adrenergicznego:
Budowa receptora adrenergicznego:
Receptor adrenergiczny dzieli się na receptor α- i β-adrenergiczny. Oba te receptory stanowią 2 strony tego
samego receptora i umieszczone są w zakończeniach układu współczulnego. W strukturze receptora α-
adrenergicznego można wyróżnić elektroujemne centrum uwarunkowane obecnością kwasu fosforowego.
Receptor β-adrenergiczny, utożsamiany z błonowym enzymem zwanym cyklazą adenylową, ma swoistą III-
rzędową strukturę białkową, w której szczególną część odgrywa układ chelatujący. W układzie tym znajduje
się atom magnezu
R
1
C
O
R
2
O
NH
3
+
R
1
C
NH
2
NH
2
O
δ
-
δ
+
CH
2
CH
2
CH
2
CH
2
R
1
R
2
R
1
O
H
O
H
R
2
δ
-
δ
-
δ
+
R
1
NH
3
+
C
O
-
O
R
2
wiązanie
chelatowe
CH
C
H
3
C
H
3
NH
2
+
CH
2
NH
2
+
C
H
3
CH
2
HC
N
H
3
+
O
H
O
H
O
Mg
O
-
P
O
O
O
C
H
3
CH
3
wiązanie
jonowe
receptor α-
adrenergiczny
receptor β-
adrenergiczny

wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
Interakcja lek-receptor:
Wiązanie się leku z receptorem polega na:
§
wytworzeniu wiązania jonowego między centrum elektroujemnym receptora a elektrododatnim jonem
amoniowym cząsteczki leku
§
chelatowaniu z udziałem grup fenolowych leku i metalu, w tym przypadku magnezu
§
uaktywnieniu sił van der Waalsa przyłożonych do płaskiego pierścienia aromatycznego – element
ułatwiający przymocowanie cząsteczki aminy katecholowe w adrenoreceptorze
„Trójstykowy” kontakt leku z receptorem zapoczątkowuje powstanie określonego skutku farmakologicznego.
Trwałość kompleksu lek-receptor oraz dopasowanie się do receptora cząsteczki leku uzależnione jest od jego
struktury
1. Interakcja adrenaliny z receptorem:
Aminy katecholowe z wolną grupą aminową wiążą się łatwiej z elektroujemnym fragmentem struktury
receptora α-adrenergicznego niż z układem chelatującym receptora β-adrenergicznego – silnie wiąże się
ona wiązaniem jonowym z resztą kwasu fosforowego wchodzącego w skład tej części receptora
2. Interakcja izopraneliny z receptorem:
Izopranelina posiada grupę aminową zablokowaną rodnikiem izopropylowym, dlatego kontakt tej grupy
z ujemnym centrum receptora α-adrenergicznego jest utrudniony – łączy się ona wyłącznie z receptorem
β-adrenergicznym dzięki grupom fenolowym
3. Interakcja adrenaliny z receptorem:
Budowa chemiczna adrenaliny pozwala na jej jednoczesny kontakt zarówno receptorem α- jak i β-
adrenergicznym
III. Antagoniści i agoniści:
Aby współdziałanie leku z receptorem mogło wywołać odpowiedni skutek farmakologiczny substancja chemiczna
musi spełniać dwa podstawowe warunki:
1. musi mieć powinowactwo chemicznego receptora
2. musi charakteryzować się odpowiednią aktywnością wewnętrzną
powinowactwo chemiczne – stopień, w jakim lek dopasowuje się do receptora. Wynika on z faktu łączenia się
odpowiednich grup chemicznych z fragmentami receptora przy użyciu wiązań
Jeżeli dany lek charakteryzuje się bardzo wysokim powinowactwem chemicznym wiąże się wówczas bardzo
silnie i szybko z receptorem, jeżeli jednak nie posiada powinowactwa chemicznego – w ogóle nie łączy się z
receptorem, a tym samym nie jest lekiem receptorowym
aktywność wewnętrzna leku – zdolność do wywoływania odkreślonego pobudzenia receptora. Jeżeli lek
charakteryzuje się dużą aktywnością wewnętrzną to silnie pobudza receptory oraz wywołuje określony skutek
farmakologiczny. Natomiast leki nie posiadające aktywności wewnętrznej nie wywołują działania
farmakologicznego, mimo iż mogą łączyć się z receptorem, jeżeli obdarzone są dużym powinowactwem
chemicznym
Substancje farmakologicznie czynne o receptorowym mechanizmie działania można podzielić na dwie grupy:
1. agonista – substancja mająca powinowactwo chemiczne do receptora posiadająca dodatkowo dużą
aktywność wewnętrzną warunkującą pobudzenie receptora. Łączy się ona z receptorem zmieniając jego
konformację, co z kolei prowadzi do określonego efektu farmakologicznego
2. antagonista – substancja mająca powinowactwo chemiczne do receptora nie posiadająca jednak
aktywności wewnętrznej, co w konsekwencji prowadzi do zablokowania receptora. Nie spełnia ona
wszystkich wymogów strukturalnych potrzebnych do zmiany konformacji receptora
Wykorzystywanie istnienia agonistów i antagonistów jest jednym z podstawowych mechanizmów działania
współczesnych leków
Działanie agonistów i antagonistów na przykładzie epinefryny oraz fentolaminy
Zarówno epinefryna, jak fentolamina oddziaływują na receptor epinefryny i posiadają w stosunku do niego
odpowiednio duże powinowactwo chemiczne. Jeżeli epinefryna (agonista) połączy się z receptorem dojdzie do
aktywacji cyklazy adenylowej w wyniku czego zostanie osiągnięty efekt farmakologiczny – dojdzie do skurczu
mięśni gładkich naczyń krwionośnych.
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
Fentolamina (antagonista) jest substancją bardzo podobną do epinefryny. Jeżeli jednak to ona połączy się z
receptorem nie dojdzie do aktywacji cyklazy adenylowej, gdyż nie posiada ona aktywności wewnętrznej.
Przykłady agonistów oraz antagonistów:
acetylocholina (agonista) atropina (antagonista)
izopanelina (agonista) propranolol (antagonista)
Praktyczne zastosowanie agonistów i antagonistów:
Największe znaczenie praktyczne w lecznictwie mają inhibitory enzymatyczne, których działanie polega na
zahamowaniu czynności przeważnie jednego z enzymów.
Np. hamowanie działalności acetylocholiny poprzez wprowadzenie neostygminy (antagonista acetylocholiny):
(-) (E) (-) (E)
zaczep anionowy zaczep estrowy zaczep anionowy zaczep estrowy
Neostygmina jest antagonistą acetylocholiny – hamuje ona czynność cholinoesterazy, enzymu
rozkładającego hydrolitycznie acetylocholinę, która jest z kolei neuroprzekaźnikiem we wszystkich
synapsach cholinergicznych. Neostygmina powoduje tym samym zwiększenie stężenia acetylocholiny, co
prowadzi do pobudzenia zakończeń układu przywspółczulnego.
Podobieństwo w budowie warunkuje ich zbliżone oddziaływanie: kontakt enzymu z acetylocholiną
możliwy jest dzięki powstawaniu wiązania jonowego między ugrupowaniem aminowym acetylocholiny a
zaczepem anionowym ośrodka aktywnego enzymu oraz w wyniku tworzenia się wiązania kowalencyjnego,
dzięki udziałowi zaczepu estrowego oraz elektrofilowego atomu węgla grupy estrowej acetylocholiny.
Neostygmina, wykazująca strukturalne podobieństwo do acetylocholiny dzięki obecności ugrupowania
amoniowego i estrowego może także łączyć się z ośrodkami acetylocholin esterazy, podobnie jak w
przypadku tworzenia się kompleksu acetylocholiny z enzymem
Inne leki mające działanie hamujące na enzymy:
(1) nialamid – hamuje enzym monoaminooksydazę (MAO) – stosowana jako lek przeciwdepresyjny
(2) allopurynol – hamuje oksydazę ksantynową – stosowany jest w skazie moczanowej
(3) sulfonamidy – hamują anhydrazę węglanową – działanie moczopędne
(4) penicyliny – inhibitory transpeptydazy, czyli enzymu uczestniczącego w budowie ścian komórkowych
bakterii
N
+
C
H
3
C
H
3
C
H
3
CH
2
CH
2
O
C
O
CH
3
C
H
3
N
O
O
H
CH
2
OH
CH
C
H
3
C
H
3
NH
CH
2
CH
OH
OH
OH
O
CH
2
C
H
OH
CH
2
NH
HC
CH
3
CH
3
N
+
C
H
3
C
H
3
C
H
3
CH
2
CH
2
O
CH
3
O
N
+
C
H
3
C
H
3
C
H
3
O
C
O
N
CH
3
CH
3
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
IV. Leki wpływające na procesy transportu w organizmie:
(1) acetylocholina – wzrost przepuszczalności błon komórkowych dla jonów Na
+
, K
+
oraz Ca
2+
(2) środki znieczulające miejscowo – hamują przepuszczalność błon komórkowych dla kationów,
zwłaszcza sodowych i potasowych, co doprowadza do wygaszenia prądu czynnościowego warunkującego
przewodzenie wzdłuż włókien nerwowych
(3) insulina – zwiększa przepuszczalność błony komórkowej mięśni prążkowanych oraz komórek tkanki
tłuszczowej dla glukozy pozakomórkowej, co skutkuje zwiększeniem dopływu glukozy do wnętrza tych
komórek
(4) glikozydy nasercowe – zmieniają przepuszczalność błon biologicznych dla jonów sodowych i
potasowych, zwiększają stężenie jonów wapniowych w bezpośrednim sąsiedztwie miofibrylli – ułatwia to
zmianę enegii chemicznej nagromadzonej w ATP na energię skurczu
V.
Antymetabolity:
Antymetabolity – substancje hamujące metabolizm komórkowy, łącząca się z pozostałymi składnikami, ale
dające „produkt fałszywy” różniący się nieznacznie od struktur fizjologicznych powstałych w procesach
biochemicznych
Wykazują duże podobieństwo chemiczne do fizjologicznych metabolitów, czemu zawdzięczają swoje
działanie. W żywym organizmie mogą być włączane w miejsce właściwych metabolitów.
metabolit antymetabolit
produkt fizjologiczny produkt „fałszywy”
Przez wprowadzenie do organizmu substancji o charakterze antymetabolitu następuje zahamowanie tego
etapu przemian biochemicznych, w którym metabolity odgrywał zasadniczą rolę.
Zastosowanie:
Na zasadzie antymetabolitów działają niektóre leki przeciwbakteryjne oraz leki cytostatyczne i
immunosupresyjne np. sulfonamidy z powodu dużego podobieństwa chemicznego do kwasu 4-
aminobenzoesowego (PABA) są jego antymetabolitami, tym samym hamują syntezę kwasu foliowego i
uniemożliwiają powstawanie pirymidyn oraz kwasów nukleinowych, co hamuje wzrost bakterii.
Przykłady metabolitów i antymetabolitów:
(1)
kwas PABA (metabolit) sulfanilamid (antymetabolit)
(2)
uracyl (metabolit) 5-fluorouracyl (antymetabolit)
biosynteza
N
H
2
O
OH
N
H
2
S
NH
2
O
O
N
H
N
O
OH
N
H
N
O
OH
F
wykłady z chemii leków – farmacja rok III | rok akademicki 2008/2009 | by p.Zosia :-)
normalna czcionka: materiały z wersji pierwotnej wykładów | kursywa: uzupełnienia z notatek i podręczników
(3)
kwas foliowy (metabolit)
metotreksat (antymetabolit)
(4)
hipoksantyna (metabolit) 6-merkaptopuryna (antymetabolit)
N
N
N
N
N
H
2
OH
CH
2
NH
C
O
NH
CH
(CH
2
)
2
COOH
(CH
2
)
2
COOH
N
N
N
N
NH
2
N
H
2
CH
2
N
CH
3
C
O
NH CH
(CH
2
)
2
COOH
COOH
N
N
N
N
H
OH
N
N
N
N
H
SH
Wyszukiwarka
Podobne podstrony:
chemia lekow wyklad2
Chemia Leków Wykłady Z Technologii Środków Leczniczych
chemia lekow wyklad14
chemia lekow wyklad3
chemia lekow wyklad12
chemia lekow wyklad3(1)
wykladowka2, Farmacja, III rok farmacji, Chemia leków
wykladowka3, Farmacja, III rok farmacji, Chemia leków
chemia organiczna wykład 6
Chemia medyczna wykład 1
Chemia fizyczna wykład 11
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
pytania leki, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
Narkotyczne leki przeciwbólowe, Farmacja, III rok farmacji, Chemia leków
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
Chemia ogolna wyklady 5 6 2012 Nieznany
chemia analityczna wyklad 11 i 12
chemia fizyczna I wykład(1)
więcej podobnych podstron