
Immunogenetyka cz. I
Małgorzata Stadnik
III rok
Grupa 47
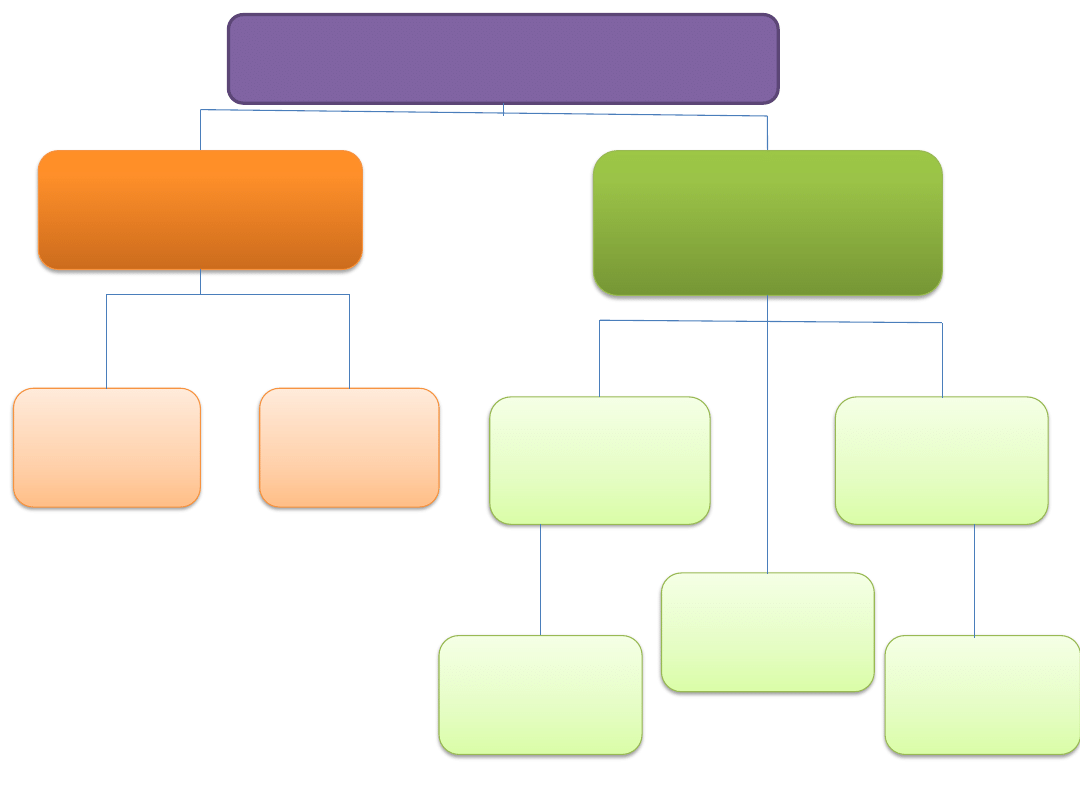
KRWIOTWÓRCZA KOM. MACIERZYSTA
MIELOIDALNA KOM.
PROGENITOROWA
LIMFOIDALNA KOM.
PROGENITOROWA
limfocyty T
limfocyty B
komórki
dendrytyczne
pomocnicze
cytotoksyczne
supresorowe
kom.
plazmatyczne
granulocyty
monocyty

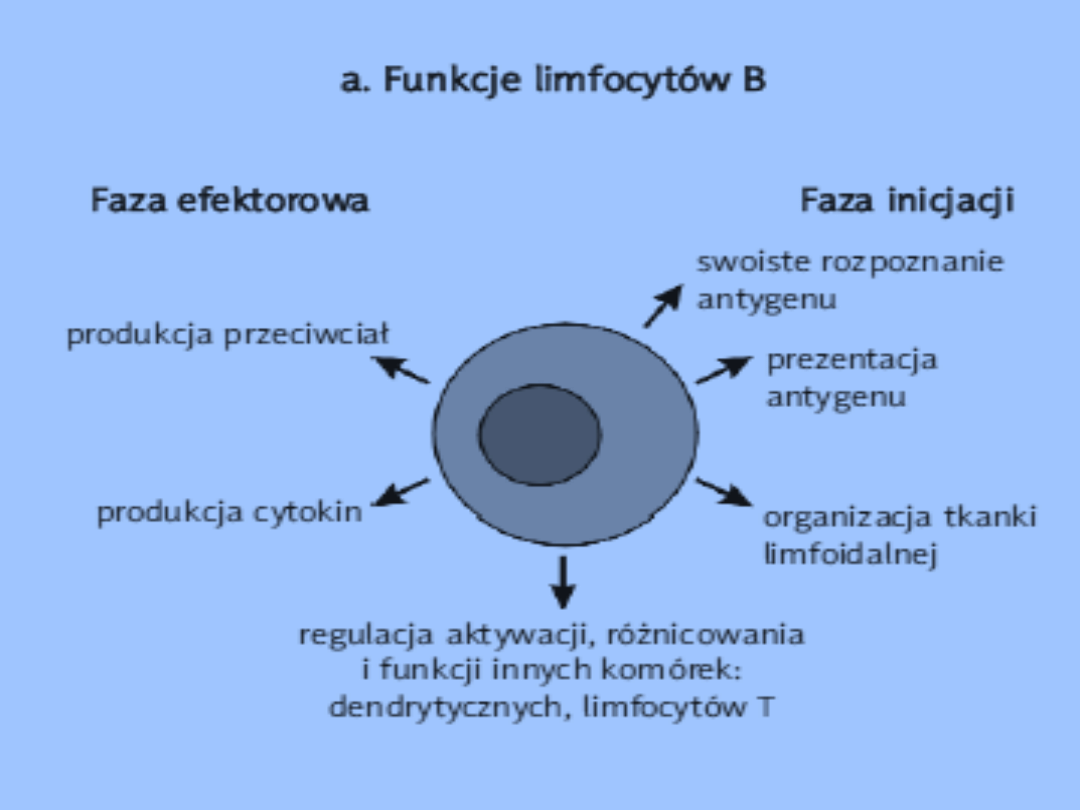
Rola w odpowiedzi immunologicznej
Limfocyty B i Limfocyty T
odpowiedzialne są za
swoiste rozpoznanie antygenów rozwój
swoistej odpowiedzi immunologicznej
(komórkowej, humoralnej).
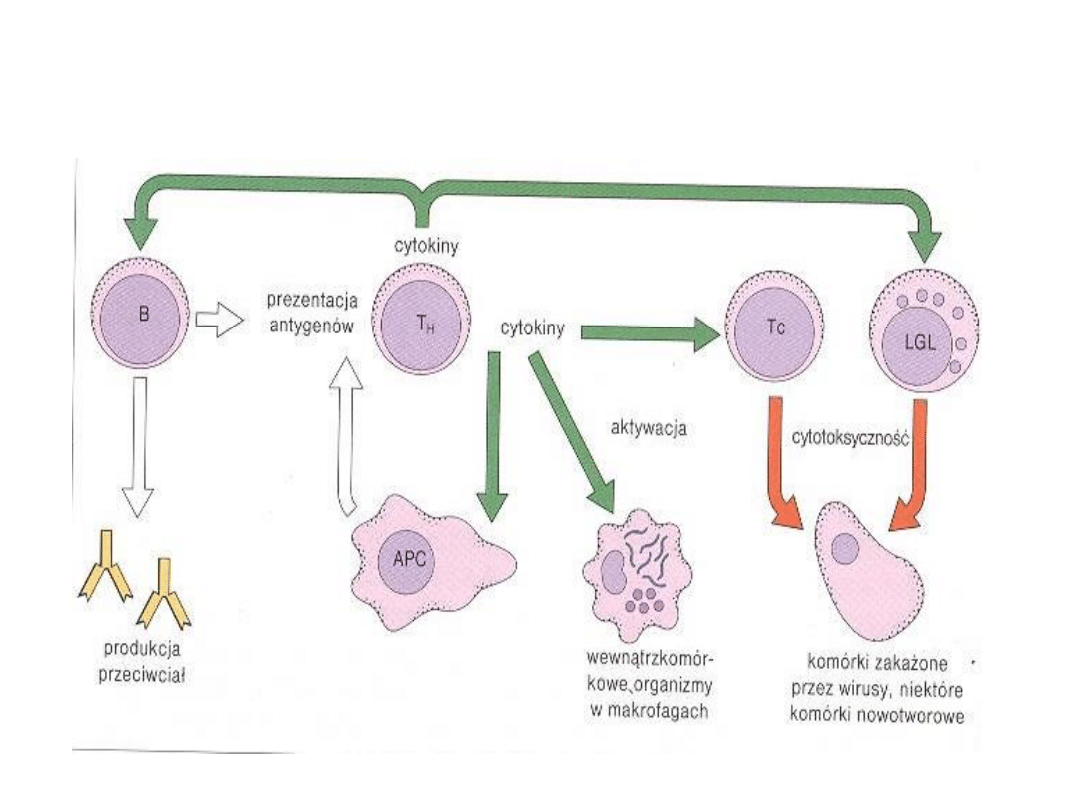
Funkcje limfocytów

Limfocyty T
Limfocyty T
-Dojrzewają w grasicy
-Charakteryzują się obecnością na ich powierzchni
następujących markerów: TCR, CD2, CD3, CD4, CD5, CD7, CD8,
CD28, CD40L
-Receptor TCR –bierze udział w rozpoznanie antygenu oraz
przekazaniu sygnału do wnętrza limfocytu T
-Warunkują odpowiedź typu komórkowego przeciw
patogenom wewnątrzkomórkowym, a także współdziałają z
limfocytami B w odpowiedzi typu humoralnego

Dojrzewanie limfocytów T
• Limfocyty T dojrzewają w grasicy – limfocyty
przebywające i dojrzewające w grasicy nazywamy
tymocytami.
• Komórki progenitorowe limfocytów T napływają do
grasicy już w 7-8 tyg. ciąży. Początkowo prekursory
limfocytów T powstają w płodowym pęcherzyku
żółtkowym oraz wątrobie płodowej. W późniejszym
okresie oraz po urodzeniu docierają do grasicy ze
szpiku.
• W czasie dojrzewania w procesach selekcji ginie ok.
90% tymocytów, tzw. wąskie gardła tymopoezy.

W grasicy możemy wyróżnić cztery populacje
limfocytów T w zależności od stopnia dojrzałości:
- Tymocyty potrójnie ujemne CD4-/CD8-/TCR-
- Tymocyty podwójnie dodatnie CD4+/CD8+
- Tymocyty CD4+ lub CD8+
- Dojrzałe limfocyty T

Dojrzewanie limfocytów T
Wyróżniamy 2 fazy:
• wczesną, w trakcie której dojrzewające
komórki nie mają receptorów rozpoznających
antygen (TCR).
• późną, w której tymocyty mają pełną
ekspresję receptorów rozpoznających antygen.

Wczesna faza
W wyniku bezpośredniego kontaktu z komórkami
tworzącymi zrąb grasicy oraz pod wpływem lokalnie
wydzielanych cytokin komórki zasiedlające grasicę
zaczynają intensywnie się dzielić.
Ta wstępna proliferacja jest niezbędna do tego, aby
powstało jak najwięcej komórek, w których zostanie
rozpoczęty proces rearanżacji genów kodujących receptor
TCR. Im więcej komórek przystąpi do tego procesu, tym
większa będzie różnorodność tych receptorów.

Selekcja β
Doprowadza do wytworzenia receptora TCR składającego
się z dwóch różnych łańcuchów: α i β. Rearanżacja genów
dla tych łańcuchów odbywa się niezależnie i w różnym
czasie. Najpierw dochodzi do rearanżacji w obrębie
genów łańcucha β TCR. Dzięki tej rearanżacji może
powstać wiele milionów różnych kombinacji. Oczywiście
w jednym tymocycie powstaje tylko jeden spośród wielu
łańcuchów.
Zanim rozpocznie się rearanżacja genów dla łańcucha α,
musi dojść do sprawdzenia, czy łańcuch β powstał
prawidłowo. Proces sprawdzania poprawności rearanżacji
genów dla łańcucha β nazywany jest SELEKCJĄ β .

Selekcja β
Jeśli łańcuch β ma prawidłową budowę, to aktywuje
on mechanizm umożliwiający przeżycie tymocytów.
Komórki, które prawidłowo nie zrearanżowały genu
TCRβ, ulegają apoptozie (około 70%). W
limfocytach, które z powodzeniem przeszły selekcję
β, dochodzi do zablokowania rearanżacji genów
TCRβ (wyłączenie alleliczne).
Po selekcji β komórki zaczynają wytwarzać CD4 i
CD8 i ulegają bardzo intensywnej proliferacji. Wraz z
pojawieniem się tych receptorów dochodzi do
zainicjowania rearanżacji genów kodujących TCRα .

Późna faza
W fazie późnej limfocyty podwójnie dodatnie
(CD4+,CD8+) poddawane są:
• selekcji pozytywnej
• selekcji negatywnej.
Celem selekcji jest wyłonienie puli limfocytów T
rozpoznających obce antygeny w połączeniu z
własnymi cząsteczkami MHC.

Selekcja pozytywna (klonalna)
Zachodzi w części korowej grasicy. Selekcji pozytywnej
poddawane są limfocyty podwójnie dodatnie, czyli
mające zarówno CD4, jak i CD8, w których doszło do
rearanżacji łańcucha α TCR.
Celem selekcji pozytywnej jest wyłonienie takich
komórek, które:
• mają prawidłowo wytworzony receptor TCR oraz
• poprzez TCR potrafią rozpoznawać peptyd
prezentowany przez autogeniczne cząsteczki MHC.
Jeśli dojrzewający tymocyt nie rozpozna żadnego
antygenu, wówczas po pewnym czasie ulega apoptozie.

Restrykcja MHC
W przebiegu selekcji pozytywnej dochodzi
jednocześnie do restrykcji MHC.
Te limfocyty, które będą rozpoznawać antygeny
prezentowane przez MHC klasy I, zachowują
ekspresję CD8+, a te, które mają wiązać antygen
w kontekście MHC klasy II, pozostają CD4+.
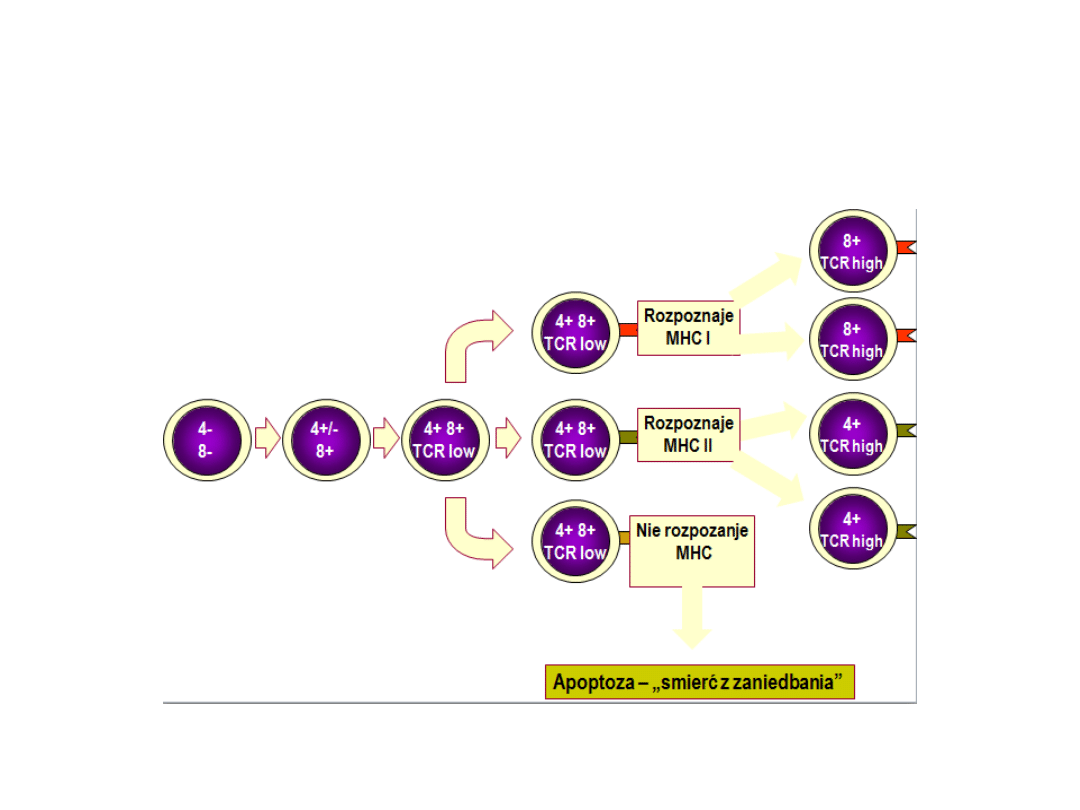
Selekcja pozytywna i restrykcja MHC

Selekcja negatywna
Zachodzi w miejscu przejścia kory w rdzeń. Selekcja
negatywna prowadzi do usunięcia tych tymocytów,
które zdolne są do rozpoznawania własnych
antygenów ze zbyt dużym powinowactwem. Proces
ten przeżywają zatem te komórki, które „słabo”
rozpoznają własne cząsteczki, ale w przyszłości będą
rozpoznawały obce antygeny.
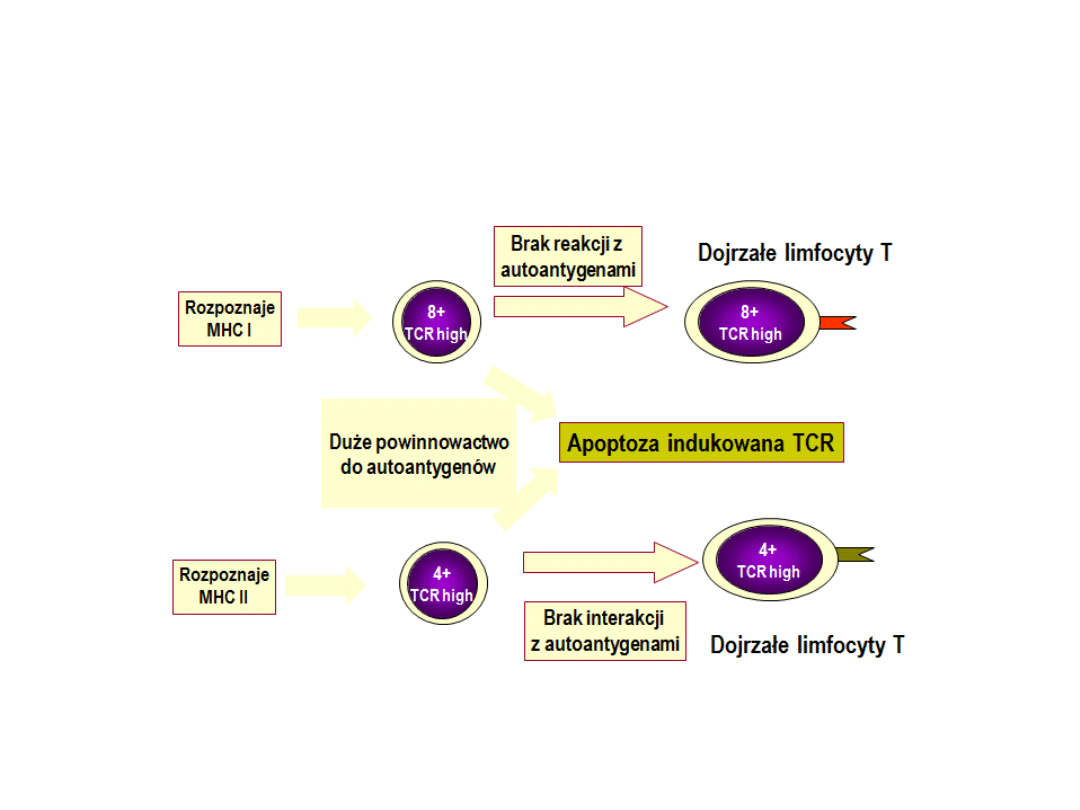
Selekcja negatywna

Losy tymocytów
W wyniku selekcji β oraz braku selekcji
pozytywnej ginie około 90% tymocytów. Spośród
nich kolejne 80% ginie w selekcji negatywnej.
Tylko niewielki procent tymocytów przechodzi
proces dojrzewania i dostaje się do krwi
obwodowej.

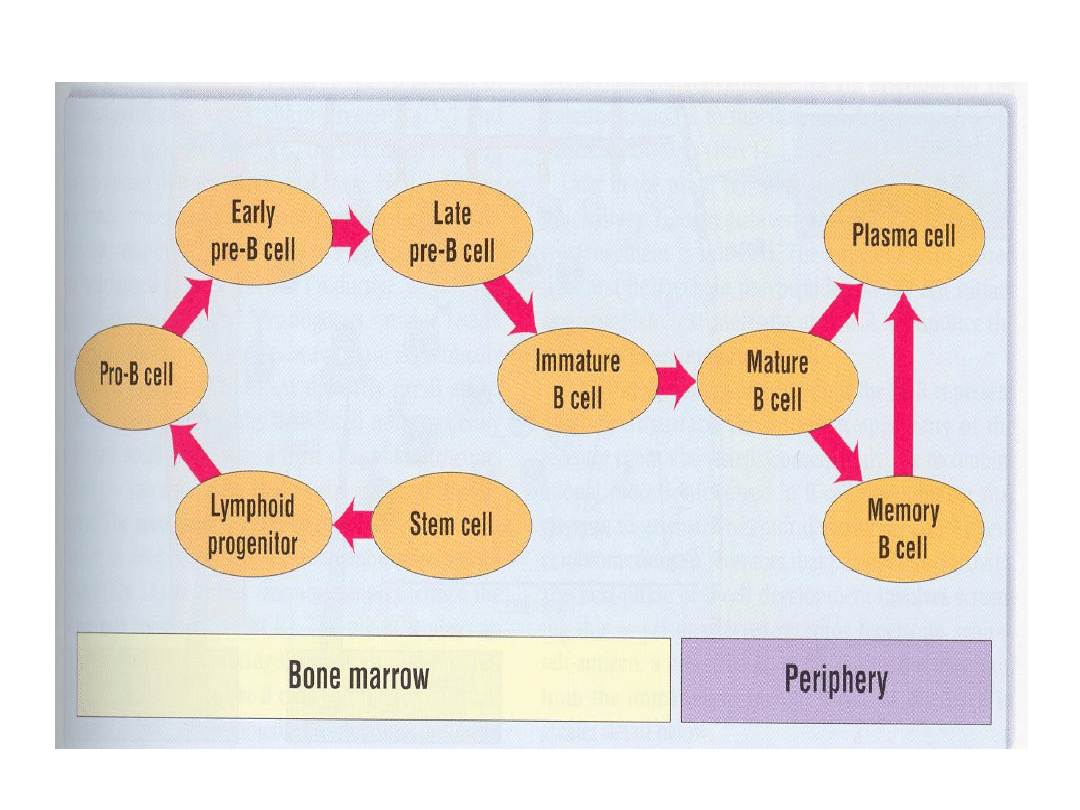
Limfocyty B

Dojrzewanie limfocytów B
Limfocyty B dojrzewają głównie w szpiku kostnym w
5 zasadniczych etapach:
• Komórka pre-pro-B,
• Komórka pro-B,
• Komórka pre-B, w tym pre-BI i pre-BII,
• Niedojrzałe limfocyty B,
• Dojrzałe limfocyty B.
Najważniejszymi czynnikami transkrypcyjnymi
determinującymi różnicowanie w kierunku
limfocytów B są Pax5 i EBF (early B cell factor).

KOM. PRE-PRO-B
Komórki/limfocyty pre-pro-B to komórki, w
których pojawia się czynnik transkrypcyjny Pax-
5.Są to komórki „nieodwołalnie skazane” na
dojrzewanie w kierunku limfocytów B. Dochodzi
w nich do ekspresji genów odpowiedzialnych za
rearanżację segmentów genów dla składowych
receptora immunoglobulinowego.

KOM.PRO-B
W komórkach tych dochodzi do pierwszych rearanżacji
segmentów genów immunoglobulinowych.Na ich powierzchni
pojawia się cząsteczka CD19 - marker limfocytów B. W błonie
komórkowej zaczynają się też pojawiać cząsteczki MHC klasy
II oraz receptor zbudowany z łańcuchów Igα (CD79a) , Igβ
(CD79b) oraz kalneksyny. Łańcuchy te w połączeniu z
kalneksyną tworzą receptor rozpoznający nieznany ligand. W
komórkach tych dochodzi do połączenia segmentów genów D
i J. Także pod wpływem IL-7 i dzięki czynnikowi
transkrypcyjnemu Pax5 dochodzi do dalszej rearanżacji
segmentów genów: V oraz DJ dla składowych receptora
immunoglobulinowego. Segmenty te po połączeniu z
segmentem genu μ kodują łańcuch ciężki przeciwciała.

KOM. PRE-B
Gdy w dojrzewającym limfocycie B pojawia się
łańcuch ciężki przeciwciała, mówimy już o
komórcepre-B. Populacja komórek pre-B jest
zwyczajowo dzielona na dwie subpopulacje: pre-
BIoraz pre-BII, które mają takie same markery
powierzchniowe, ale różnią się właściwościami
biologicznymi- szczególnie zdolnością do
proliferacji.

Pre-BI
Populacja dużych, aktywnie dzielących się komórek. Pojawia
się w nich pierwotny receptor BCR (pre-BCR ), zbudowany z
łańcucha ciężkiego, który łączy się z dwoma peptydami,
odpowiadającymi funkcjonalnie (zastępującymi) części
zmiennej i stałej łańcuchów lekkich Ig, dlatego określane
bywają jako łańcuch pseudo-L (φL) lub zastępczy łańcuch lekki.
Pojawienie się receptora pre-BCR w błonie komórkowej
wstrzymuje dalsze rearanżacje genów immunoglobulinowych.
Dochodzi także do wyłączenia allelicznego (zmian
epigenetycznych, prowadzących do unieczynnienia genów
immunoglobulinowych na jednym z pary chromosomów),
sprawdzenia funkcjonalności łańcucha ciężkiego (selekcja
pozytywna) oraz do podziałów tych prekursorów limfocytów
B.

Pre-BII
Populacja małych, postmitotycznych limfocytów, zatrzymanych w fazie G1
cyklu komórkowego. W tym stadium rozwojowym rozpoczyna się rearanżacja
segmentów genów dla łańcucha lekkiego κ immunoglobulin. Gdy nie zostanie
wytworzony sprawny łańcuch κ, może dojść do rearanżacji genów
odpowiedzialnych za powstawanie łańcucha λ.
Nie we wszystkich limfocytach obserwuje się wyłączenie alleliczne dla genów
kodujących łańcuchy lekkie- ok. 10% limfocytów B krwi obwodowej ma
prawidłowo zrearanżowane geny obu alleli, a część z nich może mieć dwa
różne receptory BCR o odmiennej swoistości.
Wyłączenie alleliczne (ekskluzja):
Mówimy o nim, kiedy tylko jeden allel danego genu ulega ekspresji, podczas
gdy drugi jest wyciszany.

NIEDOJRZAŁE LIMF. B
Gdy zakończy się rearanżacja genów dla łańcucha
lekkiego, a na powierzchni komórki pojawi się
dojrzały receptor immunoglobulinowy klasy IgM (IgM
BCR) mówimy o niedojrzałym limfocycie B. Oprócz tego
receptora na niedojrzałych komórkach B mogą
występować nieliczne receptory pre-BCR. W tym stadium
rozwojowym limfocyty mogą opuszczać szpik kostny,
przedostawać się do krwiobiegu i wędrować do
obwodowych narządów limfatycznych.

DOJRZAŁE LIMF. B
Wytworzenie przez limfocyt łańcucha ciężkiego δ
immunoglobuliny oraz pojawienie się na jego
powierzchni, oprócz BCR IgM, także receptora
immunoglobulinowego IgD (BCR IgD) jest markerem
zakończenia dojrzewania limfocytu B. Pojawieniu się
powierzchniowych IgD towarzyszy indukcja
ekspresji cząsteczek CD21 i CD23, które uczestniczą
w kostymulacji, gdy dojrzały limfocyt B włącza się
do odpowiedzi immunologicznej.

SELEKCJA LIMF. B
Proces ten nie jest jednak tak dokładny, jak w przypadku
limfocytów T.
• Selekcja pozytywna:
Ma na celu sprawdzenie czy doszło do prawidłowej rearanżacji
genów kodujących łańcuch ciężki μ oraz pre-BCR, czyli czy
zrearanżowany łańcuch ciężki potrafi łączyć się z łańcuchem
lekkim (na tym etapie- pro-B/pre-B z łańcuchem zastępczym).
W selekcji tej nie dochodzi do wiązania antygenu.
• Selekcja negatywna:
Ma na celu usunięcie limfocytów autoreaktywnych. Jeśli po
dotarciu do błony komórkowej pre-BCR rozpozna jakiś
antygen, oznacza to, że komórka ta jest potencjalnie
autoreaktywna i dochodzi do jej apoptozy.
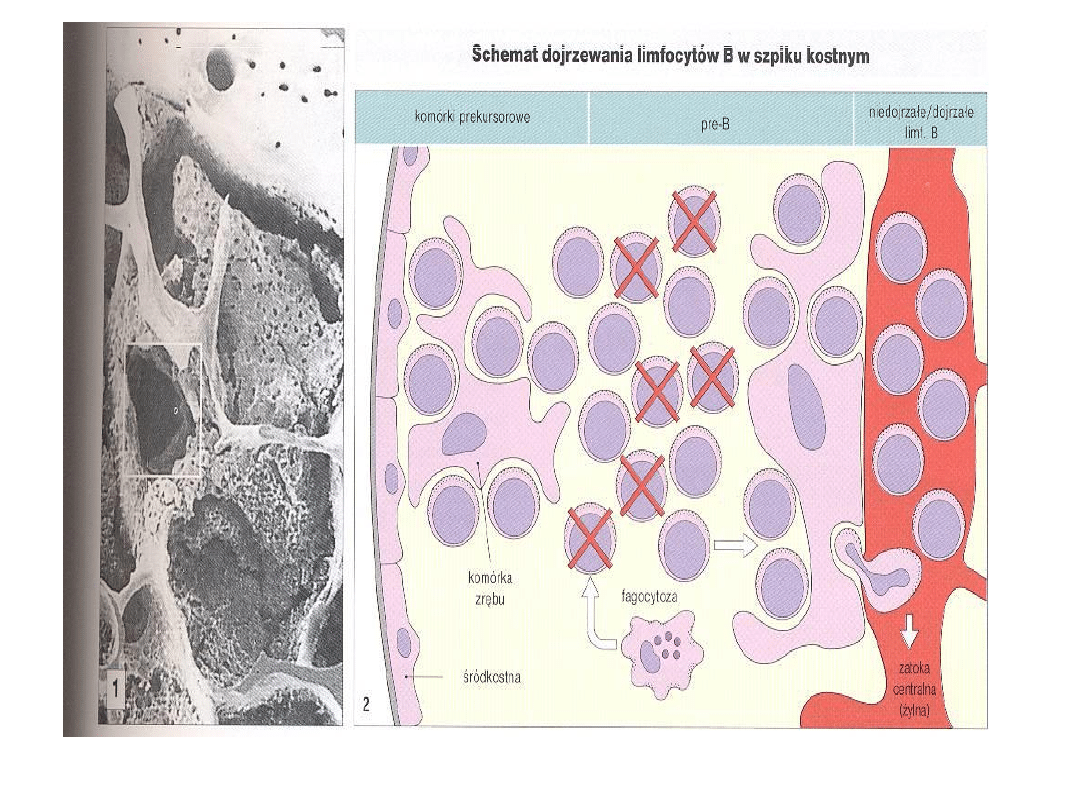

CZYNNIKI WPŁYWAJĄCE NA
DOJRZEWANIE LIMFOCYTÓW B
1. Stymulacja komórki przebiegająca poprzez
pierwotne receptory BCR (pre-BCR)
2. Bodźce pochodzące od komórek otoczenia,
głównie komórek zrębowych szpiku:
3. Interakcje komórek zrębu z dojrzewającymi
limfocytami B,
4. Czynniki wydzielane przez komórki zrębowe: IL-
7 , PPBSF (pre-pro-B cell growth-stimulating
factor), TSLP (thymic stromal lymphopoietin),
chemokinaCXCL12 .

PRZECIWCIAŁA

Przeciwciała
Zasadniczy element układu odpornościowego.
Każdy rodzaj immunoglobulin rozpoznaje tylko
jeden antygen, a właściwie jedną z determinant
antygenowych (epitopów) znajdujących się na
powierzchni antygenu.
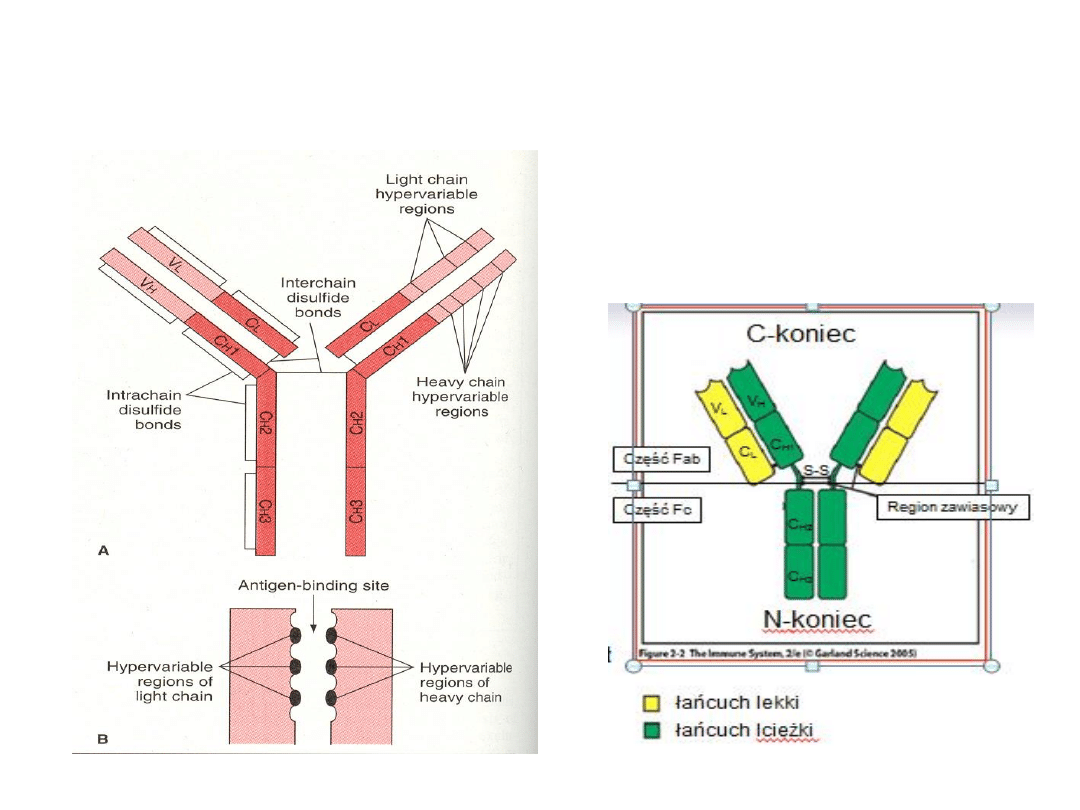
Budowa immunoglobuliny
-2 łańcuchy lekkie L (λ lub κ)
-2 łańcuchy ciężkie H
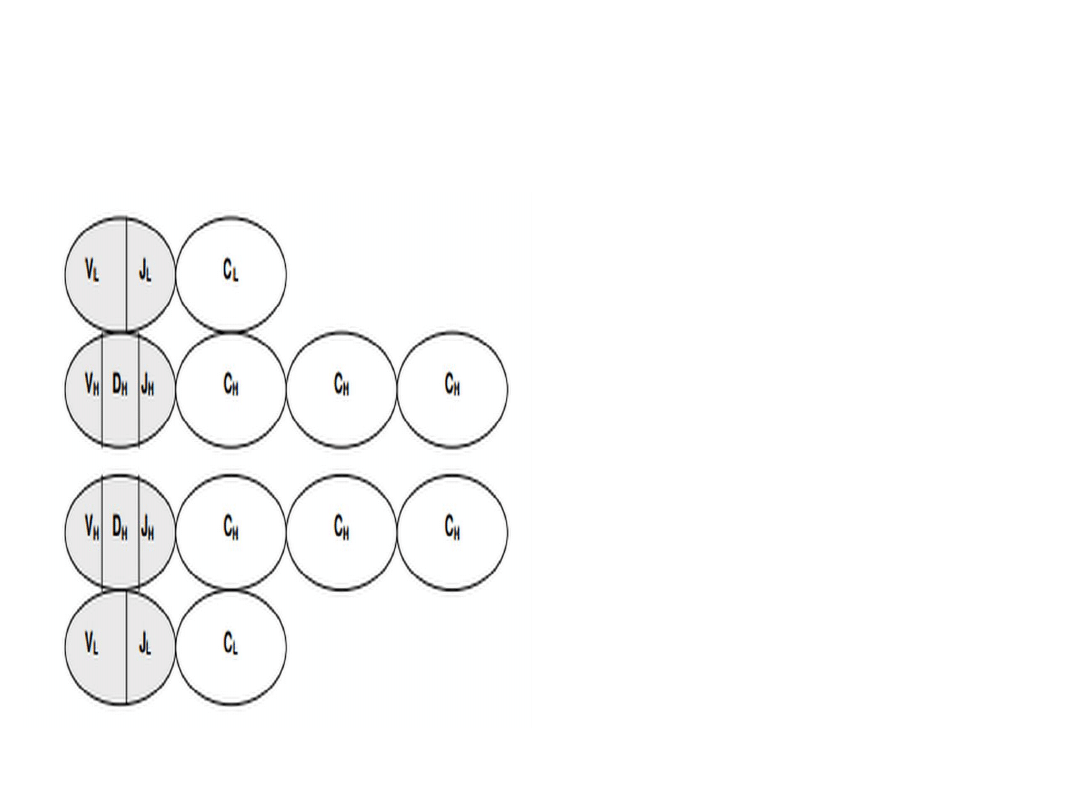
Geny immunoglobulin
Część zmienna łańcucha L:
- V (variable)
- J (joining)
Część zmienna łańcucha H:
- V
- J
- D (diversity)
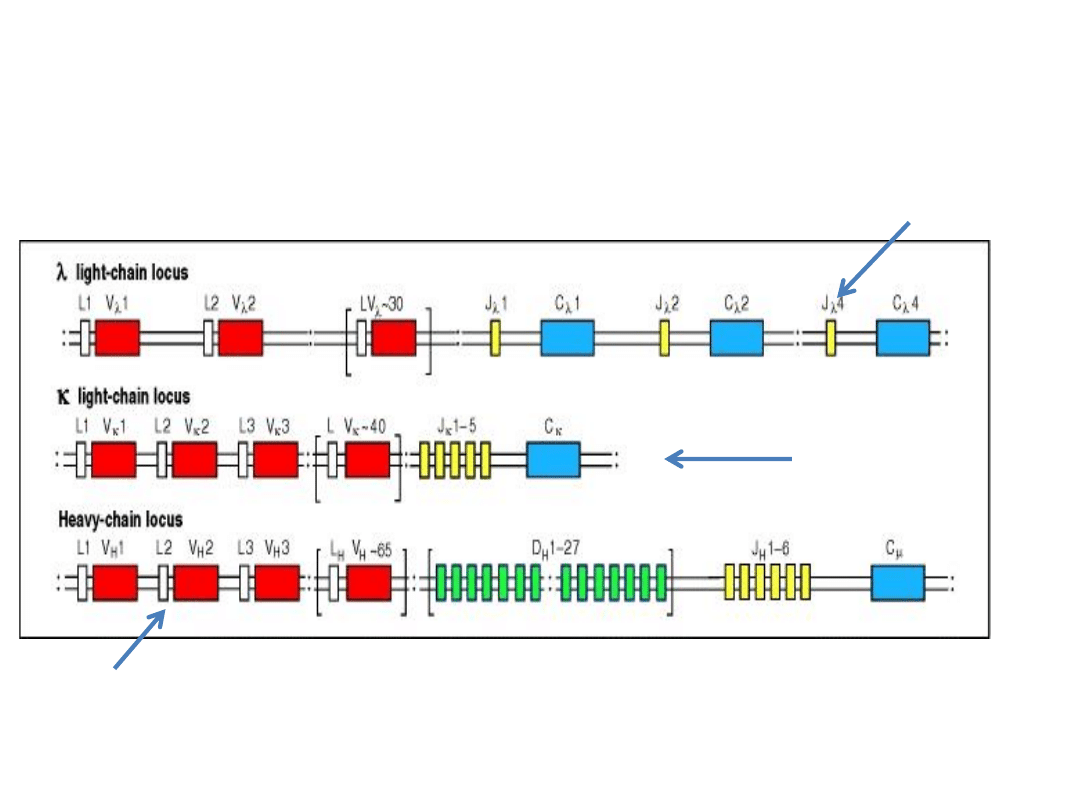
Struktura genów immunoglobulin
w komórkach macierzystych
Chromosom 22
Chromosom 2
Chromosom 14

Odpowiedź immunologiczna
Okres adaptacyjny:
Zdolność rozróżniania tego co „swoje” od tego
co obce nabywana jest w czasie rozwoju
embrionalnego. Okres trwa u człowieka do 6
miesiąca życia płodowego. W tym okresie
organizm uzyskuje trwałą tolerancje
immunologiczną dla własnych antygenów
(autoantygenów).

Odpowiedź immunologiczna
Okres neutralny:
Trwa od około 6 miesiąca życia płodowego do
około 3 miesiąca życia po urodzeniu.
Indukcja tolerancji immunologicznej w tym
okresie nie jest już możliwa i organizm nie jest
wtedy jeszcze zdolny do wzbudzenia odpowiedzi
immunologicznej na obce antygeny.

Odpowiedź immunologiczna
Okres dojrzałości układu immunologicznego:
Trwa od około 3 miesiąca życia do starości. Obce
antygeny zewnętrzne (wirusy, bakterie, grzyby,
pasożyty, antygeny przeszczepu) oraz
wewnętrzne (komórki nowotworowe), są
niszczone przez układ odpornościowy.
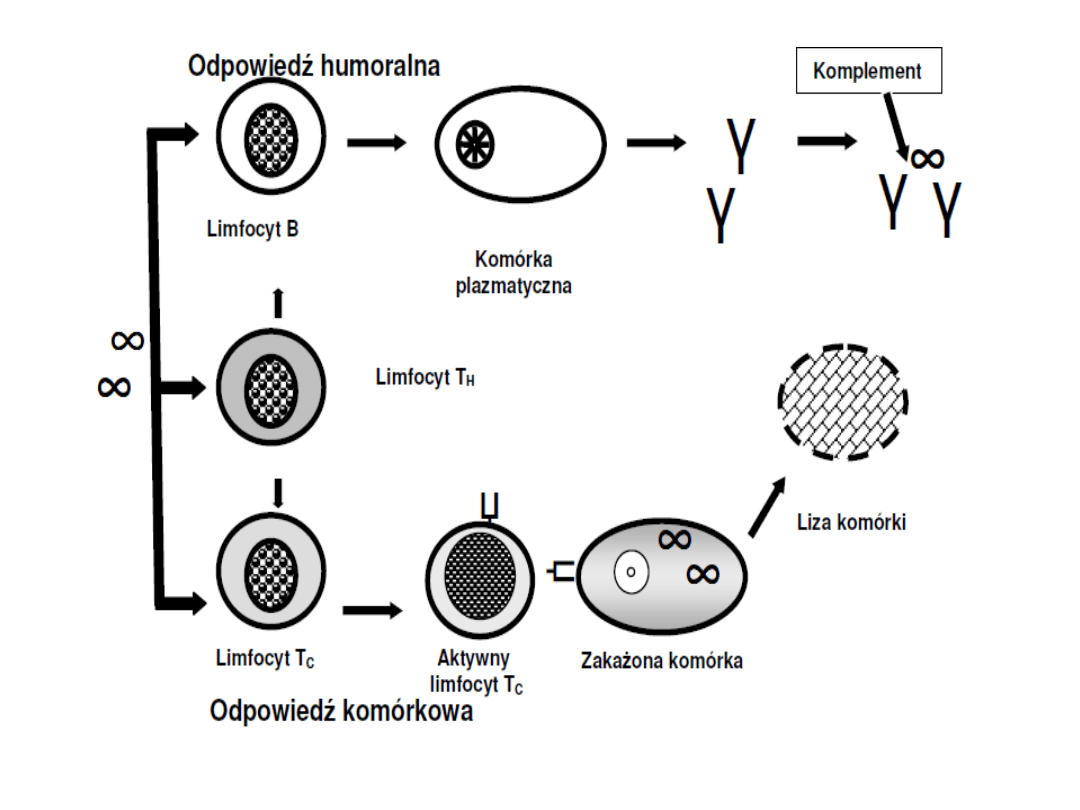
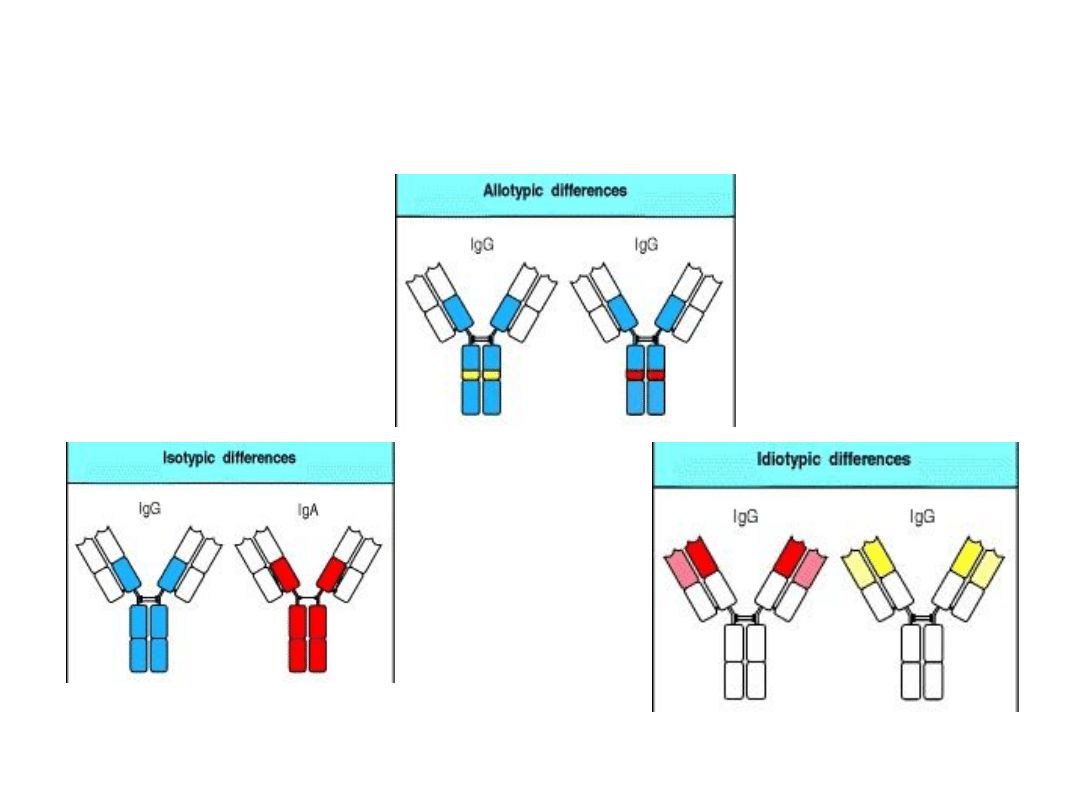
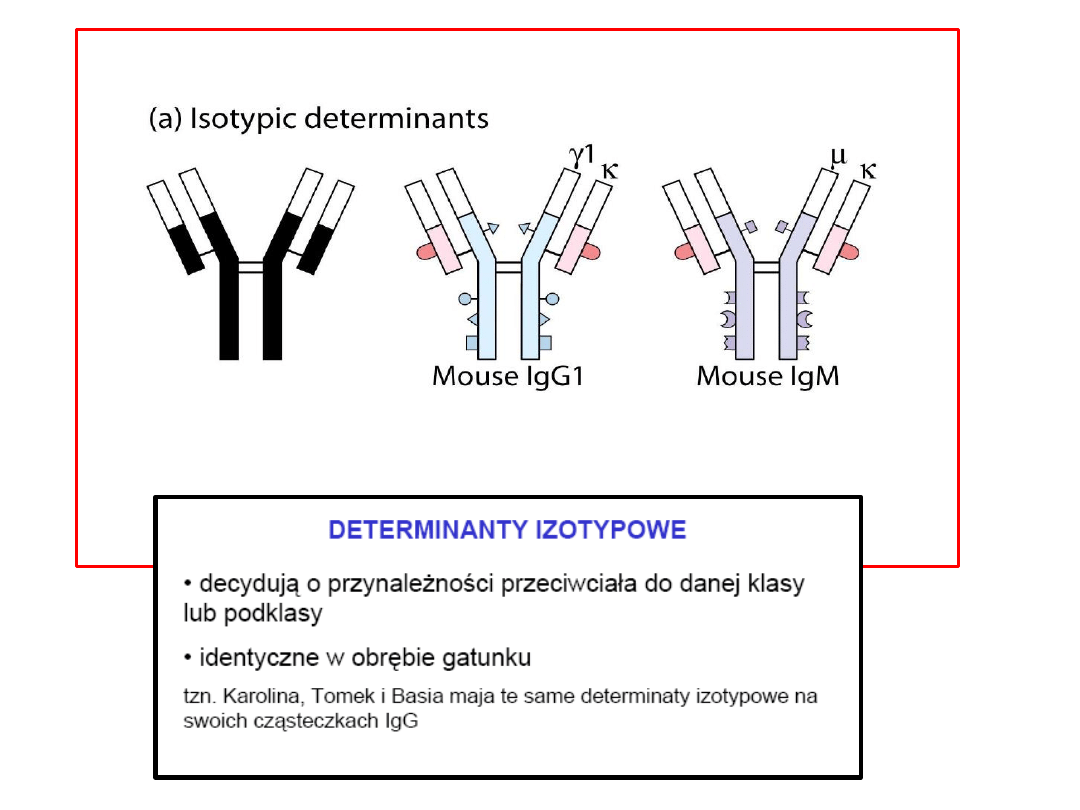
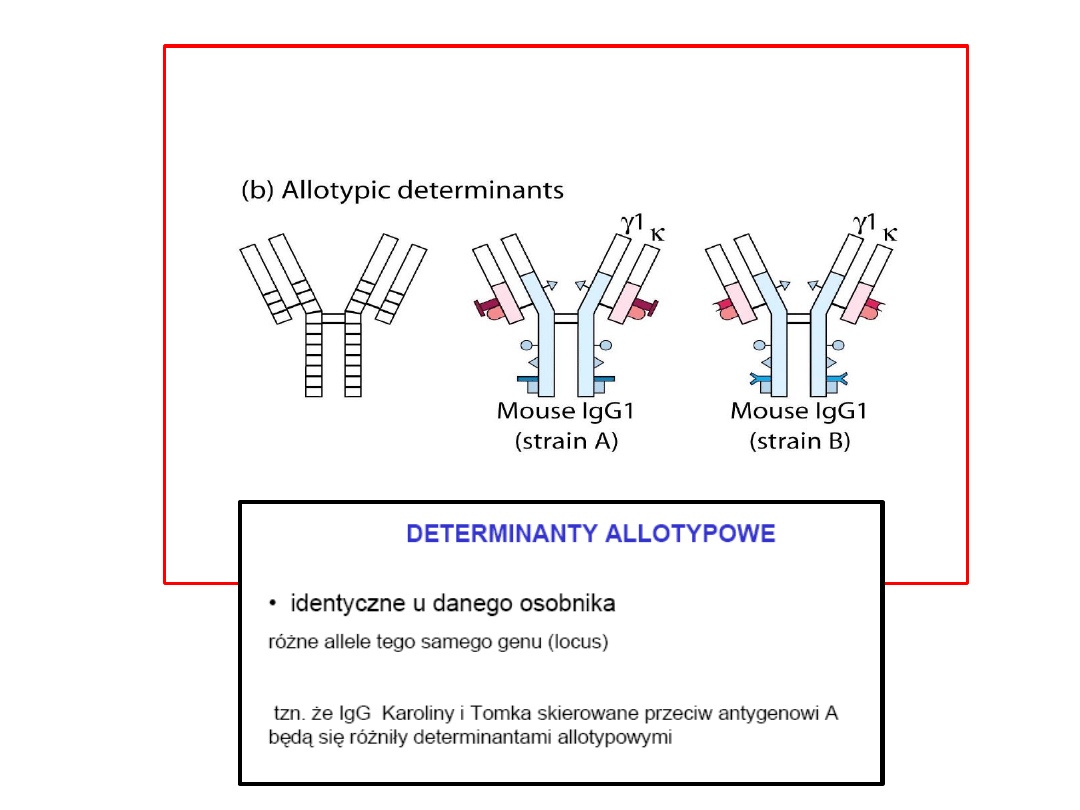
Typy różnorodności przeciwciał
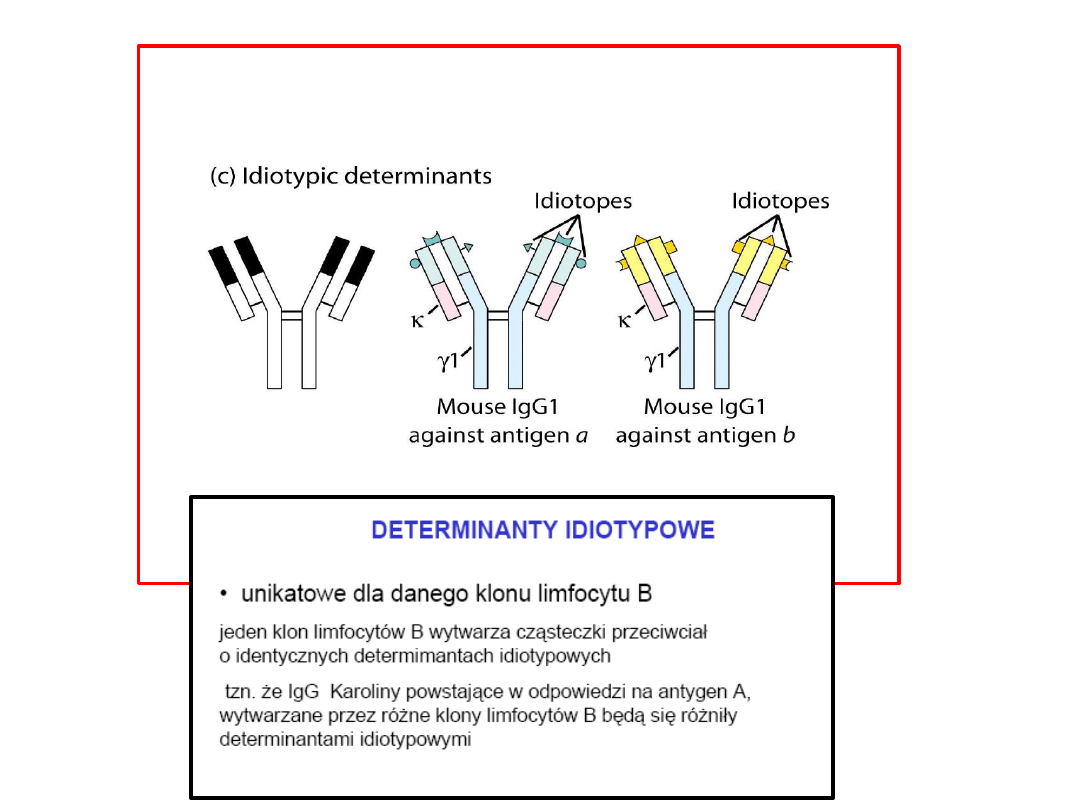

Synteza przeciwciał
Teoria selekcji klonów komórkowych
- zakłada ona możliwość powstania olbrzymiej
liczby klonów limfocytów gotowych do swoistej
odpowiedzi na wiele różnych antygenów przed
ich wtargnięciem do ustroju
- zgodnie z tą teorią po wtargnięciu antygenu do
organizmu dochodzi do selekcji wyszukujących i
rozpoznających go limfocytów określonego
klonu
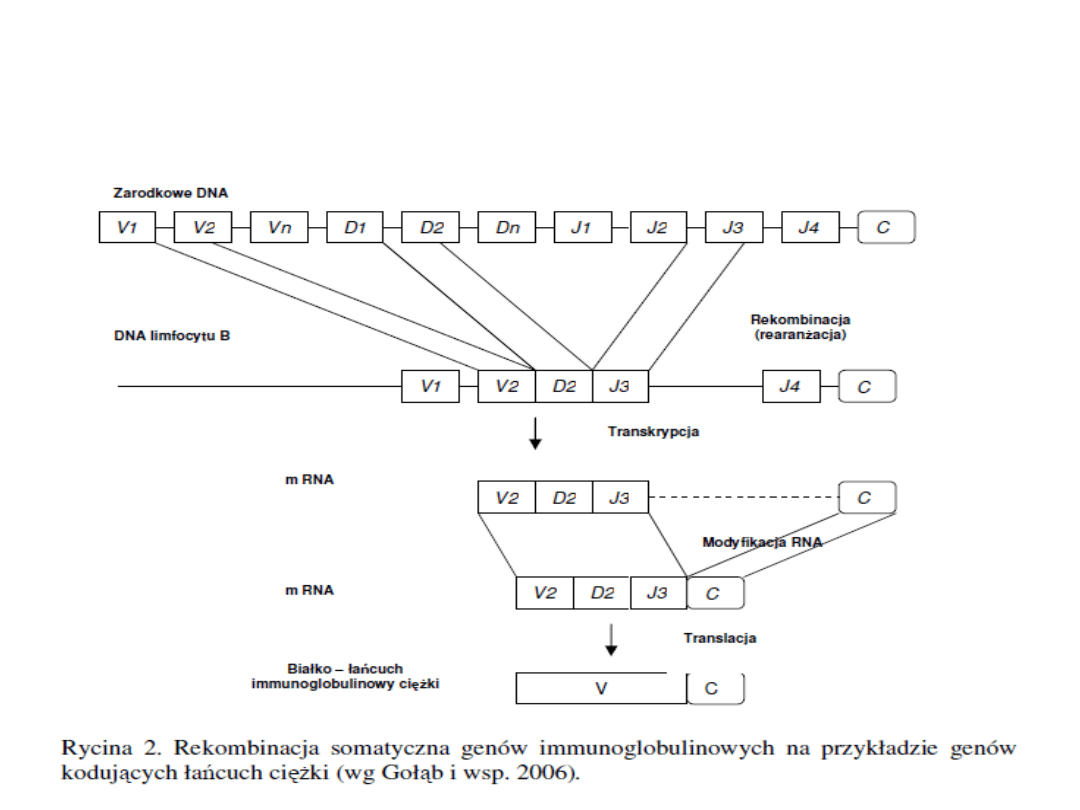
Synteza przeciwciał
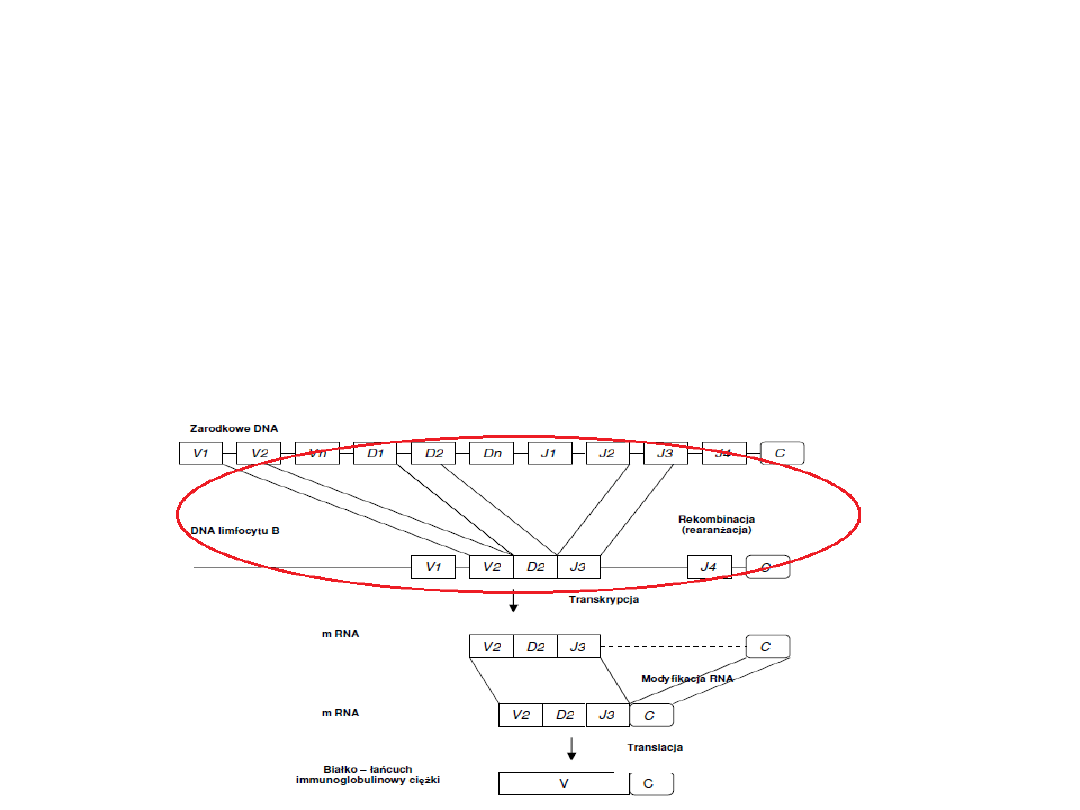
Synteza przeciwciał
1. W DNA limfocytu B, następuje zbliżenie
przypadkowo wybranych genów V,(D – dla
łańcucha ciężkiego) oraz J na drodze
rekombinacji (rearanżacji)
.

Rearanżacja
Rearanżacja genów immunoglobulinowych zachodzi w
trakcie rozwoju limfocytów B (w fazie G1).
Rekombinacja genów kodujących łańcuch ciężki
poprzedza rekombinację genów kodujących łańcuch lekki.
Produktywna rearanżacja w locus V
H
jest sygnałem do
rozpoczęcia rearanżacji w locus
.
Jeżeli rearanżacja w locus
jest produktywna to
utworzone przeciwciało ujawnia się jako receptor
powierzchniowy.
Jeżeli rearanżacja w locus
nie jest produktywna, to
rozpoczyna się rearanżacja w locus
.
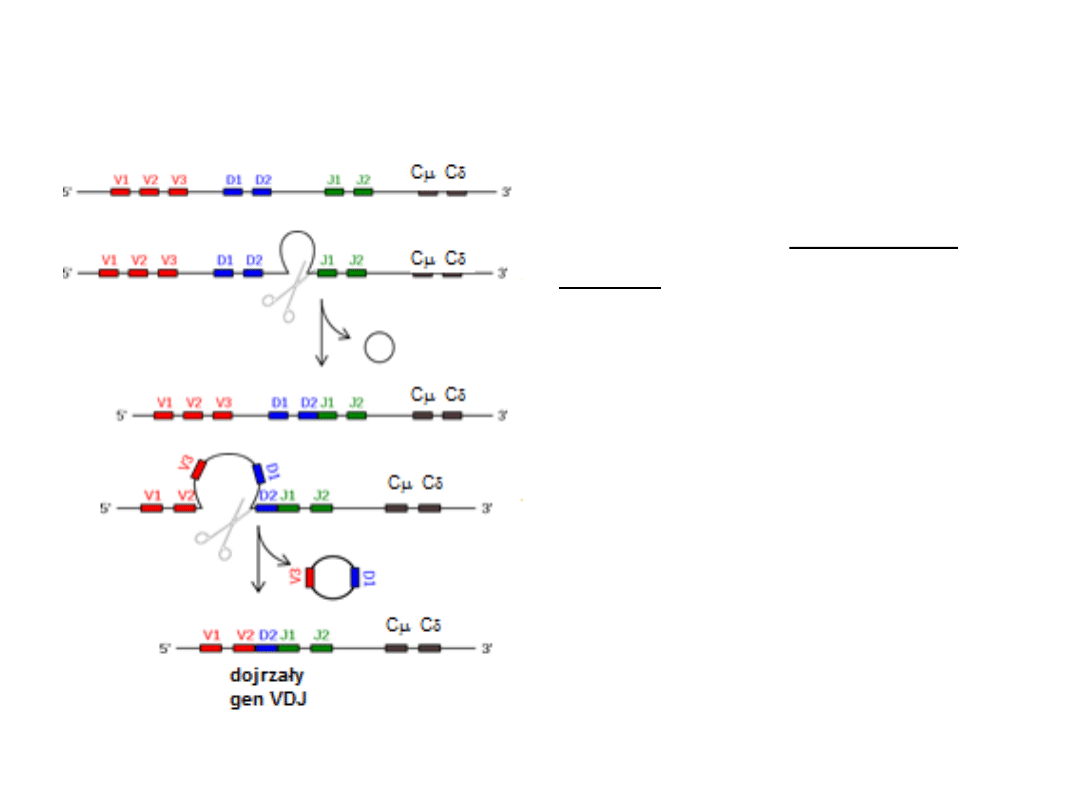
Rearanżacja
Rekombinacja zachodzi
najczęściej przez wypętlenie i
delecję fragmentu DNA pomiędzy
genem J i genem D użytym do
rekombinacji oraz pomiędzy
nowo utworzonym genem DJ a
genem V.
Wycięty fragment DNA zamykany
jest w formę kolistą.
Koliste DNA, zawierające złącza
sygnałowe można wykryć w
jądrach dojrzewających
limfocytów.

Rearanżacja
Rekombinacyjne łączenie się segmentów genów
V, D i J zachodzi dzięki aktywności enzymu –
rekombinazy, która rozpoznaje sekwencje
sygnałowe leżące przy każdym z tych
segmentów.
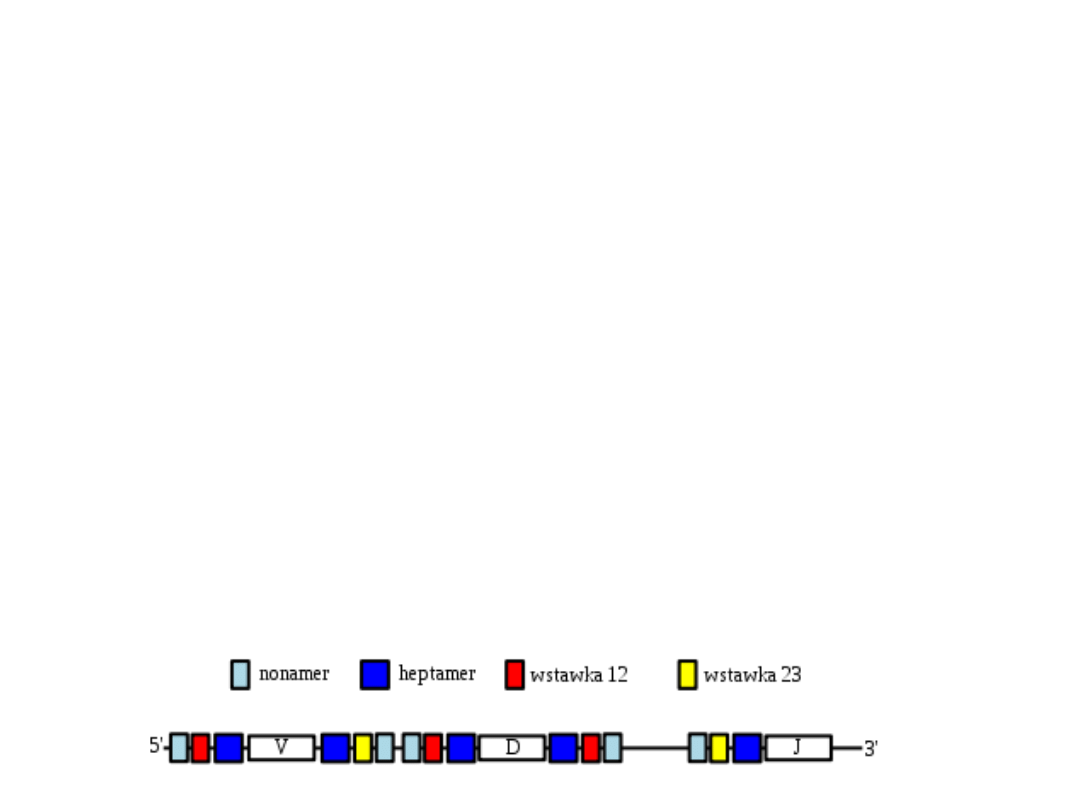
Rearanżacja
W skład sekwencji sygnałowych rekombinacji
(recombination signal sequences, RSS) wchodzą:
heptamery (sekwencja siedmiu nukleotydów
CACAGTG) i nonamery (sekwencja dziewięciu
nukleotydów ACAAAAACC). Pomiędzy nimi
występuje tzw. wstawka o długości 12 lub 23
nukleotydów.
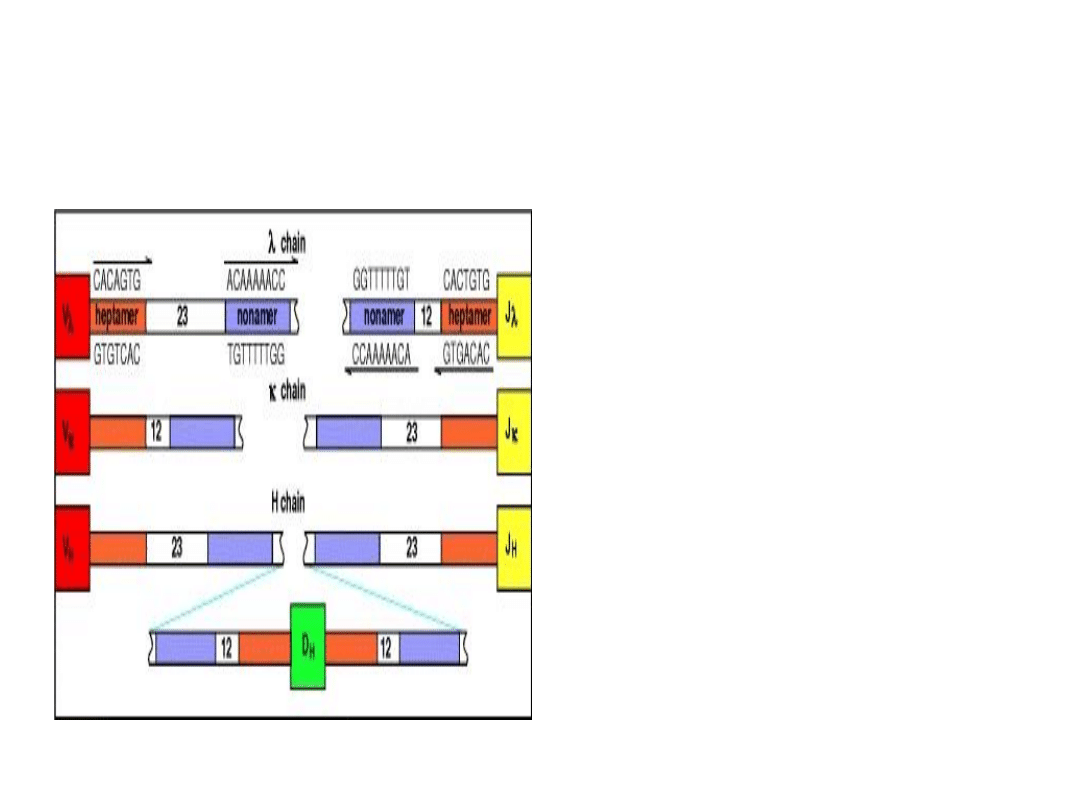
Sekwencje sygnałowe rekombinacji –
RSS (recombination signal sequences)
Podczas rekombinacji dochodzi
do połączenia się tylko tych
genów, które mają dwie różne
wstawki od strony tworzenia
połączenia
(Reguła 12/23).
Geny V wykazują po stronie 5'
wstawkę 12, zaś po stronie 3'
wstawkę 23. Geny D po obu
stronach (3’ i 5’) mają wstawkę
12, zaś segmenty J po stronie 5'
wykazują obecność wstawki 23.
•
Dzięki regule 12/23 gen J dla łańcucha ciężkiego
może łączyć się z genem D, a gen D z genem V,
lecz nie może dojść do bezpośredniego
połączenia genu V i genu J
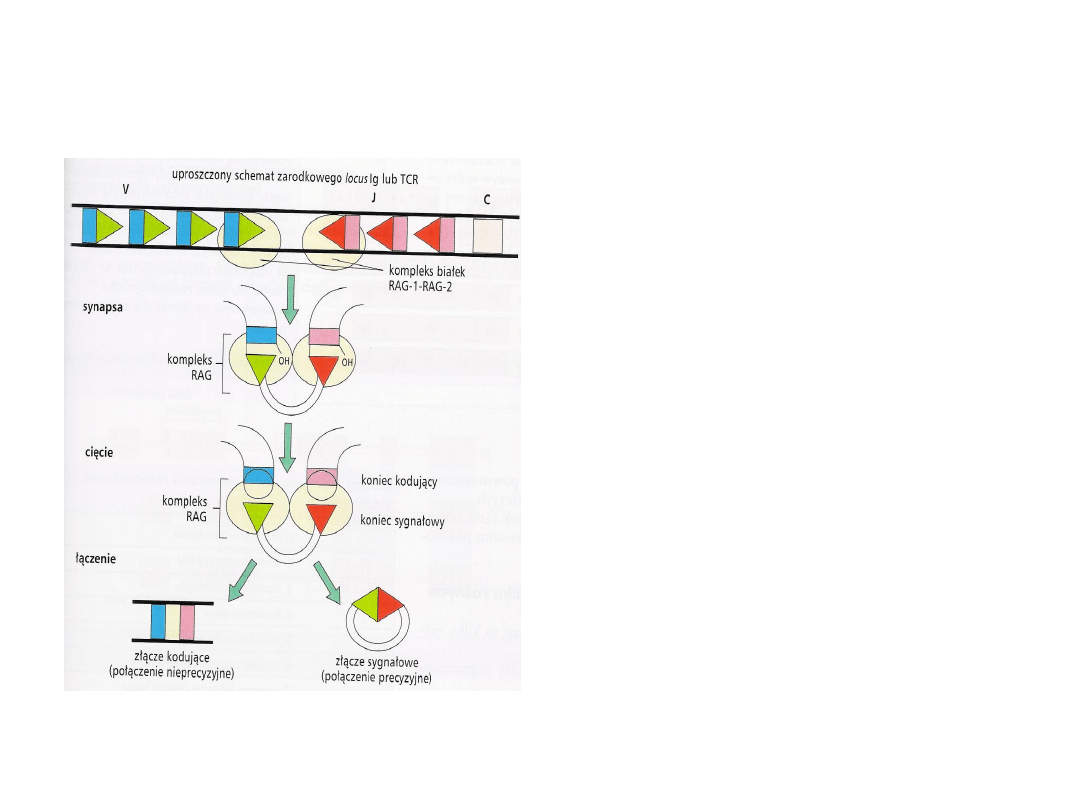
Rearanżacja
Ważną rolę w rekombinacji segmentów
genowych V, D i J odgrywają produkty genów
RAG1 i RAG2 (recombination activating gene).
Kompleks RAG1-RAG2 wiąże dwie sekwencje
sygnałowe rekombinacji 12-RSS i 23-RSS,
łącząc je w jeden kompleks.
Dochodzi do przecięcia podwójnej nici DNA na
granicy sekwencji sygnałowych i kodujących.
Powstają dwa tępe końce sygnałowe i dwa
końce kodujące o kształcie „spinki do włosów”.
Końce sygnałowe łączą się tworząc precyzyjne
złącze sygnałowe (koliste DNA).
Sekwencje kodujące V, D i J łącząc się tworzą
złącze kodujące.
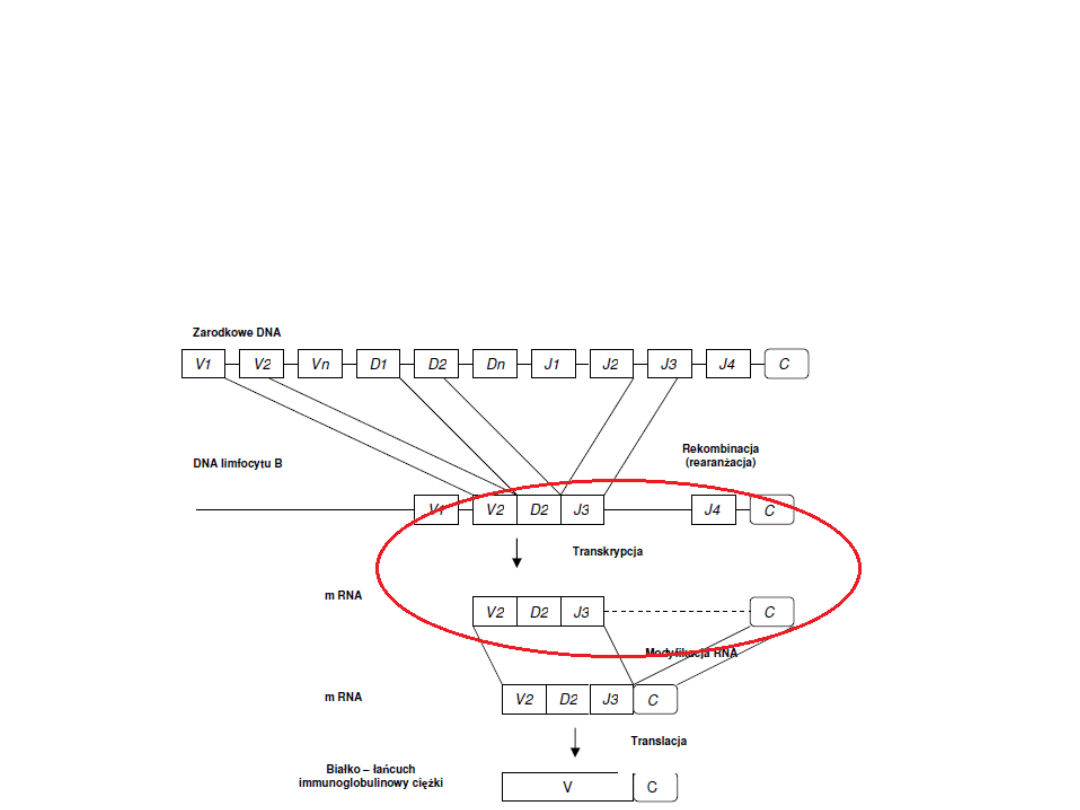
Synteza przeciwciał
2. Powstały pojedynczy duży gen, który koduje
V
H
podlega
transkrypcji
wraz z genem kodującym
C.
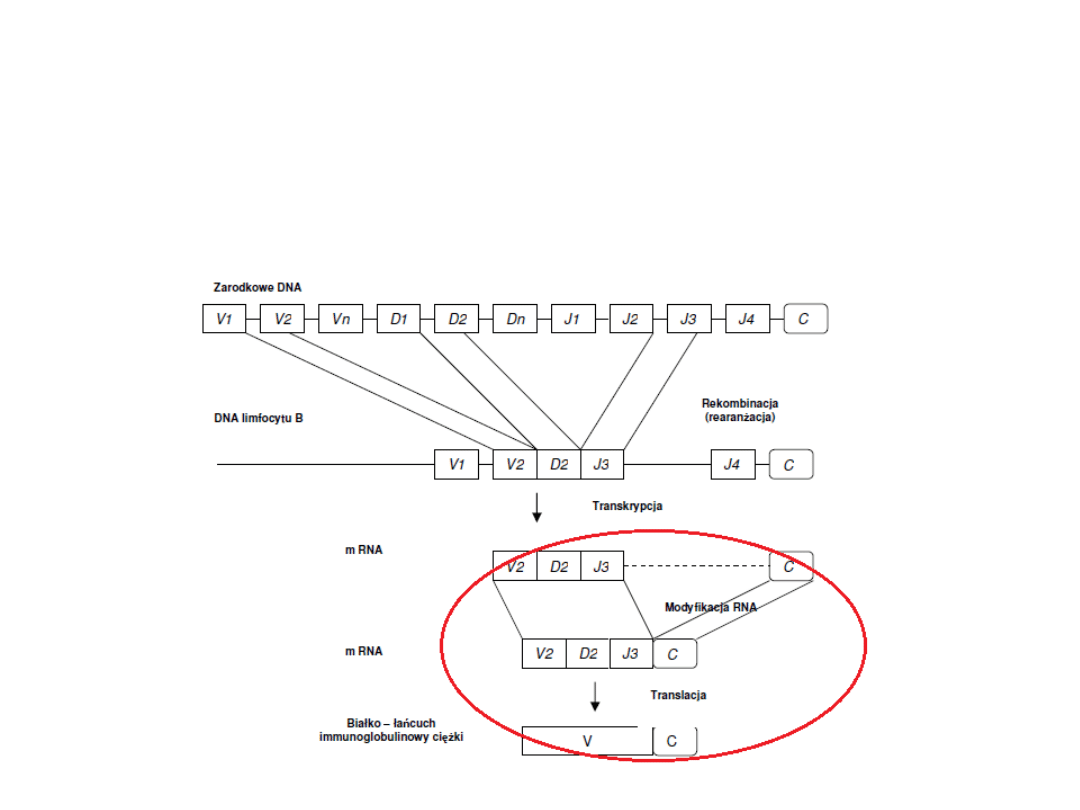
Synteza przeciwciał
3.
Modyfikacja mRNA i translacja

Synteza przeciwciał
Łańcuch lekki immunoglobuliny powstaje na
podobnej zasadzie jak łańcuch ciężki. Jednak
główną różnicą jest brak grupy genów D,
zlokalizowanej pomiędzy genami V i J.

Zmienność przeciwciał
• To, jakiej specyficzności antygenowej przeciwciało powstanie jest
przypadkowe !
• W procesie tworzenia przeciwciał dochodzi do powstania całkiem
nowych, nieobecnych w linii zarodkowej, genów!
• Limfocyty B żyją 3 dni-8 tygodni. Jeśli nie spotkają antygenu, to
wchodzą w apoptozę i umierają. Zastępują je nowe, których
specyficzność antygenowa może być inna.
• Każdy nowopowstały limfocyt B ma wyjątkową specyficzność
przeciwciała (produkuje tylko 1 typ) - te które okażą się przydatne
dają klon komórkowy - populację wytwarzającą przeciwciała o
takiej samej specyficzności
• Limfocyty produkujące przeciwciała tej samej specyficzności
antygenowej
mogą
produkować
przeciwciała
różnych klas.
(przełączenie klasy).

Zmienność przeciwciał wynika z trzech głównych
mechanizmów:
1. Zmienność kombinacyjna - spośród kilkuset genów
wybierane są trzy, które łączą się przypadkowo
2. Zmienność na złączach:
- tworzenie regionów P - przed połączeniem genów
tworzone są krótkie sekwencje palindromowe bazujące na
sekwencjach obecnych w linii zarodkowej
- tworzenie regionów N - przed połączeniem genów
dodawanych
jest
kilka
dodatkowych
nukleotydów,
tworzących nowe sekwencje, nieobecne w ogóle w linii
zarodkowej
3. Mutacje somatyczne – mutacje punktowe, rzadziej delecje,
insercje lub konwersje.

Zmienność na złączach
Zmienność na złączach jest procesem, w którym dochodzi do zmian sekwencji
nukleotydów w obrębie złącza kodującego.
Mechanizmy odpowiadające za zmienność na złączach:
– tworzenie regionów P
– tworzenie regionów N
Do powstania zmienności na złączach dochodzi podczas łączenia się genów.
Zwiększa ona liczbę wariantów ok. 100 x, czyli z wyjściowego 1 000 000
różnych genów, powstających na skutek zmienności kombinacyjnej, dochodzi
do powstania 100 000 000 genów, co daje możliwość odpowiedzi na ogromną
liczbę antygenów.

Zmienność na złączach
(regiony N)
W trakcie formowania złącza kodującego dochodzi zarówno do usunięcia
(delecji) do 20 nukleotydów, jak i do wstawienia (insercji) nowych
nukleotydów (od 1 do 15).
Doczepiania nowych nukleotydów zachodzi „bezmatrycowo” i prowadzi do
powstania „nowych genów”, których nie było w komórkach zarodkowych.
Za doczepianie nukleotydów na złączach V/D i D/J odpowiada transferaza
nukleotydów terminalnych (TdT)
Nowo powstałe odcinki DNA na złączach nazywamy regionami N
Drugim mechanizmem wpływającym na tworzenie nowych genów jest tzw.
chwytanie oligonukleotydów, które polega na dołączaniu krótkich sekwencji,
uwalnianych podczas rekombinacji genów, do złącza kodującego

Z powodu użycia do rekombinacji ograniczonego
zestawu genów V oraz niewielkiej zdolności
dojrzewających limfocytów B do tworzenia
regionów N, przeciwciała powstające
najwcześniej w rozwoju osobniczym mają
ograniczoną różnorodność.

Zmienność na złączach
(regiony P)
Regiony P, czyli regiony palindromowe, powstają na skutek wykorzystania
gotowych genów.
– Rekombinaza przecina DNA, wypętlony fragment jest usuwany. Wolne
końce genów, będące tępymi końcami, zostają zmodyfikowane przez
połączenie dwu przeciwbieżnych nici DNA
– Rekombinaza przecina jedną z nici w pewnej odległości od końca, co
powoduje powstanie jednoniciowego fragmentu DNA.
– Następuje uzupełnienie nowego fragmentu o komplementarne zasady
i ligacja DNA:
Na złączu kodującym może dochodzić do dołączania nukleotydów
komplementarnych do ostatnich nukleotydów złącza kodującego – nazywa się
je nukleotydami P.

Mutacje somatyczne
Najczęściej mutacje punktowe, rzadziej delecje, insercje lub
konwersje.
Prowadzą najczęściej do zmiany pojedynczego aminokwasu w
części zmiennej łańcucha ciężkiego i lekkiego.
Występują
głównie
w
sekwencjach
kodujących
regiony
hiperzmienne.
Prawdopodobnie zachodzą w czasie stymulowanej przez antygen
proliferacji i różnicowania limfocytów B w komórki pamięci,
między 6 i 14 dniem od momentu kontaktu z antygenem.
Częstotliwość tych mutacji jest 100-krotnie większa niż w
komórkach
spoczynkowych
i
pierwotnie
pobudzonych
limfocytach B – hipermutacje. Ich wynikiem jest wymiana około
1% nukleotydów w genach dla części zmiennych łańcuchów
ciężkich i lekkich.

Dzięki mutacjom zachodzi tzw. dojrzewanie
odpowiedzi immunologicznej albo dojrzewanie
powinowactwa, polegające na wzroście
powinowactwa przeciwciał do antygenu.
Mutacje są przypadkowe i mogą prowadzić zarówno
do wzrostu powinowactwa, jak i do spadku
zdolności wiązania antygenu lub niemożności
wytworzenia funkcjonalnej immunoglobuliny.

Limfocyt B, który w wyniku mutacji ma
mniejszą zdolność do wiązania antygenu lub
utracił ją zupełnie, może ją odzyskać dzięki
ponownej rekombinacji genów
immunoglobulinowych , która tym razem
zachodzi w ośrodkach rozmnażania grudek
limfatycznych.

Wykluczenie alleliczne
- zjawisko polegające na tym, że jeśli w komórce diploidalnej
dojdzie do ekspresji prawidłowego białka z danego allelu, to
ekpresja drugiego allelu zostanie zablokowana. W ten sposób
heterozygota produkuje tylko jedną izoformę danego białka.
- przykładem wyłączania allelicznego mogą być geny dla
łańcuchów ciężkich i lekkich przeciwciał.
- dlatego dany limfocyt B produkuje tylko 1 rodzaj przeciwciał!
- Limfocyt B do ekspresji łańcucha ciężkiego i lekkiego
wykorzystuje geny jednego z dwóch homologicznych
chromosomów.

Przełączenie klas przeciwciał
-proces, w wyniku którego następuje wymiana
części stałej łańcucha ciężkiego przeciwciała.
(część stała określa klasę przeciwciała!)
-zachodzi w czasie przekształcania się limfocytu
B do komórki plazmatycznej
.
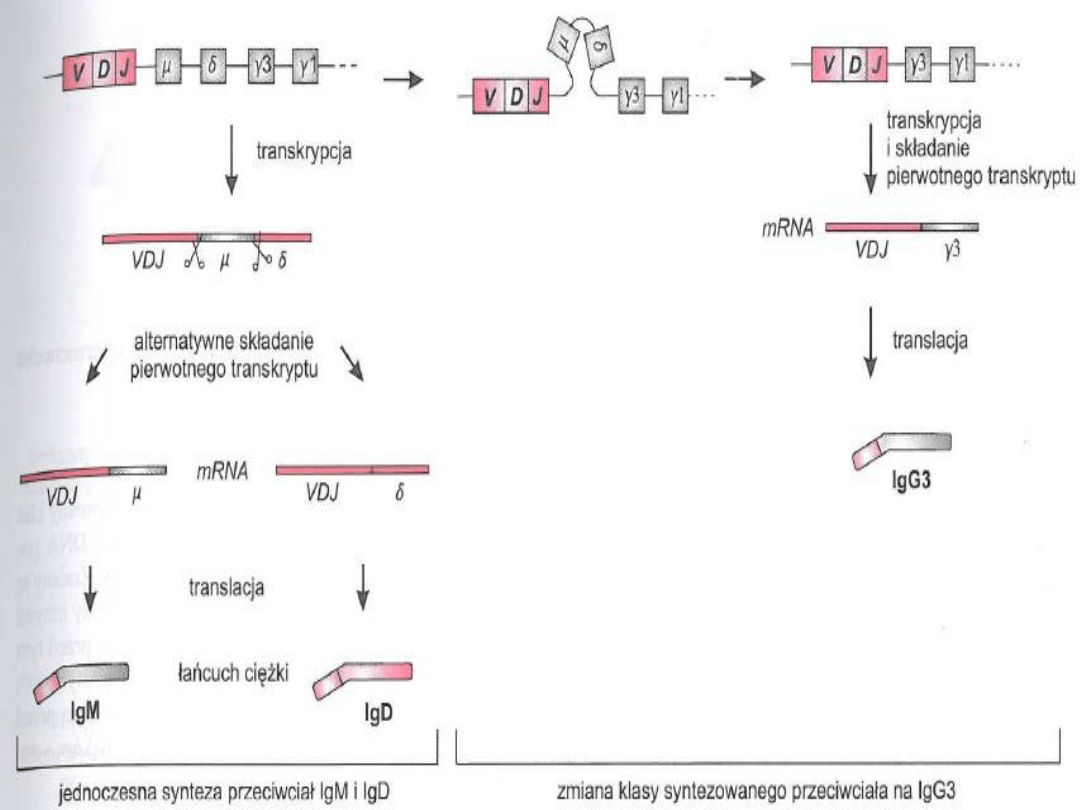

Zmiana klas
- zmiana klas syntetyzowanych przeciwciał na inną niż IgM i IgD
następuje dopiero po rozpoznaniu przez Lim B swoistego antygenu
- do zainicjowania tego procesu konieczna jest LimB pomoc LimTh
- w czasie kontaktu tych dwóch komórek na granicy strefy korowej i
przykorowej węzła limfatycznego LimB prezentuje LimT antygen, który
rozpoznał
- jednocześnie dochodzi do połączenia odpowiednich cząsteczek na
powierzchni obu komórek: CD40 i B7 na LimB odpowiednio z CD40L i
CD28 na LimT
- w wyniku tego kontaktu LimT poprzez parę cząsteczek CD40-CD40L
oraz cytokiny (np. interleukinę 4) przekazuje LimB bodziec do zmiany
klasy syntetyzowanych przeciwciał na IgG lub inną

Zmiana klas
- mechanizm zmiany klasy syntetyzowanych przeciwciał polega na
ponownej rekombinacji genów immunoglobulinowych
- odcinek nici DNA zawierający geny μ i σ zostaje wypętlony i usunięty,
dzięki czemu kompleks VDJ znajduje się bezpośrednio przed genem
kodującym część stałą przeciwciała odpowiedniej klasy
- zmiana klasy syntetyzowanych immunoglobulin może być
jednorazowa, np. IgG, IgE lub IgA, albo limfocyt zmienia klasę
syntetyzowanych przeciwciał IgM na IgG, a potem na IgE lub IgA
- jest to rekombinacja wewnątrzchromosomowa z wytworzeniem pętli
i połączona z delecją leżącego między nimi DNA w rzadziej
rekombinacja mitotyczna polegająca na niesymetrycznej wymianie
genów między chromatydami siostrzanymi

Zmiana klas
- w rzadkich sytuacjach, dzięki tym samym mechanizmom, które
umożliwiają jednoczesną syntezę przeciwciał IgM i IgD (alternatywne
cięcie i składanie pierwotnego transkryptu), LimB może również
syntetyzować przeciwciała IgM i IgG, IgM i IgE lub IgM i IgA (wydaje się,
że są to sytuacje przejściowe, potem LimB przechodzi na wytwarzanie
tylko np. IgG w wyniku rekombinacji eliminującej geny dla części
stałych łańcuchów μ i σ)
- podczas procesów rekombinacji, hipermutacji i zmiany klas
syntetyzowanych przeciwciał powstają pęknięcia w nici DNA
spowodowane przez RAG1, RAG2, AID i inne enzymy
- zmiany te mogłyby prowadzić do apoptozy LimB (aktywacja białka
p53), limfocyty chronione przed tym zjawiskiem dzięki ekspresji
antyapoptotycznych białek z grupy Bcl (chłoniaki – nowotwory
powstałe z LimB , też chronione).

IgM
- Jest pentamerem!
- Pierwsza
immunoglobulina
syntetyzowana w
rozwoju osobniczym
- Uczestniczy w
odpowiedzi pierwotnej
- Stanowi 5-10%
wszystkich p/ciał w
surowicy
IgG
- Stanowi ok. 80%
wszystkich p/ciał w
surowicy
- 4 podklasy:
IgG1, IgG3 i IgG4 zdolne są
do przekroczenia bariery
łożyskowej
1,2,3 aktywują układ
dopełniacza
- Uczestniczą we wtórnej
odpowiedzi
immunologicznej
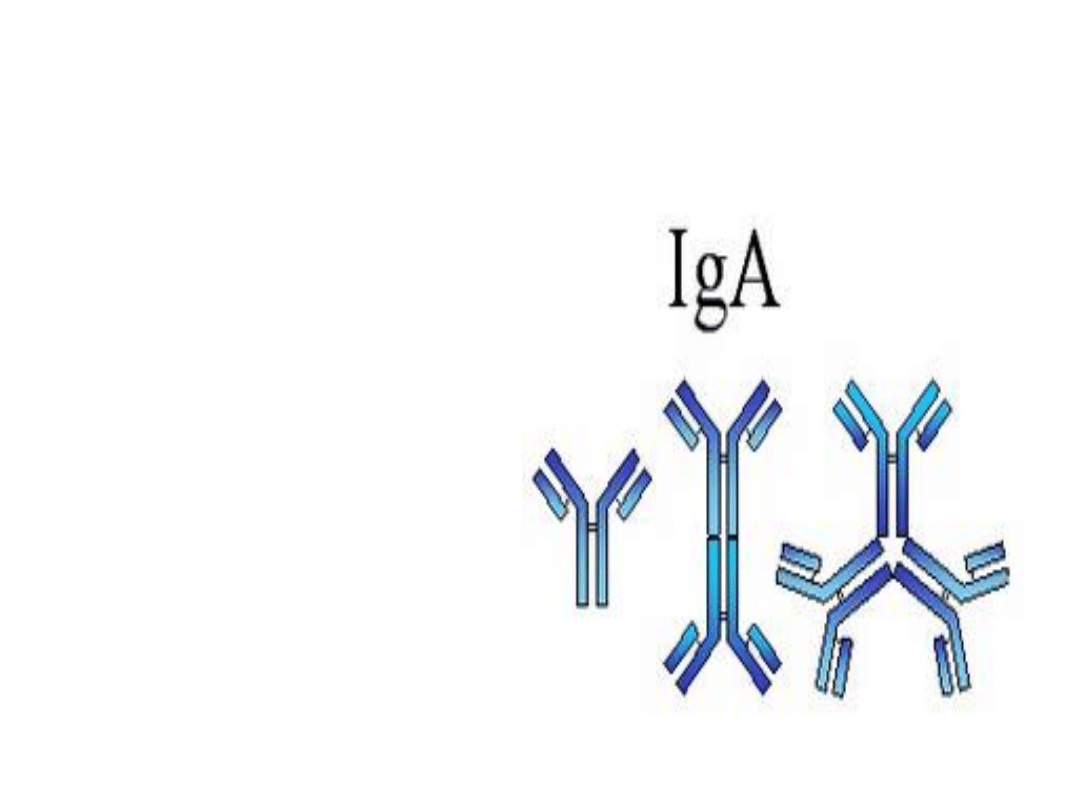
IgA
- Stanowi 10-15%
wszystkich p/ciał w
surowicy
- Obecna jest we łzach,
pocie, wydzielinach
układu pokarmowego,
oddechowego, moczowo-
płciowego
- Wytwarzana jest w
największej ilości!
- Jest dimerem
IgD
- 0,2% wszystkich p/ciał w
surowicy
- Prawdopodobnie
uczestniczy w aktywacji
limfocytów B
- Wraz z IgM obecna jest
w błonie dojrzałych,
dziewiczych limfocytów B
IgE
- Występuje w surowicy
w bardzo niskim
stężeniu
- Uczestniczy w reakcjach
alergicznych (reaginy)
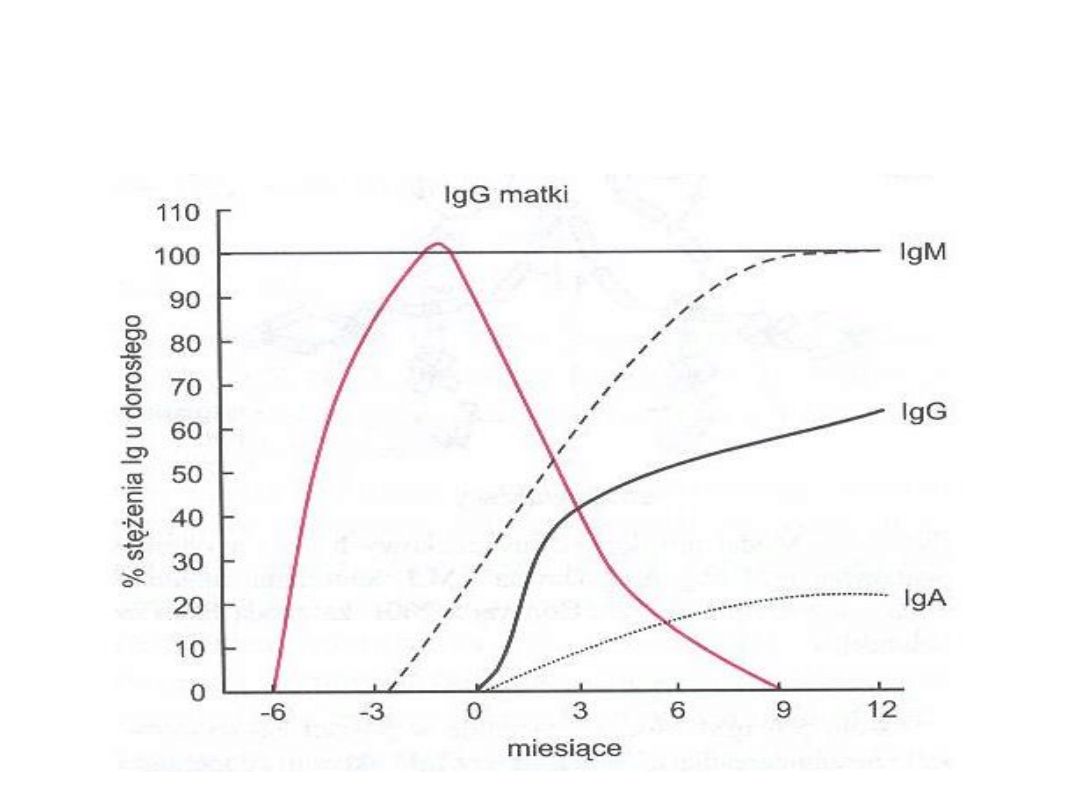
Stężenie przeciwciał we krwi dziecka

Bibliografia
Jakub Gołąb, Immunologia, Wydawnictwo
naukowe PWN, Warszawa 2012
Wikipedia:
http://pl.wikipedia.org/wiki/Prze%C5%82%C4%
85czanie_klas

Dziękuję za uwagę.
Wyszukiwarka
Podobne podstrony:
immunoglobuliny cz II
6 Immunogenetyka cz 2 Ruszczyk
wykłady immunologia cz 2 12 2013
1 i 2 Podstawowe zasady dzialania ukladu immunologicznego Odpornoss nieswoista cz 1
immunologia wykłady cz.1 2012-2013, Analityka medyczna, Immunologia
Biol kom cz 1
Systemy Baz Danych (cz 1 2)
SEMINARIUM IMMUNOLOGIA Prezentacja
cukry cz 2 st
wykłady NA TRD (7) 2013 F cz`
więcej podobnych podstron