ĆWICZENIE Nr 44
OZNACZANIE LICZBY PRZENOSZENIA.
Cel ćwiczenia: wyznaczenie liczby przenoszenia Ag
+
metodą Hittorfa.
Ładunek Q w roztworze elektrolitu jest przenoszony prze dwa rodzaje jonów,
kationy i aniony. Wielkość ładunku przeniesionego przez każdy rodzaj jonów, kation
q
+
, i anion q
-
, zależy od właściwości jonu, od jego ruchliwości. Liczbą przenoszenia
jonu, t
jon
, nazywany jest stosunek ładunku przeniesionego przez dany rodzaj jonów
q
jon
do całkowitego ładunku Q=
Σq
jon
, który przepłynął przez roztwór. Dla roztworu
zawierającego jeden elektrolit można napisać:
−
+
−
−
−
−
+
+
+
+
+
≡
=
+
≡
=
q
q
q
Q
q
t
i
q
q
q
Q
q
t
(
(
1
1
)
)
Ponieważ wielkość ładunku przeniesiona przez jeden rodzaj jonów q
jon
jest
proporcjonalna do ruchliwości jonu u
jon
, liczbę przenoszenia t
jon
można zdefiniować
jako:
−
+
−
−
−
+
+
+
+
=
+
=
u
u
u
t
i
u
u
u
t
(2)
Wykorzystując zależność pomiędzy przewodnictwem molowym jonu
λ
jon
i ruchliwością jonu można również napisać:
−
+
−
−
−
+
+
+
λ
+
λ
λ
=
λ
+
λ
λ
=
t
i
t
(3)
Do oznaczenia liczby przenoszenia wykorzystuje się zmiany składu roztworu
w przestrzeniach przyelektrodowych, które są skutkiem przepływu ładunku przez
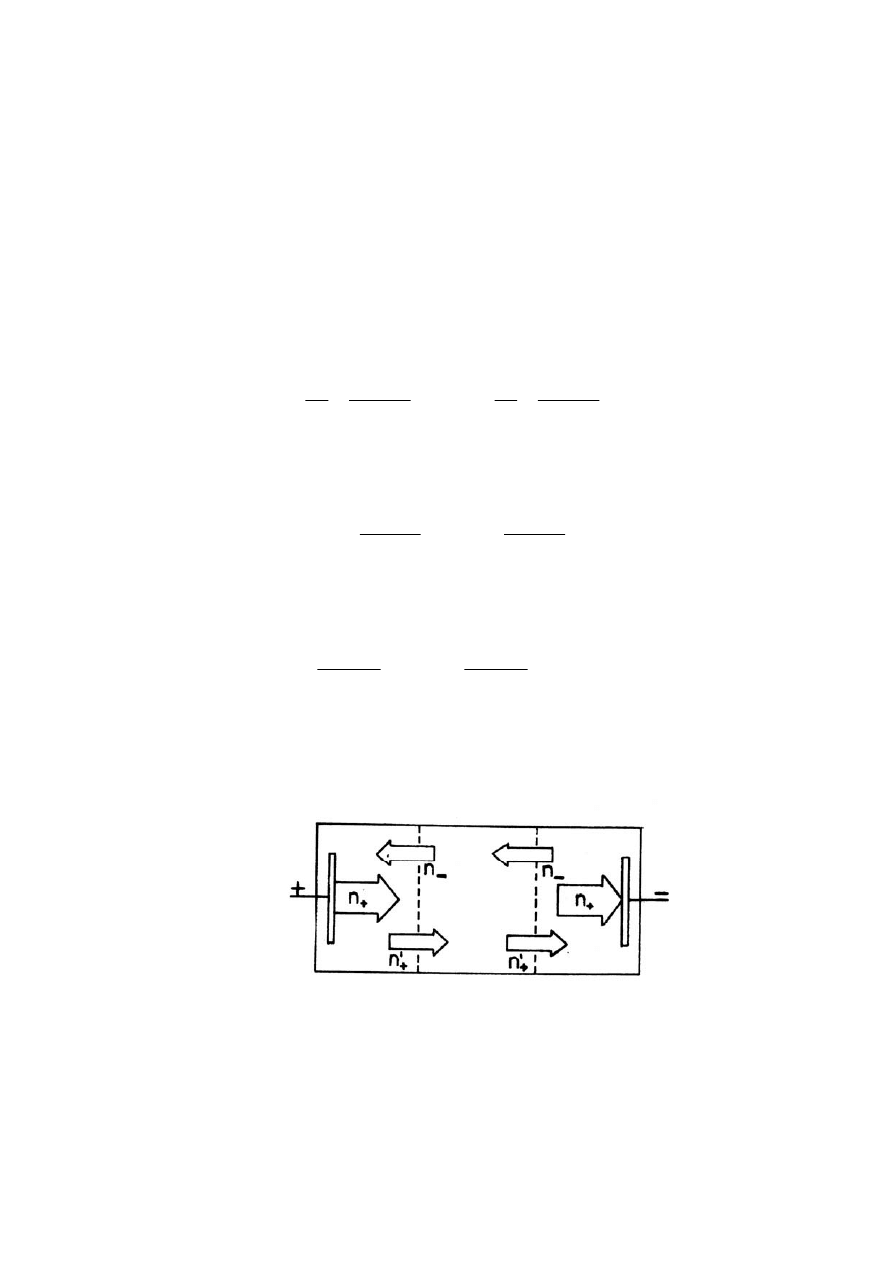
roztwór. Na rysunku przedstawiono schematycznie przenoszenie ładunku podczas
elektrolizy.
Jako przykład rozważmy elektrolizer zawierający srebrne elektrody,
napełniony roztworem AgNO
3
. Podczas elektrolizy na srebrnej katodzie osadza się
n
+
moli srebra. Liczba ta, którą na rysunku obrazuje duża strzałka, zgodnie
z I prawem Faradaya jest proporcjonalna do całkowitego ładunku Q, który przepłynął
przez roztwór, przy czym k jest równoważnikiem elektrochemicznym srebra.
Q
k
n
⋅
=
+
(1)
Jednocześnie taka sama liczba moli srebra utlenia się na anodzie
i przechodzi do roztworu jako jony Ag
+
. Natomiast w roztworze ładunek jest
przenoszony przez kationy i aniony i dlatego do przestrzeni przykatodowej wpływa
mniejsza liczba moli jonów srebra n
+
’
, co obrazuje mniejsza strzałka. Liczba moli
jonów srebrowych wpływających do przestrzeni przy elektrodzie jest proporcjonalna
do ładunku przenoszonego przez jony dodatnie q
+
:
+
+
⋅
=
q
k
n
'
(2)
Z porównania zależności (1) i (2) wynika, iż stężenie roztworu w przestrzeni
przykatodowej maleje:
)
q
Q
(
k
q
k
Q
k
)
n
n
(
n
'
+
+
+
+
−
⋅
=
⋅
−
⋅
=
−
≡
Δ
(3)
a obserwowana zmiana stężenia kationów jest proporcjonalna do ładunku
przeniesionego przez anion.
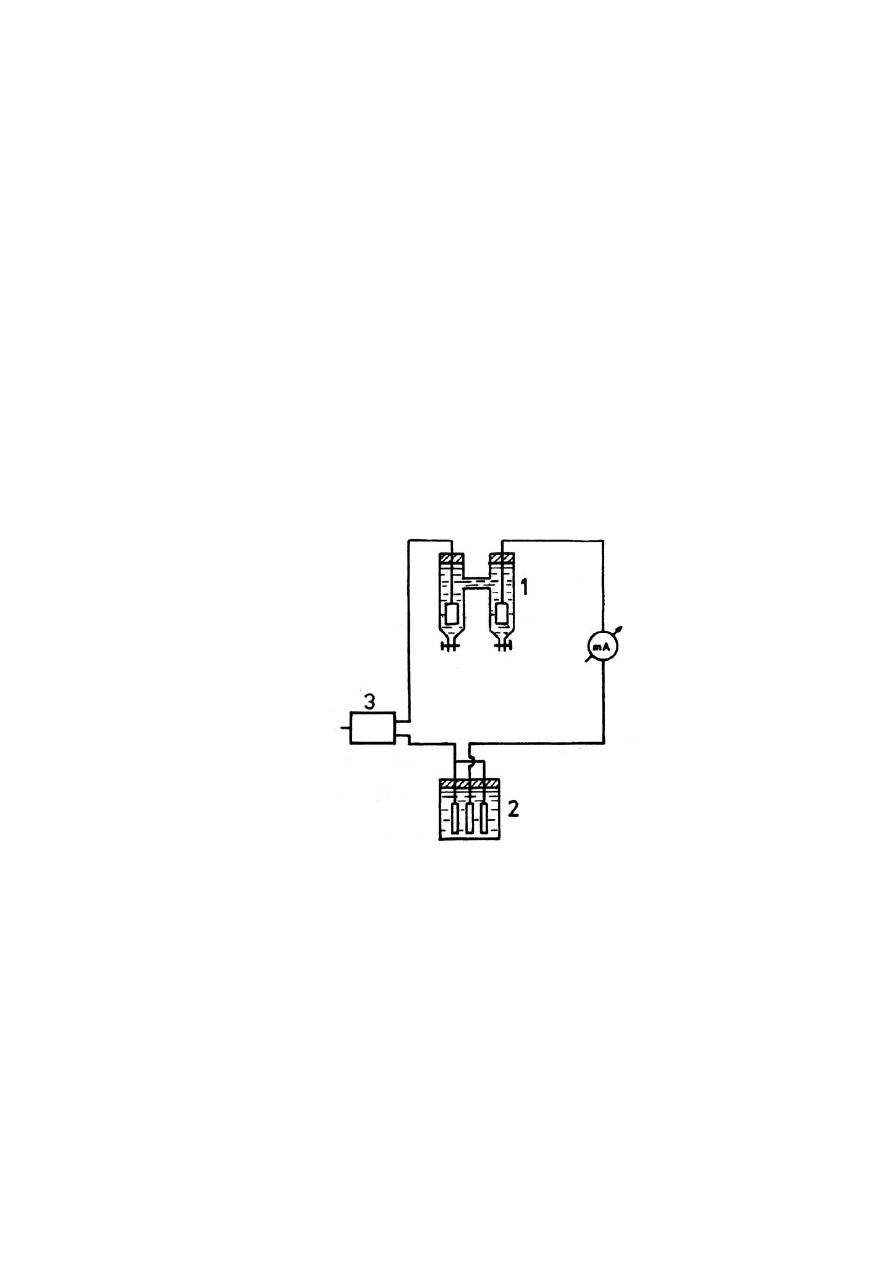
Jedną z metod umożliwiających wyznaczenie liczby przenoszenia jest
metoda Hittorfa. Schemat układu pomiarowego pokazano na rysunku. Budowa
aparatu Hittorfa (1) uniemożliwia wymieszanie roztworów z przestrzeni
przyelektrodowych. Do zmierzenia całkowitego ładunku Q służy kulometr miedziowy
(2), a układ zasilany jest prądem stałym ze źródła (3).
Wykonanie ćwiczenia.
1. Środkową elektrodę kulometru miedziowego opłukać wodą destylowaną,
dokładnie wysuszyć i zważyć na wadze analitycznej (m
Cu
)
1
.
2. Zważoną elektrodę umocować w kulometrze.
3. Aparat Hittorfa przepłukać wodą destylowana, przepłukać roztworem AgNO
3
i napełnić roztworem AgNO
3
.
4. Włączyć prostownik i przez dwie godziny przepuszczać prąd o natężeniu
około 3,5mA. Kontrolować natężenie prądu co 10 min.
5. Stężenie wyjściowego roztworu AgNO
3
oznaczyć za pomocą miareczkowania
konduktometrycznego strąceniowego. Dwie próbki, o objętości V
pr
=10 ml
każda, miareczkować rodankiem amonu o stężeniu c
RA
.

6. Po zakończeniu elektrolizy roztwór z przestrzeni katodowej przelać do suchej,
zważonej zlewki (m
zl
)
1
.
7. Zlewkę zważyć (m
zl
)
2
.
8. Z tego roztworu pobrać dwie próbki, po 10 ml każda, i oznaczyć stężenie
AgNO
3
przez miareczkowanie konduktometryczne rodankiem amonu.
9. Środkową elektrodę kulometru miedziowego wyjąć, opłukać wodą
destylowaną, wysuszyć i zważyć, (m
Cu
)
2
.
Opracowanie wyników:
1. Obliczyć całkowity ładunek, który przepłynął podczas elektrolizy:
Cu
1
Cu
2
Cu
M
F
2
]
)
m
(
)
m
[(
Q
⋅
−
=
2. Obliczyć ubytek masy srebra w przestrzeni przykatodowej:
Ag
pr
1
zl
2
zl
1
2
RA
Ag
M
V
d
]
)
m
(
)
m
[(
1000
]
V
V
(
C
m
⋅
⋅
−
⋅
−
=
Δ
3. Obliczyć ładunek przeniesiony przez aniony:
F
M
m
q
Ag
⋅
Δ
=
−
4. Obliczyć liczby przenoszenia obu jonów.
5. Porównać wyznaczone liczby przenoszenia obu jonów z granicznymi liczbami
przenoszenia obliczonymi na podstawie granicznych przewodnictw molowych
jonów, zgodnie z równaniem (3).
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 44, Ćwiczenie 44 (2), Tomasz Pastor
44, Cwiczenie 44 h
44, Cwiczenie 44 h
ćwiczenie 44
cwiczenie 44 wyodrebianie chlorku potasu z sylwinitu, Technologia chemiczna, Technologia nieorganicz
cwiczenie 44, Fizyka Sprawozdania, Ćw nr 44, Ćwiczenie 44
Cwiczenie 44 (1), 2.Elektryczność
Cwiczenie 44 (2), 2.Elektryczność
44, Cwiczenie 44 d, Politechnika Wroc˙awska
Ćwiczenie 44, Ćwiczenie 44, Małgorzata
cwiczenie 44 (1), Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
ćwiczenie 44, fff, dużo
fizyka - laboratorium - wyniki, Fizyka Sprawozdania, Ćw nr 44, Ćwiczenie 44
44 sprawozdanie czyjeś, Politechnika Rzeszowska, Elektrotechnika, semestr 2, Fizyka Lab, Sprawozdani
więcej podobnych podstron