
1. Struktury białek
2. Czym różni się mioglobina od hemoglobiny?
3. Czy mioglobina ma strukturę 4 rzędową?
4. Reakcja biuretowa
5. Reakcja Lowriego
6. Co dostarcza cykl pentozo-fosforanowy
7. Białko p53(loc17)
8. Dysmutaza ponadtlenkowa (loc.21)
9. Hemiacetal
10. Reakcja powstania hemiacetalu (co z czym reaguje?)
11. Apoptoza
12. Enzymy apoptozy
13. Kwas liponowy
14. Enzymy markerowe –
AlAT - zapalenie wątroby Rits mniejszy od 0,6-0,2
AspAT – zawał serca Rits wiekszy 1,0
(wsp deRitsa=AspAT/AlAT)
fosfataza kwaśna – nowotwór prostaty
amylaza – zapalenie trzustki
ceruloplazmina – choroba Wilsona (zw. Wątrobowo-soczewkowe)
15. Bilans energetyczny: cykl pentozo-fosforanowy, glikoliza beztlenowa i tlenowa, cykl
Krebsa
16. Pentozo-heksozy(?)
17. Wzór: glukozy, pirogronianu, mleczanu
18. Transaminacja
19. ATP – wzór, ile kalorii dostarcza
20. Aminokwasy aromatyczne:
Fenyloalanina, Tyrozyna, tryptofan
21. Gdzie znajduje się 2,3 difosfoglicerynian?
22. Estry glikolizy
23. Pirofosforan tiaminy
24. Deaminacja
25. NAD, FAD co to jest? Wzory
26. Witamina B
6
27. AcetyloCoA – ketogeneza
28. Czy β-oksydacja zachodzi w warunkach beztlenowych?
29. LCAT
30. Aminokwasy niebiałkowe
31. Płytka miażdżycowa (homocystina(?))
32. Onkogeny
33. Koenzymy dekarboksylacji
34. Albinizm
35. Synteza adrenaliny
36. Synteza melaniny
37. Osazony
38. Oksymy
Oksymy, pochodne aldehydów (aldoksymy) lub ketonów (ketoksymy) zawierające
ugrupowanie >C=N-OH. Wykazują izomerię syn-anti. Oksymy powstają w reakcji
hydroksyloaminy
(NH2OH)z odpowiednimi związkami karbonylowymi. Pod
wpływem
bezwodnika octowego
aldoksymy przechodzą w
nitryle
. Stężony kwas
przekształca ketoksymy w
amidy
.
1

39. HbS, HbF
40. Jak transportowany jest CO
2
we krwi?
41. Efekt Bohra
42. Aminokwasy endo-, egzo-, gluko- i ketogenne
43. Karcynogeneza
44. NO(?)
45. Synteza puryn
46. SV40
47. Wirus opryszczki
48. Wirus mięśniaka Rausa
49. Glikoliza
50. Łańcuch oddechowy
51. Denaturacja
52. Wysalanie
53. Cykl mocznikowy
54. CoQ
55. Funkcje bradykininy
56. Wiązanie glikozydowe – rysunek
57. RFT
58. Co to jest aminokwas?
59. Punkt izoelektryczny
60. Cukry redukujące
61. Wolne rodniki
62. Kwas foliowy
63. Enzymy transaminacji
64. Fosforan kreatyny
65. Źródła energii dla organizmu
66. Uracyl
67. Jak inaczej nazywa się tymina?
68. Transport CO
2
69. Oksydacyjna dekarboksylacja pirogronianu
70. Sposoby naprawy DNA
71. Cysteamina
Zagadnienia z examinu ustnego z biochemii:
1. Źródła energii w komórce:
Reakcje: glikolizy, i cyklu Krebsa. Fosforylacja oksydacyjna i substratowa.
Substratami tych reakcji: glikoliza cukry – glukoza, cykl krebsa gr acyetylowe przynoszone przez CoA
(pochądzące z: B-oksydacji kw. tłuszczowych, przemiany związków ketonowych).
2. Glikoliza (min. Ilość ATP):
2 cz ATP – glikoliza beztlenowa 8 cz ATP glikoliza tlenowa.
3. Wzór NAD
4. Osazony
produkty reakcji aldoz (a-hydroksyaldehydów i a-hydroksyketonów) z fenylohydrazyną. Reakcja ma 2
etapy: 1-szy przylączenie pierwszej cząsteczki fenylohydrazyny – powstaje fenylohydrazon 2-gi
powstaje osazon.
5. Osony:
Powstają przez usunięcie grup fenylohydraznonowych z osazonu (powstają związki dikarbonylowe)
6. Zasady Schiffa(iminy)
2
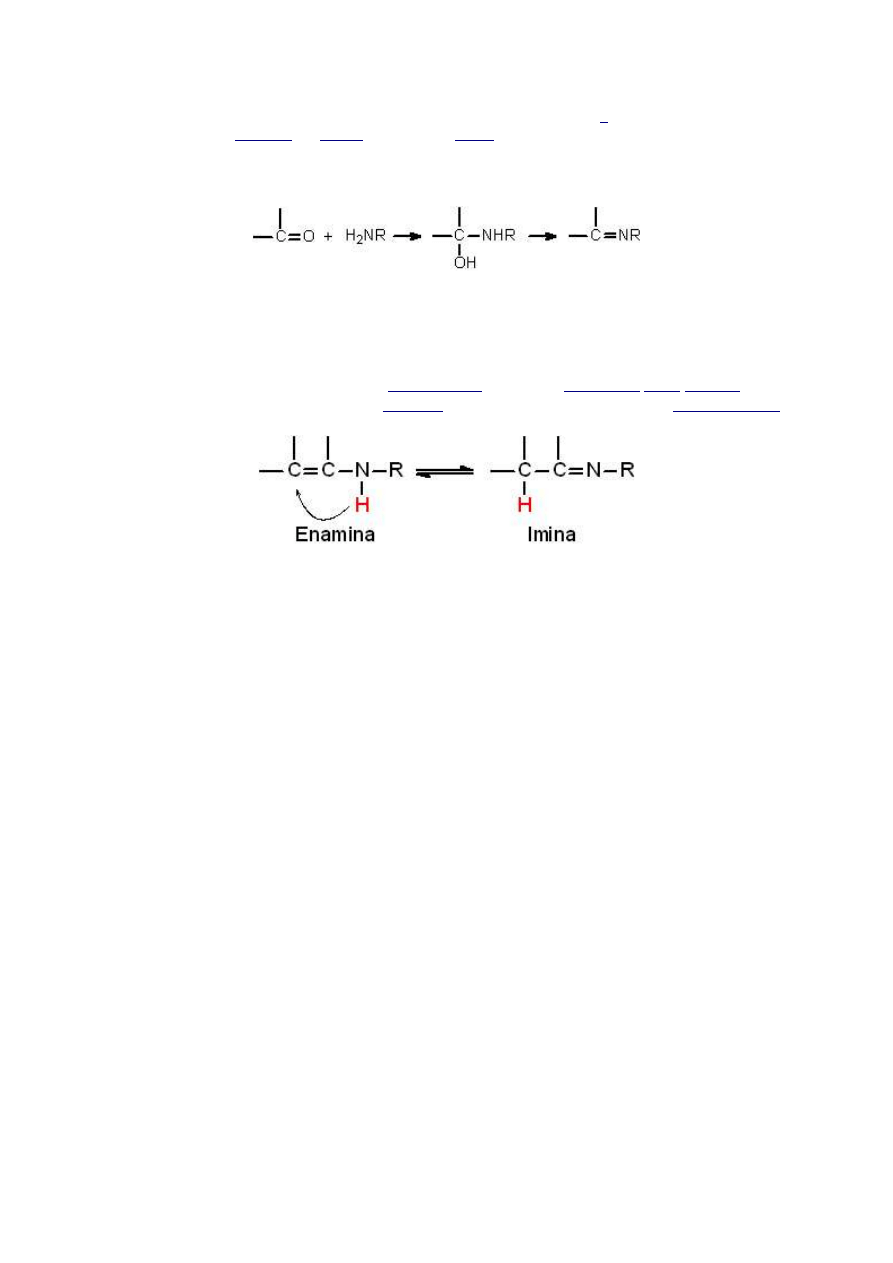
Iminy (czyli zasady Schiffa) są to związki powstałe w wyniku kondensacji
?
cząsteczki związku
karbonylowego (
aldehydu
lub
ketonu
) z cząsteczką
aminy
pierwszorzędowej (RNH
2
).
Aminy pierwszo i drugorzędowe reagując z aldehydami i ketonami tworzą iminy:
Reakcja polega na addycji nukleofilowej aminy, a następnie eliminacji cząsteczki wody.
Katalizatory kwasowe ułatwiają zajście reakcji, ale zbyt duża ilość kwasu przeszkadza jej z
powodu protonowania aminy.
W przypadku, gdy wyjściowy związek
karbonylowy
zawiera w
cząsteczce
atom
wodoru
α w
pierwszym etapie tworzy się najpierw
enamina
, która następnie ulega szybkiej
tautomeryzacji
do iminy:
Zjawisko tautomerii iminowo-enaminowej powoduje, że iminy zachowują się w wielu
reakcjach tak jakby były aminami, co powszechnie wykorzystuje się w syntezie organicznej.
Innym zastosowaniem imin, jest traktowanie ich jako wygodnej formy "transportowej" dla
amin pierwszorzędowych, gdyż można je przeprowadzić w te aminy poprzez prostą redukcję,
zaś same iminy są trwalsze i mniej reaktywne od amin pierwszorzędowych.
7. koeznymy przenoszące grupy – witaminy:
Witaminy rozpuszczalne w wodzie:
Tiamina (B
1
)
8. kw liponowy
9. Choroby metaboliczne!!
10.Onkogeny
11.karcynogeneza
12.p53
13.apoptoza
14.geny?
15.Łancuch oddechowy
16.Kwasice
17.koenzym Q
18.ciston
19.ile kcal ATP
20.Naprawa DNA
21.Wzory cysteaminy, glukozy kw. mlekowego i pirogronowego
22.Transaminacja – enzymy AspAT AlAT – gdzie który
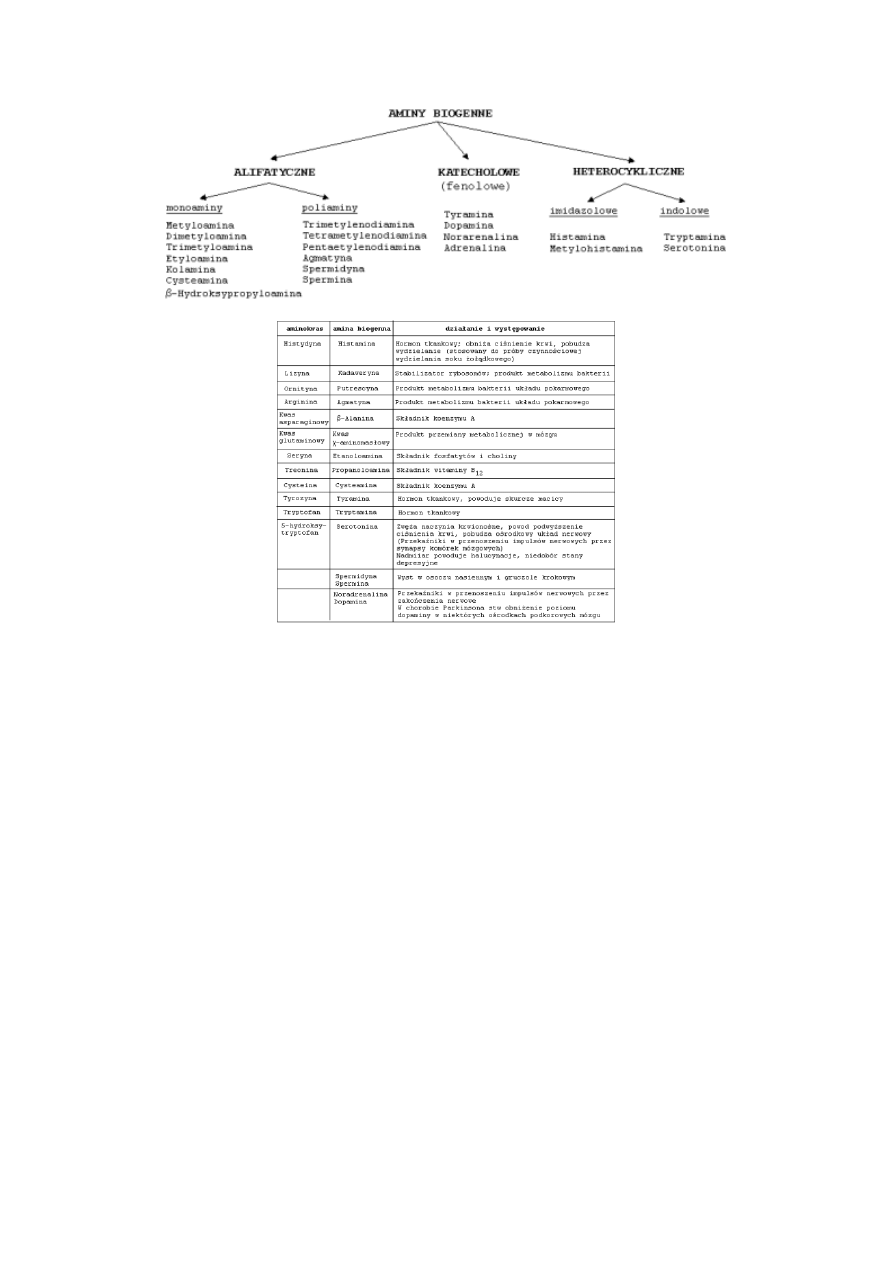
23.Aminy
3
4
Wyszukiwarka
Podobne podstrony:
ustny gielda prof Grabiec DRUKNIĘTA
USTNY giełda kardio i endo
ustny gielda prof Grabiec (4)
biochemia opis gielda 1
biochemia (1) egzam giełda, Analityka semestr IV, Biochemia, Biochemia
USTNY giełda - rozwój, Medycyna, Pobr materiały, materiały z poprzednich lat, materiały z poprzednic
USTNY giełda - zakazy, Medycyna, Pobr materiały, materiały z poprzednich lat, materiały z poprzednic
USTNY giełda (różne), Medycyna, Pobr materiały, materiały z poprzednich lat, materiały z poprzednich
USTNY giełda - rozwój 2008, Medycyna, Pobr materiały, materiały z poprzednich lat, materiały z poprz
giełda biochemia3, Fizjoterapia CM UMK, Biochemia
Giełda biochemia# 01 2012
biochemia giełda pytań
gielda biochemia 11 2 0 Kopia
pytania na egzamin ustny biochemia
Giełda, biochemia-kolokwia
Giełda, biochemia-kolokwia
ZAKRES MATERIAŁU Z BIOCHEMII WYMAGANY, Ratownictwo Medyczne Studia, Giełda, 1. rok, Chemia ogólna, B
Zasady zaliczania przedmiotu do zawieszenia dla ratownictwa, Ratownictwo Medyczne Studia, Giełda, 1.
więcej podobnych podstron