
6. Woda, roztwory, reakcje
w roztworach
• 6. 1. Właściwości wody jako
rozpuszczalnika
• 6. 2. Rozpuszczalność substancji
• 6. 3. Roztwory rzeczywiste i ich stężenia
• 6. 4. Elektrolity i dysocjacja elektrolityczna
• 6. 5. Kwasy i zasady
• 6. 6. Iloczyn jonowy wody
• 6. 7. Pojęcia pH i pOH
• 6. 8. Amfoteryczność
• 6. 9. Reakcje utleniania i redukcji
• 6. 10. Twardość wody i metody zmiękczania
wody

6. Woda roztwory, reakcje w
roztworach
• 6. 1. Właściwości wody jako rozpuszczalnika
Cząsteczki wody w różnej formie występują w
strukturze materiałów budowlanych:
Woda krystalizacyjna
– cząsteczki H
2
O wbudowane są w
strukturę kryształów.
• woda koordynacyjna
• woda sieciowa
• woda konstytucyjna
• woda luźno związana (śródwęzłowa, czyli
międzysieciowa: zeolityczna, międzywarstwowa)
Woda kapilarna
występująca w mikroporach (d<100nm)
materiału
Woda swobodna
występująca w makroporach,
przestrzeniach międzyziarnowych oraz na zwilżonych
powierzchniach, jako woda zaadsorbowana.

Woda krystalizacyjna występująca w siarczanie
miedzi II
CuSO
4
5H
2
O
sól intensywnie niebieska.
Pod wpływem prażenia sól uwodniona traci wodę i
przechodzi w białą sól bezwodną CuSO
4
.
Wody krystalizacyjna

6. Woda roztwory, reakcje w
roztworach
• 6. 1. Właściwości wody jako rozpuszczalnika
Przykłady pojęć związanych z występowaniem wody w budownictwie
wskaźnik wodno-cementowy (w/c) –
stosunek masy wody do masy
cementu w mieszance betonowej. Od
w/c
w zależy wytrzymałość
zapraw i betonów cementowych
wodożądność –
zawartość wody w mieszance zaprawy lub betonu,
niezbędna do uzyskania odpowiedniej konsystencji
wodonasiąkliwość –
zdolność danego materiału do pochłaniania wody
wodoszczelność –
odporność materiału na przenikanie wody
współczynnik rozmiękania –
stosunek wytrzymałości materiału w
stanie nasycenia wodą do wytrzymałości materiału wysuszonego
rozpuszczalność –
stężenie nasyconego roztworu wodnego
mrozoodporność
– odporność nasyconego wodą materiału
budowlanego na wielokrotne zamrażanie
twardość wody –
cecha chemiczna wody określająca stężenie (w
mmol/l) jonów wapnia (Ca
2+
) i magnezu (Mg
2+
) w wodzie
stopnień agresywności wody –
agresywność chemiczną wody
w stosunku do betonu określa się na podstawie stężenia jonów
Ca
2+
, Mg
2+,
NH
4+
, SO
42-

6. Woda roztwory, reakcje w
roztworach
6. 1. Właściwości wody jako rozpuszczalnika
Struktura cząsteczki wody
Właściwości fizykochemiczne wody
• Stała dielektryczna w temp. 298K = 78,5 F/m
• Temperatura topnienia = 273,15K
• Temperatura wrzenia = 373,15K
• Gęstość w temp. 277,15K = 1000,000 kg/m
3
• Gęstość w temp. 273,15K = 999,868 kg/m
3
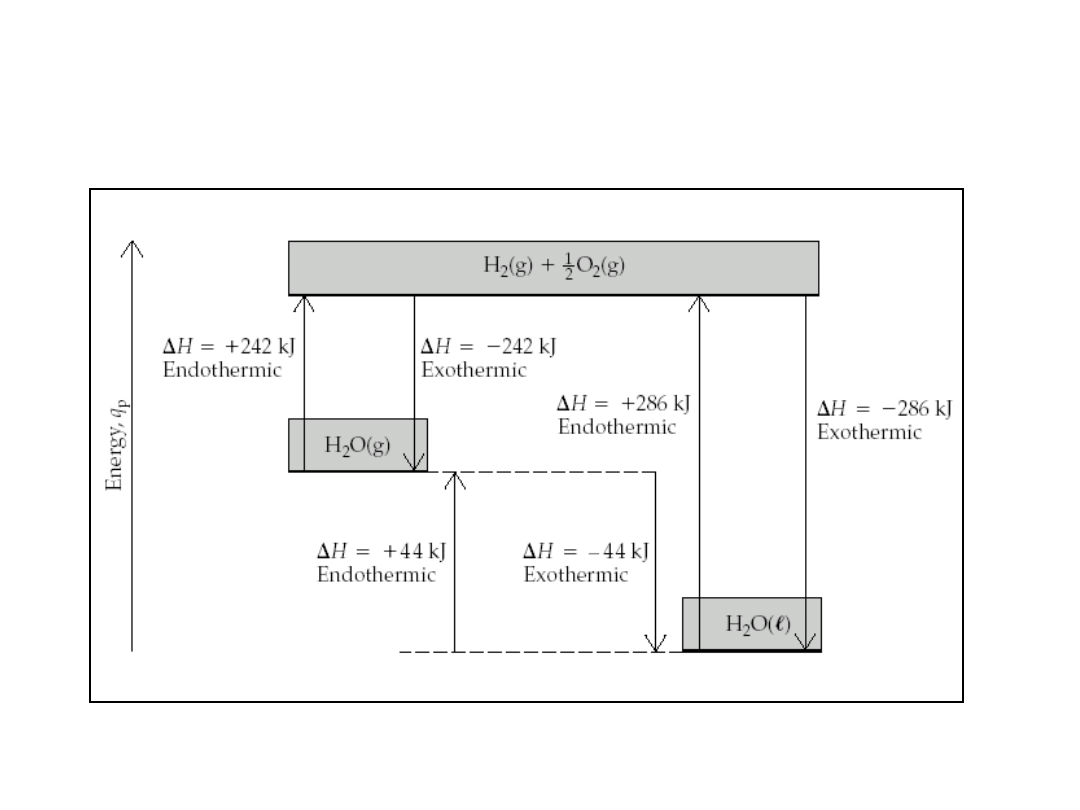
• Ciepło topnienia lodu = 6 kJ/mol = 0,334 kJ/g, w temp.
273K
• Ciepło parowania wody = 44 kJ/mol = 2,44 kJ/g, w temp.
298K
• Ciepło właściwe lodu = 2,06 J/g (dla T=273K)
• Ciepło właściwe wody = 4,1855 J/g (dla T=288K)
Liczba cząsteczek wody zasocjowanych w agregacie wynosi
od 6 w temp. 370K do 100 w temp. 273K)
6. Woda roztwory, reakcje w
roztworach
6. 1. Właściwości wody jako rozpuszczalnika

6. Woda roztwory, reakcje w
roztworach
•6. 2. Rozpuszczalność substancji
Rozpuszczalność gazów, cieczy i ciał stałych w danym
rozpuszczalniku uwarunkowana jest wzajemnym
oddziaływaniem międzycząsteczkowym substancji
rozpuszczonej i rozpuszczalnika
Rozpuszczalność nieograniczona
Rozpuszczalność ograniczona
Rozpuszczalność bardzo mała
Rozpuszczanie ciał stałych w cieczach wiąże się z rozerwaniem
wiązań między elementami sieci. Źródłem energii niezbędnej
do rozerwania tych wiązań jest energia solwatacji (hydratacji)
cząsteczek rozpuszczonego ciała stałego przez cząsteczki
rozpuszczalnika (wody
).
W roztworach rzeczywistych substancja rozpuszczona
występuje w rozdrobnieniu cząsteczkowym lub jonowym.
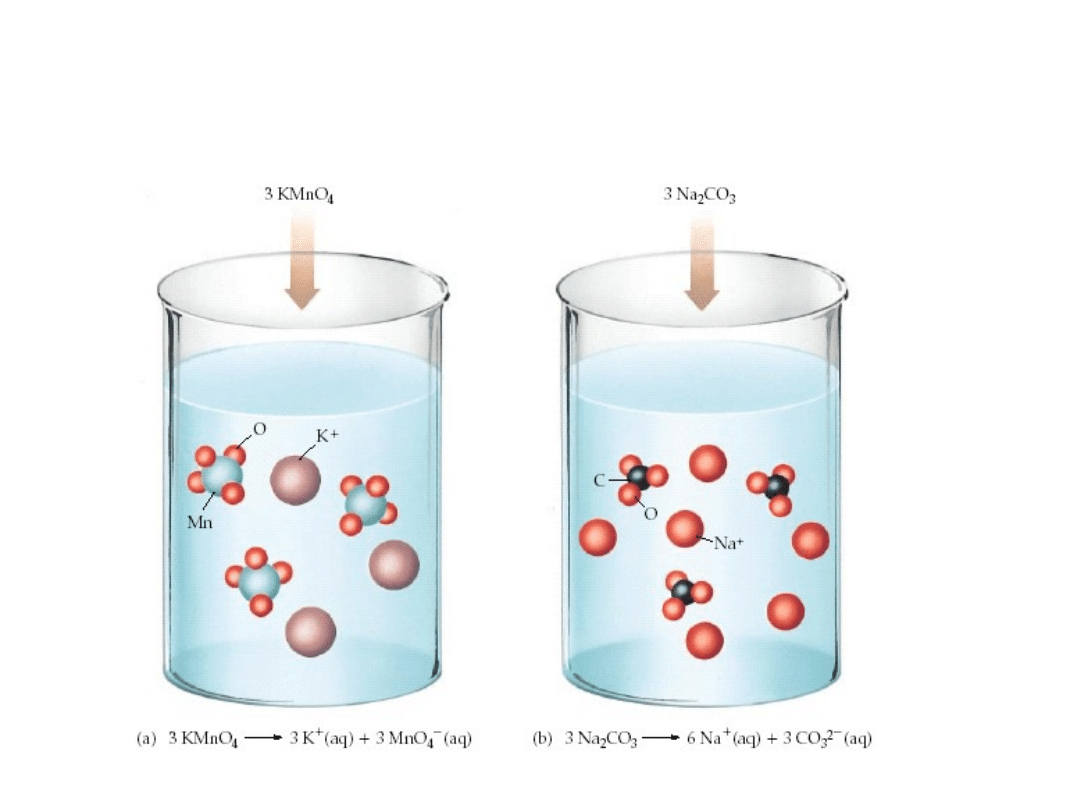
6. 2. Rozpuszczalność substancji.
Dysocjacja elektrolityczna soli
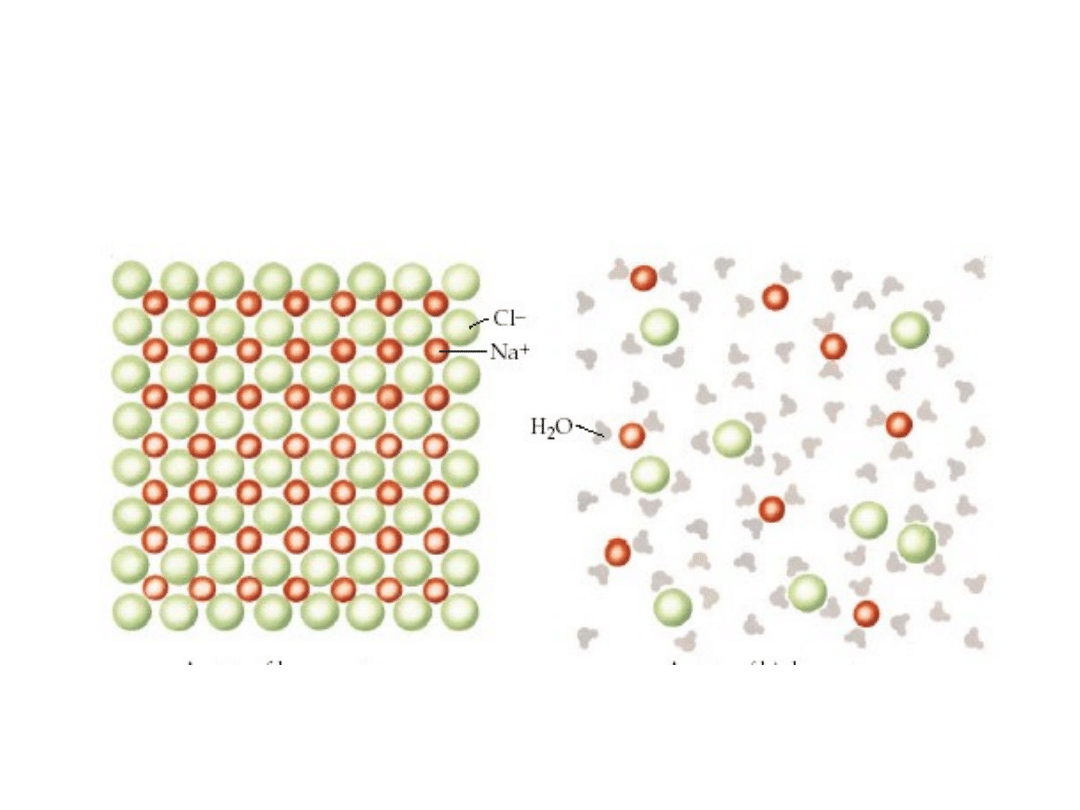
6. 2. Rozpuszczalność
substancji.
Dysocjacja elektrolityczna soli
Rozpuszczanie kryształu jonowego na przykładzie
chlorku sodu
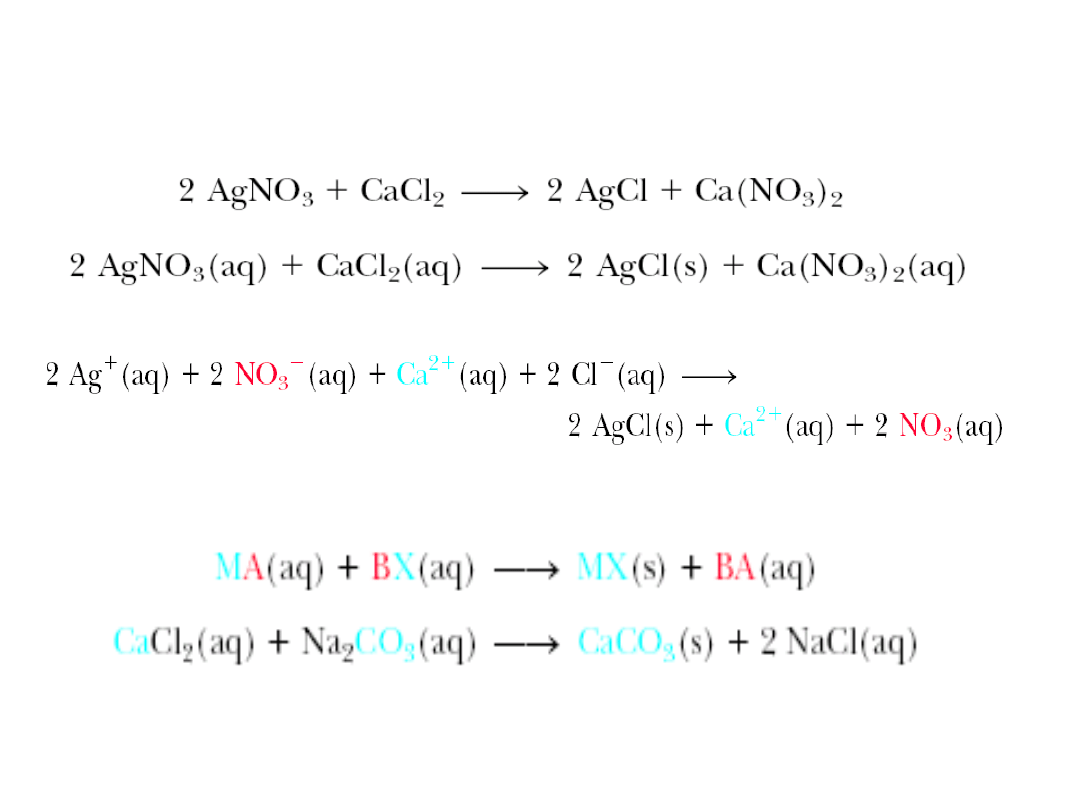
6. 2. Rozpuszczalność substancji
Reakcje strącania osadów

6. 2. Rozpuszczalność substancji
Reakcje strącania osadów
Przykłady wytrącania osadów jodku
ołowiu II, chlorku srebra I i chromianu
ołowiu II
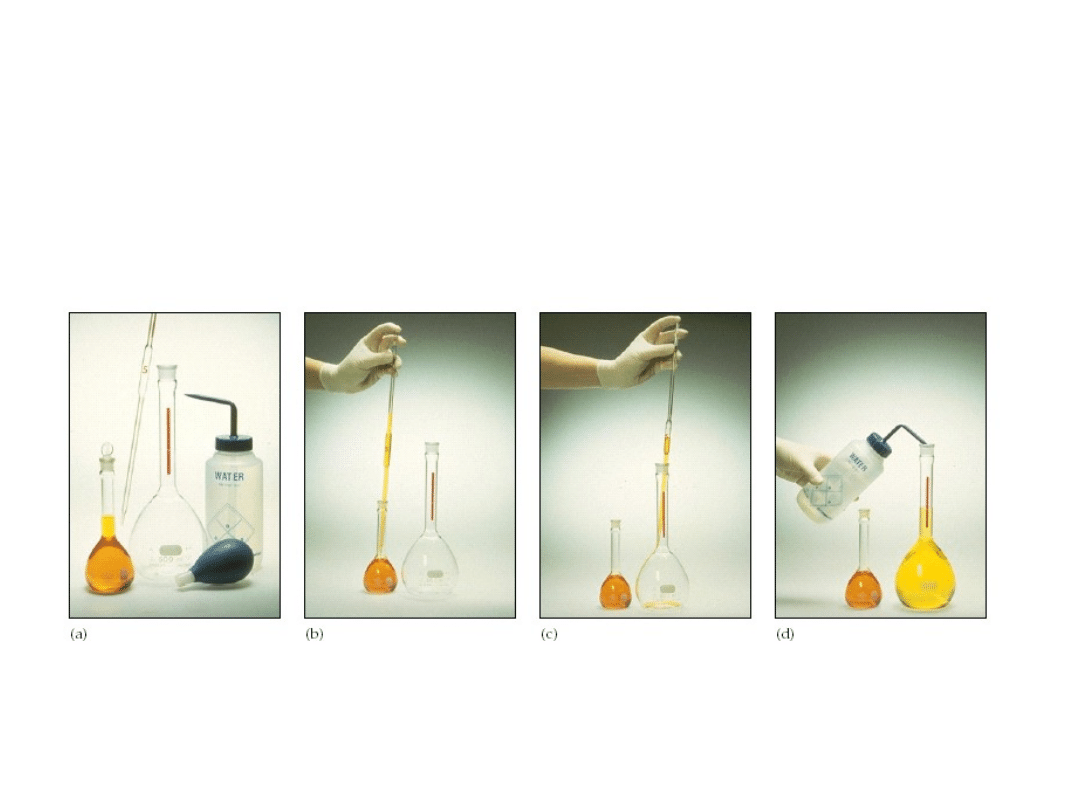
6. 3. Roztwory i ich stężenia
Sposób otrzymywania roztworów mianowanych
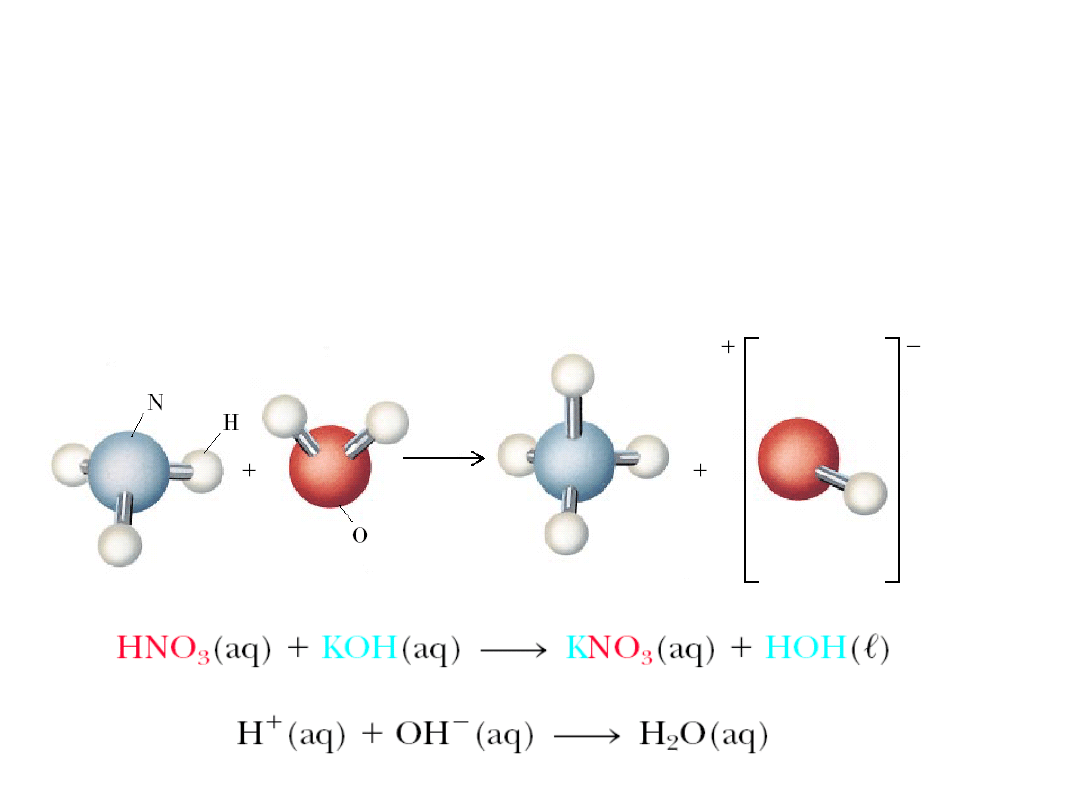
6. 5. Kwasy i zasady
Teorie kwasów i zasad
:
teoria Arrheniusa
teoria Bronsteda-Lowrego
teoria Lewisa
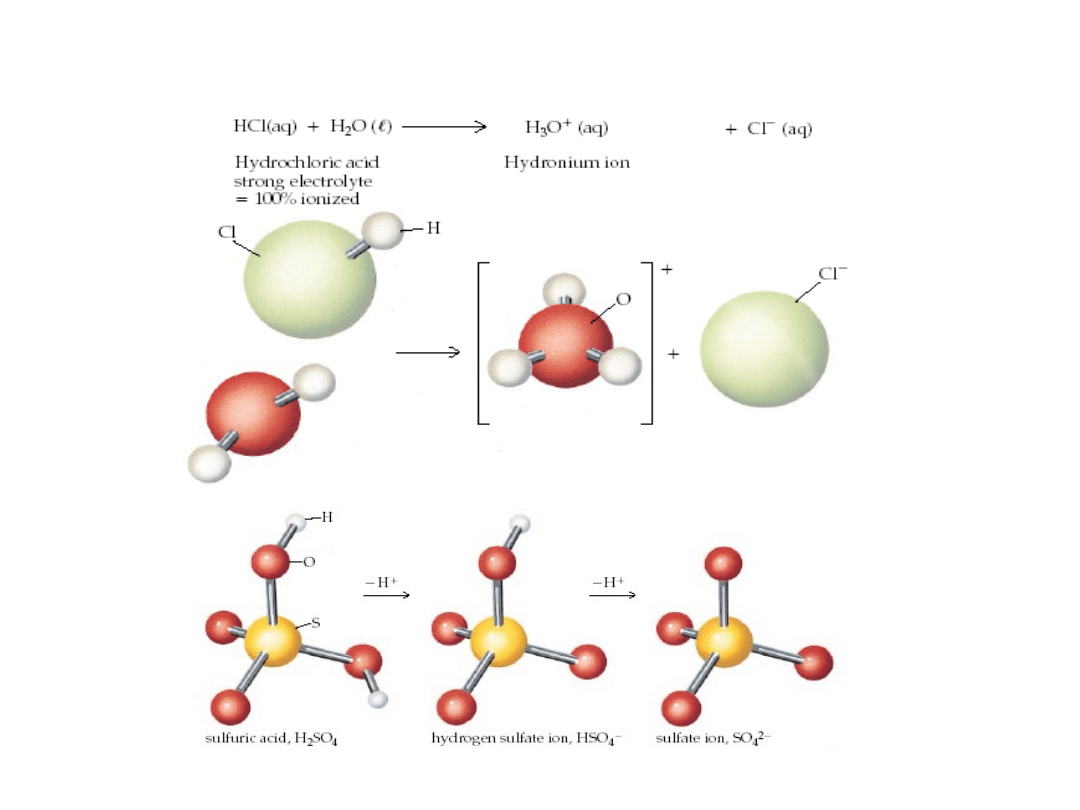
6. 5. Kwasy i zasady
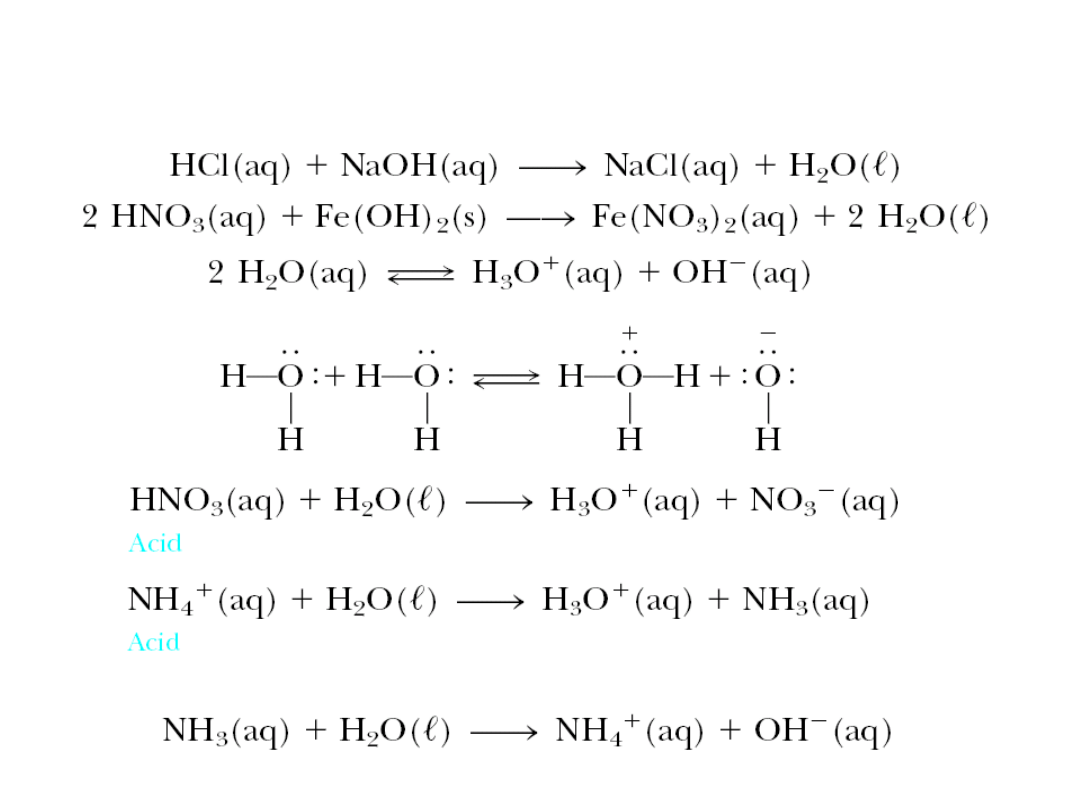
6. 5. Kwasy i zasady
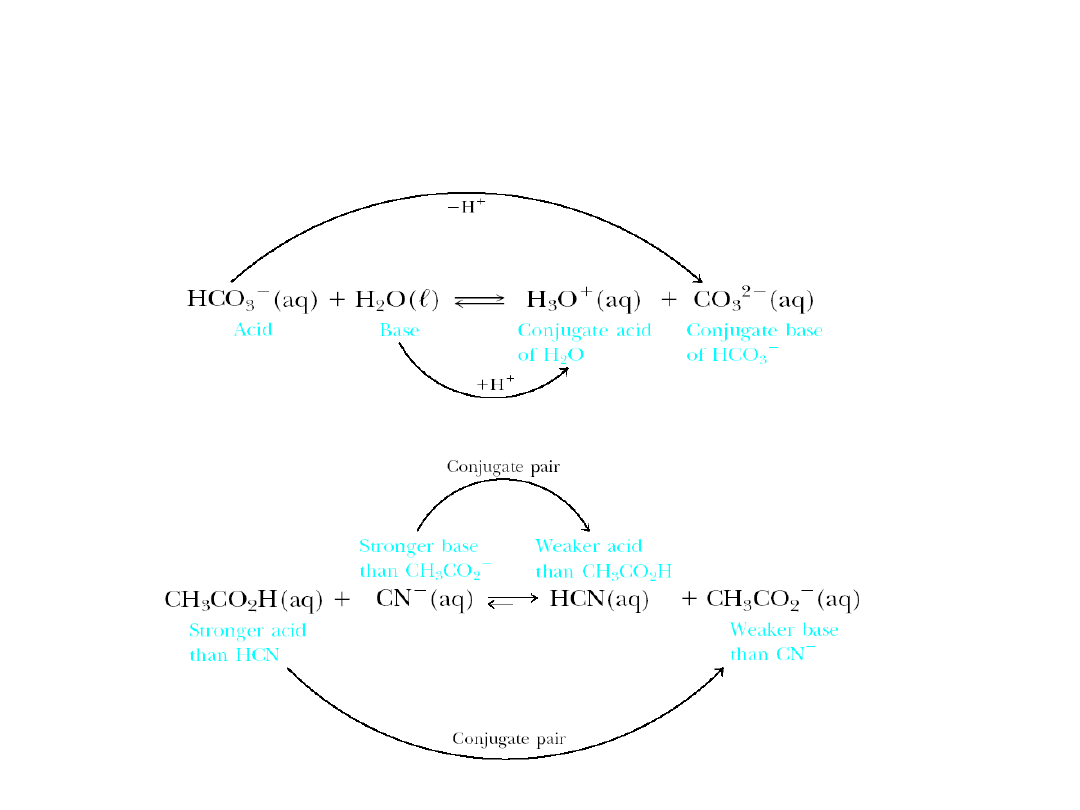
6. 5. Kwasy i zasady
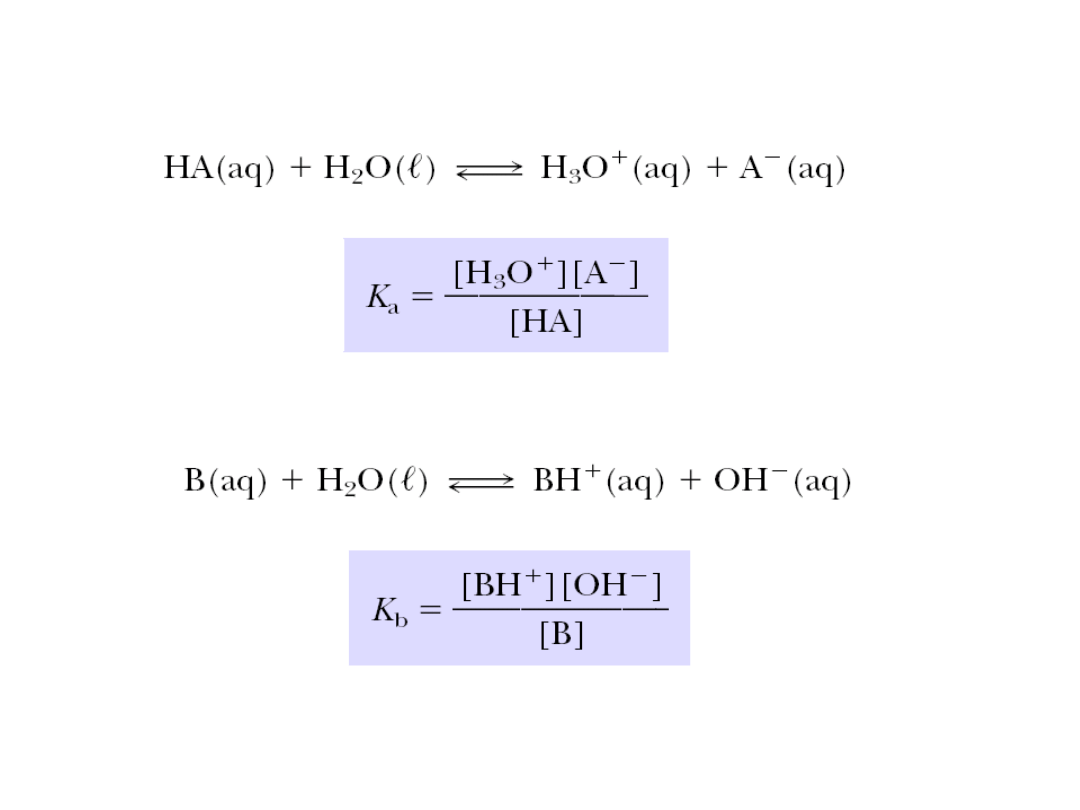
6. 5. Kwasy i zasady
Stała dysocjacji kwasowej
Stała dysocjacji zasadowej
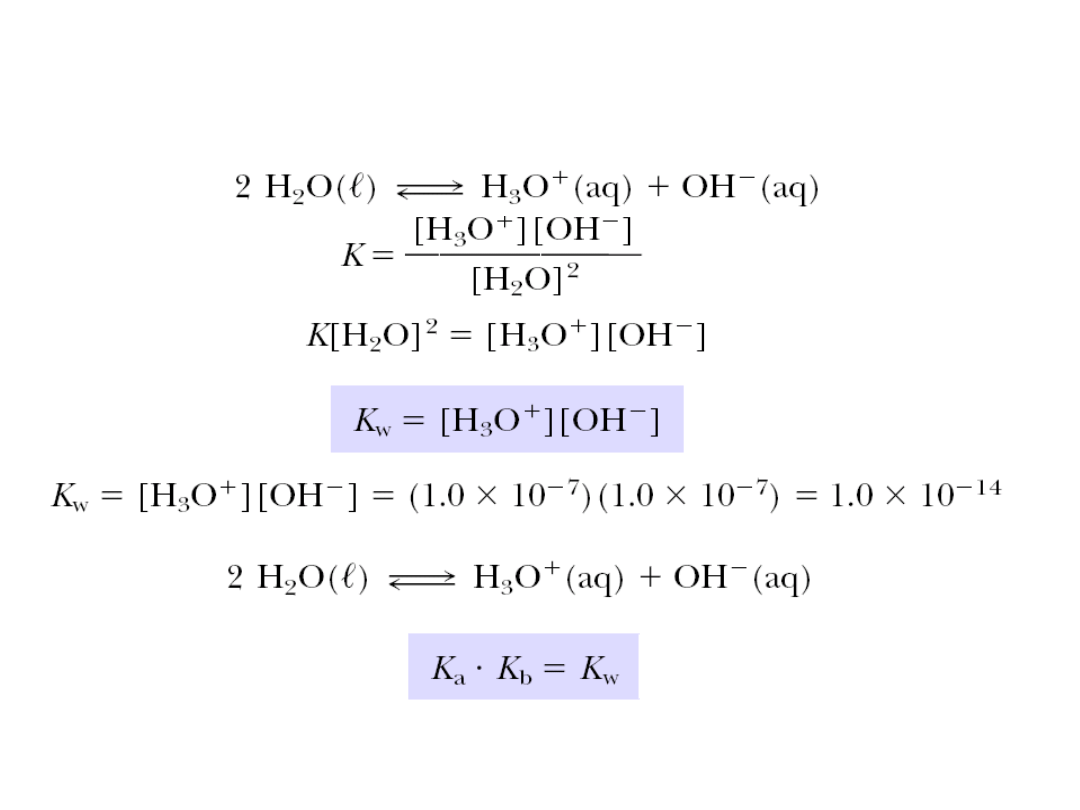
6. 5. Kwasy i zasady
Iloczyn jonowy wody
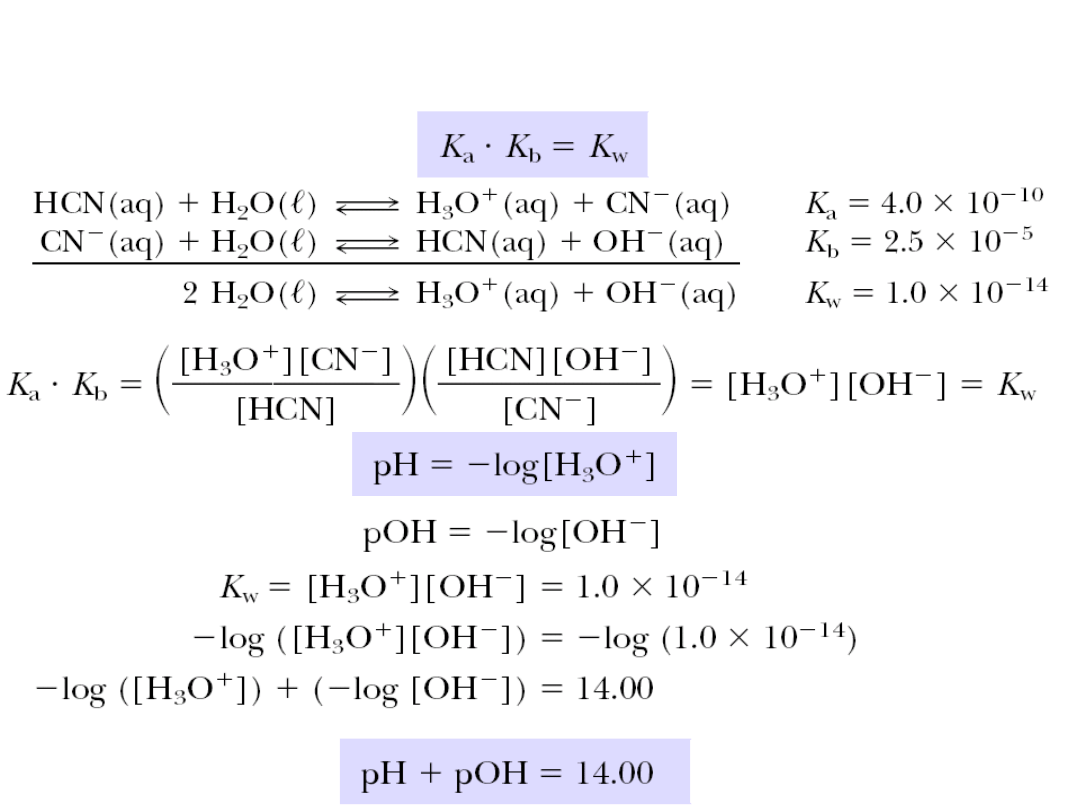
6. 5. Kwasy i zasady
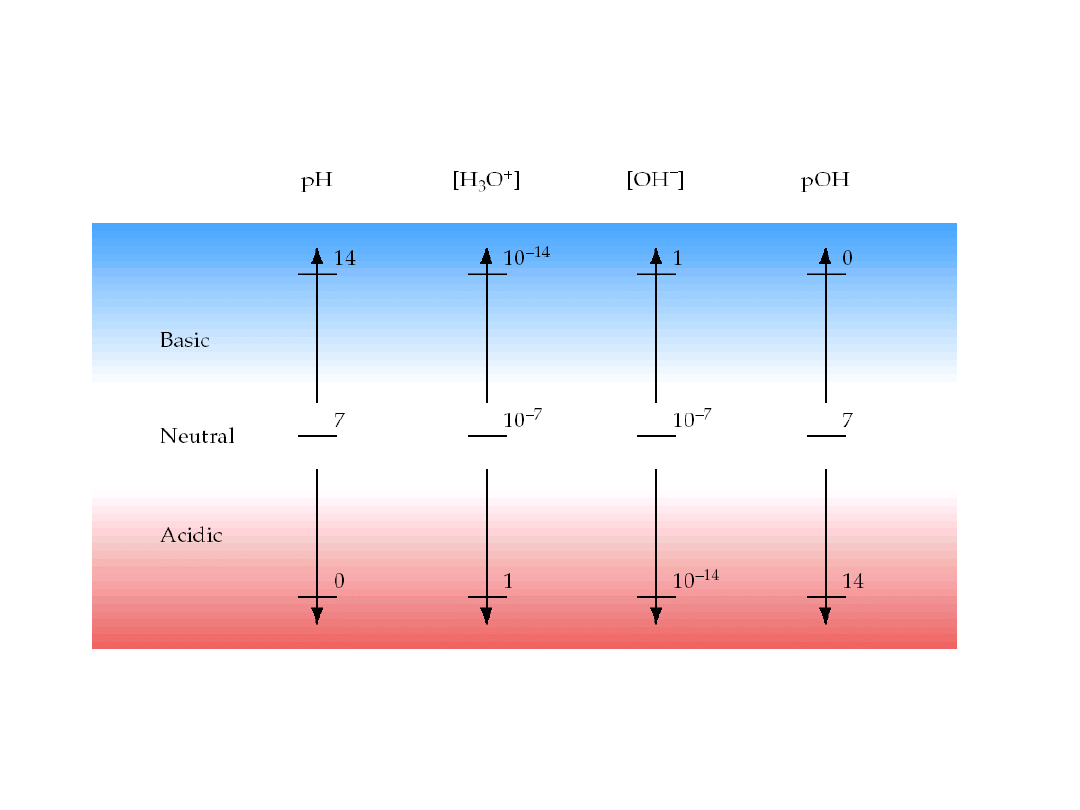
6. 5. Kwasy i zasady
Skala kwasowości i zasadowości
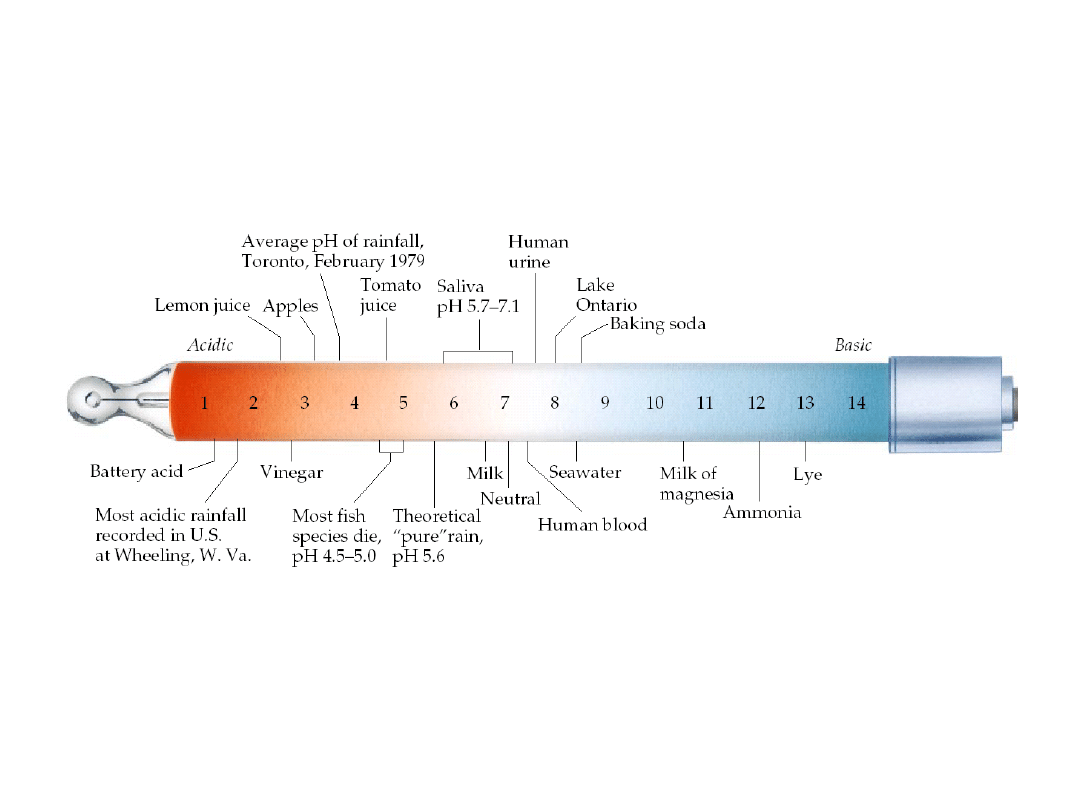
6. 5. Kwasy i zasady
Wartości pH typowych cieczy i
płynów

6. 5. Kwasy i zasady
Pomiar wartości wykładnika jonów
wodorowych (pH) cieczy
pehametr
6. 5. Kwasy i zasady
Reakcje kwasów

6. 5. Kwasy i zasady
Wytrącanie i rozpuszczanie
wodorotlenku żelaza III
roztwór
zasadowy
roztwór kwaśny

Reakcje w roztworach - miareczkowanie
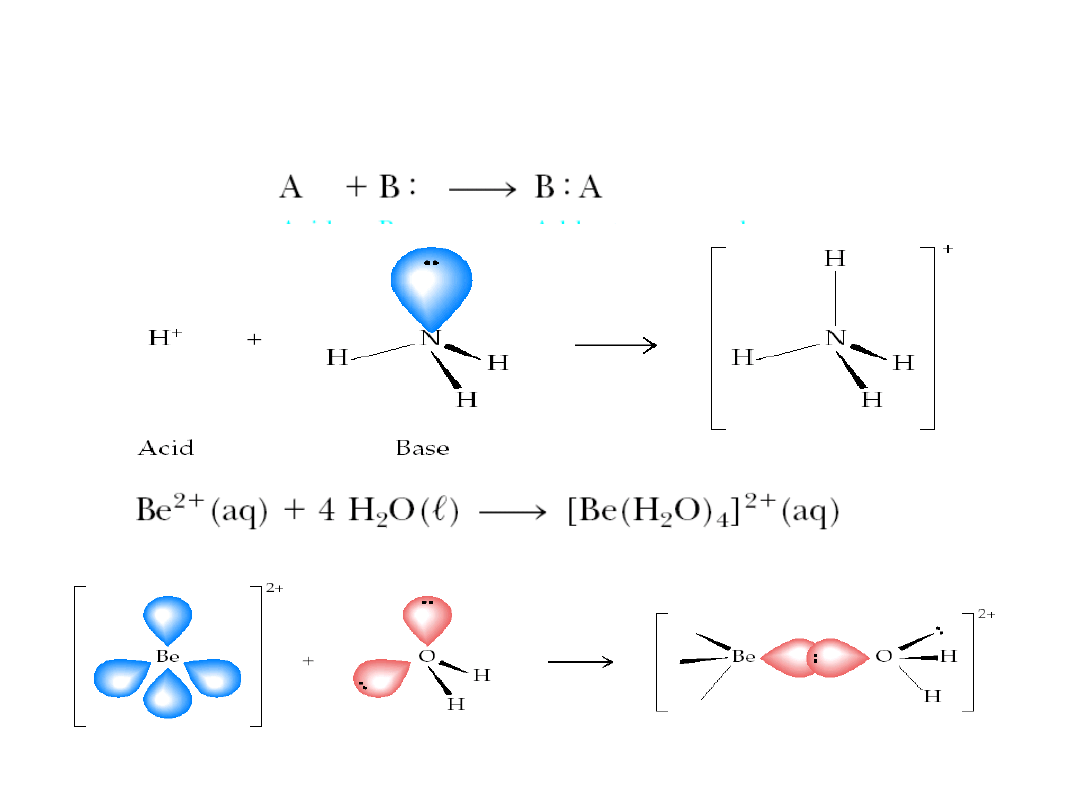
6. 5. Kwasy i zasady
Reakcje kwasów Lewisa
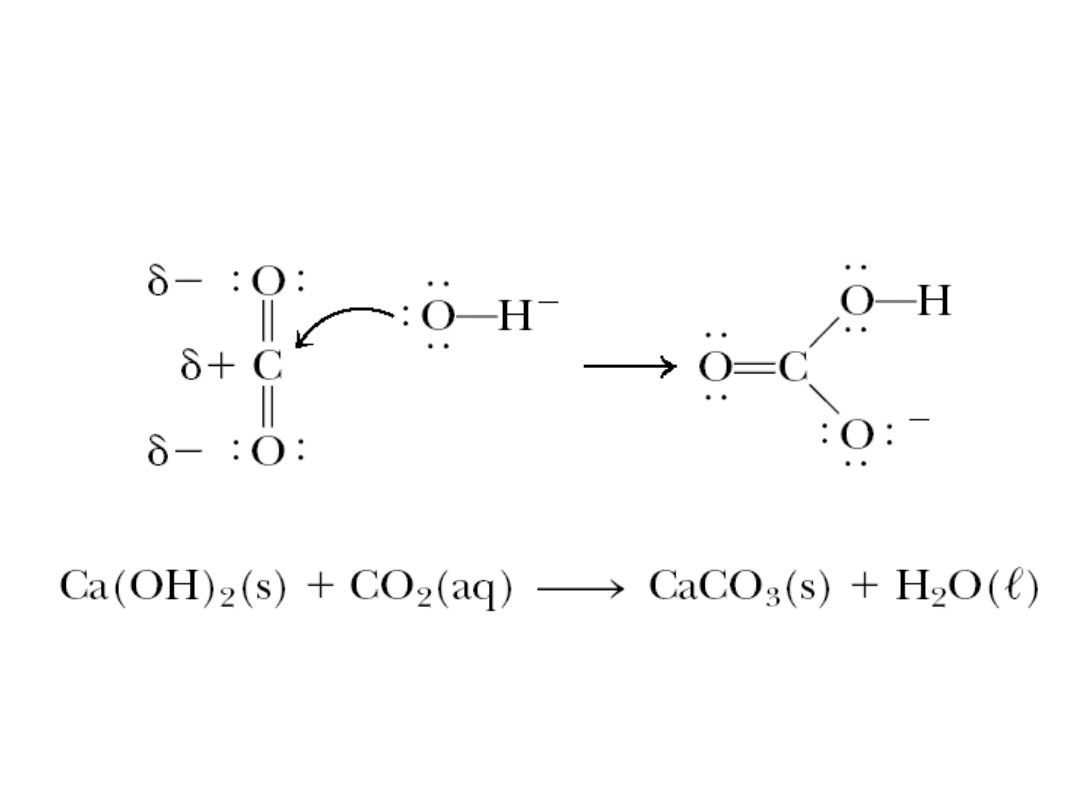
6. 5. Kwasy i zasady
Reakcje kwasów Lewisa
Reakcja dwutlenku węgla w jonem
wodorotlenowym
i wodorotlenkiem wapnia
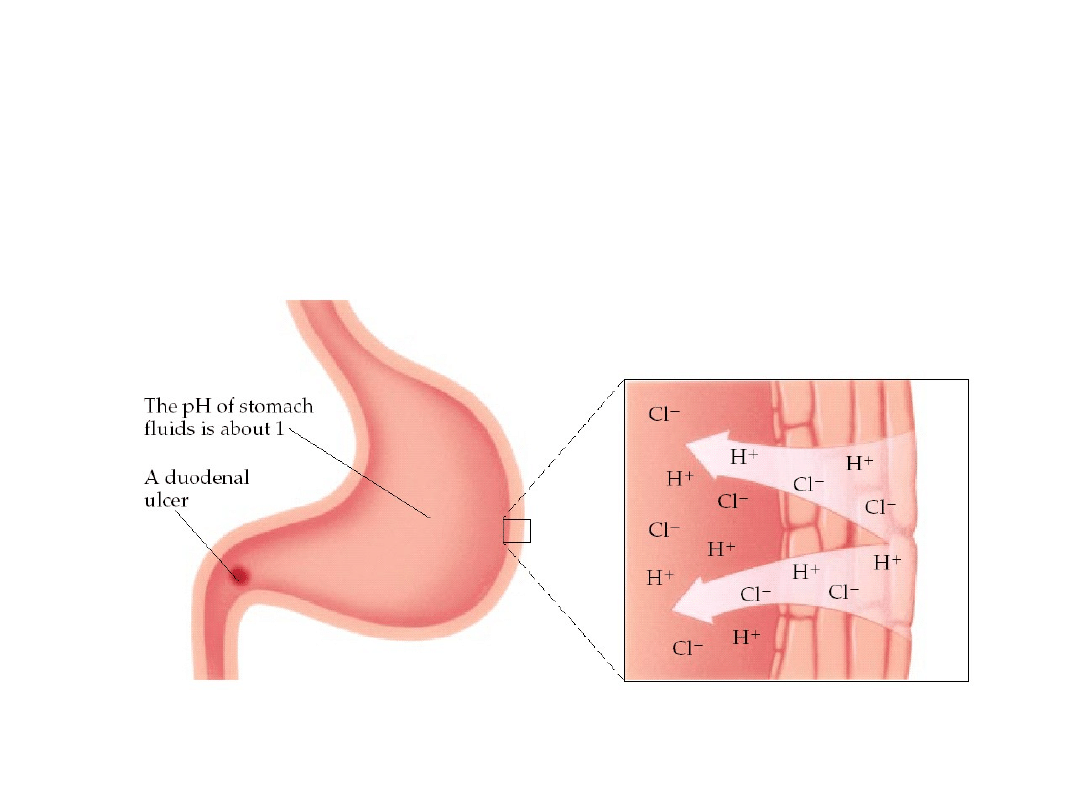
6. 5. Kwasy i zasady
Rola kwasu chlorowodorowego
w procesie trawienia
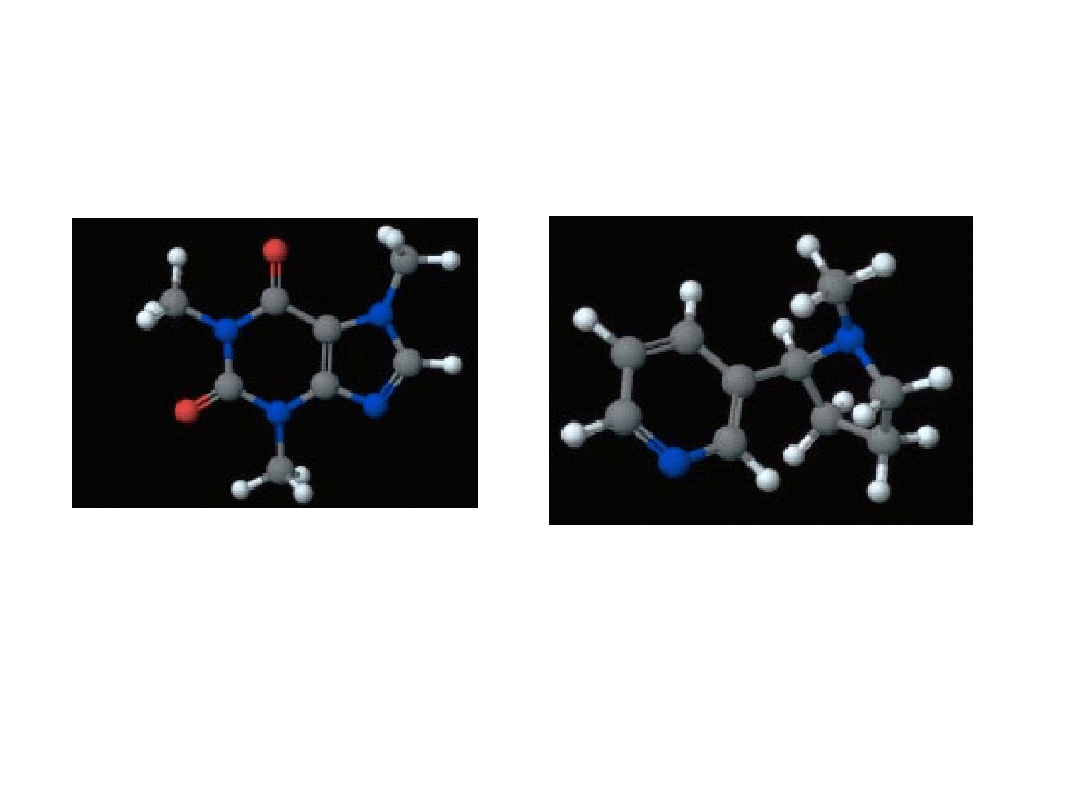
6. 5. Kwasy i zasady
Dwie ważne zasady
Kofeina
C
8
H
10
N
4
O
2
Nikotyna C
10
H
14
N
2

CHEMIA PIERWIASTKÓW GRUP GŁÓWNYCH
Budowa cząsteczki
kwasu azotowego
NO
2
+ H
2
O = HNO
3
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
chemia przygotowanie do sprawdzianu woda i roztwory wodne
chemia woda i roztwory wodne sprawdzian nowa era
Woda i roztwory wodne
Chemia Nowej Ery Woda I Roztwory Wodne
Chemia Nowej Ery 2 kl 2 testy odpowiedzi klucze Woda i roztwory wodne
sprawdzian chemia woda i roztwory wodne nowa era odpowiedzi
04 pH roztworow i reakcje soli z woda 26 02 2015
04 pH roztworow i reakcje soli z woda 26 02 2015
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
5 Reakcje utleniania i redukcji Reakcje w roztworach
1 5 1 Reakcje w roztworach wodnych
reakcje w roztworach wodnych, Studia, I rok, I rok, I semestr, Chemia I
reakcje chemicznew roztworach wodnych zadania
chemia roztwory i reakcje jonowe
reakcje w roztworach wodnych, Nauka, CHEMIA, Szkoła, Chemia ogólna
4-Reakcje w roztworach
Reakcje w roztworachgr A i B SPRAWDZIAN, do wykorzystania w szkole
kwasy i pochodne Reakcja kwasów tłuszczowych z roztworem bromu i roztworem manganianu(VII) potasu
Reakcje w roztworach wodnych, chemia
więcej podobnych podstron