
1
Właściwości
i przemiany
gazów
rzeczywistyc
h (a)
Waldemar Ufnalski
Wprowadzenie do termodynamiki
chemicznej
Wykład 9a
0,25
0,50
0,75
1,00
1,25
1,50
1,75
-1,0
-0,5
0,0
0,5
1,0
lg P/P
k
Z
1,0
1,25
1,50
2,0
4,0
0,9
0,8
0,7

2
9.1. Równania stanu
gazu
Wykład 9a

3
Model molekularny gazu
doskonałego...
• drobiny są kulami sprężystymi
poruszającymi się swobodnie
• zderzają się ze sobą i ściankami
naczynia
• objętość własna drobin jest pomijalna w
stosunku do objętości układu,
• drobiny nie oddziałują na siebie siłami
dalekie- go zasięgu.
równanie stanu gazu
doskonałego
nRT
PV
(1
)

4
Oddziaływania van der Waalsa -
s
iły przyciągania natury
elektrostatycznej...
• trwałych dipoli cząsteczkowych (oddziaływania
orientacyjne - W. H. Keesom; 1912)
A
,
B
- momenty dipolowe
drobin
•r - średnia odległość między
drobinami
(2
)
6
2
2
2
0
2
3
4
1
r
T
k
V
B
A
B
K

5
Oddziaływania van der Waalsa -
s
iły przyciągania natury
elektrostatycznej...
• trwałych dipoli cząsteczkowych i dipolami
wyin- dukowanymi przez nie w sąsiednich
drobinach polarnych lub niepolarnych
(oddziaływania pola- ryzacyjne - P. Deby’e;
1920)
A
,
B
- polaryzowalność
drobin
(3
)
6
2
2
2
0
2
3
4
1
r
T
k
V
B
A
A
B
B
D

6
Oddziaływania van der Waalsa -
s
iły przyciągania natury
elektrostatycznej...
• niepolarnych drobin w wyniku chwilowych
defor- macji sferycznej symetrii ładunków
elektrycznych (oddziaływania dyspersyjne - F.
London; 1930)
•I
A
, I
B
- pierwsza energia
jonizacji drobin
(4
)
6
2
0
2
3
4
1
r
I
I
I
I
V
B
A
B
A
B
A
L
7
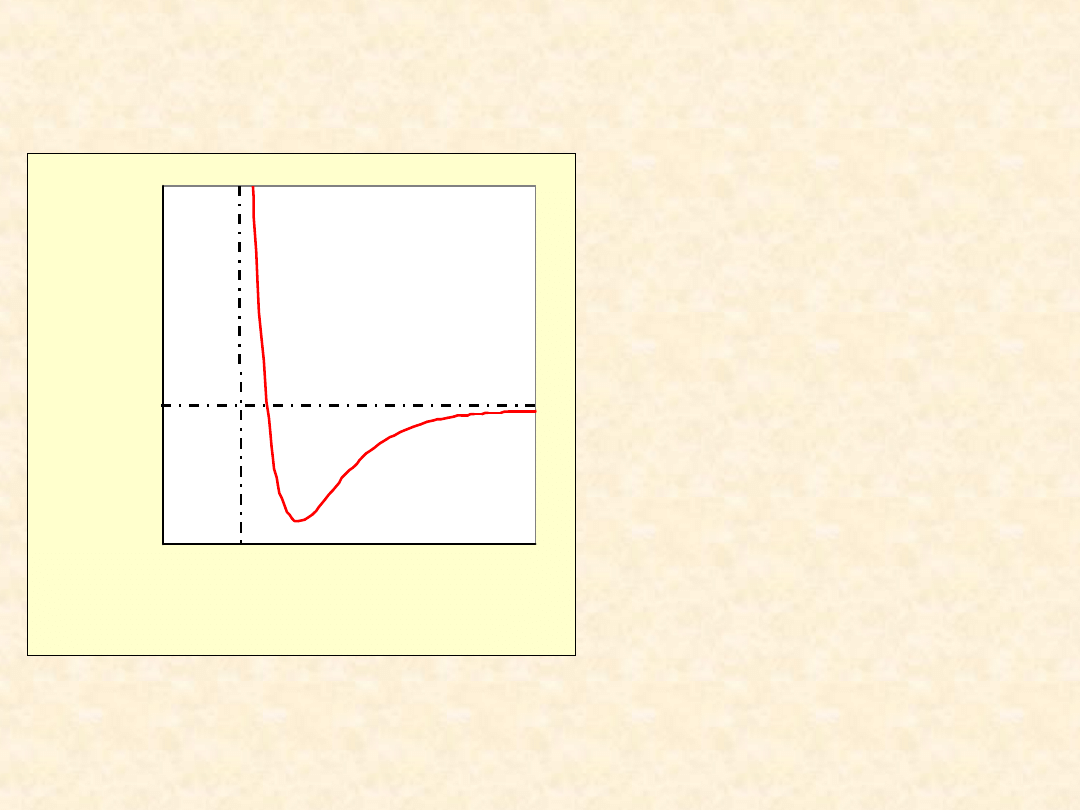
Energia potencjalna
oddziaływań
• wynik konkurencji
sił przyciągania
(van der Waalsa) i
odpychania powłok
elektronowych
(dominujących na
bar - dzo małych
odległoś - ciach)
-1200
-700
-200
300
800
1300
1800
0,25
1,25
2,25
r
V(r)
a
0

8
Równania stanu
(makroskopowa
miara odchy- leń od modelu gazu
doskonałego)...
•
Współczynnik kompresji gazu...
(5
)
RT
PV
P
T
Z
m
,
•indywidualna dla każdego gazu
funkcja tempe- ratury i ciśnienia
1
0
const
T
P
P
Z
lim
(6
)
9
Równania
stanu ...
Współczynnik
kompresji
azotu w
temperaurze:
1 - 150 K
2 - 175 K
3 - 300 K
4 - 273,15 K
5 - 373,15 K
6 - 500 K
7 - 750 K
8 - 1000 K
0,50
1,00
1,50
2,00
5,0
6,0
7,0
8,0
lg P/Pa
Z
4
5
6
7
8
3
2
1

10
Równania
stanu...
•
Wirialne równania stanu - H. K. Onnes; 1901
(7
)
•B, B’, ... - współczynniki wirialne -
indywidual - na dla każdego gazu
funkcja temperatury
(8
)
3
2
1
m
m
m
V
T
D
V
T
C
V
T
B
P
T
Z ,
2
1
P
T
C
P
T
B
P
T
Z
'
'
,

11
.... wirialne równania stanu
(10
)
Współczynniki wirialne w obu
rozwinięciach łączą ze sobą
następujące zależności:
(9
)
;
'
;
'
;
'
3
2
2
2
2
3
RT
B
BC
D
D
RT
B
C
C
RT
B
B
Wirialne równanie stanu dla
umiarkowanych ciśnień
RT
P
T
B
P
T
B
V
T
B
RT
PV
P
T
Z
m
m
1
1
1
'
,
P
T
B
RT
PV
m

12
-120,0
-80,0
-40,0
0,0
0
200
400
600
T/K
B
/(
c
m
3
/m
o
l)
1
2
3
4
5
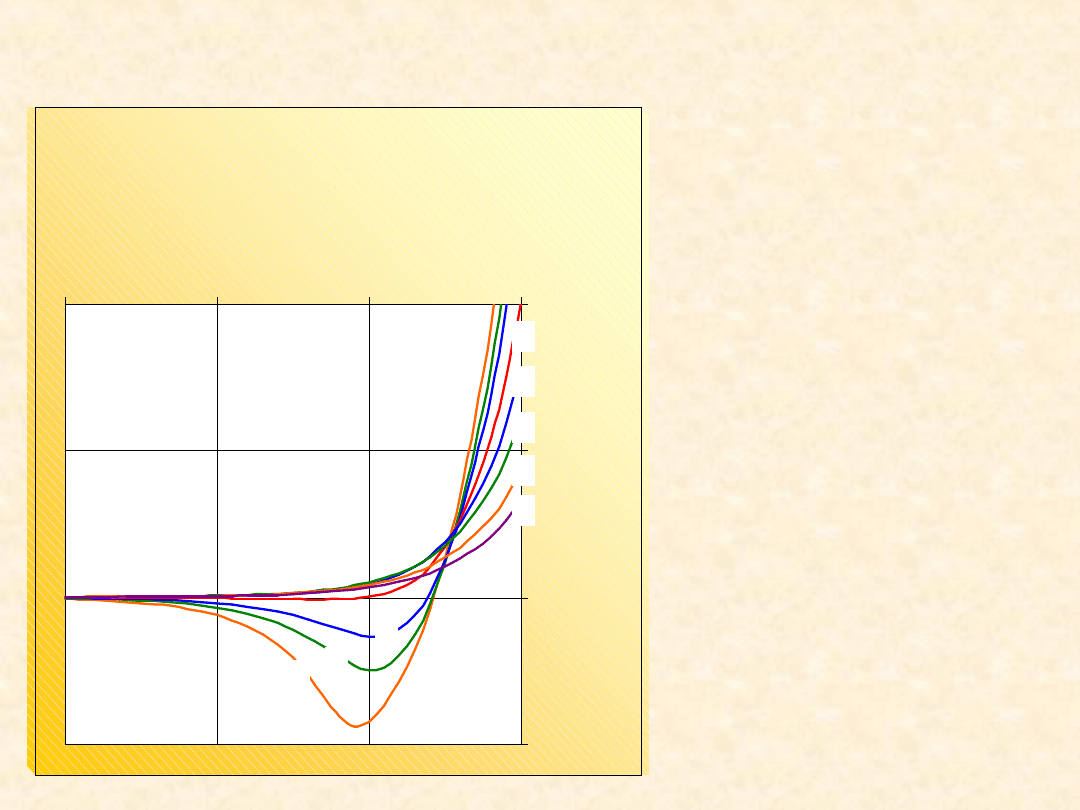
Zależność drugiego współczynnika
wirialnego od temperatury
1 - Ar
2 - CF
4
3 -
CH
4
4 - H
2
5 - N
2
Temperatura Boyle’a
B(T
B
) = 0
13
Równania
stanu...
•
J. D. van der Waals (1873) - forma ogólna:
(1
1)
b - poprawka na
objętość własną
drobin
P - ciśnienie
wewnętrzne
(poprawka na siły
przycią - gania
drobin)
(12
)
P
b
V
RT
P
m
•
J. D. van der Waals (1873) - forma szczególna:
2
m
m
V
a
b
V
RT
P
a, b - stałe
indywidualne dla
gazu

14
Równania
stanu...
•
sześcienne równania stanu - forma ogólna:
(1
3)
(14
)
• J. D. van der Waals - forma szczególna:
0
2
3
Z
Z
Z
0
2
3
P
ab
V
P
a
V
P
RT
b
V
m
m
m
0
1
3
2
2
2
3
RT
abP
Z
RT
aP
Z
RT
bP
Z
15
Wybrane sześcienne równania
stanu...
(1
5)
(16
)
• van der Waals (vdW); 1873:
2
m
V
a
P
• Berthelot (B); 1899:
2
m
TV
a
P
• Redlich - Kwong
(RK); 1899:
b
V
V
T
a
P
m
m
2
1
(17
)

16
Wybrane sześcienne równania
stanu...
(1
8)
(19
)
• Soawe - Redlich -
Kwong (SRK); 1972:
• Lee - Erdbar -
Edminster (LEE);
1973:
b
V
V
T
P
m
m
SRK
b
V
b
V
T
m
V
T
P
m
m
m
LEE

17
Wybrane sześcienne równania
stanu...
(2
0)
(21
)
• Peng - Robinson
(PR); 1976:
• Patel - Teja
(PT); 1981:
b
V
b
b
V
V
T
P
m
m
m
PR
b
V
c
b
V
V
T
P
m
m
m
PT

18
9.2. Zredukowane
równania stanu
Wykład 9a
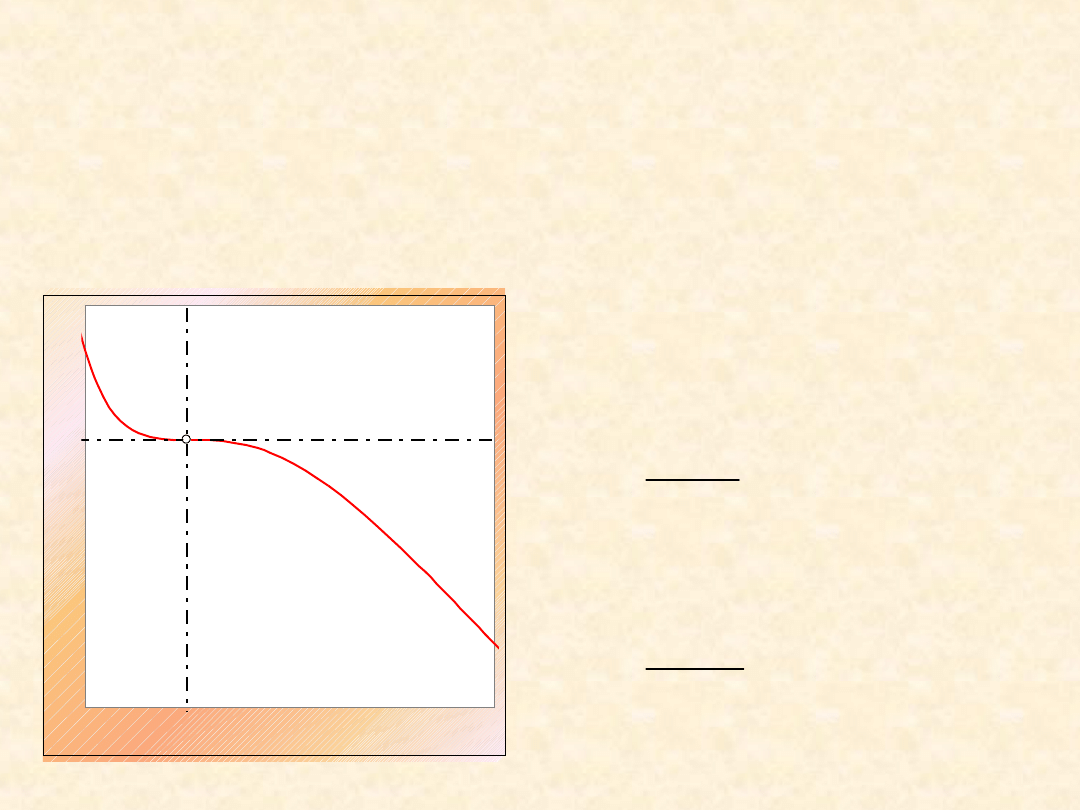
19
V
m
P
V
k
P
k
Redukcja dwuparametrowego
równania stanu...
(22
a)
Cel: wyrażenie indywidualnych parametrów
(a,b) za pomocą parametrów krytycznych
Postępowanie:
W punkcie krytycznym
izoterma krytyczna ma
płaski punkt przegięcia:
0
T
m
V
P
0
2
2
T
m
V
P
(22
b)

20
Redukcja równania van der Waalsa...
(23
a)
Postępowanie:
(23
b)
2
m
m
V
a
b
V
RT
P
3
2
2
m
m
T
m
V
a
b
V
RT
V
P
4
3
2
2
6
2
m
m
T
m
V
a
b
V
RT
V
P
(23
c)
21
Redukcja równania van der Waalsa...
(24
a)
W punkcie krytycznym (P
k
, V
k
, T
k
)
spełniony musi być układ trzech równań
(24
b)
(24
c)
2
k
k
k
k
V
a
b
V
RT
P
0
2
3
2
k
k
k
V
a
b
V
RT
0
6
2
4
3
k
k
k
V
a
b
V
RT
22
;
;
;
k
r
k
r
k
r
V
V
V
T
T
T
P
P
P
Redukcja równania van der Waalsa...
(25
)
Rozwiązanie układu równań (24a/b/c):
(2
6)
(2
7)
k
k
k
k
P
T
R
V
P
a
64
27
3
2
2
2
k
k
k
P
RT
V
b
8
3
k
k
k
T
V
P
R
3
8
Podstawienie (25) do (23a)
2
3
1
3
3
8
r
r
r
r
V
V
T
P
Zredukowane równanie
van der Waalsa
Parametry zredukowane
23
Zredukowane równanie van der
Waalsa...
Współczynnik kompresji
(2
9)
(2
8)
2
3
1
3
3
8
r
r
r
r
V
V
T
P
0
1
2
3
AB
AZ
Z
B
Z
64
27
2
r
r
T
P
A
r
r
T
P
B
8
24
Zredukowane równanie van der
Waalsa...
Krytyczny współczynnik kompresji
(3
0)
375
0
8
3
,
k
k
k
k
RT
V
P
Z
Pły n
H e
H
2
A r
N
2
O
2
Z
k
0,319 0,305 0,291 0,290 0,288
Pły n C O
2
H
2
O C H
4
C
2
H
4
C
2
H
6
Z
k
0,287 0,229 0,288 0,276 0,285
Wniosek: Równanie vdW nie opisuje ilościowo
relacji PVT w otoczeniu punktu krytycznego.
25
Zredukowane równanie Redlicha -
Kwonga...
(3
1)
b
V
V
T
a
b
V
RT
P
m
m
m
2
1
k
k
P
T
R
a
2
5
3
1
2
1
2
9
1
k
k
k
V
P
RT
b
1
2
3
1
2
3
1
3
1
k
k
k
T
V
P
R
3
(3
2)
1
2
1
2
1
1
2
3
3
1
2
1
3
1
3
1
r
r
r
r
r
r
V
V
T
V
T
P
(3
3)

26
Zredukowane równanie Redlicha -
Kwonga...
Współczynnik kompresji
(3
4)
0
2
3
AB
Z
B
B
A
Z
Z
2
5
3
1
1
2
9
1
r
r
T
P
A
r
r
T
P
B=
3
1
2
3
1
Krytyczny współczynnik kompresji
333
0
3
1
,
k
k
k
k
RT
V
P
Z
(3
5)
27
Zredukowane równanie Berthelota...
(3
6)
Krytyczny współczynnik kompresji
(3
7)
2
m
m
TV
a
b
V
RT
P
k
k
k
T
V
P
a
2
3
3
k
V
b
k
k
k
T
V
P
R
3
8
375
0
8
3
,
k
k
k
k
RT
V
P
Z

28
Zredukowane równanie Berthelota...
(3
8)
(3
9)
281
0
32
9
,
k
Z
Poprawienie dopasowania
k
k
k
T
V
P
a
2
3
16
4
k
V
b
k
k
k
T
V
P
R
9
32
r
r
r
r
r
T
V
V
T
P
9
32
4
1
3
16
2
2
6
1
128
9
1
r
r
r
m
T
T
P
RT
PV
Z
Dla P
r
< 1 oraz T
r
> 1 - forma przybliżona:

29
9.3. Zasada stanów
odpowiadających sobie
Wykład 9a

30
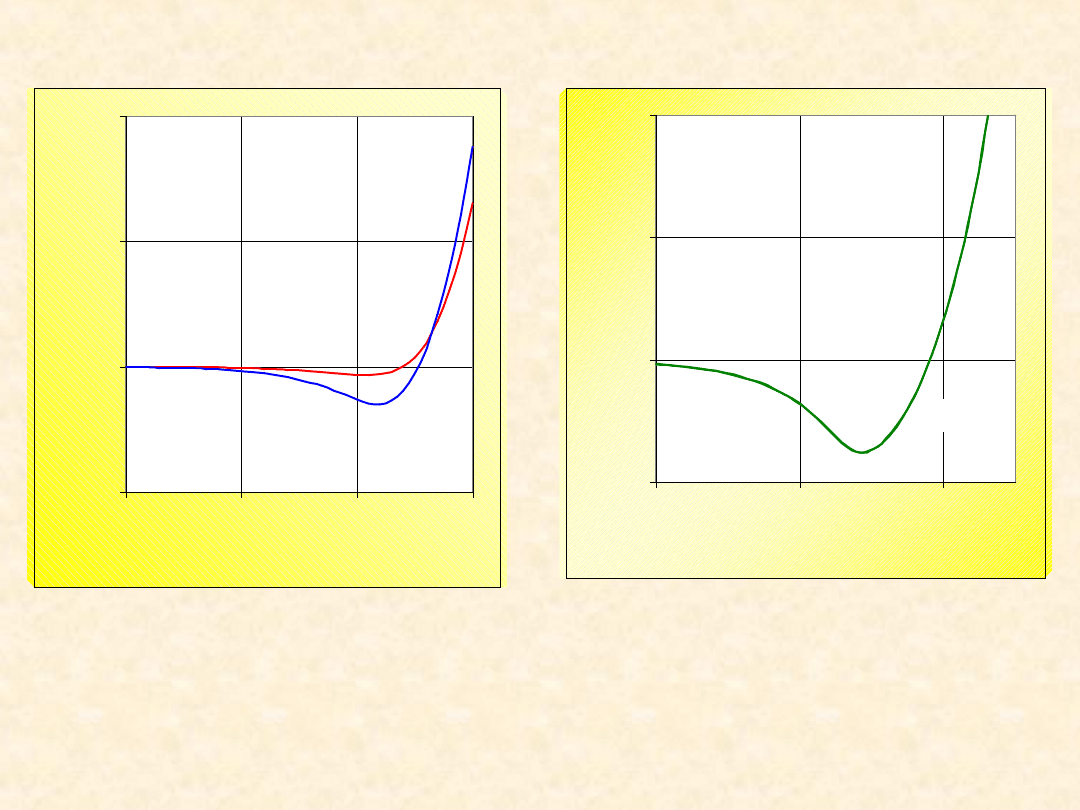
Zasada stanów odpowiadających
sobie...
•Dwa gazy opisane zredukowanym równaniem
stanu, znajdujące się w stanach o takich
samych wartościach dwóch parametrów
zredukowanych (np. T
r
,P
r
) mają identyczną
wartość trzeciego parametru zredukowanego
(V
r
) oraz współczyn -nika kompresji
•Własności różnych gazów należy porównywać
w
stanach odpowiadających sobie
czyli
opisanych identycznymi wartościami
temperatury zreduko - wanej i ciśnienia
zredukowanego (a nie tempera - tury i
ciśnienia).
31
Zasada stanów odpowiadających
sobie...
0,5
1,0
1,5
2,0
-1,0
0,0
1,0
lg P/P
k
Z
Ar
CH
4
0,5
1,0
1,5
2,0
5,0
6,0
7,0
8,0
lg P/Pa
Z
Ar
CH
4
Zależność współczynnika kompresji argonu
i metanu od ciśnienia ...
w temperaturze zredukowanej T
r
=
1,25
w temperaturze T =300 K
32
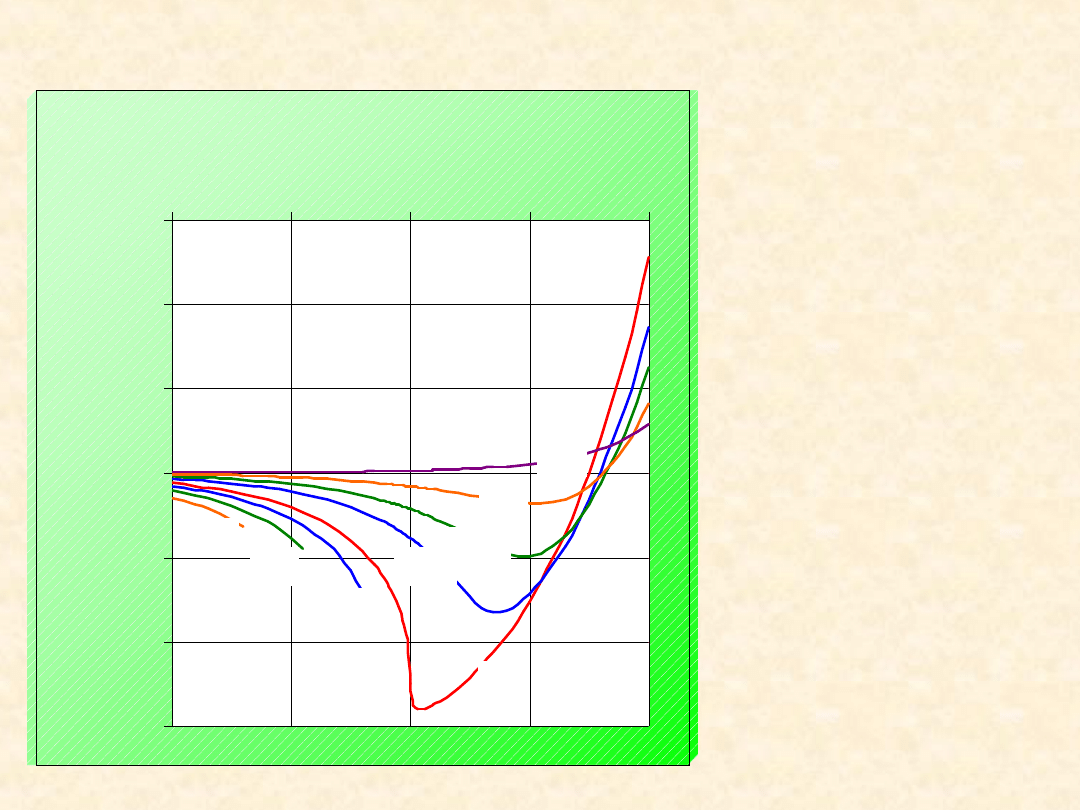
Zasada stanów odpowiadających
sobie...
Uogólniony
wykres
współczynnika
kompresji gazu
van der Waalsa
Wykreślono
izotermy
zredukowane (dla
podanych wartości
T
r
)
0,25
0,50
0,75
1,00
1,25
1,50
1,75
-1,0
-0,5
0,0
0,5
1,0
lg P/P
k
Z
1,0
1,25
1,50
2,0
4,0
0,9
0,8
0,7
33
Zasada stanów odpowiadających
sobie...
Drugi współczynnik wirialny i temperatura
Boyle’a gazu van der Waalsa...
m
m
m
m
m
m
RTV
a
V
b
RTV
a
b
V
V
RT
PV
Z
1
1
(4
0)
Rozwinięcie w szereg Taylora
3
3
2
2
1
1
1
m
m
m
m
V
b
V
b
V
b
V
b
(4
1)
34
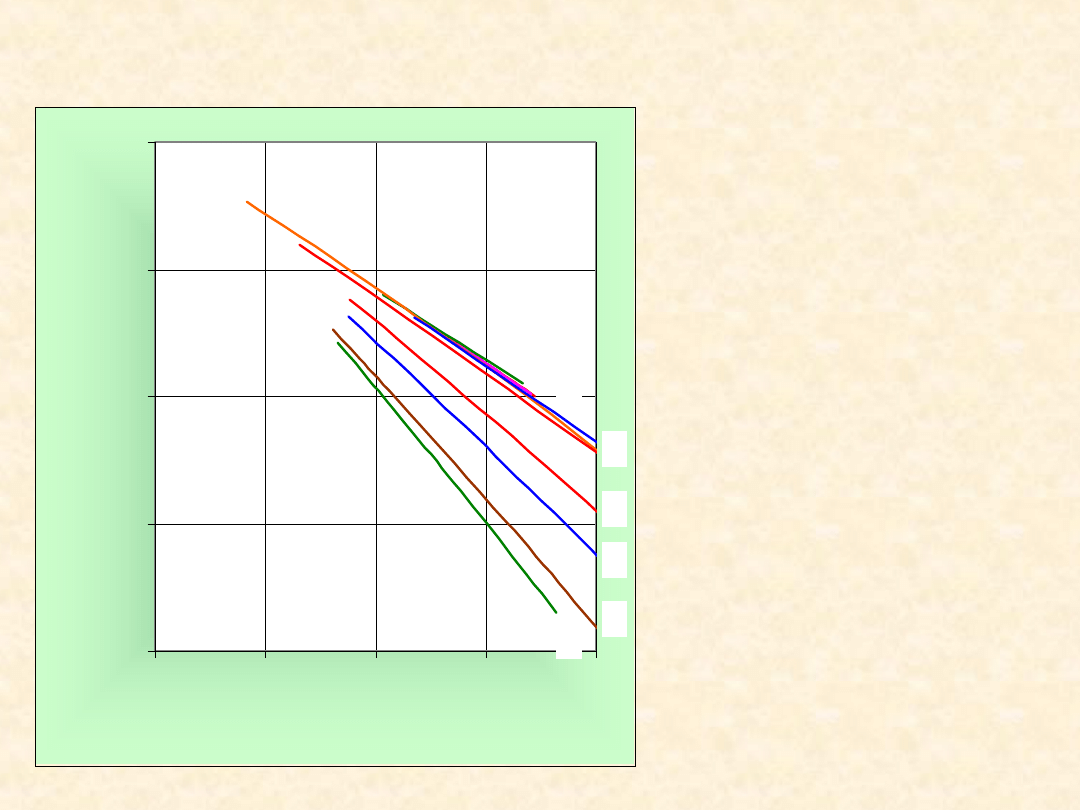
Drugi współczynnik wirialny i temperatura
Boyle’a gazu van der Waalsa...
(4
2)
(4
3)
3
3
2
2
1
m
m
m
V
b
V
b
V
RT
a
b
Z
RT
a
b
T
B
)
(
r
k
r
r
T
V
B
T
B
8
9
3
1
375
3
8
27
,
.
k
B
r
B
T
T
T
(4
4)
(4
5)
35
-1,00
-0,75
-0,50
-0,25
0,00
0,0
1,0
2,0
3,0
4,0
T/T
k
B
/V
k
1
2
3
4
5
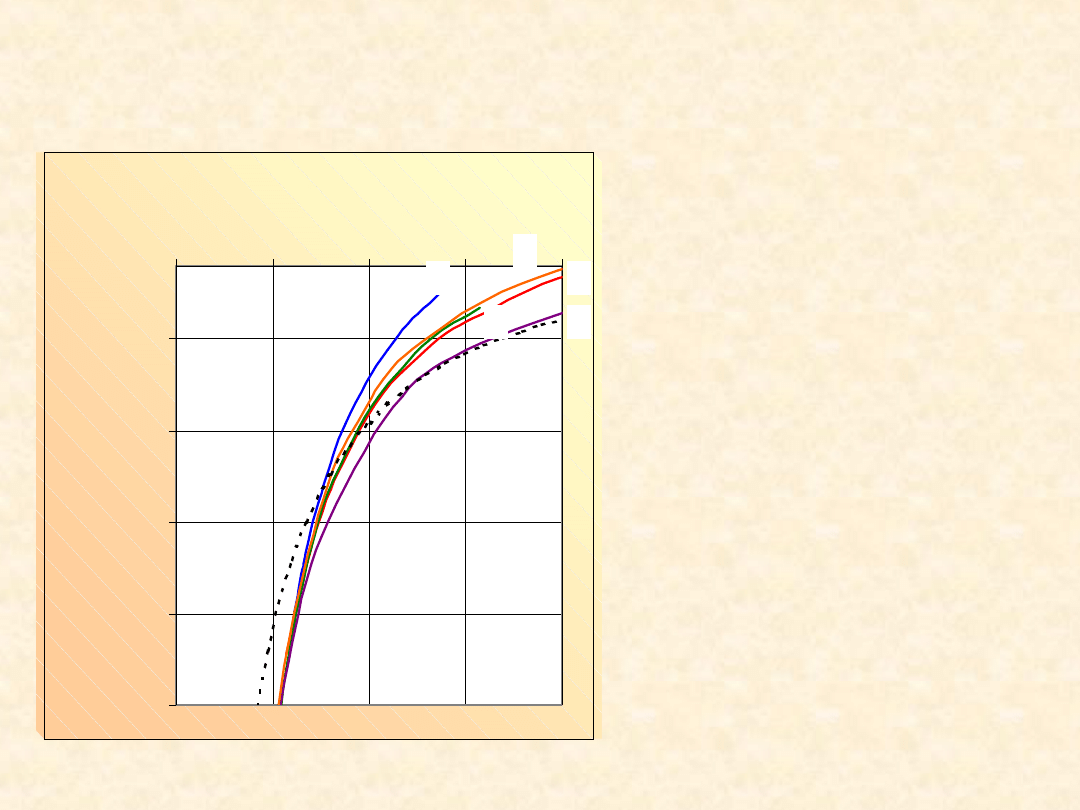
Drugi współczynnik wirialny i temperatura
Boyle’a gazu van der Waalsa...
1- Ar
2 - CF
4
3 - CH
4
4 - H
2
5 - N
2
---- - obliczona
(44)
36
Zasada stanów odpowiadających
sobie...
Analiza metodami termodynamiki statystycznej...
•Energia potencjalna oddziaływania dwóch drobin
(V) musi być funkcją wyłącznie odległości środków
ich mas (r) - warunek taki mogą spełniać w
przybliżeniu drobi- ny o symetrii zbliżonej do
kulistej.
•Zależność V(r) daje się opisać wspólnym wzorem
zawierającym wyłącznie stałe indywidualne dla gazu;
np. wzorem Lennarda - Jonesa
6
12
r
k
r
l
r
V
i
i
•
Pomijalne są efekty kwantowe, tzn. V(r)
opisuje funkcja ciągła.

37
Zasada stanów odpowiadających
sobie...
Poprawienie „dopasowania” przez wprowadzenie
parametru będącego miarą asymetrii drobin -
czyn- nik acentryczny K. S. Pitzera
(1955)....
Formalna ekstrapolacja równania Clausiusa -
Clapeyrona do punktu krytycznego...
1
T
T
RT
H
P
P
k
k
p
k
ln
r
r
T
a
P
1
1
ln
(46a
)
(46
b)
38
Zasada stanów odpowiadających
sobie...
0 - Ar, Ne, Kr
1 - CO, CH
4
,
N
2
2 - n - butan
3 - H
2
O
4 - metanol
5 - etanol
-4,0
-3,0
-2,0
-1,0
0,0
1,00
1,25
1,50
1,75
2,00
T
k
/T
L
g
(
P
/P
k
)
0
1
2
3
4
5
Zredukowana
prężność pary
nasyconej

39
Zasada stanów odpowiadających
sobie...
Zredukowana prężność pary nasyconej helowców...
70
0,
k
T
T
10
0,
k
P
P
0
1
70
0
,
)
,
(
lg
r
r
T
P
(47)
Czynnik acentryczny zdefiniowany jako...
00
1
70
0
,
,
lg
r
r
T
P
Pły n
A r
C H
4
C O
C O
2
H
2
O
C H
3
O H
-0,002 0,013 0,041 0,225 0,348 0,556

40
Trójparametrowa (rozszerzona)
zasada stanów odpowiadających
sobie - Pitzer (1955)
(48)
Tablice B. I. Lee oraz M. G. Keeslera
(1975) oraz równania interpolacyjne
udostępniają wartości z
(0)
oraz z
(1)
r
r
r
r
r
r
P
T
z
P
T
z
P
T
z
Z
,
,
,
)
(
)
(
)
(
2
2
1
0

41
9.4. Zredukowane
równania stanu
uwzględniające czynnik
acentryczny
Wykład 9a
42
Równanie Soave - Redlicha -
Kwonga...
(4
9)
(50
)
b
V
V
a
b
V
RT
P
m
m
m
Forma ogólna:
Skorelowane współczynniki:
c
a
a
k
k
k
k
c
P
RT
P
RT
a
2
2
42748
0
1
2
9
1
3
1
,
2
2
1
15613
0
55171
1
48508
0
1
r
T
,
,
,
k
k
k
k
P
RT
P
RT
b
08664
0
3
1
2
3
1
,

43
Równanie Soave - Redlicha -
Kwonga...
(51
a)
Współczynnik kompresji:
0
2
2
3
AB
Z
B
B
A
Z
Z
2
2
1
42748
0
2
9
1
3
1
r
r
r
r
T
P
T
P
A
,
r
r
r
r
T
P
T
P
B=
008664
0
3
1
2
3
1
,
(51
b)
(51
c)

44
Równanie Penga - Robinsona...
(5
2)
(53
)
Forma ogólna:
Skorelowane współczynniki:
b
V
b
b
V
V
a
b
V
RT
P
m
m
m
m
c
a
a
k
k
c
P
RT
a
2
45724
0,
2
2
1
26992
0
54226
1
37464
0
1
r
T
,
,
,
k
k
P
RT
b
07780
0,

45
Równanie Penga - Robinsona...
(54
a)
Współczynnik kompresji:
0
2
3
1
3
2
2
2
3
B
B
AB
Z
B
B
A
Z
B
Z
2
42572
0
r
r
T
P
A
,
r
r
T
P
B= 007780
0,
(54
b)
(54
c)

46
Dzielny nauczyciel umie innych
nauczyć nawet tego, na czym sam się
nie zna.
Tadeusz Kotarbiński, (1886 – 1981), filozof,
logik i prakseolog polski.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
Wyszukiwarka
Podobne podstrony:
13 ZMIANY WSTECZNE (2)id 14517 ppt
!!! ETAPY CYKLU PROJEKTU !!!id 455 ppt
2 Podstawowe definicje (2)id 19609 ppt
2 Realizacja pracy licencjackiej rozdziałmetodologiczny (1)id 19659 ppt
02 MAKROEKONOMIA(2)id 3669 ppt
11b Azotowanie i nawęglanie (PPTminimizer)id 13076 ppt
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
2 Urazy zębów u pacjentów dorosłych klasyfikacje (2)id 19701 ppt
1 Choroby układu pokarmowego(1)id 9116 ppt
Wyznaczanie pojemności cieplnej właściwej Cp gazów - dok, Obliczanie dla pomiaru pierwszego:
więcej podobnych podstron