
Czynniki fizykochemiczne kierujące migracją
substancji w roztworach wodnych.
Równowaga roztworów wodnych
w procesie migracji.
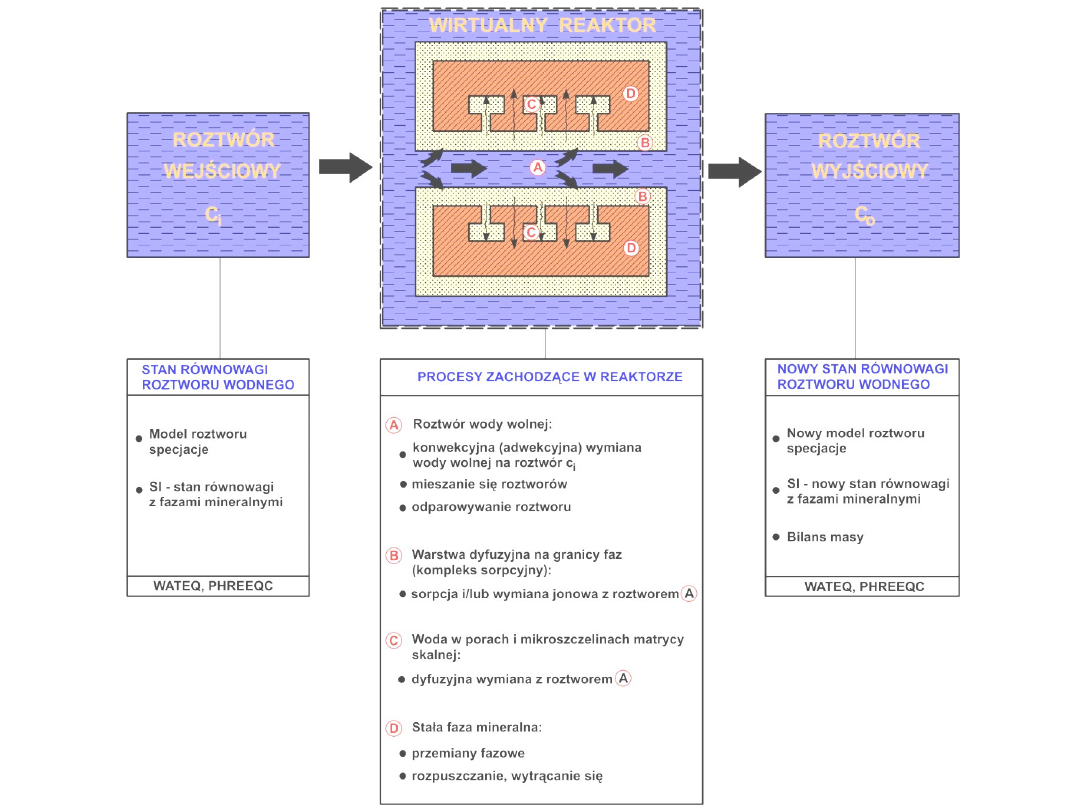

GŁÓWNE CZYNNIKI KSZTAŁTUJĄCE SKŁAD WÓD
PODZIEMNYCH
Czynniki fizykochemiczne:
Rozpuszczanie i ługowanie skał znajdujących się w
środowisku;
Rola pH i Eh;
Sorpcja i wymiana jonowa;
Dyfuzja, osmoza i ultrafiltracja (odwrócona osmoza);
Wpływ pól fizycznych (grawitacyjne, magnetyczne);
Czynniki geologiczno-geograficzne
Czynniki biologiczne
Czynniki antropogeniczne

JEDNOSTKI STOSOWANE W OBLICZENIACH
HYDROGEOCHEMICZNYCH
mg/dm
3
miligramy na litr próbki
ppm
(parts per million) = mg/kg próbki
ppb
(parts per billion) = g/kg próbki
mmol/dm
3
milimole na litr próbki = milimolarność
mval/dm
3
miligramorównoważniki na litr próbki
M
mole na kg H
2
O = molalność
mM
milimole na kg H
2
O
Molalność
M
jest używana w obliczeniach równowagowych.
Posiada tę przewagę, że jest wyrażona na kg H
2
O co
powoduje,
że jest niezależna od zmian gęstości wynikających ze
zmian temperatury i zmian stężeń innych składników.

Przeliczenia jednostek na mmol/dm
3
mmol/dm
3
=
mg/dm
3
masa
molowa
mmol/dm
3
=
ppm •
masa
molowa
- gęstość roztworu [kg/dm
3
]
mmol/dm
3
=
mval/dm
3
ładunek jonu
mmol/dm
3
= M •
(
waga roztworu – waga substancji
rozpuszczonej
) •
1000
waga roztworu

Stężenie substancji m
i
:
G
i
– ilość substancji, mol
M
V
– masa rozpuszczalnika (wody), kg
V
i
i
M
G
m
[mol/kgH
2
O]

i
– współczynnik aktywności i-tego jonu w roztworze, –
m
0
i
– stężenie idealnego 1–molalnego roztworu i-tej substancji,
mol/kgH
2
O
(stan standardowy)
Aktywność substancji a
i
:
a
i
=
i
m
i
i
0
i
i
0
i
i
i
i
m
m
1
m
m
a

Siła jonowa roztworu :
z
i
– wartość ładunku i-tego jonu
[mol/kgH
2
O]
2
i
n
1
i
i
z
m
2
1
Współczynnik aktywności
i
:
A, B – współczynniki (stałe) zależne od temperatury
d
i
– parametr zależny od promienia jonu znajdującego się w roztworze
wg teorii Debyea-Hückela (dla < 0,1):
i
2
i
i
d
B
1
z
A
log
wg teorii Daviesa (dla < 0,5):
3
,
0
1
z
A
log
2
i
i
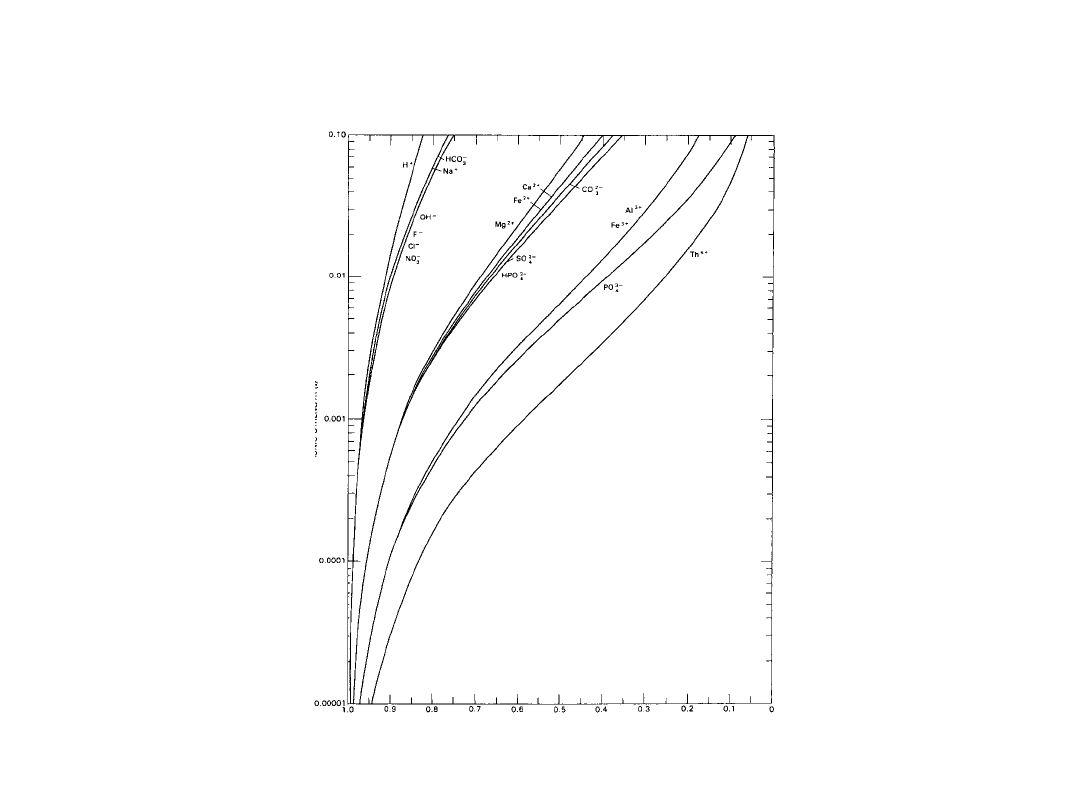
Zależność współczynnika aktywności jonów w roztworze
od siły jonowej roztworu w temperaturze 25ºC (wg Hem,
1989)
Współczynnik aktywności jonów
S
ił
a
j
o
n
o
w
a
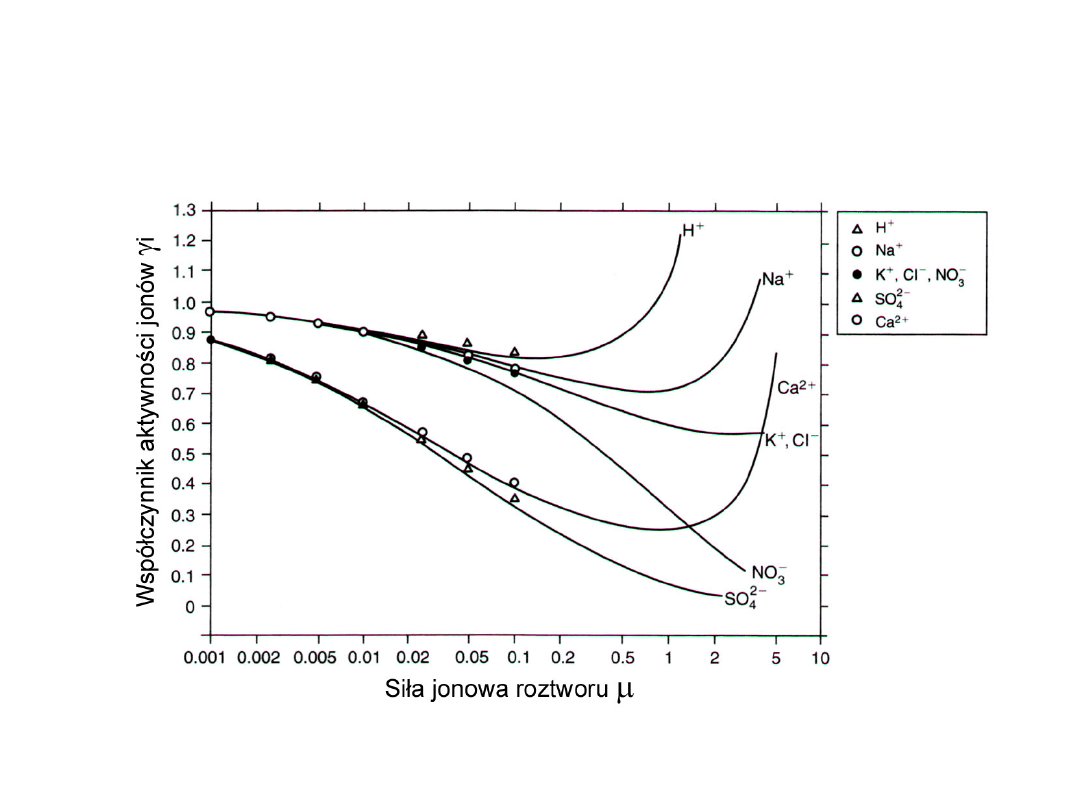
Zależność współczynnika aktywności jonów w roztworze od
siły jonowej roztworu (wg Garrels, Christ, 1965 za Appelo,
Postma, 2005)

RÓWNOWAGA ROZTWORÓW WODNYCH W PROCESIE
MIGRACJI
Prawo działania mas:
a
A
, [A] – aktywność substancji A
K – stała równowagi (K = const dla stałej temperatury i ciśnienia)
K
[B]
[A]
[D]
[C]
b
a
d
c
aA + bB = cC + dD
K
a
a
a
a
b
B
a
A
d
D
c
C

RÓWNOWAGA ROZTWORÓW WODNYCH W PROCESIE
MIGRACJI
Iloczyn rozpuszczalności:
A
n
B
m
= nA
+
+ mB
-
K
]
B
[A
]
[B
]
[A
m
n
m
-
n
[A
n
B
m
]
= 1
[A
+
]
n
[B
-
]
m
= K =
S
AnBm
S
AnBm
– iloczyn rozpuszczalności substancji A
n
B
m
[A
+
]
n
[B
-
]
m
– iloczyn jonowy

CaF
2
= Ca
+2
+ 2F
-
Przykład:
Woda krąży w skałach zawierających fluoryt CaF
2
. Ocenić
w jakim stopniu woda może się nasycić jonami
fluorkowymi F
-
.
[Ca
+2
] [F
-
]
2
= S
CaF2
= 3,125
10
-11
[Ca
+2
] = 0,5[F
-
]
0,5[F
-
]
3
= 3,125 10
-11
[F
-
] = 3,969 10
-4

F
F
F
a
m
F
1
m
F
=
3,969
10
-4
[mol/kgH
2
O]
c
F
7,54 [mg/dm
3
]
Jak na rozpuszczalność substancji wpływa siła jonowa?
= 0,01
F
0,9
c
F
8,38 [mg/dm
3
]
Wzrost siły jonowej roztworu zwiększa rozpuszczalność
substancji

Jak na rozpuszczalność substancji wpływa obecność jonów
jednoimiennych?
Ca
1
c
Ca
= 20,04 [mg/dm
3
] 20,04 [mg/kgH
2
O]
Przykład:
Skałę zawierającą fluoryt ługuje woda, która ma zawartość
jonów wapniowych 20,04 mg/dm
3
.
m
Ca
= 5 10
-4
[mol/kgH
2
O]
F
1
c
F
4,75 [mg/dm
3
]
Obecność jonów jednoimiennych zmniejsza rozpuszczalność
substancji
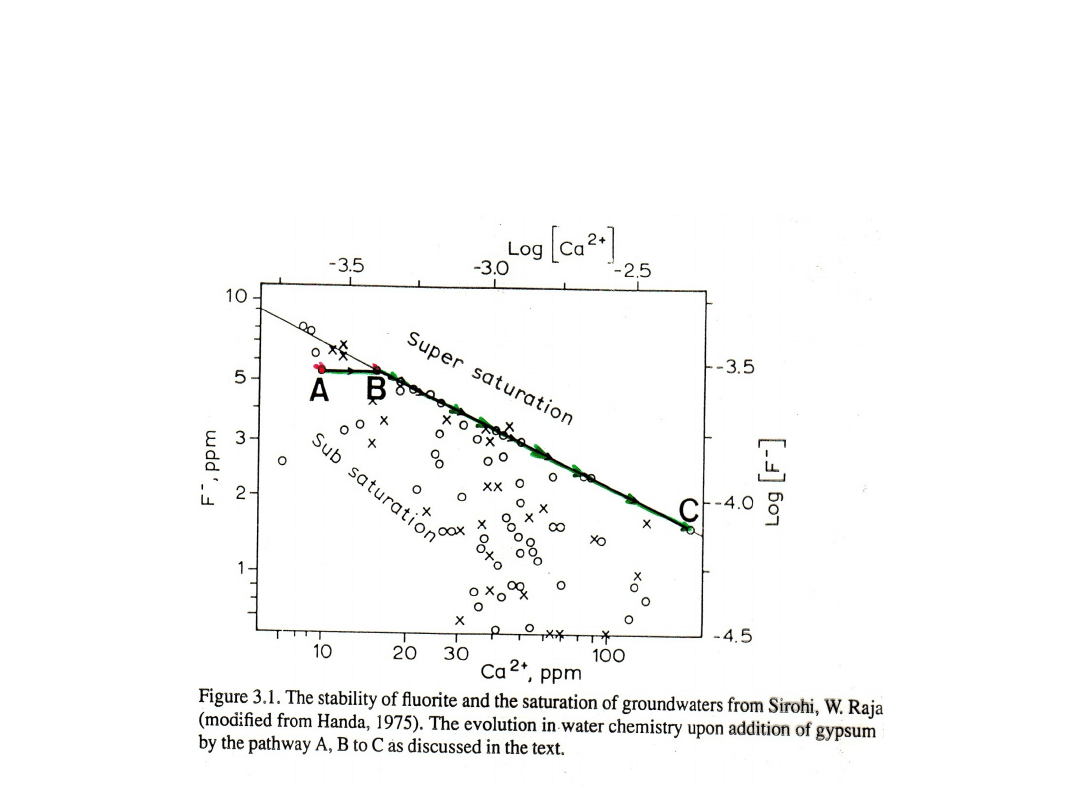
Przykład:
Wykorzystanie dodatku jonów jednoimiennych przy
uzdatnianiu wody pitnej z nadmierną ilością fluorków

Przykład:
Umiejętność oceny procesu rozpuszczania gipsu zależnie od
składu roztworu ługującego
CaSO
4
∙ 2H
2
O = Ca
+2
+SO
4
2-
+2H
2
O
[Ca
+2
] ∙[SO
4
2-
] =
S
gips
D<A<B<C

Procesy rozpuszczania z udziałem
gazów
• Przykład rozpuszczania wapieni w
obecności CO
2
CaCO
3
+ H
2
O + CO
2
→ Ca
2+
+2HCO
3-
K
pCO
HCO
Ca
2
2
3
2
]
[
]
[
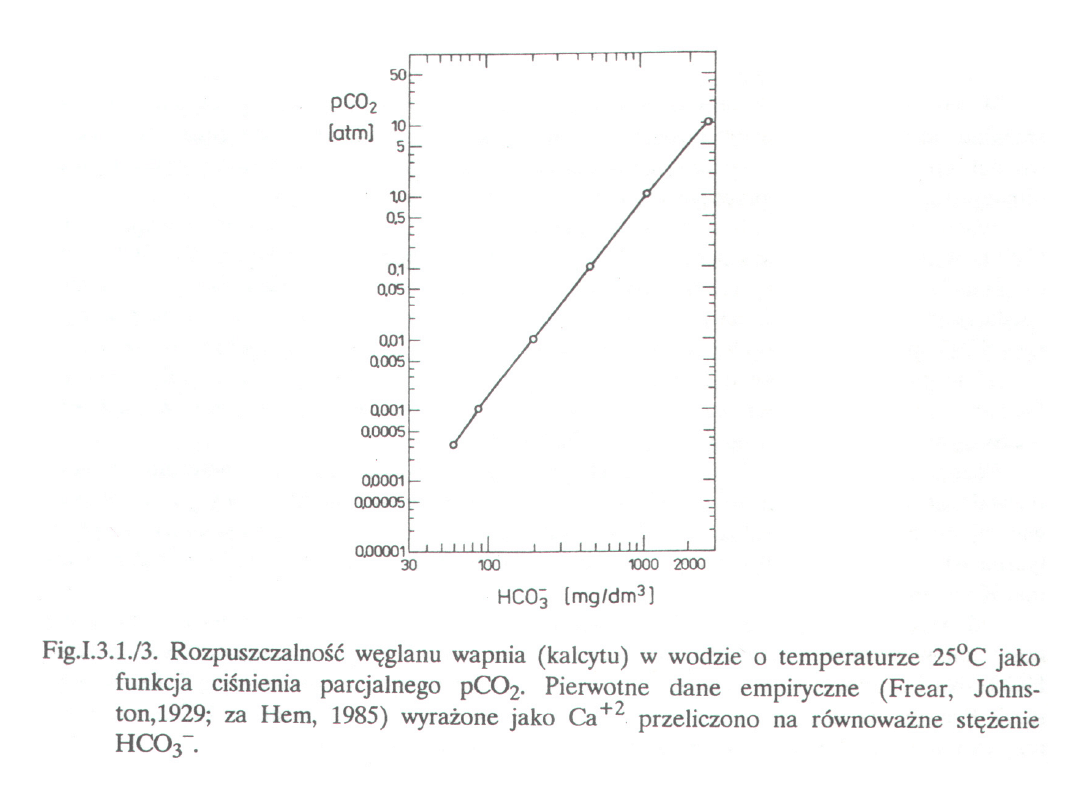

Procesy ługowania skał
• Przykład ługowania glinokrzemianów w
obecności CO
2
Na AlSi
3
O
8
+ CO
2
+5.5 H
2
O →
→ 0.25 Al
4
(Si
4
O
10
)(OH)
8
+ Na
+
+HCO
3-
+ 2
H
4
SiO
4
K
pCO
SiO
H
HCO
Na
2
2
4
4
3
]
[
]
[
]
[
albit
kaolinit

ROZPUSZCZALNOŚĆ TYPOWYCH SOLI (18°C)
CaCO
3
0,013 g/dm
3
MgCO
3
0,020 g/dm
3
Na
2
CO
3
193,9 g/dm
3
CaSO
4
2,01
g/dm
3
MgSO
4
354,3 g/dm
3
Na
2
SO
4
168,3 g/dm
3
CaCl
2
731,9 g/dm
3
MgCl
2
558,0 g/dm
3
NaCl
358,6 g/dm
3
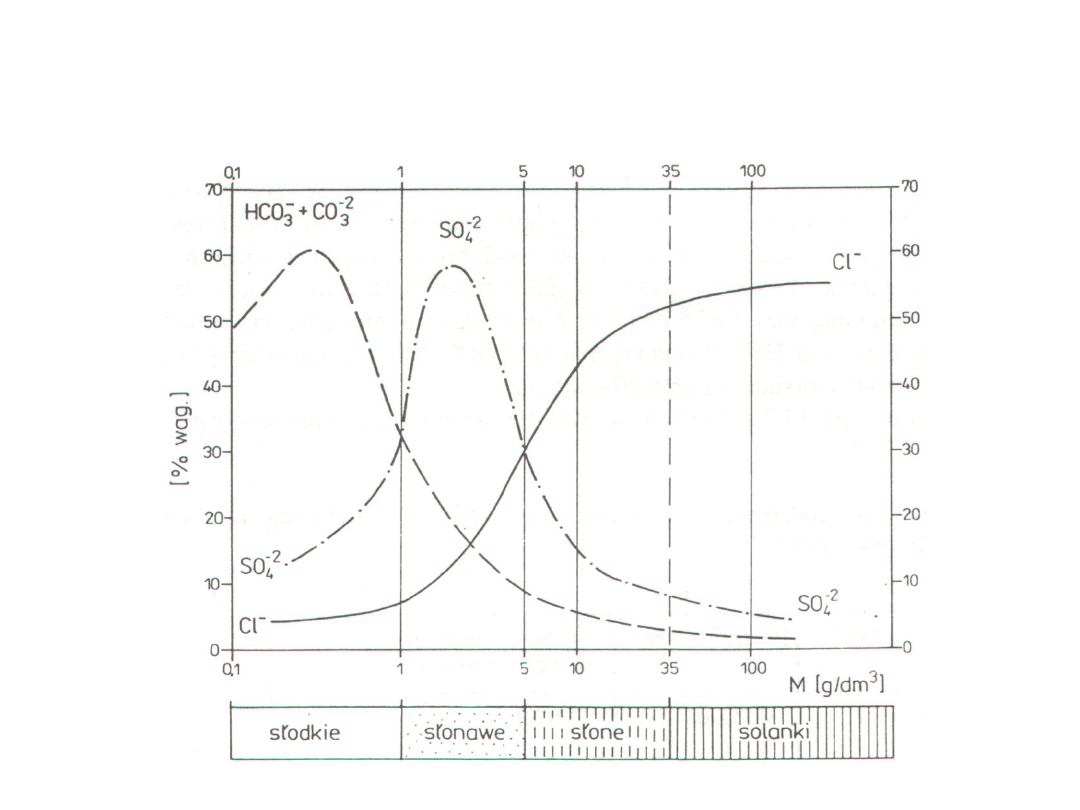
Diagram ilustrujący zmiany udziału głównych anionów w %
wagowych wraz z rosnącą mineralizacją (wg Witczak,
Adamczyk, 1994)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
RÓWNOWAGI W ROZTWORACH WODNYCH 2, Chemia
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
38 Równowagi jonowe w roztworach wodnych (dysocjacja, iloczyn jonowy wody, pH, indykatory pH, roztwo
stezenie molowe roztworow wodnych 2
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
1 5 1 Reakcje w roztworach wodnych
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
reakcje w roztworach wodnych, Studia, I rok, I rok, I semestr, Chemia I
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
13 Równowagi w roztworach elektrolitów słabych
1 Równowagi w roztworach elektrolitów Kwasy i zasady
6 pHelek ul, Temat: Równowaga w roztworach elektrolitów
więcej podobnych podstron