
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
Wykład dla III roku Chemii UJ
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
dr hab. Marek Mac
Techniki elektrochemiczne

2
Podział metod elektrochemicznych
1. Potencjometryczne:
Potencjał elektrody jest funkcją stężenia analitu
np. Miareczkowanie potencjometryczne
2. Konduktometryczne:
Przewodnictwo (lub opór) jest funkcją stężenia analitu
np. Miareczkowanie konduktometryczne
3. Woltamperometria
Mierzymy prąd płynący między elektrodami o zmieniającym się
potencjale.
np. Polarografia, cyklowoltamerometria
4. Elektrolityczne
Mierzymy masę produktów elektrolizy
3
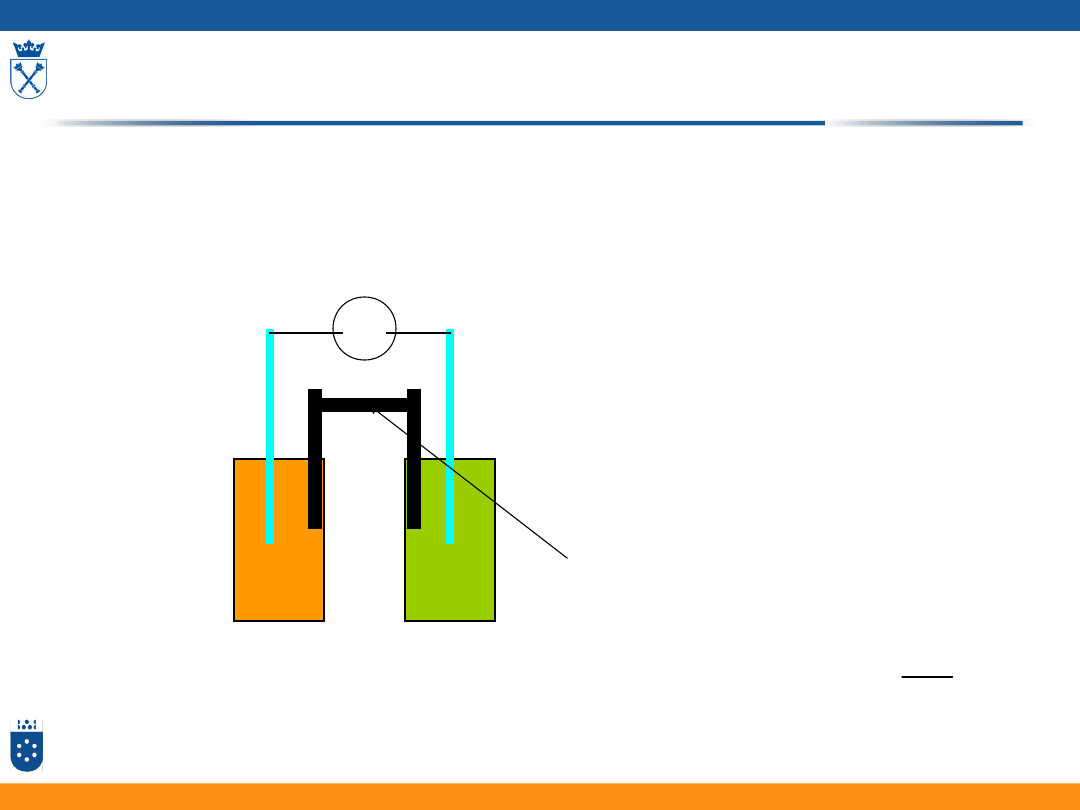
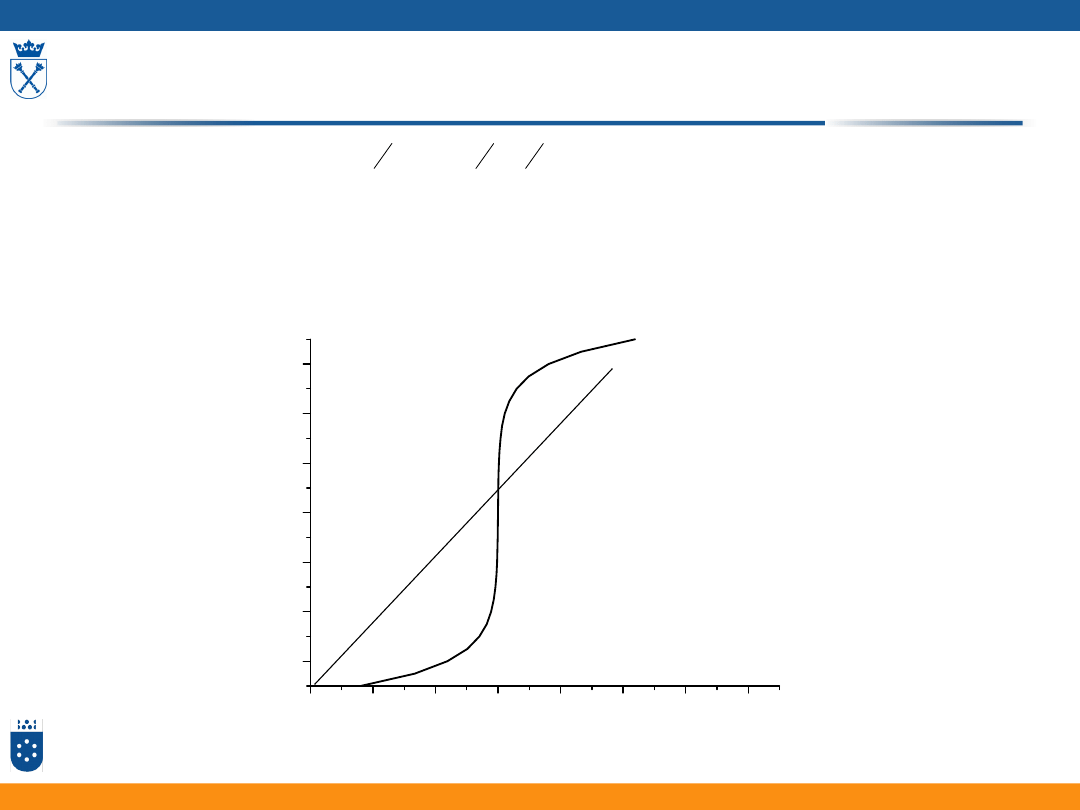
Potencjometria
1. Potencjometria bezpośrednia
Z pomiaru potencjału elektrody wyznaczamy aktywność badanego jonu
V
Roztwór badany Elektroda odniesienia
Klucz elektrolityczny
Elektroda pomiarowa,
np.. Elektroda jonoselektywna
x
a
zF
RT
E
E
ln
0

4
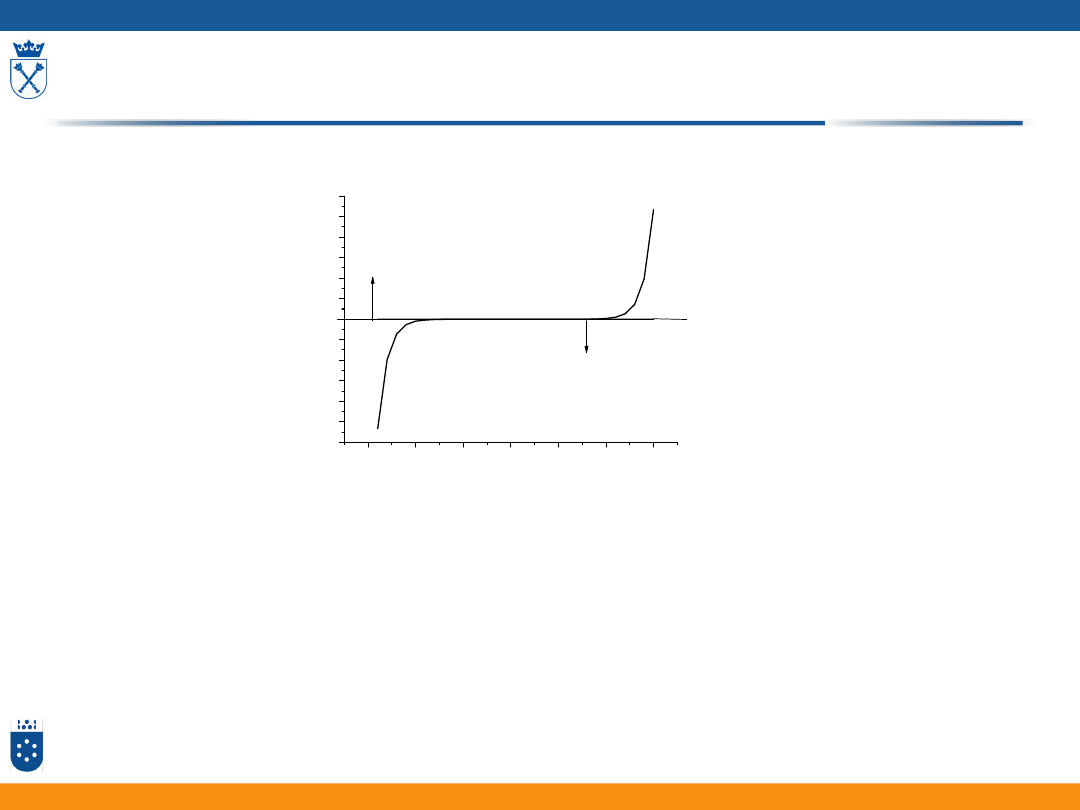
Konduktometria
Konduktometria bezpośrednia
Metoda całkowicie nieselektywna
Zastosowanie:
1. Gdy interesuje nas globalne stężenie jonów
np. W procesach zmiękczania wody
2. W kontroli procesów chemicznych, gdy produktem jest jeden produkt
3. Gdy selektywność osiągamy innymi środkami chemicznymi
l
A
L
5
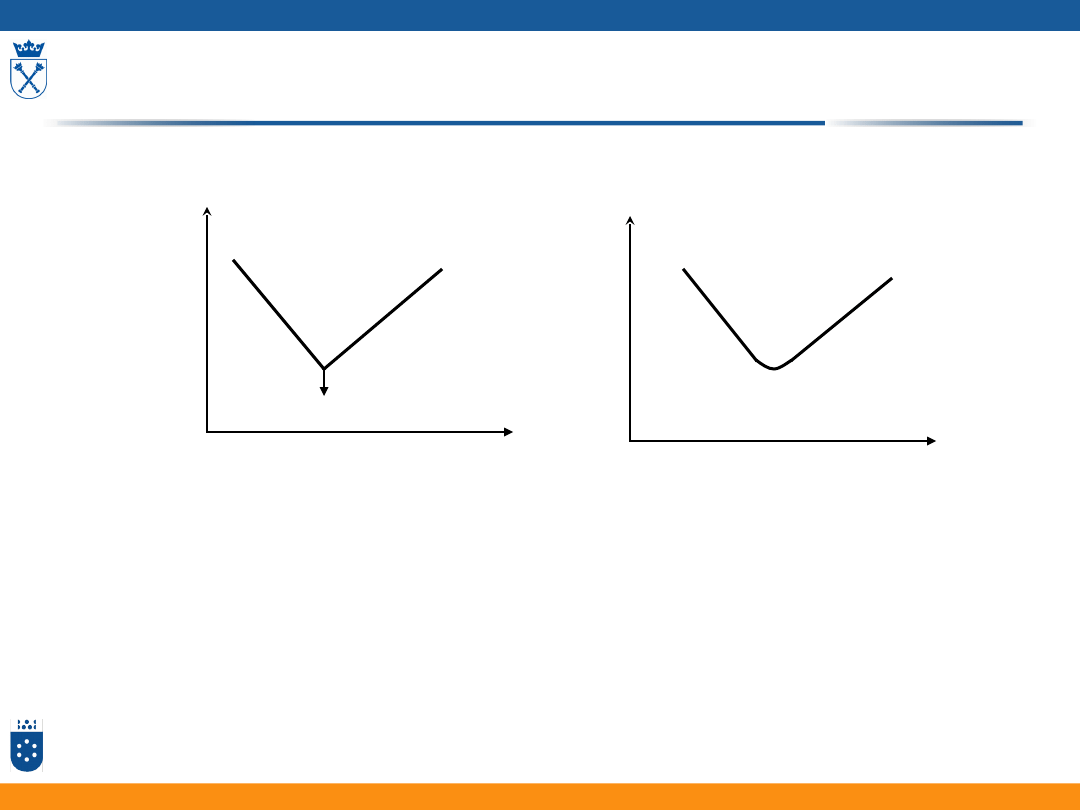
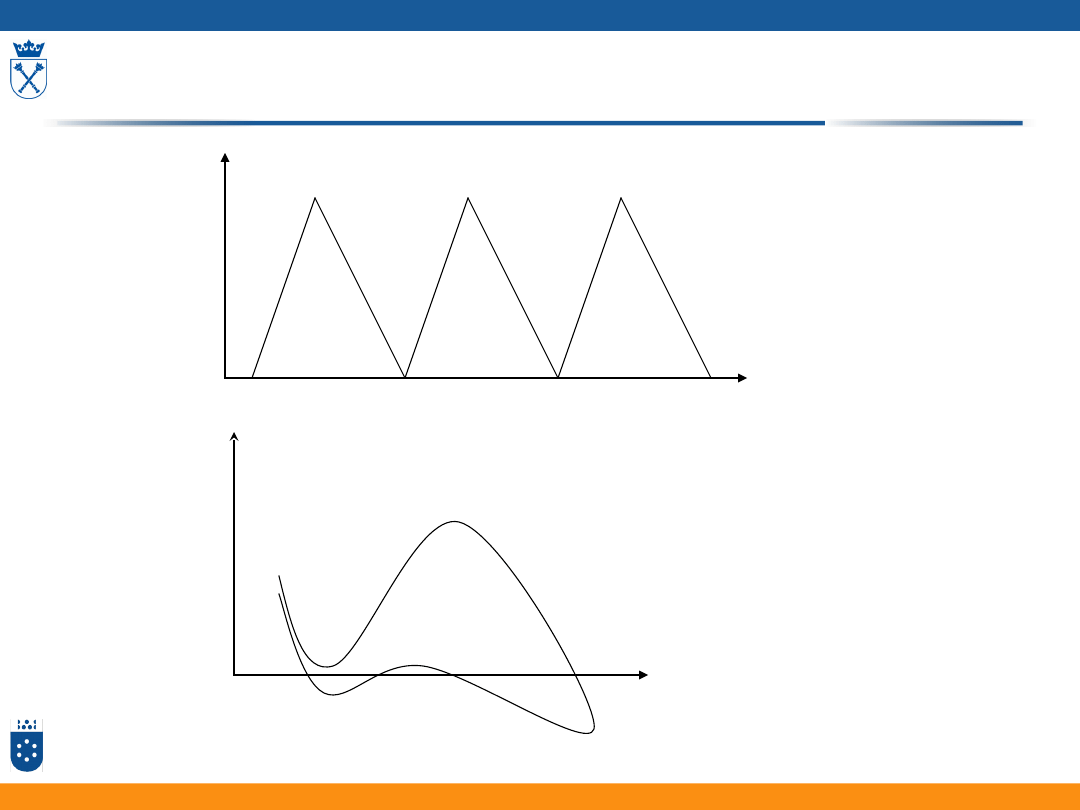
Miareczkowanie konduktometryczne
V
t
V
t
Miareczkowanie silnego
kwasu silną zasadą
Miareczkowanie strąceniowe
P
K
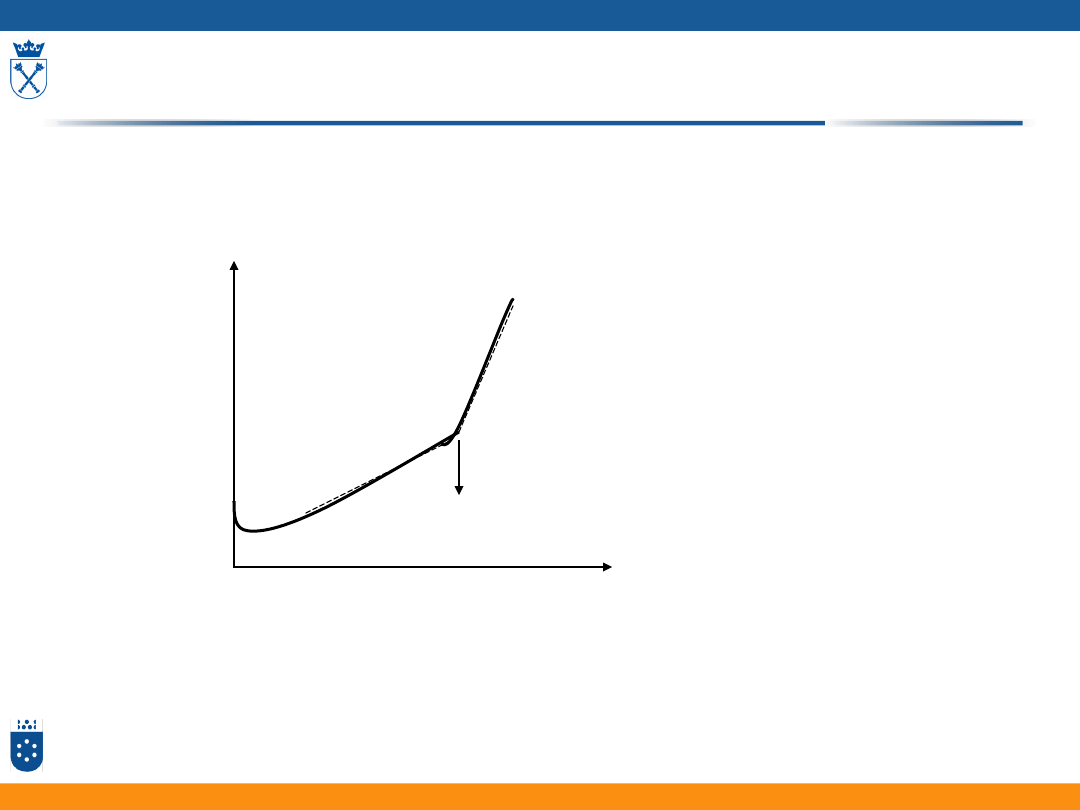
6
PK
CH
3
COOH + NaOH=CH
3
COO
-
+Na
+
+H
2
O
V
NaOH
L
7
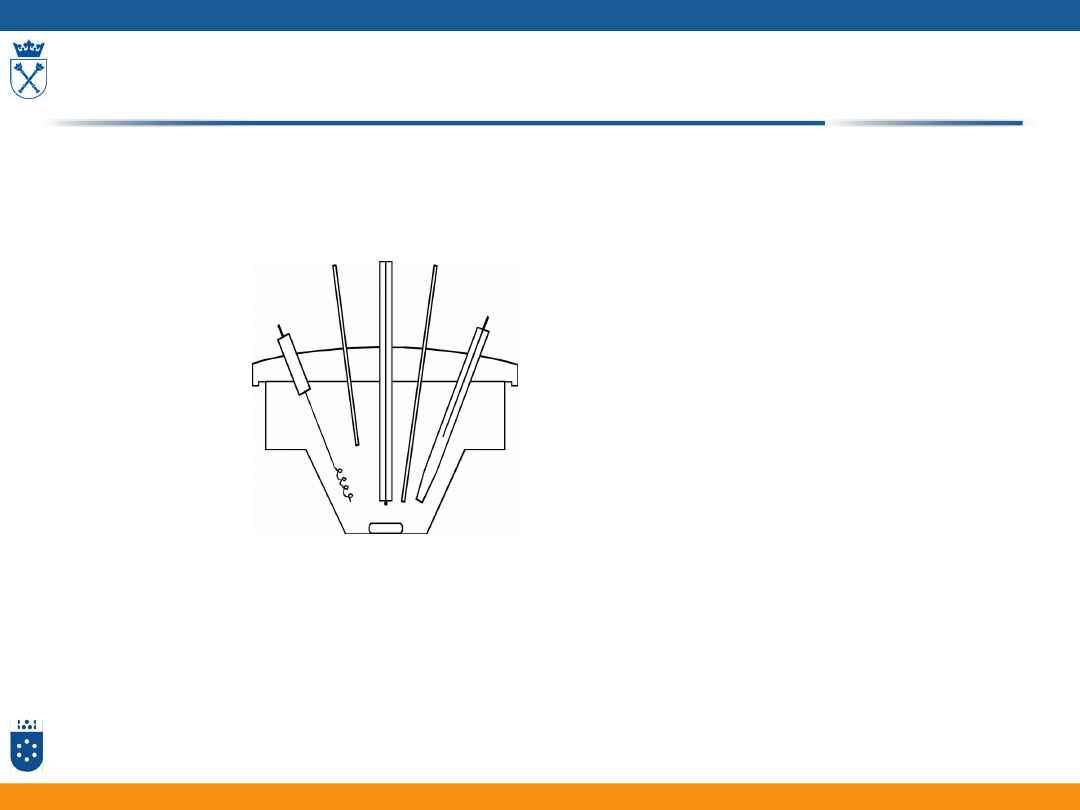
Woltamperometria –
pomiar gęstości prądu w funkcji przyłożonego
potencjału do elektrody
Naczynie woltamperometryczne
Stałe elektrody wskaźnikowe, elektroda odniesienia (AgCl, Hg
2
Cl
2
)
Depolaryzator – substancja oznaczana
Woltamperometria

8
Elektroda pracująca: mała powierzchnia i duża polaryzowalność
(tzn. silna zależność j vs , tzn. mały prąd wymiany j
0
)
0
zFj
RTj
Elektroda odniesienia: duża powierzchnia i mała polaryzowalność
(tzn. słaba zależność j vs , tzn. duży prąd wymiany j
0
)
Elektroda pomocnicza; zamknięcie obwodu, prąd przepływa poprzez
elektrody pracującą i pomocnicza
Eliminacja tlenu podczas pomiaru:
O
2
+2H
+
+2eH
2
O
2
H
2
O
2
+2H
+
+2e 2H
2
O
W środowisku kwaśnym
Woltamperometria

9
O
2
+2H
2
O+2e H
2
O
2
+2OH
-
H
2
O
2
+2e 2OH
-
W środowisku obojętnym lub zasadowym
Elektrolit podstawowy – nie uczestniczy w reakcjach
elektrodowych, o stężeniu znacznie większym
od stężenia depolaryzatora (KCl, KNO
3
, LiClO
4
)
Usuwanie tlenu – przedmuchiwanie argonem lub dodatek Na
2
SO
3
Prąd jest związany z utlenianiem lub redukcją depolaryzatora
Trzy etapy procesu:
1. Doprowadzenie depolaryzatora do elektrody pracującej
2. Proces chemiczny
3. Odprowadzenie produktów od elektrody
10
]
[
2
1
2
1
2
3
A
V
CAD
kn
i
p
Równanie Randlesa - Sevcika:
i
czas
k - stała równa 669000; n - ilość elektronów biorących udział w reakcji
elektrodowej; C - stężenie depolaryzatora w głębi roztworu [mol/cm
3
]; A -
powierzchnia elektrody [cm
2
]; D - współczynnik dyfuzji jonu depolaryzatora
[cm
2
/s]; V - szybkość polaryzacji [V/s].
11
Polarografia
i
E/V
-1V
0.5V
0
kroplowa elektroda Hg
Praca w zakresie potencjałów –1.5 – 0.2 V
Równanie Ilkovica:
]
[
3
/
2
6
/
1
2
/
1
mA
m
t
knCD
i
dyf
12
Woltamperometria cykliczna
t
i
13
-2,0
-1,5
-1,0
-0,5
-8,0x10
-5
-7,0x10
-5
-6,0x10
-5
-5,0x10
-5
-4,0x10
-5
-3,0x10
-5
-2,0x10
-5
-1,0x10
-5
0,0
1,0x10
-5
-2,0
-1,5
-1,0
-0,5
-3,0x10
-3
-2,5x10
-3
-2,0x10
-3
-1,5x10
-3
-1,0x10
-3
-5,0x10
-4
0,0
5,0x10
-4
1,0x10
-3
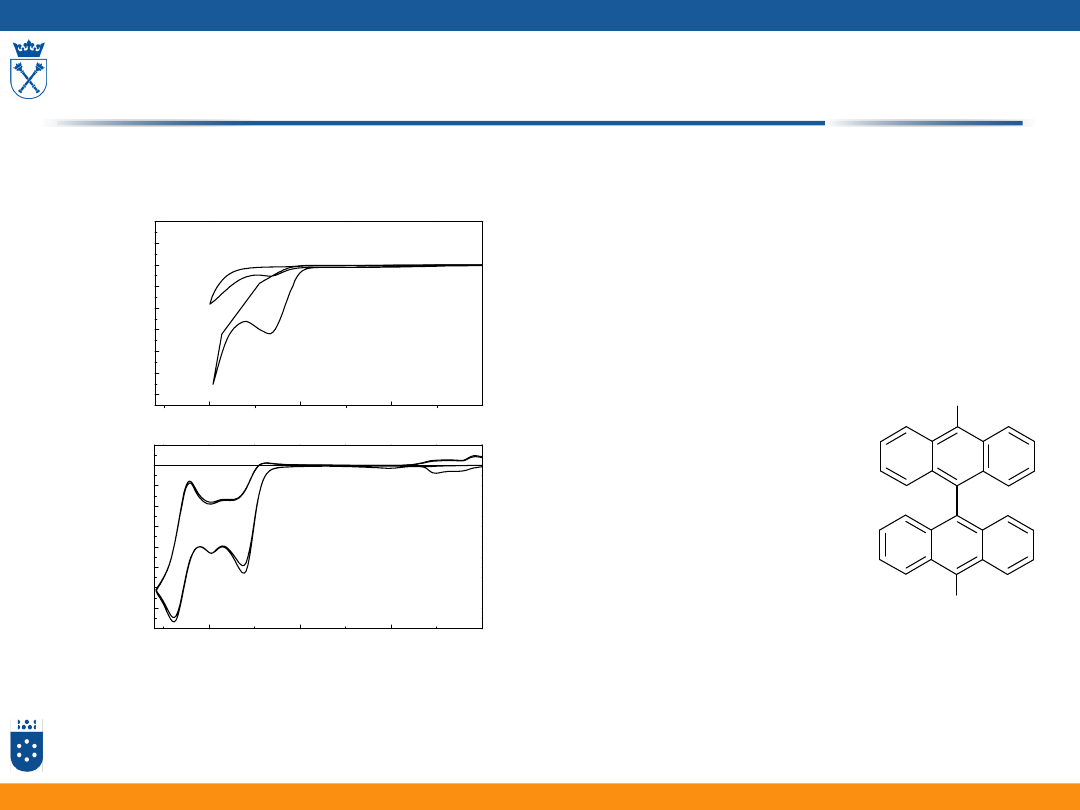
E/V vs SCE
I
kat
/A
Br
Br
W komercyjnym
ACN
W bardzo dobrze osuszonym MeCl
2
Przykład pomiarów cyklowoltamperometrycznych
(10,10’-dibromobiantryl)
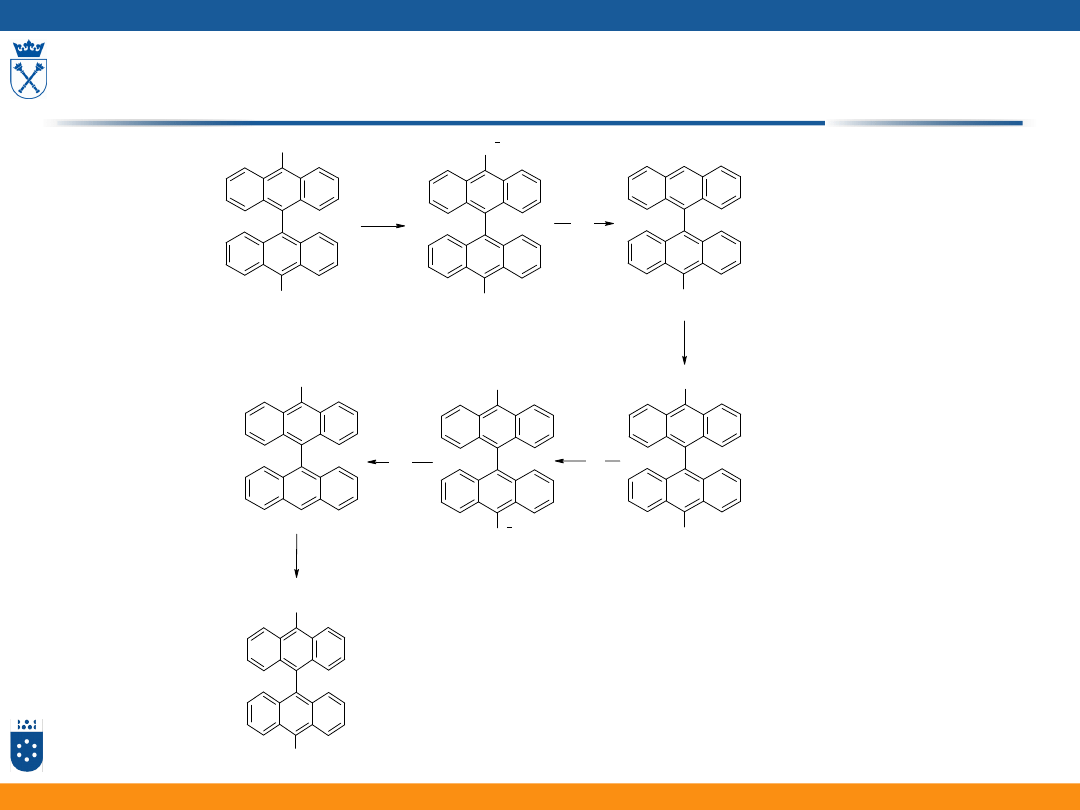
14
Br
Br
Br
Br
Br
.
H
Br
H
Br
H
H
H
+e
-Br
-
+H
2
O
+OH
.
+e
-Br
-
+H
2
O
+OH
.
W komercyjnym (zawierającym ślady wody) ACN
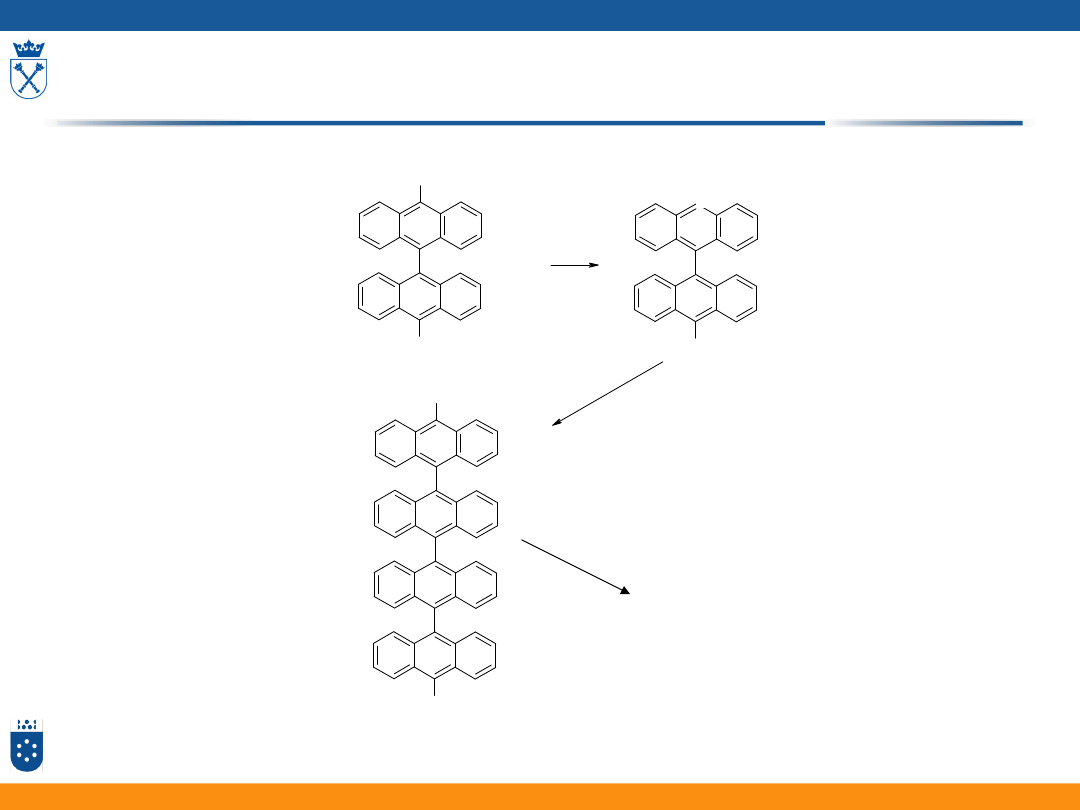
15
Br
Br
Br
Br
Br
2
+2e
2
.
W bardzo dobrze osuszonym MeCl
2
16
i
i
BrC
6
H
4
NO
2
+eBrC
6
H
4
NO
2
-
BrC
6
H
4
NO
2
-
C
6
H
4
NO
2
+Br
-
C
6
H
4
NO
2
+e C
6
H
4
NO
2
-
C
6
H
4
NO
2
-
+H
+
C
6
H
5
NO
2
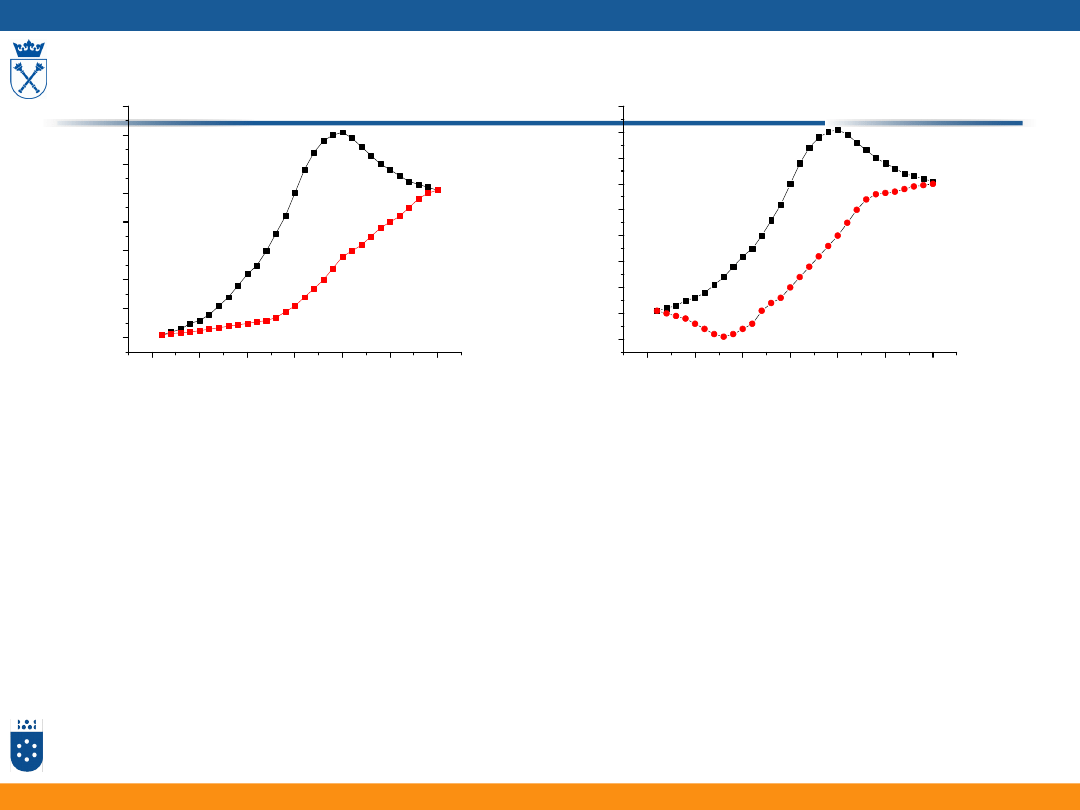
Wolne przemiatanie
szybkie przemiatanie
Szybkie i wolne przemiatanie potencjałem
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
wyklad 12nowy procesy elektrodowe i korozja
Wyklad 3b Handel elektroniczny wyniki badan
Projekt ustawy o zawodzie technika elektroradiologa, ANATOMIA I INNE, Nieuporządkowane (skog666)
07.10.12r. - Wykład -Taktyka i technika interwencji policyjnych i samoobrona, Sudia - Bezpieczeństwo
geo 1-2, Szkoła, Technikum Elektroniczne, szkoła II TA 2012;2013, Geografia
13transplot-ORT, Turystyka i rekreacja wykłady, Metody i techniki obsługi ruchu turystycznego
18obs-imprprzyj-ORT, Turystyka i rekreacja wykłady, Metody i techniki obsługi ruchu turystycznego
27rafting-ORT, Turystyka i rekreacja wykłady, Metody i techniki obsługi ruchu turystycznego
progrwyklORT-sz, Turystyka i rekreacja wykłady, Metody i techniki obsługi ruchu turystycznego
Diody1, 1. TECHNIKA, Elektryka - Elektronika, Elektrotechnika, Podstawy elektotechniki i elektroniki
Elektroenergetyka pytania na zal laboratorium, Nauka i Technika, Elektroenergetyka
Diody1, 1. TECHNIKA, Elektryka - Elektronika, Elektrotechnika, Podstawy elektotechniki i elektroniki
09kp-atnicza-ORT, Turystyka i rekreacja wykłady, Metody i techniki obsługi ruchu turystycznego
Lampowy korektor graficzny, 1. TECHNIKA, Elektryka - Elektronika, Elektrotechnika, Podstawy elektote
Zadanie egzaminacyjne - przełącznik kierunku obrotów, egzamin zawodowy technik elektryk
24turystkwalif-wstep-ORT, Turystyka i rekreacja wykłady, Metody i techniki obsługi ruchu turystyczne
Jakość energii elektrycznej, 1. TECHNIKA, Elektryka - Elektronika, Elektroenergetyka, Sieci
wykłady procesy i techniki produkcyjne
Pytania z wykładów na kolokwium z Elektroenergetyki
więcej podobnych podstron