
Ekstrakcja w układzie
ciecz - ciecz

Czym jest ekstrakcja???
Operacja służącą do rozdzielenia
mieszanin ciał stałych i ciekłych. Rozdział
następuje przez rozpuszczenie niektórych
składników mieszaniny w cieczach, zwanych
rozpuszczalnikami. Proces ekstrakcji może
zachodzić zatem w układach dwufazowych:
ciało stałe – ciecz lub ciecz – ciecz.

W ekstrakcji siłą napędową procesu jest różnica
stężeń ekstrahowanego składnika w
rozpuszczalniku pierwotnym i rozpuszczalniku
wtórnym, zatem jest to proces dyfuzyjny.
Zjawisko przebiega tak długo, aż układ osiągnie
stan równowagi termodynamicznej.

Prawo Nernsta
Procesem ekstrakcji rządzi
prawo
prawo
podziału Nernsta, które mówi:
podziału Nernsta, które mówi:
substancja rozpuszczona dzieli
substancja rozpuszczona dzieli
się pomiędzy dwa nie mieszające się
się pomiędzy dwa nie mieszające się
rozpuszczalniki w ten sposób, że w
rozpuszczalniki w ten sposób, że w
stanie równowagi stosunek stężeń
stanie równowagi stosunek stężeń
substancji rozpuszczonej w obu
substancji rozpuszczonej w obu
rozpuszczalnikach jest stały w danej
rozpuszczalnikach jest stały w danej
temperaturze.
temperaturze.
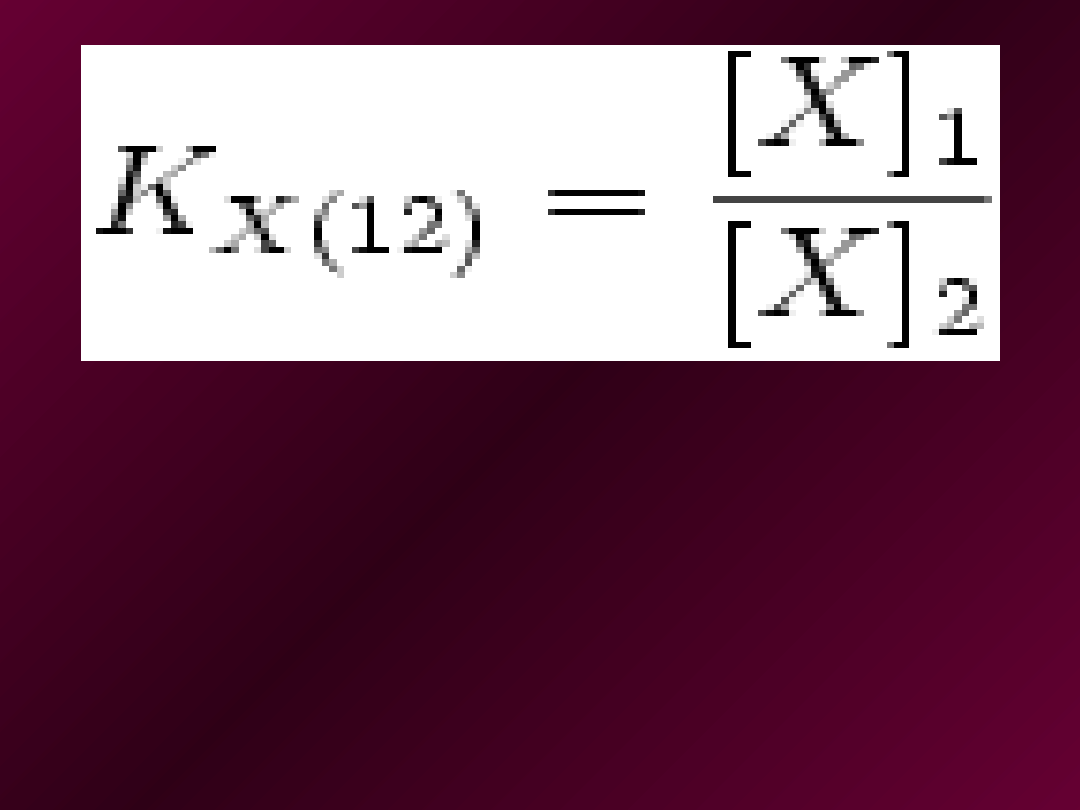
gdzie: K
X(12)
- stała podziału substancji X pomiędzy fazy "1" i
"2" (zwana też współczynnikiem podziału), [X]
i
- stężenie
substancji X w fazie "i"

Ekstrakcja w układzie
ciecz - ciecz
•
podstawowym sposobem izolowania nielotnych
trucizn organicznych była ekstrakcja ciecz - ciecz
do nie mieszających się z wodą rozpuszczalników
organicznych.
• w toku ekstrakcji następuje:
* wyizolowanie trucizn
* oczyszczenie od matrycy biologicznej
* zatężenie
* w odpowiednio dobranych warunkach podział na
podgrupy zależnie od charakteru chemicznego

Wynikiem procesu ekstrakcji ciecz – ciecz, jest
układ dwóch nie mieszających się cieczy, które
rozdziela się najczęściej w procesie filtracji
lub odwirowania.

Ekstrakcja znalazła zastosowanie w analizie
toksykologicznej, jest metodą wyodrębniania
nielotnych organicznych i nieorganicznych
związków trujących z materiału biologicznego
.

Przygotowanie materiału
biologicznego do ekstrakcji
Odbiałczanie i odtłuszczanie:
•
stosowane różne substancje: kw. wolframowy,
nadchlorowy, trichlorooctowy, etanol, siarczan
amonowy
•
odbiałczanie prowadzone w temp. 60 – 100 stopni,
co przyspiesza proces i zwiększa rozpuszczalność w
wodzie substancji trudno lotnych
•
etap ten zapobiega przed pienieniem materiału
biologicznego, zanieczyszczeniem wyciągów
•
w celu odbiałczania stosuje się 2 metody:
- siarczanowo – wolframowa: w temp. wrzenia wody,
próbka + siarczan amonu+ 1M kwas siarkowy
(pH4). Mieszaninę ogrzewa się do wrzenia i
utrzymuje przez 3 minuty, sączy, a osad na sączku
przemywa wrzącą wodą, aż do uzyskania
odpowiedniej ilości przesączu

- metoda wolframowa:
do odbiałczania materiału biologicznego,
zawierającego trucizny o charakterze kwaśnym i
obojętnym, mniej przydatna dla związków o
charakterze zasadowym.
1 część materiału biologicznego homogenizuje się
z 1 częścią 25% roztworu wolframianu
sodowego i 1 częścią wody. Mieszaninę przenosi
się do kolby, homogenizator przepłukuje 4
częściami wody. Po dodaniu 1 części 50%
roztworu disiarczanu sodowego ogrzewa się na
łaźni wodnej, aż przestanie ciemnieć, sączy lub
wiruje. Przesącz ekstrahuje się
rozpuszczalnikami organicznymi : chloroform,
eter, octan etylu

Hydroliza
- wiele związków organicznych i ich metabolitów
wiąże się w ustroju z białkami, a także ulega
sprzęganiu z kwasem glukuronowym i
siarkowym.
- przed dokonaniem analizy należy związki te
wyodrębnić w postaci wolnej
- najczęściej wykonywana jest hydroliza kwaśna
- połączenia z kwasem siarkowym głównie typu
estrowego hydrolizują w trakcie ogrzewania z
rozcieńczonymi kwasami
- znacznie trudniej rozkładają się glukuronidy
(ich postacie estrowe- wymagają dodatku
stężonych kwasów w stosunku 1:1 w temp.
powyżej 100 stopni Celsjusza) lub rozłożone
mogą być pod wpływem glukuronidazy
(oznaczanie tą metodą morfiny, poch.
benzodiazepiny, TLPD)
- w stosunku do zasadowych leków:
amitryptylina, chloropromazyna używa się
proteazy alkalicznej.

Ekstrakcja rozpuszczalnikami
organicznymi:
-
dla zwiększenia wydajności stosuje się
kilkakrotną ekstrakcję rozpuszczalnikami
organicznymi.
- pierwsza metodę ekstrakcji do celów analizy
toksykologicznej opracował Stass (izolowanie
nikotyny z materiału sekcyjnego), później
zmodyfikował ją Otto. Stosowana od lat metoda
Stass – Otto stanowi klasyczny tok
postępowania w przypadku analizy
toksykologicznej trucizn organicznych z
materiału biologicznego.
- ekstrakcji podlegają jedynie leki i ich
metabolity znajdujące się w formie wolnej , nie
związane z białkami ani z kwasem
glukuronowym, siarkowym, glicyną.
- bezpośredniej ekstrakcji rozpuszczalnikami
organicznymi podlegają materiały z zatruć
przyżyciowych: mocz, osocze i surowica krwi,
zawartość żołądka

-
dla materiałów jak: krew pełna, tkanki i
narządy, mocz patologiczny (duże ilości białek,
barwników), żołądek wraz z zawartością (obfita,
śluzowata, tłusta), niektóre kosmetyki, leki
postępowanie jest 2 etapowe:
* izolowanie wstępne – zdolność rozpuszczania
trucizn ekstrakcyjnych w wodzie lub wodzie
zakwaszonej, etanolu lub etanolu zakwaszonym
w celu otrzymania czystego, kwaśnego,
zatężonego wyciągu nadającego się do ekstrakcji
właściwej
* właściwa ekstrakcja – poszukiwanych
związków z kwaśnego wyciągu do
rozpuszczalnika organicznego,

Wydajność ekstrakcji zależna jest od:
* współczynnika podziału substancji pomiędzy
fazą wodną (analizowany materiał) a fazę
organiczną (rozpuszczalnik użyty do ekstrakcji)
* stanu elektrochemicznego izolowanych
związków

Do rozpuszczalników organicznych przechodzą
w trakcie ekstrakcji substancje:
* obojętne
* kwasowe
*zasadowe
w formie niezdysocjowanej, bowiem
nierozpuszczalne w wodzie, lepiej rozpuszczają
się w rozpuszczalnikach organicznych, dzięki
czemu mogą być łatwiej ekstrahowane.

Związki organiczne – leki o charakterze
słabych kwasów lub zasad występują w fazie
wodnej częściowo w formie niezjonizowanej,
częściowo zjonizowanej.

Zmiana pH (alkalizacja bądź zakwaszanie)
poddawanej ekstrakcji fazy wodnej
powoduje przeprowadzenie poszukiwanej
trucizny w postać niezdysocjowaną i zależnie
od charakteru chemicznego umożliwia jej
wydajną ekstrakcję z odpowiednio dobranego
środowiska.
* związki o charakterze kwasowym
przeprowadza się w postać
niezdysocjowaną przez zakwaszenie
kwasami : winowym, solnym, fosforowym lub
siarkowym
* związki o charakterze zasadowym przez
alkalizację roztworami NaOH, KOH, Na
2
CO
3
,
NH
4
OH.

Lipofilowe substancje o charakterze obojętnym
występuje w fazie wodnej w formie
niezjonizowanej mogą być izolowane ze
środowisk o różnym pH (jeśli nie ulegają
rozkładowi pod wpływem kwasów lub alkaliów).

Na przedstawionych wyżej zasadach opiera
się ekstrakcja nielotnych trucizn organicznych
połączona z ich równoczesnym podziałem na
podgrupy zależnie od charakteru
chemicznego, co stanowi podstawę toku
postępowania w oszukiwaniu nieznanej
trucizny.

• Według Stass – Otto próbę poddaje się
kolejnym ekstrakcjom różnymi
rozpuszczalnikami organicznymi zmieniając pH
próby:
1.
eterem ze środowiska kwaśnego (pH 3 – 4),
leki kwasowe i obojętne, np. kw. salicylowy,
aspiryna, fenacetyna, barbiturany
2.
eterem ze środowiska zasadowego ( NaOH;
pH 9 –10) – leki zasadowe, np. strychnina,
papaweryna, chinina, poch. fenotiazyny. Po
wyekstrahowaniu substancji tej grupy wodny
roztwór zakwaszony kwasem solnym
alkalizujemy amoniakiem
3.
eterem ze środowiska amoniakalnego (pH 9-
10) – leki zasadowe, np. apomorfina. Ten sam
roztwór po odparowaniu eteru poddajemy
ekstrakcji gorącym chloroformem.

4.
Chloroformem ze środowiska amoniakalnego
( pH 9-10) – leki amfoteryczne, np. morfina
5. Substancje pozostałe w roztworze wodnym,
nie ekstrahujące się wymienionymi
rozpuszczalnikami organicznymi.
Zastosowanie wieloetapowego procesu
ekstrakcji umożliwia rozdzielenie trucizn na
mniejsze podgrupy, a następnie ich
wykrywanie przy zastosowaniu grupowych lub
specyficznych reakcji chemicznych, prób
biologicznych oraz metod fizycznych.

Wady klasycznej metody Stass – Otto i jej
licznych odmian:
•
długotrwały tok wyosabniania trucizny
• mała wydajność
• uzyskiwanie ekstraktów zanieczyszczonych
ciałami balastowymi
• konieczność użycia dużej ilości materiału
biologicznego
• powstawanie emulsji w toku reakcji
• niewystarczająca wykrywalność
• zużycie dużej ilości odczynników do ekstrakcji

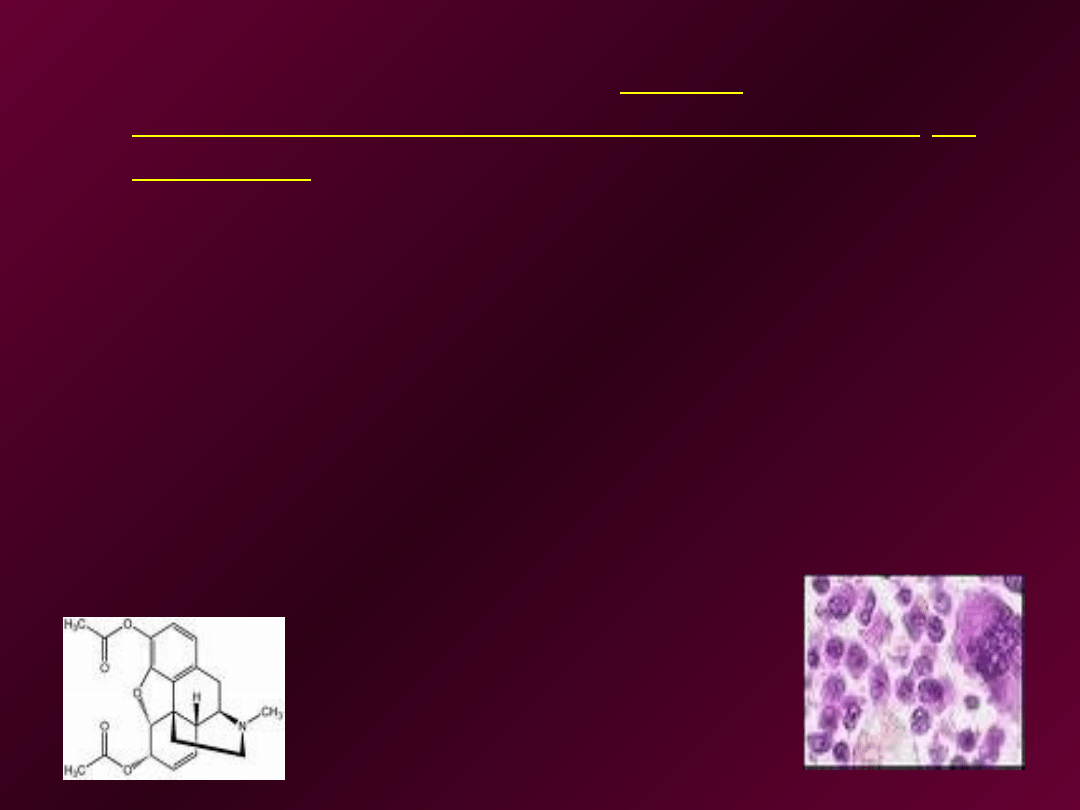
Ekstrakcja próbki moczu
•
do 10 ml moczu należy dodać odpowiednią ilość
kw. fosforowego albo kw. winowego do uzyskania
pH3.
• następnie należy prowadzić ekstrakcje 2*30ml
eterem, połączyć wyciągi eterowe, przemyć 5 ml
wody, dodać roztwór do próbek i zachować wodny
roztwór do ekstrakcji.
• frakcja A mocnych kwasów: następnie należy
prowadzić ekstrakcje 5ml nasyconym roztworem
Na
2
CO
3
i zachować wodny roztwór do zbadania
obecności salicylanów
• frakcja B słabych kwasów: ekstrahować roztwory
eterowe 5ml 0,5M NaOH i zachować ekstrakty dla
wykazania obecności barbituranów i innych słabych
kwasów

c.d.
• obojętna frakcja C: należy przemyć roztwory
eterowe wodą, zlać pozostałość po płukaniu i
wysuszyć roztwór bezwodnym siarczanem sodu i
pozostawić do odparowania. Osad może zawierać
leki o charakterze obojętnym
• Zasadowa frakcja D: do wodnego roztworu
zachowanego po pierwszej ekstrakcji należy dodać
rozcieńczony roztwór amoniaku do uzyskania pH8.
Ekstrakcje należy przeprowadzić używając 2*10ml
chloroformu, przemyć połączone ekstrakty wodą,
przesączyć, dodać niewielką ilość kw. winowego
aby zapobiec utracie lotnych zasad. Następnie
odparować do sucha, otrzymany osad może
zawierać związki o charakterze zasadowym

• frakcja E: doprowadzić wodny roztwór
uzyskany po frakcji D do pH3 dodając kw.
solny, ogrzewać do 100 stopni przez 30 min,
oziębić i ekstrahować 2*10ml eterem.
Zachować wodny roztwór. Przemyć eterowe
ekstrakty 5ml 1M NaOH i odparować eter do
sucha. Osad może zawierać benzofenony
(frakcja E)
• Frakcja F: doprowadzić zachowany roztwór
wodny do pH 9, oziębić, ekstrahować
mieszaniną octanu etylu i izopropanolu (9:1).
Odparować warstwę rozpuszczalnika do
sucha. Osad może zawierać opiaty


Ekstrakcja zawartości
żołądka
• w celu przeprowadzenia ekstrakcji wszelkie
fragmenty kapsułek i tabletek oraz materiały
sproszkowane powinny być usunięte i zawieszone
w wodzie.
• jeśli próbka zawiera resztki pokarmu lub
wydzieliny, powstaną trwałe emulsje podczas
ekstrakcji i konieczne jest wtedy ponowne
poddanie próbki ekstrakcji.
• w celu wyekstrahowania należy dodać nadmiar
stałego siarczanu amonu z kilkoma kroplami 10%
kw.fosforowego, po czym ogrzać i dokładnie
wymieszać, a następnie odsączyć zawartość
próbki.
• przesącz jest później poddany ekstrakcji tak jak w
przypadku ekstrakcji z użyciem próbki moczu.

Ekstrakcja próbki krwi
• Ponieważ próbki krwi, osocza i surowicy są
małe i tylko niewielka ilość leków może być w
nich łatwiej wykryta i oznaczona ta metoda
ekstrakcji może nieznacznie różnić się od
ekstrakcji w moczu czy zawartości żołądka.

• Początkowa ekstrakcja jest przeprowadzana przy
pH 4 ponieważ wiele zasadowych leków jest
odzyskiwanych przez ekstrakcje chloroformem
przy tym samym pH. W rezultacie szukana
substancja będzie najprawdopodobniej w frakcji
B lub C, a przygotowanie frakcji D jest
konieczne albo do upewnienia się, że nic nie
zostało przeoczone lub jeśli lek nie został
znaleziony we frakcji C lub B
• do 4ml próbki dodać 2ml buforu fosforanowego
(pH 7,4) i 40ml chloroformu. Wstrząsnąć
energicznie, dodać ok. 2g bezwodnego siarczanu
sodu i wstrząsnąć znowu aby otrzymać stabilną
postać. Następnie należy przelać chloroform
przez sączek, ekstrahować masę 20ml
chloroformu i połączyć ekstrakty chloroformu.

• frakcja A mocnych kwasów: jeżeli salicylany są
obecne w ekstrakcie powinny zostać usunięte z
chloroformu przez ekstrakcje z Na
2
CO
3
• Frakcja B słabych kwasów: do chloroformowych
ekstraktów dodać 8 ml 0,5M NaOH , wymieszać
2minuty i odwirować. Roztwór NaOH może
zawierać barbiturany i inne słabe kwasy
• neutralna i zasadowa frakcja C: przemyć
roztwór chloroformu wodą , odsączyć i wysuszyć
bezwodnym siarczanem sodu. Przesączyć i
odparować do sucha, osad może zawierać leki
obojętne i zasadowe
• zasadowa frakcja D: jeśli odpowiednia ilość
wyjściowej próbki jest dostępna przygotować
należy kolejną ilość alkalicznego roztworu
używając rozcieńczonego roztworu amoniaku,
ekstrahować 2*10ml chloroformu, wysuszyć
chloroform bezwodnym siarczanem sodu i
odparować do sucha. Osad może zawierać leki
zasadowe
• zasadowa frakcja
D:
jeśli nie ma
odpowiedniej próbki wyjściowej potrzebnej do
ekstrakcji należy użyć następującej metody:
po zbadaniu próbki C przez metody
przedstawione poniżej należy rozpuścić
wszelkie pozostałości osadu w chloroformie i
ekstrahować 0,5M kw. siarkowym. Dodać ten
ekstrakt do masy siarczanu sodowego
zachowanej po pierwszej ekstrakcji, stworzyć
zasadowy roztwór używając rozcieńczonego
roztworu amoniaku i ekstrahować 2*10ml
chloroformu. Wysuszyć chloroform
bezwodnym siarczanem sodu i odparować do
sucha. Osad może zawierać zasadowe leki

Dziękuję
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Ekstrakcja ciecz ciecz4 ppt
Ekstrakcja ciecz ciecz3 ppt
Ekstrakcja ciecz ciecz4 ppt
Ekstrakcja ciecz ciecz2
Ekstrakcja ciecz ciecz2
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
13b Równowaga ciecz kryształ w układach dwuskładnikowych (b)id 15112 ppt
13a Równowaga ciecz kryształ w układach dwuskładnikowych (a)id 15105 ppt
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
poprawa druk, Uczelnia, sem I, fiza, LABORATORIUM, Nowe laborki, Ciecz
Wpływ energii mieszania na współczynnik wnikania w układzie ciało stałe - ciecz, pwr biotechnologia(
9 Stopień wyekstrahowania w układzie ciecz – ciecz
równowagi?zowe w układach trójskładnikowych typu ciecz ciecz QF25CWFHBNOJU75IQNDOXSMNI2HT3XQ4PPBF
Izotermiczna?sorpcja okresowa w układzie ciało stałe ciecz (2)
cialo stale ciecz 1Edytka2
Ciecz newtonowska, Studia, Studia sem IV, Uczelnia Sem IV, SIWM
więcej podobnych podstron