
Promieniotwórc
zość
Autorzy:
Aleksandra Wiktorowicz
Paulina Dobrowolska
Żaneta Dębska

Historia
promieniotwórczości
•
W
1895
roku
Wilhelm
Roentgen
odkrył
promienie
elektromagnetyczne
mające zdolność przenikania ciała
stałego. Ze względu na ich tajemniczość nazwał je promieniami
X.
•
W 1896 roku francuski fizyk Henri Becquerel badając uran
położył kawałek rudy uranu na niewywołanych kliszach
fotograficznych, dla ochrony opakowanych w czarny papier. Po
wywołaniu klisz okazało się, że nieznane promieniowanie
pochodzące z rudy wytworzyło na kliszach obraz w kształcie
kawałka rudy. Wyciągnął, więc wniosek, iż związki uranu
wysyłają promieniowanie same z siebie. Stwierdził on również,
że
uran metaliczny jest źródłem niewidzialnego promieniowania
.
•
W 1898 roku Maria Skłodowska – Curie i Piotr Curie wydzielili 1 g
aktywnej substancji z ok. 1 tony blendy uranowej. Nowa
substancja została nazwana
polonem
na cześć ojczyzny Marii
Curie – Polski. W 1903 roku Maria i Piotr Curie oraz Becquerel
otrzymali za to odkrycie Nagrodę Nobla w dziedzinie fizyki. W
1911 roku Maria Skłodowska – Curie dostała Nagrodę Nobla w
dziedzinie chemii za wydzielenie
radu – pierwiastka naturalnie
promieniotwórczego.
2

Definicja
Promieniotwórczość
– zdolność jąder
atomowych do rozpadu promieniotwórczego, który
najczęściej jest związany z emisją
cząstek alfa,
cząstek
beta
oraz
promieniowania
gamma
(promieniowanie elektromagnetyczne o bardzo dużej
energii). Na przemianę jądra nie mają wpływu czynniki
zewnętrzne takie jak: temperatura, pole magnetyczne
czy skupienie materiału promieniotwórczego.
Źródło
Aktywność
promieniotwórcza
banan
125 Bq/kg
mleko
50 Bq/l
superfosfat
500 Bq/kg
woda morska
12 Bq/l
granit
7 000 Bq/kg
popiół węglowy
2 000 Bq/kg
5-letnie dziecko
600 Bq
dorosła osoba (70kg)
10 000 Bq
3

Rodzaje
promieniotwórczości
Promieniotwórczość możemy podzielić na
promieniotwórczość
naturalną
(towarzysząca przemianom jądrowym izotopów
występujących w przyrodzie)
i
promieniotwórczość sztuczną
(zachodzącą
w jądrach atomów otrzymywanych sztucznie -
poprzez
bombardowanie
jąder
trwałych
pierwiastków cząstkami alfa oraz beta).
4
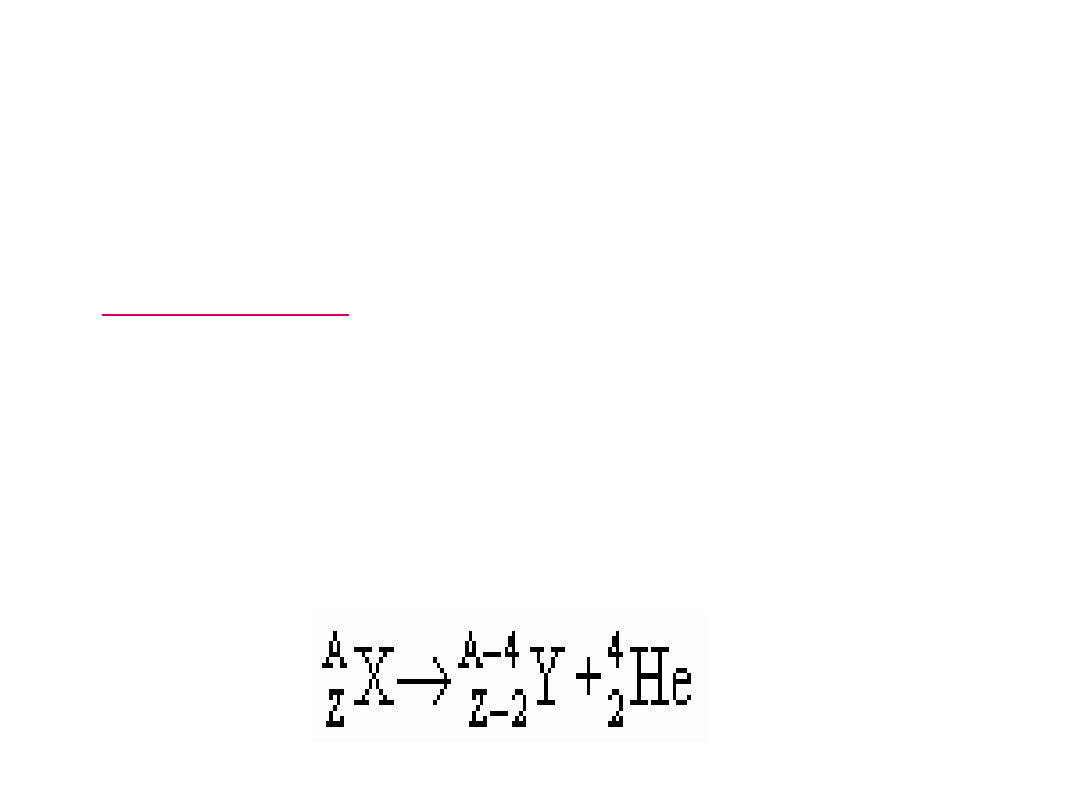
Przemiana α
5
Promienie α
są strumieniem jąder helu
, czyli
atomów helu dwukrotnie zjonizowanych. Cząstki te
mają prędkość rzędu 14000-20000 km/s i energię
rzędu kilku MeV (4-10,5 MeV).
W wyniku emisji cząstek α jądro traci dwa protony i
dwa neutrony, liczba masowa pierwiastka zmienia się o
4, liczba atomowa zaś o 2. Rozpad α symbolicznie
zapisujemy wzorem:
He
4
2
Przemiany
promieniotwórcze
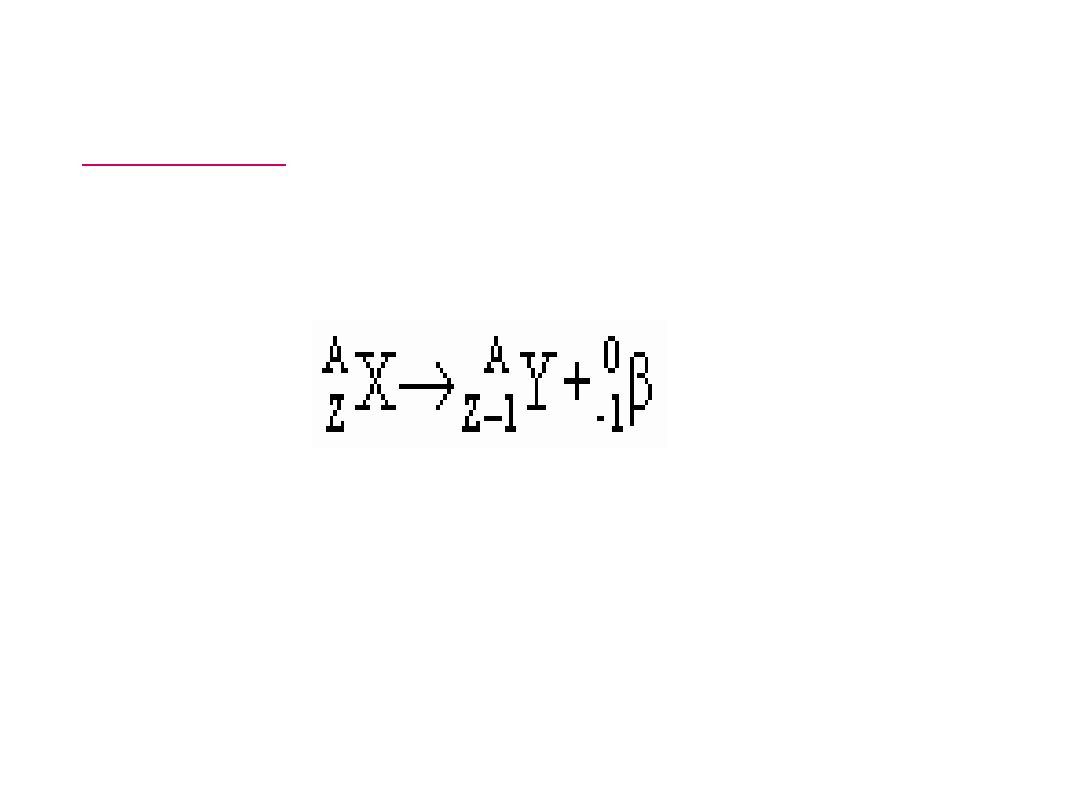
Przemiana β
6
Promienie β
są elektronami poruszającymi się z prędkościami
bliskimi prędkości światła. Przemiana β jest to taka przemiana
jądrowa, w której liczba masowa pozostaje bez zmiany, a liczba
atomowa zmienia się o 1.
Rozpad β zapisujemy symbolicznie:
Z równania przemiany β wynika, że jądro emituje w tej
przemianie elektron. Skąd się bierze elektron, skoro - jak wiadomo
– jądro zawiera tylko protony i neutrony? Okazuje się, że podczas
rozpadu β w jądrze pierwiastka następuje przemiana neutronu w
proton i elektron. Proton zostaje w jądrze, a elektron jest
wyrzucony na zewnątrz.

7
Znamy właściwie dwa rodzaje rozpadów β: rozpad β
-
i rozpad
β
+
. Rozpad β
-
, gdy jądro emituje elektron ( ), i rozpad β
+
, w
którym następuje emisja pozytonu ( )
*
. Emisji elektronu z
jądra musi towarzyszyć przekształcenie neutronu w proton, ∆Z =
+1. Natomiast emisja pozytonu jest związana z przekształceniem
protonu w neutron, ∆Z = -1:
β
-
: n p
+
+ e
-
+ γ
e
β
+
: p
+
n + e
+
+ γ
e
0
1
e
0
1
Jądro może pochłonąć jeden ze swych elektronów z powłoki
orbitalnej. Jest to tzw.
wychwyt elektronów K
, ponieważ
prawdopodobieństwo absorpcji elektronu przez jądro z powłoki K,
najbliżej położonej od jadra, jest największe.

Przemiana γ
8
Promienie γ
są przenikliwym promieniowaniem
elektromagnetycznym, którego długości fal w próżni
leżą w zakresie od 0,4 do 0,005 . Podczas przemiany
γ liczba masowa i atomowa nie ulegają zmianie, a
zmienia się jedynie energetyczny stan jądra.
Jądro znajdujące się w stanie wzbudzonym *
może powrócić do stanu o niższej energii, pozbywając
się nadmiaru energii przez wysłanie fotonu γ o energii
E = hv
**
A
X
A
Z
Reguła przesunięć Fajansa
i Soddy`ego
9
Emisji cząstek α i β towarzyszą zmiany liczby atomowej Z i
liczby masowej A pierwiastka. Emisją cząstek α i β rządzi
reguła
przesunięć Fajansa i Soddy`ego
(1921 r.):
• z wyrzuceniem cząstki α jądro traci dwa ładunki dodatnie, czyli
liczba Z maleje o 2, zatem atom przesuwa się o dwa miejsca
wstecz w układzie pierwiastków, a jego liczba masowa A maleje o
cztery jednostki;
• elektrony promieniowania β powodują utratę przez jądra
atomów po jednym ładunku ujemnym, wobec czego Z rośnie o
jednostkę, liczba masowa A zaś pozostaje niezmieniona;
• promieniowanie γ nie wywołuje zmian liczby porządkowej Z i
liczby masowej A.
Zjawisko promieniotwórczości dowodzi, że
jądra atomowe
nie są niepodzielne i mogą przekształcać się jedne w
drugie.
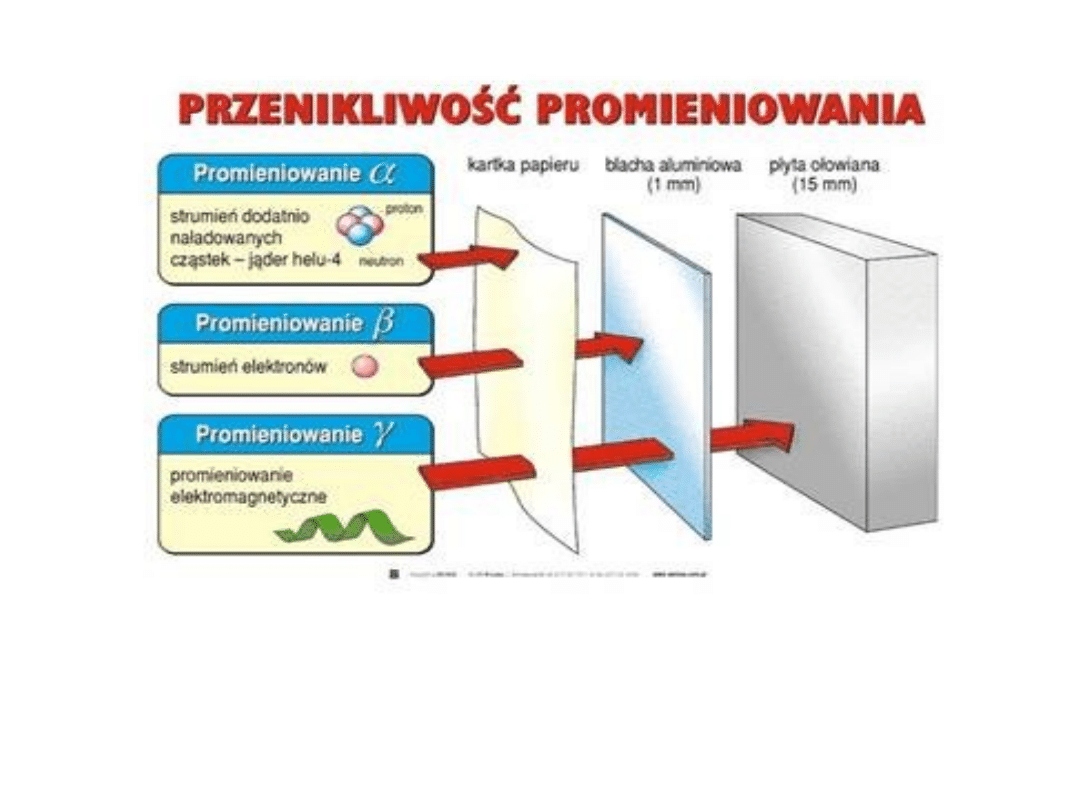
10
http://gfx2.bryk.pl/text/00026/00026285.jpg
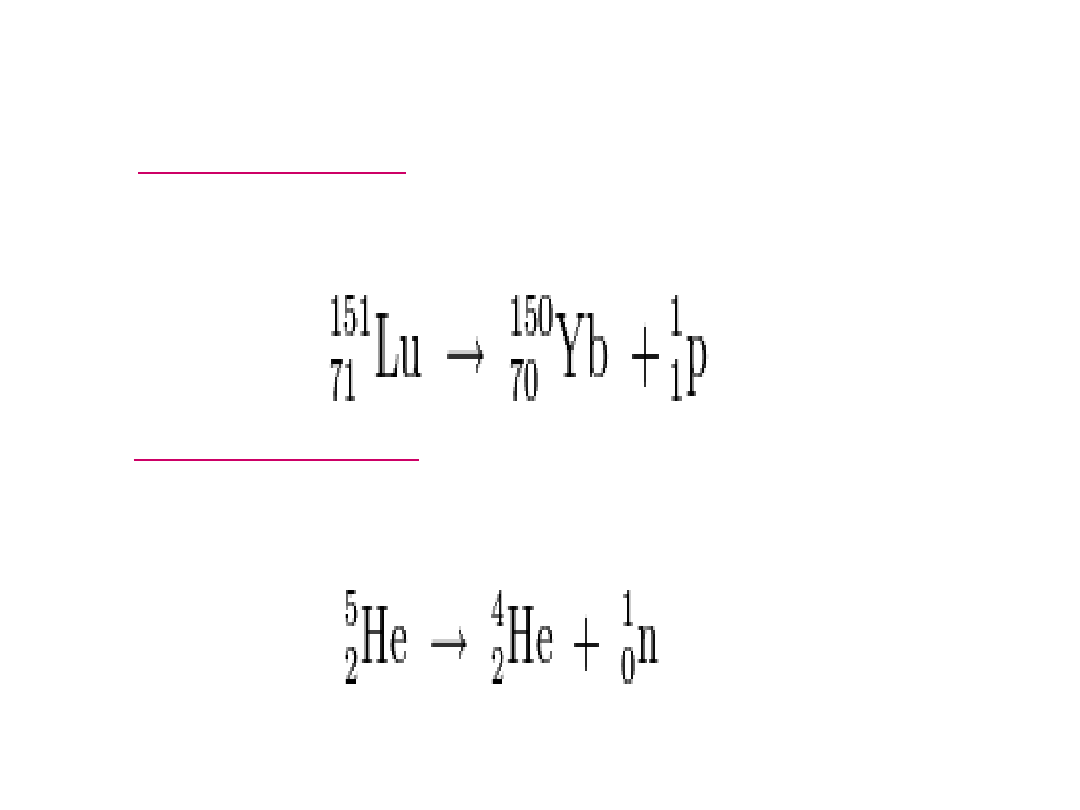
Emisja protonu i
neutronu
11
Emisja protonu
jest to reakcja jądrowa rozpadu jądra
atomowego, podczas której emitowany jest proton.
Przykładowy schemat rozpadu protonowego:
Emisja neutronu
jest to reakcja jądrowa rozpadu jądra
atomowego, podczas której emitowany jest neutron.
Przykładowy schemat rozpadu neutronowego:

12
Szeregi
promieniotwórcze
Wyróżniamy 4 szeregi promieniotwórcze:
• występujące naturalnie w przyrodzie:
uranowy – wywodzący się od izotopu uranu
aktynowy – wywodzący się od izotopu uranu
torowy - wywodzący się od izotopu toru
• sztuczny:
neptunowy – wywodzący się od izotopu neptunu
Nazwy szeregów pochodzą od nazw pierwszych, macierzystych
pierwiastków
.
12
U
238
92
U
235
92
Th
232
90
Np
237
93
szeregi promieniotwórcze
czyli szeregi nuklidów
promieniotwórczych przekształcających się kolejno
jedne
w
drugie
na
drodze
rozpadów
promieniotwórczych. Kolejne produkty rozpadów
promieniotwórczych tworzą szereg, który rozpoczyna
się izotopem promieniotwórczym o długim okresie
półtrwania,
a
kończy
izotopem
trwałym
(niepromieniotwórczym).
Wszystkie pierwiastki cięższe od bizmutu są
promieniotwórcze. Tworzą one:

13
Szeregi promieniotwórcze
Przemiany jądrowe zachodzące w szeregach to przemiany typu:
alfa (α) - następuje przesunięcie pierwiastka w układzie okresowym o
dwa miejsca w lewo (zmniejszenie liczby atomowej o 2 i liczby
masowej o 4);
beta (β) – następuje przesunięcie pierwiastka w układzie okresowym
o jedno miejsce w prawo (wzrost liczby atomowej o 1 i brak zmiany
liczby masowej).
O tym, do którego szeregu należy dany nuklid decyduje jego liczba
masowa A; ponieważ zmienia się ona tylko w przejściach α, liczby
atomowe
wszystkich
pośrednich
członków
szeregów
promieniotwórczych można opisać wzorem:
A = 4 n + m
gdzie:
n – jest liczbą całkowitą,
m – przyjmuje wartości 0, 1, 2, 3 odpowiednio dla szeregu toru,
neptuna, uranu i aktynu.
14
Szeregi promieniotwórcze
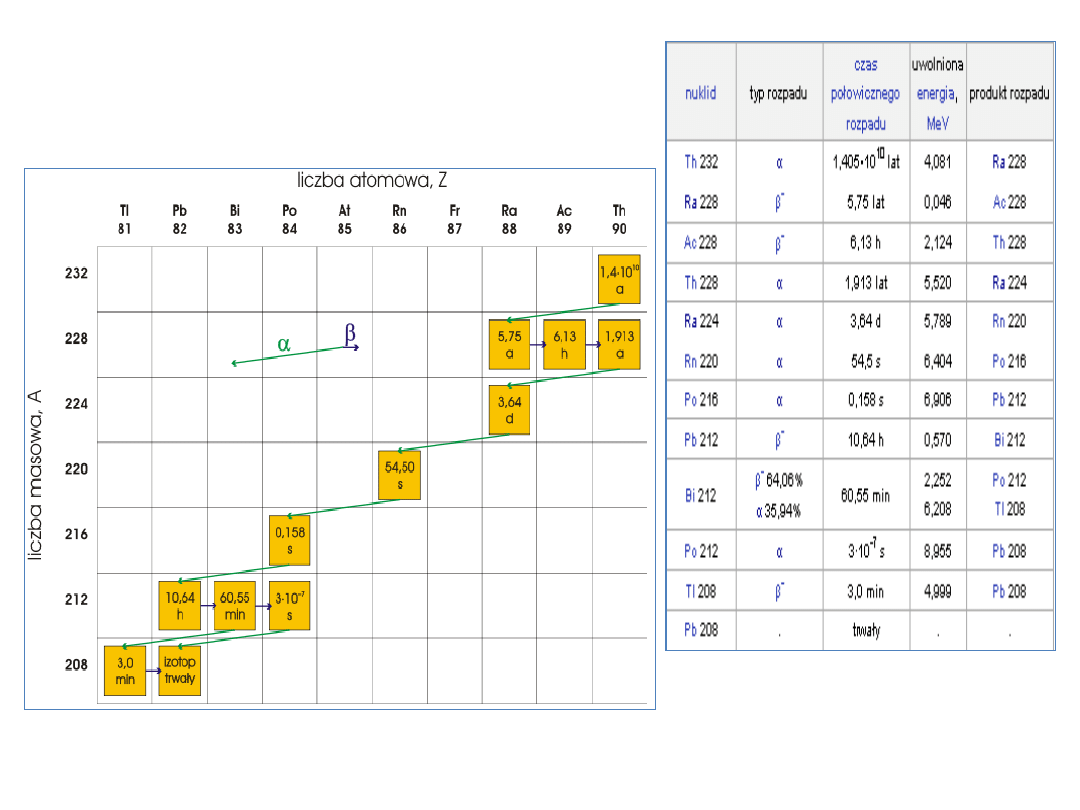
14
szereg torowy A= 4n
15
Szeregi promieniotwórcze
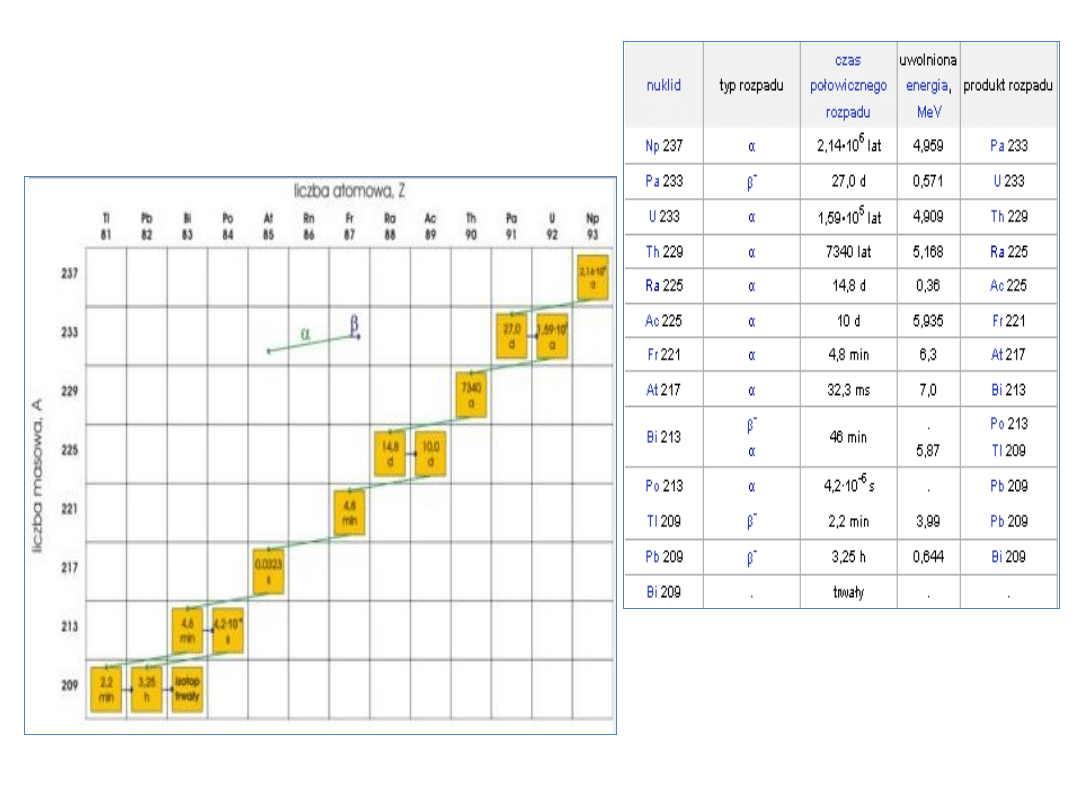
15
szereg neptunowy A=4n + 1
16
Szeregi promieniotwórcze
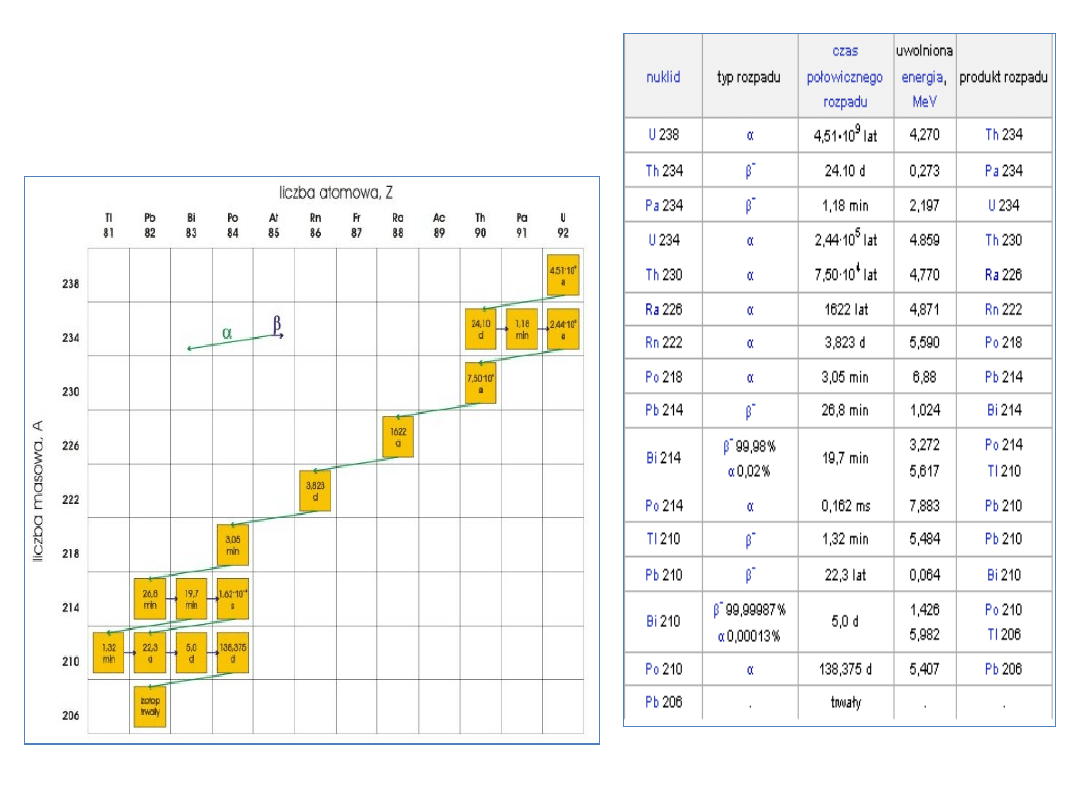
16
szereg uranowy A= 4n + 2
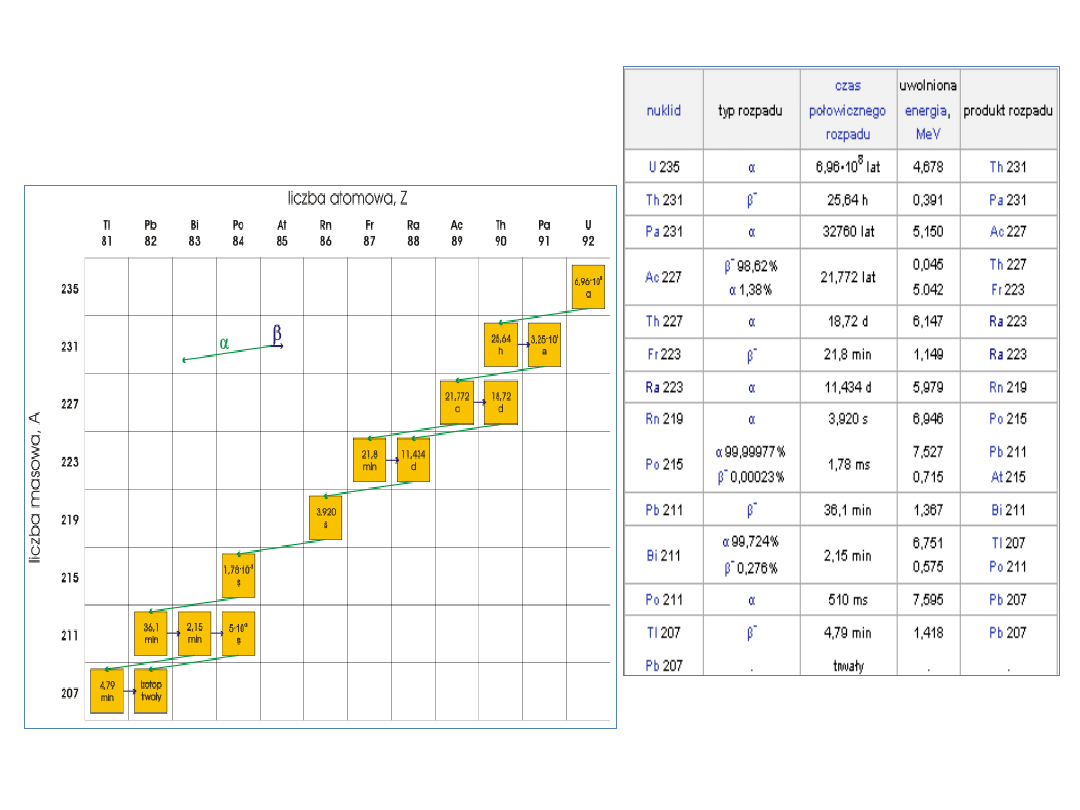
17
Szeregi promieniotwórcze
17
szereg aktynowy A= 4n + 3
18
Szeregi promieniotwórcze
18
Nazwa
szeregu
A
Izotop
początkow
y
Izotop
końcowy
T
1/2
, lat
torowy
4n
232
90
Th
208
82
Pb
1.4*10
10
neptunowy
4n+1
237
93
Np
209
83
Bi
2.2*10
6
uranowy
4n+2
238
92
U
206
82
Pb
4.5*10
9
aktynowy
4n+3
238
92
U
207
82
Pb
7.2*10
8
Każdy szereg promieniotwórczy rozpoczyna się nuklidem
stosunkowo trwałym, zanikającym znacznie wolniej niż inne
nuklidy stanowiące pozostałe ogniwa szeregu. Szeregi naturalne
kończą się izotopami ołowiu, nie ulegającymi dalszym
przemianom. Szereg neptunowy natomiast kończy się trwałym
izotopem bizm
utu.

19
Kinetyka rozpadu
promieniotwórczego
Rozpad promieniotwórczy
zjawisko spontanicznej przemiany jądra atomowego danego
izotopu w inne jądro,
statystyczny w swej naturze,
jest wyłączną właściwością samego jądra .
Podstawową własnością rozpadu promieniotwórczego jest brak
wpływu fizykochemicznych czynników zewnętrznych na
proces. Rozpad promieniotwórczy zachodzi zgodnie z kinetyką
I rzędu, a jego szybkość zależy od dwóch tylko czynników :
liczby jąder w rozpatrywanej próbce,
rodzaju tych jąder.
Ze względu na rodzaj przemiany zachodzącej w jądrze i
towarzyszące mu zjawiska wyróżnia się:
rozpad α
rozpad β (β
+
i β
-
)
rozpad γ

20
Prawo rozpadu
promieniotwórczego
Prawo określające
zmianę w czasie ilości jąder
substancji
promieniotwórczej na skutek rozpadu promieniotwórczego. Jeżeli
odpowiednio duża liczba rozpadów promieniotwórczych jest obserwowana
można zaobserwować prawo rozpadu
.
Rozpad wszystkich nietrwałych jąder, zarówno naturalnych jak i
otrzymanych na drodze sztucznej, przebiega w taki sposób, że jego
szybkość jest w każdej chwili wprost proporcjonalna do liczby jeszcze nie
rozłożonych atomów N.
N
dt
dN
Szybkość tę wyrażamy następującym wzorem :
gdzie: jest współczynnikiem proporcjonalności zwanym stałą
rozpadu,
dN – ubytek liczby atomów, które uległy rozpadowi w czasie dt,
„-” oznacza zmniejszenie się liczby atomów wskutek
rozpadu promieniotwórczego.
(1)

21
Rozdzielając zmienne i całkując je w granicach N
0
, N oraz
t=0, t
t
N
N
o
ln
lub w postaci wykładniczej :
t
o
e
N
N
gdzie:
N – liczba atomów po czasie t,
N
o
– początkowa liczba atomów,
- stała rozpadu, t – czas.
N
N
t
t
o
tdt
N
dN
0
otrzymujemy:
(2)
(3)
(4)
Prawo rozpadu promieniotwórczego
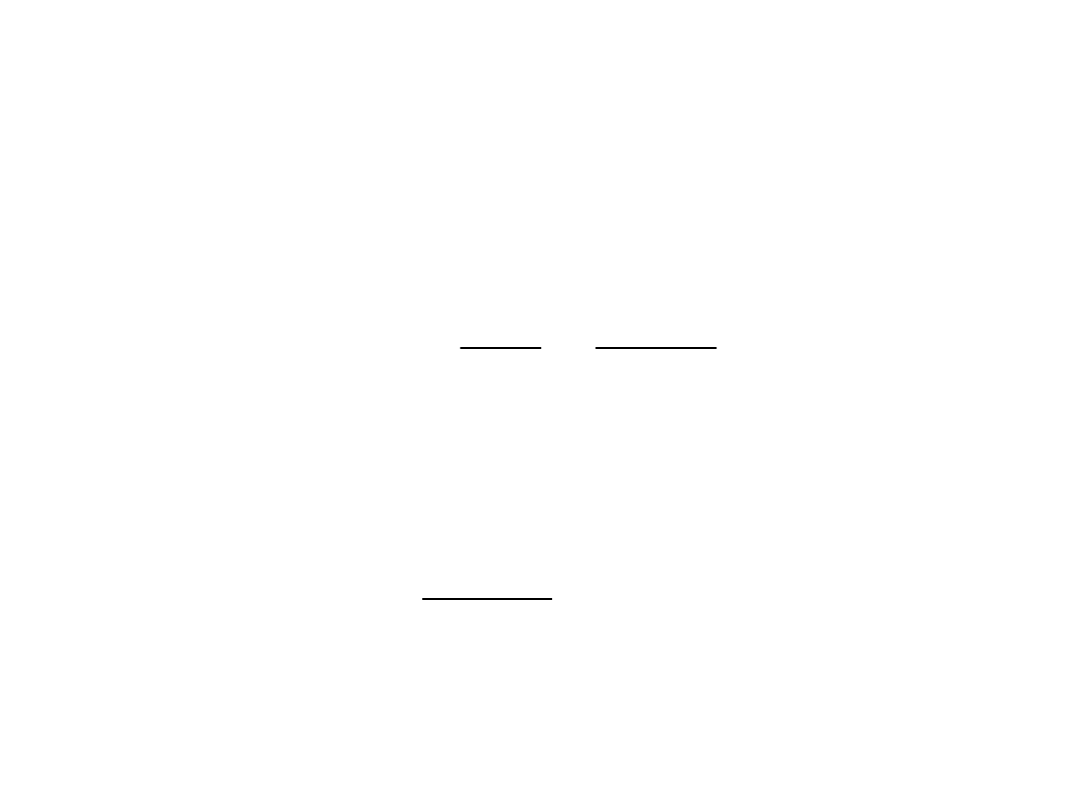
22
Jest to czas w którym rozpada się połowa początkowej liczby atomów
N
0
danego pierwiastka.
Podstawiając do równania (3)
N= N
0
/2 oraz
t=T
1 /2
otrzymujemy:
693
,
0
2
ln
2
/
1
T
A-liczba masowa (ciężar atomowy pierwiastka
promieniotwórczego),
n- liczba atomów ulegających rozpadowi na jednostkę czasu.
gdzie: λ
- określa ułamek gramoatomu pierwiastka
promieniotwórczego, który uległ rozpadowi na jednostkę czasu
23
10
02
,
6
An
Czas połowicznego
zaniku
23
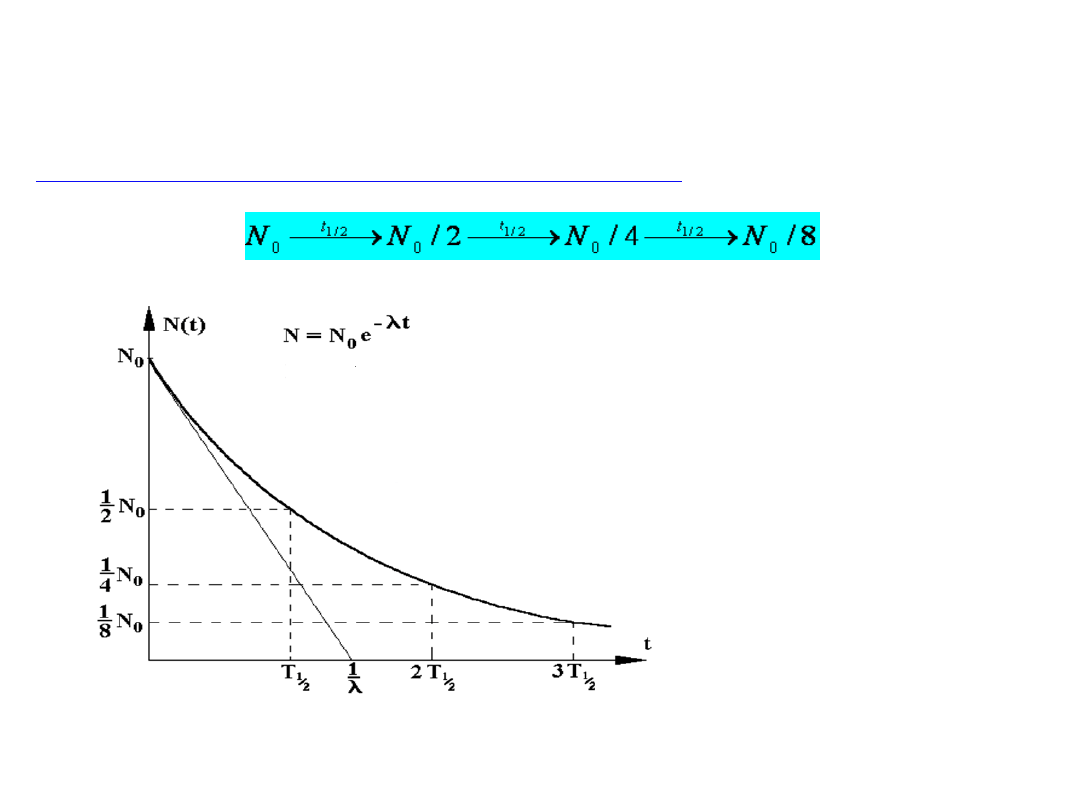
Przebieg rozpadu promieniotwórczego można zilustrować za pomocą
krzywej rozpadu promieniotwórczego
co przedstawia Rys.1
N
0
- pierwotna liczba atomów
N – liczba atomów które nie uległy
rozpadowi po upływie czasu t
T
1/2
– okres połowicznego zaniku
λ - stała zaniku
Rys.1 Wykres funkcji rozpadu
Czas połowicznego zaniku
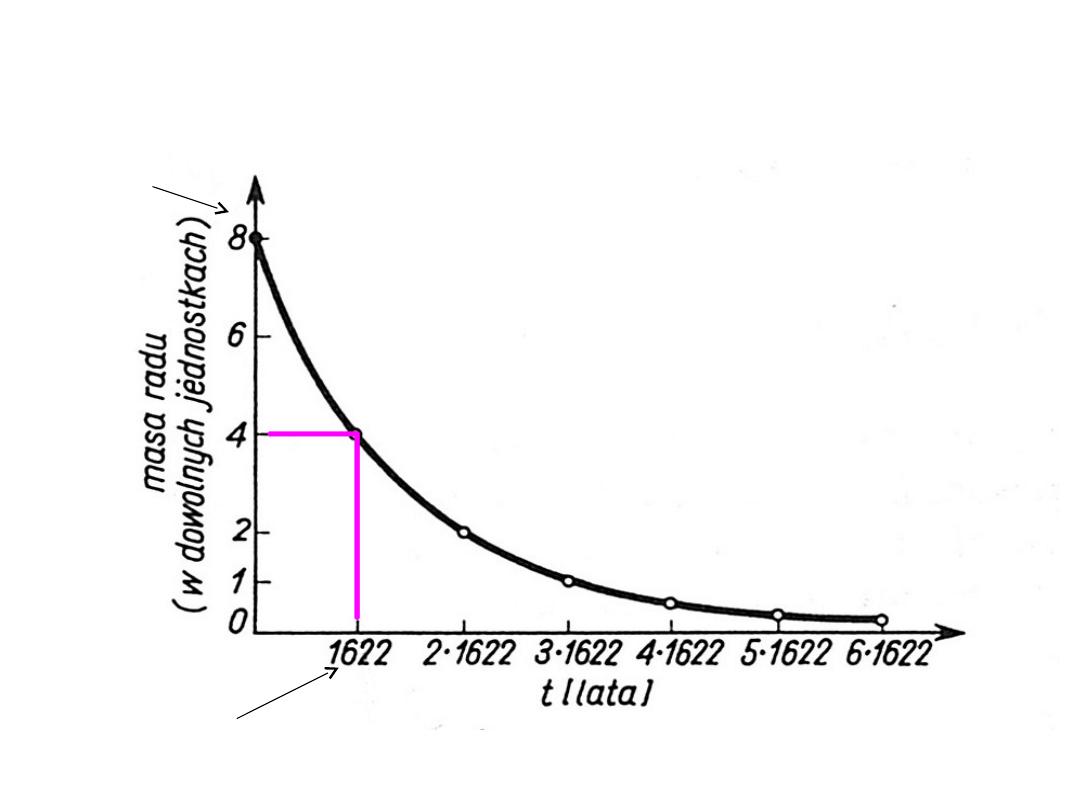
24
T
1/2
N
0
Rys.2 Rozpad promieniotwórczy radu
Przykład:
Ra
226
88
N
0
= 8
T
1/2
= 1622
lat
Czas połowicznego zaniku

25
Wybrane zastosowania
zjawiska
promieniotwórczości
Radioterapia
Radioterapia
R
adioterapia jest metodą leczenia polegającą na zniszczeniu
nowotworu
za
pomocą
promieniowania
jonizującego,
czyli
promieniowania, którego energia powoduje powstawanie zmian w
strukturze atomu lub cząsteczki.
Radioterapia nowotworów jest stosowana u chorych z wykrytym i
zlokalizowanym anatomicznie guzem złośliwym.
Istotą leczniczego działania promieniowania jonizującego
stosowanego w tej metodzie leczenia jest fakt, że do zniszczenia tkanki
rakowej potrzeba niższej dawki promieniowania niż do zniszczenia tkanki
zdrowej (tkanka nowotworowa jest na ogół bardziej promieniowrażliwa
niż otaczające ją tkanki zdrowe).

Źródłem promieniowania mogą
być:
lampa
rentgenowska,
akcelerator liniowy oraz pierwiastki
i izotopy promieniotwórcze
W zależności od tego jak blisko nowotworu jest źródło promieniowania
wyróżniamy :
teleradioterapię
brachyterapię.
W leczeniu nowotworu stosowana jest również
terapia izotopowa
- polegająca na podaniu dożylnym lub doustnym izotopu
promieniotwórczego, który jest wybiórczo wychwytywany w
określonym narządzie. Stosuje się ją w takich nowotworach, w których
podany pierwiastek kumuluje się w określonych tkankach – należą do
nich przerzuty raka stercza do kości (podaje się stront 89) oraz rak
pęcherzykowy tarczycy (podaje się jod 131).
Radioterapia
Radioterapia

27
Znakowanie izotopowe
Znakowanie izotopowe
Znakowanie izotopowe jest to proces
zamiany
w
związku
chemicznym
trwałego
jądra,
wysyłającym
promieniowanie
izotopem
promieniotwórczym
tego
samego
pierwiastka, dzięki czemu można śledzić
drogę tego atomu wewnątrz układu
biologicznego lub mechanicznego

28
stosowana głównie w chemii organicznej polegająca na wymianie
wybranych atomów danego pierwiastka w cząsteczce na jego izotop
wymieniony atom jest „oznakowany”, dzięki czemu można go
obserwować rozmaitymi technikami analitycznymi
najczęściej stosuje się izotopy promieniotwórcze, ale współczesne
techniki analityczne umożliwiają też stosowanie izotopów stabilnych.
Z
nakowanie izotopowe bywa stosowane w celu:
•badania mechanizmów reakcji chemicznych, które polegają na
stwierdzeniu obecności izotopu w produktach.
•śledzenia dróg wędrówki określonych związków chemicznych w
organizmach żywych
• metoda stosowana w biologii, mechanice i medycynie
Do śledzenia znakowanych atomów stosuje się między innymi
następujące techniki analityczne:
•spektroskopię EPR
•NMR
•spektroskopię mas
Znakowanie izotopowe
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
ROZPAD PROMIENIOTWÓRCZY PIERWIASTKÓW
Okres połowicznego rozpadu izotopu pierwiastka promieniotwórczego, szkola, chemia
chemia- izotopy promieniowanie konfiguracje (2) , Izotopy- odmiany pierwiastka o takiej samej liczbi
Zanieczyszczeniami gleb i gruntów są wszelkie związki chemiczne i pierwiastki promieniotwórczex
Zastosowanie pierwiastków promieniotwórczych w diagnostyce i terapii
Pierwiastki promieniotwórcze, chemia(2)
ZASTOSOWANIE PIERWIASTKÓW PROMIENIOTWÓRCZYCH W DIAGNOSTYCE I TERAPII 2
Zastosowanie pierwiastków promieniotwórczych w życiu człowieka
Pierwiastki promieniotwórcze rad i polon
Pierwiastki promieniotwórcze
ZASTOSOWANIE PIERWIASTKÓW PROMIENIOTWÓRCZYCH
3B Promieniowanie jonizujące
Budowa Układu Okresowego Pierwiastków
sem 2 promieniowanie rtg
Promieniowanie ultrafioletowe
więcej podobnych podstron