Tolerancja immunologiczna.
Autotolerancja.
Autoagresja.
Seminarium 8

Autotolerancja
Limfocyty autoreaktywne i
autoprzeciwciała stanowią prawidłową
składową układu odpornościowego, w
większości wypadków nie prowadząc
do rozwoju choroby
autoimmunizacyjnej.
Dzieje się to dzięki zjawisku
autotolerancji

Swój czy obcy?

Teoria sygnału
niebezpieczeństwa
(danger signal) – Polly Matzinger
decyzja o tym, czy rozpocząć
odpowiedź immunologiczną na dany
antygen czy go „zlekceważyć” nie
zostaje podjęta w zależności od tego
czy jest to antygen własny czy obcy,
ale w zależności od tego, czy jest on
postrzegany jako zagrażający
zdrowiu i życiu organizmu, czy jako
nieszkodliwy
niezbędny jest zatem dodatkowy
sygnał, nazwany
„sygnałem
niebezpieczeństwa” („danger
signal”),
który komórka
prezentująca antygen musi
otrzymać, aby taką decyzję podjąć.

Teoria sygnału
niebezpieczeństwa
"układ odpornościowy odróżnia
bezpieczne od niebezpiecznego”, a nie
„swoje od obcego”
do powstania odpowiedzi
immunologicznej konieczne są:
prezentacja antygenu
sygnał niebezpieczeństwa, który
pozwala na prawidłową interpretację
zaistniałej sytuacji

Sygnały
niebezpieczeństwa:
sygnały endogenne
białka szoku cieplnego (HSP)
cytokiny
reaktywne formy tlenu (reactive oxygen species -
ROS)
substancje uwalniane z uszkodzonych komórek np.
nukleotydy
sygnały egzogenne – wzorce molekularne
związane z patogenami (PAMP)
dwuniciowy RNA
lipopolisacharyd ścian bakterii gramujemnych (LPS)

Teoria sygnału
niebezpieczeństwa
(danger signal) – Polly Matzinger
Mechanizmy autotolerancji
CENTRALNE
OBWODOWE
•selekcja
negatywna
(delecja
klonalna)
limfocytów B i T
•delecja
klonalna
•ignorancja
(sekwestracja
antygenu)
•anergia
klonalna
•aktywna
supresja
Centralne mechanizmy
autotolerancji

Dojrzewanie limfocytów T
Głównym celem procesów
zachodzących w grasicy
jest wytworzenie takich
limfocytów T, które:
będą miały prawidłowo
zbudowany receptor TCR
(tzn. taki, który będzie
rozpoznawać antygeny
prezentowane przez własne
cząsteczki MHC)
nie będą rozpoznawały
własnych antygenów.
g
ra
s
ic
a
k
re
w
s
zp
ik
komórka macierzysta
hematopoezy
wspólna komórka
progenitorowa
limfopoezy
prekursor limfocytu T
(komórka potrójnie
negatywna)
CD25
+
CD44
+
c-Kit
+
CD25
+
CD44
+
c-Kit
+
CD25
+
CD44
+
c-Kit
+
CD4
-
CD8
-
TCR/CD3
-
migracja do grasicy
prekursor limfocytu T
(komórka potrójnie
negatywna)
CD25
+
CD44
+
c-Kit
+
CD4
-
CD8
-
TCR/CD3
-
prekursor limfocytu T
(komórka potrójnie
negatywna)
rearanżacja genów TCR
a
k
ty
w
a
c
ja
R
A
G
1
i
2
proT
D
β
J
β
CD25
+
CD44
+
c-Kit
+
CD4
-
CD8
-
TCR/CD3
-
TCR
β
prekursor limfocytu T
(komórka potrójnie
negatywna)
rearanżacja genów TCR
a
k
ty
w
a
c
ja
R
A
G
1
i
2
proT
wczesne
preT
D
β
J
β
V
β
D
β
J
β
preT
α
CD25
+
CD44
+
c-Kit
+
CD4
-
CD8
-
TCR/CD3
-
CD3
+
preT
α
TCR
β
TCR
β
prekursor limfocytu T
(komórka potrójnie
negatywna)
rearanżacja genów TCR
a
k
ty
w
a
c
ja
R
A
G
1
i
2
proT
wczesne
preT
D
β
J
β
V
β
D
β
J
β
preT
α
CD25
+
CD44
+
c-Kit
+
CD4
-
CD8
-
TCR/CD3
-
CD3
+
preT
α
TCR
β
TCR
β
selekcja β
wyłączenie alleliczne
apoptoza
70% preT !!!
czy nastąpiła prawidłowa
rearanżacja TCR
β
?
selekcja β
wyłączenie alleliczne
czy nastąpiła prawidłowa
rearanżacja TCR
β
?
V
β
D
β
J
β
V
α
J
β
CD4
+
CD8
+
TCR
β
TCR
α
selekcja β
wyłączenie alleliczne
selekcja
pozytywna
śmierć
z zaniedbania
90% tymocytów!!!
proliferacja
późne preT
podwójnie dodatnia
MHC klasy I i II
próba wytworzenia
prawidłowego
łańcucha α poprzez
wymianę segmentu
genu V na nowy
selekcja β
wyłączenie alleliczne
selekcja
pozytywna
śmierć
z zaniedbania
proliferacja
MHC klasy I i II
restrykcja MHC
CD4
+
CD8
+
TCR
β
TCR
α
późne preT
podwójnie dodatnia
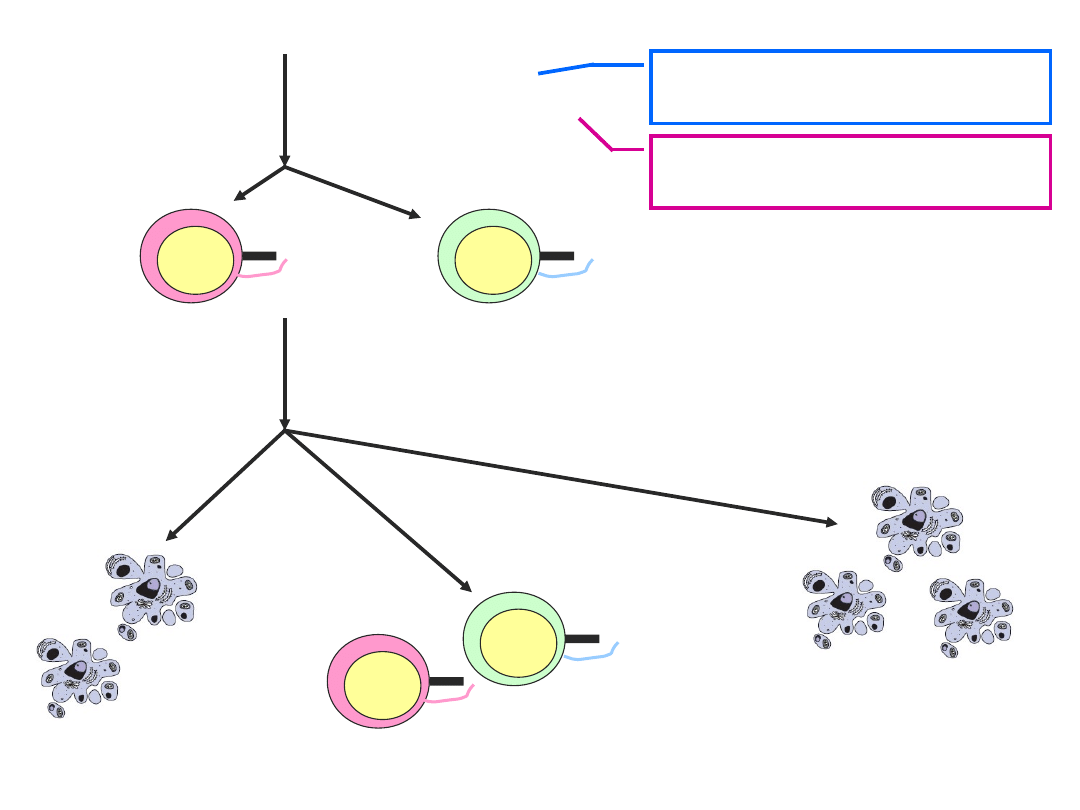
selekcja
pozytywna
restrykcja MHC
CD4
+
CD8
+
selekcja
negatywna
(delecja klonalna)
czy TCR rozpoznaje własne
MHC?
limfocyt albo CD4
+
albo
CD8
+
CD4
+
TCR
β
TCR
α
lub
CD8
+
TCR
β
TCR
α
nie rozpoznaje
antygenu
rozpoznaje ze
słabym
powinowactwem
rozpoznaje z
dużym
powinowactwem
CD4
+
CD8
+
dziewicze limfocyty T
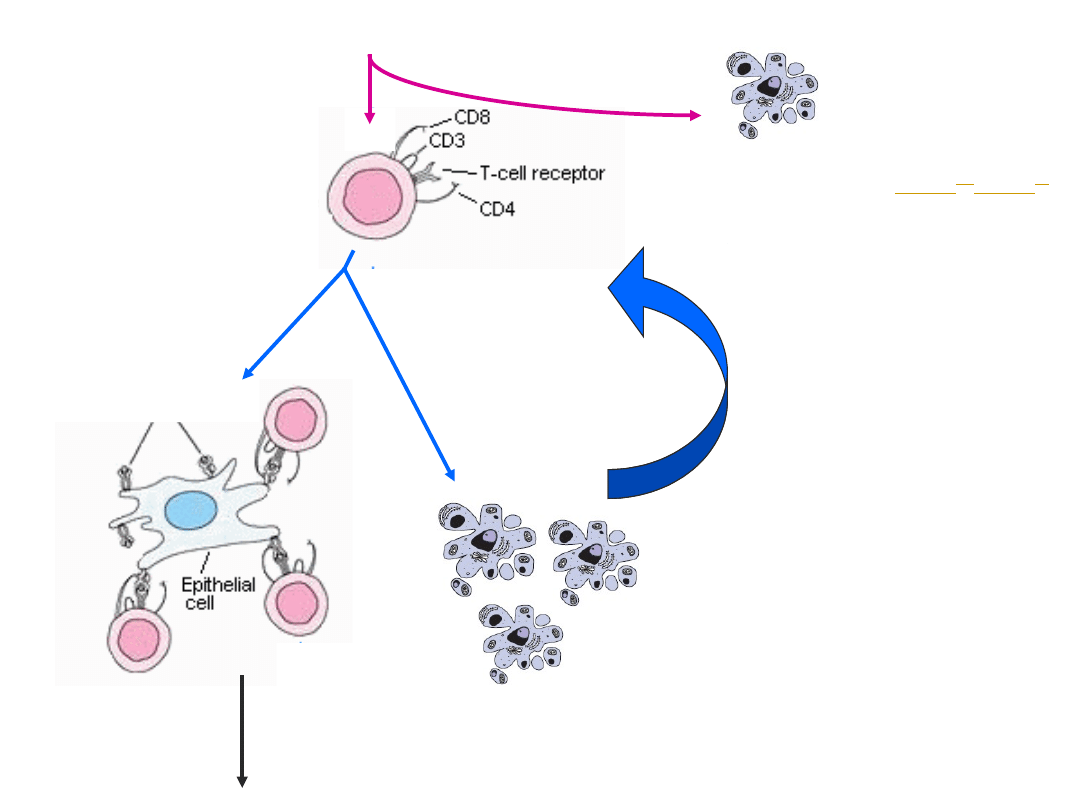
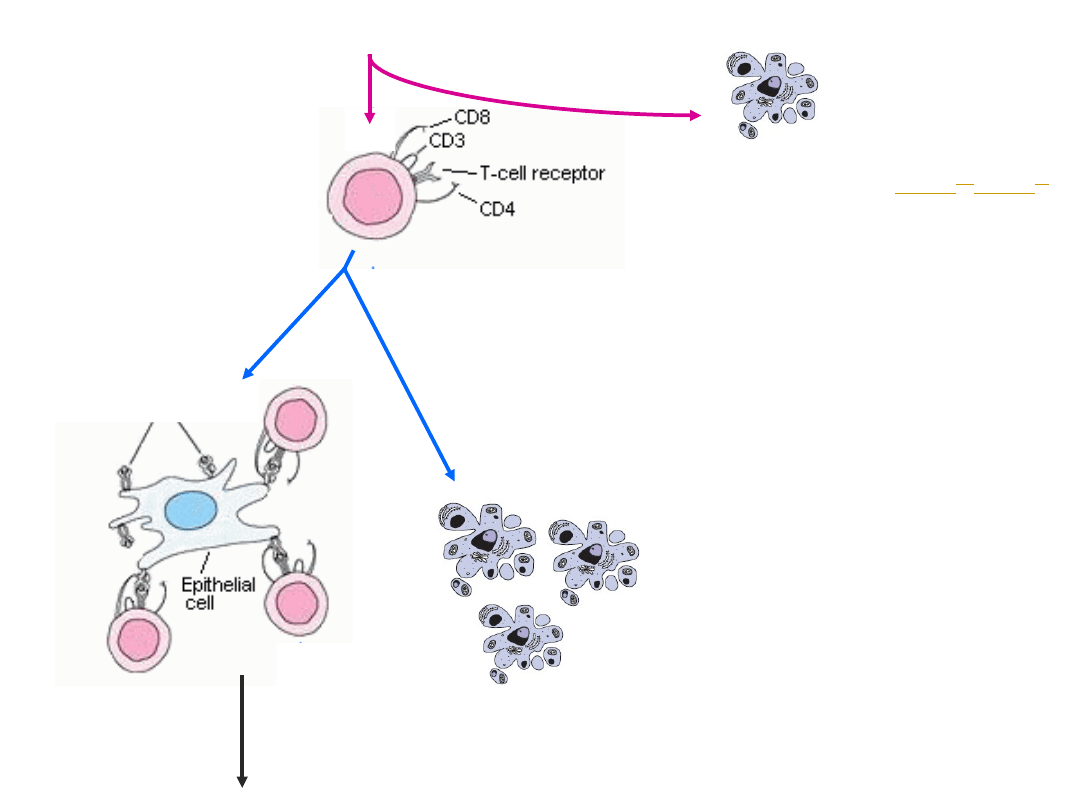
Obwodowe mechanizmy
autotolerancji

Kiedy DC „unieszkodliwia”
a kiedy aktywuje limfocyt
T?
bardziej podatne na delecję są limfocyty o
wyższym powinowactwie do kompleksu
MHC-peptyd
jeśli DC otrzyma sygnał aktywujący poprzez
interakcję ligandu dla cząsteczki CD40 na
limfocycie Th z CD40 na DC, dojdzie do
aktywacji limfocytu autoreaktywnego T
CD8+ i potencjalnej autoimmunizacji
niespecyficzna aktywacja DC (cytokiny: IL-
1, TNF czy IFN-)
(delecja klonalna)

Ignorancja
= sekwestracja antygenu
sekwestracja
anatomiczna
Molekularna
Gdy autoantygeny nie
dostają się do krwi bo sa
oddzielone śródbłonkiem
to przeżyją limfocyty na
nie reaktywne

Epitopy dominujące i
ukryte

Anergia

Anergia klonalna
jeśli limfocyt dziewiczy stymulowany
jest tylko za pośrednictwem TCR –
wejdzie w stan anergii
stan ten charakteryzuje się brakiem
wytwarzania IL-2 i proliferacji w
odpowiedzi na antygen
nasilenie procesu waha się od
obniżenia poziomu ekspresji TCR aż do
śmierci komórki

Aktywna supresja
(działanie komórek regulatorowych)
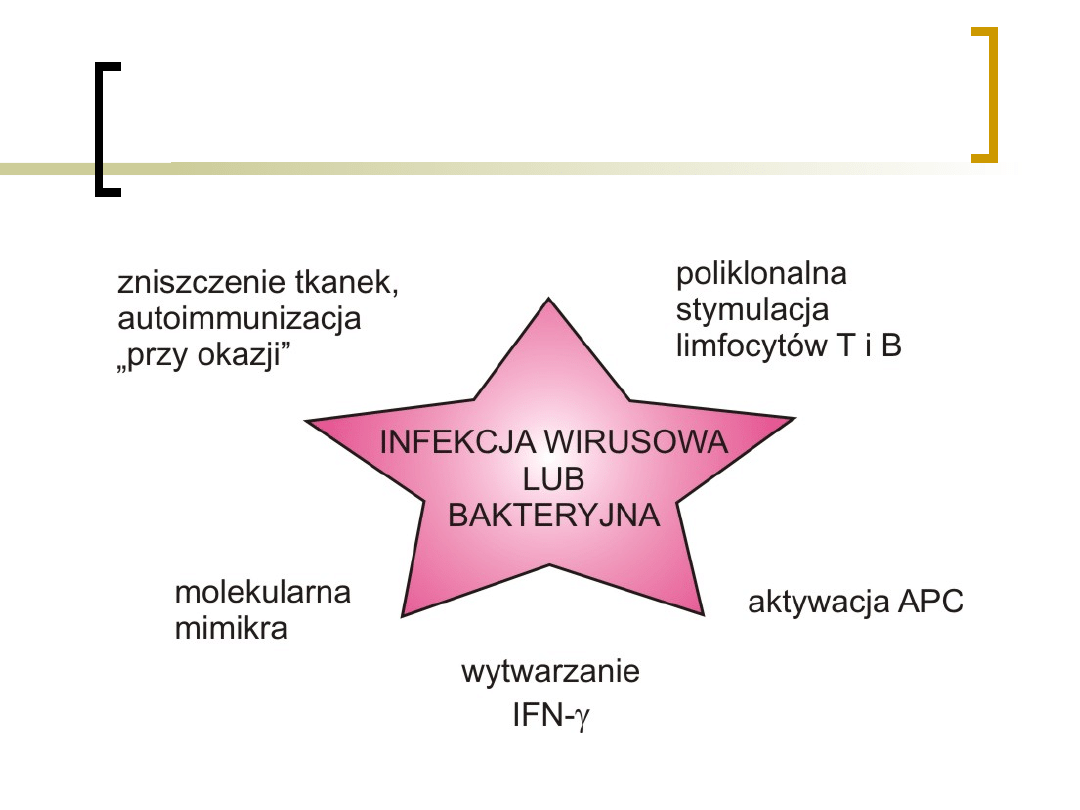
Co może wyindukować
proces
autoimmunizacyjny?
czynniki endogenne
czynniki egzogenne

Czynniki genetyczne
haplotyp MHC (głównie klasy II)
np.:
HLA-DR4 reumatoidalne zapalenie
stawów
HLA-DQ8 cukrzyca typu 1
HLA-DR2 stwardnienie rozsiane
brak niektórych składników
dopełniacza (np. C1q, C4 SLE)

Czynniki genetyczne o
potwierdzonym związku z SLE
NEJM, 2008

Zaburzenia funkcji
komórek regulatorowych
brak równowagi pomiędzy komórkami
autoreaktywnymi a „trzymającymi je w
ryzach” limfocytami regulatorowymi
uniezależnienie mechanizmów
efektorowych od komórek regulatorowych
poprzez selekcję limfocytów
autoreaktywnych o wysokim
powinowactwie do autoantygenu oraz
poprzez wpływ wysokiego stężenia cytokin
prozapalnych obecnych w chorych
tkankach

Co stanowi większe
zagrożenie
autoimmunizacją
autoreaktywny limfocyt B
autoreaktywny limfocyt T
?

Hormony płciowe
żeńskie hormony płciowe:
estrogeny i progesteron, mogą
w niskich stężeniach (a więc poza
ciążą) nasilać wytwarzanie IFN- przez
limfocyty,
promując odpowiedź Th1
w wysokich stężeniach, tak jak to się
dzieje w ostatnim trymestrze ciąży,
mogą
działać immunosupresyjnie

Hormony płciowe
kobiety stanowią aż 60-75% chorych na
RZS, SM czy miastenię, a ponad 80%
chorych na SLE, chorobę Gravesa, chorobę
Hashimoto czy twardzinę układową
ciężarne, chore na SM czy RZS, zauważają
niekiedy w ciąży złagodzenie przebiegu
choroby (najczęściej w ostatnim
trymestrze) i jej nawrót po porodzie
mężczyźni chorzy na RZS mają niższe
stężenie testosteronu niż mężczyźni zdrowi

„Przełamanie” ignorancji
uraz
uszkodzenie tkanek
ujawniające antygeny ukryte za
barierami anatomicznymi
zapalenie
wzrost stężenia IFN-
i TNF prowadzący do zwiększenia
prezentacji antygenów (w tym
antygenów „ukrytych”)

Czynniki infekcyjne
rozwój chorób
autoimmunizacyjnych
często poprzedzają
infekcje
jeden i ten sam limfocyt T
może rozpoznawać różne
peptydy prezentowane w
kontekście różnych
cząsteczek MHC

Czynniki infekcyjne
– teoria mimikry
molekularnej
zakażenie wirusem lub bakterią
mającymi epitopy wykazujące
podobieństwo do antygenów gospodarza
może prowadzić do aktywacji limfocytów
autoreaktywnych i rozwoju odpowiedzi
na własne antygeny (np. gorączka
reumatyczna, choroba Guillaina-Barre)

Czynniki infekcyjne
– superantygeny
Zarówno bakterie jak i
wirusy mogą
oddziaływać jako tak
zwane poliklonalne
aktywatory proliferacji
limfocytów

Czynniki infekcyjne – źródła
sygnału niebezpieczeństwa
(TLR)
DC dojrzewające pod wpływem
stymulacji TLR stają się “odporne”
na supresyjny efekt limfocytów
Treg, co potencjalnie może
prowadzić do przełamania
tolerancji na autoantygeny
aktywacja TLR działa jako „sygnał
niebezpieczeństwa” dla DC

Stan zapalny
Czynniki infekcyjne –
podsumowanie

Czynniki środowiskowe
UV toczeń układowy rumieniowaty
krzem, chlorek winylu twardzina
dym papierosowy, rozpuszczalniki
organiczne zespół Goodpasture’a
leki (hydralazyna, prokainamid,
hydantoina) toczeń
Choroby
autoimmunizacyjne

Choroby
autoimmunizacyjne
schorzenia o przewlekłym
przebiegu
charakteryzują się okresami
zaostrzeń i remisji
cierpi na nie ok. 5% populacji
liczba zachorowań wzrasta

Dewiacja immunologiczna
populacje
limfocytów Th1 i
Th2 są
antagonistyczne
(Th1 hamują
odpowiedź Th2 i
vice versa)
inna nazwa tego
zjawiska to
rozdwojona
tolerancja
Th1
Th2
Choroby
autoimmunizacyjne
z przewagą
odpowiedzi
komórkowej
z przewagą
odpowiedzi
humoralnej
•choroba Hashimoto
•cukrzyca typu 1
•stwardnienie rozsiane
•łysienie plackowate
•bielactwo
•pęcherzyca
•miastenia
•choroba Gravesa-
Basedowa
•niedokrwistość
hemolityczna
•toczeń układowy
rumieniowaty
Choroby
autoimmunizacyjne
narządowo swoiste
układowe
występowanie danego
autoantygenu
ogranicza się do
konkretnego narządu
lub typu komórek
autoantygen
występuje
powszechnie w
ustroju, a zmiany
chorobowe mają
charakter
wielonarządowy
np.:
cukrzyca
stwardnienie rozsiane
pęcherzyca zwykła
np.:
toczeń układowy
rumieniowaty
twardzina układowa
reumatoidalne zapalenie
stawów

Patomechanizm chorób
autoimmunizacyjnych

Choroba Gravesa-
Basedowa

Choroba Gravesa-
Basedowa

Choroba
Gravesa-
Basedowa

Miastenia gravis
przeciwciała przeciw
receptorom cholinergicznym
płytki nerwowo mięśniowej
mogą pojawić się w
przebiegu grasiczaka

Miastenia gravis

Toczeń układowy rumieniowaty
(SLE)

Toczeń układowy rumieniowaty
– choroba kompleksów
immunologicznych
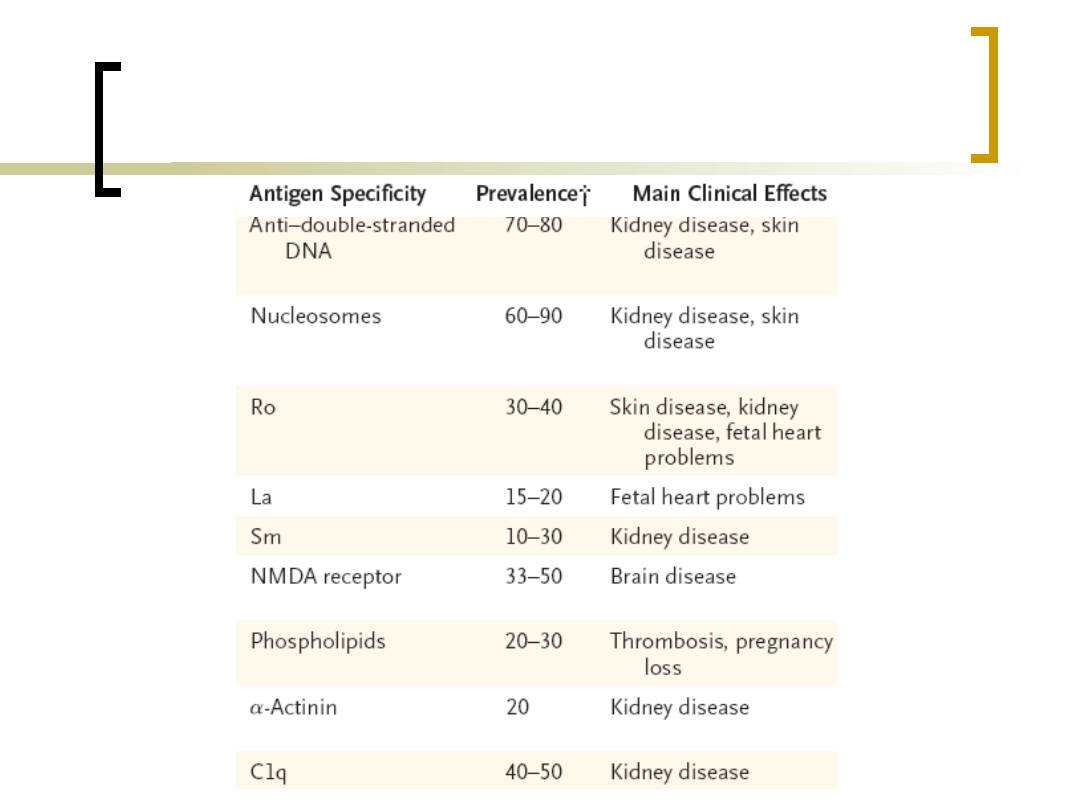
Autoprzeciwciała w SLE
NEJM, 2008

Patofizjologia
Czynnikami uszkadzającymi w SLE są przeciwciała i
kompleksy antygen-przeciwciało.
Krążące kompleksy odkładane są w ścianie naczyń i
kłębuszkach nerkowych, prowadząc do uszkodzenia
tych tkanek (w procesie odkładania w tkankach mają
znaczenie: wielkość, rozpuszczalność, stężenie,
zdolność wiązania składowych dopełniacza ze strony
kompleksów, a ze strony układu siateczkowo-
śródbłonkowego- zdolność usuwania kompleksów z
krążenia.
Można stwierdzić obecność przeciwciał przeciw
erytrocytom, leukocytom, płytkom, co powoduje
spadek liczby tych komórek.

Etiopatogeneza
Czynnik indukujący dotąd nieznany
Predyspozycje genetyczne - rodziny z
wrodzonym
niedoborem składowych
dopełniacza
, częstsza obecność
antygenów zgodności tkankowej
HLA-DR2 i
HLA-DR3
u chorych.
Estrogeny
mogą modulować pojawienie się
tocznia - ułatwiają aktywację limfocytów B.
Promieniowanie UV-
indukcja uwolnienia
keratynocytów skórnych IL-1, wpływającej
na zaburzenia aktywacji limfocytów B.

Objawy kliniczne SLE – skóra
typowa
wysypka na twarzy
z zajęciem
policzków i nosa, o kształcie motyla u
50% chorych, nasilająca się pod
wpływem promieniowania słonecznego;
łysienie plackowate -
dotyczy 70%
chorych;
rumień dłoni
oraz zapalenie naczyń
skórnych prowadzące do owrzodzeń.

SLE

Kryteria rozpoznania SLE
1.
Rumień twarzy w kształcie motyla.
2.
Rumień krążkowy.
3.
Nadwrażliwość na światło.
4.
Owrzodzenia jamy ustnej.
5.
Zapalenie lub ból stawów - dotyczące co najmniej dwóch stawów, bez
nadżerek w obrazie RTG
6.
Zapalenie błon surowiczych - opłucnej lub osierdzia, stwierdzone w
wywiadzie lub w chwili badania.
7.
Zmiany w nerkach - utrzymująca się proteinuria powyżej 0,5 g/dobę
i/lub obecność wałeczków nerkowych w moczu.
8.
Zaburzenia neuropsychiatryczne - napady drgawek lub psychoza (po
wykluczeniu przyczyn polekowych, metabolicznych, mocznicy).
9.
Zaburzenia hematologiczne - anemia hemolityczna z retykulocytoza
lub limiopenia (poniżej 1500 w 1 mm3), lub leukopenia (poniżej 4000 w 1
mm3), lub trombocytopenia (poniżej 100 000 w 1 mm3)
10.
Zaburzenia immunologiczne - obecność komórek LE lub przeciwciał do
nDNA, lub przeciwciał do Sm, lub fałszywie dodatnie serologiczne testy
kiłowe przy ujemnym teście na immobilizację krętków.
11.
Przeciwciała przeciwjądrowe - w mianie uznanym za nieprawidłowe,
badane metoda immunofluorescencji lub inna odpowiednia

Stwardnienie rozsiane
DEMIELINIZACJ
A

Reumatoidalne
zapalenie stawów
(RZS)

Reumatoidalne zapalenie
stawów (RZS)
punkty, w których
może rozwinąć się
RZS
łuszczka
reumatoidaln
a w stawie

Zespół Sjögrena
„suche oko”
uszkodzenia
rogówki i zapalenie
spojówek
suchość w
jamie ustnej
uszkodzenia
zębów
uszkodzeniu ulegają
komórki ślinianek
oraz gruczołów
łzowych.
nazwa pochodzi od
nazwiska
szwedzkiego okulisty
Henrika Sjögrena
który po raz
pierwszy opisał ten
zespół w 1933 roku

Twardzina układowa
(Sclerodermia systemica)
Charakteryzuje się
zmianami zapalnymi,
naczyniowymi, zwłóknieniem
gł. okolicy
koniuszków palców oraz zajęciem wielu narządów.
Występuje rzadko, rocznie rozpoznaje się 5-10
nowych zachorowań na 1 mln mieszkańców.
3-4 razy częściej chorują kobiety.
Pierwsze objawy pojawiają się między 30. a 50.
r.ż.

Objaw Raynauda
napadowy skurcz naczyń
pod wpływem zimna lub
stresu, spadek przepływu
krwi wywołuje zblednięcie
palców lub sinicę z
towarzyszącym
zdrętwieniem i bolesnością,
powrót ukrwienia powoduje
zaczerwienienie
występuje jako samodzielna
jednostka chorobowa lub
jest pierwszym objawem
twardziny
skurcz
naczyń
sinica

Sklerodaktylia w twardzinie
Skóra jest zajęta u 90%
pacjentów;
stwardnienie jest
symetryczne
najczęściej zmiany
pojawiają się dystalnie i
stopniowo przechodzą
na ramiona, tułów i szyję
skóra jest napięta,
błyszcząca i nadmiernie
pigmentowana, trwale
połączona z tkanką
podskórną
twarz przybiera wygląd
maskowaty;
Terapia chorób
autoimmunizacyjnych

Odra a zespół nerczycowy
1947 – Blumberg i Cassidy
opisali częściową lub całkowitą
remisję u 5 chorych z zespołem
nerczycowym krótko po
zakażeniu wirusem odry
1948 – Janeway i wsp. zakazili
wirusem odry 12 dzieci chorych
na oporny na leczenie zespół
nerczycowy. U 8 wystąpiła
całkowita remisja, u 1 doszło do
częściowej remisji, u 3 nie
stwierdzono żadnej reakcji.

Strategie leczenia
substytucja (np. terapia insuliną)
przeszczep narządu (np. trzustki, nerek)
leczenie immunosupresyjne
(antygenowo-nieswoiste)
terapia antygenowo-swoista
podawanie autoantygenu drogą
doustną/donosową
podawanie APL (zmienionych ligandów
peptydowych)
szczepionka/przeciwciała przeciwko
autoreaktywnym TCR

Anakinra
rekombinowany
antagonista receptora
dla IL-1 (IL1-Ra)
uzyskiwany z modyfikowanych
genetycznie bakterii E. coli
(transfekcja plazmidem)
od ludzkiego
antagonisty różni się
dodatkową metioniną
wstawioną na N-końcu
łańcucha peptydowego

Anakinra
wykazuje działanie
przeciwzapalne
wskazania
reumatoidalne
zapalenie stawów
gdy inne leki są
nieskuteczne

Funkcje
glikokortykosteroidów

Mechanizm
y działania
glikokortyk
osteroidów

Molekularne
podstawy
działania
glikokortyko
steroidów

Przeciwciała monoklonalne
humanizowane MAb przeciwko
integrynie α4 –
NATALIZUMAB
–
stosowane w SM i chorobie
Leśniowskiego-Crohna
chimeryczne MAb przeciwko TNFα –
INFLIXIMAB
– stosowane w ZZSK,
RZS, chorobie Leśniowskiego-
Crohna
humanizowane MAb przeciwko TNFα
–
ADALIMUMAB
– stosowane w RZS

TNF w
reumatoidalny
m zapaleniu
stawów

Terapia SLE – „punkty
uchwytu”

Działania niepożądane
terapii immunosupresyjnej
zwiększona częstość infekcji (w tym
poważnych infekcji zagrażających
życiu)
zwiększona częstość występowania
nowotworów
niewydolność nerek, przerost
dziąseł, zespół Cushinga itp. – w
zależności od stosowanego
preparatu

Zespół
Cushinga
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
Wyszukiwarka
Podobne podstrony:
seminaria material, Immunologia
OZP Tolerancja immunologiczna
W9 TOLERANCJA IMMUNOLOGICZNA
Tolerancja immunologiczna po przeszczepieniu nerki
seminaria material, Immunologia
SEMINARIUM IMMUNOLOGIA Prezentacja
Seminarium 6 Immunologia transplantacyjna farmacja 2
tolerancja ok, Immunologia
Obwodowe mechanizmy tolerancji na autoantygen, studia, immunologia
seminarka immunologia
immunologia seminarium IV mert
chirurgia urazowa spis seminariow IV, Ginekologia, Chirurgia Immunologia, Chirurgia (pajro)
seminarium 2, biotechnologia Sem 5 Olsztyn, III rok, Immunologia
seminarium 2, biotechnologia Sem 5 Olsztyn, III rok, Immunologia
IMMUNOLOGIA seminarium 1
więcej podobnych podstron