
Mikrobiologia Przemysłowa
Mikroorganizmy stosowane w
procesach przemysłowych
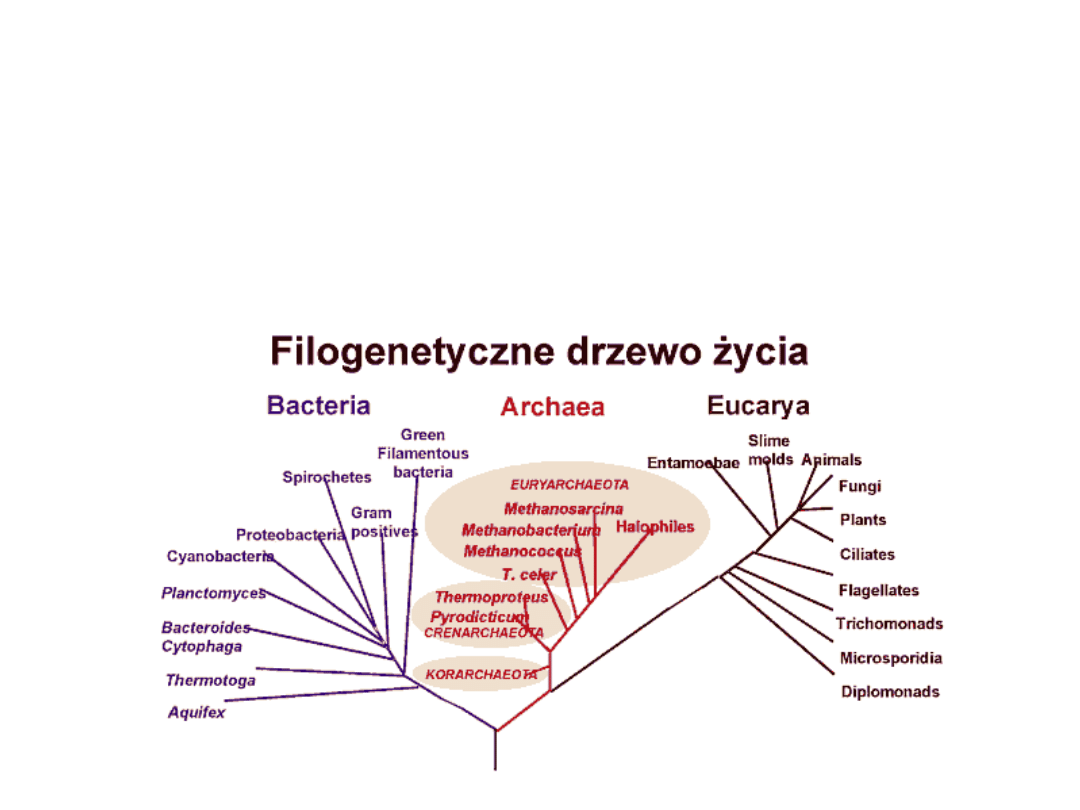
Drzewo życia – czyli filogenetyczny podział
organizmów planety Ziemia
FILOGENETYKA -
dyscyplina biologii zajmująca się odtwarzaniem
dróg rozwoju rodowego poszczególnych grup organizmów, zarówno
żyjących współcześnie, jak i w epokach minionych

Drzewo życia – czyli filogenetyczny podział
organizmów planety Ziemia
Drzewo filogenetyczne zbudowane jest w oparciu o
taksony
Takson - grupa organizmów na tyle do siebie podobnych, że
można ją wyróżnić i zaklasyfikować do jakiejś kategorii
systematycznej np. klasy, rodziny, gatunku
Podstawową jednostką klasyfikacji biologicznej jest gatunek
System klasyfikacji musi być oparty na cechach
występujących we wszystkich żywych organizmach

Drzewo życia – czyli filogenetyczny podział
organizmów planety Ziemia
Molekularna miara stopnia pokrewieństwa – sekwencja
DNA wspólnych genów – genów kodujących
rybosomalny RNA
(Carl Woese)
dla organizmów prokariotycznych – geny kodujące 16S rRNA
dla organizmów eukariotycznych – geny kodujące 18S rRNA
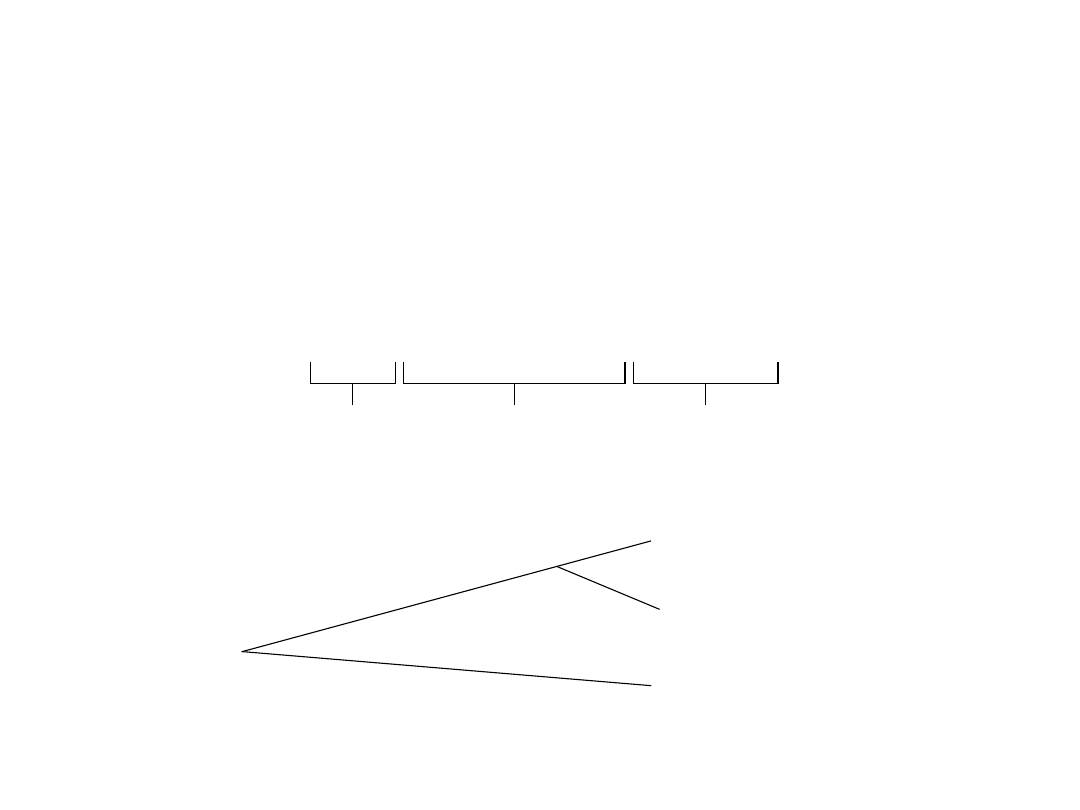
Molekularna miara stopnia pokrewieństwa
Porównanie sekwencji genów rRNA z różnych
organizmów
Organizm I ACTGCATTA
C
GCCTTAAGAGGCTCT
Organizm II ACTGCATTA
G
GCCTTAAGAGGCTCT
Organizm III ACTGCAT
A
A
T
GC
ACA
A
T
GAGGCTCT
Sekwencja
zmienna
Sekwencja
zakonserwowa
na
Sekwencja
zakonserwowa
na
Organizm I
Organizm II
Organizm III
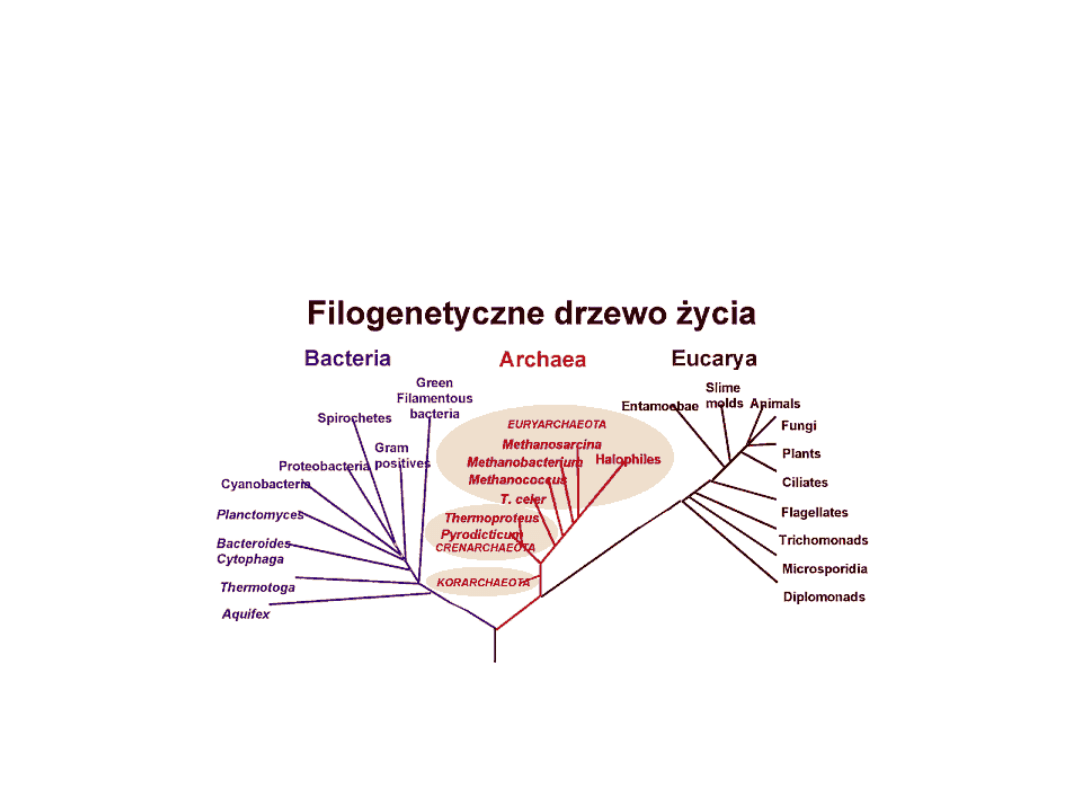
Molekularna miara stopnia pokrewieństwa
- trzy domeny organizmów

Pyrococcus woesei
izolowany z morskiej solfatary (Porto di Levante, wyspa Volcano,
Włochy)
Domena: Archaea
Grupa: Euryarchaeota
Klasa: Thermococci
Rząd: Thermococcales
Rodzina:
Thermococcaceae
Rodzaj: Pyrococcus
Gatunek: Pyrococcus
woesei
Beztlenowiec
Optimum temperatury - 97 - 100°C
Optimum pH - 6,0
Optimum NaCl - 30%
Produkty metabolizmu - H
2
, H
2
S (w obecności S
0
)
Ziarniak
0,8 - 2,0 μm
Urzęsienie
lofotrichalne
Klasyfikacja taksonomiczna mikroorganizmów -
archeony

Deinococcus geothermalis
izolowany z gorących źródeł (Sao Pedro, Portugalia)
Domena: Bacteria
Grupa: Deinococcus-Thermus
Klasa: Deinococci
Rząd: Deinococcales
Rodzina: Deinococcaceae
Rodzaj: Deinococcus
Gatunek: Deinococcus geothermalis
Tlenowiec
Optimum temperatury - 45 - 50°C
Optimum pH - 7,2
Podwyższona oporność na promieniowanie jonizujące i UV
Podwyższona oporność na warunki ograniczonej wilgotności
Ziarniak
Gram+
Brak urzęsienia
Klasyfikacja taksonomiczna mikroorganizmów -
bakterie
Saccharomyces cerevisiae
izolowany ze skórek winogron
Domena: Eukarya
Królestwo: Fungi
Gromada: Ascomycota
Podgromada:
Saccharomycotina
Klasa: Saccharomycetes
Rząd: Saccharomycetales
Rodzina: Saccharomycetaceae
Rodzaj: Saccharomyces
Gatunek: Saccharomyces
cerevisiae
Metabolizm tlenowy i beztlenowy
Optimum temperatury - 25 - 30°C
Optimum pH - 6,5
Klasyfikacja taksonomiczna mikroorganizmów -
eukariota
komórki kuliste lub
owalne
5 - 10 μm średnicy

Bakterie
Mikroorganizmy jednokomórkowe
Otoczone sztywną ścianą komórkową
(za wyjątkiem
mykoplazm)
Brak jądra komórkowego, DNA zlokalizowane w cytoplazmie,
1 – 2 chromosomy, mogą zawierać DNA plazmidowe
Szybki wzrost i metabolizm
Rozmnażanie przez podział komórki
Zdolność do horyzontalnego transferu genów – nabywania
DNA od innych mikroorganizmów i włączania go do własnego
genomu
Wielkość: długość 1-5 μm; średnica 1-2 μm
Kształt: kulisty lub owalny, cylindryczny, spiralny
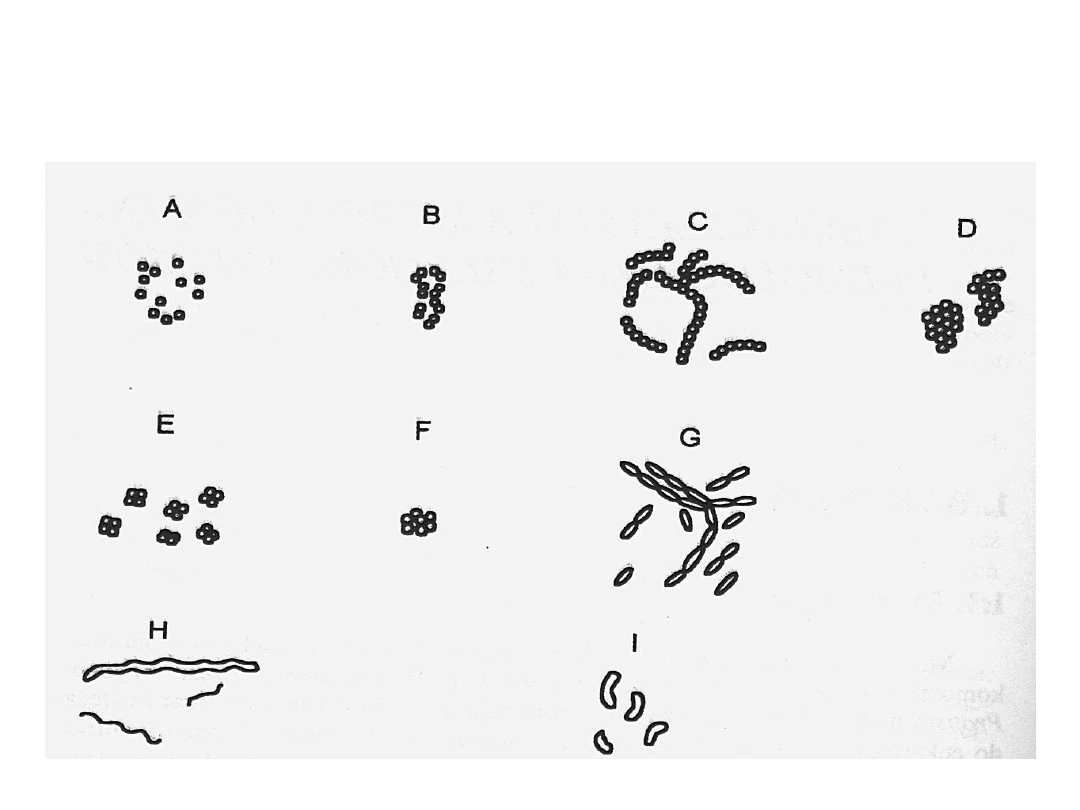
Podstawowe kształty i ugrupowania
komórek bakterii
ziarniaki dwoinki paciorkowce
gronkowce
czworaczki pakietowce pałeczki
śrubowce
przecinkowce
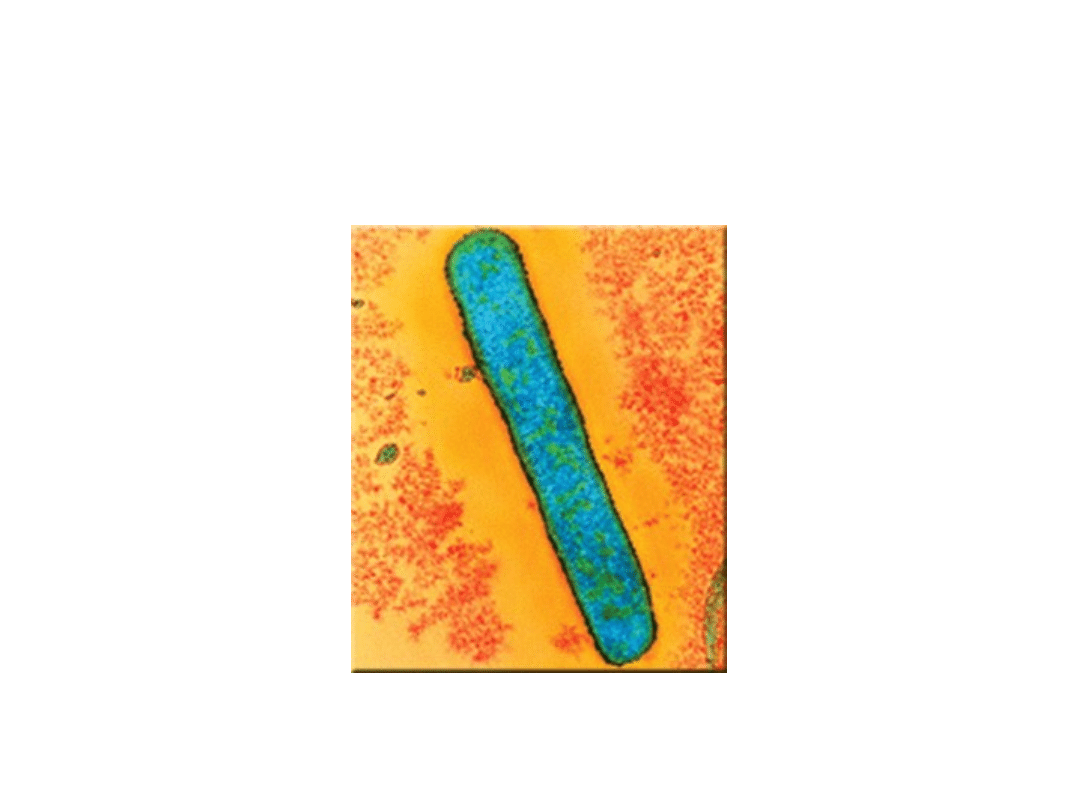
Laseczki - Bacillus

Pałeczki - bacterium
Escherichia coli
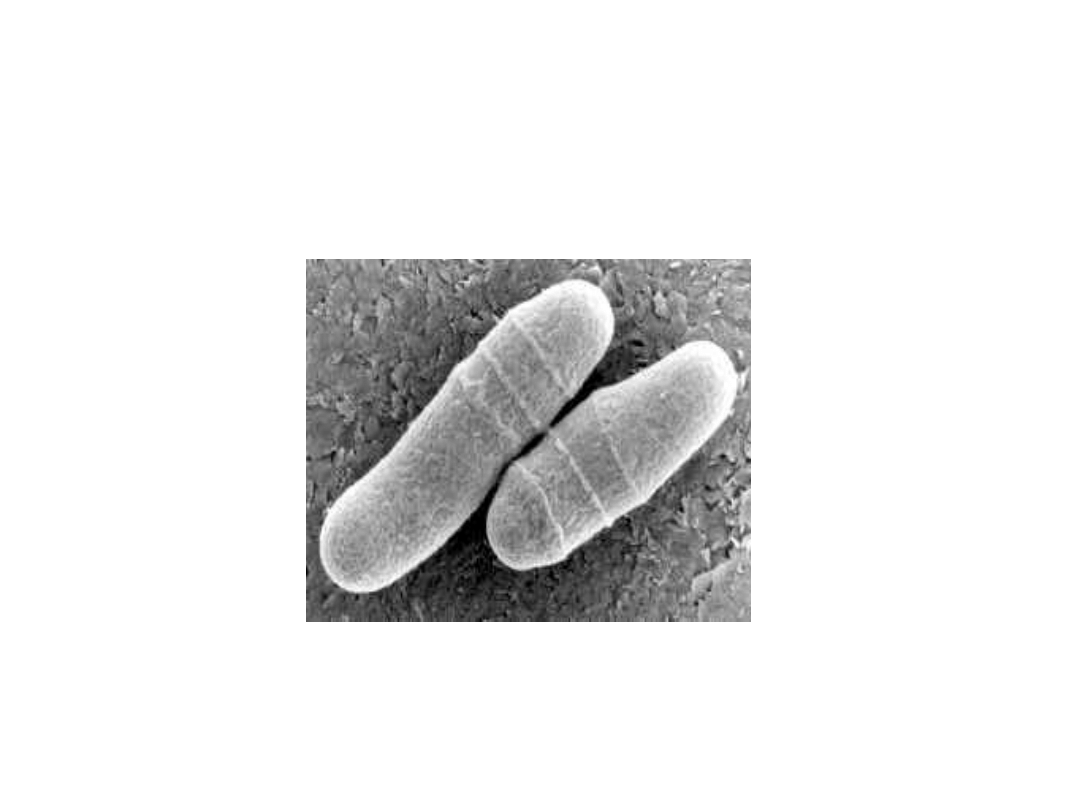
Maczugowce -
Corynebacterium
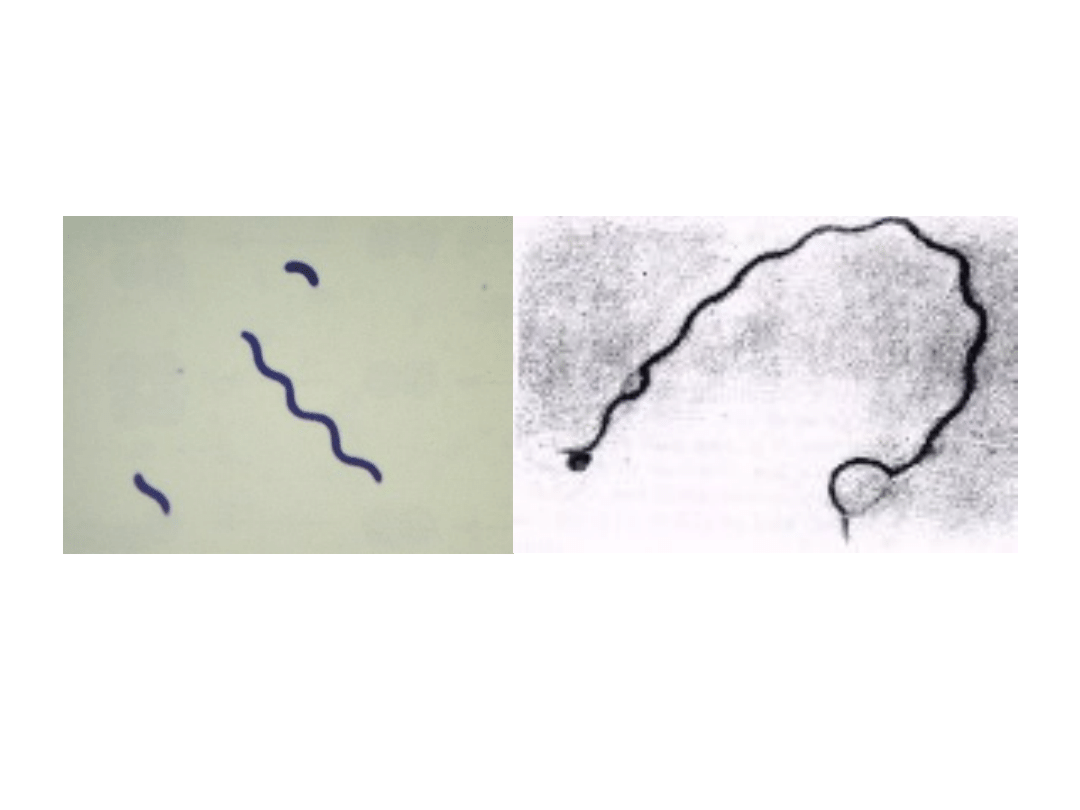
Śrubowce - Spirillum i Krętki -
Spirochaetea
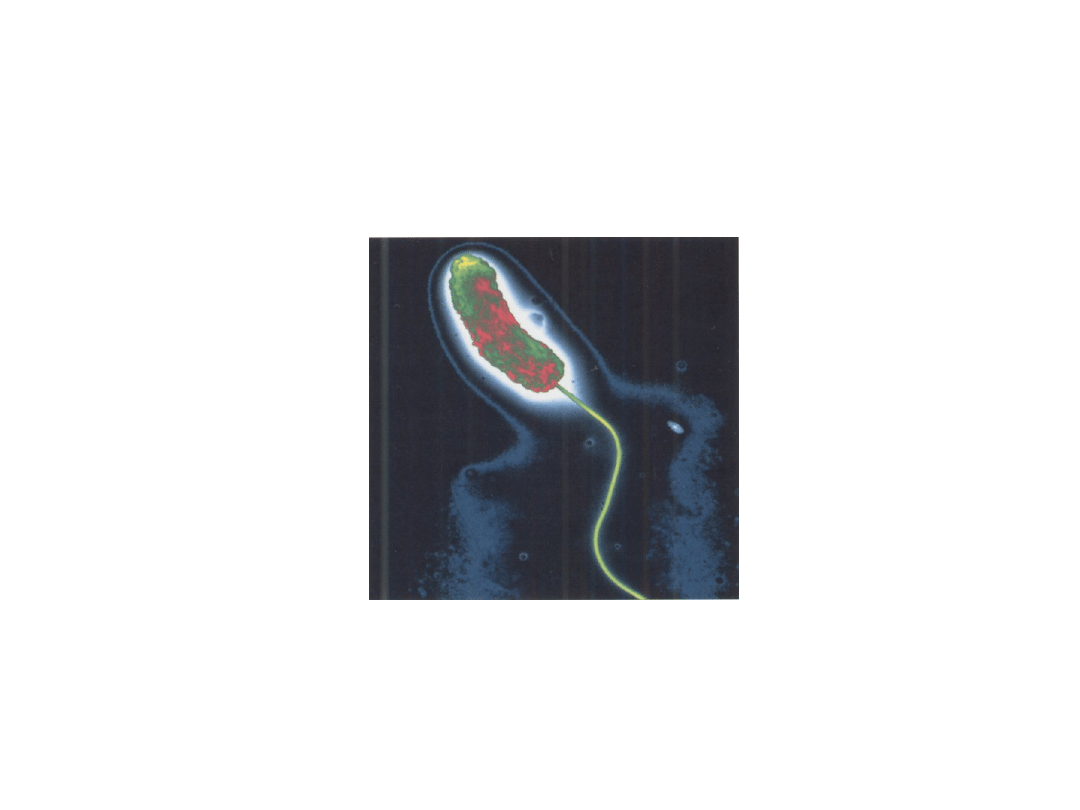
Przecinkowce - Vibrio

Ziarniaki - Coccus
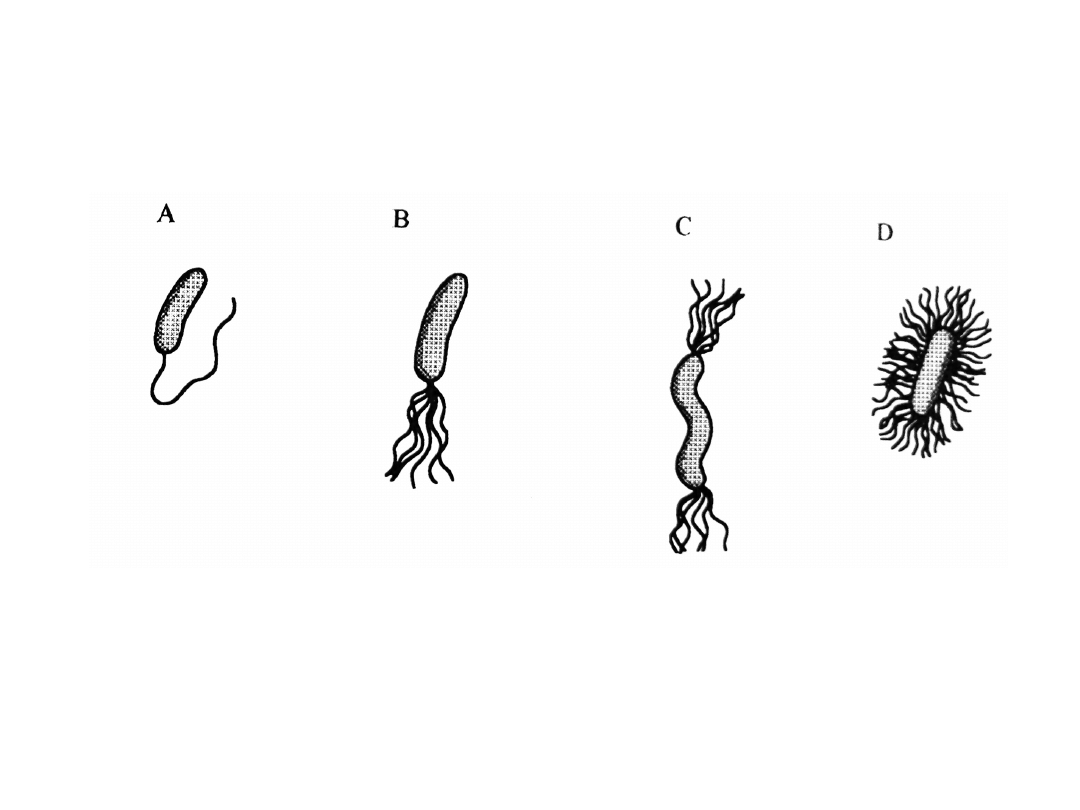
Zdolność do ruchu – rzęski
występowanie i sposób ułożenia rzęsek jest cechą o
znaczeniu taksonomicznym
Taksja – ukierunkowany ruch jako odpowiedź na bodźce
zewnętrzne: chemo-, foto-, aero-, magneto-, termotaksja
monotrichal
ne
lofotrichaln
e
amfitrichalne
peritrichaln
e
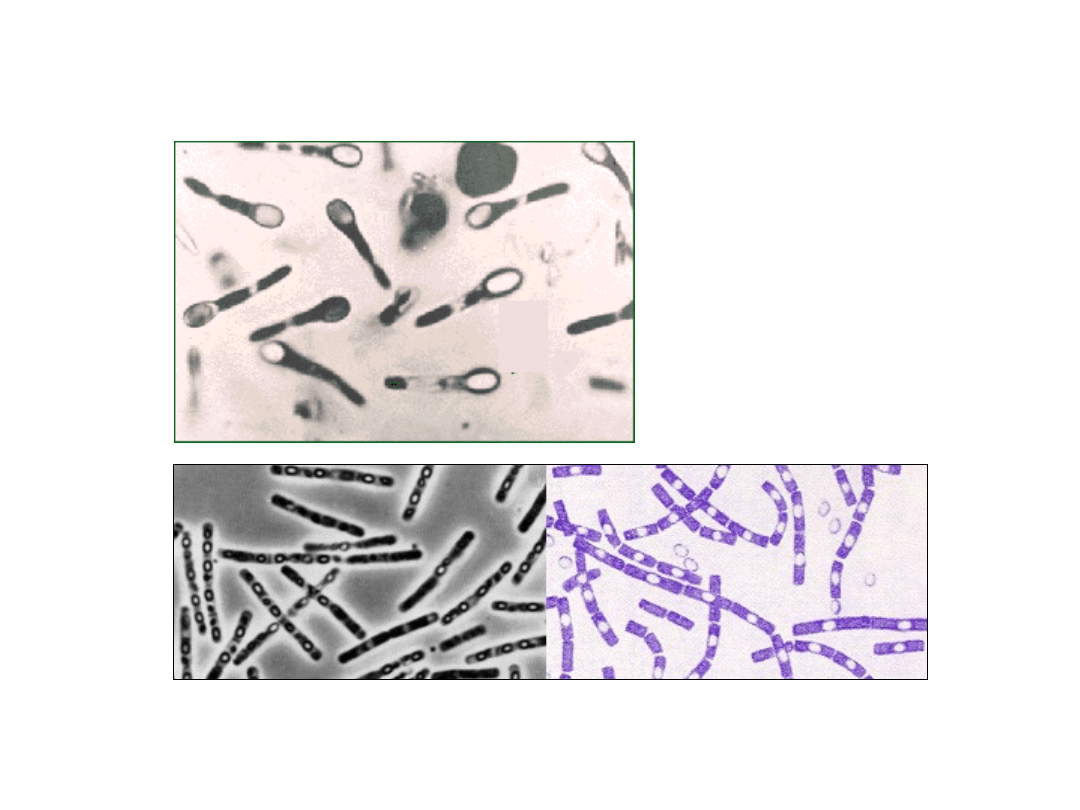
Formy przetrwalne bakterii - endospory
Clostridium tetani
Bacillus thuringiensis
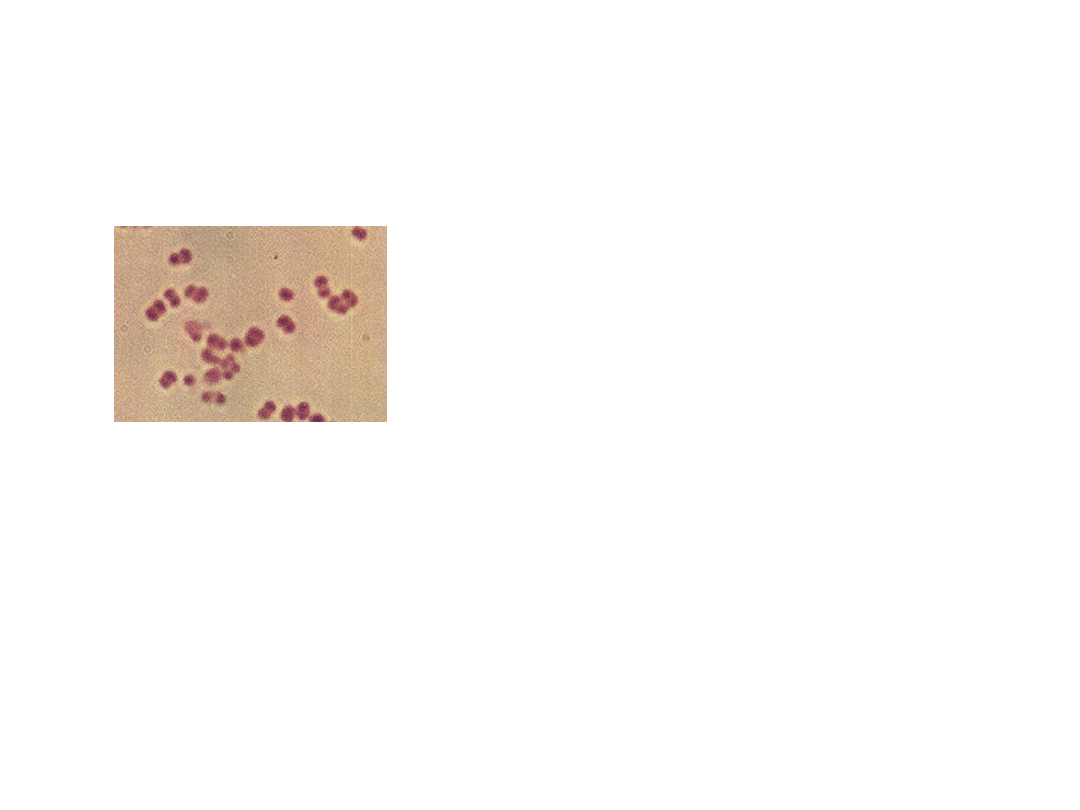
Otoczki bakteryjne
Neisseria meningitidis
dwoinka G-
wytwarza polisacharydową
otoczkę
optymalna temp. wzrostu 37°C
wzrost na pożywkach
wzbogaconych z dodatkiem
krwi
Postacie kliniczne zakażeń N. meningitidis
posocznica z zapaleniem opon mózgowo-rdzeniowych – 60%
posocznica z zapaleniem opon mózgowo-rdzeniowych – 60%
zakażeń inwazyjnych, śmiertelność ≤ 11%
zakażeń inwazyjnych, śmiertelność ≤ 11%
posocznica – 20% zakażeń inwazyjnych, śmiertelność 20 – 53%
posocznica – 20% zakażeń inwazyjnych, śmiertelność 20 – 53%
zapalenie
opon
mózgowo-rdzeniowych
–
20%
zakażeń
zapalenie
opon
mózgowo-rdzeniowych
–
20%
zakażeń
inwazyjnych, śmiertelność ≤ 1,2%
inwazyjnych, śmiertelność ≤ 1,2%
zapalenie spojówek, osierdzia, stawów, płuc
zapalenie spojówek, osierdzia, stawów, płuc
substancja czynna szczepionki – wyizolowane i
substancja czynna szczepionki – wyizolowane i
oczyszczone polisacharydy otoczki
oczyszczone polisacharydy otoczki
N.
N.
meningitidis
meningitidis

Obserwacja komórek bakterii
• Obserwacje mikroskopowe żywych bakterii
nie pozwalają na rozpoznanie kształtów i
szczegółów struktur komórkowych. Kształt
bakterii obserwuje się zwykle po ich
wybarwieniu.
• Do celów diagnostycznych stosuje się
barwienie różnicujące, metodę Grama,
która jest podstawą podziału bakterii na
dwie grupy o odmiennych cechach
fizjologicznych i biochemicznych.

Hans Christian Gram
(13.09.1853 –
14.11.1938)
Duński farmakolog i
lekarz. W roku 1884
opublikował
autorską
metodę
barwienia
bakterii.
Dokonał przełomowego
odkrycia
przyczyniającego się do
rozwoju mikrobiologii
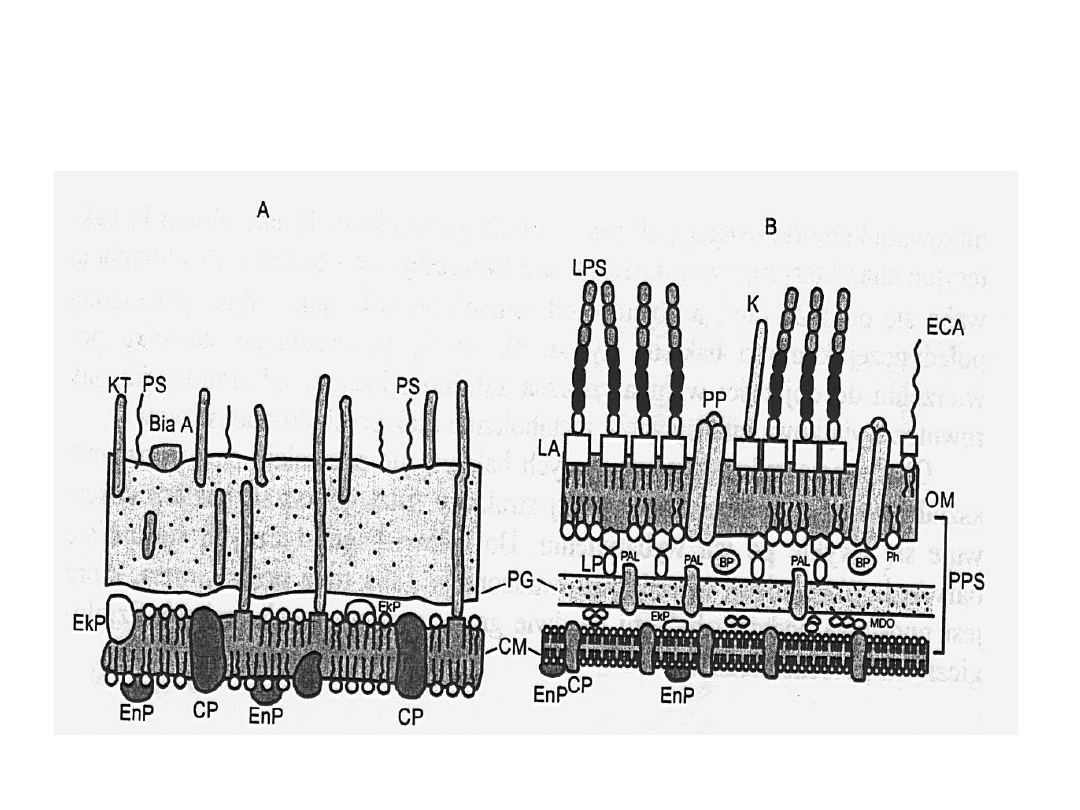
Budowa ściany komórkowej bakterii G- i G+
G+
G-

Mechanizm barwienia metodą Grama
1. Komórki bakteryjne (G+ i G-) barwią się fioletem
krystalicznym.
2. Dodanie płynu Lugola powoduje, że fiolet reaguje z jodem, w
wyniku czego tworzą się stosunkowo duże kompleksy złożone z
barwnika i jodu.
3. Płukanie alkoholem powoduje, że w komórkach G+ następuje
zmniejszenie pustej przestrzeni w wielowarstwowych ścianach
komórkowych, mających wygląd wielu (ok. 50) nałożonych na
siebie siatek mureiny. W rezultacie kompleksy fioletu
krystalicznego z jodem nie mogą ulec wypłukaniu, co w
przypadku 1-2 warstw u bakterii G- nie jest przeszkodą i alkohol
świetnie wypłukuje barwnik.
4. Po zakończeniu płukania komórki G+ są fioletowe, zaś G- -
bezbarwne.
5. Dodatkowy barwnik np. fuksyna dobarwi komórki G- na kolor
czerwony, nie zmieniając barwy komórek G+.
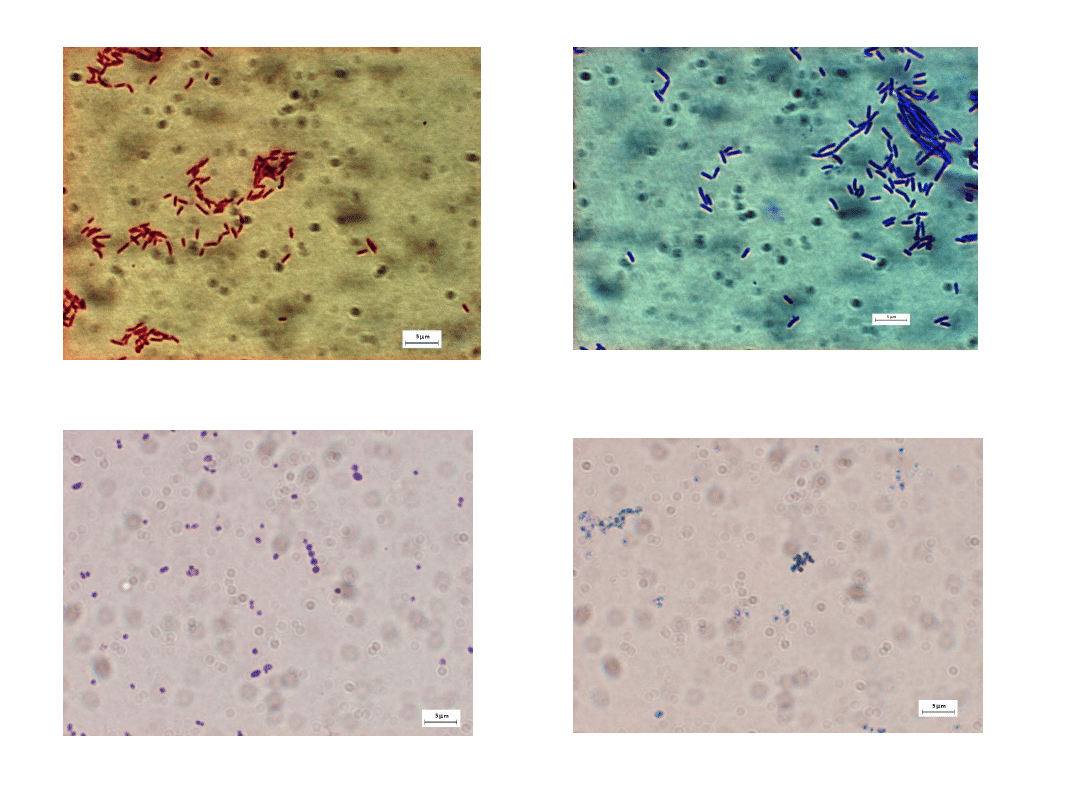
Thermus Thermophilus - barwienie metodą Grama i błękitem
metylenowym
Deinococcus geothermalis – barwienie metodą Grama i błękitem
metylenowym

Promieniowce - Actinomycetales
• Bakterie, których komórki, w postaci cienkich
nitek, tworzą rozgałęzienia na wzór strzępków
grzybni; promieniowce tworzą też zarodniki
(spory, konidia).
• O przynależności do bakterii decydują: brak
jądra komórkowego, podobny skład chemiczny
ściany komórkowej, wrażliwość na fagi.
• Naturalne środowisko: gleba, rozkładająca się
masa roślinna, wilgotne stogi siana, torfowiska,
sterty odpadów organicznych, rzadziej zbiorniki
wodne.

Promieniowce - Actinomycetales
• Przeważnie tlenowce
• Są chemoorganotrofami
• Optymalna temperatura wzrostu 25-30 °C (zakres
15-37°C)
• Optymalne pH bliskie 7 (zakres 5,0-9,0)
• Barwią się Gram dodatnio
• Tworzą 3 rodzaje pseudogrzybni (powietrzną,
substratową i wgłębną)
• Rozmnażają się przez podział nitek pseudogrzybni
oraz zarodniki

Promieniowce - Actinomycetales
Najważniejsze rodzaje promieniowców
• Actinoplanes
• Geodermatophilus
• Micromonospora
• Nocardia
• Streptomyces
Klasyfikacja na podstawie cech morfologicznych,
fizjologicznych i pigmentacji

Promieniowce -
Actinomycetales
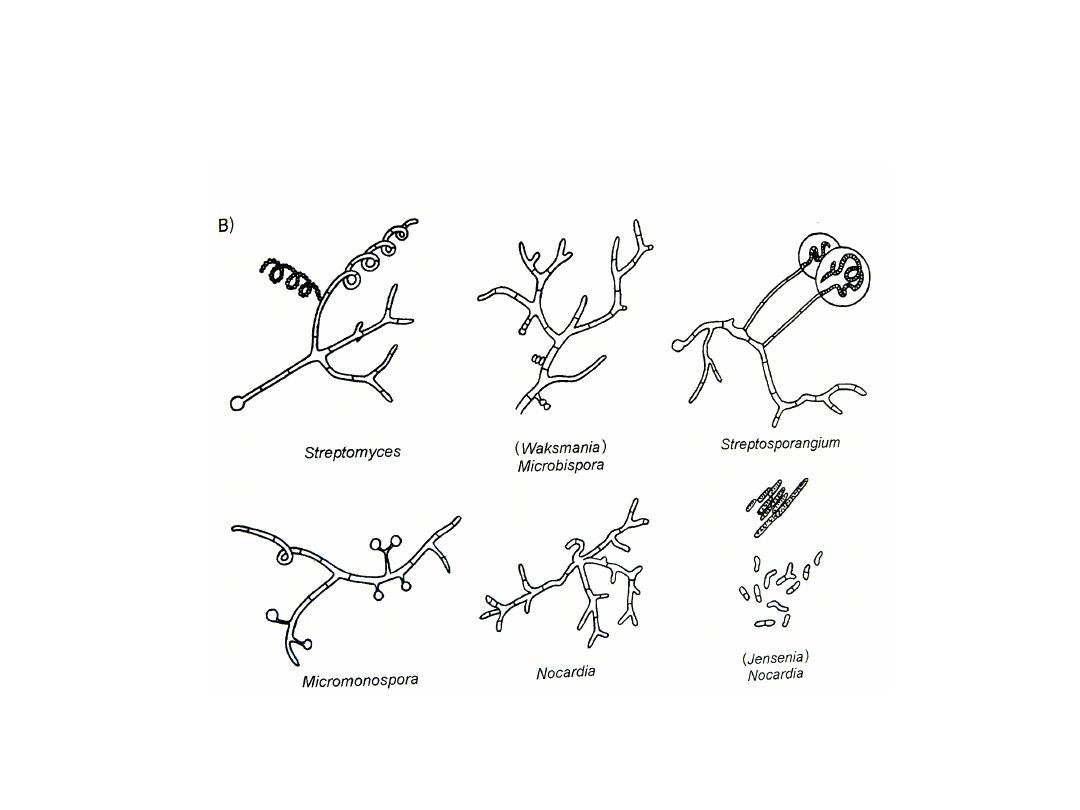
Morfologia strzępek i układów sporonosnych
promieniowców

Przemysłowe zastosowanie bakterii
właściwych
i promieniowców
Promieniowce
• produkcja
antybiotyków
(np.
aktynomycyna,
amfoterycyna B, kanamycyna, neomycyna, nystatyna,
tetracyklina)
• produkcja leków steroidowych - biokonwersja (kortyzon,
hydrokortyzon)
• produkcja witamin (witamina B
12
)
• produkcja enzymów (proteazy, izomeraza glukozowa)

Przemysłowe zastosowanie bakterii
właściwych
i promieniowców
Bakterie właściwe
• produkcja kwasu octowego (Acetobacter sp.)
• produkcja kwasu mlekowego (Lactobacillus delbrueckii)
• produkcja fermentowanych produktów mlecznych (Lactococcus
lactis, Streptococcus thermophilus, Lactobacillus acidophilus)
• produkcja nizyny (Lactococcus lactis)
• produkcja kwasu glutaminowego (Corynebacterium
glutamicum)
• produkcja antybiotyków (Bacillus brevis – gramicydyna S)
• produkcja etanolu (Zymomonas mobilis)
źródło genów kodujących enzymy
nośnik obcych genów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Znaczenie bakterii w przemyśle(1)
Wykorzystanie bakterii fermentacji mlekowej w przemyśle
karta pomiarowa bakterie mlekowe 09, Mikrobiologia Przemysłowa, MP
bakterie mlekowe zastosowanie lab w przemysle mleczarskim
Tadeusz Przemysłw Trzmiel Biotechnologiczne znaczenie bakterii Bacillus
notatek pl klimek Ochab, mikrobiologia przemys owa,Bakterie kwasu octowego
klimek Ochab, mikrobiologia przemysłowa,Bakterie kwasu octowego
bakterie mlekowe zastosowanie lab w przemysle mleczarskim
Bakterie spiralne do druk
choroby wirus i bakter ukł odd Bo
chemioterapia zakazeń bakteryjnychskrócona
Bakterie 2
Szkol Lampy bakteriobójcze
CHEMIOTERAPEUTYKI W CHOROBACH BAKTERYJNYCH
Bakterie w biotech
bakteria 2 ppt
więcej podobnych podstron