1. Wpływ kwasów na
metale
1a. Do pierwiastków który posiada ujemny
potencjał należy Zn
E
o
(Zn/Zn2+)
= - 0,76 V
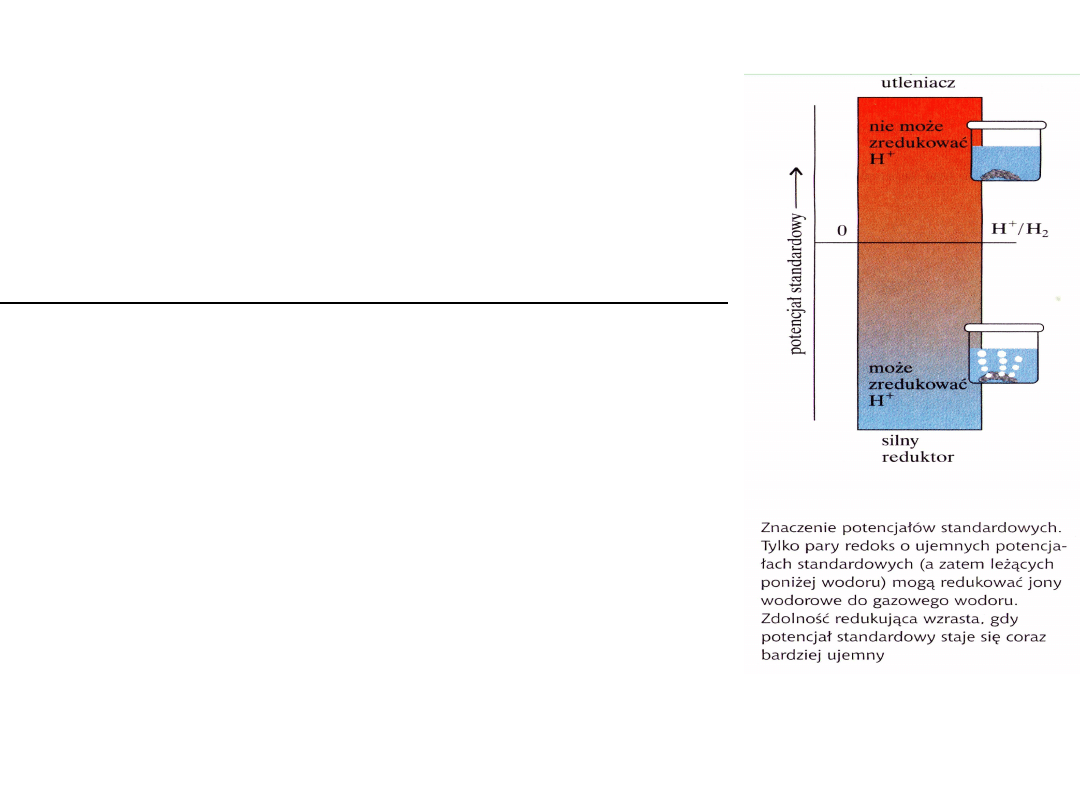
Potencjały standardowe metali przybierają wartości
ujemne lub dodatnie zawsze względem wodoru , dla
którego potencjał reakcji 2H
+
(aq)
+ 2e = H
2(g)
wynosi
0.
Jeśli złożymy ogniwo z elektrody wodorowej i cynkowej,
to w takim ogniwie reakcja będzie przebiegać, ponieważ
cynk ma ujemny potencjał tzn. ma zdolności redukujące.
W ogniwie reakcja sumaryczna :
Zn
(s)
+ 2H
+
(aq)
Zn
2+
(aq)
+ H
2(g)
Cynk redukuje jony
wodorowe do
gazowego wodoru
Wszystkie pierwiastki o potencjałach mniejszych od wodoru mają
zdolność redukcji wodoru , czyli wypierania wodoru z kwasów
beztlenowych i tlenowych.

Na podstawie standardowych potencjałów elektrod możemy przewidywać kierunek
reakcji samorzutnych. np.: Mg, Fe, In, Sn, Pb i inne metale o ujemnych potencjałach
wykazują dążność do redukowania jonów wodorowych w roztworach kwasów i wypierania
tych jonów jako gazowego wodoru czyli redukowania H
+
do H
2
1. Reakcja metalu o ujemny potencjale
z kwasem beztlenowym
a) Zn + 2HCl ZnCl
2
+
H
2
2. Reakcja metalu o ujemnym
potencjale z kwasem tlenowym:
a) Zn + 2HNO
3
Zn(NO
3
)
2
+
H
2
b) Sn + HNO
3
Sn(NO
3
)
2
+
H
2
b) 2Na + 2HCl 2NaCl +
H
2
W praktyce występuje wyjątek
Al-glin
2Al + 6 HCl 2AlCl
3
+ 3
H
2
wypiera wodór z kwasów
beztlenowych i tlenowych –
ROZCIEŃCZONYCH
2Al + 6HNO
3
2Al(NO
3
)
3
+ 3H
2
Al nie reaguje ze stężonym HCl i
HNO
3
Al + HCl
(stęż.)
pasywacja
Al + HNO
3
(stęż)
pasywacja
Kwas HNO
3
to kwas silnie
utleniający, utworzone jony Al
3+
natychmiast tworzą warstewkę
tlenku Al
2
O
3
na powierzchni
metalu. Warstwa tlenku
uniemożliwia dalsza reakcję.
Metal został spasywowany
(zabezpieczony przed dalsza
reakcją).
Pasywacja – wytworzenie ochronnej
warstwy tlenku Al
2
O
3
na powierzchni
metalu
Pasywacja -
glinu umożliwia
zastosowanie glinu do produkcji
puszek do napojów, samolotów czy
ram okiennych
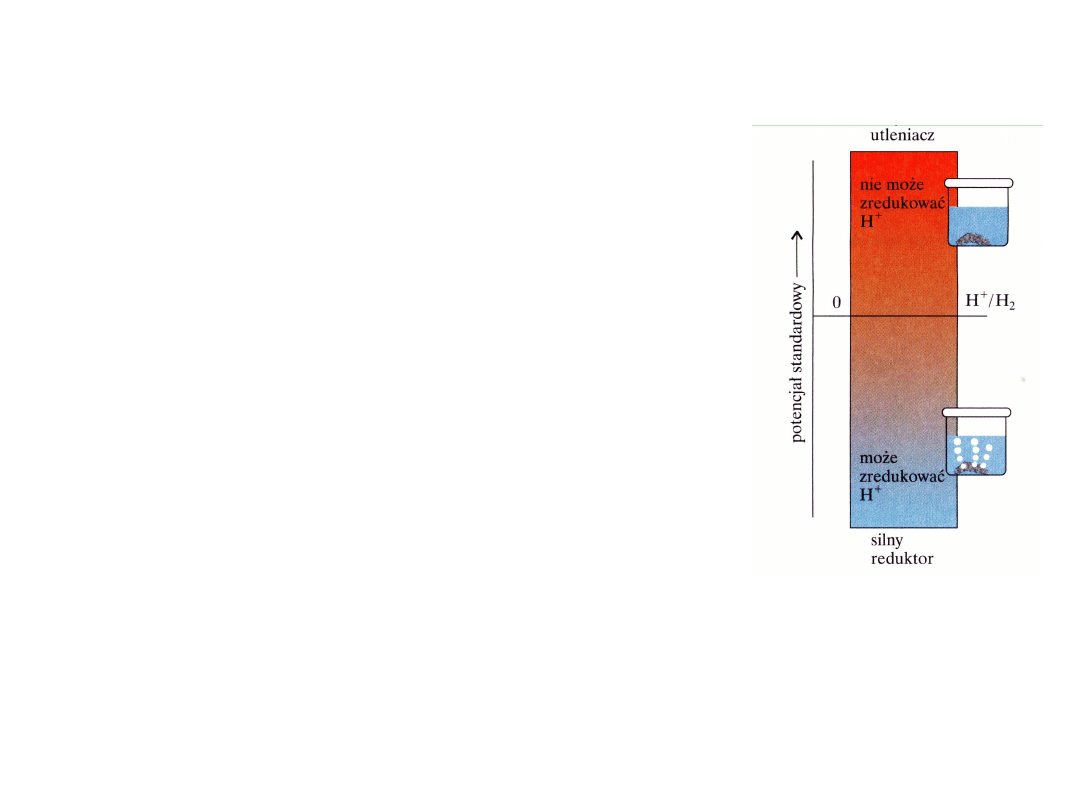
Do pierwiastków który posiada dodatni potencjał
należy Cu
E
o
(Cu2+/Cu)
= + 0,34 V
Wszystkie pierwiastki które, w szeregu potencjałów
posiadają dodatnie wartości potencjału nie mają
zdolności redukcji wodoru.
NIE WYPIERAJĄ WODORU Z KWASÓW
BEZTLENOWYCH
Cu + HCl nie
zachodzi
Ag + HCl nie
zachodzi
Au + HCl nie
zachodzi
Miedź i metale szlachetne (Ag, Pt, Au, Ag) nie
zostają utlenione przez jony wodorowe.
Jest to jeden z powodów, dla których są one od
dawna używane do produkcji monet.
1b. Metale o dodatnim potencjale elektrodowym

3Cu + 8HNO
3
3Cu(NO
3
)
2
+ 2NO +
4H
2
O
Cu nie reaguje z HCl ale może reagować z HNO
3
nie wypiera wodoru ale wypiera NO
lub NO
2
Cu + 4HNO
3(steż.)
Cu(NO
3
)
2
+ 2NO
2
+
2H
2
O
Bezbarwn
y gaz
Brunatn
y gaz
V
V
II
V
V
IV
Stopień utlenienia miedzi wzrósł z 0 do II jest więc ona reduktorem, a stopień
utlenienia azotu zmalał z V na II lub IV – wniosek : kwas azotowy(V) jest
utleniaczem
Metale które posiadają dodatnie potencjały elektrodowe (Ag, Cu, Au, Hg, Pt) nie
reagują z kwasami beztlenowymi ale reagują z kwasami tlenowymi (kwasy
utleniające) z wydzieleniem odpowiednich tlenków- które z kwasów mogą się
wydzielać (No, NO
2
, SO
2
)
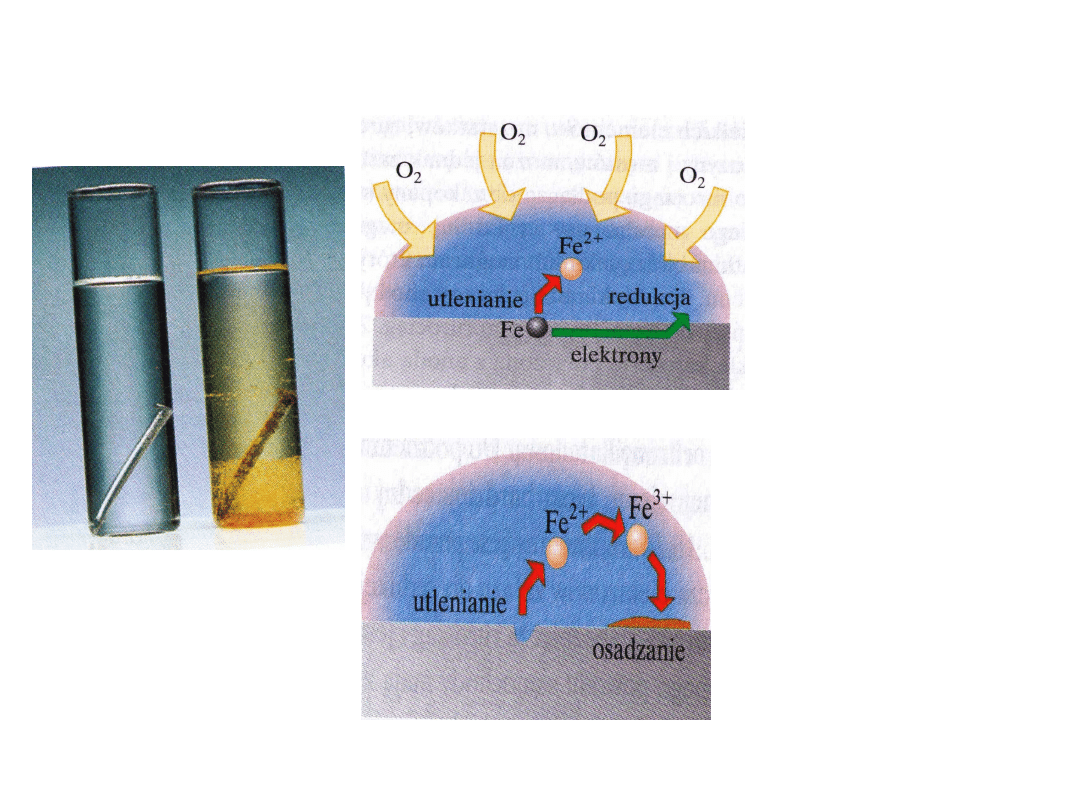
2. KOROZJA
Korozja jest niepożądanym utlenianiem metalu,
skraca ona żywotność produktów ze stali – mostów ,
samochodów.
Korozja jest procesem
elektrochemicznym.
Główna winowajczynią w korozji jest
woda.
Gwóźdź
żelazny
przechowywa
ny w wodzie
pozbawionej
tlenu nie
rdzewieje
Gdy obecny
jest tlen (w
wyniku
rozpuszczania
powietrza w
wodzie)
utlenianie
żelaza zachodzi
samorzutnie i
zaraz tworzy
się rdza.
Na brzegu kropli tlen
rozpuszczony w wodzie
utlenia żelazo. Elektrony
wyciągnięte z metalu w
wyniku tego utleniania
mogą zostać uzupełnione
elektronami z innej
części przewodzącego
metalu.
Tutaj atomy oddają swe
elektrony i tworzą jony Fe
2+
które odpływają w głąb
otaczającej wody.
W wyniku tego tworzą się
małe zgłębienia. Jony Fe
2+
zostają utlenione do Fe
3+
przez rozpuszczony tlen. Te
jony strącają się następnie
w postaci uwolnionych
tlenków żelaza(II)
Fe
2
O
3
•H
2
O - RDZA
Korozję żelaza przyspiesza obecność tlenu,
wilgoci i soli.

Co się dzieje w trakcie korozji :
2 H
2
O
(c)
+ 2e H
2(g)
+ 2OH
-
(aq)
E
0
= - 0,83 V dla pH=14 ale
już
E
0
= -0,42 dla pH=7
Fe - 2e Fe
2+
E
0
= - 0,44 V
W czystej wodzie pozbawionej tleny sama woda nie jest w stanie utlenić
żelaza do jonów Fe
2+,
ponieważ potencjały reakcji rozkładu wody i reakcji
utleniania żelaza są prawie takie same
Jednak gdy w wodzie obecny jest rozpuszczony tlen to po uwagę należy brać
reakcje
O
2(g)
+ 4H
+
+ 4e 2H
2
O dla której przy pH= 7 E
0
= + 0,82V
Fe - 2e Fe
2+
E
0
= - 0,44 V
Potencja reakcji rozkładu tlenu w wodzie jest dużo wyższy od
potencjału żelaza – a więc tlen i woda łącznie mogą utlenić żelazo
Document Outline
Wyszukiwarka
Podobne podstrony:
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
Szeregi Fouriera
wyklad 12nowy procesy elektrodowe i korozja
KOROZJA BIOLOGICZNA II
WYKŁAD 7 Szeregowy regulacja hamowanie
korozja i tarcie
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
14 Korozja metali i stopów
Analiza matematyczna, lista analiza 2008 6 szeregi
1 2085 (2316+S) odporna na korozję na formy
Badanie szeregowego polaczenia RLC
korozja teoria
Microsoft Word W14 Szeregi Fouriera
korozja teoria(1)
całki, szeregi zadania z kolosa wykład 21 03 2009
więcej podobnych podstron