
Wiązanie kowalencyjne
spolaryzowane
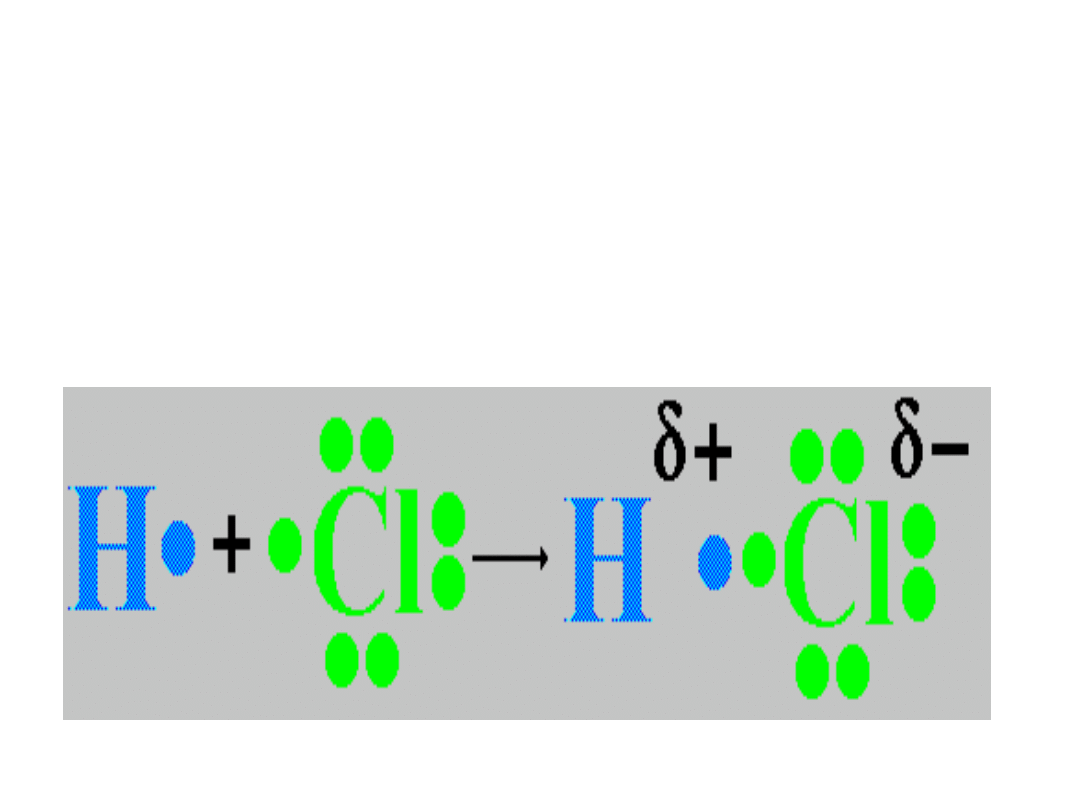
WIĄZANIE KOWALENCYJNE
SPOLARYZOWANE
• Wiązanie utworzone przez wspólną parę elektronową,
przesuniętą w kierunku jednego z atomów o większej
wartości elektroujemności, nazywamy wiązaniem
kowalencyjnym spolaryzowanym
.

• Wiązanie kowalencyjne spolaryzowane - występuje w
cząsteczkach heterojądrowych , których różnica
elektroujemności między pierwiastkami składowymi nie
przekracza 1,7 wg skali Paulinga . Powstawanie tego
wiązania polega na utworzeniu wspólnych par
elektronowych. Atom bardziej elektroujemny przyciąga je
bliżej siebie, deformuje chmurę elektronową.
• Zjawisko to nosi nazwę polaryzacji wiązania. Polaryzacja
polega na tym, że wspólna para elektronowa nie należy w
jednakowym stopniu do obu atomów, lecz jest przesunięta
w kierunku atomu bardziej elektroujemnego. Skutkiem
polaryzacji jest niesymetryczny rozkład ładunku
elektrycznego w cząsteczce. Cząsteczka ma więc budowę
dwubiegunową i nazywa się dipolem elektrycznym.

• Wiązanie kowalencyjne
spolaryzowane ma właściwości
pośrednie między typowym
wiązaniem jonowym a
kowalencyjnym niespolaryzowanym.
• Miarą polarności wiązań jest moment
dipolowy (µ).

• Moment dipolowy cząsteczki(µ) –
wielkość fizyczna charakteryzująca dipol
elektryczny, określana jest jako wektor
skierowany wzdłuż osi cząsteczki od jej
punktowego ładunku ujemnego do
dodatniego. Wartość momentu dipolowego
określa zależność:
µ =σ·l
σ – wartość ładunku cząstkowego
l – odległość między biegunami

Cechy związków chemicznych
zawierających wiązania
kowalencyjne
:
• tworzą kryształy kowalencyjne lub
cząsteczkowe;
• nie dysocjują (z wyjątkiem kwasów, które
mają wiązania spolaryzowane);
• nie przewodzą prądu elektrycznego;
• rozpuszczają się w rozpuszczalnikach
niepolarnych lub słabo polarnych;
• reakcje z ich udziałem zachodzą wolniej;
• mają stosunkowo niskie temperatury
wrzenia i topnienia.
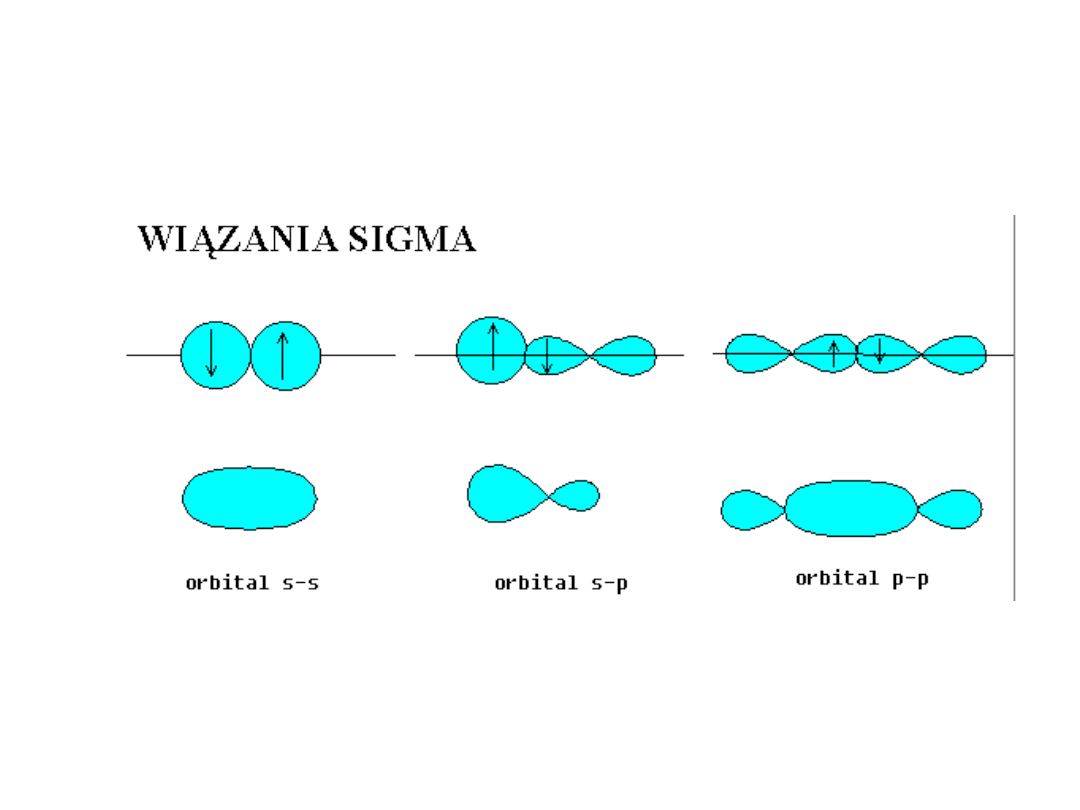
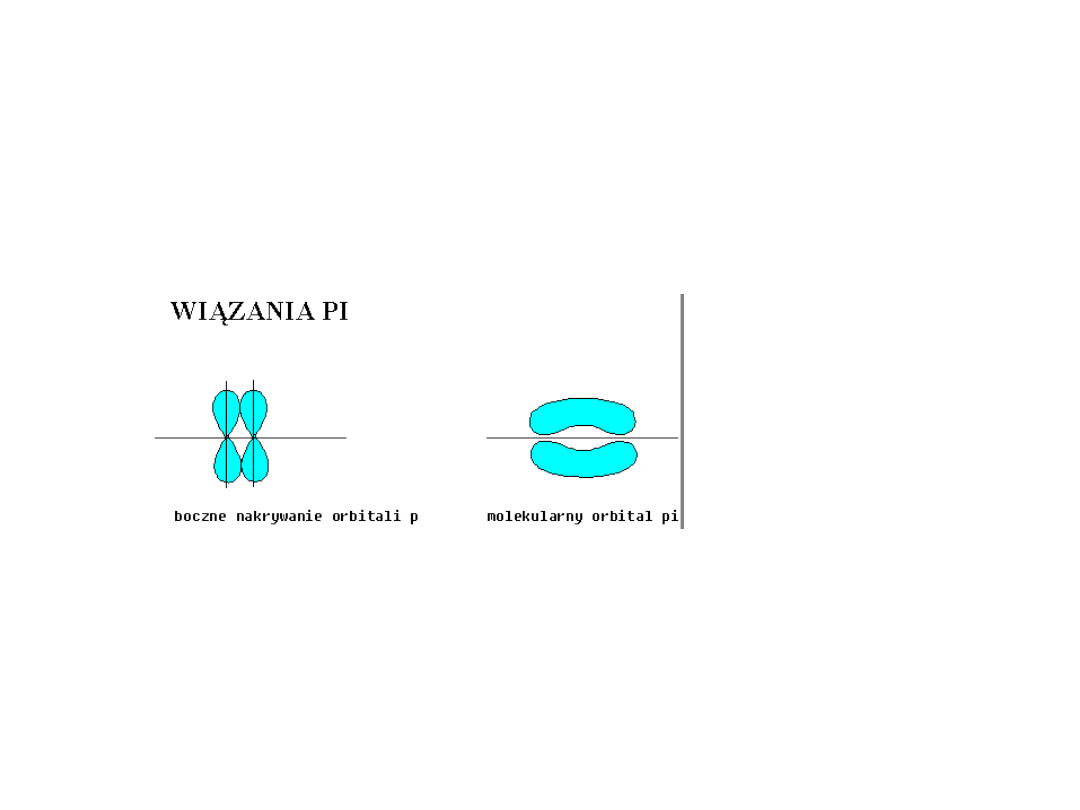

• Wiązanie utworzone przez parę
elektronową, które
ukierunkowane jest wzdłuż osi
łączącej oba atomy, nazywamy
wiązaniem sigma (s), natomiast
wiązanie powstające podczas
bocznego nakrywania się
orbitali, nazywamy wiązaniem pi
(p).

Orbital wiążący i
antywiążący
• Dla dwuatomowej cząsteczki takich
samych atomów typu A
2
rozwiązaniem
funkcji falowej elektronu w cząsteczce są
dwie funkcje własne: orbital wiążący oraz
orbital antywiążący. Orbitale te różnią się
energią, przy czym orbital wiążący
charakteryzuje się mniejszą energią od
wyjściowych orbitali atomowych, a
orbital antywiążący większą .
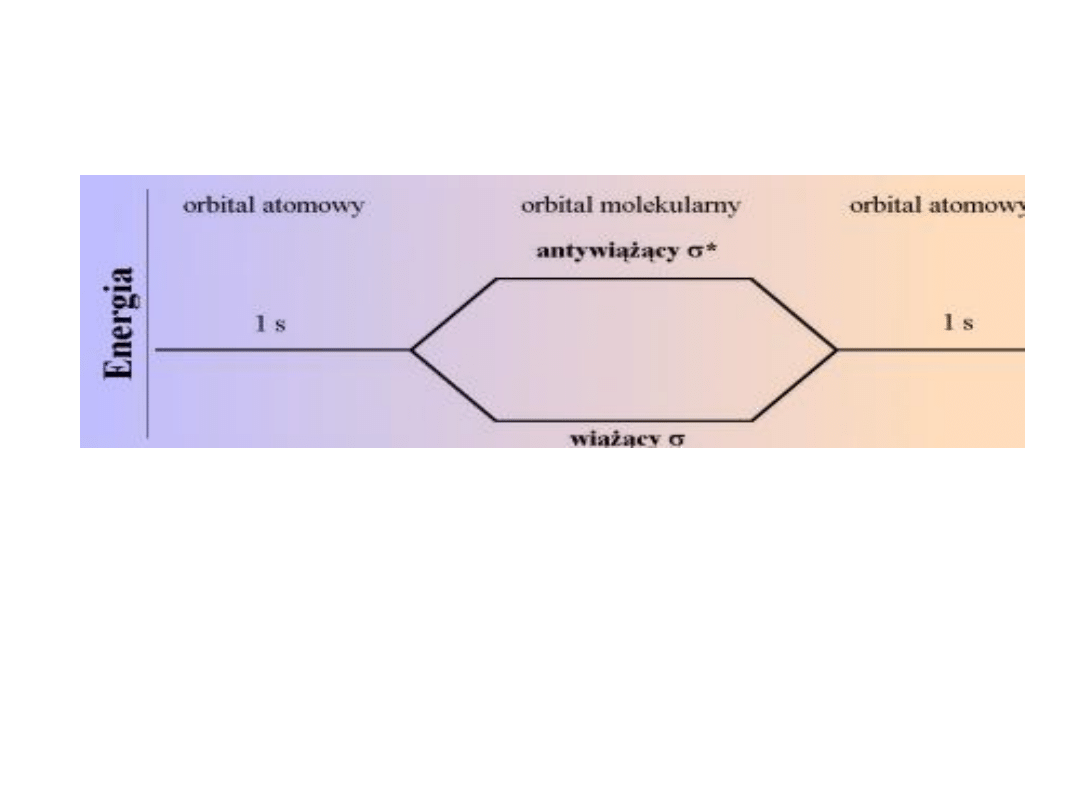
• Trwałość wiązania zależy od ilości
elektronów na obu typach orbitali. Jeśli ilość
elektronów na orbitalach wiążących jest
większa od ilości elektronów na orbitalach
antywiążących, to wiązanie jest trwałe.

• W przypadku atomów, które tworzą wiązania z udziałem orbitali
atomowych s – s, s - p lub współliniowo leżących orbitali p (py – py;
oś y jest kierunkiem zbliżania się atomów) powstaje wiążący orbital
cząsteczkowy σ i antywiążący orbital cząsteczkowy σ *. Orbital
wiążący charakteryzuje się zwiększoną gęstością elektronów w
przestrzeni między jądrami. Para elektronów zajmująca ten orbital
nosi nazwę wiążącej i tworzy trwałe wiązanie. Orbital antywiążący
σ* charakteryzuje się mniejszą gęstością elektronów w przestrzeni
między jądrami, co powoduje, że jądra atomów odpychają się.
Ilustracją tworzenia wiązań σ i σ * są oddziaływania
międzyatomowe w cząsteczce H
2
i nie istniejącej cząsteczce He
2
.
Cząsteczka H
2
powstaje w wyniku utworzenia orbitalu
cząsteczkowego z orbitali 1s atomów wodoru. Przez nałożenie się
dwu orbitali atomowych powstają dwa orbitale cząsteczkowe σ i σ
*. W cząsteczce wodoru obydwa elektrony obsadzają orbital o
niższej energii, a orbital * pozostaje nie zajęty. W czasie tworzenia
wiązania wydziela się energia (energia wiązania), a układ jest
trwały ze względu na uzyskanie uprzywilejowanego stanu
energetycznego charakteryzującego się minimum energii.

• Cząsteczka H
2
powstaje w wyniku
utworzenia orbitalu cząsteczkowego z
orbitali 1s atomów wodoru. Przez nałożenie
się dwu orbitali atomowych powstają dwa
orbitale cząsteczkowe σ i σ *. W cząsteczce
wodoru obydwa elektrony obsadzają orbital
o niższej energii, a orbital * pozostaje nie
zajęty. W czasie tworzenia wiązania
wydziela się energia (energia wiązania), a
układ jest trwały ze względu na uzyskanie
uprzywilejowanego stanu energetycznego
charakteryzującego się minimum energii.

Cząsteczka He
2
?
• Podczas tworzenia się hipotetycznej
cząsteczki He
2
, powstałyby orbitale
cząsteczkowe σ i σ *, które zostałyby zajęte
przez cztery elektrony 1s
2
obu atomów helu.
Utworzyłby się układ, w którym ilość
elektronów na orbitalu wiążącym i
antywiążącym byłaby taka sama. To nie
spowodowałoby obniżenia energii układu,
ponieważ suma energii orbitalu σ i σ * nie
jest mniejsza od sumy energii orbitali
atomowych 1s
2
. Cząsteczka He
2
nie może
być trwała, czego skutkiem jest
występowanie helu w postaci atomowej.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
dewitrifikator, granica plastycznośi, ferryt, wiązania kowalencyjne
Właściwości związków z wiązaniem kowalencyjnym
45 Znaczenie polaryzacji wiazan kowalencyjnych dla wlasciwosci fizykochemicznych wody
chemia pytania wiązania jonowe i kowalencyjne
chemia pytania wiązania jonowe i kowalencyjne
Charakterystyka wiązań jonowych, kowalencyjnych, metalicznych, jonowych
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
Eliade Kowale i alchemicy Rytualy i sekrety metalurgow
Pecznienie to zdolnosc odwodnionych koloidow do wiazania wody
2 Atom i cząstka Wiązania chemiczne klucz
2 Atom i cząstka Wiązania chemiczne
Technologia?tonu Czas wiązania?mentu
więcej podobnych podstron