1. PRAWO ZACHOWANIA MASY XVIII
WIEK
ANTOINE LAURENT LA VOISIER, DYMITR
ŁOMONOSOW
Całkowita masa układu reagującego jest taka sama przed
reakcją jak po reakcji.
m = const
Masa substratów jest równa masie produktów reakcji.
2 HgO → 2Hg + O
2
2 AgNO
3
+ Na
2
S → ↓ Ag
2
S + 2 NaNO
3
∆H
2
NaOH + HCl → NaCl + H
2
O ∆H
3
Hg
O
2
HgO

Albert Einstein wykazał równoważność masy i energii
E = mc
2
c = 300
000Km/s
E = [J]
m = [g], [J]
1g = 9 10
13
J [g m
2
/s
2
]
W reakcjach rozszczepienia i syntezy jąder
znaczna
część
masy
m
1
przechodzi w energię
2 . PRAWO ZACHOWANIA MATERII XIX
235
U + n
142
Ba +
91
Kr + 3
1
0
n ∆H
powstaje ok. 200
izotopów 35 pierwiastków
1000g U
8,23 10
13
J
0,915 g
0,1 % masy U
Prawo zachowania materii
Suma masy i energii w układzie zamkniętym jest stała i
nie zależy od zmian zachodzących w układzie.
( m + E/c
2
) = const
( m + m
1
)
E = m
1
c
2
m
1
= E/c
2

3. PRAWO STAŁOŚCI SKŁADU PROUST XVIII
Stosunek wagowy pierwiastków w związku chemicznym jest
wielkością stałą.
AB
m
A
- masa atomu A
w CO
2
:
m
B
- masa atomu B
m
A
/m
B
= const
% C = 27,27
% O =
72,73
m
C
m
O
1 12
2 16
3
8
Substancje reagują ze sobą w określonych stosunkach
wagowych ; stosunek ilościowy reagentów to stosunek
stechiometryczny.
Każdemu związkowi chemicznemu odpowiada ściśle określony,
niezmienny skład ilościowy.
Twierdzenie odwrotne jest niesłuszne
( benzen i acetylen : 7,69 % H , 92,31
% )
Odstępstwa :
Związki międzymetaliczne np. Cu
5
Zn
6
mogą zmieniać skład
ilościowy w granicach kilku % ( podstawianie atomów, niepełne
obsadzenie węzłów sieciowych itp.
Nazywa się je bertolidy. Y Al.
1, 3 – 0,9
Ge
0,7 – 1,1
Daltonidy stosują się do prawa stałości składu.

3. PRAWO STOSUNKÓW WIELOKROTNYCH DALTON XIX W.
Jeśli pierwiastki tworzą dwa lub więcej związków
chemicznych, to ilość
jednego pierwiastka
przeliczone na
takie same ilości
drugiego pierwiastka
mają się do siebie
jak niewielkie liczby całkowite proste.
Przykład :
NO
14 :
16
14 :
16
7 :
8
N
2
O
3
28 :
48
14 :
24
7 :
12
NO
2
14 :
32
14 :
32
7 :
16
N
2
O
5
28 :
80
14 :
40
7 :
20
Na
7
jednostek wagowych azotu
przypada
8;12;16;20
jednostek
wagowych tlenu
.
Teoria atomistyczna
:
ponieważ na jeden atom pierwiastka A może przypadać
tylko całkowita liczba pierwiastka B to ich masy muszą
być w prostych proporcjach liczbowych.
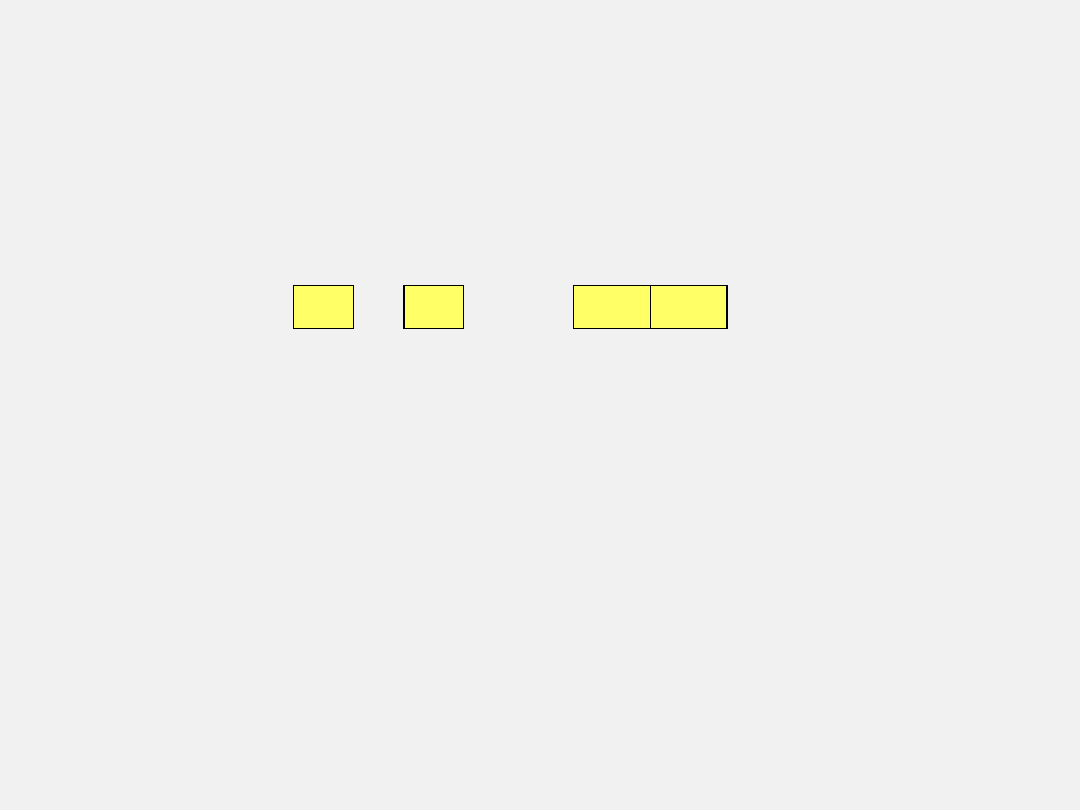
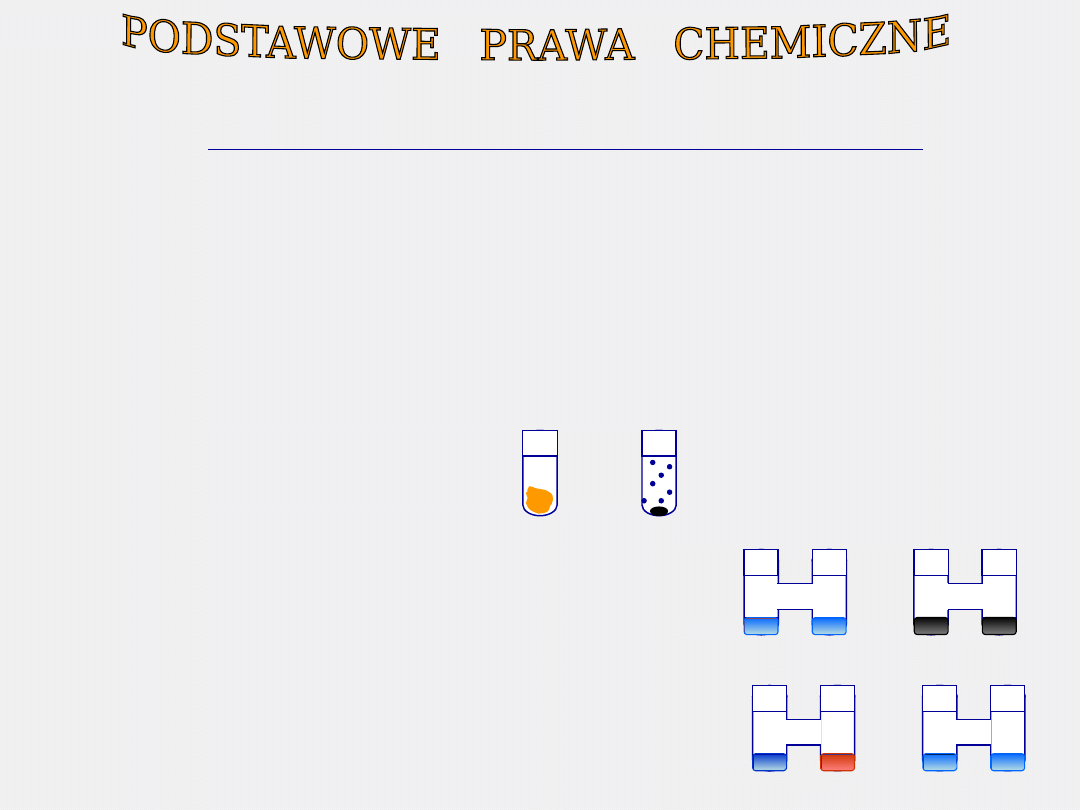
PRAWO PROSTYCH STOSUNKÓW OBJĘTOŚCIOWYCH
GAY LUSSAC
1805 r
Objętość gazów reagujących ze sobą i tworzących się w
wyniku reakcji chemicznej pozostają do siebie w stosunku
małych liczb całkowitych.
chlor + wodór → chlorowodór
Cl
2
+
H
2
HCl HCl
zawsze V chloru : V wodoru
= 1 : 1
:
2
Avogadro :
Jeśli
1 obj. + 1 obj. → 2
objętości
to
1 cząst. + 1 cząst. → 2 cząst.
cząsteczka cząsteczka
składa się składa się
z 2 atomów z 2 atomów
Gazy złożone są z cząsteczek
o określonej i stałej liczbie
atomów.
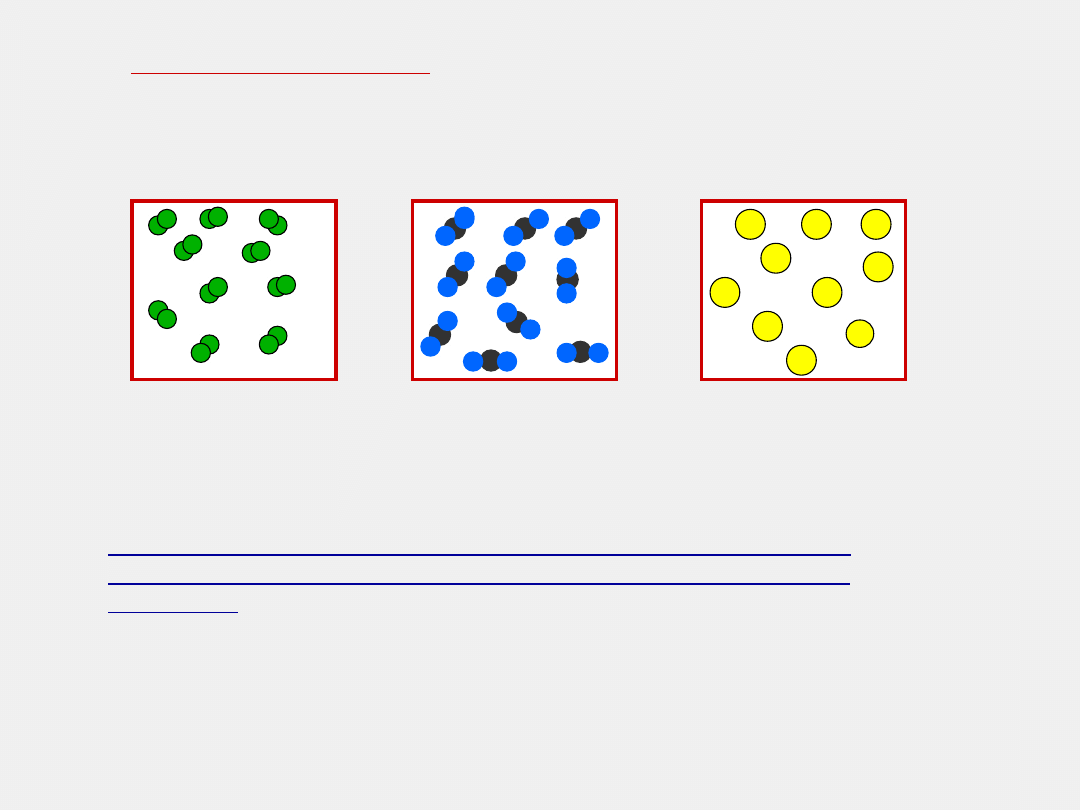
6. PRAWO AWOGADRO
W równych objętościach różnych gazów różnych gazów
w
tych samych
warunkach ciśnienia i temperatury
znajduje
się taka sama liczba cząsteczek.
Liczba cząsteczek N
2
w 1dm
3
= liczbie cząst. CO
2
w
1dm
3
Twierdzenie prowadzi do wniosku odwrotnego :
Równe liczby cząsteczek różnych gazów w tych samych
warunkach ciśnienia i temperatury zajmują jednakowe
objętości.
Mol N
2
, O
2
, CO
2
to taka sama liczba cząsteczek;
Więc objętość zajmowana przez mol każdego gazu będzie taka
sama w tych samych warunkach ciśnienia i temperatury.
Mol gazu w warunkach normalnych zajmuje
objętość 22,4 dm
3
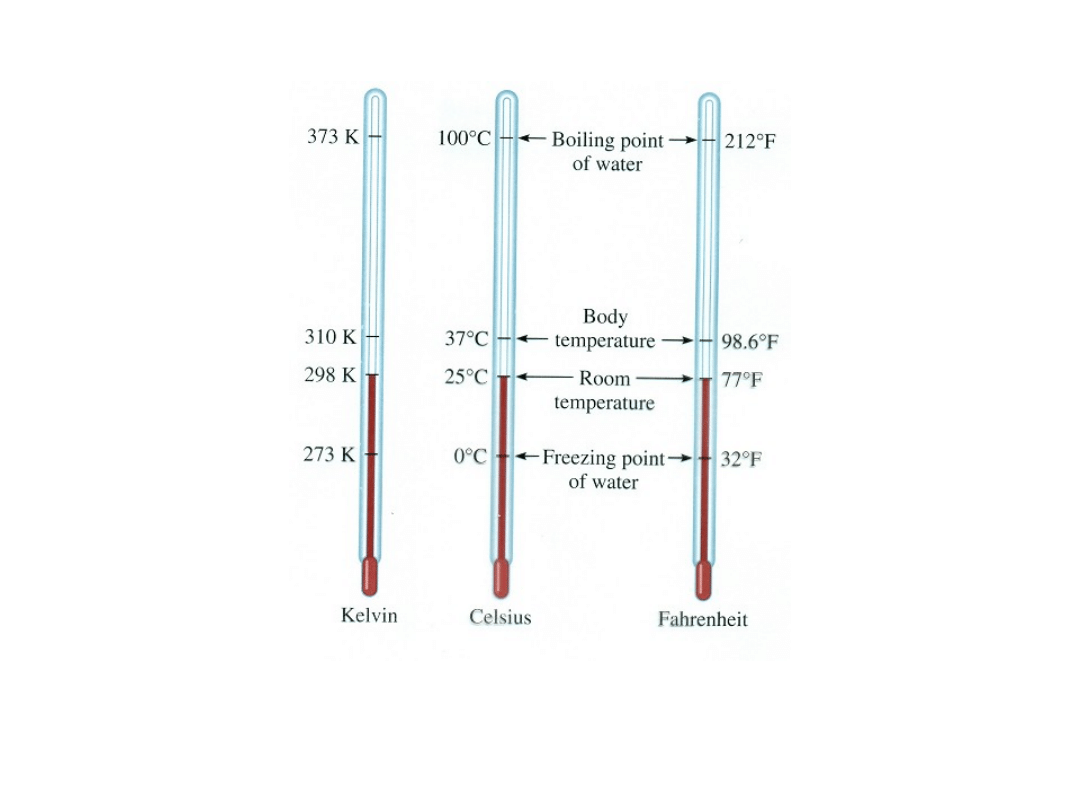
Warunki normalne
: 273 K czyli 0
˚
C
1013 hPa
czyli 1 at
7.

MASA ATOMU
Masa atomu czyli masa indywidualnego nuklidu, atomu wyrażona
jest w kg, g lub unitach
Masa atomu
63
Cu
wynosi 62,939 u
= 62,939 1,6604
10
-24 g
= 104,5 10
-24 g
Masa atomu
65
Cu
wynosi 64,927 u
= 64,927 1,6604
10
-24 g
= 107,8 10
-24 g
JEDNOSTKI I STAŁE FIZYCZNE
Jednostka masy atomowej
„ u ” = unit = jednostka węglowa
Unit jest to 1/12 części masy atomu węgla izotopu
12
C
11
C
12
C
13
C
14
C
W skali bezwzględnej jednostka
masy atomowej (jma, unit) wynosi
1,6604 10
-24 g
1,6604 10
-27
kg

MASA ATOMOWA
- - średnia ważona z mas nuklidów występujących w
naturalnej mieszaninie izotopów wyrażona w jednostkach
masy atomowej.
Masy atomowe pierwiastków podane są w układzie
okresowym.
A
E
=
A
E
1
•
c
%
+ A
E
2
•
c
%
100
Przykład :
63
Cu =
69,1 %
65
Cu =
30,9 %
63
Cu =
62,939u
65
Cu =
64,927u
Masa at.Cu =
69,1
x
62,939u
+
30,9
x
64,927u
100
A = 63,546u
LICZBA AVOGADRA
Liczba Avogadra N to liczba wskazująca ile atomów
węgla zawartych jest w 12g węgla
12
C.
N = 6,022 • 10
23
/
mol
Wartość dokładna : N = 6,022 14 199 (47) · 10
23
MOL - miara liczności materii
Mol substancji jest to taka ilość substancji, która zawiera
tyle samo cząstek
(atomów, cząsteczek, jonów, rodników lub elektronów)
ile atomów węgla znajduje się w 12g izotopu węgla
12
C.
czyli około 6,022 · 10
23
cząstek
6,02214199(47) ·
10
23
Mol cząstek to
6,022 · 10
23
cząstek
1 mol atomów S
= 6,022 · 10
23
atomów S
1 mol cząsteczek CO
2
= 6,022 · 10
23
cząsteczek
CO
2
1 mol jonów SO
4
2-
=
6,022 · 10
23
jonów SO
4
2-
1 mol = 6,022 x 10
23
JEDEN MOL
1 mol cząsteczki Co(OH)
2
= 6,022 •10
23
cząsteczek
= 92,6 g
1 mol cząsteczki CuSO
4
· 5 H
2
O
= 6,022 •10
23
cząsteczek = 249,1 g
1 mol cząsteczki NiO
= 6,022 •10
23
cząsteczek
= 74,7 g
1 mol cząsteczki H
2
O
= 6,022 •10
23
cząsteczek = 18,0 g
1 mol atomów S
= 6,022 •10
23
cząsteczek
= 92,6 g
1 mol atomów
12
C
= 6,022 •10
23
cząsteczek = 12,0 g

MASA MOLOWA
Masa molowa jest to masa jednego mola cząstek.
Masę molową M wyraża się w g/mol.
Masa molowa równa jest liczbowo masie
cząsteczkowej, atomowej lub jonowej (wyrażonej w
gramach).
Masa molowa H
2
O
6,022 • 10
23
cząsteczek • 18 u
6,022 • 10
23
cząsteczek • 18 • 1,66 • 10
-24
g
= 18 g/mol
M
H
2
O
= 18 g/mol
M
H
2
= 2 g/mol
M
H
2
SO
4
= 98 g/mol

OBJĘTOŚĆ MOLOWA GAZÓW
Jeden mol każdej substancji w stanie gazowym w
warunkach normalnych zajmuje taką samą objętość równą
22,4 dm
3
.
1 mol gazu = 6,022 • 10
23
cząsteczek
= 22,4 dm
3
1mol CH
4
= 6,022 • 10
23
cząsteczek
= 22,4 dm
3
(16g)
1mol CO
2
= 6,022 • 10
23
cząsteczek
= 22,4 dm
3
(44g)
1mol C
2
H
2
= 6,022 • 10
23
cząsteczek
= 22,4 dm
3
(26g)
W warunkach odbiegających od normalnych 1 mol gazu
zajmuje inną objętość wyliczaną ze wzoru Clapeyrona:
pV = m / M • RT

OBJĘTOŚĆ MOLOWA
Objętość molowa jest to objętość jednego mola
substancji ( dowolnej ).
V
M
= M / d
[ cm
3
/ mol ]
Przykład :
Obliczyć objętość molową wody.
V
M
=
18,02
g/mol
0,999
g/cm
3
V
M
= 18,05 cm
3
/ mol
WAŻNIEJSZE
PRZELICZNIKI
0 °C
= 273,15 K
1 cal
= 4,1869 J
1 atm
= 101325 Pa
1 atm
= 760 mm Hg
Wielokrotność i ułamki
tych jednostek oznacza się za pomocą
następujących przedrostków
Mnożn
ik
przedrost
ek
symbol
Mnożn
ik
przedrost
ek
symbol
10
-1
10
-2
10
-3
10
-6
10
-9
10
-12
10
-15
10
-18
10
-??
10
9
10
12
10
15
10
18
10
??
10
1
10
2
10
3
10
6
dec
y
d
c
m
n
p
f
a
cen
ty
mili
mikr
o
nan
o
pik
o
femt
o
atto
dek
a
hekt
o
kilo
me
ga
gig
a
tera
pet
a
eks
a
da
h
k
M
G
T
P
E

JEDNOSTKI UKŁADU SI ( SYSTEM
INTERNATIONAL
)
Jest 7 jednostek podstawowych
Wielkość
fizyczna
Nazwa
jednostki
Symbol
jednostki
Długość
Masa
Czas
Prąd
elektryczny
Temperatura
Światłość
Ilość substancji
metr
kilogram
sekunda
amper
kelwin
kandela
mol
m
kg
s
A
K
cd
mol
Jednostki pochodne
Siła
Praca, energia
niuton
dżul
N = kg • m
• s
-2
J = N • m
lubkg • m
2
• s
-2
Temperature Scales
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
Chemia (prawo zachowania masy), szkola technikum, polski mowtywy
Prawo zachowania masy Klasa I Chemia Gimnazjum Portal wiedzy o chemii
Prawo zachowania masy, Pomoce naukowe=D
Prawo zachowania masy - Klasa I - Chemia-Gimnazjum, Portal wiedzy o chemii
02 Zasada zachowania masy & Dru Nieznany (2)
Prawo administracyjne (11 stron), Prawo administracyjne - zbiór norm regulujących organizacje i zach
prawo cywilne, 45. Zachowek, a)
Prawo a inne regulatory zachowań
III Prawo i inne regulatory zachowań ćw, Politologia, Wstęp do nauki o państwie a prawie, Ćwiczenia
ZACHOWEK JAKO OCHRONA INTERESÓW NAJBLIŻSZYCH KREWNYCH ZMARŁEGO, PRAWO-CYWILNE, ADMINISTRACYJNE, PRAC
Prawo spadkowe min. zachowek, Semestr 2
Fizyka 3 2, Prawo powszechnej grawitacji- dwa ciała przyciągają się siłami o równych warto-ściach wp
fiz-prawo powszechnego ciążenia, Prawo powszechnego ciążenia - Każde dwa ciała (masy) przyciągają si
więcej podobnych podstron