WYKŁAD 6
1
Biotechnologia w produkcji
biopestycydów
Wykład 6

WYKŁAD 6
2
Metoda biologiczna walki
ze szkodnikami roślin
polega na wprowadzaniu
na zagrożone plantacje
roślin wrogów naturalnych
tych zwierząt. Często jest
rozumiana jednak szerzej i
wiąże się ją z umiejętnym
wykorzystaniem wszelkich
zjawisk zachodzących w
przyrodzie oraz z
zastosowaniem wszelkich
metod niechemicznych.
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
3
Naturalnymi wrogami
szkodników roślin są ich
pasożyty i drapieżce.
Pasożyty żyją na lub w ciele
żywicieli, czerpią z nich
pokarm, wskutek czego
osłabiają je, obniżają ich
płodność i niekiedy
doprowadzają do ich
śmierci.
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
4
Spośród pasożytów
szkodników roślin możemy
wyróżnić grupę silnie
patogenicznych
mikroorganizmów, które
wywołują typowe objawy
chorobowe. Grupa ta
określana mianem
mikroorganizmów
patogenicznych obejmuje :
wirusy, bakterie i
grzyby.
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
5
Zalety
biopreparatów mikrobiologicznych:
nietoksycznosć dla ludzi zwierząt, w tym
owadów pożytecznych
możliwość stosowania w czasie kwitnienia
duża skuteczność działania preparatu
mimo małych dawek
ograniczanie populacji szkodników, które
przeżyły zabieg
trwałość
w
środowisku
(ilość
wprowadzonych mikroorganizmów wykazuje
tendencję wzrostu i zwiększenia nasycenia
środowiska)
możliwość wnikania do tkanek, w których
żerują szkodniki
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
6
Zalety
biopreparatów mikrobiologicznych:
możliwość równoczesnego zwalczania
jednego lub wielu szkodników wrażliwych na
danego patogena
w rozprzestrzenianiu mikroorganizmów
pomagają chore owady, których odchody
zawierające dużą ilość mikroorganizmów
skażają pokarm zjadany następnie przez inne
zdrowe szkodniki
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
7
Wady
biopreparatów mikrobiologicznych:
wpływ
sztucznie
wprowadzonych
patogenów
na
biocenozy:
na
stan
środowiska, oraz na inne bezkręgowce
zwłaszcza glebowe – stwierdzono np.
chorobotwórczy
wpływ
Bacillus
thuringiensis na dżdżownice
duża
zależność
od
warunków
klimatycznych
konieczność utrzymania preparatu w
stanie
dużej
żywotności
przed
jego
zetknięciem ze szkodnikami
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
8
Wady
biopreparatów mikrobiologicznych:
konieczność ustalenia dokładnego terminu
zabiegu ze względu na okres inkubacji
choroby
możliwość wykształcenia odporności u
owadów na toksyny białkowe w przypadku
silnej presji selekcyjnej, zwłaszcza u roślin
transgenicznych
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
9
Szczepy
o
zwiększonej
aktywności
owadobójczej można uzyskać poprzez:
poszukiwanie w naturze nowych bardziej
toksycznych dla owadów szczepów
ulepszanie
stosowanych
szczepów
technikami nierekombinacyjnymi, opartymi
na zjawisku koniugacji polegającym na
przekazywaniu materiału genetycznego z
komórki biorcy do komórki dawcy
ulepszanie technikami rekombinacyjnymi
drogą inżynierii genetycznej
Wstęp
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
10
Na świecie istnieje
ponad 300 gatunków
wirusów owadzich.
Najwięcej wykryto tych
mikroorganizmów u
gąsienic motyli, ale
mogą także atakować
błonkówki, chrząszcze ,
muchówki i inne grupy
owadów
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
11
Ponad 85% wiroz owadów
to
poliedrozy jądrowe
,
które są najbardziej
przydatne w zwalczaniu
szkodliwych gatunków
owadów. Wywołują one
ogólne zakażenie,
wskutek czego chory
owad przestaje żerować i
ginie
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
12
Duże znaczenie w
zwalczaniu szkodników
mają także
granulozy i
poliedrozy
cytoplazmatyczne
.
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
13
Swoją przydatność w biologicznym zwalczaniu
bakulowirusy zawdzięczają:
wysokiej bioselektywności, przez co są
bezpieczne dla człowieka i fauny pożytecznej
powolnej biodegradacji – mogą być
przenoszone przez wiatr, deszcz i ptaki,
stanowiąc stałe źródło infekcji dla owadów
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
14
Zakażenie wirusem
następuje na skutek
spożycia przez owada tzw.
poliedrów. Pod wpływem
soków trawiennych z
poliedrów uwalniane są
wiriony, które przenikają
przez ścianę jelita do krwi i
atakują jądra komórek
różnych tkanek, prowadząc
do ich rozpadu
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
15
Poliedrozy jądrowe
obserwowano u wielu
gatunków gąsienic
motyli: prządki
pierścienicy, rolnic,
białki wierzbówki.
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
16
Charakterystyczne dla
poliedroz
cytoplazmatycznych
jest
białe zabarwienie jelita
chorych owadów.
Zaatakowany owad
przestaje żerować i ginie.
Tego typu schorzenia
obserwowano u rolnic,
błyszczki jarzynówki,
dużych gąsienic sadów.
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
17
Granulozy
to zakażenia
wirusowe,
charakteryzujące się
obecnością ciał
wtrętowych w jądrach
lub cytoplazmie
komórek hipodermy,
ciała tłuszczowego,
nabłonka tchawek
owadów. Hemolimfa
chorych owadów jest
mlecznobiała.
Stwierdzano je u
bielinka kapustnika,
rolnic, sówek, owocówki
jabłkóweczki
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
18
Liczne owady noszą w
swoich organizmach
wirusy, które dopiero w
niekorzystnych dla
żywiciela warunkach, pod
działaniem stresów
środowiska namnażają
się i powodują chorobę
owada. Są to tzw.
latentne infekcje
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów
WYKŁAD 6
19
Do produkcji preparatów
handlowych wybiera się
gatunki i szczepy
wirusów o największej
zjadliwości. Zwykle
hoduje się owady na
sztucznych pożywkach i
larwy określonego wieku
zakaża się podając im
zakażony pokarm.
Zamierające larwy
homogenizuje się, filtruje
homogenat i
odpowiednio
przygotowuje
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
20
Materiały takie można
przechowywać przez wiele lat w
temperaturze 4st. C.
Standaryzowany materiał zawiera
określoną liczbę wtrętów na
jednostkę objętości lub masy i ma
określoną wirulentność, sprawdzaną
testami biologicznymi.
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
21
Przykładami
biopreparatów
handlowych
zawierających
bakulowirusy są:
Virin,
Virex, Biotrol, Viron,
Polyvirocide,
Matsukemin.
Stosowane są na rośliny
w podobny sposób jak
preparaty chemiczne.
Zabiegom powinno się
poddawać młode larwy,
najczęściej gąsienice.
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
22
Wadami biopreparatów bakulowirusowych
są:
powolne ich działanie (przyczyną tego
jest kilkuetapowy cykl replikacji wirusa
trwający od pięciu do siedmiu dni)
wąski krąg gospodarzy (korzystny z
ekologicznego punktu widzenia,
niekorzystny ze względów ekonomicznych)
wrażliwość na promieniowanie UV
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
23
Intensywnie rozwijane metody inżynierii
genetycznej bakulovirusów wykorzystujące
je do ekspresji obcych genów, mogą
zwiększych atrakcyjność tych
biopreparatów.
Duże nadzieje pokładane są w genach
neurotoksyn, które wbudowane w genom
bakulowirusa mogłyby przyspieszać i
zwiększać skuteczność działania
biopreparatu wirusowego na owada
Biopreparaty wirusowe
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
24
Bakterie
to mikroorganizmy o największej
użyteczności w zwalczaniu szkodników
roślin. Około 100 gatunków bakterii ma
właściwości owadobójcze; wnikają one do
ciała owada przez otwór gębowy, oskórek
lub tchawki.
Wyróżnia się bakterie patogeniczne
obligatoryjne, fakultatywne i potencjalne.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
25
Największe znaczenie
mają bakterie
patogeniczne,
fakultatywne
wytwarzające enzymy,
dzięki którym mogą
rozkładać tkanki
gospodarza.
Przykładem jest
Bacillus thuringiensis
Berliner
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
26
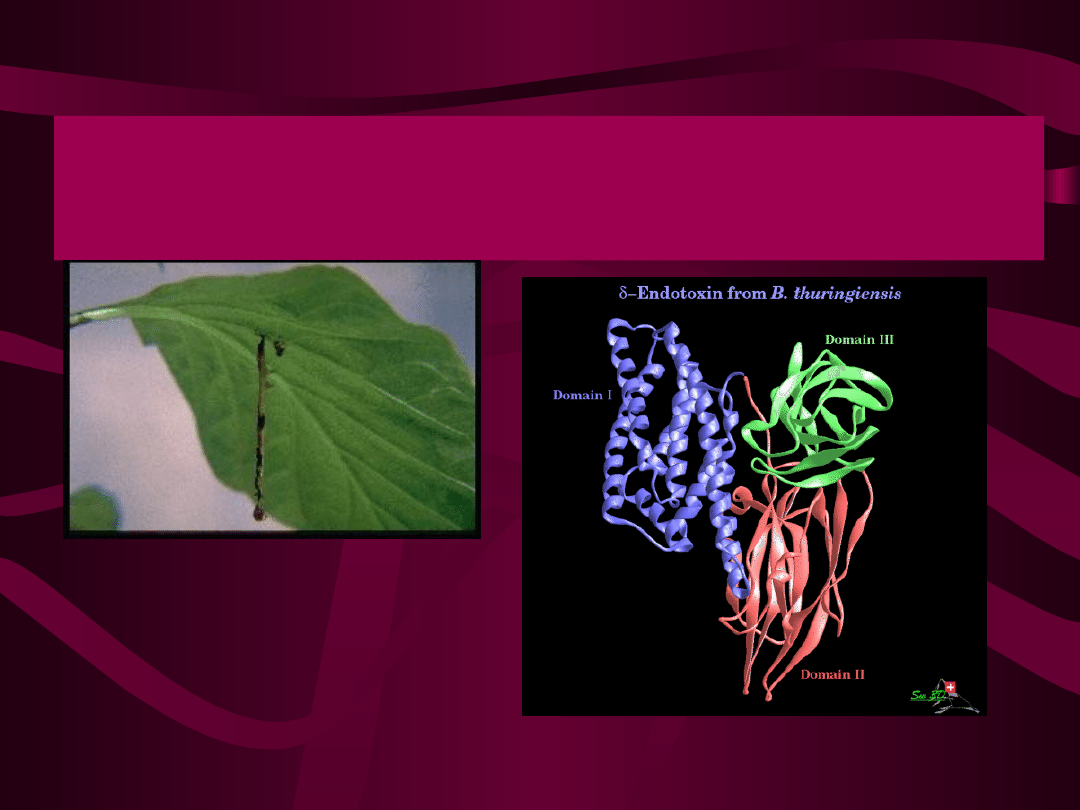
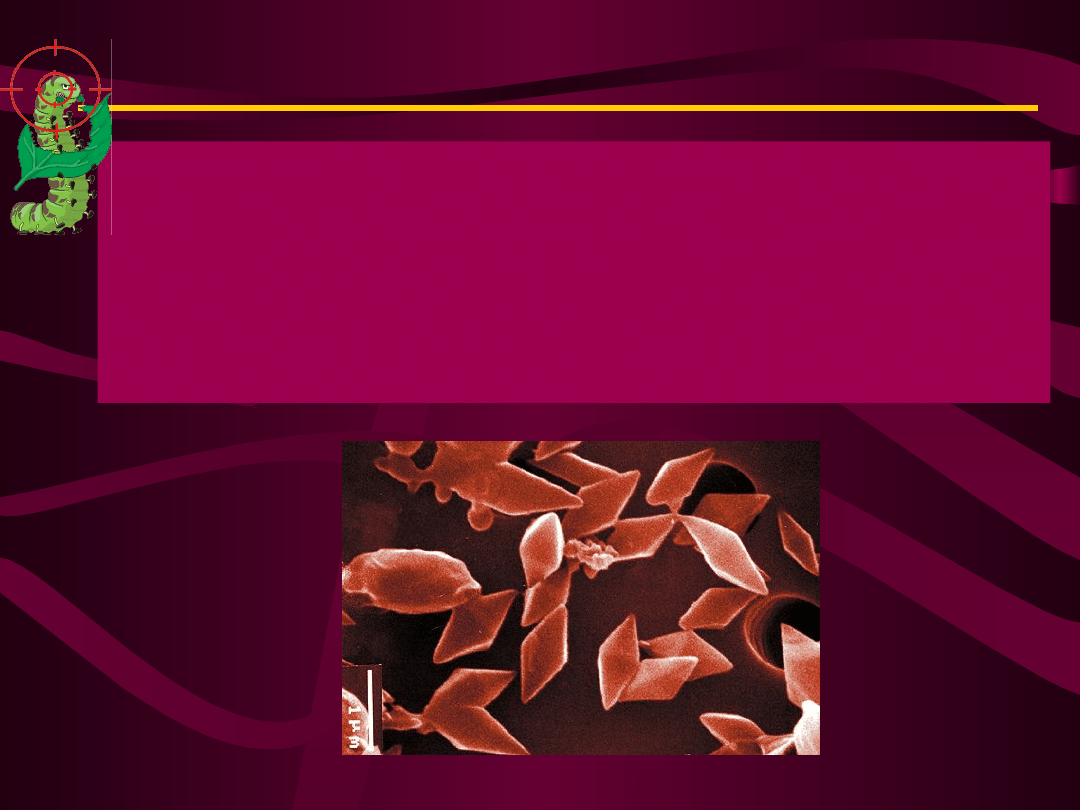
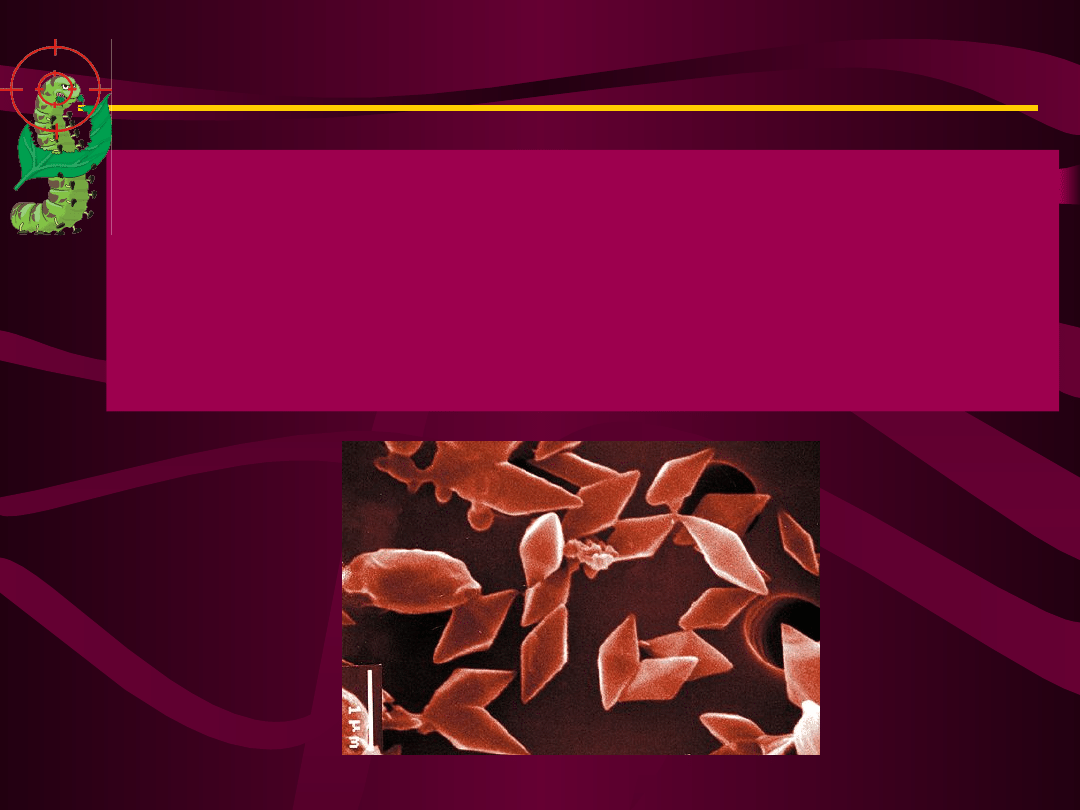
Bacillus thuringiensis
rozmnaża się przez
podział lub tworzy
spory, czyli
przetrwalniki. Oprócz
przetrwalnika w
komórce powstają
substancje toksyczne, z
których jedna, białko,
występuje w formie
romboidalnych
kryształów.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
27
Główną rolę w
patogenezie chorób
owadów odgrywają dwie
grupy toksyn
bakteryjnych:
krystaliczna
endotoksyna i
termostabilna
egzotoksyna. Toksyna
krystaliczna powoduje
paraliż przewodu
pokarmowego, owad
przestaje żerować, ma
biegunkę i wymioty,
wreszcie ginie.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
28
W zależności od
szczepu bakterii
równocześnie mogą
występować różne
objawy dodatkowe, jak
rozluźnienie struktury
ścian jelita (stąd
infekcja jamy ciała),
zaburzenie gospodarki
jonowej organizmu i
podwyższenie pH krwi
zainfekowanego owada.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
29
Niektóre szczepy B.
thuringiensis oprócz
toksyny krystalicznej
wydzielają do podłoża
odporną na
temperaturę, nie
krystalizującą
egzotoksynę. Powoduje
ona w owadach zmiany
teratogeniczne, atrofię
narządów gębowych, co
uniemożliwia im
odżywianie się.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
30
Owady zainfekowane
laseczką turyngską
przestają natychmiast
żerować i giną w ciągu
kilku dni. Bakterie
wpływają raczej na
płodność i wylęg larw,
endotoksyna
krystaliczna zaś na
żerowanie owadów
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
31
Podatne na tę bakterię
są gąsienice ponad 150
gatunków motyli,
pojedynczych gatunków
muchówek i chrząszczy.
Bakteria nie ma
właściwości toksycznych
dla zwierząt wyższych i
człowieka.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
32
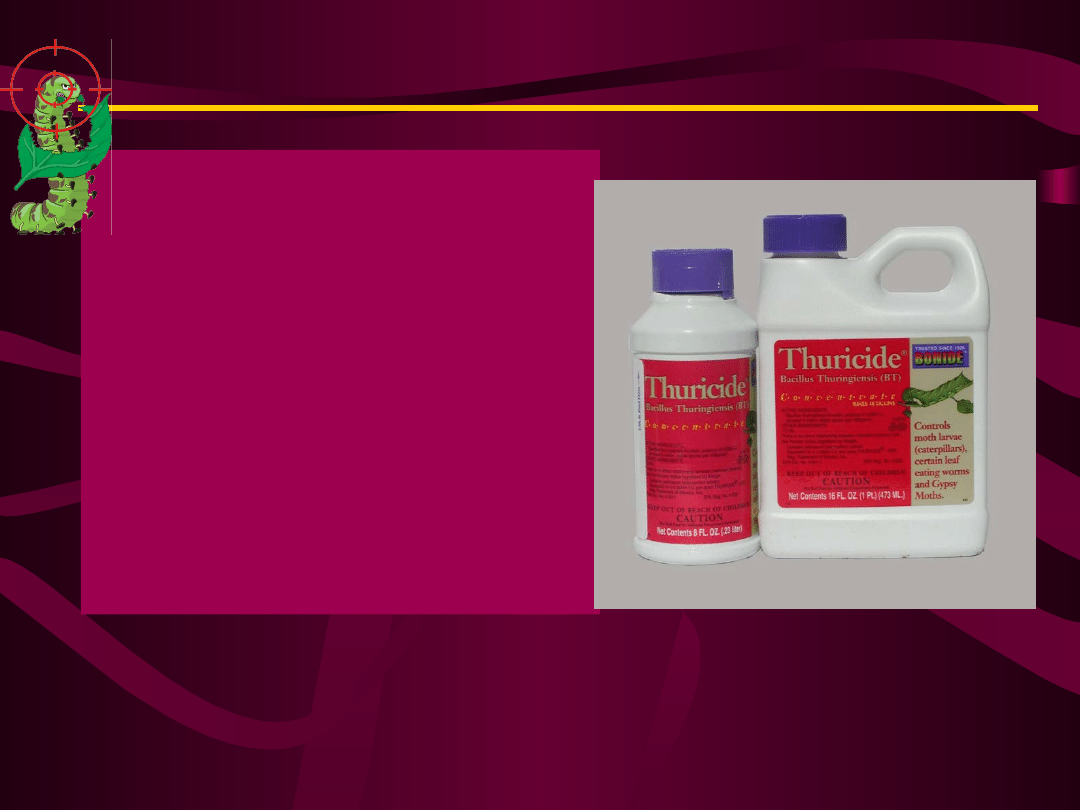
Jako pożywkę do
produkcji biopreparatów
stosuje się melasę z
mikroelementami i
witaminami. Handlowe
nazwy biopreparatów to:
Thuricide, Biospor,
Dipel,
Bitoksybacillin,
Insektin, Gomelin,
BIP, Bactospeine,
Ektobakterin,
Dendrobacilin
i inne
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
33
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
Niektóre biopreparaty zawierające B.
thuringiensis do zwalczania szkodników
owadzich
Biopreparat
Mikroorganizm
Bactospeine 16000WP
(Abbott Lab., USA)
Bacillus thuringiensis
var. kurstaki
Biobit 3,2 WP (Abbott
Lab., USA)
Bacillus thuringiensis
var. kurstaki
Dipel 3,2 WP (Abbott
Lab., USA)
Bacillus thuringiensis
var. kurstaki
Ekotech 15 OF (AgroEvo,
Niemcy)
Bacillus thuringiensis
var. kurstaki
Ekotech Pro 075 OF
(AgroEvo, Niemcy)
Bacillus thuringiensis
var. kurstaki

WYKŁAD 6
34
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
Niektóre biopreparaty zawierające B.
thuringiensis do zwalczania szkodników
owadzich
Biopreparat
Mikroorganizm
Foray 02,2 UL (Abbott
Lab., USA)
Bacillus thuringiensis var.
kurstaki
Foray 03 UL (Abbott
Lab., USA)
Bacillus thuringiensis var.
kurstaki
Foray 04 UL (Abbott
Lab., USA)
Bacillus thuringiensis var.
kurstaki
Novodor 02 SC (Abbott
Lab., USA)
Bacillus thuringiensis var.
tenebroides
Thuricide (Thermo
Trilogy Co., USA)
Bacillus thuringiensis
Thuridan – Krem (Polfa,
Polska)
Bacillus thuringiensis

WYKŁAD 6
35
Pierwsze handlowe
biopreparaty B.
thuringiensis pojawiły
się na rynku we Francji
w 1938 roku, ale na
szeroką skalę zaczęto je
stosować od 1961 roku,
kiedy zostały one
zarejestrowane, a ich
masowa produkcja
została podjęta w USA,
Francji, Niemczech i w
dawnym ZSRR.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
WYKŁAD 6
36
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
W Polsce pierwsze
zastosowanie
biopreparatów datuje
się na początek lat
sześćdziesiątych, a
pierwszym
zarejestrowanym
biopreparatem był
Thuricide WP (Lipa
1962). Dzisiaj jest
zarejestrowanych w
naszym kraju 10
biopreparatów, w tym
dwa z nich Bacilan i
Thuridan są
produkowane w Polsce.

WYKŁAD 6
37
W roku 1986 na Sesji Naukowej IOR
przedstawiono perspektywę wytworzenia z
trzech
szczepów
Bacillus
wykazujących
biologiczną aktywność przeciwko różnym
rzędom
owadów,
jednego
szczepu
uniwersalnego,
który
posiadać
będzie
wlaściwości zabijania owadów z rzędu motyli,
chrząszczy oraz muchówek.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
38
Przewidywania te stały się rzeczywistością,
gdyż
na
drodze
inżynierii
genetycznej
uzyskano nowe szczepy bakterii Bacillus
thiuringiensis oraz nowe formy użytkowe
biopreparatów
przydatne
w
zwalczaniu
szerszego
kręgu
szkodliwych
owadów,
przeciwko którym, dawne biopreparaty były
nieskuteczne.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
39
Ograniczenia
konwencjonalnych
biopreparatów B. thuringiensis:
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
Skuteczność
ograniczona
do
rzędu
owadów;
Nieskuteczność
przeciwko
owadom
wewnątrz tkanek;
Krótki okres aktywności pozostałościowej;
Szybka degradacja toksyn w glebie;
Nieskuteczność
przeciwko
owadom
glebowym;
Absorpcja do cząstek organicznych;
Szybka sedymentacja;
WYKŁAD 6
40
Obecnie wprowadzane są “genetycznie”
udoskonalone biopreparaty. Bakterie z
nowych biopreparatów mogą wnikać do
wnętrza tkanek, w których żerują owady, bądź
przemieszczać się w glebie do strefy
przykorzennej, w której żerują larwy
szkodników.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
WYKŁAD 6
41
Dalszy postęp w technikach inżynierii
genetycznej pozwolił uzyskać biopreparaty o
wielu specyficznych cechach (np. brak
przetrwalników), dzięki czemu spełniały
wymagania krótkiej trwałości w środowisku
wodnym stawiane przez niektóre kraje, np.
Niemcy.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
42
Biopreparaty produkowane przez Mycogen
Corporation charakteryzują się tym, iż
techniką rekombinacji DNA przeniesiono
geny CryIA - kodujące produkcję delta-
endotoksyny - do niechorobotwórczej bakterii
Pseudomonas fluorescens, w komórce której
nie rozwija się przetrwalnik natomiast
powstaje krystaliczna endotoksyna o swym
normalnym romboedrycznym kształcie i
toksycznym działaniu na wrażliwe owady.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
43
Komórki P. fluorescens hodowane są w
płynnych pożywkach w tkankach
fermentacyjnych i zabijane metodami
fizycznymi lub chemicznymi. Kryształy B.
thuringiensis są otoczone przez ścianki
komórki P. fluorescens i dlatego technika ta
nazywana jest CellCap, a ma ona wiele
korzystnych cech technologicznych i
środowiskowych.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
44
Biopreparaty oparte na bakteriach – wektorach, którym
na drodze inżynierii genetycznej wprowadzono określone
geny Bacillus thuringensis
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
Wprowadzony
gen
Bakteria wektor lub
biopreparat
Korzyści dla
ochrony roślin
Cry IA(c)
Kolonizator układu
I wiazkowego Clavibacter
xyli In-Cide
Kolonizator liści
Pseudomonas fluorescens
Cell-cap (Mycogen)
Zwalczanie
endofitofagów np.
Ostrinia nubilalis
Zwiększona
trwałość na liściach
Cry IA (b)
Pseudomonas fluorescens Zwalczanie
szkodników korzeni
Cry IVB
Pseudomonas fluorescens Zwalczanie larw
koziułek
Cry IV
Bradyrhizabium
Zwalczanie larw
Riviella ssp. na
brodawkach
korzeniowych.
WYKŁAD 6
45
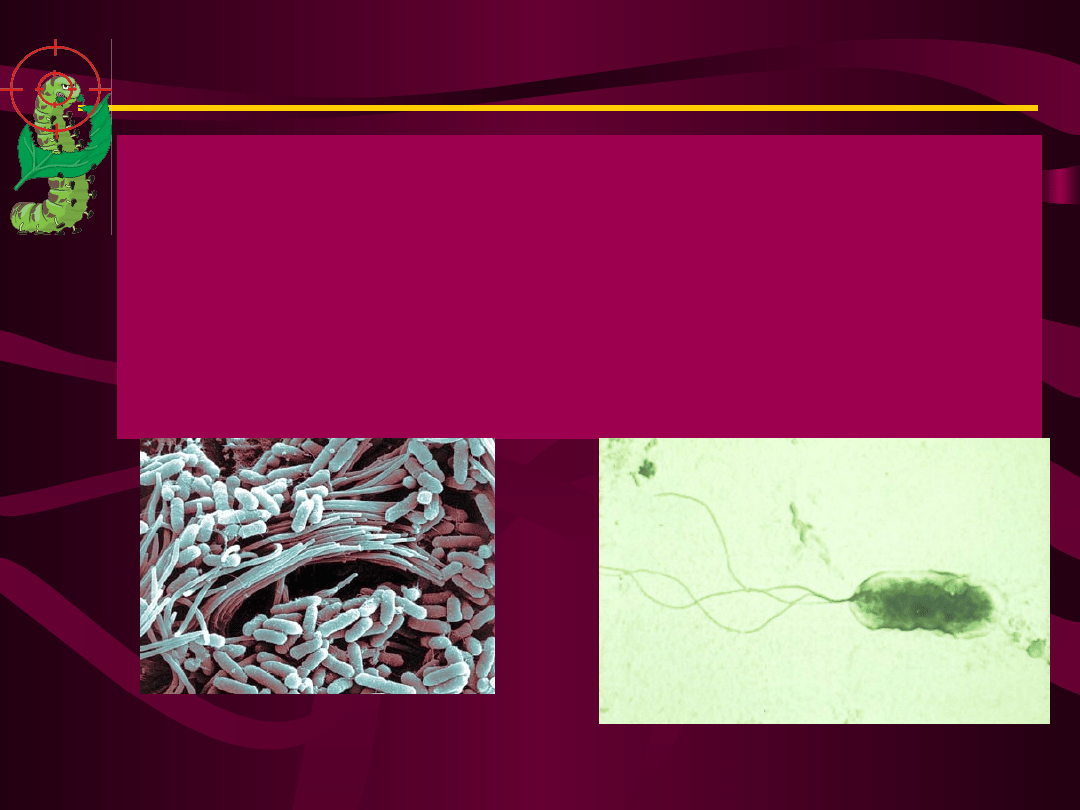
W
przypadku
biopreparatu
In-Cide
wektorem jest obojętna dla roślin bakteria
Clavibacter xyli, zasiedlająca komórki
sitowe, a więc istniejąca w wewnętrznych
tkankach roślin np. kukurydzy.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
46
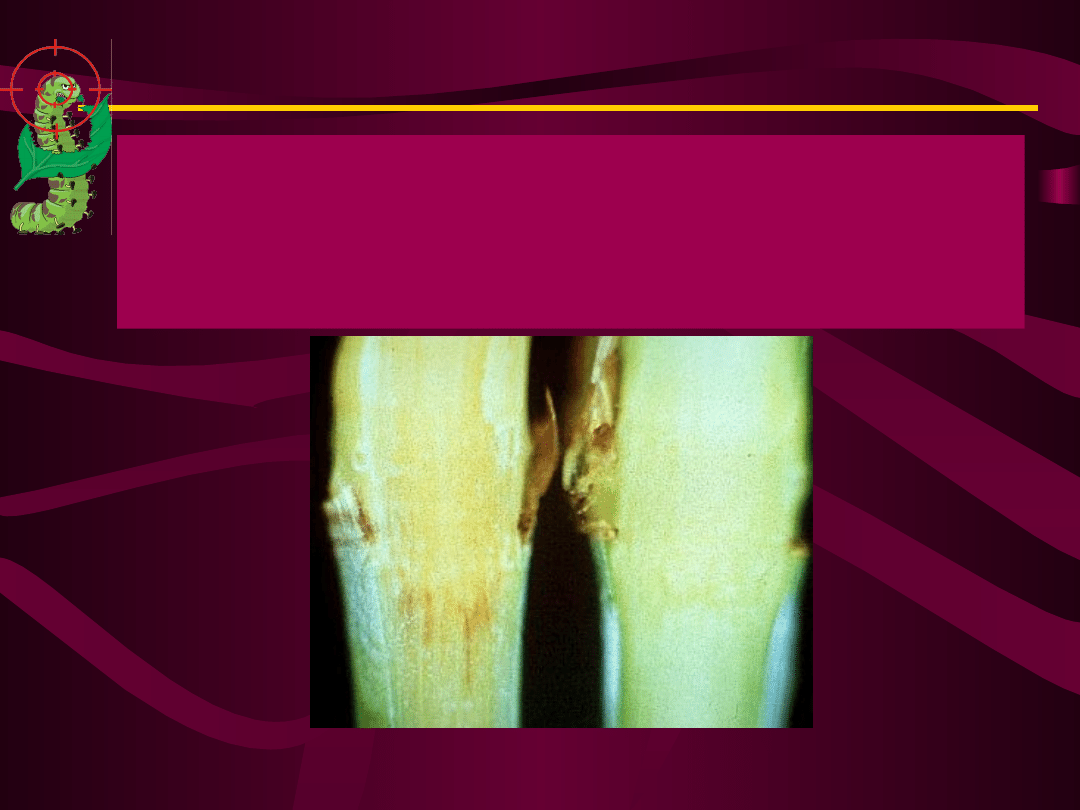
Gąsienice omacnicy prosowianki, które
wygryzają chodniki w pędach kukurydzy
zjadają z tkankami bakterie C. xyli
zawierające owadobójcze toksyny i ulegają
zatruciu.
Tego
rodzaju
użytkowe
formy
biopreparatów B.thuringiensis są znacznie
bardziej skuteczne w ochronie kukurydzy
od
granulowanych
form
stosowanych
dotychczas.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
WYKŁAD 6
47
W przypadku owadobójczego biopreparatu
Cell-Cap
wektorem
jest
bakteria
Pseudomonas fluorescens, która tworzy
trwałą fillosferę na liściach roślin.
Dzięki
temu
zabieg
opryskiwania
biopreparatem
wykazuje
wielokrotnie
wyższą trwałość, a tym samym większą
skuteczność w zwalczaniu liściożernych
owadów
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów

WYKŁAD 6
48
Biopreparaty
B.thuringiensis oparte na
bakterii P.fluorescens
zasiedlającej także system
korzeniowy mogą
być
stosowane do zwalczania
szkodników korzeniowych
z rzędu Lepidoptera,
Coleoptera czy Diptera,
zależnie od typu genów
B.thuringiensis
wprowadzonych do ich
komórek.
Biopreparaty bakteryjne
Biotechnologia w produkcji
biopestycydów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
Wyszukiwarka
Podobne podstrony:
Wpływ biotechnologii w produkcji zwierzęcej
BIOTECHNOLOGICZNE METODY PRODUKCJI WITAMIN
Wydzielanie produktów biotechnologicznych metodą perwaporacji
03 Otrzymywanie estrów zapachowych, Biotechnologia, chemia produktów naturalnych
06 Synteza Indygo, Biotechnologia, chemia produktów naturalnych
Resweratrol produkowany biotechnologicznie w drożdżach
7 ćwi. produkcja enzymu -amylazy - NOWE (1), Biotechnologia UKW I ST, Biotechnologia żywności UKW
05 Barwniki w papryce, Biotechnologia, chemia produktów naturalnych
02 Wiskoza - Włókno celulozowe, Biotechnologia, chemia produktów naturalnych
04 Olejki eteryczne, Biotechnologia, chemia produktów naturalnych
Produkty GMO wprowadzone do obrotu na terenie UE na podstawie dyrektywy 90, NAUKA, NAUKA nowa, BIOTE
Produkty przeciwwskazane w chorobach jelit II
Ewolucja marketingu era produkcyjna, sprzedazowa, marketingowa Rynek definicja
download Zarządzanie Produkcja Archiwum w 09 pomiar pracy [ www potrzebujegotowki pl ]
Biotechnologia w 6
Przygotowanie PRODUKCJI 2009 w1
więcej podobnych podstron