
FLUOROWCE
FLUOROWCE
Konfiguracja elektronowa fluorowców
duża elektroujemność
duża tendencja do przyłączania
1 elektronu s
2
p
6
X X
–
duże powinowactwo
elektronowe A
(tylko fluorowce i tlen
mają dodatnie A
duża energia
potrzebna do
oderwania elektronu
X X
+
(duża energia jonizacji)
duży potencjał oksydacyjny
X
–
najczęściej
(jonowe)
wiązanie
kowalencyjne
rzadziej
duża reaktywność
mała
energia
wiązania
X
2
rośnie w szeregu
I<Br <Cl <F
duże ciepło
hydratacji X
–
fluor najsilniejszy utleniacz
wśród pierwiastków E = +2,85 V
duża
aktywność
chemiczna
I
2
<Br
2
<Cl
2
<F
2
•tylko stopień utlenienia -I
•przeprowadza pierwiastki na
najwyższy możliwy stopień
utlenienia (np. SF
6
, PF
5
, IF
7
, F
2
O, PtF
6
)
+
stopień utlenienia
G
/F
[V
]
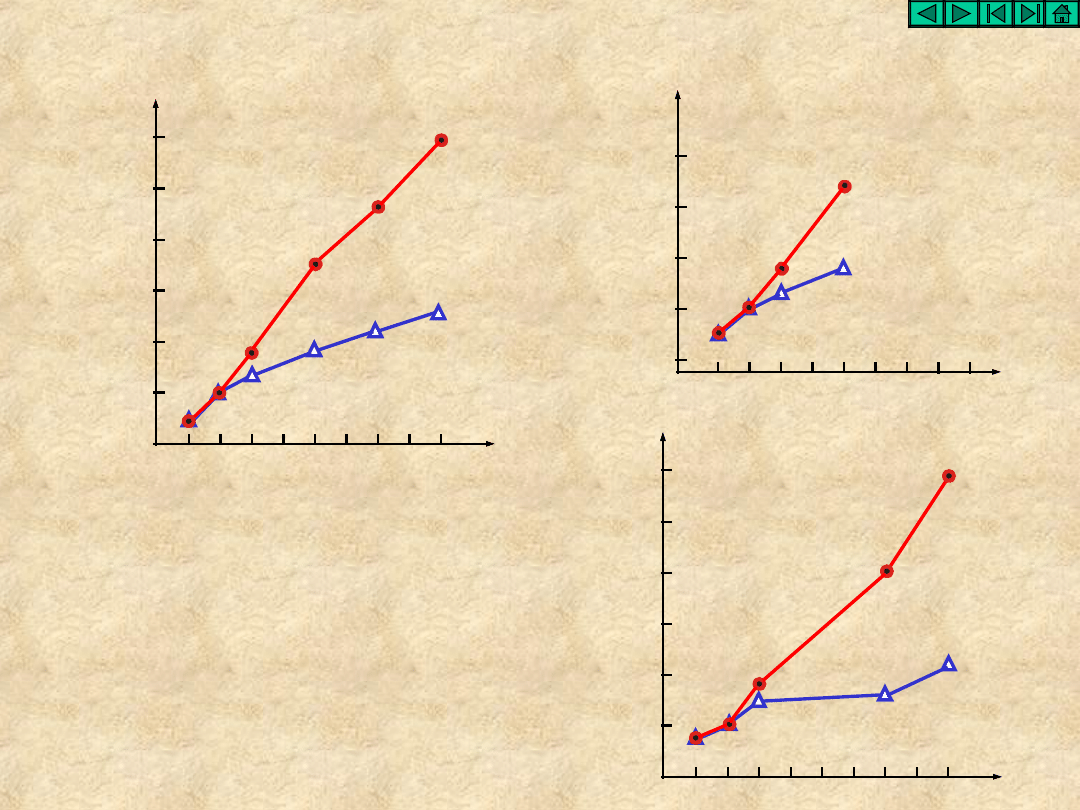
Diagramy Frosta-Ebswortha
4
2
0
-2
6
8
10
-I 0
III
V
VII
I
4
2
0
-2
6
8
10
-I 0
III
V
VII
I
Cl
–
Cl
2
HClO
HClO
2
ClO
3
–
ClO
4
–
ClO
–
ClO
2
–
ClO
3
–
ClO
4
–
4
2
0
-2
6
-I 0
III
V
VII
I
Br
2
Br
–
HBrO
BrO
3
–
BrO
–
BrO
3
–
HIO
I
–
I
2
IO
3
–
H
5
IO
6
H
3
IO
6
2 –
IO
–
IO
3
–
pH= 0
pH= 14
E
2
HE
H
2
H
2
O
2HF + 1/2O
2
RE + HE
w
ę
g
lo
w
o
d
o
ry
ME
metale
X
2
inne niemetale
związki
międzyhalogenowe
EX, EX
3
, EX
5
,
EX
7
EF
Reakcje fluorowców (E)
fluorki, chlorki, bromki,
jodki
wodorofluorki
KHF
2
, KH
2
F
3
, KH
3
F
4
fluorki, chlorki, bromki,
jodki
np. SCl
4
, SF
4
, SF
6
, PE
3
, PF
5
E
2
aq
HCl + HClO
HCl + 1/2O
2
Br
(Br)
(Br)
(Br)
I
3
–
h
Document Outline
Wyszukiwarka
Podobne podstrony:
zjawisko fluoroscencji, MiBM UWM 1 i 2 semestr
~$ ANTYBIOTYKI RÓŻNE FLUOROCHINOLONY
KWAS FLUOROWODOROWY, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
Amonu fluoroboran
Magnezu fluorokrzemian r r
Cynku fluoroboran r r@
Fluorowce
Polimery fluorowe, Chemia, Prace, Prace
Zw fluorowców z wodorem
Fluorowcopochodne weglowodorow
Fluorowcopochodne weglowodorow
Fluorowce 3
Metody profilaktyki fluorowej
2 Otrzymywanie fluorowców
5.Związki węgla z fluorowcami1, charakterystyka poszczególnych grup układu okresowego
Kwas fluorowodorowy min p techn
więcej podobnych podstron