Rafał Jurko, Analityka chemiczna
5.Związki węgla z fluorowcami.
Znanych jest wiele związków węgla z fluorem, zaliczanych do „związków organicznych” i mających wielkie znaczenie praktyczne; można tu wymienić na przykład fluoropolimery i fluorochlorowęglowodory. Przykłady „nieorganicznych fluorków węgla” to CF4.
Węgiel tworzy z wszystkimi fluorowcami związki typu CX4, które mogą być uważane za pochodne halogenkowe metanu.
Czterofluorek węgla, CF4 stanowiący produkt końcowy fluorowania węgla lub zawierających węgiel substancji jest łatwo lotnym, bardzo trwałym związkiem (temp. topn. -185oC , temp. wrz. -128oC). Powstaje np. w wyniku fluorowania węglika krzemu, przy czym utworzony jednocześnie SiF4 można łatwo usunąć przez wymycie ługiem sodowym. CF4 nie jest przy tym aktywny, natomiast SiF4 ulega natychmiast hydrolizie. Jest to związane z faktem, że CF4 jest koordynacyjnie wysycony, natomiast krzem w SIF4 dysponuje orbitalami 3d, co umożliwia przyłączenie jonów OH i hydrolizę. CF4 jest bezbarwnym gazem, bardzo odpornym na działanie podwyższonej temperatury, a zarazem na działanie czynników chemicznych.
Fluorek czterowęgla, (CxF)n (x=3,6-4), powstaje jako czarna substancja w wyniku reakcji grafitu z fluorem i HF w temperaturze pokojowej. Jest bardzo trwały chemicznie, wykazuje jednak mniejszą trwałość termiczna niż (CFx)n; zaczyna rozkładać się w temp. Ok. 100oC. W strukturze tego związku występują płaskie warstwy C, w których jeden atom F związany jest kowalencyjnie z co czwartym atomem C.
Difluorocarben, CF2, można otrzymać przez termiczny rozkład pochodnych trifluorometylowych:
(CF3)3PF2→(CH3)2PF3 + CF2
Jako monomer CF2 jest trwały jedynie w wysokiej temperaturze, a w nieobecności innych partnerów dimeryzuje lub polimeryzuje bardzo szybko; jest bardzo reaktywny, pojawia się w reakcja tylko jako produkt pośredni i wchodzi w reakcję insercji i addycji. Z jodem powstaje CF2I2 i ICF2CF2I, z HCl tworzy się CClF2H a z O2 - COF2.
Czterochlorek węgla. CCl4, otrzymuje się wprowadzając chlor do dwusiarczku węgla w obecności jodu lub chlorku manganu (II) jako katalizatorów:
CS2 + 3Cl2→CCl4 + S2Cl2
W obecności FeS dwuchlorek dwusiarczku reaguje dalej z nadmiarem CS2, przy czym tworzą się nowe porcje CCl4:
2S2Cl2 + CS2→CCl4 + 6S
W przemyśle otrzymuję także przez chlorowanie metanu:
CH4 + 4Cl2 →CCl4 + 4HCl
Czterochlorek węgla jest bezbarwną cieczą o charakterystycznym odurzającym zapachu, o znacznej gęstości (1,593 g/cm3), wrząca w temperaturze 349.9K, trudno rozpuszczalna w wodzie. W temp. pokojowej nie reaguje z kwasami ani z zasadami, nie ulega także hydrolizie. Znajduje zastosowanie jako rozpuszczalnik tłuszczów, żywic, i wielu innych substancji organicznych. Używa się go także do wypełniania gaśnic przeciwpożarowych.
Chloroform, CHCl3, (temp. topn. -63,6oC; temp. wrz. 62,2oC) był dawniej najczęściej używanym środkiem do narkozy, obecnie jest stosowany tylko jako rozpuszczalnik. Otrzymuje się go przez działanie wapnia chlorowanego na etanol.
Spośród trzech istniejących mieszanin halogenków węgla, zawierających w cząsteczce fluor i chlor, najważniejszy jest dichlorodifluorometan, CCl2F2(froen) używany w technice chłodniczej.
Obok łańcuchowych fluorków węgla o wzorze ogólnym CnF2n+2 (n=2-7), stanowiących fluorowęglowę odpowiedniki węglowodorów nasyconych i odznaczających się znaczną biernością chemiczną, znane są także fluorki łańcuchowe zawierające wiązania podwójne. Najważniejszy spośród tych ostatnich jest tetrafluoroetylen C2F4, który pod zwiększonym 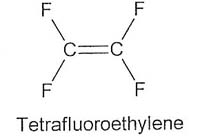
ciśnieniem ulega polimeryzacji z utworzeniem bezbarwnej stałej masy zawierającej długie łańcuchy :
Tak otrzymany poli(tetrafluoroetylen) odznacza się dużą odpornością na działanie czynników chemicznych (F2, HCl, HF wrzący HNO3 itd.) i stosowany jako bardzo cenne tworzywo syntetyczne znane pod nazwą teflon.
Bibliografia:
„Podstawy chemii nieorganicznej” Adam Bielański, wyd. PWN (str. 703)
„Chemia nieorganiczna, część I” Lothar Kolditz wyd. PWN (str. 400-401)
Wyszukiwarka
Podobne podstrony:
5.Związki węgla z fluorowcami2, charakterystyka poszczególnych grup układu okresowego
związki krzemu z fluorowcami, charakterystyka poszczególnych grup układu okresowego
związki boru z wodorem, charakterystyka poszczególnych grup układu okresowego
zastosowanie fluorowców, charakterystyka poszczególnych grup układu okresowego
Związki fluorowców z tlenem, charakterystyka poszczególnych grup układu okresowego
Związki nitrozylowe, charakterystyka poszczególnych grup układu okresowego
otrzymywanie tlenu i siarki, charakterystyka poszczególnych grup układu okresowego
11) Fosfan, charakterystyka poszczególnych grup układu okresowego
Boraks, charakterystyka poszczególnych grup układu okresowego
BORKI otrzymywanie i klasyfikacja wg Kiesslinga, charakterystyka poszczególnych grup układu okresowe
7. Tlenowe kwasy azotu (H2N2O2, charakterystyka poszczególnych grup układu okresowego
cyjanamid wapnia (azotniak), charakterystyka poszczególnych grup układu okresowego
3. Hydroborany, charakterystyka poszczególnych grup układu okresowego
Spinele, charakterystyka poszczególnych grup układu okresowego
Węgliki i węglany berylowców, charakterystyka poszczególnych grup układu okresowego
skalenie zeolity zw typu ultramaryny, charakterystyka poszczególnych grup układu okresowego
Aluminotermia i termity, charakterystyka poszczególnych grup układu okresowego
5. azydki, charakterystyka poszczególnych grup układu okresowego
10. Fosfor -odmiany alotropowe, charakterystyka poszczególnych grup układu okresowego
więcej podobnych podstron