
ANALITYKA AM L
UBLIN
2007/2008
1
Konsekwencje I zasady
Termodynamiki
Energia chemiczna

ANALITYKA AM L
UBLIN
2007/2008
2
Energia wiązania
• Energia chemiczna jest energią związaną z
wiązaniami chemicznymi występującymi w
cząsteczkach.
• E Ch jest energią związaną z
utrzymywaniem atomów za pomocą wiązań
atomowych(kowalencyjnych) lub jonowych.
• Jeżeli chcemy rozłączyć atomy lub jony to
musimy przerwać te wiązania dostarczając
energii.

ANALITYKA AM L
UBLIN
2007/2008
3
Powstawanie cząsteczek
• Połączenie dwóch atomów powoduje
przegrupowanie elektronów walencyjnych.
• Powstawanie orbitali o niższej energii a
zatem układu bardziej stabilnego.
• W trakcie tworzenie nowego
układu/struktury energia zostaje
przekazana do otoczenia.
• Zasadnicza teza: niższa energia = większa
stabilność

ANALITYKA AM L
UBLIN
2007/2008
4
Energia wiązania
• Nakład energii do rozdzielenia
dwóch atomów – wiązanie
atomowe
• Stabilność wiązania –poziom
energii odpowiadający parze
elektronów
• Definicja
energii wiązania:

ANALITYKA AM L
UBLIN
2007/2008
5
Energia wiązania -
definicja
• Energia „zawarta” w wiązaniu
• Energia potrzebna do rozerwania
wiązania
atomowego lub jonowego
celem rozdzielenia pary atomów
lub jonów nosi nazwę
energii
wiązania.

ANALITYKA AM L
UBLIN
2007/2008
6
Co i jak wpływa na
energię
• Wielkość energii wiązania zależy
od:
• rodzaju tworzących wiązanie
atomów
• Od otoczenia czyli atomów lub
grup atomów powiązanych z
atomami tworzącymi dane wiązanie
ANALITYKA AM L
UBLIN
2007/2008
7
Przykład wiązania
• H---O---H
•
492 kJ mol
-1
• H
3
C—O---H
•
437 kJ mol
-1
H
H
3
C
ANALITYKA AM L
UBLIN
2007/2008
8
Energie wiązań
• H
3
C CH
3
etan –
347 kJ mol
-1
• H
2
C CH
2
cyklobutan –
417 kJ
mol
-1
• H
2
C CH
2

ANALITYKA AM L
UBLIN
2007/2008
9
Średnie energie wiązania
Wiązanie
Energia wiązania kJ
mol
-1
C---H
412
C---C
348
C==C
610
C==C
835
O---H
463

ANALITYKA AM L
UBLIN
2007/2008
10
Co nam mówi energia
wiązania
• Ile energii zostanie
wydzielone
przy utworzeniu wiązania
• Ile energii należy
dostarczyć
w
celu rozerwania wiązania

ANALITYKA AM L
UBLIN
2007/2008
11
I zasada termodynamiki
• Energia
nie może być
wytworzona lub zniszczona a
jedynie przekształcona z jednej
formy w inną.
• Spalanie benzyny- poruszający
się samochód
• Energia chemiczna energia
kinetyczna

ANALITYKA AM L
UBLIN
2007/2008
12
Formy przekazywania
energii
• Układ =otoczenie
• Praca
• Ciepło.

ANALITYKA AM L
UBLIN
2007/2008
13
Przekazywanie energii w
formie pracy
• Praca – zdobycie pieniędzy
• Praca (naukowa) – wykonanie ruchu
wbrew siłom np.grawitacyjnym
• Np.. Podniesienie książki
• Układ (człowiek) otoczenie (książka)
• Energia chemiczna w mięśniach
energię ruchu książki i energię
potencjalną
ANALITYKA AM L
UBLIN
2007/2008
14
Przekazywanie energii w
formie ciepła
• Gorącezimne
• Wysoka temperatura niska
temperatura
Układ
Otoczenie

ANALITYKA AM L
UBLIN
2007/2008
15
Ciepło vs temperatura
• Temperatura jest miarą dla energii
termicznej układu.
• Energia termiczna:
– Energia kinetyczna cząsteczek czyli
energia związana z ruchem
– Temperatura jest miarą tej energii

ANALITYKA AM L
UBLIN
2007/2008
16
Temperatura
• O temperaturze należy mówić
rozpatrując poziom makroskopowy
bowiem łatwo skorelować energie
z temperaturą którą możemy
zmierzyć.
• Na poziomie mikroskopowym
należy mówić o energii atomów,
cząsteczek lub komórek

ANALITYKA AM L
UBLIN
2007/2008
17
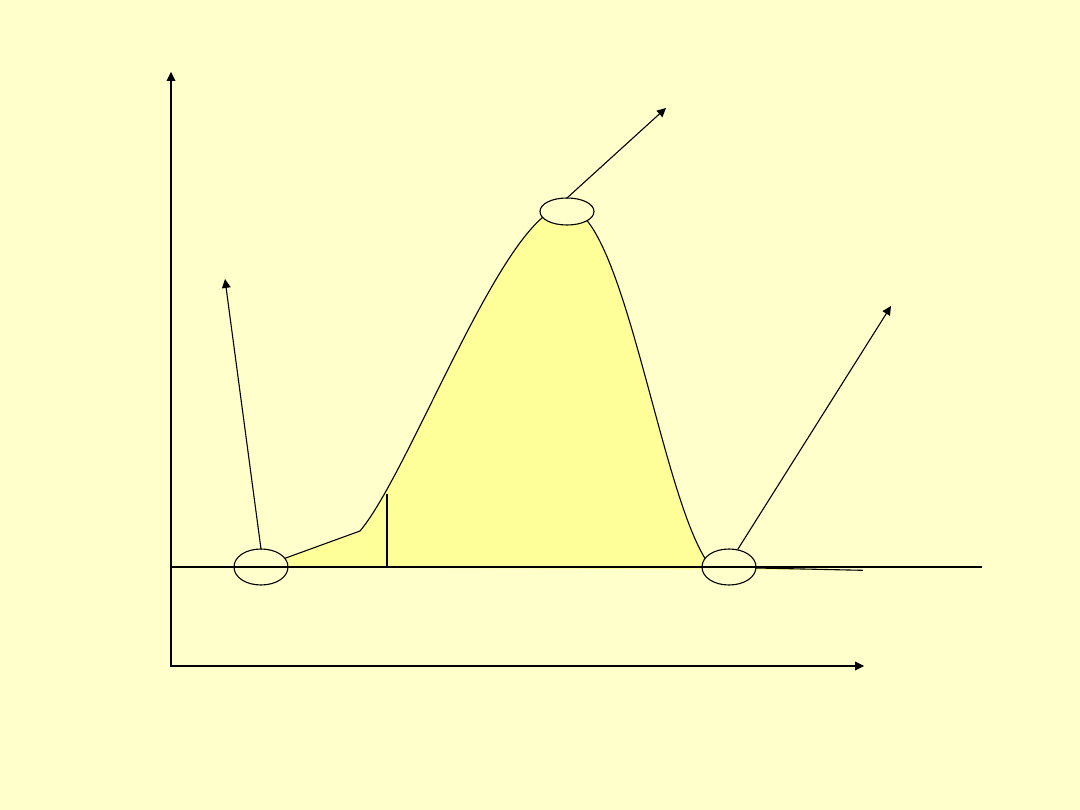
Temperatura
• Kiedy mierzymy temperaturę
układu oznacza to pomiar
uśrednionej energii wszystkich
atomów lub cząsteczek w układzie.
• Rysunek poniżej przedstawia
rozkład energii
termicznej(związanej z ruchem)
ANALITYKA AM L
UBLIN
2007/2008
18
Energia
kinetyczna
propor
cja
Niska
energi
a
Wysoka
energia
Bardzo
wysoka

ANALITYKA AM L
UBLIN
2007/2008
19
Spontaniczny/Samorzutny
przepływ ciepła
• Przepływ energii od układu o wyższej
temperaturze do otoczenia o niższej
temperaturze jest procesem
spontanicznym.
• Proces ten nie wymaga żadnej pracy.
• Przykłady takich procesów:
• Samochód na szczycie góry
• Woda w lodówce o temperaturze
poniżej 0
°C

ANALITYKA AM L
UBLIN
2007/2008
20
Szybkość a
spontaniczność
• Procesy spontaniczne/samorzutne mogą
zachodzić tak wolno, że nie są
zauważalne.
• Np.. Przekształcenie glikozy do dwutlenku
węgla i wody jest procesem bardzo
wolnym w temperaturze pokojowej stąd
wniosek że nie jest to proces samorzutny.
Natomiast raz proces rozpoczęty będzie
przebiegał dalej samorzutnie.

ANALITYKA AM L
UBLIN
2007/2008
21
Kierunkowość procesów
samorzutnych/spontaniczn
ych
• Samochód na górze (bez hamulca)
• Powrót do miejsca wymaga nakładu
pracy/zewnętrznej interwencji
• Gorący napój na stole ulega
ochłodzeniu ponieważ otoczenia
temperatura jest niższa a nie
odwrotnie pomiar temperatury
układu i otoczenia pozwala na
określenie kierunku przepływu.
ANALITYKA AM L
UBLIN
2007/2008
22
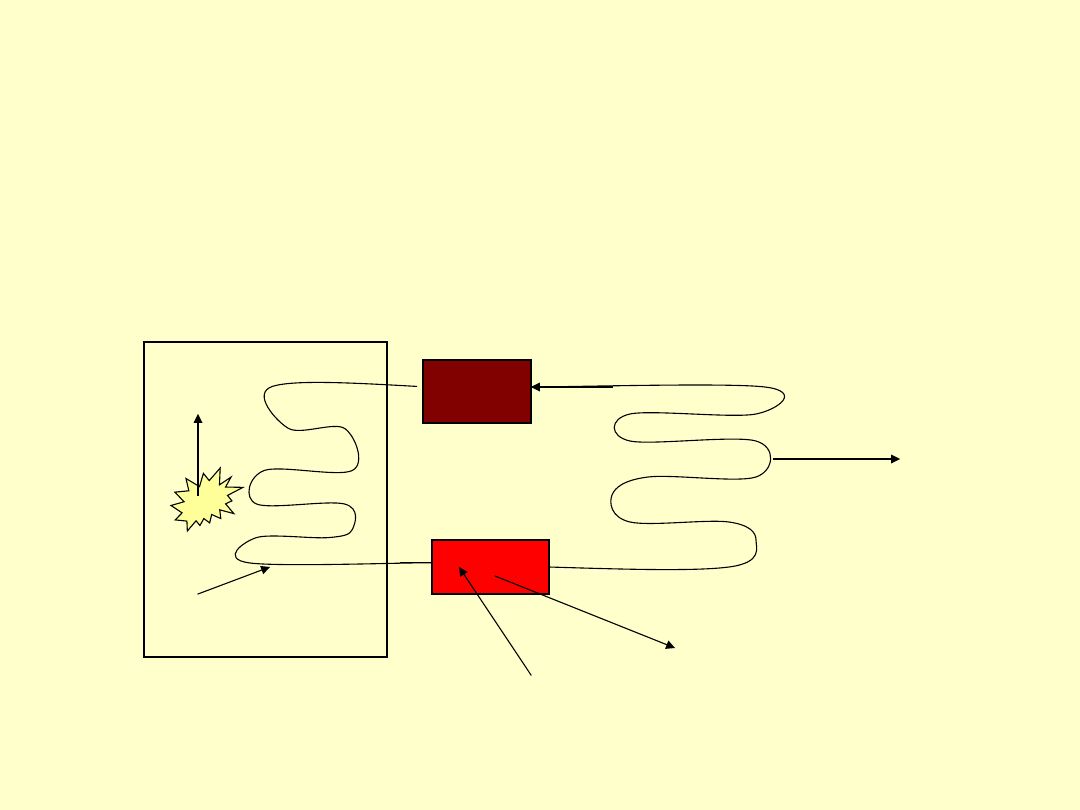
Przykład lodówki
Pompa sprężająca
Q
Q
W
Q

ANALITYKA AM L
UBLIN
2007/2008
23
Przykład lodówki
• Procesy spontaniczne:
• Żywność wnętrze lodówki
• Wnętrze lodówki płyn chłodzący
• Płyn chłodzący zewnętrzne
powietrze
• Procesy Niesamorzutne
• Płyn chłodzący---płyn chłodzący
sprężony

ANALITYKA AM L
UBLIN
2007/2008
24
Przepływ energii a reakcja
chemiczna
• Co się dzieje kiedy związki reagują
tworząc nowe substancje?
• Pewne wiązania są rozrywane inne
tworzone.
• Trudno byłoby oczekiwać żeby
energie obu procesów były
jednakowe

ANALITYKA AM L
UBLIN
2007/2008
25
Energia reakcji
chemicznych
• Jeżeli w trakcie tworzenia nowych
wiązań powstaje więcej energii
aniżeli jest zużywane na
przerwanie wiązań, nadmiar
energii jest przekazywany do
otoczenia.
• W odwrotnej sytuacji reakcja
pochłania energie z otoczenia.

ANALITYKA AM L
UBLIN
2007/2008
26
Zmiana energii reakcji
chemicznej
• Różnica pomiędzy energią zużytą
na rozerwanie wiązań a energią
uwolnioną w tworzeniu wiązań
nosi nazwę zmiany entalpii reakcji
i oznaczamy symbolem H.
ANALITYKA AM L
UBLIN
2007/2008
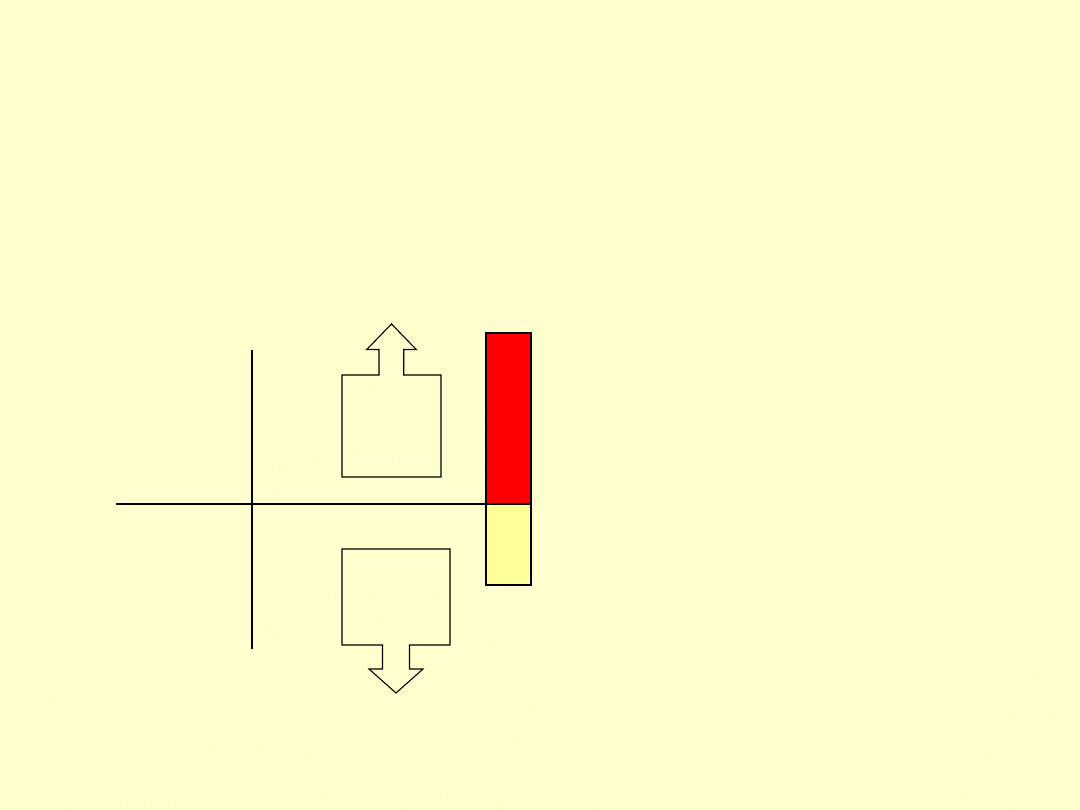
27
Entalpia reakcji
H>0
E ab
E od
Układ
Otoczenie
Absorpcja
energii z
otoczenia
ANALITYKA AM L
UBLIN
2007/2008
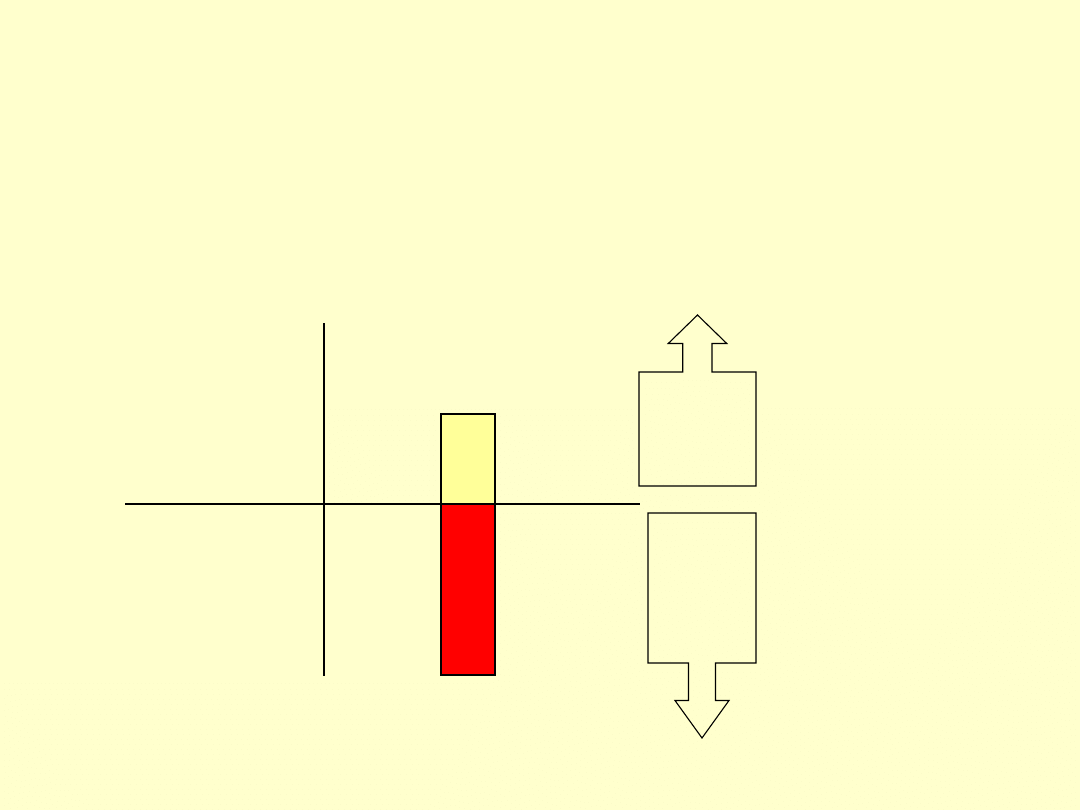
28
Entalpia reakcji
H<0
Układ
Otoczeni
e
E ab
E od

ANALITYKA AM L
UBLIN
2007/2008
29
Wyznaczenie entalpii
reakcji
• Można obliczyć jako różnicę
energii wiązań substratów
produkty
substraty
E
E
H
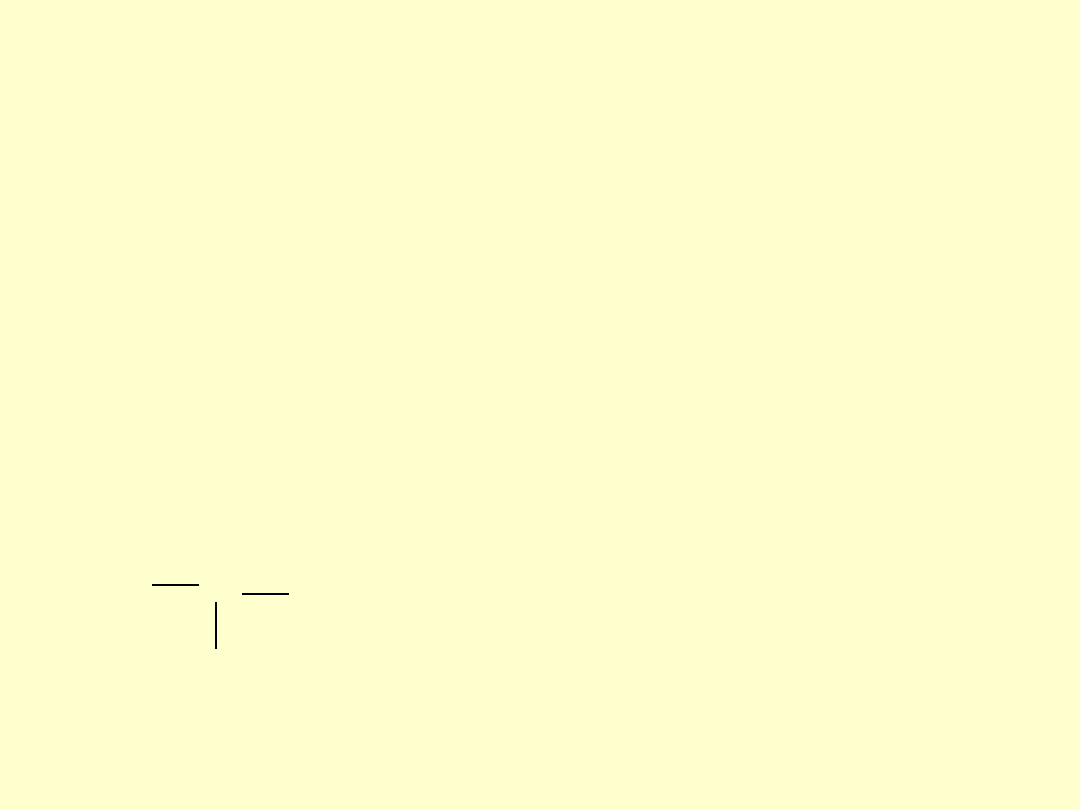
ANALITYKA AM L
UBLIN
2007/2008
30
Przykład
• Rozpatrzmy reakcję:
• CH
4
+2O
2
=CO
2
+2H
2
O
• Produkty: CH
4
+2O
2
• Cząsteczki: CH
4
+ 2O
2
• Wiązania:
• 4 x (C—H) = 4 x (412 kJ mol
-1
)=
1648 kJ/mol

ANALITYKA AM L
UBLIN
2007/2008
31
Cd Przykładu
• 2 x (O=O)
• 2 x (497 kJ mol
-1
) = 994 kJ mol
-1
• Razem: 1648+994=2642 kJ mol
-1
• Produkty:
• CO
2
+ 2H
2
O
• Cząsteczki O==C==O i 2 x H--O--
H

ANALITYKA AM L
UBLIN
2007/2008
32
Cd. przykładu
• Wiązania
• 2 x (C=O) 2 x (740 kJ mol
-1
) = 1480
• 4 x (O—H) 4 x (463 kJ mol
-1
) = 1852
• Razem: 1480 +1852 = 3332 kJ mol
-1
H= 2642 – 3332= - 690 kJ mol
-1
• Reakcja spalania metanu jest reakcją
egzotermiczną
ANALITYKA AM L
UBLIN
2007/2008
33
Opis zmian entalpii
• Reakcja spalania glikozy
C
6
H
12
O
6
+6O
2
6CO
2
+6H
2
O
Postęp reakcji
ANALITYKA AM L
UBLIN
2007/2008
34
Pomiar praktyczny
• Bomba kalorymetryczna
• Pomiar temperatury otoczenia
wskutek przepływu energii

ANALITYKA AM L
UBLIN
2007/2008
35
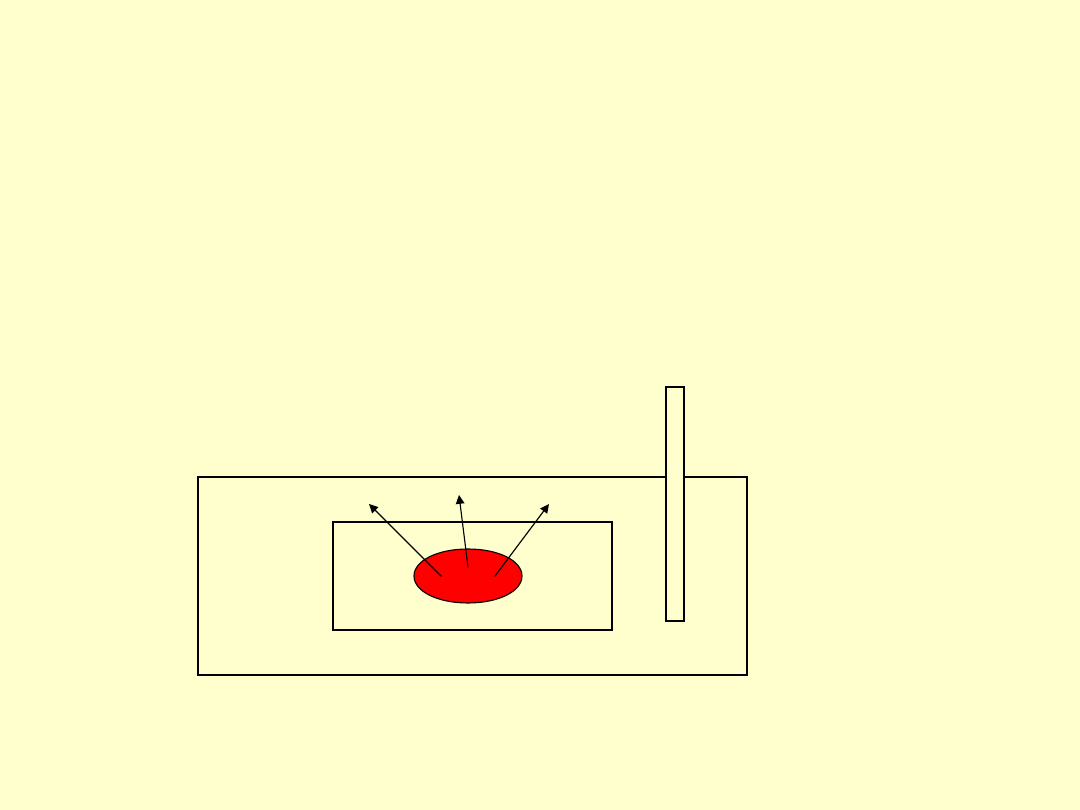
Trwałość związku i
entalpia reakcji
• W przypadku reakcji
egzotermicznych produkty mają
niższą energię aniżeli substraty co
oznacza większą trwałość.
• W przypadku reakcji
endotermicznych produkty mają
wyższą energię aniżeli substraty
co oznacza mniejszą trwałość.
ANALITYKA AM L
UBLIN
2007/2008
36
Entropia i jej rozkład
• Rozpatrzmy sytuację

ANALITYKA AM L
UBLIN
2007/2008
37
Entropia
• Przypomnijmy:
• Całkowita energia wszechświata –
układu i jego otoczenia jest stała
ponieważ energia nie może być
tworzona ani zanikać
• Energia przepływa jako ciepło od
„gorącego” układu do zimnego
otoczenia lub z gorącego otoczenia
do zimnego układu.

ANALITYKA AM L
UBLIN
2007/2008
38
Rysunek
• Kubek z ciepło wodą na stole
• Tworzy układ + otoczenie
• Ma miejsce przepływ energii do
otoczenia aż do wyrównania
temperatur
• Na czym polega różnica pomiędzy
pomiędzy opisanymi sytuacjami i
dlaczego energia przepływa

ANALITYKA AM L
UBLIN
2007/2008
39
entropia
• Wprowadzamy pojęcie
entropii
jako
pojęcia opisującego właściwości
wszelkiego rodzaju materii.
• W trakcie przepływu energii entropia
układu i otoczenia ulega zmianie.
• Co to jest?
• Tak jak energia jest naturalną
właściwością tak i entropia

ANALITYKA AM L
UBLIN
2007/2008
40
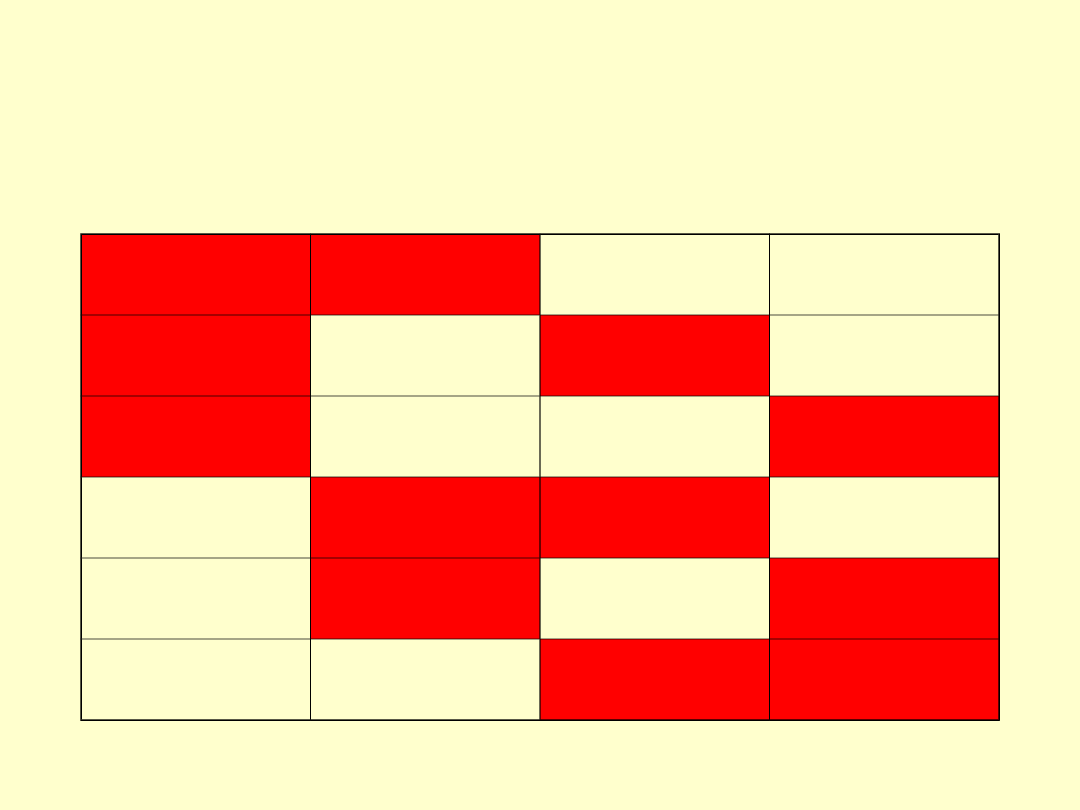
Opis
systemu(układ+otoczenie)
• Miliony atomów i cząsteczek
• Zmienny zakres energii
• Zmienny sposób rozłożenia tej
energii
• Rozpatrzmy następujący rysunek
ANALITYKA AM L
UBLIN
2007/2008
41
Rozkład

ANALITYKA AM L
UBLIN
2007/2008
42
Rozkład
• Dwa litry wody odpowiada
całkowitej energii układu
• Dwa litry można rozlać do
czterech jednolitrowych
pojemników na sześć sposobów
• Dwa litry można rozlać do sześciu
jednolitrowych pojemników na
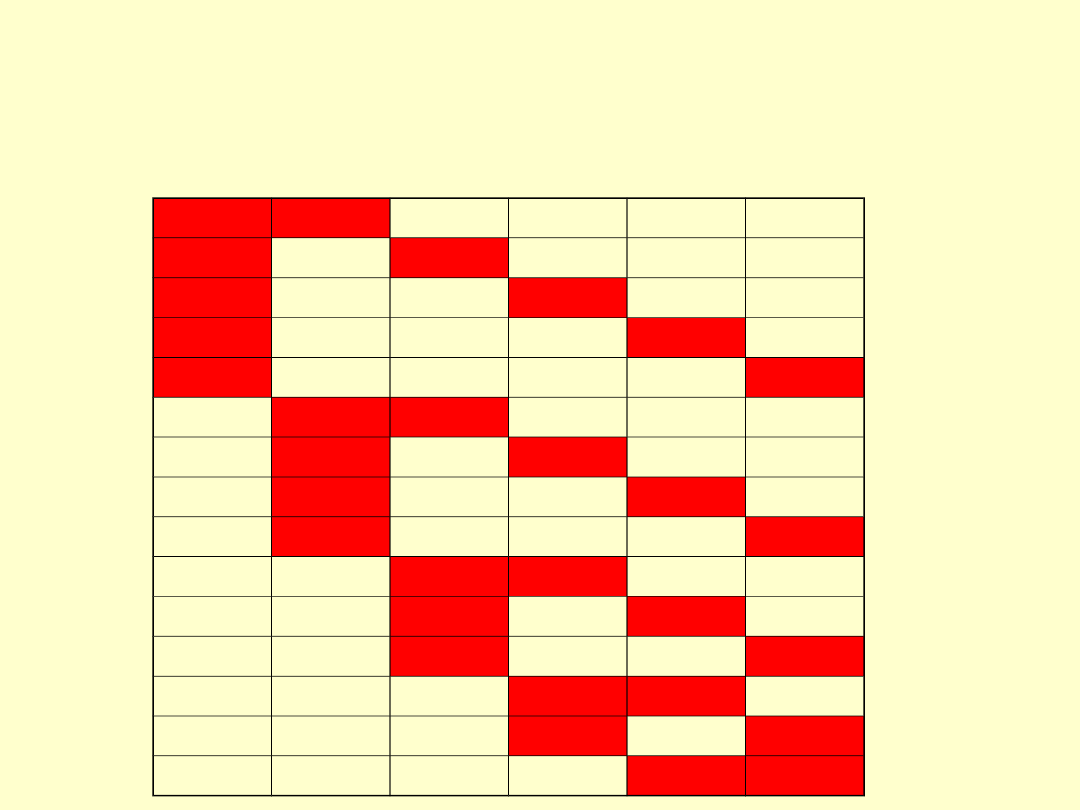
ANALITYKA AM L
UBLIN
2007/2008
43
Rozkład

ANALITYKA AM L
UBLIN
2007/2008
44
Rozkład
• Jeżeli zwiększymy liczbę naczyń do 6
pojemników to te dwa litry można rozlać
na 15 sposobów
• Entropia jest miarą w jaki sposób
energia może w danym układzie ulec
podziałowi pomiędzy składniki.
• Jeżeli entropia jest niska wtedy energia
układu też jest niska, zatem rozkład jest
wąski w przeciwieństwie do rozkładu w
układzie o dużej entropii i energii

ANALITYKA AM L
UBLIN
2007/2008
45
Entropia
• Inaczej entropia jest miarą
nieporządku energetycznego w
układzie lub otoczeniu.
• Im większa entropia, tym układ
zawiera większe możliwości
rozkładu energii.

ANALITYKA AM L
UBLIN
2007/2008
46
Entropia a energia
• Entropia jest funkcją energii
wewnętrznej ( i entalpii) układu:
jeżeli energia układu wzrasta to
wzrasta entropia i odwrotnie.

ANALITYKA AM L
UBLIN
2007/2008
47
Entropia reakcji
chemicznej
• Co się stanie z entropią układu i
otoczenia jeżeli zachodzi reakcja
chemiczna?
• W reakcji egzotermicznej entalpia
układu się zmienia, zatem entropia
musi ulec zmniejszeniu również.
• Entalpia otoczenia w takim
przypadku ulega zwiększeniu, zatem
entropia musi się zwiększyć też.

ANALITYKA AM L
UBLIN
2007/2008
48
Entropia reakcji
endotermicznej
• W tej reakcji energia układu się
zmienia – rośnie wskutek
pochłaniania energii, zatem
entropia rośnie również.
• Następujące dwa rysunki
podsumowują oba typy reakcji.
ANALITYKA AM L
UBLIN
2007/2008
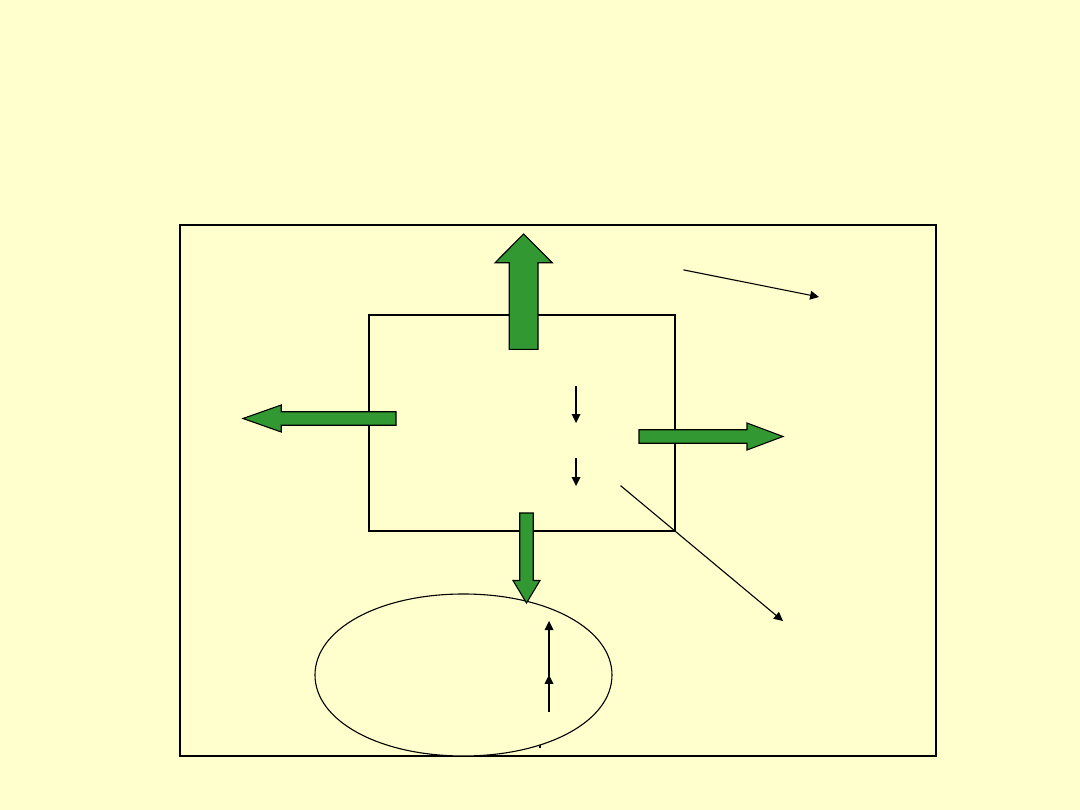
49
Reakcja egzotermiczna
Entalpia
Entropia
Entalpia
Entropia
Entropia
Entalpia
Otoczenie
Układ
ANALITYKA AM L
UBLIN
2007/2008
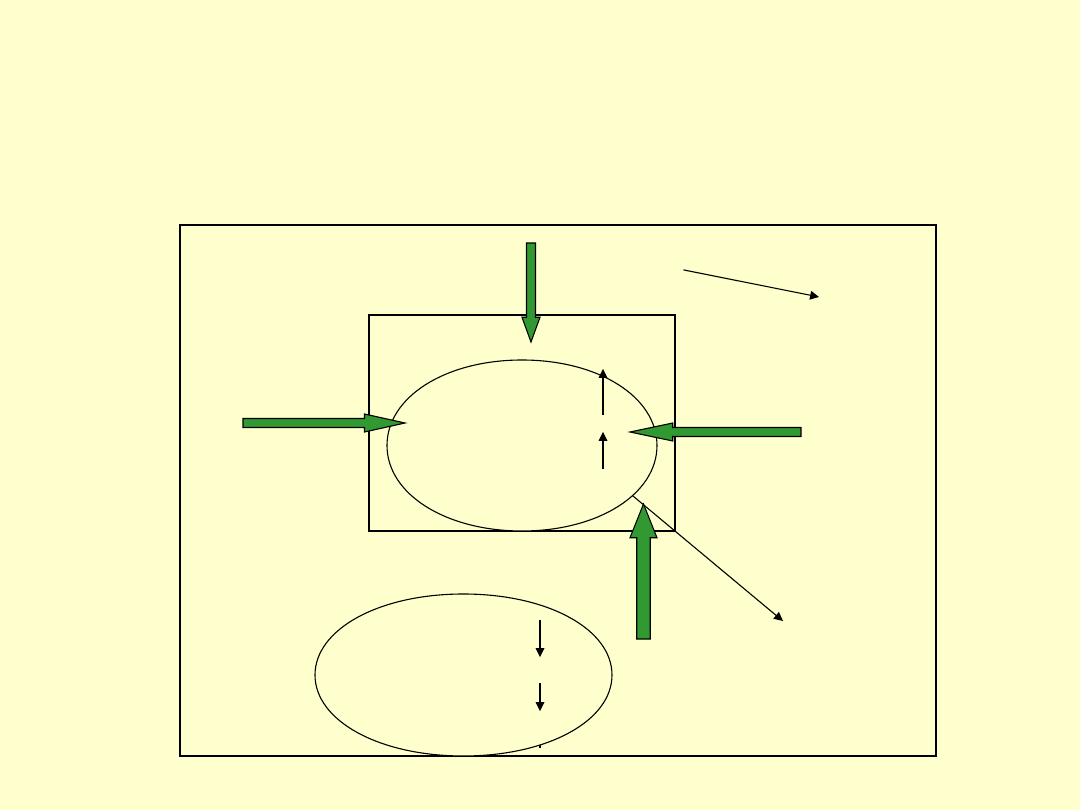
50
Reakcja endotermiczna
Entalpia
Entropia
Entalpia
Entropia
Entropia
Entalpia
Otoczenie
Układ
Entropia
Entalpia

ANALITYKA AM L
UBLIN
2007/2008
51
Temperatura i zmiana
entropii otoczenia
• Zmiana entropii zależy od
temperatury otoczenia:
T
H
S
otoczenia
J mol
-1
J K
-1
mol
-1
Temperatura (K)
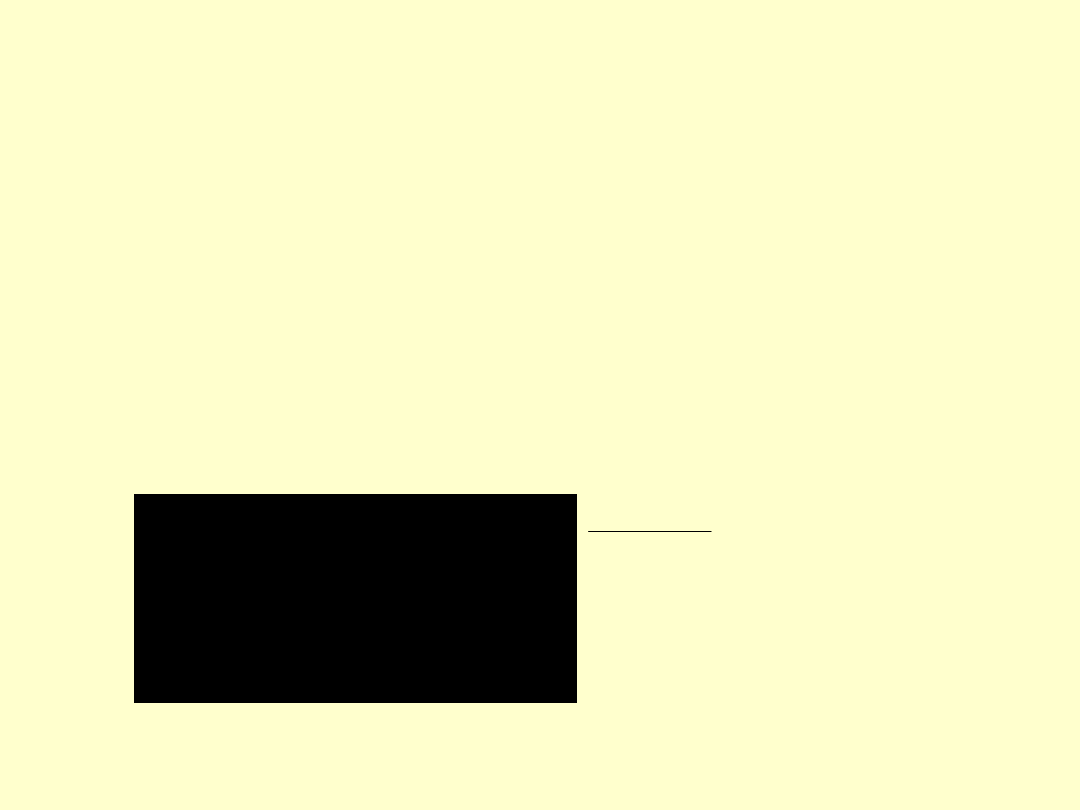
ANALITYKA AM L
UBLIN
2007/2008
52
Warunki izobaryczne
• Wniosek, w niższej temperaturze
zmiana entropii jest większa
• Wraz ze wzrostem temperatury
człon maleje
T
H
S
otoczenia

ANALITYKA AM L
UBLIN
2007/2008
53
Zmiana entropii
H = -40 kJ K
-1
mol
-1
T= 278 K (5 C)
• - H /T = - (-40 000/278) = +144
JK
-
1
mol
-1
• - H /T = - (-40 000/298) = +134 JK
-
1
mol
-1

ANALITYKA AM L
UBLIN
2007/2008
54
Wnioski
• Wzrost entropii przy wyższej
temperaturze jest stosunkowo
niewielki
• Przy niższej temperaturze otoczenia
wpływ energii na zmianę entropii
jest większy aniżeli przy wyższych
• Np.. Przekrzykiwanie w czytelni
biblioteki i barze piwnym

ANALITYKA AM L
UBLIN
2007/2008
55
Zmiana entropii
wszechświata
• Całkowita zmiana entropii
otoczenia
ukł
total
S
S
S

ANALITYKA AM L
UBLIN
2007/2008
56
Entropia w reakcji
spontanicznej
• Dla reakcji samorzutnej całkowita
zmiana entropii musi być dodatnia
czyli musi następować wzrost
entropii wszechświata
• To stanowi sformułowanie drugiej
zasady termodynamiki

ANALITYKA AM L
UBLIN
2007/2008
57
Przykład
• Tworzenie wody:
• 1/2O
2
+H
2
H
2
O reakcja
egzotermiczna z dużą ilością
wydzielonego ciepła
• Zatem zmiana entropii układu jest
ujemna a zmiana entropii otoczenia
dodatnia.
• Sumaryczna zmiana entropii wynosi:

ANALITYKA AM L
UBLIN
2007/2008
58
Zmiana entropii
• (-89 JK
-1
mol
-1
)
• (1623 JK
–1
mol
-1
)
• Razem:
1534
S

ANALITYKA AM L
UBLIN
2007/2008
59
Zmiana entropii
• Zmiana entropii w otoczeniu
rekompensuje ujemną zmianę
entropii układu i całkowita zmiana
jest dodatnia zatem reakcja
przebiega
spontanicznie/samorzutnie

ANALITYKA AM L
UBLIN
2007/2008
60
Woda i lód
• Dlaczego woda samorzutnie
zamarza poniżej 0°C :
• Razem:
• Otoczenie:
• - H /T
otoczenie
ukłkł
total
S
S
S

ANALITYKA AM L
UBLIN
2007/2008
61
Wodalód
• Temperatury T=283 i T=263
• Entropia zmiany fazowej lód-woda
wynosi
• -22,0 JK
-1
mol
-1
• Zmiana entropii otoczenia:
• W temp –10 °C wynosi:
• Zmiana entalpii H = - 6010 J mol
-1

ANALITYKA AM L
UBLIN
2007/2008
62
Wodalód
• Reakcja woda lód jest reakcją
egzotermiczną, zatem w temperaturze
-10°C zmiana entropii otoczenia wyniesie:
S
otocz
= - H /T = -(-6010/263) = + 22,9 J
K
-1
mol
-1
• Natomiast w temperaturze + 10°C
wyniesie
S
otocz
= - H /T = -(-6010/283) = + 21,2 J
K
-1
mol
-1

ANALITYKA AM L
UBLIN
2007/2008
63
Woda lód
• W obu przypadkach zmiany
entropii sa dodatnie
• Zmiany entropii razem dla układu i
otoczenia wynoszą:
• W temperaturze -10°C wynosi:
• -22,0 +22,9=+0,9
• W temperaturze +10 °C
• -22,0+21,2 = -0,8

ANALITYKA AM L
UBLIN
2007/2008
64
Podsumowanie
• W niższej temperaturze całkowita
zmiana entropii jest dodatnia,
zatem reakcja przebiega
samorzutnie.
• Entropia i II zasada
termodynamiki są wystarczające
do wyjaśnienia tego zjawiska

ANALITYKA AM L
UBLIN
2007/2008
65
Entalpia swobodna
• Dlaczego zachodzą reakcje
chemiczne?
• Odpowiedź bardzo ważna z punktu
widzenia utrzymania funkcjonowania
systemy biologicznego.
• Wiemy że energia może być
przekazywana na dwa sposoby czyli
pracy i ciepła.

ANALITYKA AM L
UBLIN
2007/2008
66
Przepływ energii
• Jaka część energii może być
wykorzystana do pracy.
• Jeżeli reakcji odpowiada zmiana
entalpii H to czy cała energia może
być zamieniona na pracę?
• Część zmiany energii równej
zmianie entalpii musi być
wykorzystana do zmiany entropii
otoczenia

ANALITYKA AM L
UBLIN
2007/2008
67
Przepływ energii
• Zmianę entalpii możemy podzielić na
dwie części:
H
entropia
+ H
praca
= H
całkowita
• Wiemy że zmiana entropii otoczenia
równa się S = -H/T a więc : H =
T· S
H
praca
= H
całkowita
-(T· S )

ANALITYKA AM L
UBLIN
2007/2008
68
Swobodna entalpia
H
praca
= H
całkowita
-(-T· S )
G = H
całkowita
-(-T· S )
• Reprezentuje tą część energii
którą można wykorzystać jako
pracę
• Oblicza się jako różnicę G
produktów i G substratów

ANALITYKA AM L
UBLIN
2007/2008
69
Przykład
• Reakcja spalania węgla:
• C+O
2
=CO
2
G = -394.4 kJ/mol
• Czyli z całkowitej zmiany entalpii
394.4 może być wykorzystane do
wykonania pracy.
• Synteza wody:
• Entalpia H = -571,7 KJ/mol a G
= - 474.3 KJ/mol
ANALITYKA AM L
UBLIN
2007/2008
70
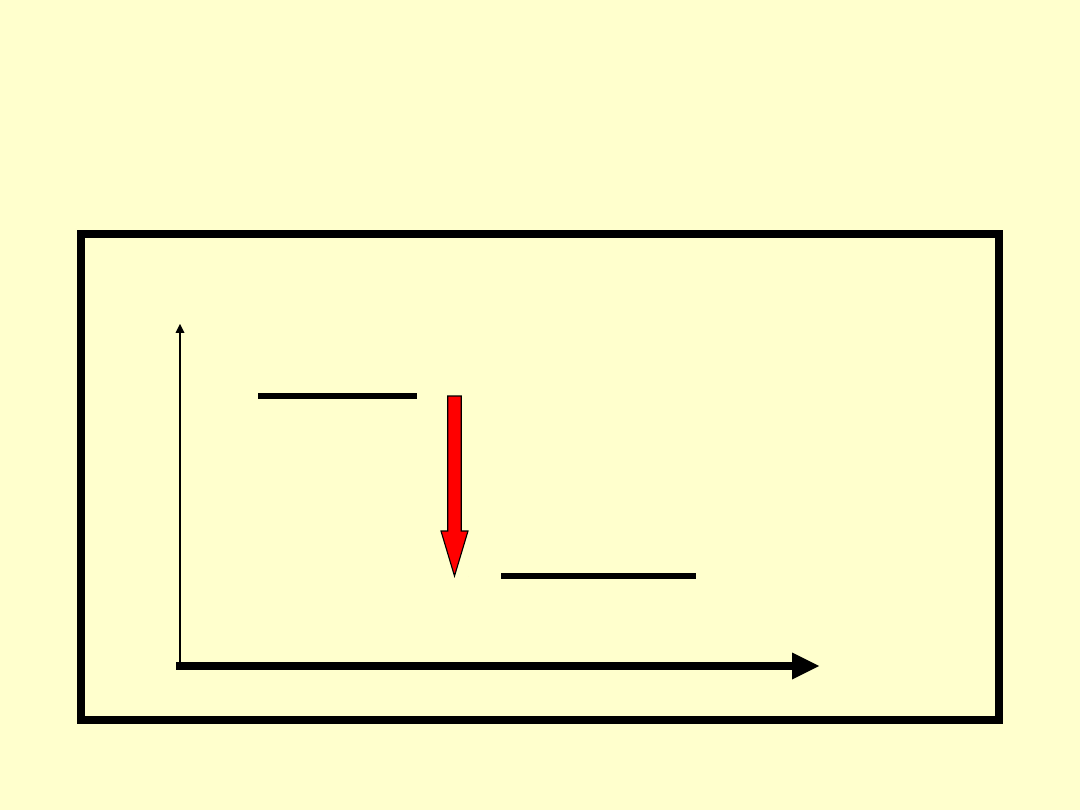
Spontaniczność a energia
Gibbsa
• W reakcji spontanicznej G <0
zatem:
G
Substraty
Produkty
ANALITYKA AM L
UBLIN
2007/2008
71
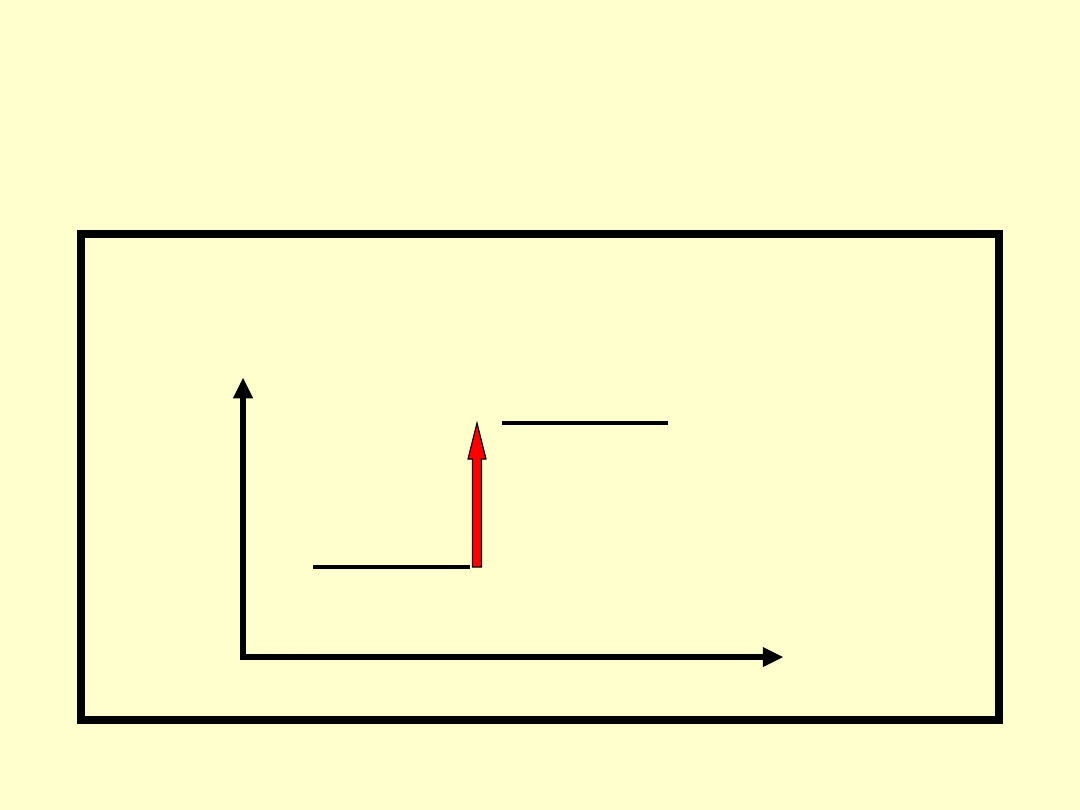
Spontaniczność a energia
Gibbsa
• Jeżeli G >0 zatem reakcja nie
przebiega samorzutnie:

ANALITYKA AM L
UBLIN
2007/2008
72
Metabolizm
• Energia z samorzutnej reakcji
egzotermicznej może być
wykorzystana do przeprowadzenia
reakcji endotermicznej i
niesamorzutnej. Np..
• Reakcja spalania glukozy
G = -2870 kJ/mol
• Wykorzystuje to w 30 reakcjach
składających się na proces oddychania

ANALITYKA AM L
UBLIN
2007/2008
73
Łączenie reakcji
biochemicznych
• Metabolizm to szereg reakcji zachodzących
w jakimś organizmie żywym dzieli się na
• Kataboliczne i anaboliczne
• Rozkład wysokoenergetycznych związków
na pros trze –reakcje egzotermiczne i
samorzutne
• Tworzenie złożonych struktur z prostych
cząsteczek – reakcje endotermiczne i
niesamorzutne

ANALITYKA AM L
UBLIN
2007/2008
74
Metabolizm
• Reakcje kataboliczne dostarczają
energii a część z niej służy do
przeprowadzenia reakcji
anabolicznych
• Jeżeli brak właściwej równowagi
proces metabolizmu ustaje

ANALITYKA AM L
UBLIN
2007/2008
75
Trójfosforan adenozyny
ATP
• Utlenianie glikozy dostarcza:
G = -2870 kJ/mol
• ADP+ PiATP G = +30,5 kJ/mol
• W odwrotnej reakcji (reakcji hydrolizy)
G = -30,5 kJ/mol i to wystarcza do
przeprowadzenia większości reakcji
• ATP jest nośnikiem energii

ANALITYKA AM L
UBLIN
2007/2008
76
Zatrucie organizmu
• ATP występuje w komórce w
krótkim okresie i musi być
utrzymywany odpowiedni poziom -
produkowane w sposób ciągły.
Np.. Cyjanek obniża poziom
poprzez związanie się z ATP co w
obrębie kilku minut powoduje
śmierć.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
Wyszukiwarka
Podobne podstrony:
10 Zasady termodynamiki 3
10 Zasady termodynamiki
10 Zasady termodynamiki
zasady termodynamiki
Sprawdzanie słuszności I zasady termodynamiki przy pomocy kalorymetru elektrycznego (2)
27, Zastosowanie I zasady termodynamiki do opisu przemian gazu doskonalego
zasady termodynamika
10 Zasady termodynamiki 2
26 Zasady termodynamiki id 31330 (2)
Zasady termodynamiki w procesach biologicznych
Zasady termodynamiki, CENTRALNA SZKO˙A PA˙STWOWEJ STRA˙Y PO˙ARNEJ W CZ˙STOCHOWIE
Zasady termodynamiki
fale, zasady termodynamiki, ciepło
Zasady termodynamiki Wykład
Sawiński, ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Lista z I zasady Termodyna
nemś,termodynamika, Układy termodynamiczne i zasady termodynamiki zadania z rozwiązaniami
zasady termodynamiki, cykl carltona
więcej podobnych podstron