
1
26. Zasady termodynamiki. Pojęcie energii wewnętrznej, pracy i
ciepła w termodynamice
0 zasada termodynamiki
Zerowa zasada termodynamiki pozwala na wprowadzenie wielkości nazywanej
temperaturą. Określenie wstępne: mówimy, że dwa ciała (układy) nieodizolowane od siebie
pozostają w równowadze termicznej, jeśli nie następuje między nimi przepływ energii
wewnętrznej.
Jeżeli dwa ciała A i B są w równowadze termicznej z ciałem C, to ciała A i B są w
równowadze termicznej ze sobą. Mówimy o nich, że mają tą samą temperaturę.
I zasada termodynamiki
Doświadczalną podstawą pierwszej zasady jest doświadczenie Joule’a i pokrewne mu, które
dowodzą równoważności ciepła i pracy mechanicznej przez pokazanie możliwości całkowitej
zamiany pracy na ciepło. Uznanie ciepła jako innego niż praca sposobu zmiany energii prowadzi w
naturalny sposób do włączenie ciepła do zasady zachowania energii. Pierwsza zasada
termodynamiki jest dokładnie tym prawem
Zmiana energii wewnętrznej układu równa jest dostarczonemu do układu ciepłu i pracy
wykonanej nad układem przez siły zewnętrzne:
U = Q + W
Konwencja: U to przyrost energii wewnętrznej układu. Q oznacza tu ciepło dostarczone do
układu z zewnątrz. Jeśli jednak układ oddaje ciepło, wówczas jego energia wewnętrzna maleje;
ciepło bierzemy ze znakiem ujemnym. W to praca wykonana nad układem przez siły zewnętrzne.
Gdy zaś układ wykonuje pracę (jak to ma miejsce podczas rozprężania się gazu), jego energia
maleje - pracę bierzemy ze znakiem ujemnym. Istnieją konwencje znaków różne od tutaj przyjętej.
I zasada termodynamiki pozwala na zdefiniowanie energii wewnętrznej jako funkcji stanu: dla
wszystkich procesów prowadzących od pewnego określonego stanu do drugiego, zmiana U ma
zawsze tą samą wartość, choć ilości dostarczanego ciepła i wykonanej pracy są na ogół różne dla
różnych procesów
II zasada termodynamiki
Druga zasada termodynamiki mówi o niemożliwości stworzenia silnika, który całkowicie zamieniałby
ciepło na pracę mechaniczną. Podano kilka sformułowań drugiej zasady termodynamiki, z których
każde podkreśla inny aspekt tej zasady, ale wszystkie te sformułowania są sobie równoważne
Clausius wyraził drugą zasadę następująco.
Żadna pracująca cyklicznie maszyna nie może, bez dodatkowych efektów, przenosić w sposób ciągły
ciepła z jednego ciała do drugiego, mającego wyższą temperaturę
Sformułowanie drugiej zasady termodynamiki podane przez Kelvina(i Plancka) było następujące:
Niemożliwa jest przemiana, której jedynym wynikiem byłaby zamiana na pracę ciepła pobranego ze
źródła mającego wszędzie tę sama temperaturę
Najczęściej jednak zasadę tę wyraża się korzystając z pojęcia entropii
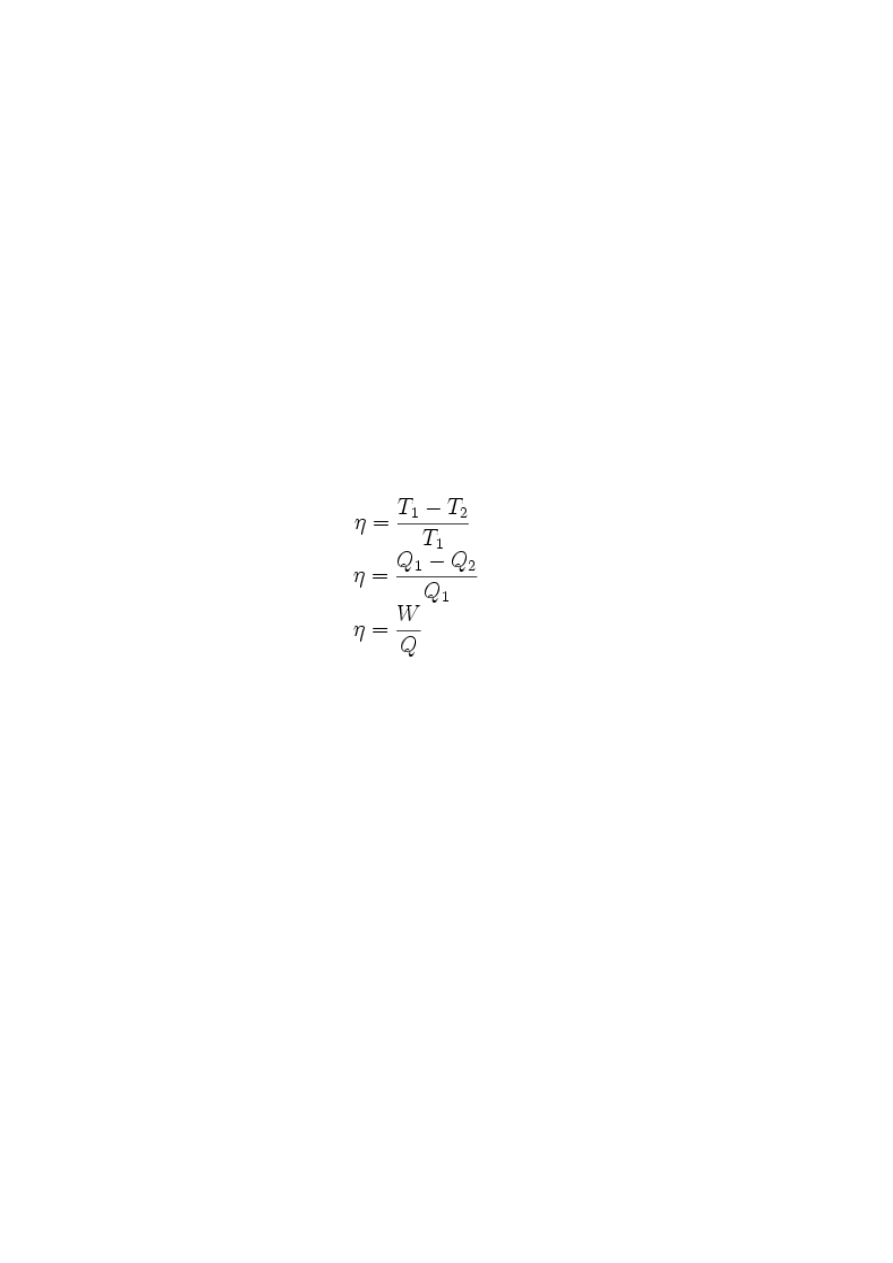
2
W dowolnym procesie (odwracalnym lub nieodwracalnym) w układzie zamkniętym zmiana entropii
dS jest równa dQ/T lub większa
lub jeszcze prościej:
W układzie zamkniętym w dowolnym procesie entropia nigdy nie maleje
Gdzie entropią nazywamy termodynamiczną funkcja stanu, będąca miarą nieuporządkowana układów,
a więc także całego Wszechświata
WNIOSKI PŁYNĄCE Z DRUGIEJ ZASADY TERMODYNAMIKI
Silnik cieplny nie może działać bez różnic temperatury
Inne, równoważne, sformułowanie drugiej zasady termodynamiki wiąże się z silnikiem cieplnym,
czyli urządzeniem zamieniającym ciepło na pracę. Zgodnie z tym sformułowaniem, spontaniczny
przekaz ciepła może się dokonywać tylko od ciała cieplejszego do zimniejszego. Idealny silnik,
pracujący w cyklu przemian odwracalnych, ma sprawność η ograniczoną różnicą temperatur ciał,
pomiędzy którymi przekazywane jest ciepło:
gdzie ciepło jest przekazywane od ciała o temperaturze T
1
do ciała o temperaturze T
2
. Silnik
spełniający tę regułę jest nazywany silnikiem Carnota.
Z II zasady termodynamiki zastosowanej do silników cieplnych wynika, że nie można ciepła
zamieniać na pracę bez ograniczeń, nawet wtedy gdy jest to zgodne z I zasadą termodynamiki. Nie
można bez wkładu pracy przesyłać energii termicznej między ciałami mającymi tę samą temperaturę.
Prowadzi to do dalszego wniosku - nie da się w pełni kontrolować procesów statystycznych, np. nie
można czerpać energii z przypadkowych ruchów cząstek, takich jak ruchy Browna. Z II zasady
wynika, że przyrządy do czerpania tego rodzaju energii po pewnym czasie też zaczną się zachowywać
przypadkowo, a więc staną się bezużyteczne. Miarą tej przypadkowości jest właśnie temperatura. Aby
czerpać energię termiczną z układu, trzeba dysponować czymś zimniejszym niż ten układ.
Śmierć cieplna Wszechświata
Z II zasady termodynamiki wynika też hipoteza tzw. śmierci cieplnej Wszechświata. Miałaby ona
polegać na tym, iż po jakimś czasie Wszechświat, jako całość, dojdzie do stanu równowagi
termodynamicznej, czyli będzie miał jednakową temperaturę w każdym punkcie i wymiana energii
termicznej całkowicie zaniknie, a co za tym idzie zanikną wszelkie inne rodzaje wymiany energii,
które w ten czy inny sposób są zawsze związane ze zmianą temperatury. Teoria śmierci cieplnej jest
jednak nadinterpretacją, wynikającą z przeniesienia rozumowania pochodzącego z fizyki
fenomenologicznej w dziedzinę przekraczającą zakres jej stosowalności – do kosmologii. Taka
interpretacja II zasady termodynamiki, zakłada bowiem, że Wszechświat jako całość jest układem

3
zamkniętym, na co nigdy nie będzie dowodów eksperymentalnych. Drugim problem jest fakt, że II
zasada termodynamiki zawodzi w przypadku niektórych zjawisk kwantowych
Paradoks nieodwracalności
Z interpretacją II zasady termodynamiki jest też związany swoisty paradoks. Z jednej strony wynika z
niej, że wiele zjawisk, obserwowanych w skali makroskopowej może być całkowicie nieodwracalne.
Z drugiej strony termodynamika statystyczna, z której ta zasada się wywodzi, zakłada, że każde
jednostkowe zjawisko w skali mikroskopowej, czyli w skali pojedynczych cząstek jest odwracalne.
Mimo że wszystkie zjawiska makroskopowe są sumą odwracalnych zjawisk mikroskopowych,
przyjmuje się jednak - wbrew zdrowemu rozsądkowi - możliwość ich nieodwracalności. Paradoks ten
przyczynił się do początkowego odrzucenia równania Boltzmanna, opisującego procesy
nierównowagowe.
Ten paradoks wskazuje na ścisły związek między teorią a pomiarem w fizyce. Interpretacja pomiaru
układów wielocząstkowych jest oparta na teoriach tworzonych dla układów makroskopowych. Można
powiedzieć, że pomiary te dotyczą sum uśrednionych zjawisk mikroskopowych. Dla takich pomiarów
koncepcja entropii jest niezbędna teoretycznie. Gdyby jednak dało się w jakiś sposób przejść do
pomiaru tych zjawisk na poziomie pojedynczych cząstek, koncepcja entropii przestałaby być
potrzebna. Liczba cząstek w rzeczywistych, makroskopowych układach doświadczalnych jest jednak
bardzo duża (rzędu stałej Avogadra) i dlatego pomiar olbrzymiej większości zjawisk fizycznych na
poziomie mikroskopowym jeszcze długo pozostanie poza zasięgiem nauki.
III zasada termodynamiki
Trzecia zasada termodynamiki głosi, że entropia substancji tworzących doskonałe kryształy dąży do
0 gdy temperatura dąży do 0 K.
Mówiąc jaśniej, gdyby udało się schłodzić jakąś substancję do 0 K i gdyby ona utworzyła kryształ
doskonały to jej entropia musiałaby przyjąć wartość 0. Jest to jednak technicznie, a także formalnie
niewykonalne, dlatego definicja trzeciej zasady termodynamiki w formie:
entropia kryształu doskonałego w temperaturze zera bezwzględnego jest równa 0
nie jest poprawna, choć intuicyjnie akceptowalna.
Energia wewnętrzna to część energii układu zależna tylko od jego stanu wewnętrznego, stanowi ona
sumę energii oddziaływań międzycząsteczkowych i wewnętrzcząsteczkowych układu oraz energii
ruchu cieplnego cząsteczek.
Jest jednym z parametrów (potencjałów) termodynamicznych. Według I zasady termodynamiki
energia wewnętrzna stanowi jednoznaczną funkcję stanu, którą dla gazu można wyrazić przez
dowolne dwa z trzech parametrów; ciśnienie, objętość, temperatura.
W termodynamice, praca jest obok ciepła jedną z dwu form przekazywania energii między układami
lub częściami układu. Jest wielkością makroskopową, czyli związaną z zachowaniem układu jako
całości. Równa jest energii, jaką układ oddaje otoczeniu przy jednoczesnej zmianie swoich
parametrów makroskopowych (objętość, położenie, natężenie pola, itp). Zasadą określającą sposób

4
wymiany energii z otoczeniem (wykonywanie pracy nad układem, wykonywanie pracy przez układ
nad otoczeniem, przepływ ciepła) jest pierwsza zasada termodynamiki.
W przypadku pracy wykonanej na skutek procesów niemechanicznych (termodynamicznych,
elektrycznych, chemicznych itp.) można ją sobie wyobrazić jako sumę prac przesunięć cząsteczek
biorących udział w danym procesie.
Ciepło w termodynamice to forma przekazywania energii termicznej. Relacja między energią
termiczną a ciepłem jest taka sama jak między pracą i energią w mechanice. Cieplnym
odpowiednikiem określenia "wykonanie pracy na układzie" jest określenie "wystąpienie przepływu
ciepła".
Ciepło przepływa między ciałami, które znajdują się w stosunku do siebie w nierównowadze
termicznej, zwykle wtedy, gdy posiadają one różną temperaturę. W niektórych, szczególnych
przypadkach może ono jednak także przepływać między ciałami o tej samej temperaturze.
Wyszukiwarka
Podobne podstrony:
obiegi termodynamiczne id 32706 Nieznany
26 ZASADY KSZTAŁCENIA I KSZTAŁTOWANIA KANDYDATÓW DO
26 Ironia i groteska id 31313 Nieznany (2)
potencjaly termodynamiczne id 3 Nieznany (2)
W 4 1 Konsekwencje I zasady Termodynamiki
26 05 2011 id 31262 Nieznany (2)
8 Obieg termodynamiczny id 467 Nieznany (2)
6 Zasady Projektowania id 43987 Nieznany (2)
10 Zasady termodynamiki 3
10 Zasady termodynamiki
02 GOTO MK zasady (wykaz)id 3407 ppt
FINANSE WYKLAD 4 (26 11 2011) id 171465
kodeks postepowania administrac 26,03,2015 id 238391
10 Zasady termodynamiki
Cykle termodynamiczne id 126592 Nieznany
zasady termodynamiki
Cykle termodynamiczne id 126591 Nieznany
więcej podobnych podstron