1. Oksydoreduktazy
Enzymy katalizujące reakcje oksydoredukcyjne, polegające
na przenoszeniu elektronów, protonów (H
+
) lub polegające
na bezpośrednim włączaniu tlenu do substratu
Klasa ta obejmuje następujące grupy enzymów:
AH
2
+ B <-> A + BH
2
A - substrat, B - przenośniki e
-
i H
+
np.: NAD
+
,
FAD
A + BH
2
<-> AH
2
+ B
A,B - przenośniki e
-
i H
+
np.: NADP
+
,FAD,
ferredoksyna
cytochromy
A – substrat, B-przenośniki e
-
i H
+
2AH
2
+ O
2
<-> A + 2H
2
O
A - substrat
AH
2
+ O
2
<-> A + H
2
O
2
AH
2
+ H
2
O
2
<-> 2A + 2H
2
O
A - substrat
a) A + O
2
<-> AO
2
A - substrat
b) AH + BH
2
+
O
2
<-> AOH + B + H
2
O
A, B - substraty
- dehydrogenazy – odwodorowanie, utlenienie
- reduktazy – redukcja
- oksydazy
- peroksydazy
- oksygenazy (a) i hydroksylazy (b)

2. Transferazy
Klasa ta obejmuje enzymy katalizujące przeniesienie grup chem. pomiędzy
poszczególnymi związkami i to zwykle przy udziale specyficznych koenzymów.
W zależności od rodzaju przenoszonych grup lub rodników wyróżniamy min.:
przenoszą grupę aminową –NH
2
przenoszą grupy fosforanowe z udziałem ATP
przenoszą grupę –CH
3
przenoszą grupy cukrowe
przenoszą grupy acylowe 2,4,6-węglowe
- aminotransferazy:
- fosfotransferazy (kinazy):
- metylotransferazy:
- glikozylotransferazy:
- acylotransferazy:

3. Hydrolazy
Enzymy katalizujące reakcje hydrolizy, czyli rozkładu wiązań z udziałem
cząsteczki wody.
Jest to jedyna klasa enzymów, która nie wymaga obecności koenzymów.
-esterazy
- lipazy
- fosfatazy
- glikozydazy
(np. amylazy, celulaza)
- peptydazy
-
amidohydrolazy
W zależności od rodzaju atakowanych wiązań rozróżniamy hydrolazy min. :
- rozkładające wiązanie estrowe
:
(hydrolazy estrów karboksylowych),
(hydrolazy monoestrów fosforanowych)
- hydrolizujące wiązania glikozydowe
- hydrolizujące wiązania peptydowe
(np. trypsyna, pepsyna,
chymotrypsyna)
- rozkładające wiązanie C- N inne niż peptydowe np. w amidach

Ze względu na rodzaj rozszczepianych wiązań wyróżniamy min. liazy:
- rozrywające wiązanie C-C
- uwalniają CO
2
z substratów
- uwalniają aldehydy z substratu
- działające na wiązania C-O, np.:
- odłączają cząsteczkę wody
- przyłączają i odłączają cz. wody
- rozszczepiające wiązanie C-N
- odłączają NH
3
4. Liazy
Enzymy katalizujące odwracalane lub nieodwracalne rozerwanie
różnych wiązań bez udziału wody, przy czym z substratu na który
działa enzym odłączane są pewne grupy (np.. CO
2
, H
2
O, NH
3
,
aldehydy).
Do klasy tej należą
syntazy
, które nie wymagają nakładu energii do
syntezy wiązań
- dekarboksylazy
- aldolazy
- dehydratazy
- hydratazy
- deaminazy

5. Izomerazy
Należą tutaj enzymy katalizujące różne reakcje izomeryzacji min.:
- odpowiedzialne za zmianę konfiguracji przy węglu
asymetrycznym (wzajemne przekształcenia
konfiguracji L i D lub formy i )
- racemazy i epimerazy
- izomerazy cis - trans
- izomeria geometryczna (cis-trans)
- odpowiedzialne za przemieszczenie grup wewnątrz cząsteczki
- mutazy
Klasa enzymów katalizujących przekształcenia wewnątrzcząsteczkowe.
Może to być przegrupowanie atomów bądź grup. Skład chemiczny
związku nie ulega zmianie
6. Ligazy, zwane potocznie syntetazami
Są to enzymy katalizujące syntezę - powstanie nowych wiązań:
C-O, C-S, C-N, C-C.
Wszystkie reakcje katalizowane przez ligazy zachodzą z udziałem ATP
lub innego związku makroergicznego
Syntetazy katalizujące dołączenie do substratu CO
2
– nazywamy
potocznie
karboksylazami
- izomerazy odpowiedzialne za wewnątrzcząsteczkowe przemiany
oksydoredukcyjne (przesunięcie atomów H
+
)

Koenzymy
- niskocząsteczkowe związki organiczne
- niebiałkowa część enzymu, która łącząc się z białkiem enzymu i
substratem umożliwia przemianę substratu w produkt
- przenośniki elektronów, protonów bądź określonych grup
funkcyjnych
- syntetyzowane na bazie witamin rozpuszczalnych w wodzie
(głównie witamin z grupy B)
Witaminy
- składniki mające istotne znaczenie w prawidłowym metabolizmie
- konieczne do życia substancje o charakterze regulacyjnym
- muszą być dostarczone wraz z pożywieniem
- działają w małych stężeniach
- ich brak lub niedobór powoduje awitaminozę

Podział koenzymów
1.
Koenzymy przenoszące elektrony i protony,
współdziałające z
oksydoreduktazami
-
NAD
+
- dinukleotyd nikotynamidoadeninowy
[wit. PP]
-
NADP
+
- fosforan dinukleotydu nikotynamidoadeninowego
[wit. PP]
-
FAD - dinukleotyd flawinoadeninowy
[wit.B
2
]
-
FMN - mononukleotyd flawinowy
[wit.B
2
]
-
CoQ - koenzym Q
-
Lipoamid - amid kwasu liponowego
-
Heminy - stanowią grupę prostetyczną enzymów np.
peroksydazy ale
też białek nieenzymatycznych np.
cytochromów)
2. Koenzymy przenoszące różne grupy chem., współpracujące
z klasą
transferaz
-
PLP
- fosforan pirydoksalu
[wit. B
6
]
-
nukleozydotrifosforany (ATP, UTP, CTP, GTP)
-
DPT - difosforan tiaminy
[wit.
B
1
]
-
THF - kwas tetrahydrofoliowy
3. Koenzymy przenoszące różne grupy chem., współpracujące
z
liazami, ligazami, izomerazami,
-
nukleozydotrifosforany
-
PLP
- fosforan pirydoksalu
[wit. B
6
]
-
DPT - difosforan tiaminy
[wit.
B
1
]
-
CoA-SH - koenzym A
[wit.
B
5
]
-
CoB
12
- koenzym B
12
- kobalamina
[wit.
B
12
]
-
Biotyna - witamina H
Dinukleotyd nikotynamidoadeninowy (NAD
+
)
i jego fosforan (NADP
+
)
OH
OH
CH
2
C
O
NH
2
+
O
-O P
O
amid kwasu
nikotynowego
(wit. PP)
D-ryboza
NAD
+
:
R
= H
NADP
+
:
R
=
PO
3
2-
NH
2
O
R
OH
CH
2
O
O
-O P
O
adenina
D-ryboza
AMP
N
O
N
N
N
N
O
C
O
NH
2
+
H
R
C
O
NH
2
H
R
H
+
H
+
2
H
+
+
2e-
-
2
H
+
-
2e
-
Amid kwasu nikotynowego
utleniony
(NAD+
, NADP
+)
zredukowany
(NADH + H+
, NADPH + H+)
N
N
..
+
Flawina - dimetyloizoaloksazyna
O
O
+
2H
+
+
2e-
-
2H
+
-
2e
-
N
O
O
R
R
H
H
H
3
C
H
3
C
H
3
C
H
3
C
N
N
NH
NH
N
N
N
forma utleniona
(FAD, FMN)
forma zredukowana
(
FADH
2
,
FMNH
2
)
NH
N
N
N
O
H
3
C
H
3
C
O
C
C
C
H
H
OH
OH
H
H
ry
b
it
o
l
ry
b
o
f
a
w
in
a
(
w
it
.
B
2
)
f
a
w
in
a
AMP
O-
C
C OH
H
H
2
O
O
P
O
O
P
O
O-
FMN
- mononukleotyd fawinowy
- fosforan rybofawiny
Dinukleotyd fawinoadeninowy - FAD
OH
CH
2
O
NH
2
OH
N
N
N
N
żółta
bezbarwna
Amid kwasu liponowego
CH
2
CH
CH
2
S
(CH
2
)
4
C NH
2
O
CH
2
CH
CH
2
S
H
S
H
(CH
2
)
4
C NH
2
O
+
2H
+
+
2e
-
-
2H
+
-
2e
-
forma utleniona
forma zredukowana
S
CH
3
CH
(
CH
2
CH
3
CH
2
)
C
H
H
3
CO
H
3
CO
O
O
n
CH
3
CH
(
CH
2
CH
3
CH
2
)
C
H
H
3
CO
H
3
CO
O
H
O
H
n
+
2
H
+
+
2e-
-
2H
+
-
2e-
forma utleniona
(Q, ubichinon)
forma zredukowana
(QH
2
, ubichinol)
Koenzym Q (ubichinon)
n= 6-10
izopentenol
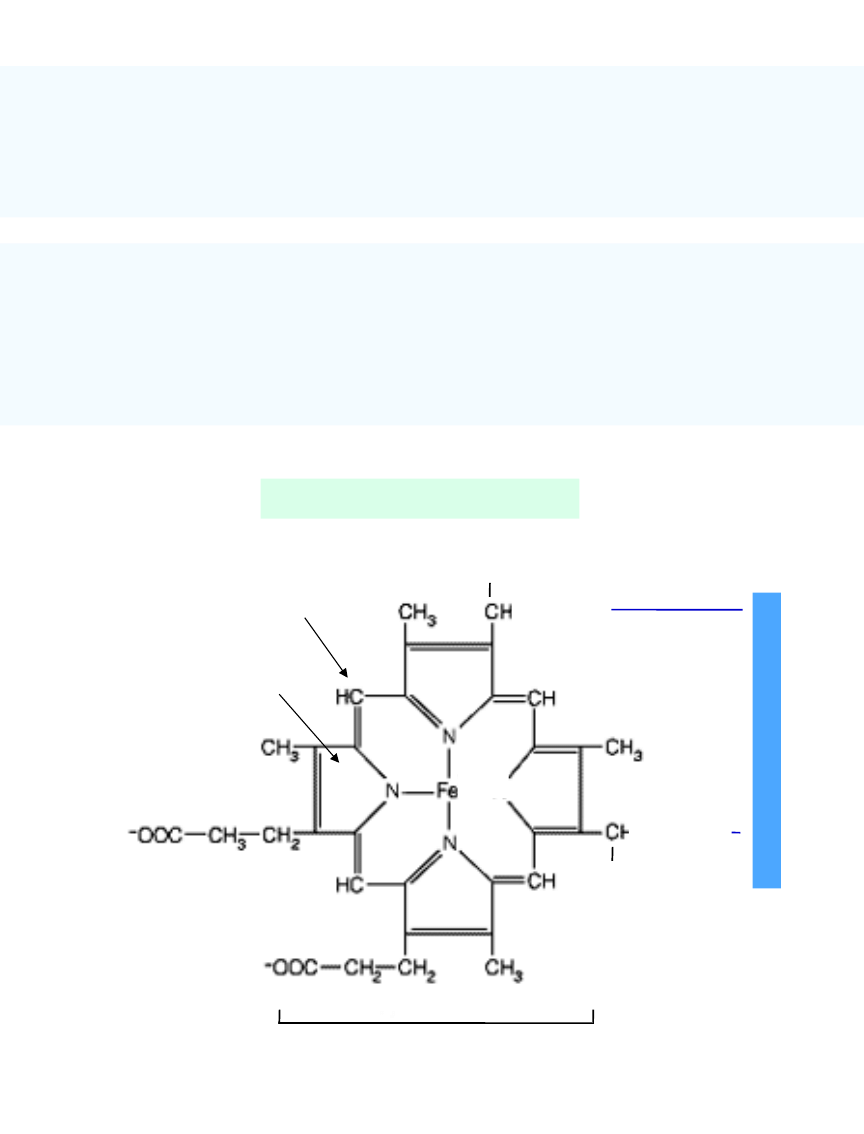
Budowa cytochromu c
Heminy komórkowe
- związki o charakterze żelazoporfiryn
- uczestniczą w transporcie elektronów
- stanowią grupę prostetyczną:
- wielu enzymów: peroksydaza, katalaza, oksydaza cytochromowa c
- białek o charakterze nieenzymatycznym np. cytochromów
Cytochromy
- hemoproteiny o charakterze nieenzymatycznym
- biorą udział w transporcie pojedynczych elektronów w łańcuchu oddechowym
- ich rola polega na utlenianiu za pośrednictwem koenzymu Q zredukowanych
koenzymów flawinowych
- przyjmują i oddają elektrony zmieniając wartościowość żelaza (Fe
2+
- zred, Fe
3+
-
utl.)
N
b
ia
łk
o
CH
3
-
S – CH
2
żelazoporfiryna
-
S – CH
2
CH
3
1
2
3
4
pierścień pirolowy
mostki metinowe
3
+
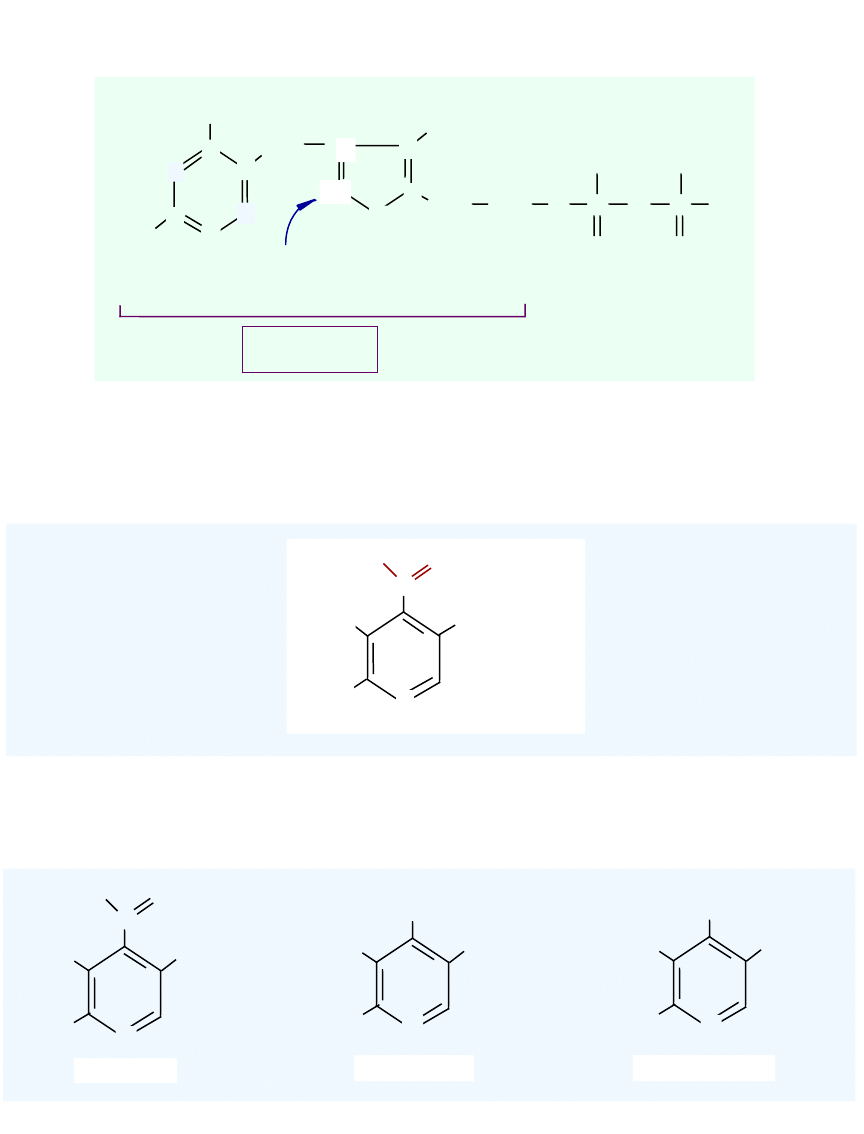
Difosforan tiaminy - DPT
NH
2
H
3
C
CH
2
S
CH
3
CH
2
CH
2
O
O
P
O
P
O
O-
O-
O-
CH
C
N
+
proton
dysocjujący
tiamina
(witamina B
1
)
N
N
C
C
C
H
C
Różne formy witaminy B6
C
CH
2
O-
PO
3
2-
HO
H
3
C
C
O
H
N
Fosforan pirydoksalu (PAL)
CH
2
OH
CH
2
OH
HO
H
3
C
N
pirydoksyna
CH
2
NH
2
CH
2
OH
HO
H
3
C
N
pirydoksamina
C
CH
2
OH
HO
H
3
C
C
O
H
N
pirydoksal
C
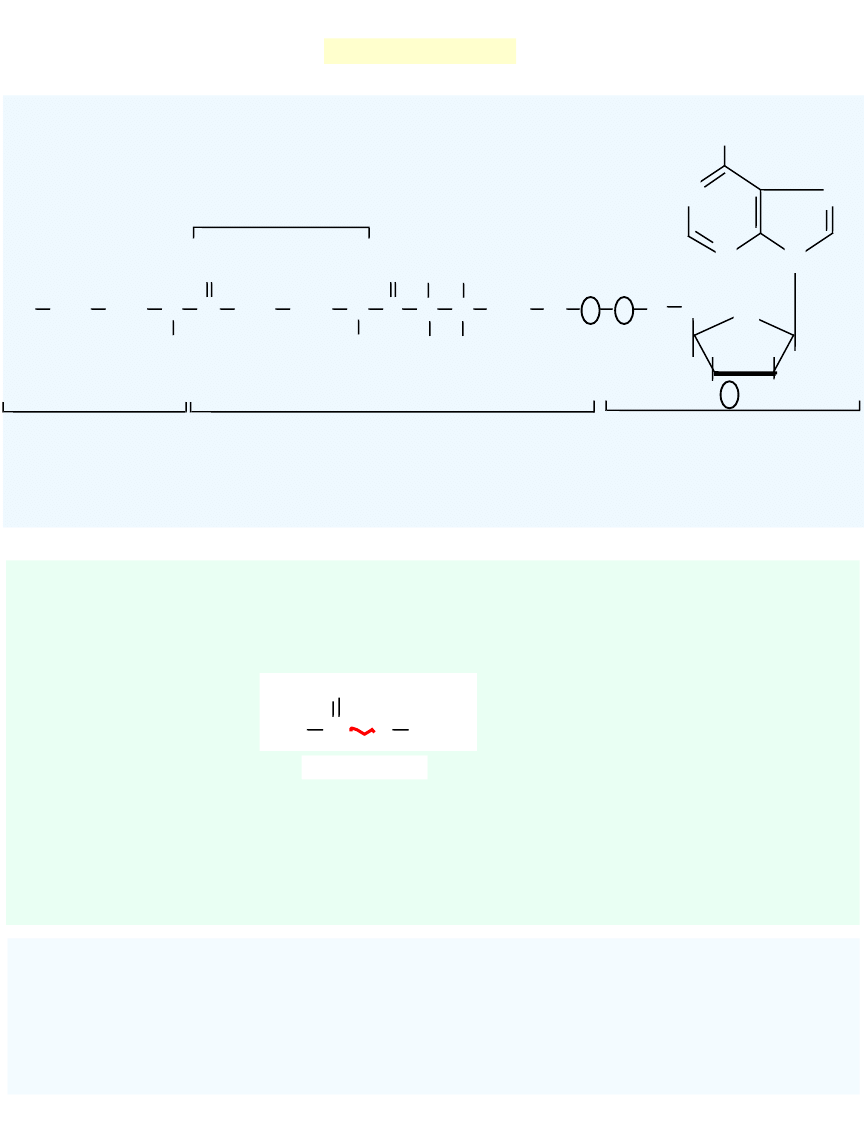
Koenzym A (CoA)
NH
2
N
N
O
CH
2
O
OH
N
N
C
O P
O
P
CH
2
C
CH
3
CH
3
HO
H
C
O
CH
2
CH
2
C
O
CH
2
CH
2
HS
N
H
N
H
cysteamina
fosforan kwasu
pantotenowego
3,5 - difosforan
adenozyny
-alanina
Podstawową funkcją
CoA
jest aktywowanie i przenoszenie reszt acylowych (np. 3,6, 8, 10-
węglowych).
Najczęściej przenoszoną grupą jest
grupa acetylowa
, powstaje
acetylo-CoA.
Acetylo-CoA
- związek bogaty w energię
- wykorzystywany na pokrywanie potrzeb energetycznych
organizmu, przez włączenie do cyklu Krebsa
- wykorzystywany do biosyntezy ważnych substancji jak
np.wyższe kwasy tłuszczowe, cholesterol.
acetylo-CoA
CoA
uczestniczy także w procesach tj.:
- aktywacja kwasów tłuszczowych
- degradacja kwasów tłuszcz
owych przez
-oksydację
- dekarboksylacja oksydacyjna 2-oksokwasów
C
O
CH
3
CoA
S
P
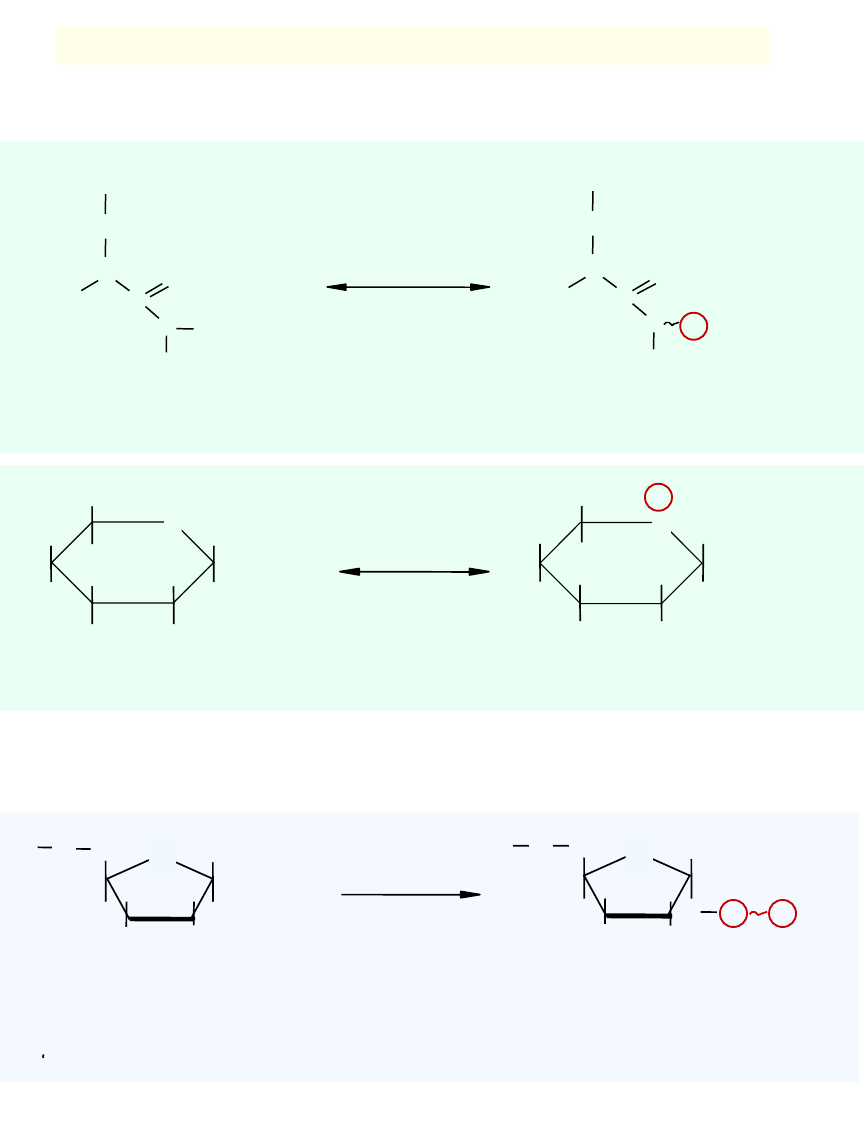
2. Przeniesienie reszty difosforanu z ATP na substrat
OH
CH
2
O
P
O
P
OH
OH
+ ATP
OH
CH
2
O
P
O
P
OH
O
P
P
+ AMP
pirofosfokinaza
rybozofosforanowa
rybozo- 5-fosforan
5-fosforybozylo-1-
pirofosforan
COOH
CH
2
N
C
H C
3
N
H
NH
H
COOH
CH
2
N
C
H C
3
N
H
NH
P
+ ATP
+ ADP
kinaza
kreatynowa
kreatyna
fosfokreatyna
Typy reakcji, w których ATP uczestniczy jako koenzym:
1. Przeniesienie pojedynczej reszty fosforanowej z ATP na substrat
+ ATP
OH
OH
OH
OH
H
H
H
H
H
CH
2
OH
OH
OH
OH
OH
H
H
H
H
H
CH
2
-O-
P
+ ADP
glukoza
glukozo-6-fosforan
heksokinaza
O
O
CH
2
NH
2
COOH
C
H
CH
2
S
CH
3
NH
2
OH
CH
2
N
O
N
N
N
OH
CH
2
NH
2
COOH
C
H
CH
2
S
H
3
C
+ ATP
adenozylotransferaza
metioninowa
P P
+
+ P
metionina
adenozylometionina
3. Przyłączenie monofosforanów nukleozydów do substratu
4. Przyłączenie reszty adenozyny do substratu
Typy reakcji, w których ATP uczestniczy jako koenzym:
R CH C
O
OH
NH
2
+ ATP
R CH C
O
AMP
NH
2
AMP
P P
+
syntetaza
aminoacylo-tRNA
aminokwas
aminoacylo-AMP
+
- chroni nienasycone tłuszcze w błonach przed
utlenieniem
- odpowiedzialna za prawidłowy rozwój narządów
- rozrodczych u zwierząt.
Wit. E
(- tokoferol)
- pochodna witaminy D reguluje metabolizm Ca
2+
i fosforu
- brak witaminy D osłabia kości rozwijających się zwierząt
Wit. D
- jest potrzebna do prawidłowego krzepnięcia krwi
Wit. K
- prekursor retinalu, biorącego udział w procesie
widzenia
- brak jej prowadzi do kurzej ślepoty
- młode zwierzęta potrzebują jej do wzrostu
Wit. A
(retinol)
funkcja
witamina
Witaminy rozpuszczalne w tłuszczach
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Koenzymy, Kosmetologia, Notatki i wyłady, Biochemia
KOENZYMY, Zootechnika, Biochemia
Koenzymy oksydoreduktazy
Koenzymy flawinowe
Koenzym Q10 - substancja życia, Koenzym Q10-substancja życia
Koenzym Q10, Studium kosmetyczne, Chemia kosmetyczna
etanol - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
etanol - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
koenzymy 1
pros 6 Proenzymy Koenzymy
Witaminy jako koenzymy Kopia
koenzymy
koenzymy2010
Farmakologia kliniczna koenzymu Q10 J Drzewoski
KOENZYMY zagadnienia na kolokwium, Ogrodnictwo UP Lbn, Biochemia
regulacje - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
enzymy koenzymy 2
Koenzym Vita Care Q10 Dental w tabletkach do ssania, Koenzym Q10-substancja życia
więcej podobnych podstron