
Enzymy
BUDOWA ENZYMU
Miejsce aktywne (katalityczne) enzymu, centrum aktywne
(obszar enzymu przyłączający substrat)
Miejsce wiązania substratu
Miejsce allosteryczne

Enzymy
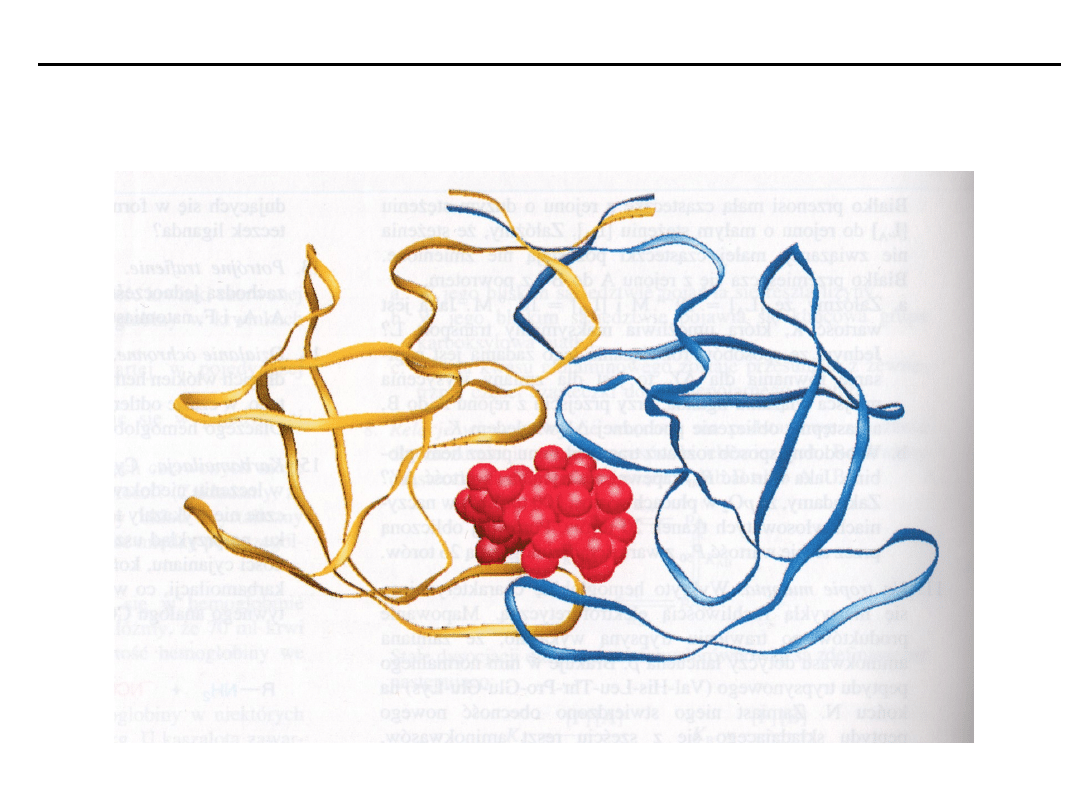
Charakterystyka centrum aktywnego enzymów oraz modele
miejsc katalitycznych
• Centra aktywne enzymu są to miejsca, w których następuje przyłączenie
substratów

Enzymy
Charakterystyka centrum aktywnego enzymów oraz modele
miejsc katalitycznych
• Centra aktywne charakteryzują się:
• małymi rozmiarami w stosunku do całkowitej objętości cząsteczki,
• trójwymiarowa budową,
• specyficznością wiązania substratu uzależnioną od przestrzennego
ułożenia atomów tworzących centrum aktywne,
• w większości enzymów wiązaniem substratu za pomocą słabych
oddziaływań,
• umiejscowieniem w szczelinach i zagłębieniach na powierzchni białka
enzymatycznego.
Enzymy

Enzymy
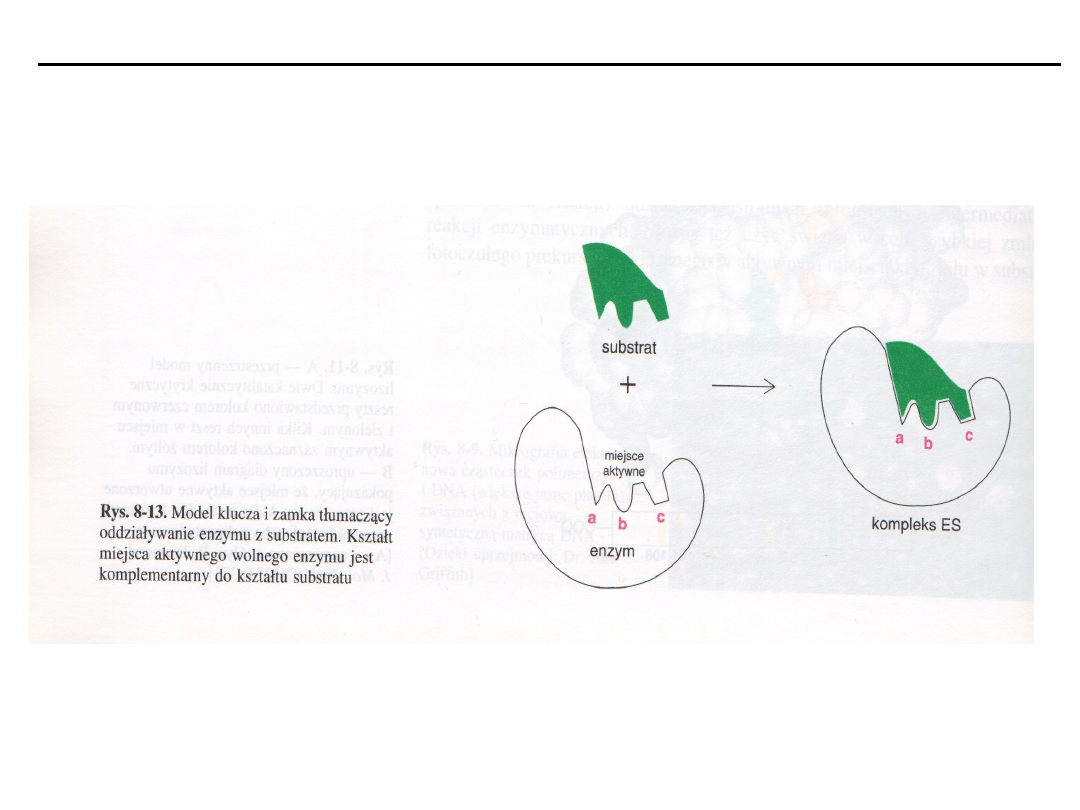
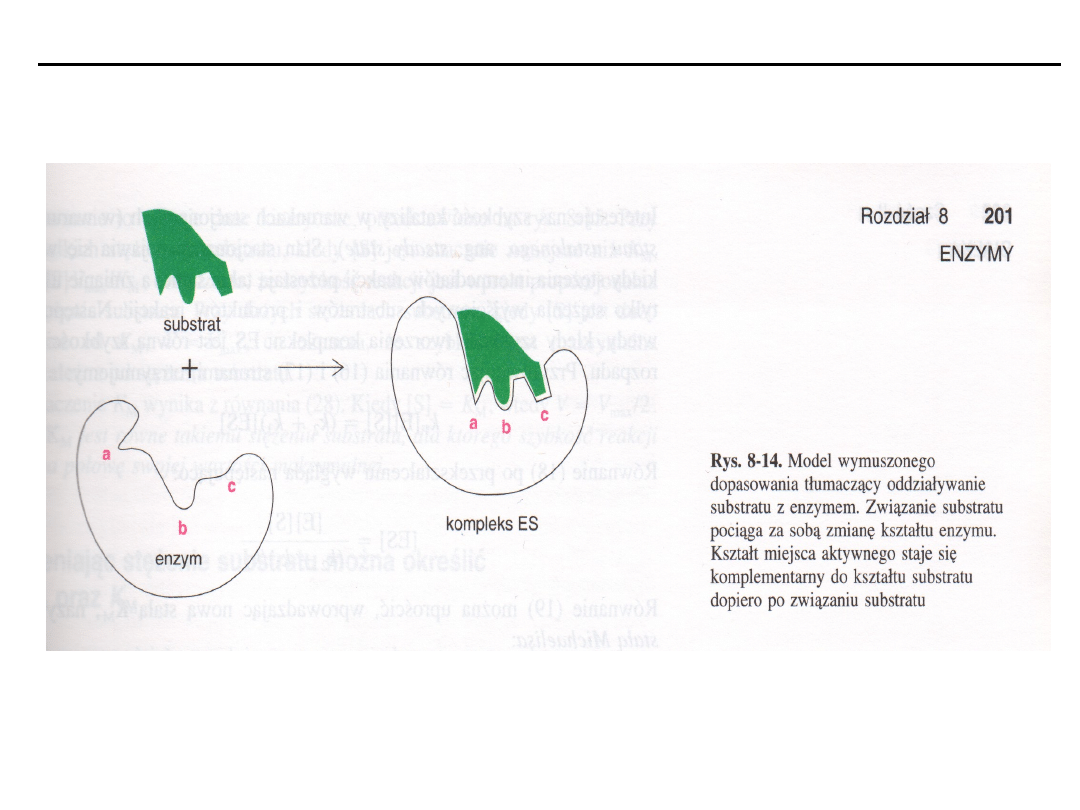
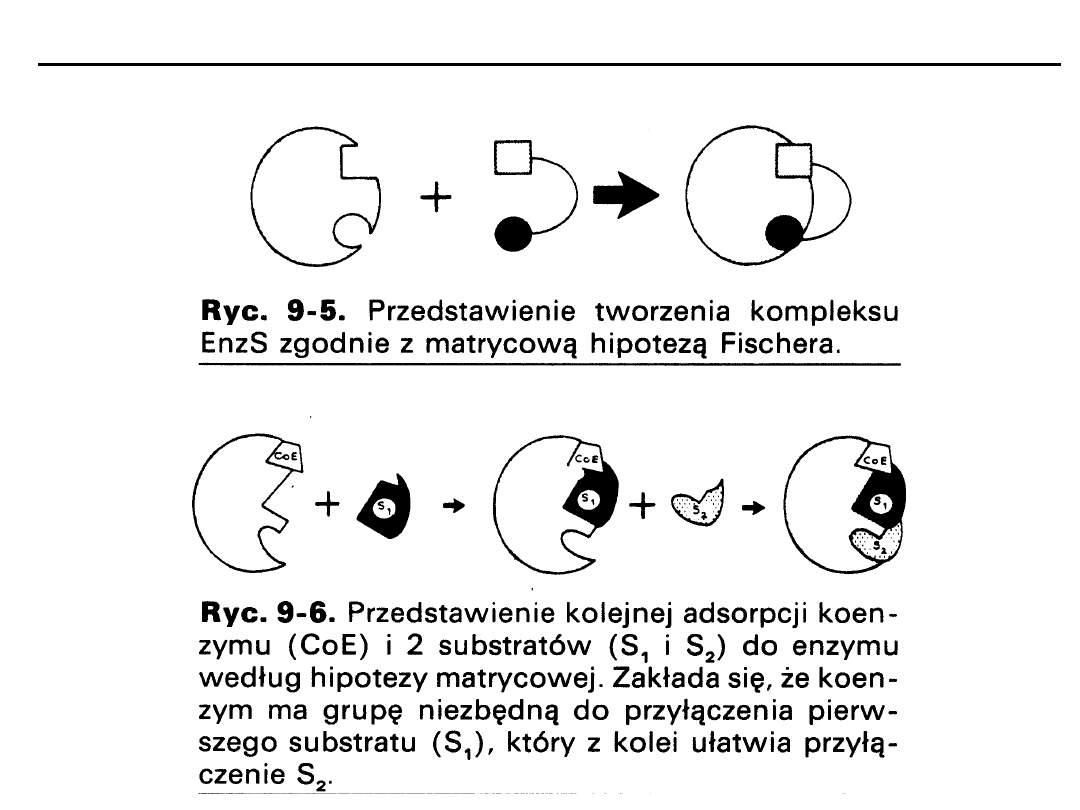
Model miejsca katalitycznego
(centrum aktywnego)
Zamek i klucz - sztywny model matrycowy - E. Fisher
Indukowane dopasowanie się - Koshland
Enzymy
Enzymy
Enzymy

Enzymy

Enzymy
Enzymy allosteryczne
-
wiążą aktywatory (A) i inhibitory (I) w miejscach innych niż aktywne
(miejsca allosteryczne),
- zawierają wiele podjednostek współdziałających ze sobą podczas
wiązania substratu,
- zmiany konformacyjne podczas wiązania allosterycznego efektora
(A lub I) wpływają na wiązanie substratu i (lub nie) na V
max

Enzymy
KINETYKA REAKCJI ENZYMATYCZNYCH
Teoria zderzeń (kinetyczna)
Aby cząsteczki mogły reagować muszą zbliżyć się do siebie na
odległość tworzonego wiązania z energią wystarczającą do
przekroczenia progu energetycznego reakcji (energia
aktywacji, stan przejściowy).
Czynniki zwiększające częstość zderzeń i energię kinetyczną
zwiększają szybkość reakcji.
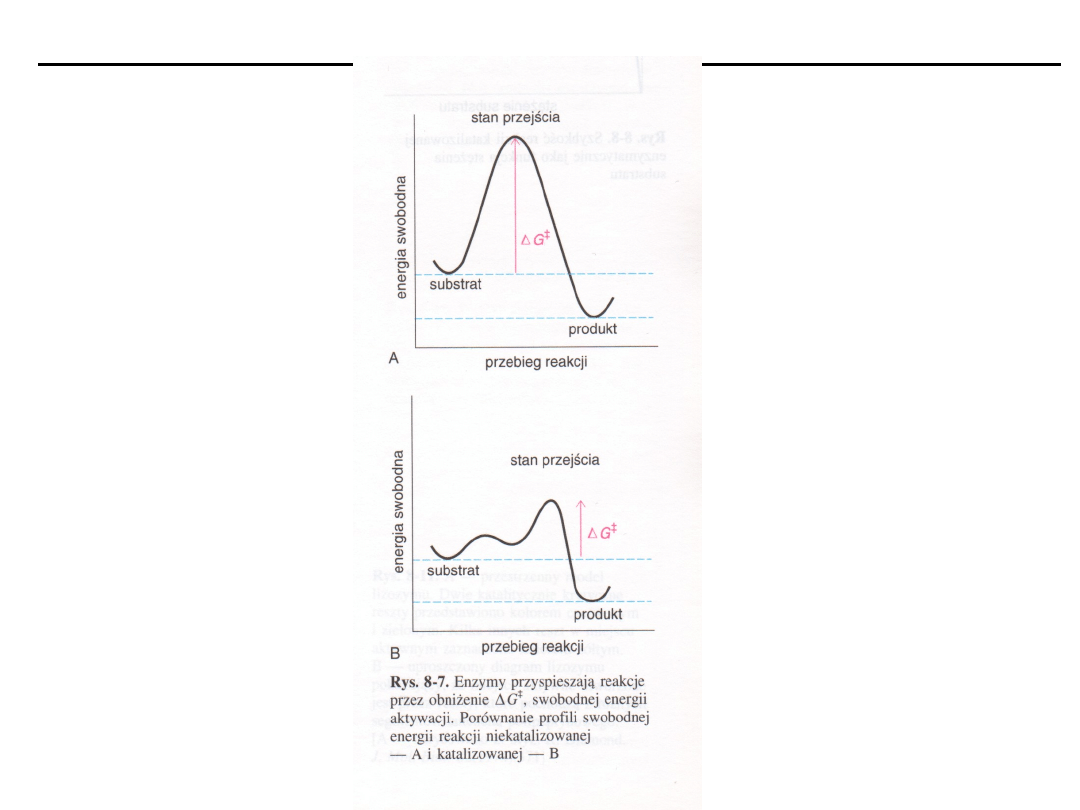
Enzymy

Enzymy
Czynniki wpływające na szybkość reakcji
Temperatura
pH
Stężenie substratu
Stężenie enzymu
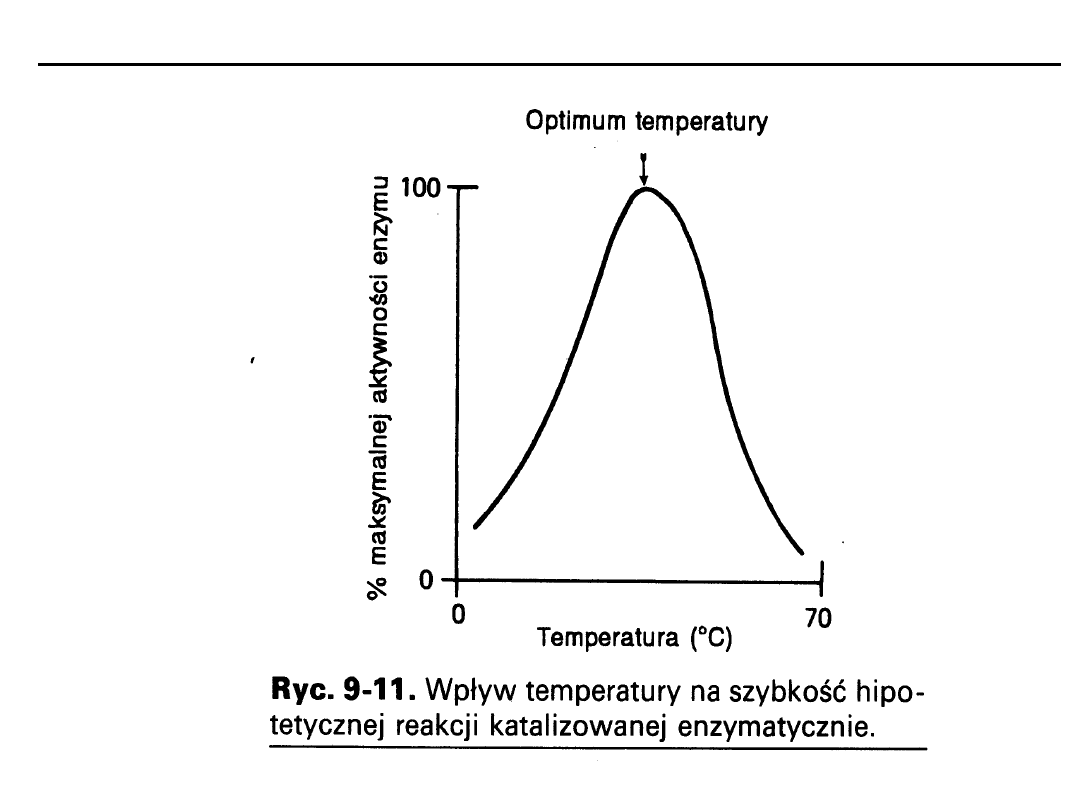
Enzymy
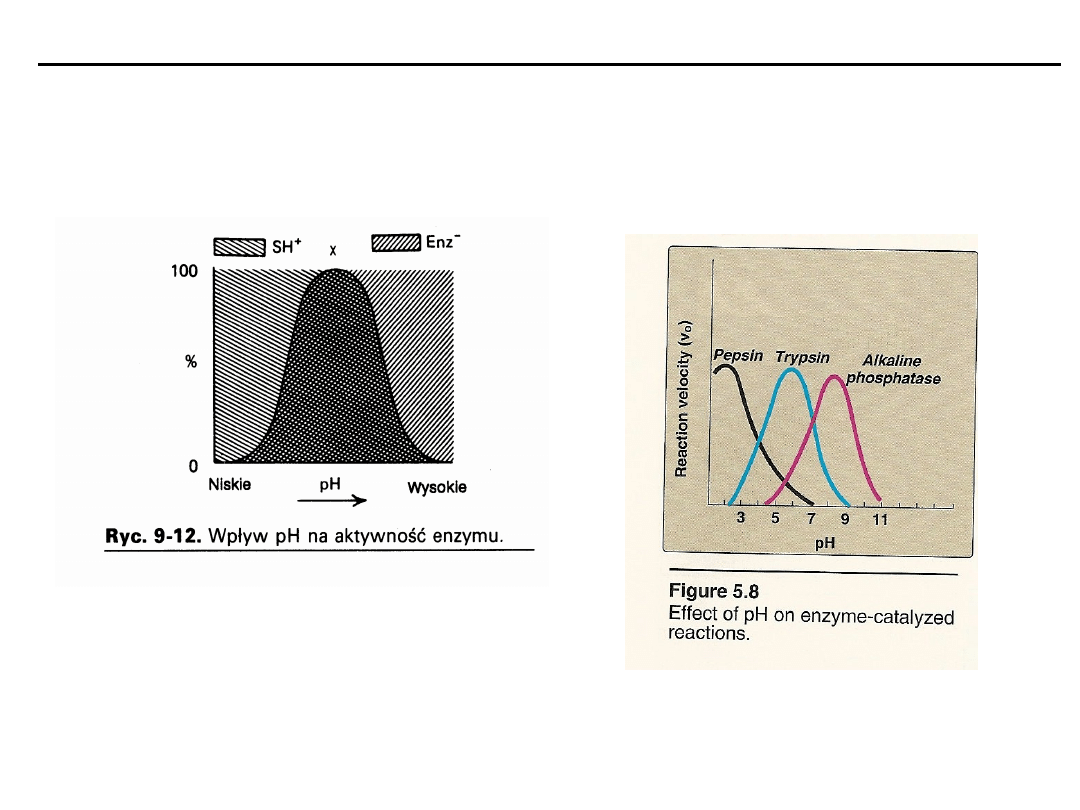
Enzymy
Enzymy
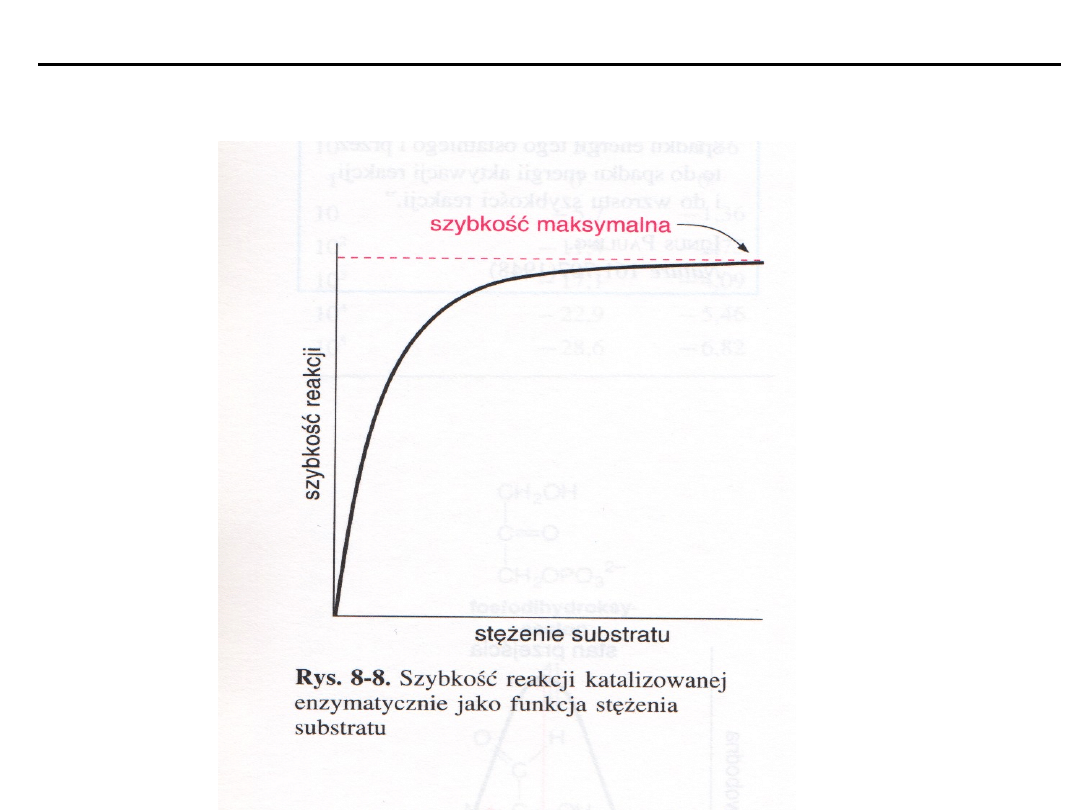
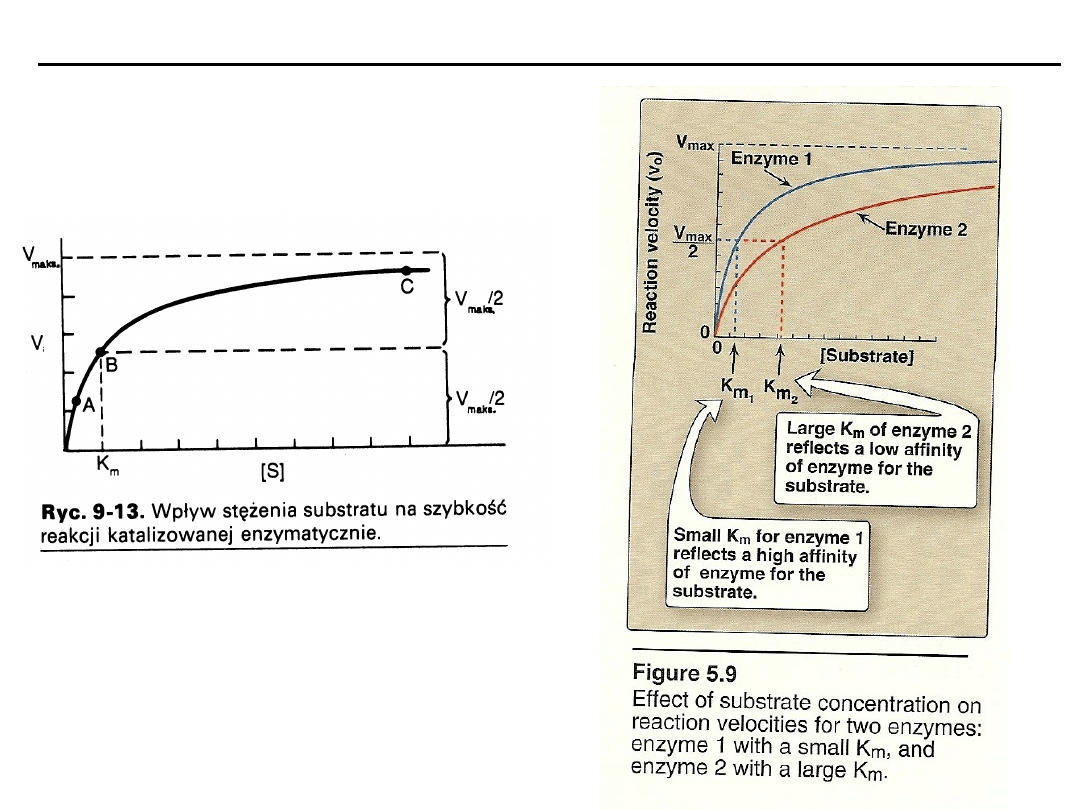
Wpływ stężenia substratu na szybkość reakcji katalizowanej
enzymatycznie
Enzymy
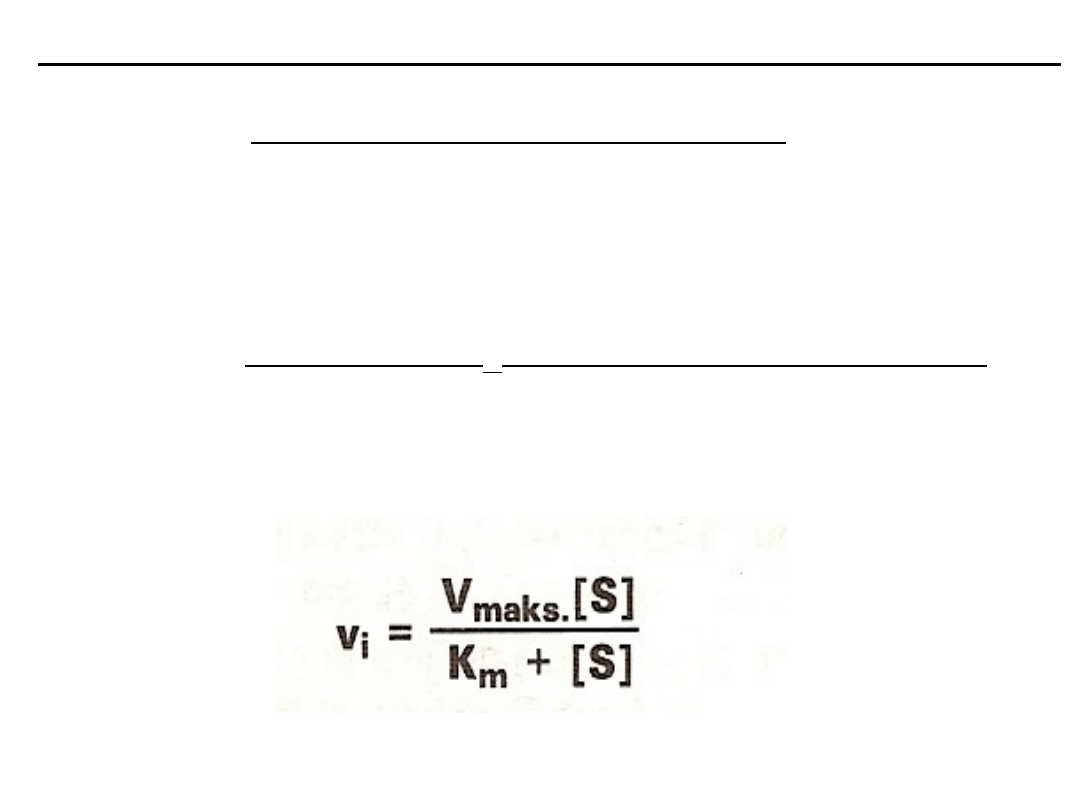
Równanie Michaelisa-Menten
Obrazuje wpływ stężenia substratu na szybkość reakcji katalizowanych
enzymatycznie.
Stężenie substratu, które powoduje osiągnięcie połowy szybkości maksymalnej
określane jest stałą Michaelisa K
m
, która ma wymiar stężenia molowego.
Wiele enzymów ma wartości K
m
zbliżone do fizjologicznego stężenia ich
substratów.
Enzymy

Enzymy

Enzymy
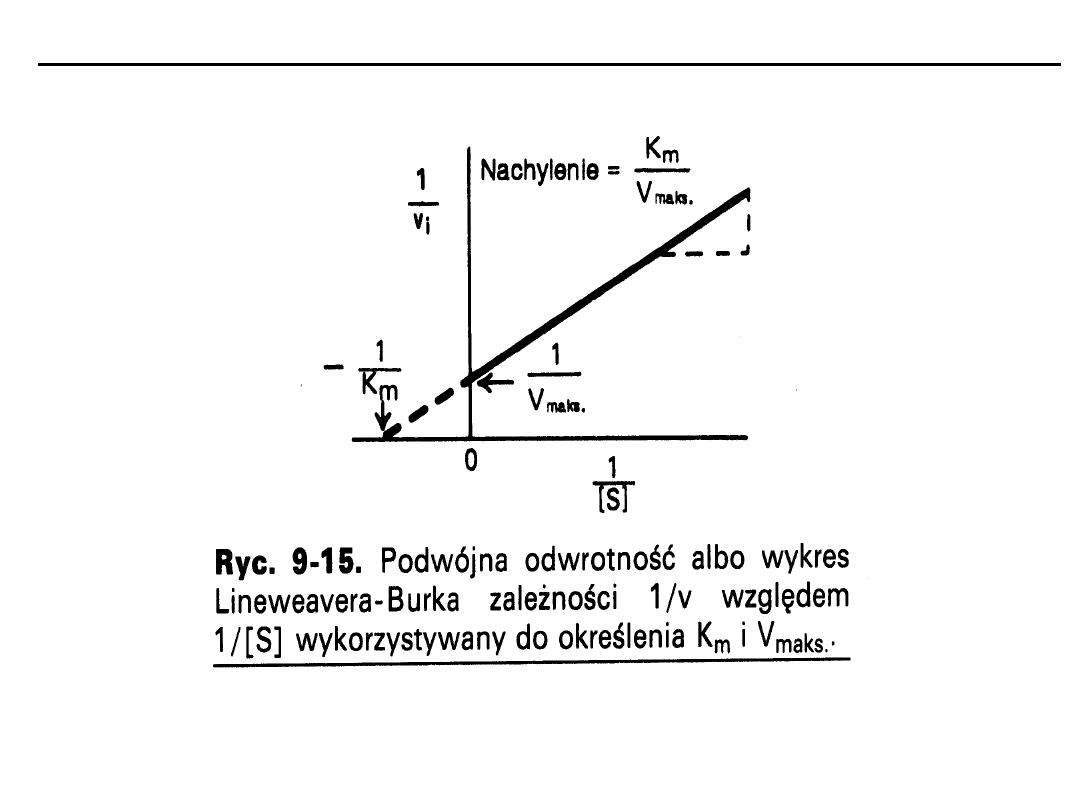
Aby określić wartość K
m
i V
max
równanie M-M
jest przekształcane tak, by otrzymać linie prostą

Enzymy
Równanie Michaelisa-Menten
Enzymy
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
- Slajd 22
Wyszukiwarka
Podobne podstrony:
enzymy koenzymy 3
Enzymy i koenzymy, olimp biologia
enzymy
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
enzymy
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
Koenzymy, Kosmetologia, Notatki i wyłady, Biochemia
enzymy
Enzymy
biochemia enzymy2
Enzymy podział na klasy
więcej podobnych podstron