
Enzymy
Funkcja enzymu wyraża się przebiegiem katalizowanej reakcji,
więc ilość enzymu oznacza się na podstawie pomiaru szybkości reakcji
w określonych warunkach.
Jednostki aktywności enzymatycznej
Komisja Enzymatyczna Międzynarodowej Unii Biochemicznej
wprowadziła pojęcie bezwzględnej międzynarodowej jednostki
standardowej (U) enzymów i określiła warunki jej oznaczania.

Enzymy
Jednostką (U) każdego enzymu jest ta jego ilość, która
katalizuje przemianę 1 μmola substratu w ciągu 1 minuty,
w temp. 30
C i w optymalnych warunkach (pH i stężenie
substratu).
U, mU, kU
Aktywność właściwa to liczba jednostek aktywności
na 1 mg białka.
Enzymy
Enzymy

Enzymy
Wpływ inhibitorów na aktywność enzymatyczną
Inhibitory
są substancjami zmniejszającymi szybkość reakcji enzyma-
tycznej. Zahamowanie aktywności jest jednym ze sposobów regulacji
procesów życiowych w komórce.
Inhibicja odwracalna
charakteryzuje się zdolnością do dysocjacji
kompleksu enzym-inhibitor.
Inhibicja nieodwracalna
powoduje denaturację enzymu (cząsteczki
białkowej) przez związki chemiczne i czynniki fizyczne, utlenienie grup –SH
lub ich alkilowanie.

Enzymy
Wpływ inhibitorów na aktywność enzymatyczną
Wyróżnia się typy inhibicji odwracalnej:
- kompetycyjna,
- niekompetycyjna,
- akompetycyjna,
- mieszana.

Enzymy
Hamowanie aktywności enzymatycznej
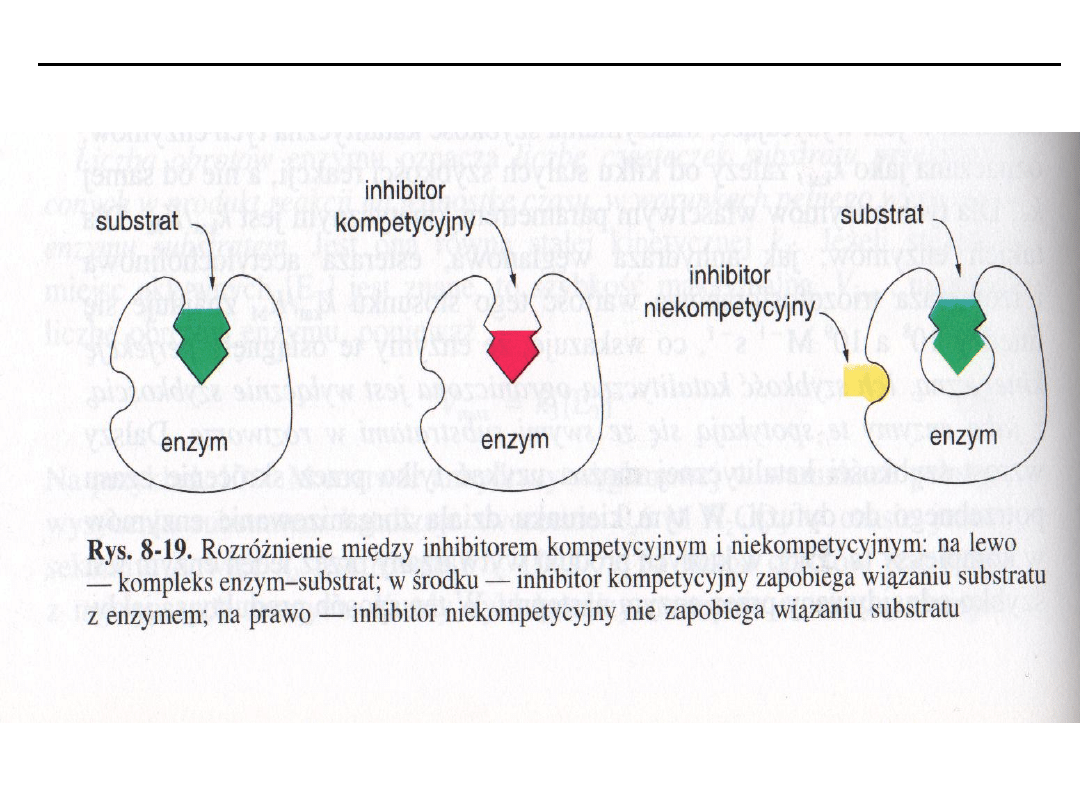
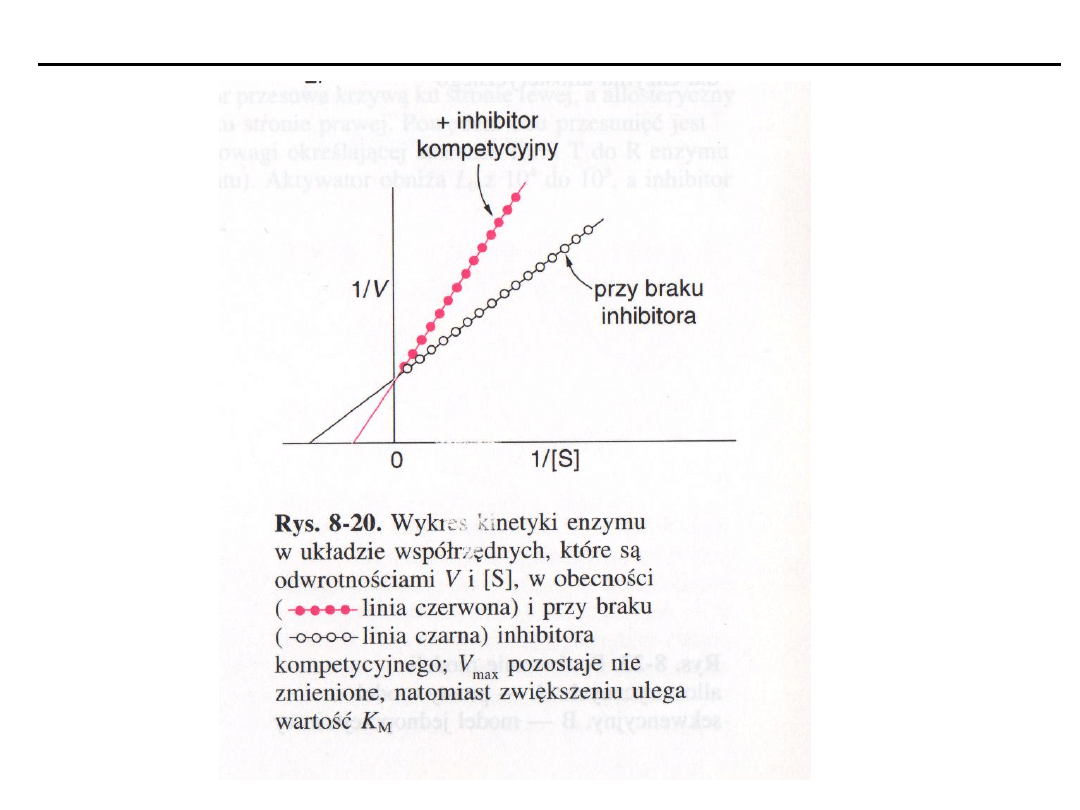
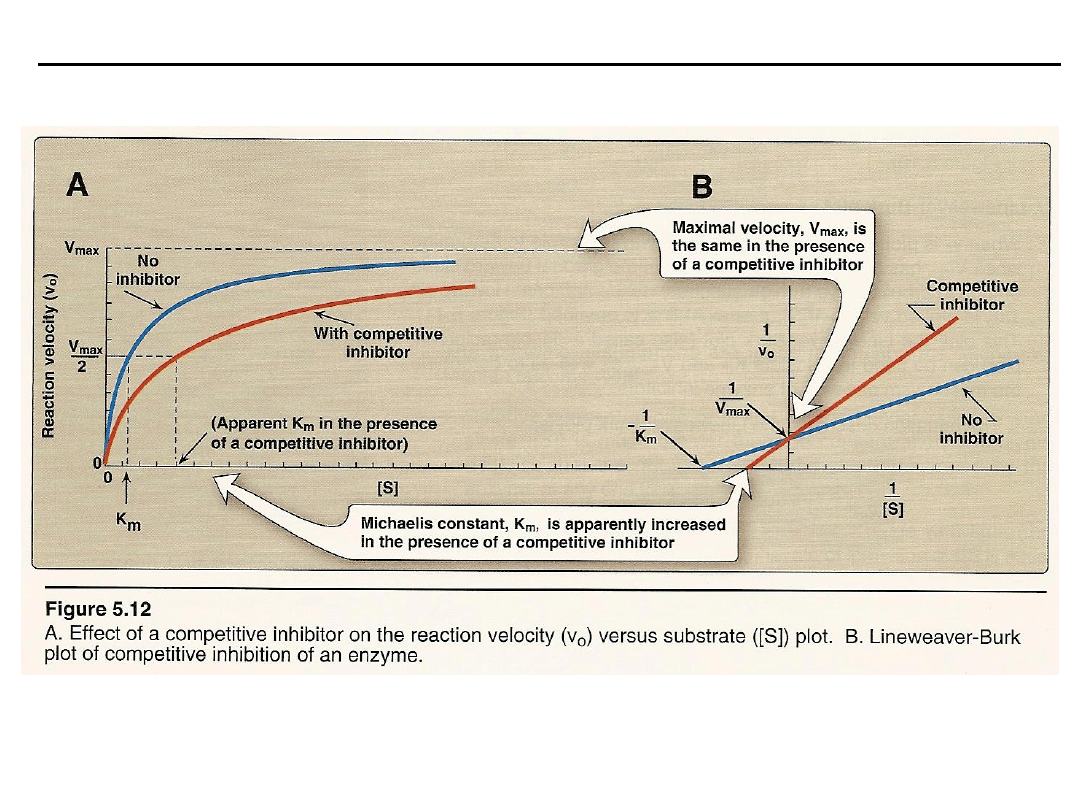
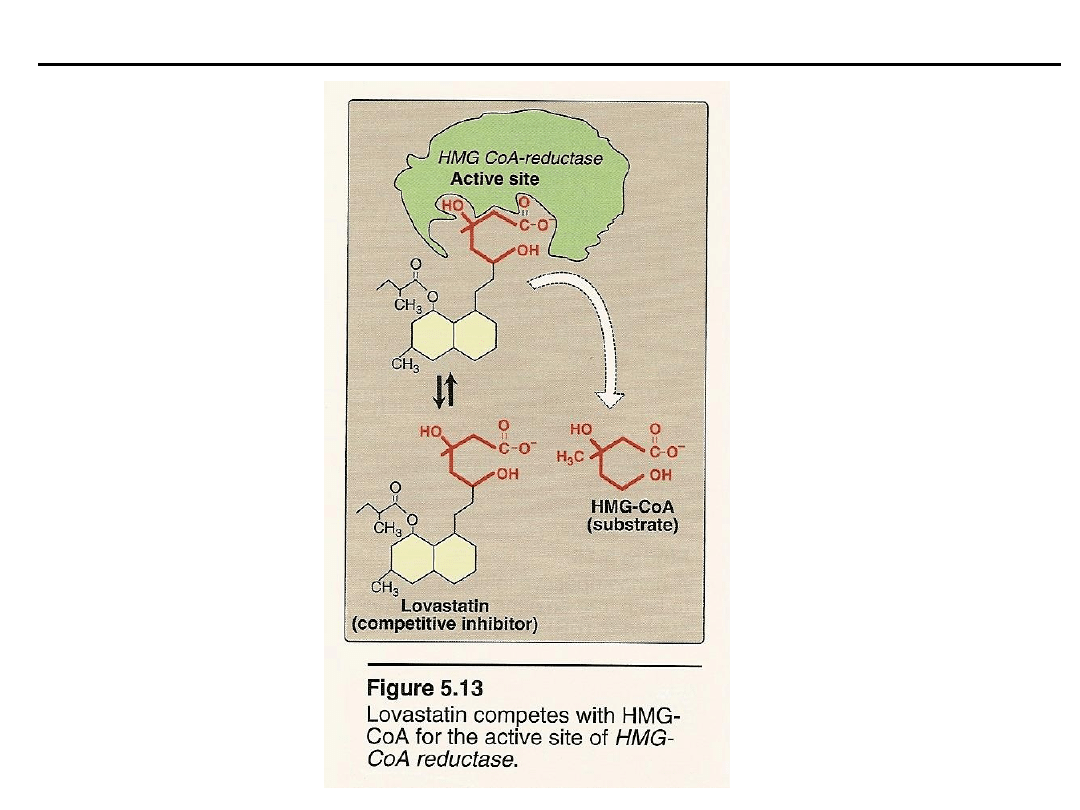
Inhibitory kompetycyjne (współzawodniczące)
– wykazują ścisłe podobień-
stwo strukturalne do substratu, konkurują z nim o centrum katalityczne,
hamowanie zachodzi w miejscu wiązania substratu, zwiększają K
m,
efektywność
tych inhibitorów jest oceniana przez wykres podwójnych odwrotności 1/v
i
względem 1/[S]).
Szybkość reakcji zależy od stężenia substratu, inhibitora oraz względnego
powinowactwa substratu i inhibitora do centrum aktywnego enzymu.

Enzymy
Hamowanie aktywności enzymatycznej
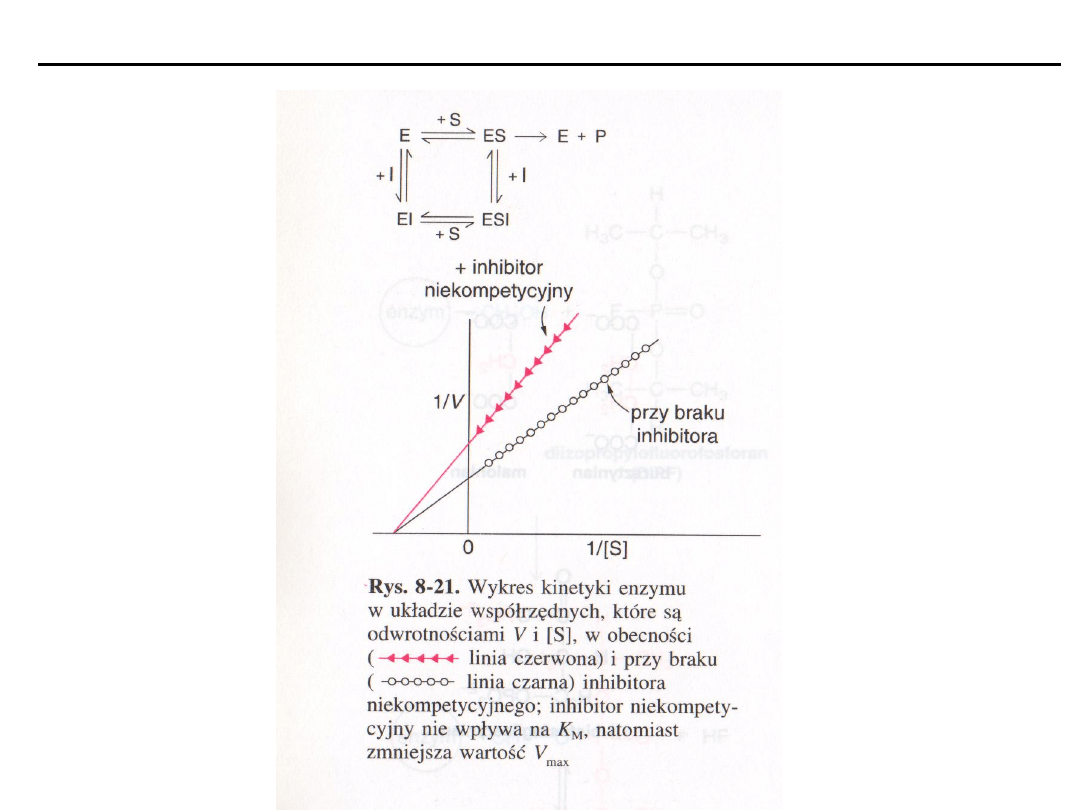
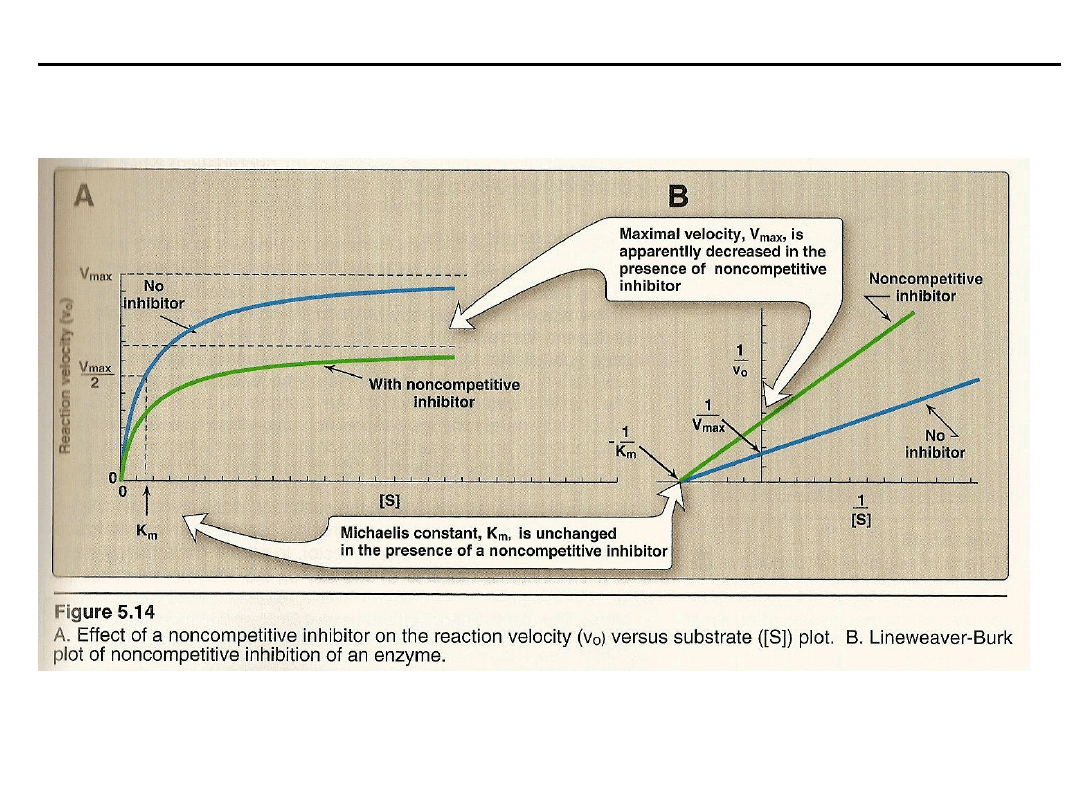
Inhibitory niekompetycyjne
hamują szybkość reakcji enzymatycznej przez
działanie na wolny enzym lub na kompleks ES. Hamowane zależy od stężenia
inhibitora i powinowactwa do enzymu, a nie stężenia substratu. Inhibitor i
substrat wiążą się odwracalnie i niezależnie od siebie w różnych miejscach
enzymu.
Inhibitor niekompetycyjny zmniejsza V
maks
, nie wpływają na K
m
.
Nie ma konkurencji między substratem i inhibitorem, ponadto inhibitor nie
wykazuje podobieństwa do substratu i wiąże się z inną domeną enzymu.

Enzymy
Hamowanie aktywności enzymatycznej
Inhibitor akompetycyjny
wiąże się odwracalnie z kompleksem ES, tworząc
nieaktywny kompleks ESI. Wartość V
max
jest mniejsza w obecności tego
inhibitora niż w jego nieobecności, zmniejsza się również wartość K
m
.
Inhibicja mieszana
jest hamowaniem częściowo kompetycyjnym i niekom-
petycyjnym, inhibitor może wiązać się zarówno z E jak i kompleksem ES.
Zmniejsza się V
max
i wzrasta K
m
.
Enzymy
Enzymy
Enzymy
Enzymy
Enzymy

Enzymy
Enzymy
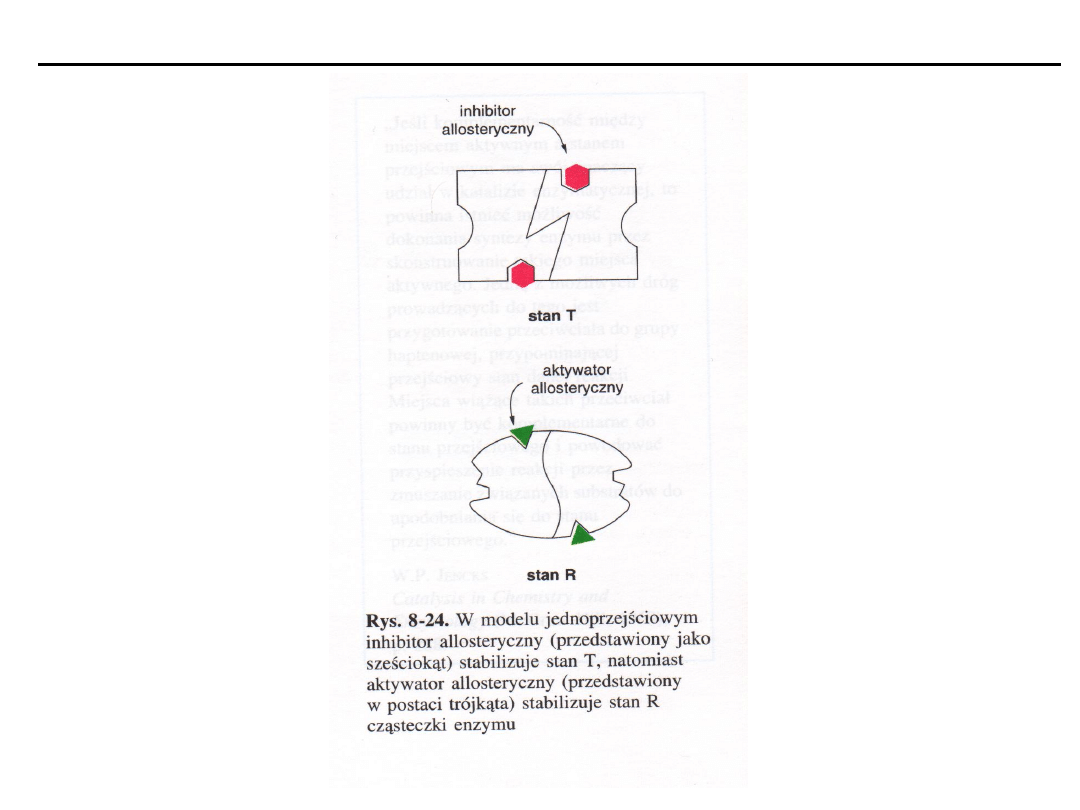
Enzymy
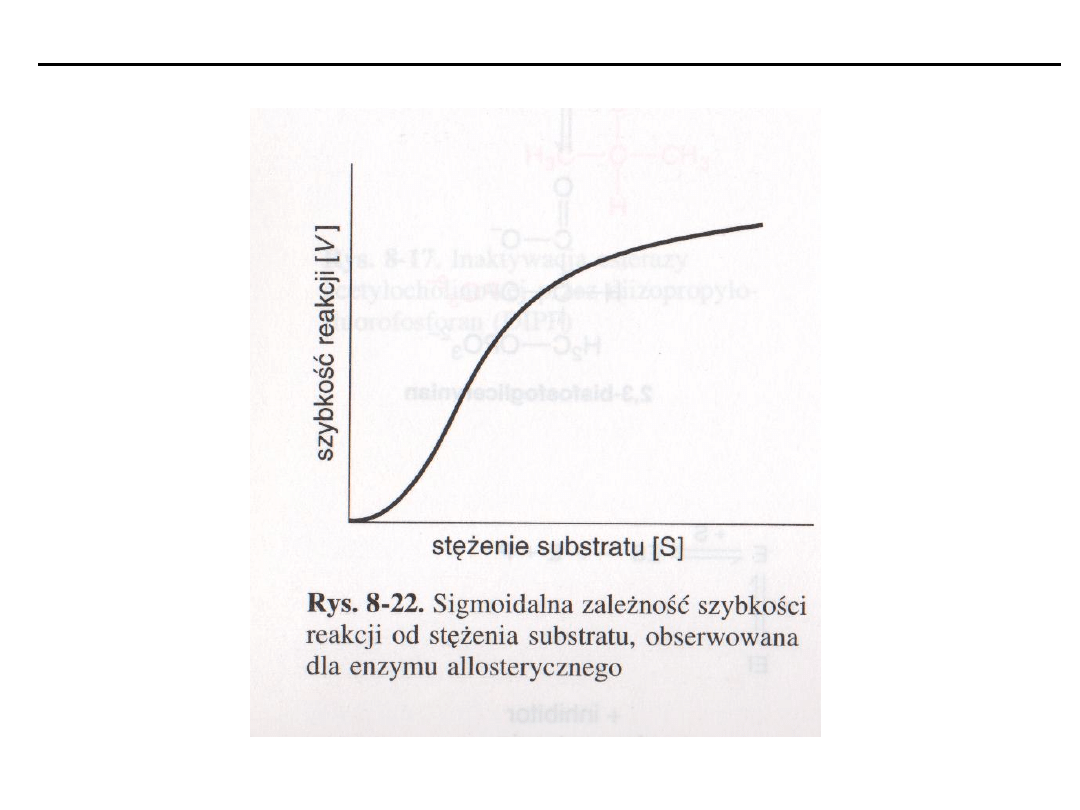
Enzymy
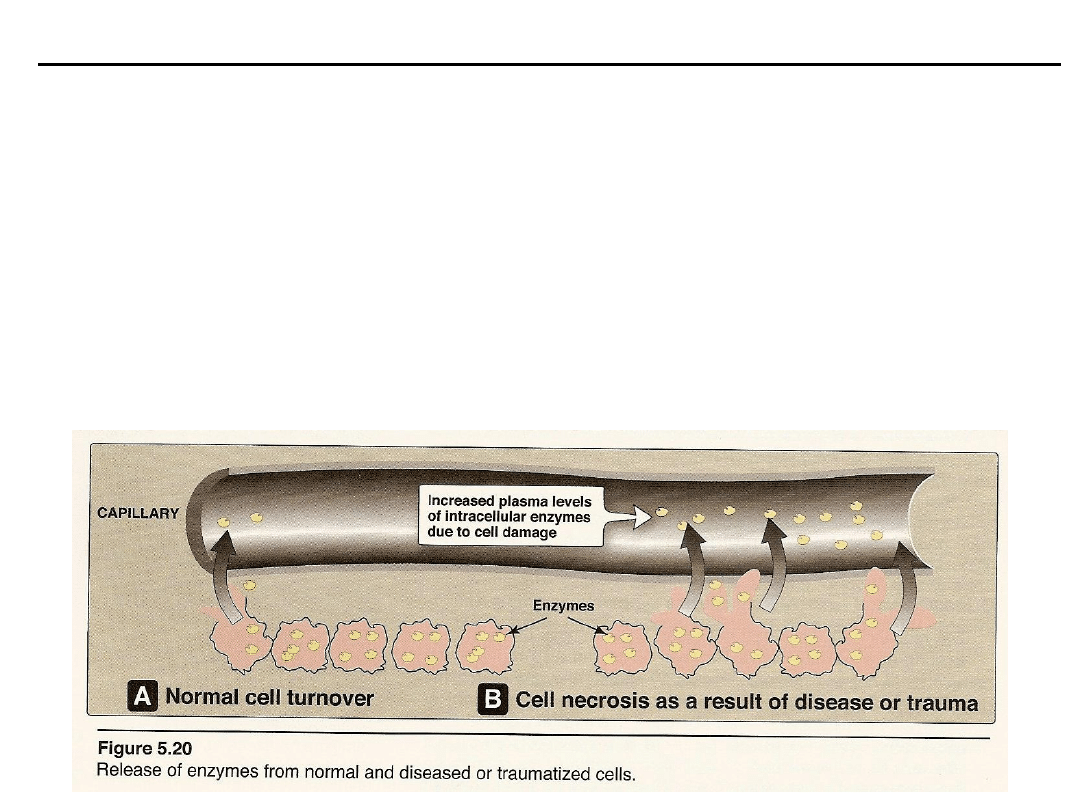
Enzymy
W stanach patologicznych zmiany aktywności enzymów są często odbiciem zmian
w narządach – dostarczają więc informacji ułatwiających rozpoznanie schorzenia i
leczenie.
Grupy enzymów występujące w surowicy krwi:
-
sekrecyjne,
- ekskrecyjne,
- wskaźnikowe (indykatorowe).

Enzymy
Sekrecyjne
– są normalnie wydzielane do krwi, np. czynniki
krzepniecia i fibrynolizy, esteraza cholinowa, ceruloplazmina,
lipaza lipoproteinowa…
Wskaźnikowe
– pojawiają się w dużych ilościach po uszko-
dzeniu różnych narządów, są specyficzne.
Ekskrecyjne
– ich wzrost obserwuje się wskutek przeszkody
w normalnym odpływie różnych wydzielin ustrojowych takich
jak żółć, sok trzustkowy, ciecz sterczowa, ślina (amylaza,
lipaza, fosfataza zasadowa).
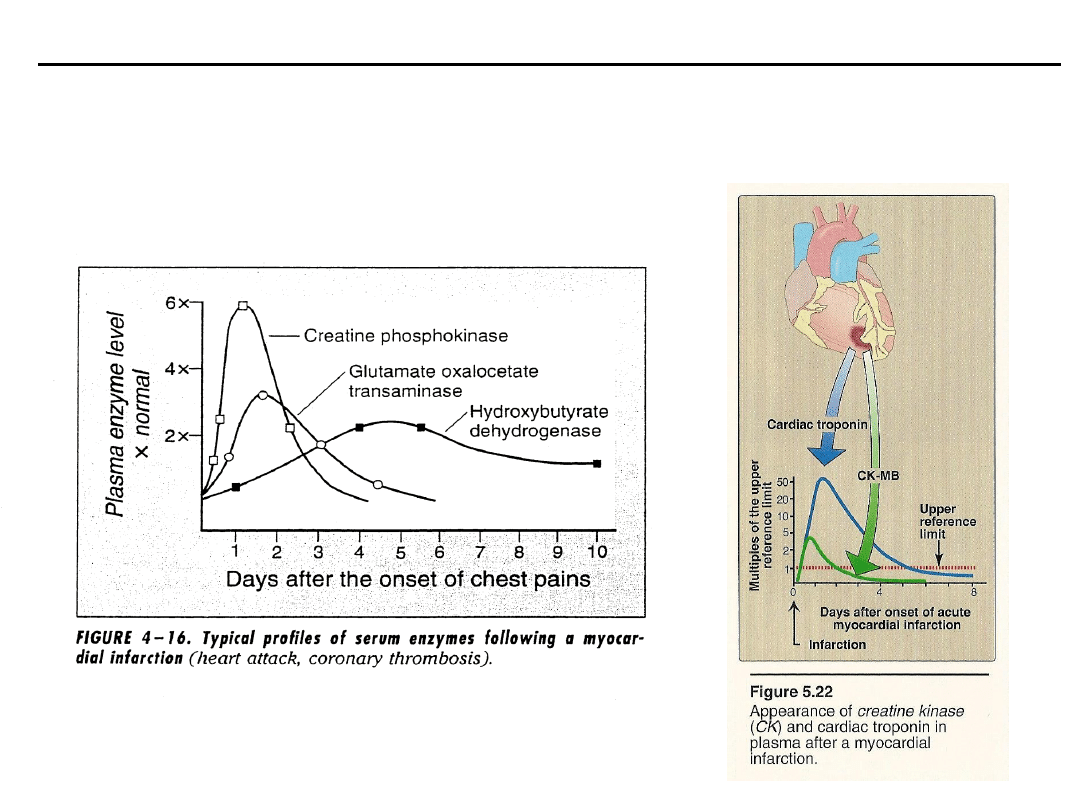
Enzymy
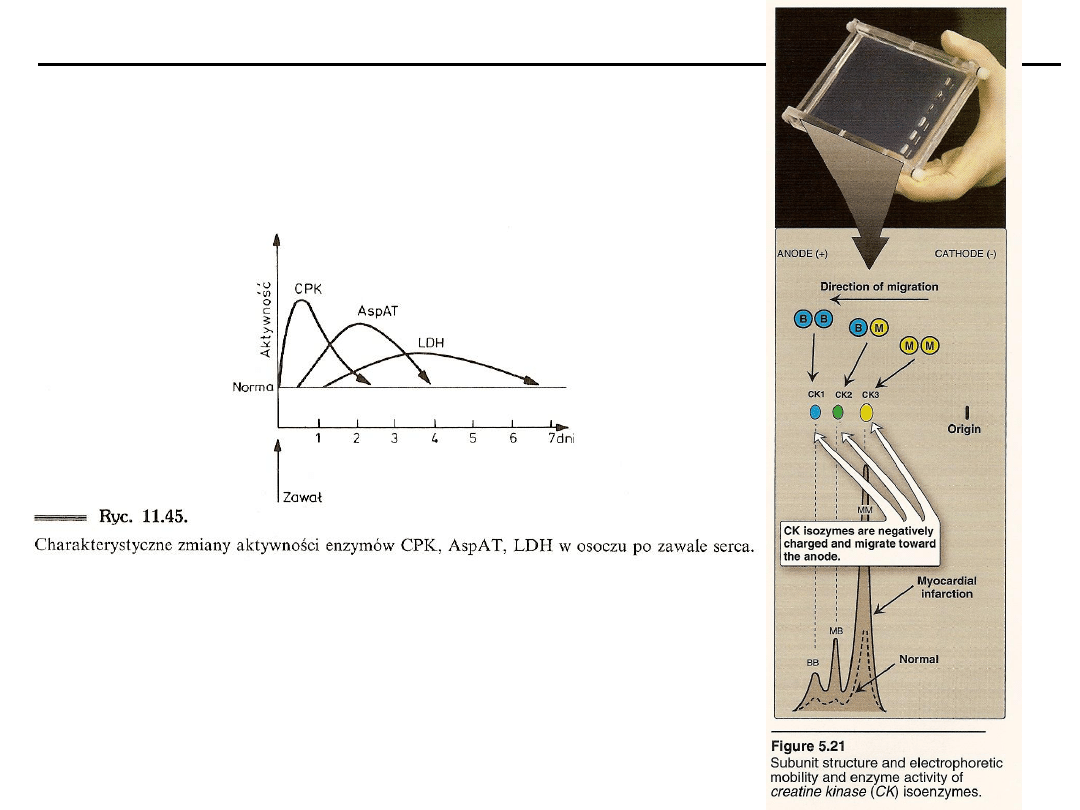
Pomiar aktywności enzymatycznej jako wykładnika stanu fizjologicznego
organizmu (AspAT, AlAT, LDH, fosfatazy).
Enzymy
Wyszukiwarka
Podobne podstrony:
enzymy koenzymy 2
Enzymy i koenzymy, olimp biologia
enzymy
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
enzymy
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
Koenzymy, Kosmetologia, Notatki i wyłady, Biochemia
enzymy
Enzymy
biochemia enzymy2
Enzymy podział na klasy
więcej podobnych podstron