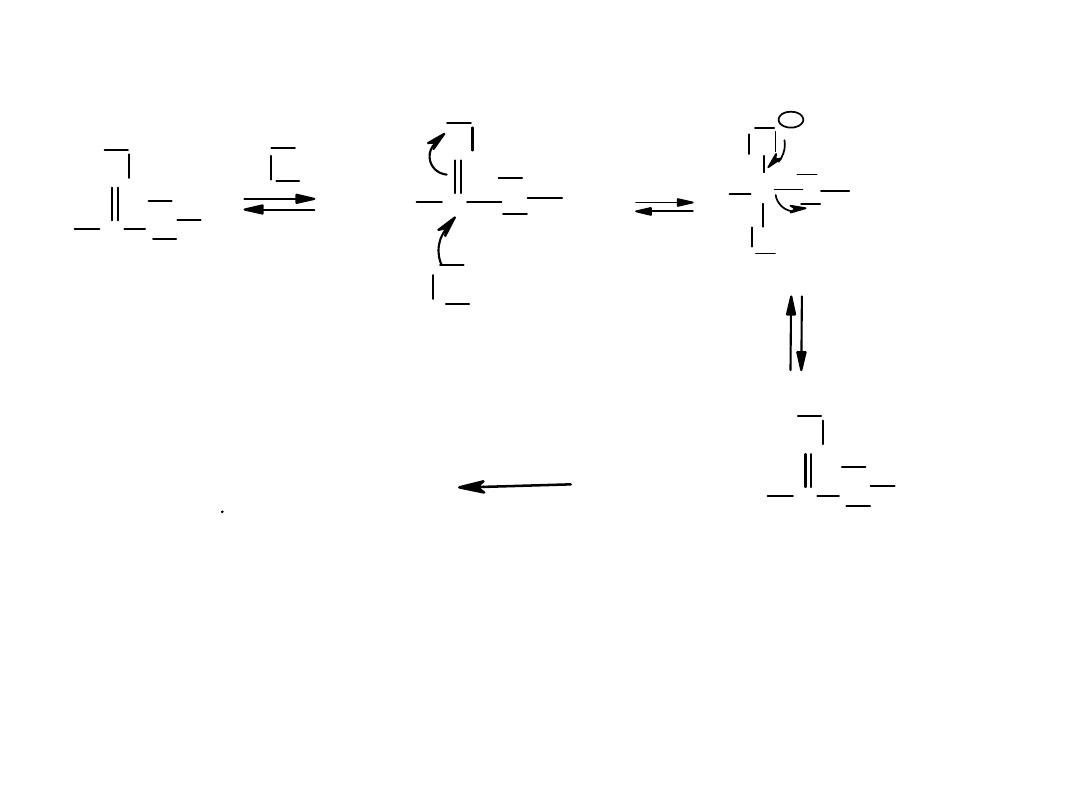
Przedstawić mechanizm hydrolizy estru w środowisku zasadowym
R OH
R COO
2
1
+
-
R
R
O
O
C
OH
-
1
2
OH
R
R
O
O
C
-
1
2
R
R
O
O
OH
C
-
2
1
RO
R
O
O
C
-
+
2
1
H
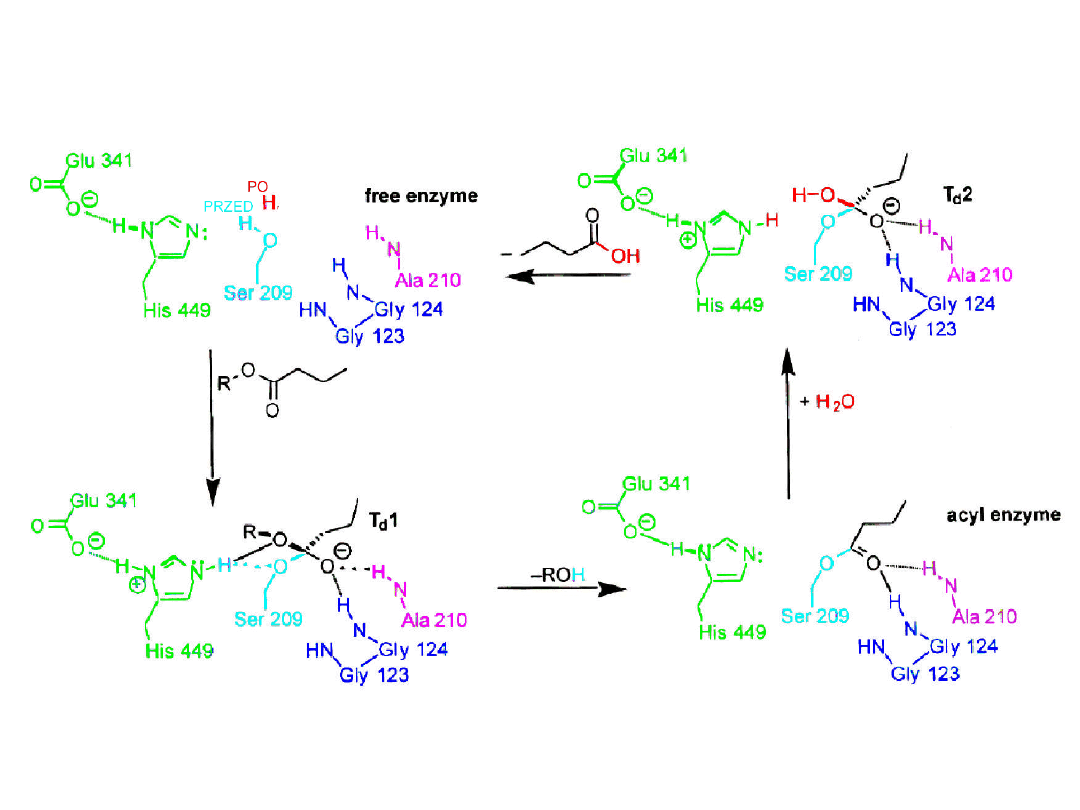
O
O
N
N
H
Asp
O
H
His
Ser
R
2
O
O
R
1
1
O
O
N
N
H
O
O
H
H
Asp
His
Ser
+H
2
O
(Glu)
R
1
O
-
3
O
O
N
N
H
O
O
H
Asp
His
Ser
(Glu)
....
R
1
O
-
R
2
+
O
N
N
H
Asp
His
Ser
O
O
R
1
O
-
+ R
2
OH
2
O
O
N
N
H
Asp
His
Ser
O
H
(Glu)
:
+ R
1
COOH
4
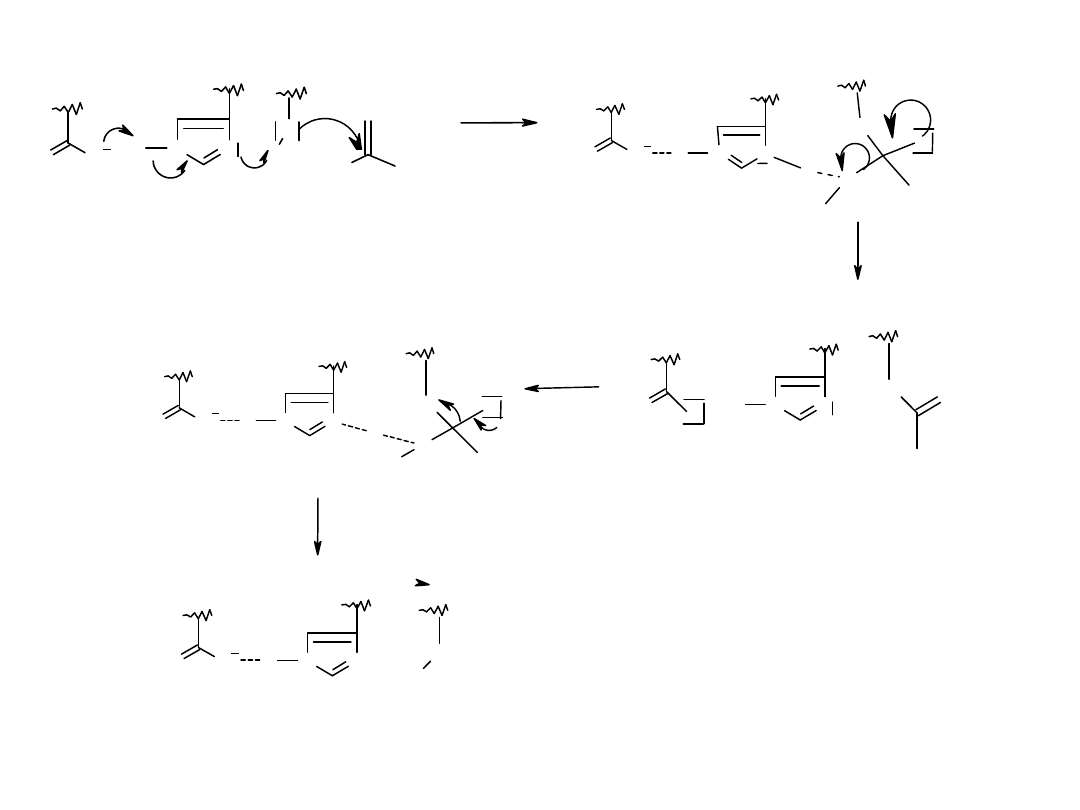
Wymienić numery wzorów, których stabilizacja zależy znacząco od wiązań wodorowych.
3
2
1
4
OAc
H
C
H
3
Ph
+
S
CH
3
Ph
OAc
SAM-2
+
-
( )
OH
H
C
H
3
Ph
R
OH
H
C
H
3
Ph
+
S
CH
3
Ph
OH
+
-
( )
SAM-2
OAc
H
C
H
3
Ph
R
X
Rozszyfrować X
?
O
R
H
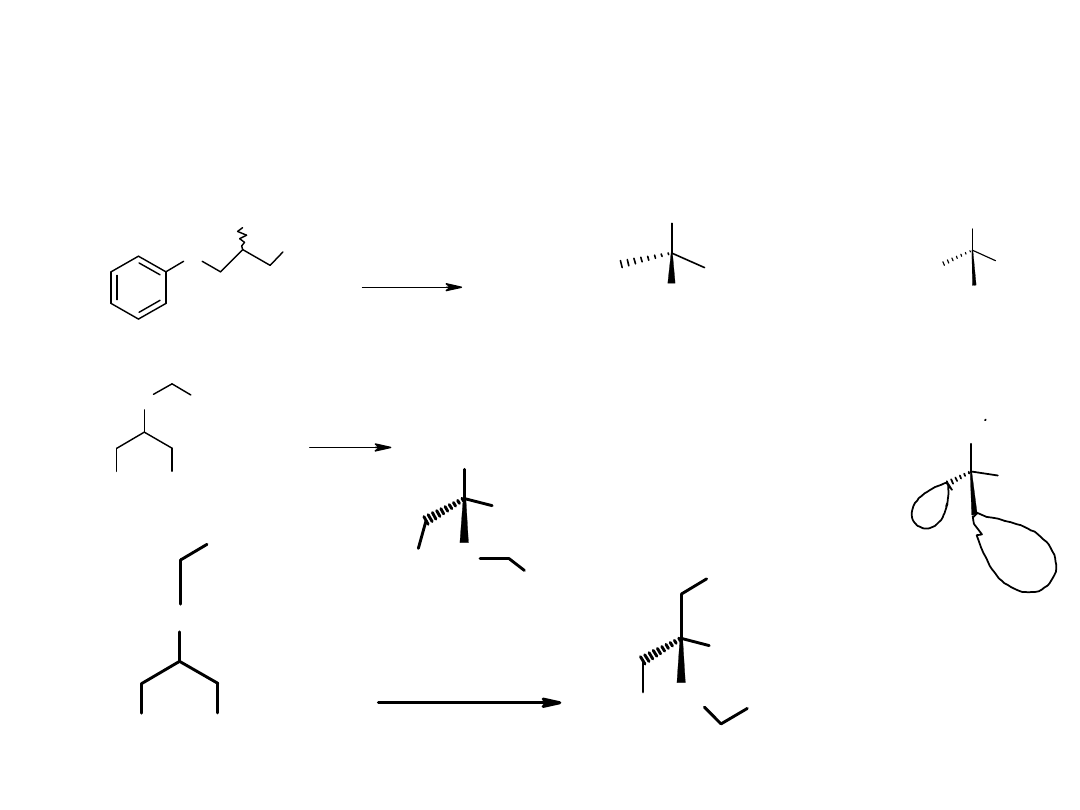
O
OAc
O
C
6
H
5
O
OH
Cl
Ac
a/
b/
SAM-2
(±)
SAM-2
W oparciu c załączony model selektywności substratowej
lipazy SAM-2 przedstawić przebirg reakcji poniższych
substratów.
W jakim środowisku należy prowadzić poszczególne
reakcje?
CH
2
OH
H
O O
Ph
Ac
OH OH
O
Ph
SAM - 2
R
S
H
OH
OAc
O
Ph
OAc
CH
2
OPh
H
CH
2
Cl
O
R
H
OH
CH
2
OPh
H
CH
2
Cl
+
1.
O
O
O
H
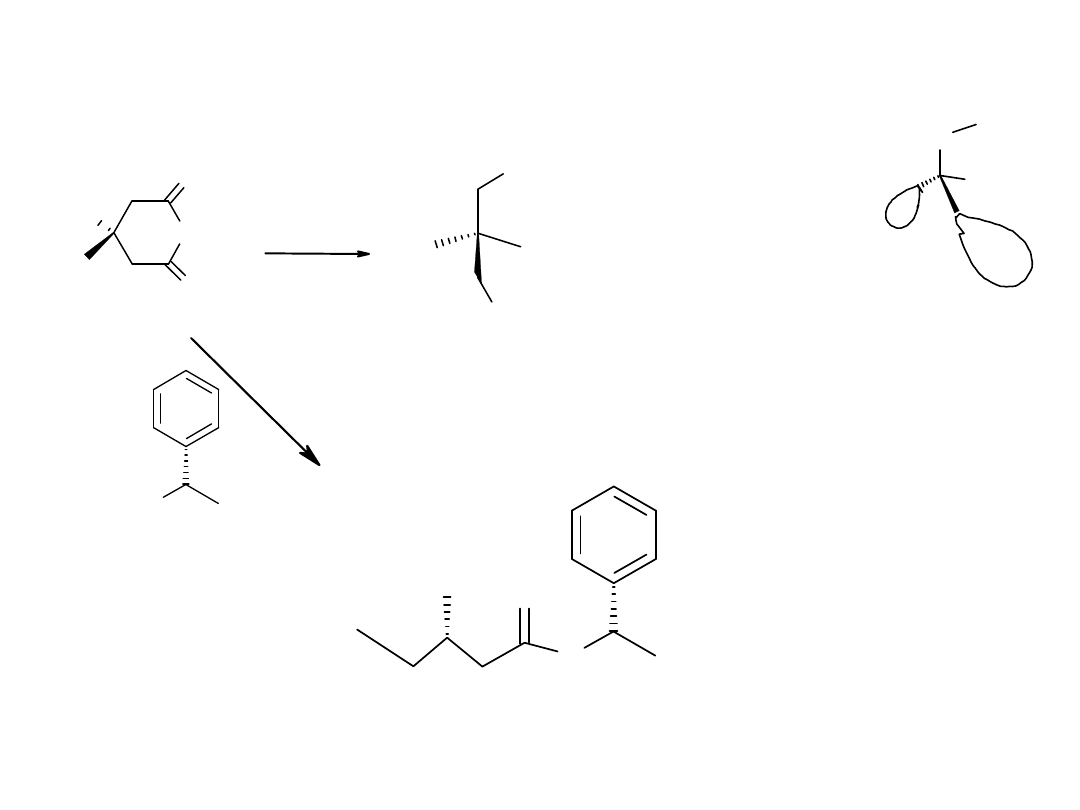
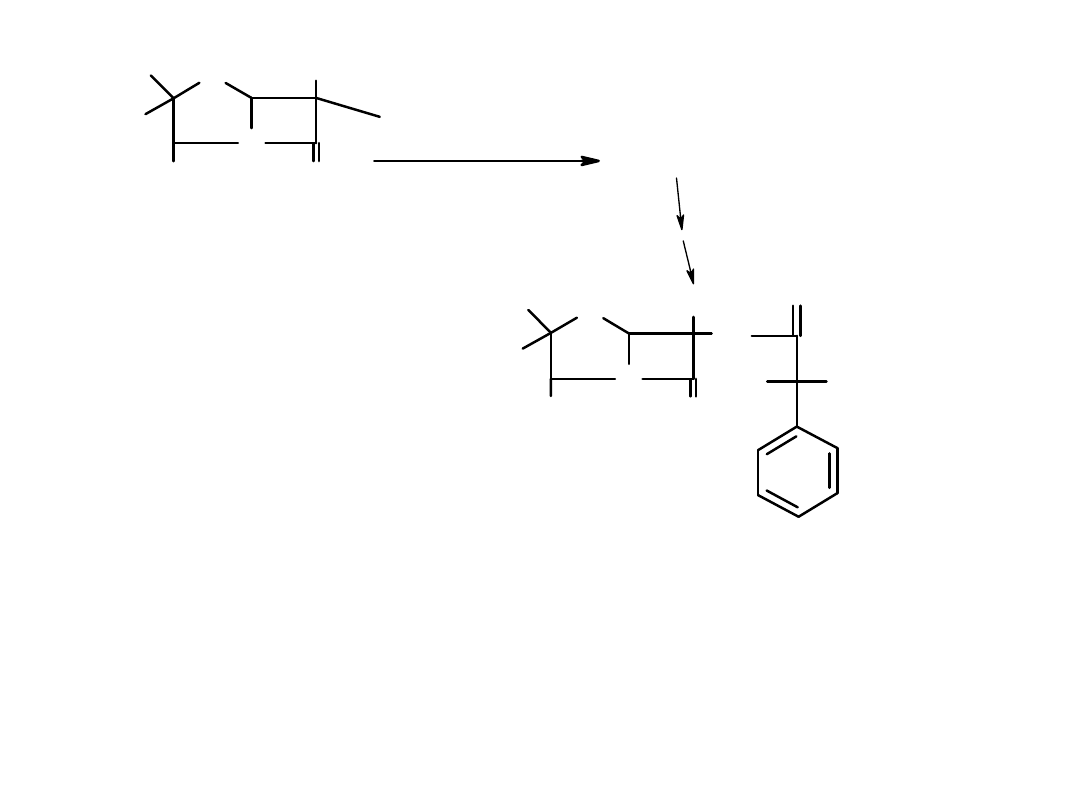
Zaproponować przekształcenie prochiralnego bezwodnika w optycznie czynny monoester w wyniku
reakcji
a/enzymatycznej,
b/ chemicznej.
H
COOC
4
H
7
COOH
R
SAM-2
O
O
HOOC
O
H
SS
O
R
H
Przedstawić schemat reakcji rozdzielenia mieszaniny racemicznej pochdnych L-alaniny – 3
rodzaje pochodnych.
CHNH
CH
3
COOH O
CH
3
N
H
2
R
H
COOH
R
COOH
NH
O
CH
3
H
+
L
acylaza
CHNH
2
CH
3
COOC
2
H
5
(±)
(±)
R
H
N
H
2
C=O
OH
R
H
NH
2
C=O
NH
2
amidaza
L
D
+
R
H
N
H
2
C=O
NH
2
D,L
N
H
2
CH
3
H
COOH
CH
3
NH
2
COOCH
3
H
+
L
R
H
O
+ HCN + NH
3
synteza
Streckera
R
CN
H
N
H
2
R
H
N
H
2
CONH
2
H
2
O
-
D,L
OH
R
H
N
H
2
C=O
NH
2
R
H
N
H
2
C=O
OH
R
H
NH
2
C=O
NH
2
amidaza
D,L
L
D
+
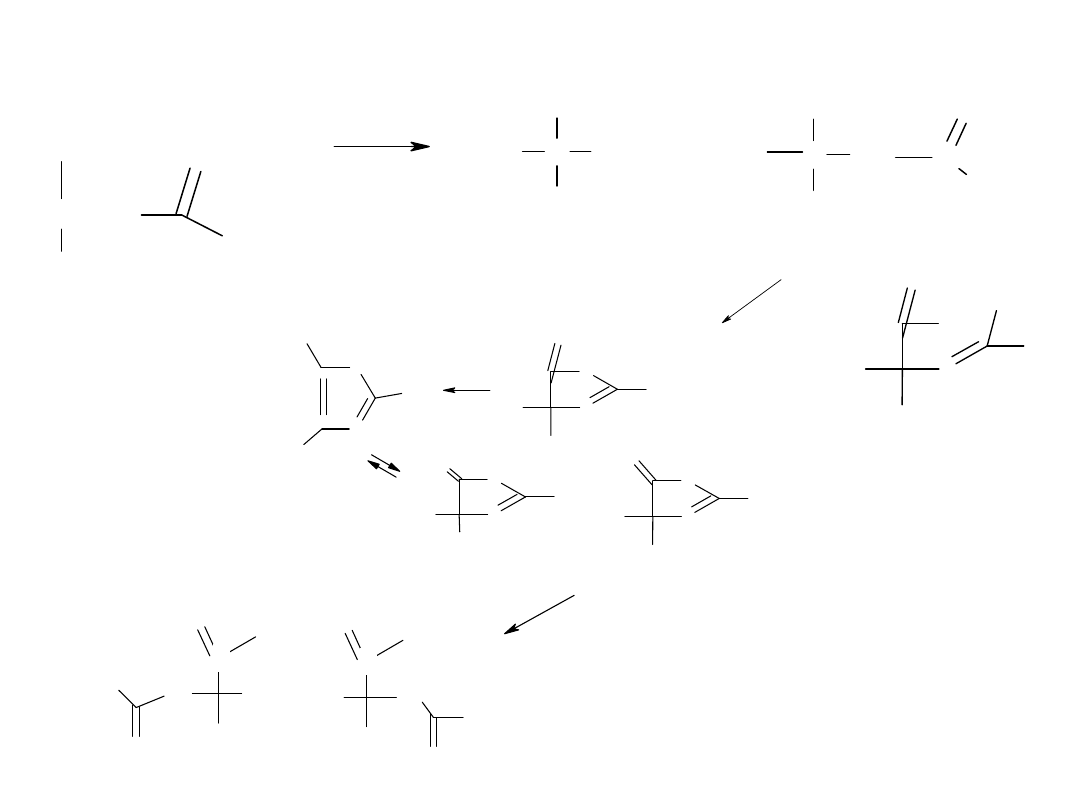
C
CH
3
COOH
NH C
O
CH
3
H
+
CHNH
CH
3
COOH
O
CH
3
±
( )
N
H
2
C
11
CH
3
H
COOH
L
H
2
O
Ac
2
O
O
OH
CH
3
N
R
H
OH
O
R
NH
H
OH
C
H
3
O
CH
3
O
O
R
NH
H
OH
C
C
+
O
O
CH
3
N
R
H
2
+ H O
N
R
O
CH
3
O
H
O
O
CH
3
N
R
H
O
O
CH
3
N
R
H
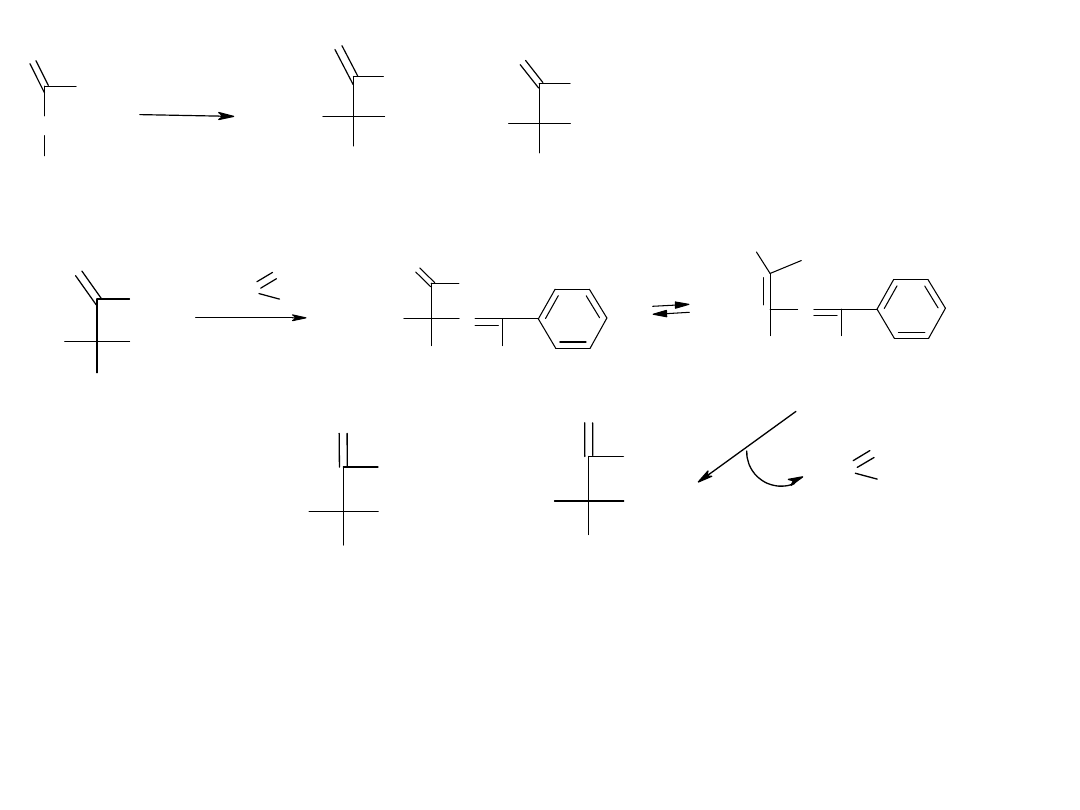
H
R
NH
2
O
NH
2
PhC
O
H
N
H
2
R
H
O
NH
2
L
+
D
H
2
O
+
-
1
CHNH
2
R
O
NH
2
N
H
2
R
H
O
OH
H
R
NH
2
O
NH
2
amidaza
+
D
H
R
NH
2
O
NH
2
PhC
O
H
racemizacja
- H
2
O
H
R
N
O
NH
2
H
R
N
O
H
NH
2
H
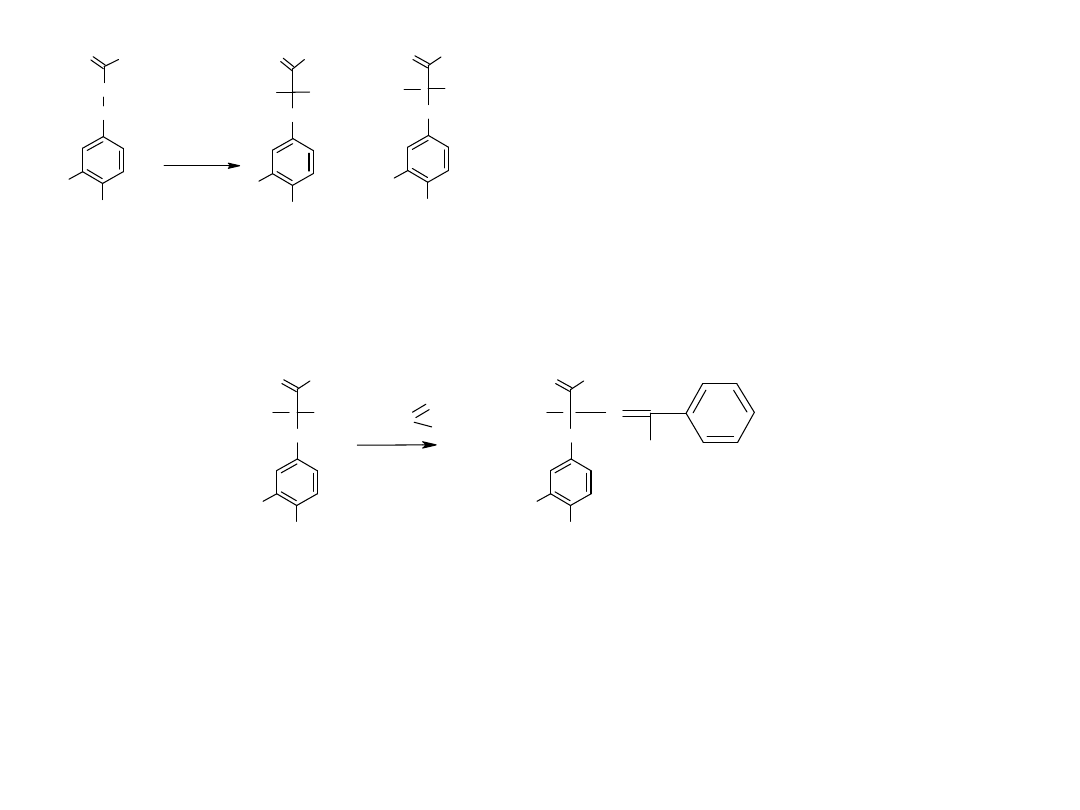
C(CH
3
)NH
2
O
NH
2
CH
2
OH
O
H
OH
O
H
N
H
2
CH
3
O
OH
CH
2
NH
2
NH
2
CH
2
OH
O
H
O
C
H
3
amidaza
+
L
D,L
D
NH
2
NH
2
CH
2
OH
O
H
O
C
H
3
PhC
O
H
D
racemizacja
- H
2
O
N
H
NH
2
CH
2
OH
O
H
O
C
H
3
D
N
S
NH COCH
2
C
6
H
5
H
O
COOH
N
S
NH
H
O
COOH
H
NH
2
O
6AP +
X
ampicylina
penicilina G
Wymienić (zapisać) trzy procesy biotransforamcji stosowane w syntezie ampicyliny
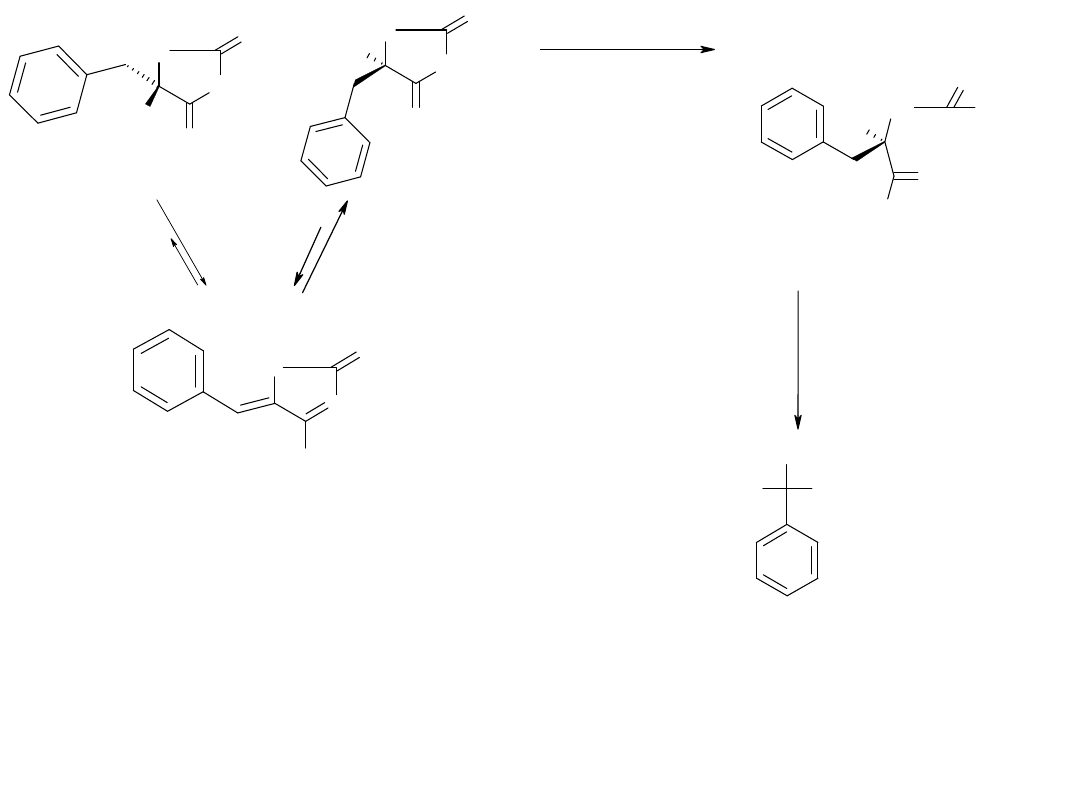
N-karbamylo-D-aminokwas
HNO
2
lub
HCl,
,
amidohydrataza,
NH
2
H
COOH
D fenyloalanina
NH
N
H
O
H
O
NH
N
H
O
O
H
D hydantoinaza
+
N
N
H
O
OH
H
NH
O
H
O
O
NH
2
NH
2
H
COOH
D fenyloalanina
N
S
NH
H
O
COOH
O H
NH
2
ampicylina
acylaza Bacillus
megaterium
proteaza
Pseudomonas citrii
N
S
NH
2
H
O
COOH
C
6
H
5
CH
2
COOH
6AP
+
N
S
NH COCH
2
C
6
H
5
H
O
COOH
hydroliza
H O
2
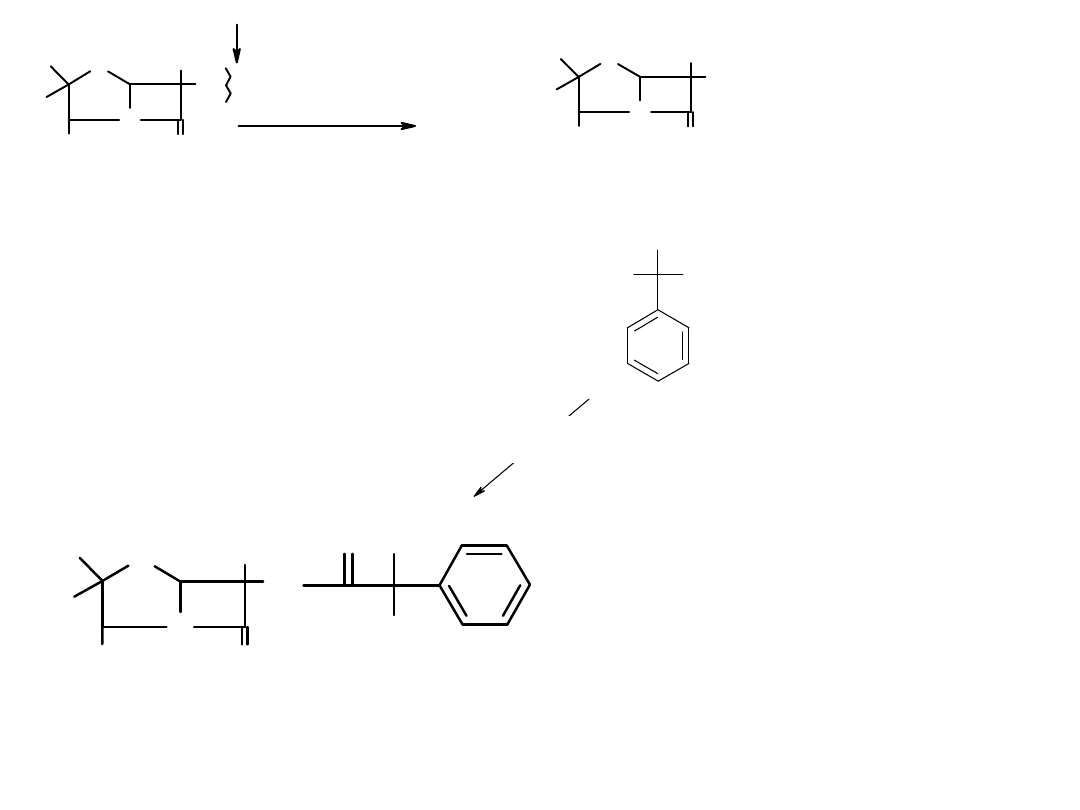
CO
2
Me
CO
2
Me
CO
2
Me
CO
2
H
PLE
97% ee
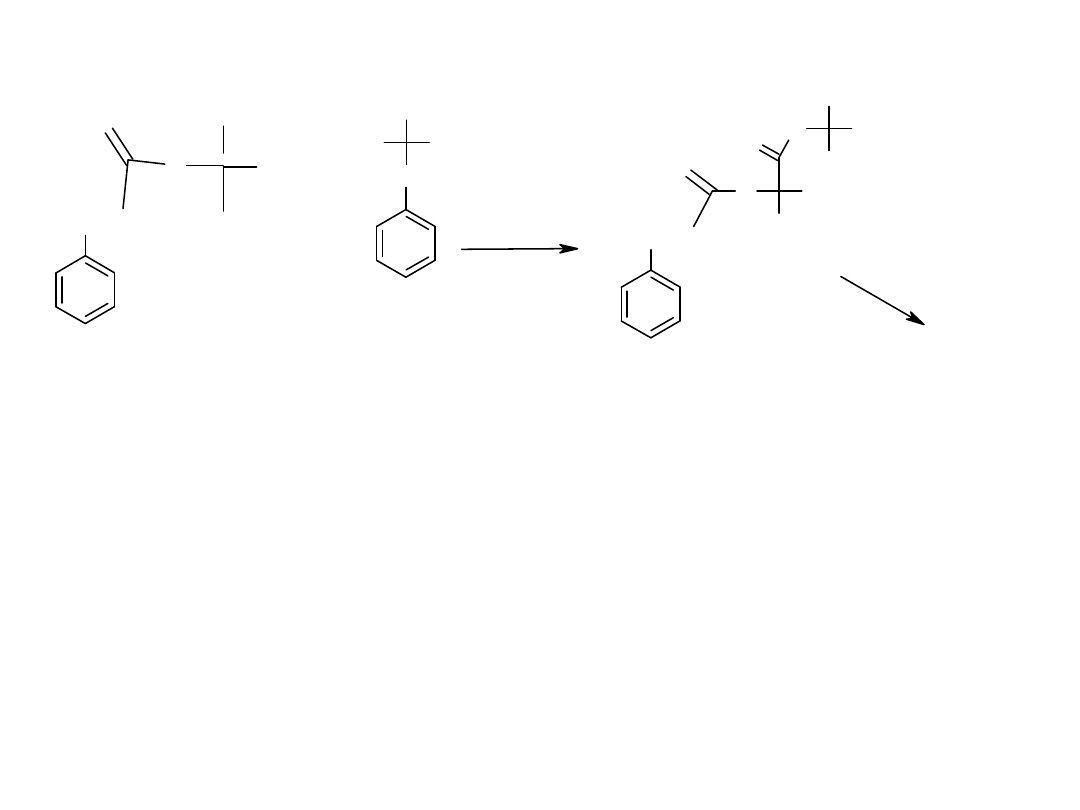
a/ Do jakiej grupy należy enzym katalizujący poniższą reakcję, b/cechy
działania enzymu, c/wzór X, d/wzór Y.
O
N
H
CH
2
COOH
H
H
N
H
CH
2
Ph
O
N
H
O
CH
2
COOH
H
COOMe
H
N
H
2
CH
2
COOCMe
CH
2
O
COOH
CH
2
O
+
D,L
+
H
2
X
enzym z grupy ?
Y
H
2
O
+
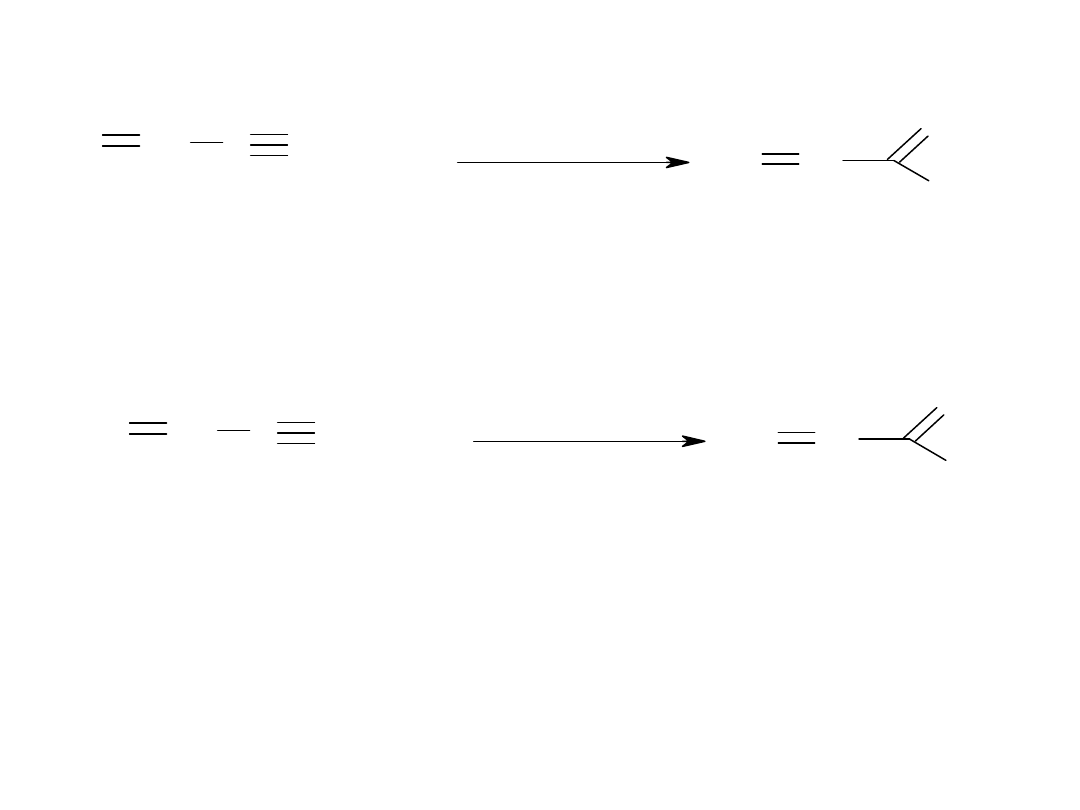
C
H
2
CH
O
OH
nitrylaza
C
N
C
H
2
CH
+
H
2
O
Podać nazwę enzymu i skład pożywki
C
H
2
CH
O
NH
2
C
N
C
H
2
CH
+
H
2
O
2
Hydrataza
nitrylowa
Hydrataza: dodatek jonów Co i mocznika
Nitrylaza: e-kaprolaktam, 3-metylobutylnitryl, bez jonów Co
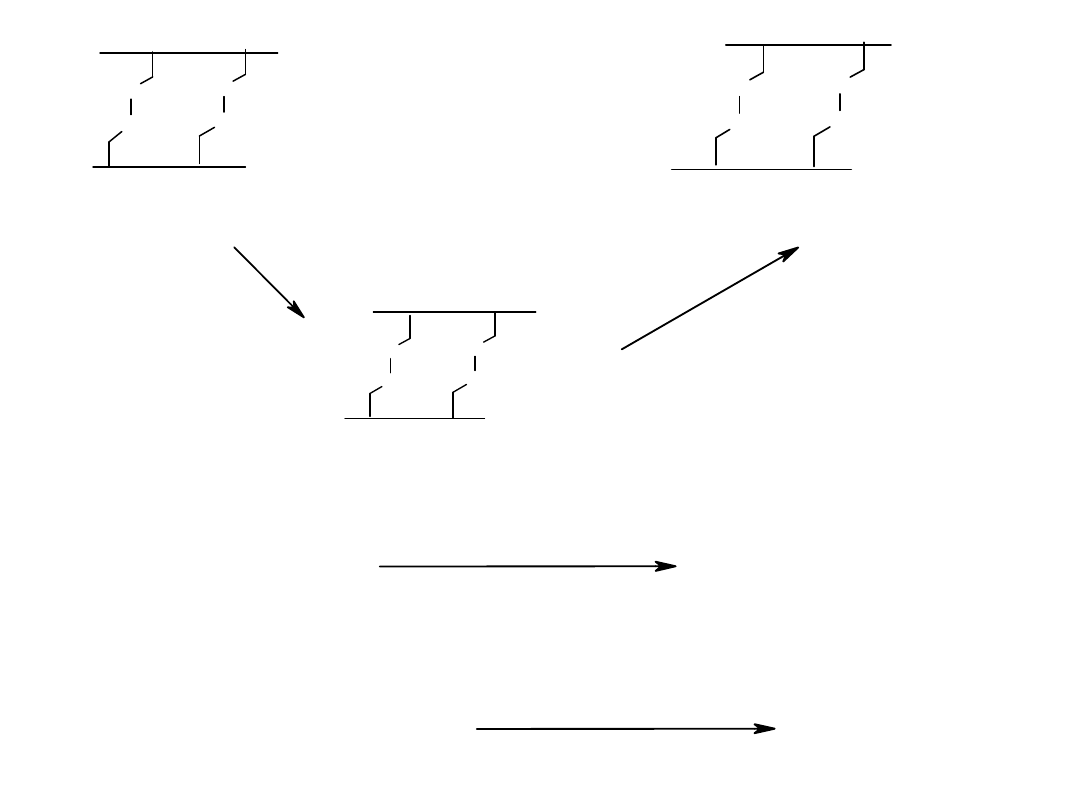
podstawienie alaniny przez
treoninę
insulina
świni
insulina
ludzka
L-Thr-OMe
+
S
S
S
S
LyzAla
insulin
a
łańcuch A
łańcuch B
S
S
S
S
LyzThr
łańcuch A
łańcuch B
insulina ludzka
S
S
S
S
Lyz
łańcuch A
łańcuch B
+ AlaOH
karboksy-
peptydaza
serynopeptydaza
Achromobacter lyticus
L-Thr-OMe
+
transkarboksypeptydaza
insulina
świni
insulina
ludzka
L-Thr-OC(CH
3
)
3
+
trypsyna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
Ćwiczenia ortograficzne dla uczniów klasy III
ZESTAW ĆWICZEŃ DOMOWYCH DLA DZIECI Z PŁASKOSTOPIEM I KOŚLAWOŚCIĄ KOLAN, korektywa(1)
Ćwiczenia Kegla dla mężczyzn, dla mężczyzn, Ćwiczenia
Cwiczenia MATERIALY dla UP
63 zbior cwiczen metafonologicznych dla nauczycieli nauczania poczatkowego
Konspekt ćwiczeń psychologicznych dla dzieci z problemami koncentracji uwag1, Autyzm
rzeczowniki do cwiczen w odmianach dla prawa, Prawo, Łacina
Ćwiczenie 7 Hydroliza nukleoproteidów
Ćwiczenia i zabawy dla dzieci agresywnych i nadpobudliwych
Opracuj zestaw ćwicze kinezoterapełtycznych dla osób z?llulitem
litera W -ćwiczenia, zabawy dla przedszkolaków, LITERY- ALFABET
ZESTAW ĆWICZEŃ GIMNASTYCZNYCH DLA 6-LATKÓW, PRZEDSZKOLE, PRZEDSZKOLE, Ćwiczenia gimnastyczne
Konspekt do ćwiczeń gimnastycznych dla dzieci 3 (2), Konspekt do ćwiczeń gimnastycznych dla dzieci 3
więcej podobnych podstron