
1
Podstawy
spektroskopii
cząsteczkowej
2
Co to jest spektroskopia cząsteczkowa?
Spektroskopia molekularna zajmuje się
oddziaływaniem
promieniowania
elektromagnetycznego z cząsteczkami, na
skutek którego dochodzi do absorpcji, emisji
lub rozproszenia fotonów światła przez
badane
cząsteczki.
Charakter
tego
oddziaływania określa mechanika kwantowa
Wynik takiego oddziaływania obserwuje
się jako widmo badanej cząsteczki z
charakterystycznym zbiorem maksimów
(pasm) o różnych częstościach, kształcie i
intensywności.

3
MOLEKUŁA
STRUKTURA MOLEKULARNA
SPEKTROSKOPIA MOLEKULARNA
4
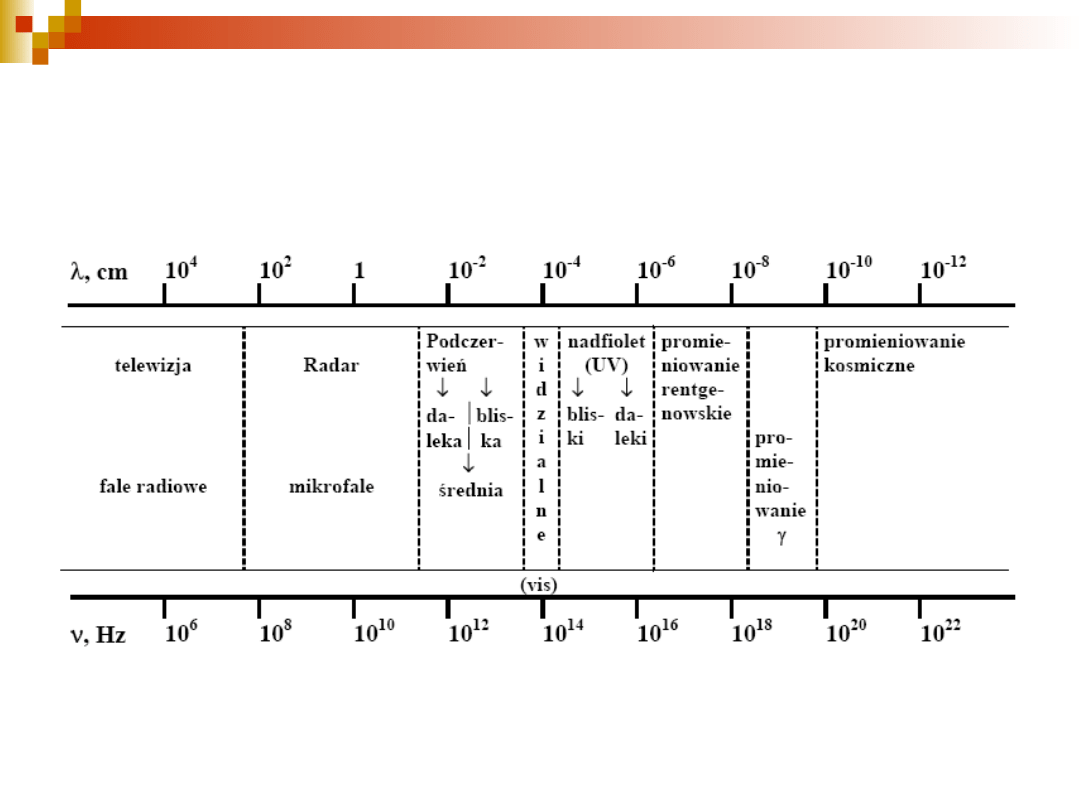
Zakresy promieniowania elektromagnetycznego
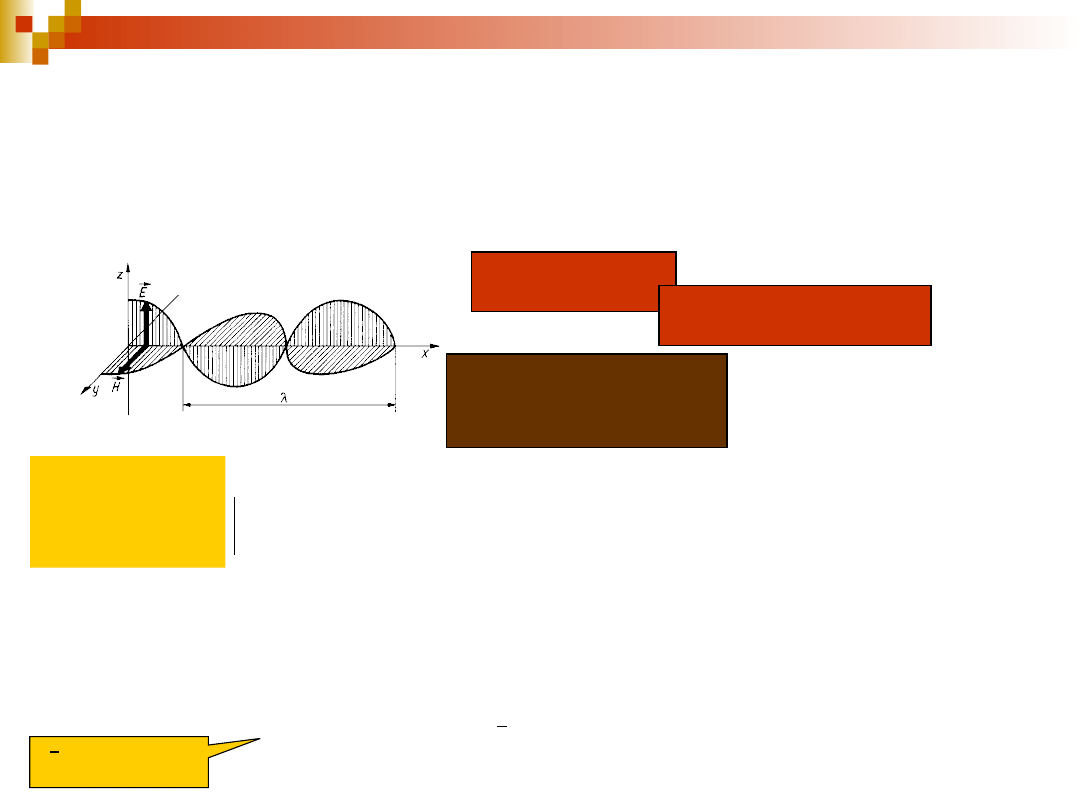
5
Natura promieniowania
elektromagnetycznego
promieniowanie elektromagnetyczne – drganie pola elektrycznego,
któremu towarzyszy drganie pola magnetycznego
c = 3·10
8
m·s
-1
w próżni
u c
w ośrodku materialnym
długość fali ( [cm]) – odcinek drogi
promieniowania, na którym mieści się jeden
okres drgania pola, czyli jedno drganie
częstość ( [s
-1
]) – liczba drgań przypadająca na
sekundę
liczba falowa ( [cm
-1
]) – liczba drgań
przypadająca na 1 cm drogi promieniowania
=
/
c
=
1
/
E = E
0
cos2t
H = H
0
cos2t
Promieniowan
ie
spolaryzowan
e liniowo
6
Cechy promieniowania i jego widmo
energia 1 mola fotonów – ajnsztajn – równy jest N
A
h, gdzie
N
A
jest liczbą Avogadra (6.022·10
23
); ajnsztajn energii jest
zbliżony do energii wiązań chemicznych w obszarze
promieniowania widzialnego i nadfioletu
E = h = hc
zależność Plancka
6.62·10
-34
J·s
zależność Plancka jednoczy naturę falową
i korpuskularną promieniowania
intensywność promieniowania (I) – energia przechodząca w
ciągu 1 sekundy przez 1 m
2
powierzchni prostopadłej do
kierunku biegu promieniowania
gęstość promieniowania () – energia lub proporcjonalna do
niej liczba fotonów monochromatycznych zawarta w 1 m
3
napromieniowanego
układu
(stężenie
objętościowe
fotonów)
I = c =
c
/
n
n – współczynnik załamania światła
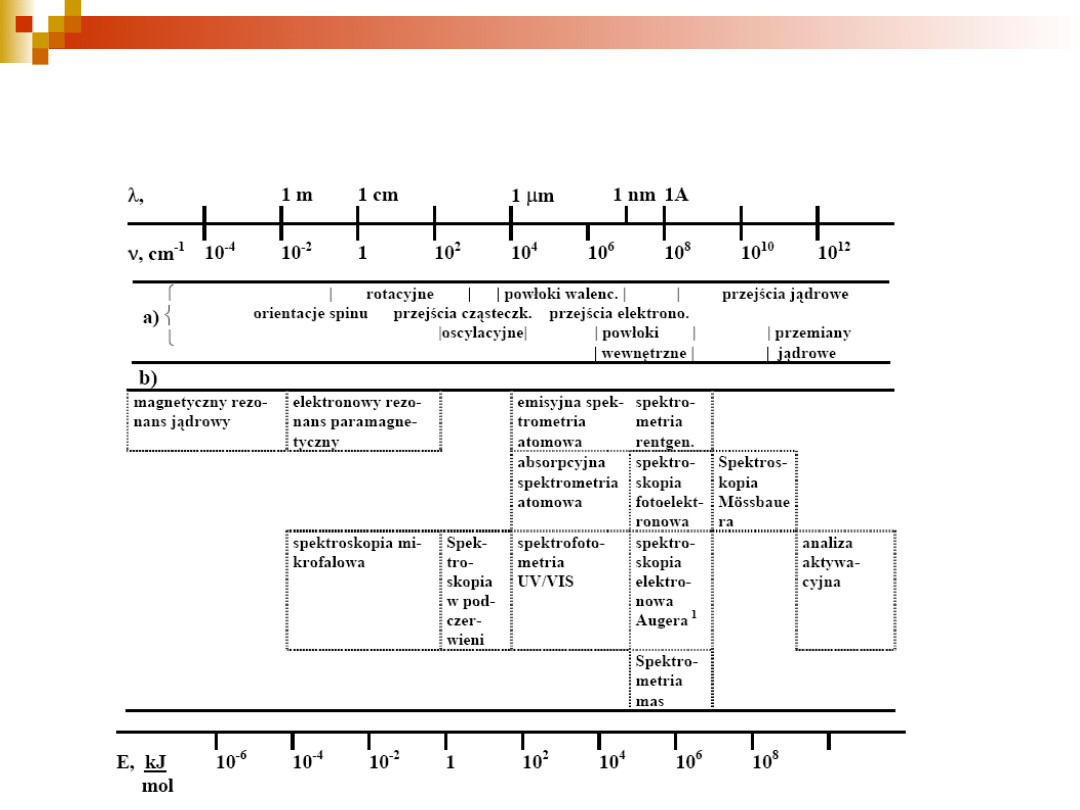
7
Zakresy promieniowania
elektromagnetycznego używanego w różnych
metodach spektroskopowych
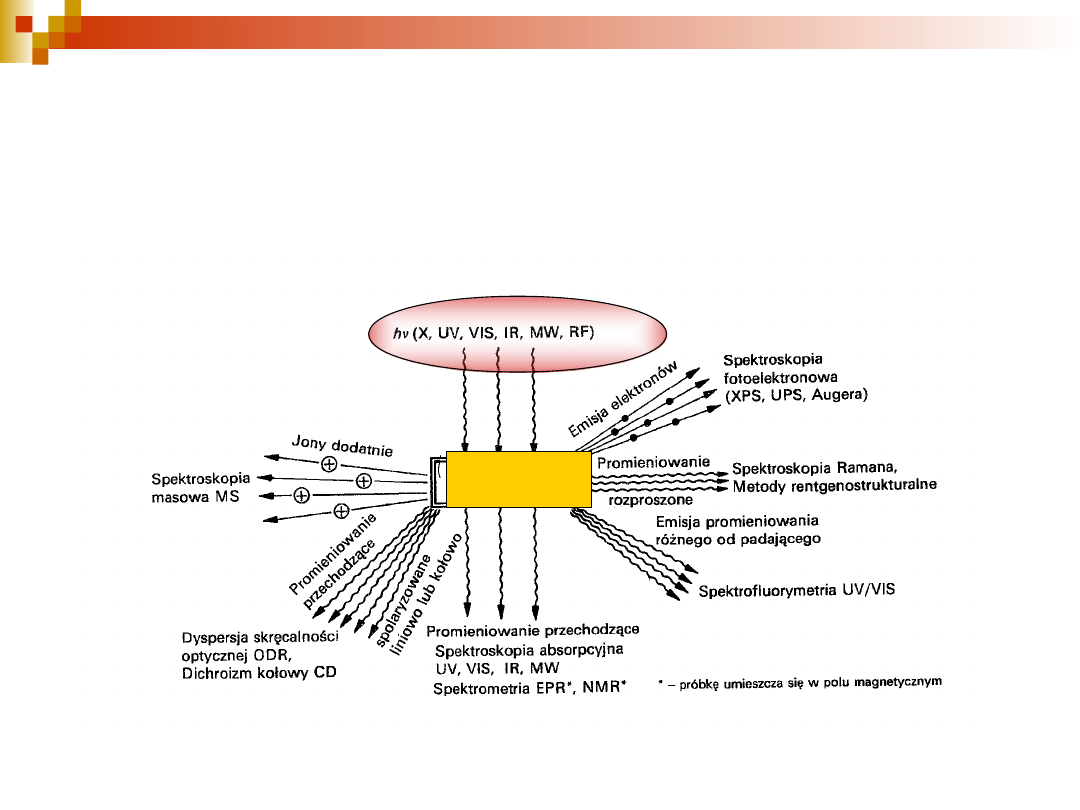
8
Oddziaływanie promieniowania
elektromagnetycznego z materią
próbka
9
Energia molekuł
[J·molekuła
-1
]
[J·mol
-1
]
[eV]
[cm
-1
]
[Hz]
[J·molekuła
-1
]
1
6.02·10
23
6.24·10
18
5.03·10
22
1.51·10
33
[J·mol
-1
]
1.66·10
-24
1
1.04·10
-5
8.35·10
-2
2.51·10
9
[eV]
1.60·10
-19
9.65·10
4
1
8066
2.42·10
14
[cm
-1
]
1.99·10
-23
12.0
1.24·10
-4
1
3·10
10
[Hz]
6.62·10
-34
3.98·10
-10
4.13·10
-15
3.33·10
-11
1
Energię odnosi się do jednej molekuły lub do jednego mola.

10
Zakres energii dla poszczególnych przejść
Rodzaj poziomów
Orientacyjny zakres
Poziomy elektronowe
kilka – tysiące eV
Poziomy oscylacyjne
0.02 – 0.05 eV
Poziomy rotacyjne
ułamki eV (100 – 0.1 cm
-
1
)
Poziomy energetyczne w zewnętrznych polach
magnetycznych
kilka cm-1
Poziomy energetyczne w zewnętrznych polach
elektrycznych
zależy od siły
zewnętrznego pola
elektrycznego

11
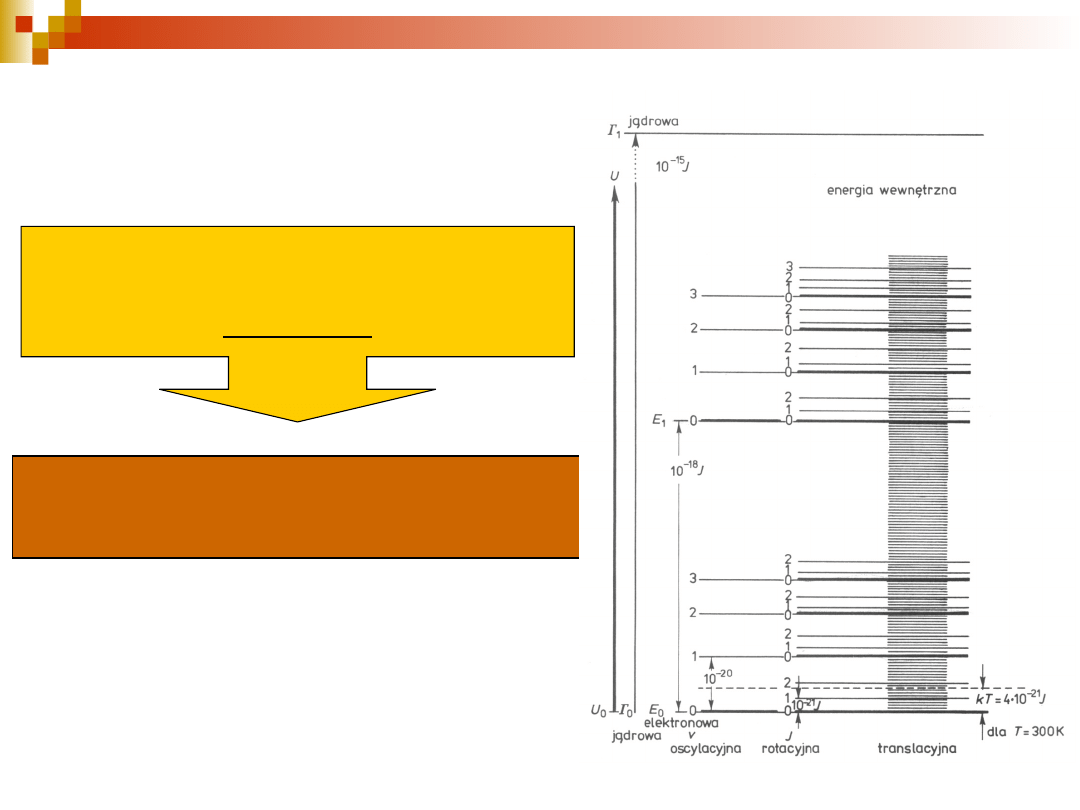
Energia wewnętrzna
molekuł
E = E
translacyjna
+ E
rotacyjna
+ E
oscylacyjna
+
E
elelektronowa
+ E
jądrowa
Każdy z rodzajów energii molekuły może przyjmować
tylko
nieciągłe (dyskretne,
kwantowane) wartości nazywane poziomami energii.
E
translacyjna
=
kT
2
3
Średnia energia translacji molekuły
dzieli się
równomiernie na stopnie swobody i na
każdy przypada ½ kT
w 298 K:
E
tr
= 6,210
-21
J/molekuła ( )
E
tr
= 3,710
3
J/mol ( )
kT
2
3
A
kTN
2
3
Energia translacyjna jest bardzo słabo kwantowana
J
ma
h
E
tr
40
2
2
10
1
8
10
19
poziomów
translacyjnych
cząstka w pudle
a = rozmiar pudła = średnia odległość między molekułami
Dla N
2
:
w T = 298K – 62000 poziomów translacyjnych; w T = 1K – 5 poziomów translacyjnych
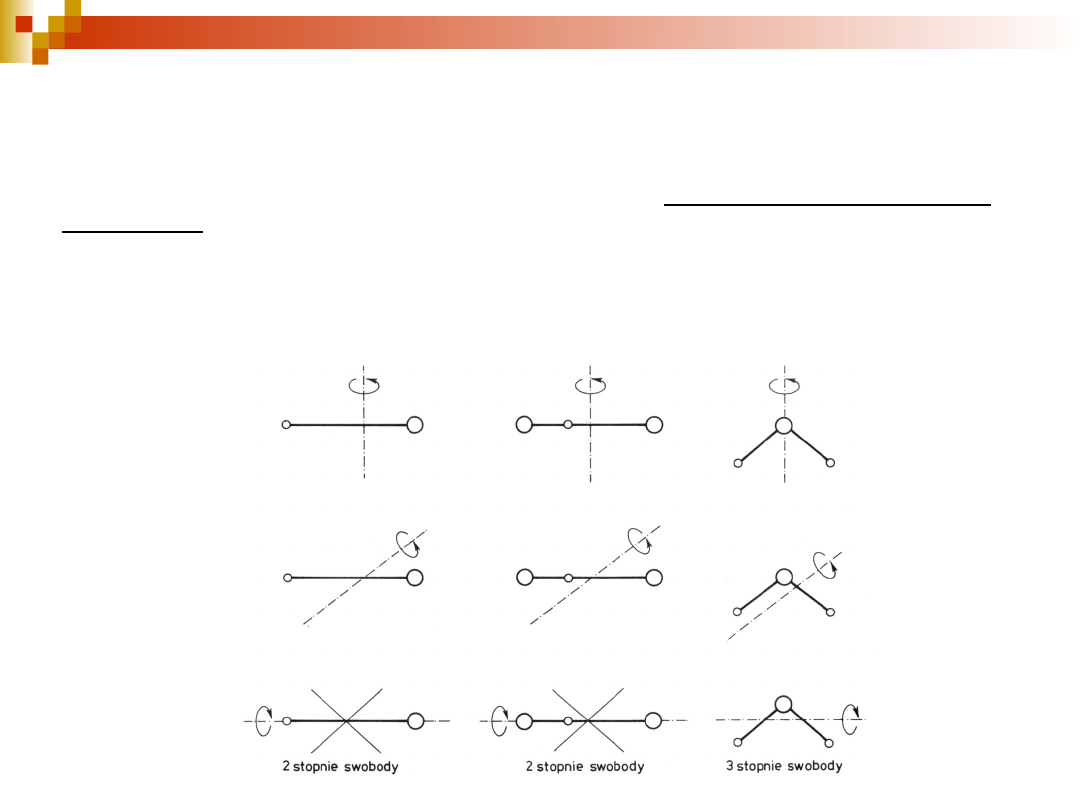
12
E
rotacyjna
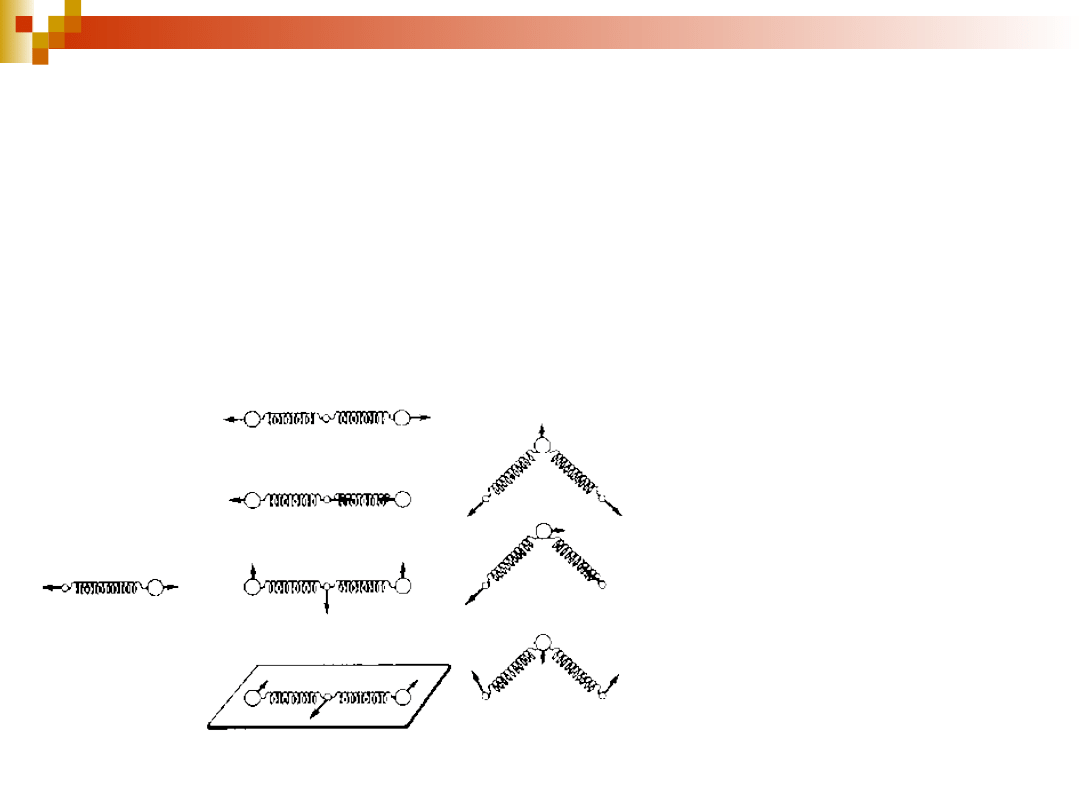
- wynika z wirowania molekuły wokół własnej osi. Ruch ten
przypominający bąka można rozłożyć na składowe rotacje wokół
dwóch lub trzech osi wzajemnie do siebie prostopadłych w zależności
od struktury molekuły, czyli przypisać mu dwa lub trzy stopnie
swobody. Na każdy stopień swobody przypada pewna ilość energii
rotacji.
T = 400-500 K zasada ekwipartycji energii na każdy stopień swobody rotacji przypada
1
/
2
kT
energii rotacyjnej
13
E
oscylacyjna
- atomy w molekule połączone są wiązaniami utworzonymi przez
elektrony walencyjne. Wiązania zachowują się jak sprężyny, które wiążą
zręby atomowe, czyli jądra otoczone zamkniętymi powłokami elektronów
nie biorących udziału w wiązaniach. „Sprężynujące” wiązania wywołują
drgania zrębów atomowych – oscylacje wokół położeń równowagi.
3n – 3 – 3 = 3n – 6 (w molekułach nieliniowych)
3n – 3 – 2 = 3n – 5 (w molekułach liniowych)
n – liczba atomów w molekule
1 stopień swobody 4 stopnie swobody 3 stopnie
swobody

14
E
elektronowa
– energia kinetyczna ruchu elektronów w
molekule i energia przyciągania elektronów przez
jądra i odpychania ich przez sąsiadujące elektrony.
E
jądrowa
– kinetyczna i potencjalna energia
nukleonów tworzących jądra molekuły.
15
Kwantowanie
energii
dana molekuła może oddać otoczeniu swą
energię tylko charakterystycznymi porcjami –
kwantami
energia w mikroświecie jest skwantowana

16
Zadanie 1
Jeden mol gazu doskonałego w temperaturze
298 K i pod ciśnieniem 1 bar zajmuje objętość 2.48·10
-
2
m
3
, odległość średnia między molekułami wynosi
więc
a = (2.48·10
-2
/N
A
)
1/3
m = 3.45·10
-9
m
W przypadku molekuł azotu, których masa
m=4.65·10
-26
kg, h
2
/8ma
2
10
-25
J, a więc na wartość
średniej energii translacji 3/2kT przypada 62 600
poziomów translacyjnych.
Podobne obliczenie dla T = 1K i ciśnienia 1 bar
daje 5 poziomów translacyjnych w obrębie średniej
energii translacyjnej wynoszącej 3/2kT = 2·10
-23
J·molekuła
-1
.

17
Obsadzenie poziomów energetycznych
E
wyższa
E
niższa
E
w
– E
n
= E = h
W stanie równowagi termicznej:
]
exp[
]
exp[
kT
h
kT
E
n
n
n
w
funkcja rozkładu energii Boltzmanna
Przenoszenie się molekuł na wyższe poziomy energetyczne kosztem
energii translacji przekazywanej w zderzeniach
4
e
n
e
rg
ia
0
1
0
1
2
3
kT

18
Analiza funkcji
Boltzmanna
I.
E=0 lub T=
1
n
w
n
n
poziomy pokrywają się ze sobą
nieskończenie wysoka temperatura
przypadek graniczny
Im bliżej siebie leżą poziomy lub im wyższa T, tym bardziej wyrównane obsadzenie.
II.
E= lub T=0
0
n
w
n
n
przypadek graniczny
Im bardziej odległe od siebie poziomy lub im niższa T, tym mniej obsadzony poziom wyższy.
III.
nie ma sensu dla poziomów o tym samym stopniu degeneracji,
bez dopływu energii z zewnątrz
1
n
w
n
n
]
exp[
kT
E
g
g
n
n
n
w
n
w
Zablokowanie drogi powrotu molekuł na niższy stan prowadzi do inwersji obsadzeń, a bodziec
może spowodować lawinowy spadek molekuł na niższy poziom i emisję wiązki fotonów
(akcja laserowa).
19
Procesy ważne dla powstania akcji
laserowej
pompowanie
emisja spontaniczna
emisja wymuszona
absorpcja
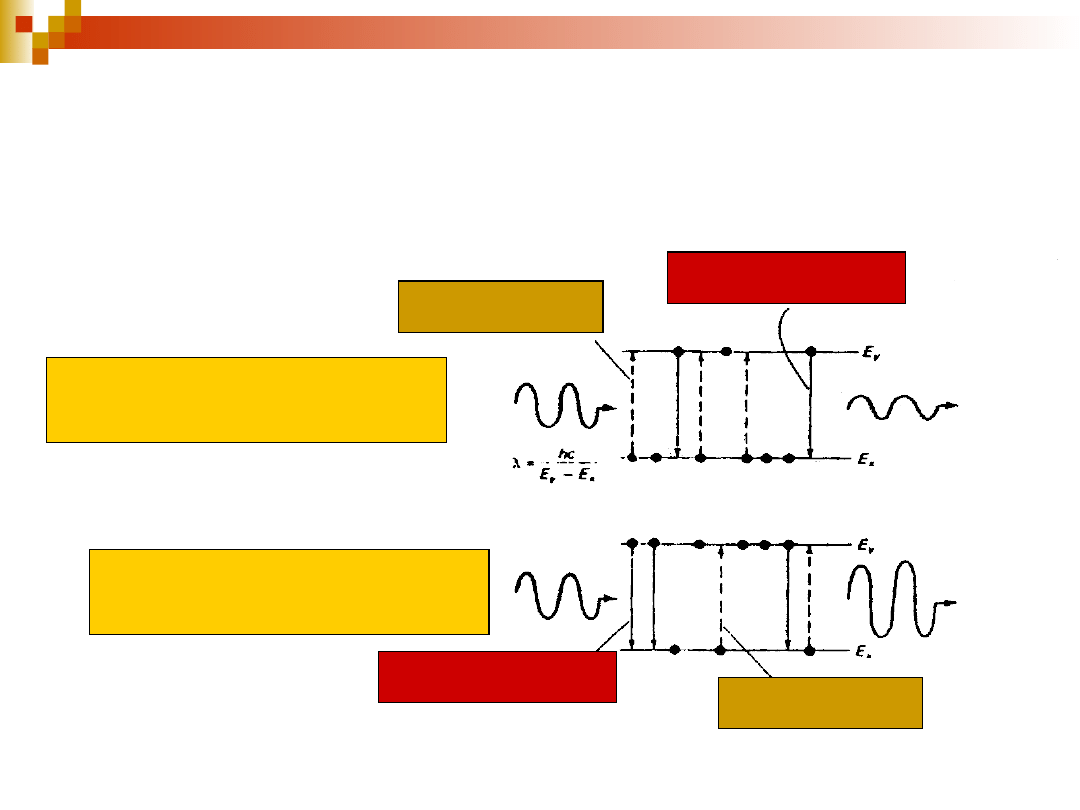
20
Oddziaływanie promieniowania z
układem bez inwersji i z inwersją
obsadzenia stanu wzbudzonego
absorpcja
emisja spontaniczna
emisja wymuszona
absorpcja
brak inwersji obsadzeń stanów
inwersja obsadzeń stanów
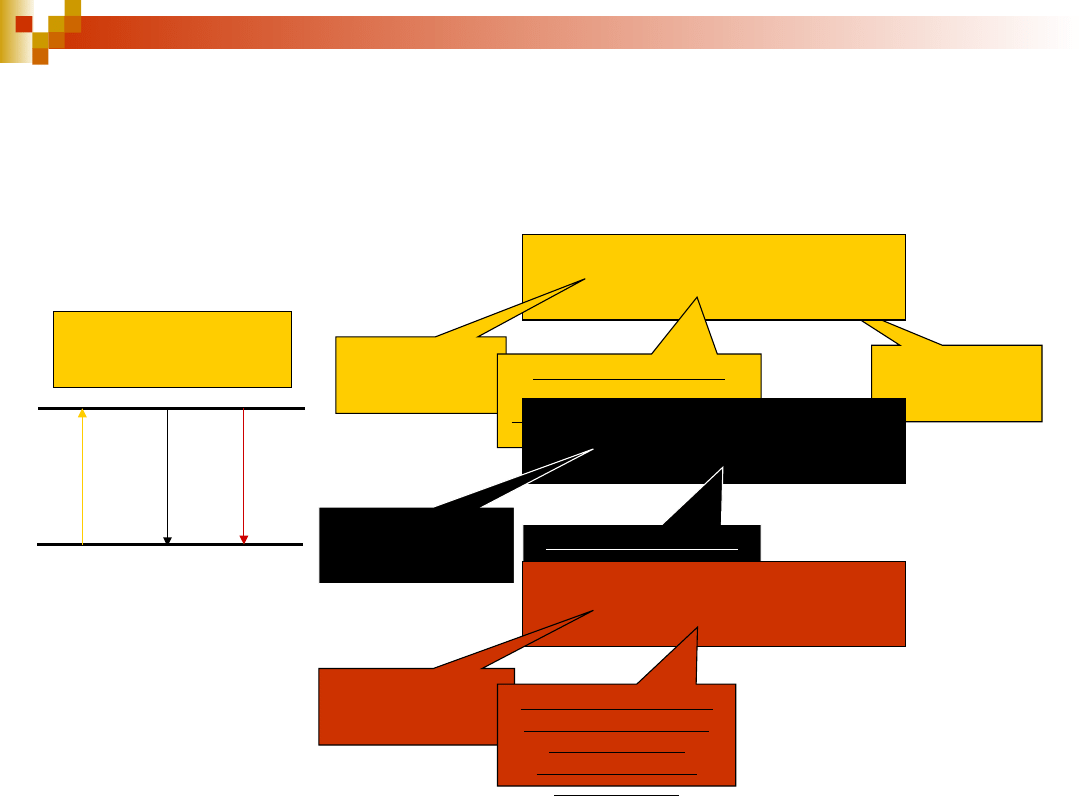
21
Gęstość
promieniowania
Prawdopodobieństwo absorpcji
i emisji promieniowania
E = h
a
b
so
rp
cj
a
e
m
is
ja
sp
o
n
ta
n
ic
zn
a
e
m
is
ja
w
y
m
u
sz
o
n
a
Z
nw
= B
nw
n
n
liczba przejść
absorpcyjnych
w jednostce
czasu
prawdopodobieństwo
absorpcji wymuszone –
współczynnik absorpcji
Einsteina
Z’
wn
= A
wn
n
w
liczba przejść
emisji
spontanicznej w
jednostce czasu
prawdopodobieństwo
emisji spontanicznej –
współczynnik
Einsteina emisji
spontanicznej
Z
wn
= B
wn
n
w
liczba przejść
emisji wymuszonej
w jednostce czasu
prawdopodobieństwo
emisji wymuszonej –
współczynnik
Einsteina emisji
wymuszonej
w
n
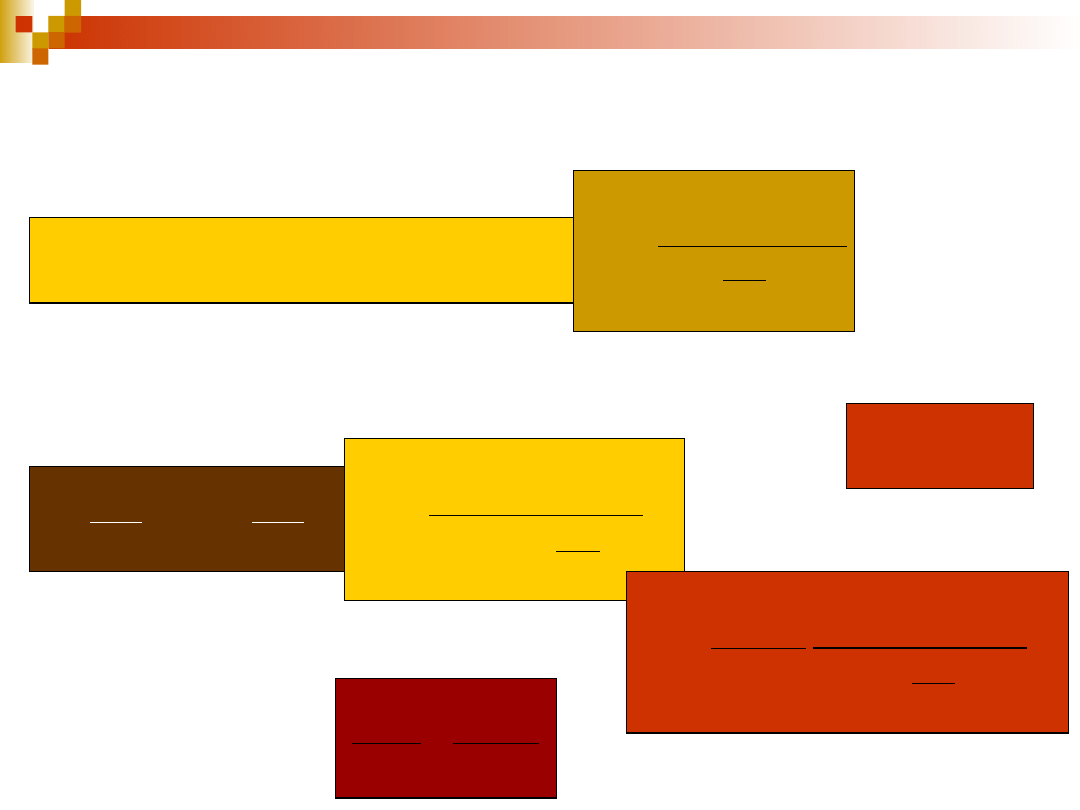
22
Dynamiczny stan równowagi
obsadzeń poziomów
B
nw
n
n
= A
wn
n
w
+ B
wn
n
w
=
A
wn
B
nw
- B
wn
n
n
n
w
Współczynniki Einsteina absorpcji i wymuszonej emisji są sobie równe, gdy poziomy n i w
mają ten sam stopień degeneracji, czyli g
n
= g
w
B
nw
= B
wn
= exp
[
]
n
n
n
w
h
kT
=
A
wn
B
nw
(exp[ ] -1)
h
kT
=
1
(exp[ ] -1)
h
kT
8h
3
c
3
ciało doskonale czarne – wzór Plancka
A
wn
8h
3
B
nw
c
3
=

23
rodzaj
spektroskopii
częstość
promieniowania
[Hz]
A
wn
B
nw
jądrowy rezonans
magnetyczny
10
8
6·10
-34
elektronowy
rezonans
paramagnetyczny
10
10
6·10
-28
rotacyjna
10
12
6·10
-22
oscylacyjna
10
14
6·10
-16
elektronowa
10
15
6·10
-13
Wartości A
wn
/B
nw
dla częstości charakteryzujących promieniowanie używane
w różnych spektroskopiach wskazują, że współczynnik A
wn
jest znacznie
mniejszy od współczynników absorpcji i emisji wymuszonej i stosunek ten
szybko rośnie ze wzrostem częstości przejść pomiędzy poziomami
energetycznymi.
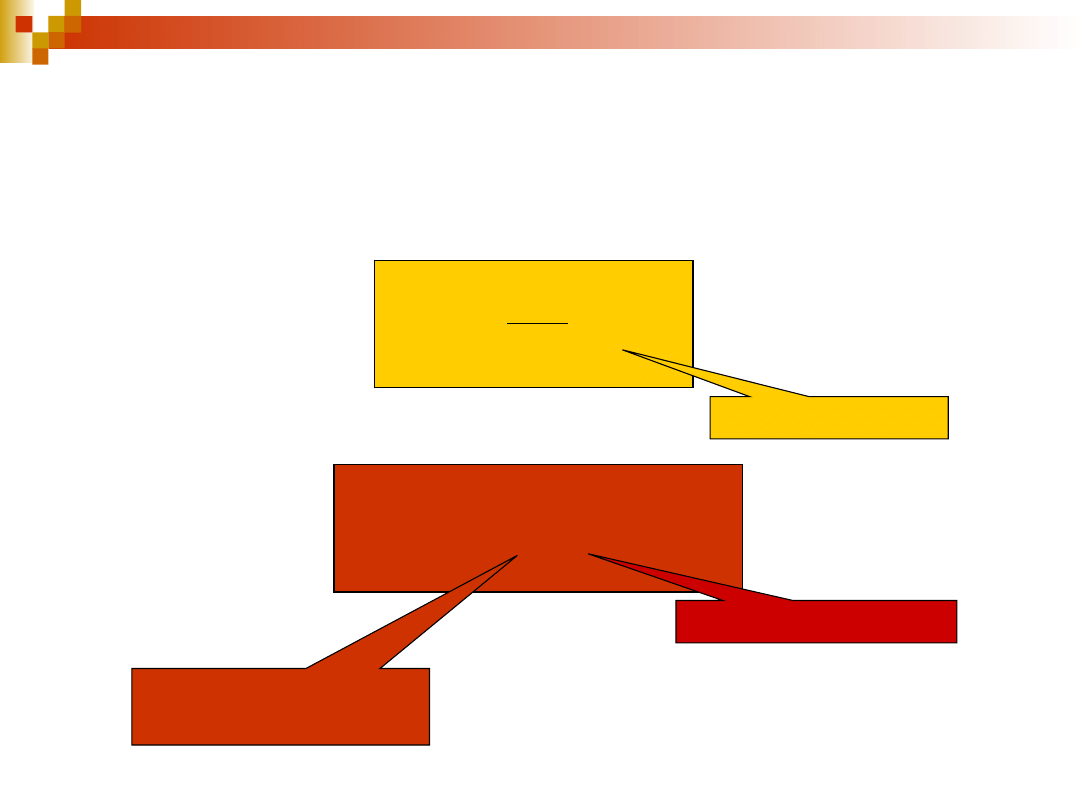
24
Równanie Schrödingera zależne od czasu
pozwala wyznaczyć współczynnik B
nw
B
nw
= |R
nw
|
2
8
3
3h
2
|R
nw
| =
n
*
Op
w
d
+
-
moment
przejścia
funkcje falowe
stanów niższego i
wyższego
operator przejścia

25
spektros-
kopia
rodzaj energii
wewnętrzenej,
która zmienia
energię
zaabsorbowane
go
promieniowania
E
kJ/mol
N
w
/N
n
populacja
stanu
wzbudzone
-go
%
czas życia
stanu
wzbudzon
e-go
s
obliczono
dla
NMR
energia spinów
jądrowych w
polu
magnetycznym
4·10
-6
0,99999
8
49,999
9
~10
=100
MHz
EPR
energia spinów
niesparowanych
elektronów w
polu
magnetycznym
4·10
-3
0,999
8
49,9
~10
-3
=10
10
MHz
MW
energia rotacji
cząsteczek
4·10
-3
0,999
8
49,9
~10
-3
=10
10
MHz
IR
energie
oscylacji i
rotacji
cząsteczek
20
0,00015
0,01
~10
-8
=170 cm
-
1
UV/VIS
energia
elektronów
3·10
3
0
znikom
a
~10
-9
=400
nm

26
Ważne!
Nawet, jeśli stosunek N
w
/N
n
=0.99998, to i tak w
takim przypadku istnieje znaczący nadmiar
molekuł (jąder) na niższych poziomach
energetycznych. W 1 molu cząsteczek taki stosunek
obsadzenia poziomów energetycznych odpowiada
nadmiarowi rzędu
10
17
cząsteczek
znajdujących
się na niższym poziomie energetycznym.
Dzięki temu nadmiarowi procesy absorpcji
(wymuszonej) mają przewagę nad procesami
emisji!!
27
Czynniki determinujące kształt i szerokość
konturu pasma
rozmycie skwantowanych poziomów energetycznych,
między którymi zachodzi przejście absorpcyjne lub
emisyjne; rozmycie to tłumaczy zasada nieoznaczoności
Heisenberga (· ħ/2)
efekt Dopplera
szczątki gałęzi rotacyjnych w pasmach oscylacyjno-
rotacyjnych układów skondensowanych
chwilowe różnice otoczenia molekuł w fazie
skondensowanej
zderzenia molekuł w fazie gazowej powodujące jej
deformacje
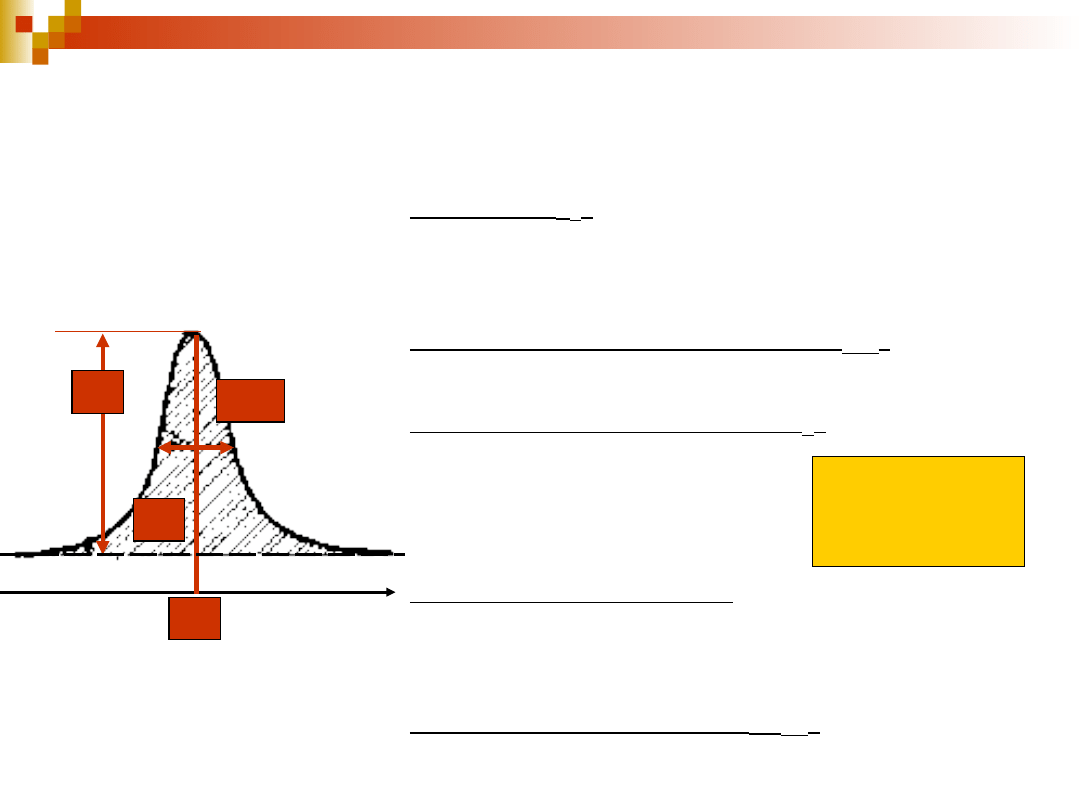
28
Parametry pasma
spektralnego
częstość (
0
) – częstość osi symetrii konturu,
która charakteryzuje położenie pasma względem
innych pasm w widmie i pozwala zidentyfikować
obiekt dający pasmo
intensywność w maksimum (I
max
) – wysokość
konturu pasma mierzona od tła pasma
intensywność integralna (I
) – powierzchnia
ograniczona konturem pasma i tłem
intensywność molowa (w maksimum lub
integralna) – stosunek zmierzonej intensywności
do stężenia substancji, której pasmo badamy,
wyrażona w molach na jednostkę objętości
szerokość połówkowa (
1/2
) – szerokość
konturu zmierzona w połowie jego wysokości
I
1
2
1/2
0
tło
I
max
I
= I d
2
1
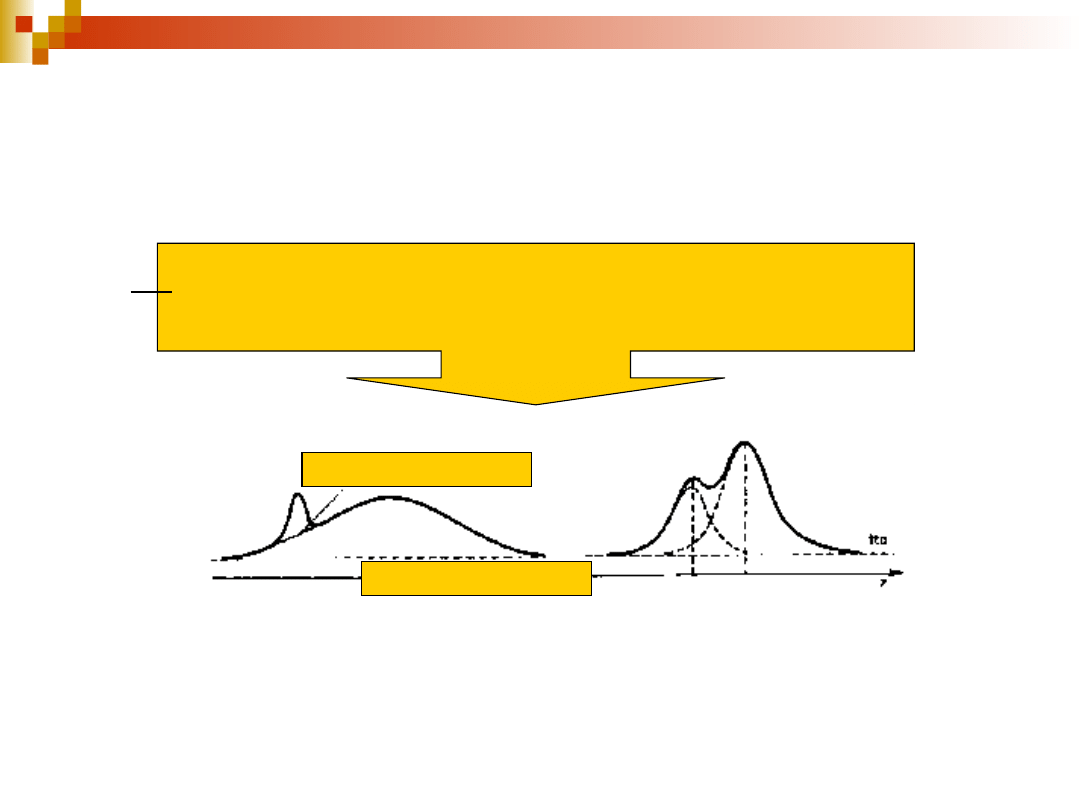
29
tło pasma wąskiego
tło pasma szerokiego
tło – intensywność widma poza obszarem badanego pasma
i innych pasm znajdujących się w bezpośrednim sąsiedztwie
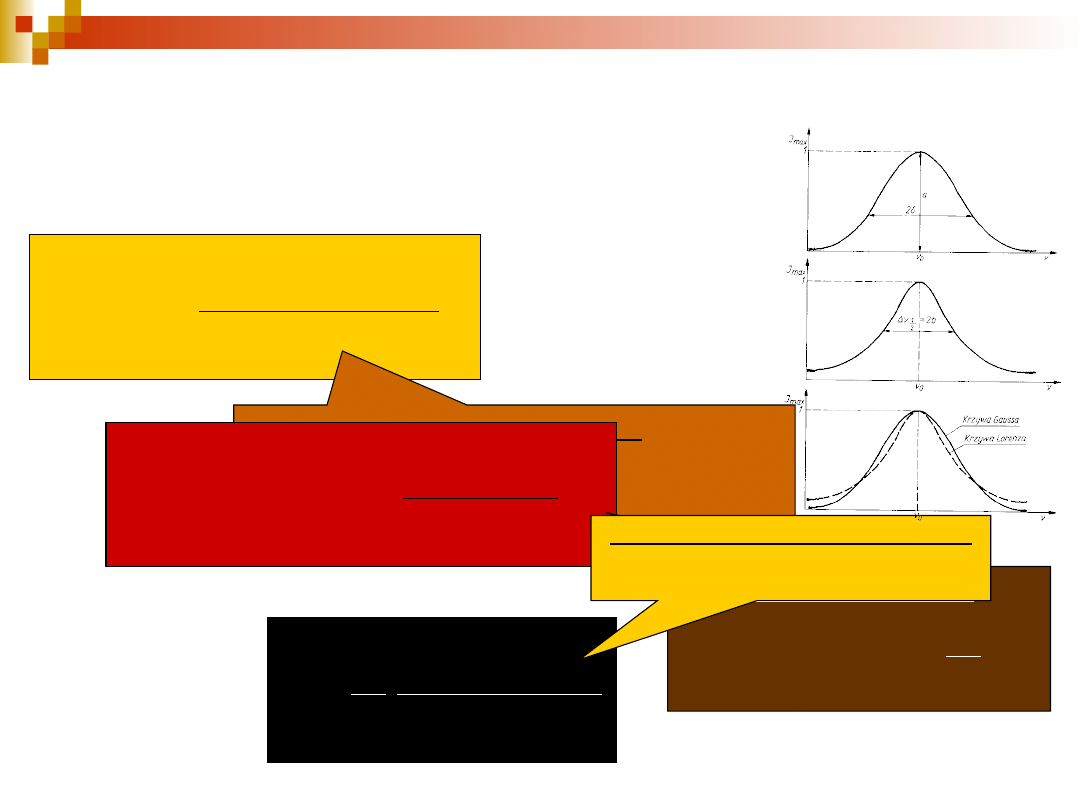
30
Funkcje analityczne opisujące
kontur pasma
I() =
a
( -
0
)
2
+ b
2
funkcja Lorentza
b – połowa szerokości połówkowej konturu (
1/2
=
2b)
I
max
= a/b
2
I
= a/b
I() = a’ exp[ - ]
( -
0
)
2
q
2
funkcja Gaussa
q – połowa szerokości konturu na
wysokości 1/e, a’ – wysokość
konturu (I
max
= a’),
1/2
= 2q ln2
I
=a’q
r =
1/2
· I
max
2 I
współczynnik kształtu konturu
r = 1 funkcja Lorentza
r = ln2 = 1.47 funkcja Gaussa

31
Kryteria podziału spektroskopii molekularnej
I. Sposób oddziaływania promieniowania z układem
molekularnym:
spektroskopia absorpcyjna,
spektroskopia emisyjna,
spektroskopia rozproszenia.
II. Rodzaj wzbudzeń wywołanych prze oddziaływania
promieniowania z układem:
spektroskopia elektronowa,
spektroskopia oscylacyjna,
spektroskopia rotacyjna,
spektroskopia elektronowego rezonansu
paramagnetycznego,
spektroskopia magnetycznego rezonansu jądrowego.

32
III. Wykorzystanie informacji zawartej w widmie:
A. Spektroskopia klasyczna:
parametry geometrii molekuły (długości wiązań, kąty walencyjne),
stałe siłowe i energie dysocjacji wiązania,
charakter
i
wielkość
oddziaływania
między-
i
wewnątrzmolekularnych,
energia drgań,
rozkład gęstości elektronowej,
identyfikacja ilościowa i jakościowa związków chemicznych.
B. Spektroskopia kształtu pasma:
wyznaczenie reorientacyjnych i wibracyjnych czasów korelacji,
wartość bariery aktywacyjnej dla ruchu reorientacyjnego molekuł.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
analityka podstawy spektroskopii 2012 2013
Absorpcyjna Spektrofotometria czasteczkowa
podstawy spektro odpowiedzi
podstawy spektroskopii lista1 2011
12 Spektroskopia czasteczkowa
1 instrukcja Podstawy spektroskopii
analityka podstawy spektroskopii 2012 2013
Absorpcyjna Spektrofotometria czasteczkowa
Z Kęcki Podstawy spektroskopii molekularnej
Wyznaczanie masy cząsteczkowej makromolekuł na podstawie pomiarów wiskozymetrycznych
Genetyka mendlowska, I prawo Mendla to podstawa korpuskularnej, czyli cząsteczkowej teorii dziedzicz
Fizyka-ściąga , Podstawowe równanie torii kinetyczno-cząsteczkowej gazu doskonałego
CW2 3, POMIAR EFEKTÓW PODSTAWNIKOWYCH METODĄ SPEKTROSKOPII ABSORPCYJNEJ W PODCZERWIENI
Kafarski, podstawy chemii organicznej, ANALIZA WIDM SPEKTROSKOPOWYCH
wyznacznie masy czasteczkowej makromolekuł na podstawie pomiarów wiskozymetrycznych cz 1
TUTORIALE Dym podstawy czastek w 3ds max
więcej podobnych podstron