
CUKRY
Czyli kilka słów o węglowodanach

Czym są cukry?
Cukry, zwane również
węglowodanami, należą do jednej z
trzech podstawowych grup związków
naturalnych (będących elementami
budulcowymi organizmów obok
tłuszczów i białek). Zbudowane są z
atomów węgla, wodoru i tlenu.

Jak dzielimy cukry?
Jednocukry - MONOSACHARYDY
dwucukry- DISACHARYDY
wielocukry- POLISACHARYDY
Dwucukry i wielocukry zbudowane są z
fragmentów cząsteczek cukrów prostych
(reszty jednocukrowe)

MONOSACHARYDY
Monosacharydy ze względu na ilość
atomów ilość atomów węgla w pojedynczej
cząsteczce dzielimy na:
triozy o 3 atomach węgla, np. aldehyd
gliceronowy,
tetrozy o 4 atomach węgla,
pentozy o 5 atomach węgla, np. ryboza,
deoksyryboza, rybuloza,
heksozy o 6 atomach węgla np. glukoza,
galaktoza i fruktoza
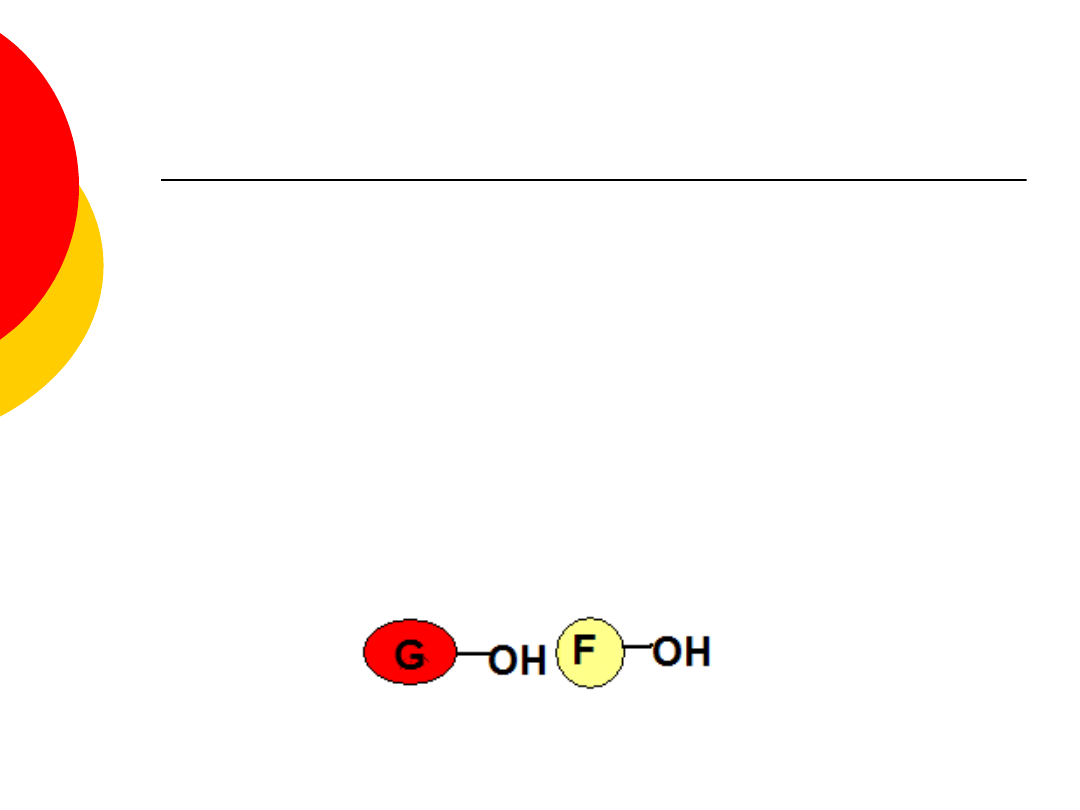
Cukry proste są alkoholami
wielowodorotlenowymi o pierścieniowej
budowie (pięcio lub sześcioczłonowy
pierścień). Dla uproszczenia ich wzory
możemy zapisywać w formie elipsy lub
okręgu z wpisaną literą oznaczającą rodzaj
cukru oraz z zaznaczoną przynajmniej
jedną grupę hydroksylową.

Aldoza
cukry proste, w których cząsteczkach występuje grupa
aldehydowa (CHO), ogólny wzór: CnH2nOn (gdzie n≥3)
Najprostszą aldozą jest aldehyd glicerynowy,
W nazwach cukrów występuje charakterystyczna
końcówka -oza.

Ketozy
cukry proste, w których cząsteczkach występuje
grupa ketonowa (C=O),
są cukrami redukcyjnymi,
ketozy nie odbarwiają wody bromowej (w
przeciwieństwie do aldoz)
trioza
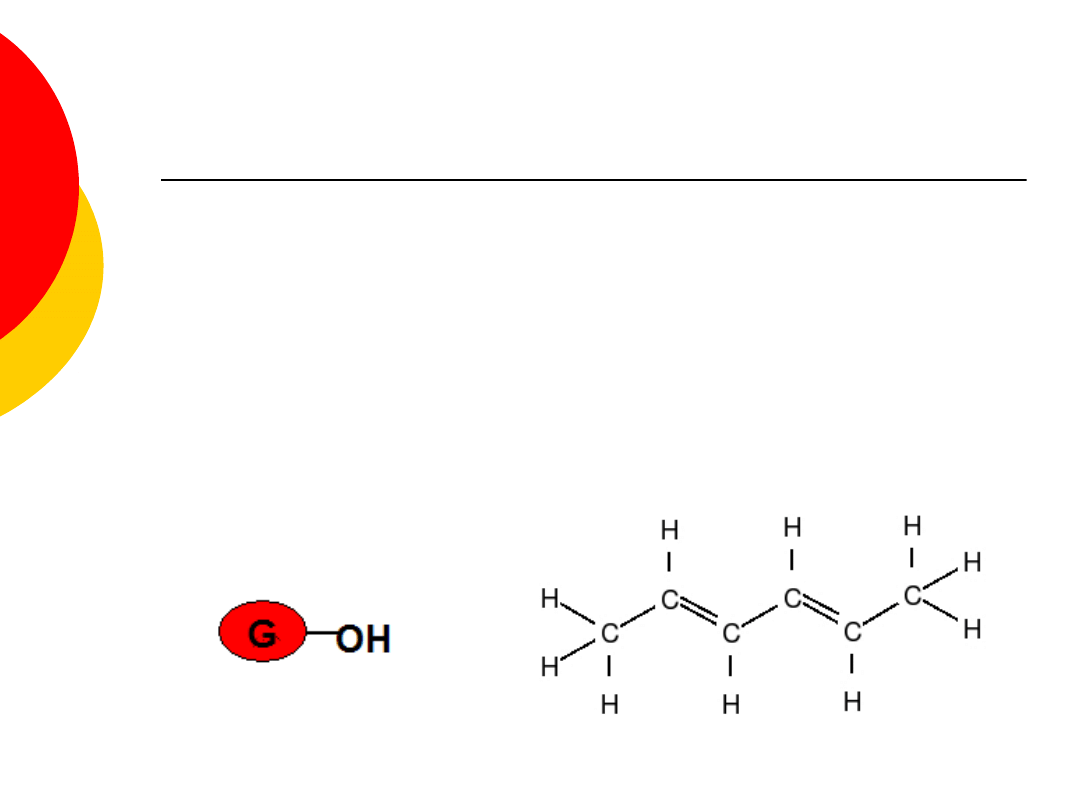
Glukoza – właściwości
(
należy do aldoz), jest białą, krystaliczną
substancją stałą o słodkim smaku,
bardzo dobrze rozpuszczalna w wodzie,
praktycznie nierozpuszczalna w alkoholach
i innych rozpuszczalnikach organicznych,
odczyn obojętny,
cukier gronowy
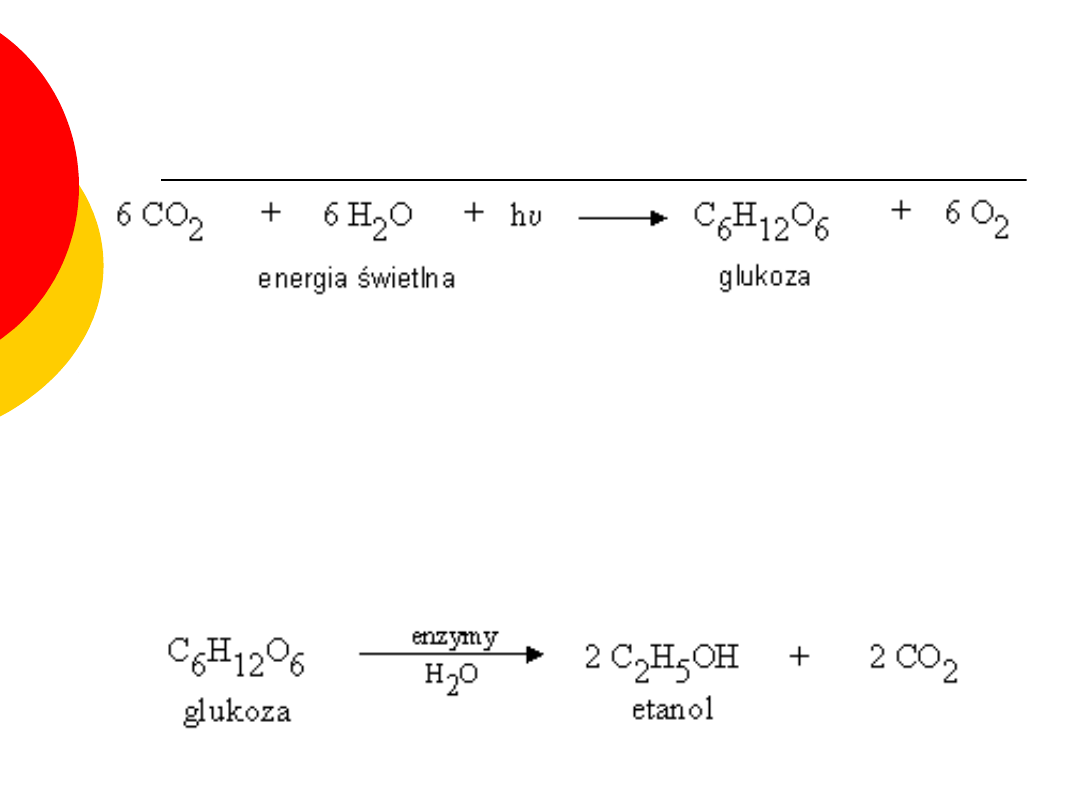
jest wytwarzana w procesie fotosyntezy przez
organizmy zielone.
w komórkach roślinnych jest przekształcana we
wszystkie inne związki organiczne.
jest używana przez człowieka do celów spożywczych, w
przemyśle farmaceutycznym (otrzymuje się z niej
witaminę C)
jest substratem w fermentacji alkoholowej. Pod
wpływem enzymów wytwarzanych przez drożdże,
ulega rozkładowi z utworzeniem etanolu i dwutlenku
węgla.

Fruktoza - właściwości
należy do ketoz,
cukier owocowy występujący w stanie wolnym
(w owocach, miodzie i nektarze kwiatów),
w temperaturze pokojowej jest białą
substancją krystaliczną,
charakteryzuje się słodkim smakiem (jest
nieco słodsza od sacharozy i znacznie słodsza
od glukozy) oraz dobrą rozpuszczalnością w
wodzie,
jest znacznie wolniej przyswajana przez
organizm, niż sacharoza i glukoza. Znaczne
ilości fruktozy mogą powodować biegunkę i
bóle żołądkowo-jelitowe.
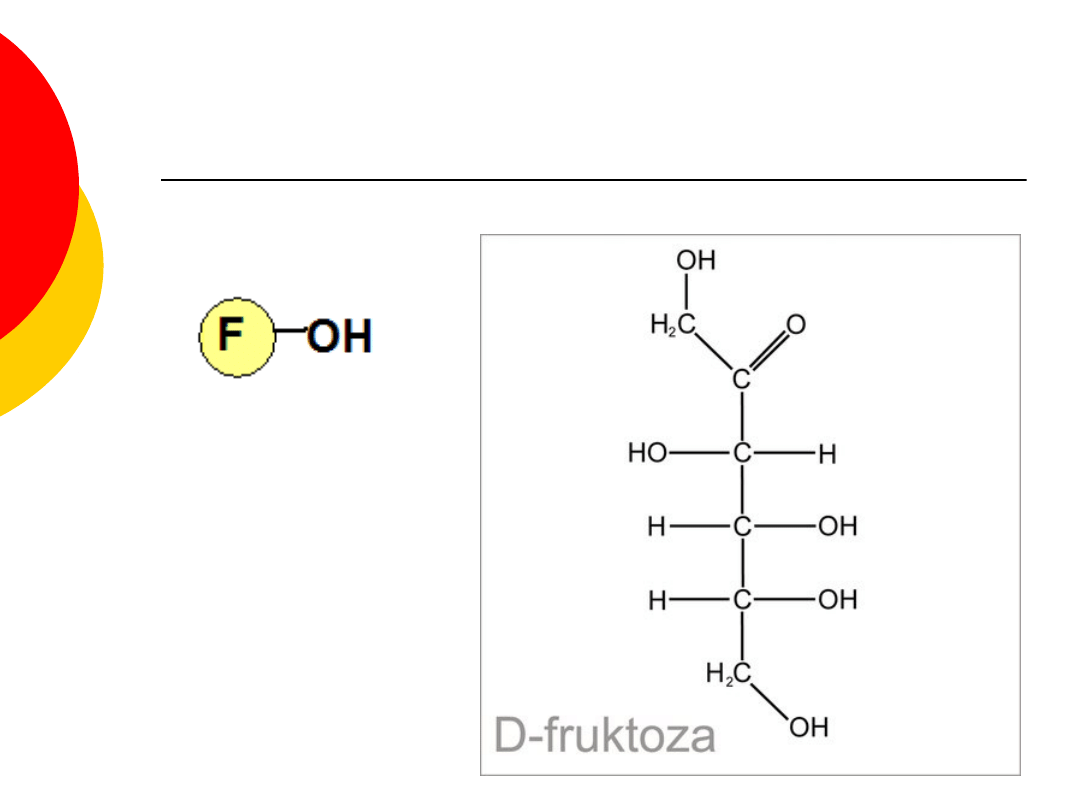
Fruktoza wzór
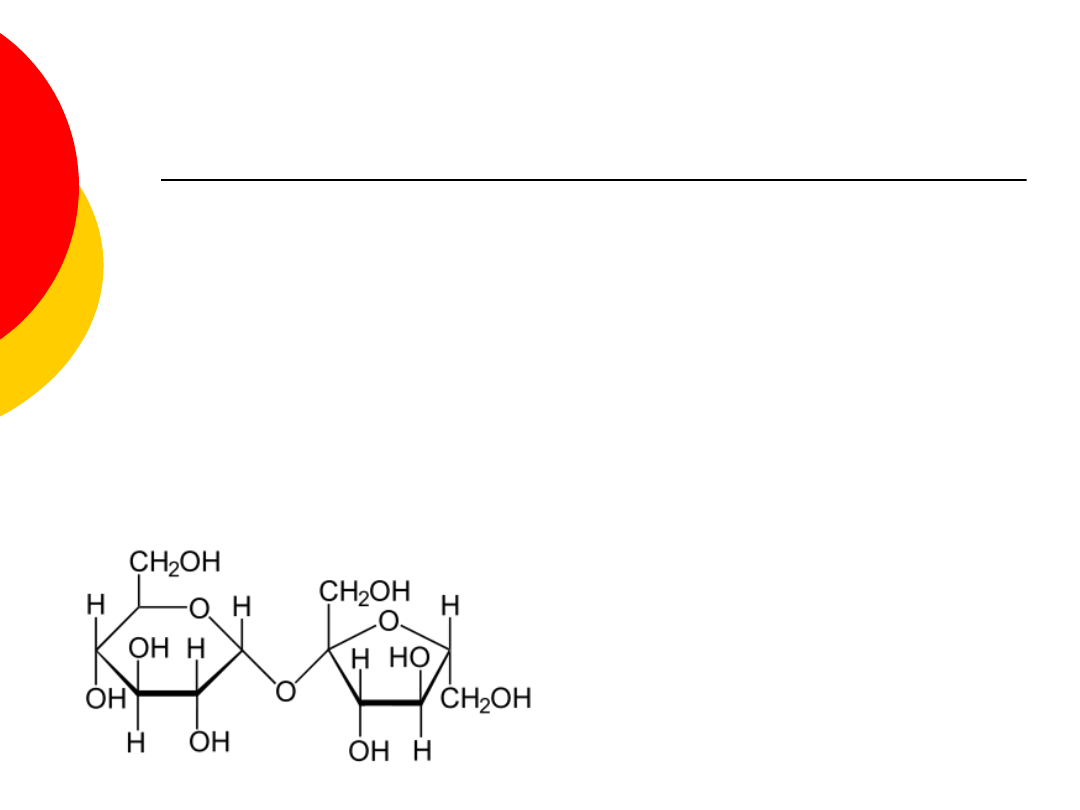
Dwucukry - sacharoza
złożony z fruktozy i glukozy, będący zasadniczym
składnikiem cukru trzcinowego i cukru
buraczanego,
posiada wiązanie glikozydowe (łatwo ulegają
hydrolizie w środowisku kwaśnym),
w temperaturze pokojowej sacharoza jest
bezbarwnym, krystalicznym ciałem stałym,
nietoksyczna, ma słodki smak i jest bardzo dobrze
rozpuszczalna w wodzie.
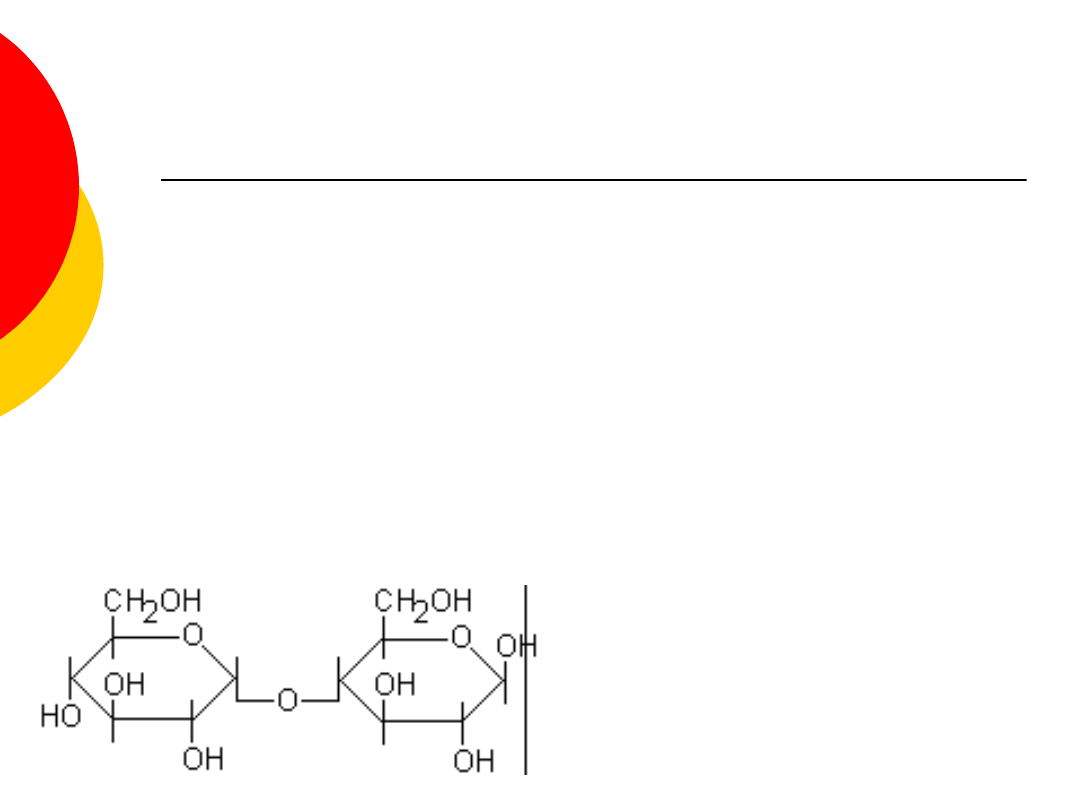
Dwucukry - maltoza
zbudowany z dwóch cząsteczek glukozy,
inaczej cukier słodowy,
fermentuje,
otrzymywany przez hydrolizę skrobi,
stosowany jako środek słodzący,
Występuje w słodzie i pośrednich
produktach przemysłu fermentacyjnego.
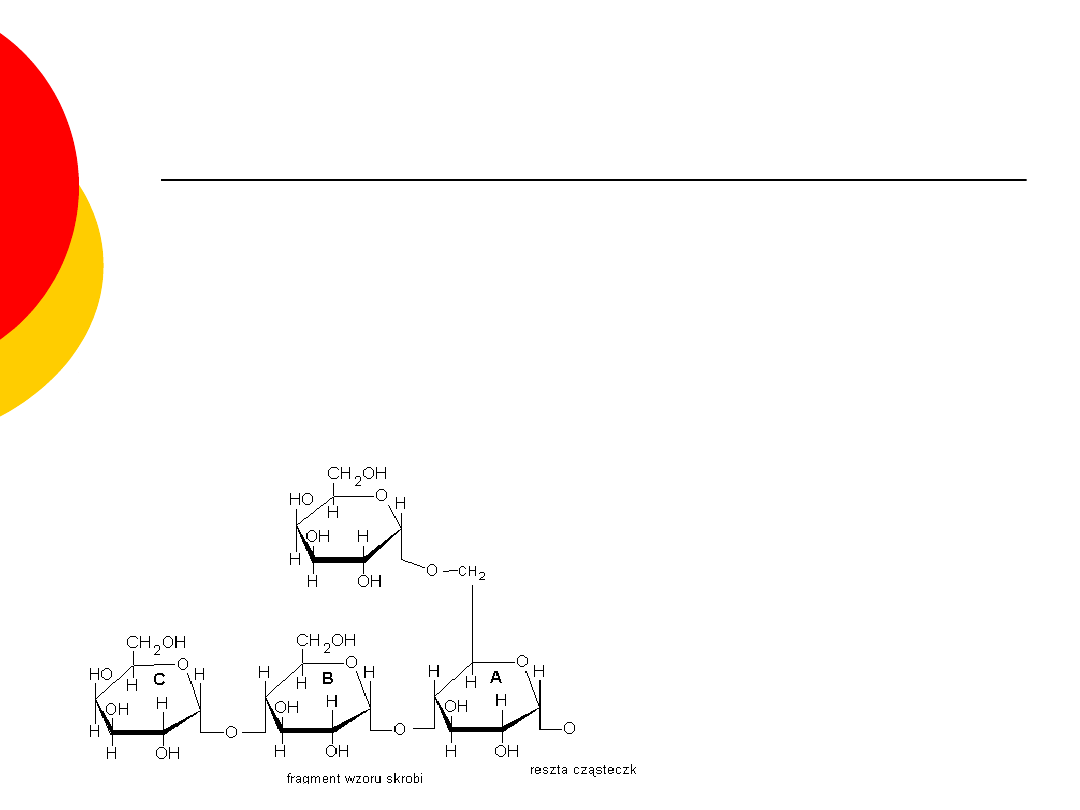
Wielocukry – skrobia
polisacharyd roślinny, składający się wyłącznie z
glukozy, pełniący w roślinach rolę magazynu
energii,
jest głównym węglowodanem w diecie człowieka,
czysta skrobia jest białą, bezpostaciową (nie jest
krystaliczna), amorficzną substancją bez smaku i
zapachu, nierozpuszczalną w zimnej wodzie, z
gorącą tworzącą kleik skrobiowy,
szczególnie bogate w skrobię są ziarna zbóż i bulwy
ziemniaka, a także (choć mniej) kolby kukurydzy,

Doświadczenie skrobi z jodem
Wykorzystany sprzęt laboratoryjny:
Probówki
Zlewka
Palnik
Potrzebne odczynniki:
Roztwór jodu, 1g jodu i 2g jodku potasu w
15cm3
Skrobia - (C6H10O5)n
Przebieg doświadczenia:
Dodanie roztworu jodu do roztworu skrobi
Ogrzanie mieszaniny
Ponowne ochłodzenie mieszaniny

Obserwacje
Po dodaniu roztworu jodu do
rozcieńczonego roztworu skrobi,
zaobserwowano zmianę zabarwienia na
ciemnogranatowe.
Po podgrzaniu zawartości probówki
zaobserwowano powolne odbarwianie się
roztworu, aż do całkowitego zaniku
ciemnej barwy
W wyniku ponownego ochładzania
do temperatury pokojowej,
zaobserwowano ponowne pojawienie się
ciemnogranatowego zabarwienia.

Wnioski
W temperaturze pokojowej skrobia tworzy z
jodem ciemno zabarwiony związek kompleksowy.
Dzieje się tak dlatego, że łańcuchy skrobi
przyjmują określony kształt umożliwiający
związanie cząsteczek jodu.
W momencie podwyższania temperatury
struktura ta jest zaburzana, a cząsteczki jodu nie
mogą w tych warunkach pozostawać związane
(ciemnogranatowy kompleks rozpada się)
Na skutek ponownego obniżenia
temperatury, łańcuchy skrobi ponownie przyjmują
specyficzną strukturę, umożliwiającą wiązanie się
cząsteczek jodu. Zabarwiony charakterystycznie
kompleks może ponownie się tworzyć.

KONIEC
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
aminy-cukry, Chemia, Liceum, klasa II
aminy amidy izoptyczna, Chemia, Liceum, klasa II
KARBOKSYLOWE KWASY, Nieorganiczna, chemia, chemia - liceum, chemia - liceum, lekcja
prawa gazowe, chemia - liceum
weglowod, Chemia, Liceum, klasa II
Napoje dnia codziennego chemia liceum
Budowa atomu testy chemia liceum, chemia liceum
alkohole i fenole, Chemia- liceum
Zad nieorganiczna, Chemia, Liceum, matura, maturz
chemia organiczna benzen, chemia liceum
ESTRY, Nieorganiczna, chemia, chemia - liceum, chemia - liceum, lekcja
ściąga - węglowodory, chemia, liceum, ściągi
kartkowka estr kwas itluszcz, Chemia, Liceum, klasa II
reakcje jonowe lo, Chemia, Liceum, klasa II
Estry kwaów karboksylowych, CHemia LICEUM
sole, Chemia, Liceum, klasa II
Aldehydy, chemia, liceum, notatki
25. Cukry(1), chemia, 0, httpwww.pg.gda.plchemKatedryOrganaindex.phpoption=com content&view=category
więcej podobnych podstron