
CHEMIA OGÓLNA
CHEMIA OGÓLNA
prof. dr hab. MARIA MIKOS - BIELAK
prof. dr hab. MARIA MIKOS - BIELAK

POSTULATY TEORII
POSTULATY TEORII
RUTHERFORDA
RUTHERFORDA
I.
I.
W skład atomu wchodzą ładunki elektryczne:
W skład atomu wchodzą ładunki elektryczne:
dodatnie – protony, obojętne – neutrony i ujemne
dodatnie – protony, obojętne – neutrony i ujemne
– elektrony
– elektrony
II.
II.
Elektrony mają znikomo małą masę 1/1837 masy
Elektrony mają znikomo małą masę 1/1837 masy
protonu
protonu
III.
III.
Protony i neutrony znajdują się w jądrze, którego
Protony i neutrony znajdują się w jądrze, którego
średnica 10
średnica 10
-13
-13
cm, tu też skupiona jest cała masa
cm, tu też skupiona jest cała masa
IV.
IV.
Ilość ładunków dodatnich jest charakterystyczna
Ilość ładunków dodatnich jest charakterystyczna
dla każdego pierwiastka i decyduje o jego
dla każdego pierwiastka i decyduje o jego
położeniu w układzie okresowym. Liczbę
położeniu w układzie okresowym. Liczbę
protonów określa liczba porządkowa pierwiastka
protonów określa liczba porządkowa pierwiastka
w układzie okresowym
w układzie okresowym

PLANETARNY MODEL BUDOWY
PLANETARNY MODEL BUDOWY
ATOMU WG. BOHRA
ATOMU WG. BOHRA
1.
1.
Elektrony krążą po orbitach znajdujących się w ściśle
Elektrony krążą po orbitach znajdujących się w ściśle
określonej odległości od jądra
określonej odległości od jądra
2.
2.
Energia własna elektronu zależy od promienia orbity
Energia własna elektronu zależy od promienia orbity
– im większy promień tym wyższa energia elektronów
– im większy promień tym wyższa energia elektronów
3.
3.
Elektrony krążące po torach stacjonarnych nie
Elektrony krążące po torach stacjonarnych nie
emitują i nie pochłaniają energii
emitują i nie pochłaniają energii
4.
4.
Pochłonięta z zewnątrz energia przesuwa elektron na
Pochłonięta z zewnątrz energia przesuwa elektron na
orbitę dalszą od jądra a atom pierwiastka przechodzi
orbitę dalszą od jądra a atom pierwiastka przechodzi
w stan wzbudzony
w stan wzbudzony
5.
5.
Pochłonięcie przez elektron dużej ilości energii
Pochłonięcie przez elektron dużej ilości energii
powoduje jego wybicie poza obręb oddziaływania
powoduje jego wybicie poza obręb oddziaływania
jądra – powstaje kation
jądra – powstaje kation

TRWAŁOŚĆ JĄDRA
TRWAŁOŚĆ JĄDRA
I.
I.
DEFEKT MASY
DEFEKT MASY
.
,
rzecz
e
n
p
M
M
M
Dla Helu
Δ M
He
= [2 ∙ 1,0078 + 2 ∙1,0086] – 4,0015 = 0,0314 D
Dla Fluoru
9
F M
rzecz.
= 18,9984
Δ M
F
= [ 9 ∙ 1,0078 + 9 ∙1,0086 + 9 ∙ 1/1840 D] –
18,9984
Δ M
F
= 0,1596 D

Po przeliczeniu na energię
Po przeliczeniu na energię
ΔM
ΔM
He
He
= 0,0314 ∙ 931,5 MeV = 29,25 MeV
= 0,0314 ∙ 931,5 MeV = 29,25 MeV
ΔM
ΔM
F
F
= 0,1596 ∙ 931,5 MeV = 148,7 MeV
= 0,1596 ∙ 931,5 MeV = 148,7 MeV
II. EFEKT UPAKOWANIA JĄDRA
f = ΔM / A
określa wielkość defektu masy na jeden nukleon

REGUŁY TRWAŁOŚCI JĄDRA
REGUŁY TRWAŁOŚCI JĄDRA
HARKINSA
HARKINSA
1.
1.
Żadne zwykłe jądro z wyjątkiem wodoru nie zawiera
Żadne zwykłe jądro z wyjątkiem wodoru nie zawiera
mniej „n” niż „p” , stosunek n/p nie przekracza 1,6
mniej „n” niż „p” , stosunek n/p nie przekracza 1,6
2.
2.
Pierwiastki o parzystych liczbach atomowych są
Pierwiastki o parzystych liczbach atomowych są
trwalsze, mają więcej izotopów i występują częściej
trwalsze, mają więcej izotopów i występują częściej
3.
3.
Pierwiastki o parzystej liczbie „n” są trwalsze od
Pierwiastki o parzystej liczbie „n” są trwalsze od
pierwiastków z nieparzystą liczbą „n”
pierwiastków z nieparzystą liczbą „n”
4.
4.
Bardzo stabilne są jądra w których liczba protonów
Bardzo stabilne są jądra w których liczba protonów
lub neutronów osiąga wartość liczb magicznych : 2,
lub neutronów osiąga wartość liczb magicznych : 2,
8, 20, 28, 50, 82, 126
8, 20, 28, 50, 82, 126
5.
5.
Odkryto: 267 trwałych jąder i ~1200 naturalnych
Odkryto: 267 trwałych jąder i ~1200 naturalnych
lub sztucznych jąder nietrwałych
lub sztucznych jąder nietrwałych

Największe efekty upakowania mają pierwiastki od 30
Największe efekty upakowania mają pierwiastki od 30
do 63
do 63
III. Najtrwalsze jądra mają stosunek:
1,0 < n/p < 1,2 TRWAŁE
1,2 < n/p < 1,4 NIETRWAŁE
1,4 < n/p < 1,6 PROMIENIOTWÓRCZE

NIETRWAŁOŚĆ JĄDRA
NIETRWAŁOŚĆ JĄDRA
I. n>p
I. n>p
no
antyneutri
p
n
1
1
1
0
S
P
32
16
32
15
Masa nie ulega zmianie

II. n<p
II. n<p
a)
a)
b)
b)
n
p
1
0
1
1
emisja
pozytonu
B
C
11
5
11
6
wychwyt elektronów z
powłoki K
n
e
p
1
0
1
1
Li
e
Be
7
3
7
4
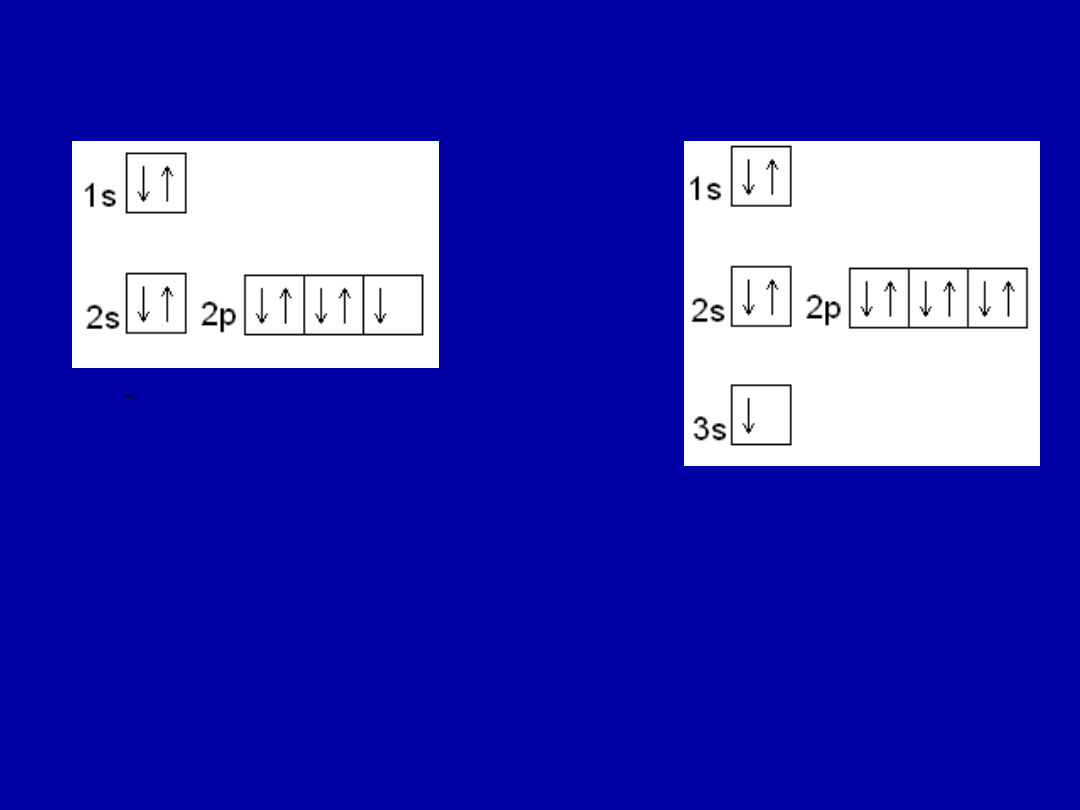
POZAJĄDROWA
POZAJĄDROWA
BUDOWA
BUDOWA
ATOMU
ATOMU
Powłoki elektronowe zajmują przestrzeń 10
Powłoki elektronowe zajmują przestrzeń 10
5
5
razy większą
razy większą
od jądra. Ich średnica wynosi 10
od jądra. Ich średnica wynosi 10
-8
-8
cm.
cm.
LICZBY KWANTOWE
LICZBY KWANTOWE
I.
I.
Główna „n”
Główna „n”
– określa poziom energetyczny .
– określa poziom energetyczny .
Przyjmuje wartości liczb całkowitych:
Przyjmuje wartości liczb całkowitych:
1 < n ≤ 7
1 < n ≤ 7
w układzie okresowym równa jest numerowi okresu.
w układzie okresowym równa jest numerowi okresu.

II.
II.
Poboczna liczba kwantowa „l” – określa podpoziom i
rodzaj orbitalu. Przyjmuje wartości:
0 ≤ l ≤ n – 1
podpoziomy
podpoziomy
s
s
l = 0
l = 0
orbitale
orbitale
s – kulisty
s – kulisty
p
p
l = 1
l = 1
p – hantla
p – hantla
d
d
l = 2
l = 2
d – podwójna
d – podwójna
hantla
hantla
f
f
l = 3
l = 3
f – potrójna hantla
f – potrójna hantla
dalsze nieokreślone

III.
III.
Magnetyczna liczba kwantowa „m” – określa zmianę
stanu energetycznego elektronu spowodowanego
skręceniem płaszczyzny orbitalu elektronowego pod
wpływem pola magnetycznego.
n =
1
l = 0
(s)
m = 0 (1
orbital s)
n =
2
l = 0
(s)
l = 1
(p)
m = 0 (1
orbital s)
m = -1
m = 0 (3
orbitale p)
m = +1
n =
3
l = 0
(s)
l = 1
(p)
l = 2
(d)
m = 0 (1
orbital s)
m = -1
m = 0 (3
orbitale p)
m = +1
m = - 2
m = - 1
m = 0 (5
orbitali d)
m = 1
m = 2

IV.
IV.
Liczba kwantowa spinu – określa kierunek
obrotu
e
wokół własnej osi, przyjmuje wartości:
- ½ = s = + ½ (zgodny ze wskazówkami
zegara)
Pojemność orbitali, podpoziomów i poziomów
Orbital: część przestrzeni poza jądrem określona 3
liczbami kwantowymi: n, l, m – każdy orbital może
mieć maksymalnie 2
e
o różnych
spinach.

Podpoziom: określają dwie liczby kwantowe „n” i „l”
Poziom: określa tylko „n”

Pojemność orbitali podpoziomów i poziomów
Pojemność orbitali podpoziomów i poziomów
Orbital:
Orbital:
część przestrzeni o określonym kształcie,
część przestrzeni o określonym kształcie,
opisany przy pomocy trzech liczb kwantowych – n, l, m.
opisany przy pomocy trzech liczb kwantowych – n, l, m.
Każdy orbital
Każdy orbital
mieści dwa elektrony o przeciwnych
mieści dwa elektrony o przeciwnych
spinach.
spinach.
Pojemność podpoziomów:
Pojemność podpoziomów:

Pojemność poziomów
Pojemność poziomów
Przedstawienie zapisu i orbitali
Przedstawienie zapisu i orbitali
e
Orbital s Orbitale p
Orbitale d Orbitale f
np.
np.
9
9
F
F
11
11
Na
Na
lub 1s
2
2s
2
2p
5
lub 1s
2
2s
2
2p
6
3s
1
„F” – ma 2 powłoki wiec leży w 2 okresie, na ostatniej
powłoce ma
2 elektrony + 5 elektronów = 7 elektronów - VII
grupa
„Na” – 3 powłoki = 3 okres, 1 elektron na ostatniej
powłoce –
I grupa
e

KOLEJNOŚĆ ZAJMOWANIA ORBITALI I POZIOMÓW
KOLEJNOŚĆ ZAJMOWANIA ORBITALI I POZIOMÓW
ENERGETYCZNYCH
ENERGETYCZNYCH
W stanie podstawowym atomów elektrony zajmują
W stanie podstawowym atomów elektrony zajmują
możliwie najniższe poziomy energetyczne. Dla różnych
możliwie najniższe poziomy energetyczne. Dla różnych
pierwiastków można to przedstawić schematem:
pierwiastków można to przedstawić schematem:

KOLEJNOŚĆ ZAPEŁNIANIA ORBITALI
KOLEJNOŚĆ ZAPEŁNIANIA ORBITALI
ZAKAZ PAULIEGO
ZAKAZ PAULIEGO
W atomie dozwolone są tylko takie stany energetyczne
W atomie dozwolone są tylko takie stany energetyczne
elektronów w których różnią się miedzy sobą
elektronów w których różnią się miedzy sobą
przynajmniej jedną liczbą kwantową
przynajmniej jedną liczbą kwantową
LUB INACZEJ
LUB INACZEJ
W atomie stan elektronu określony czterema liczbami
W atomie stan elektronu określony czterema liczbami
kwantowymi n, l, m, s o konkretnych wartościach tych
kwantowymi n, l, m, s o konkretnych wartościach tych
liczb może być obsadzony tylko przez jeden elektron
liczb może być obsadzony tylko przez jeden elektron
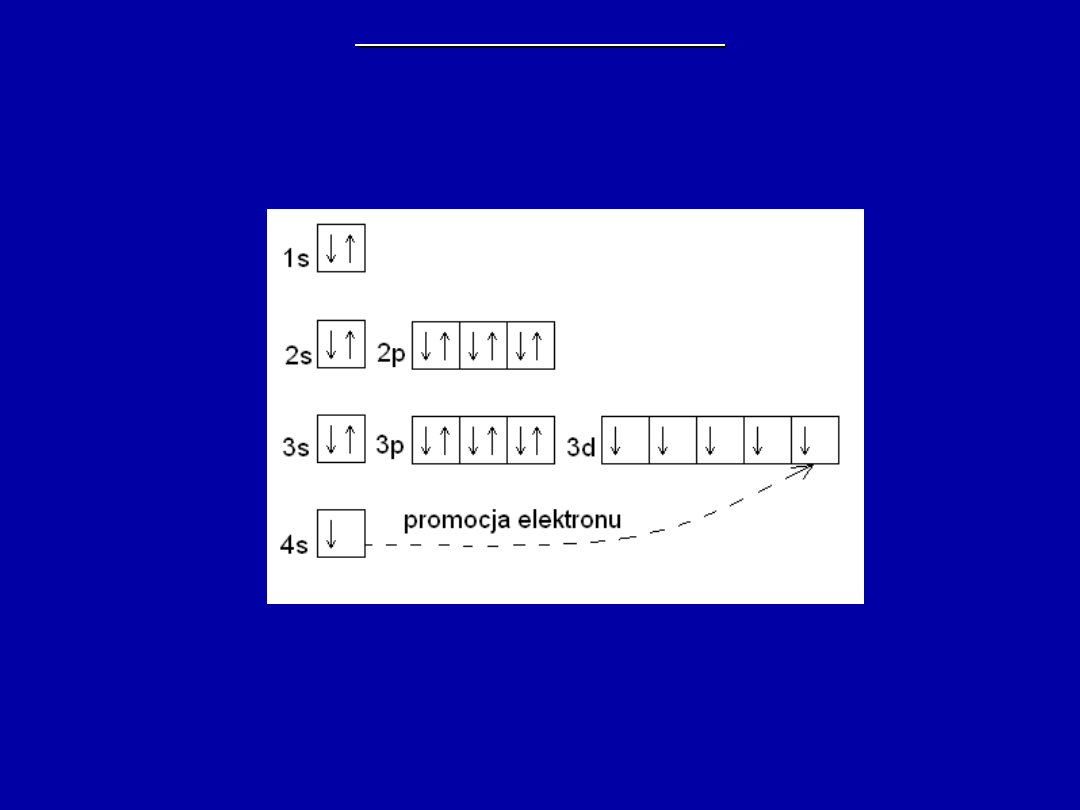
WYJĄTKI OD REGUŁY
WYJĄTKI OD REGUŁY
24Cr 1s
24Cr 1s
2
2
2s
2s
2
2
2p
2p
6
6
3s
3s
2
2
3p
3p
6
6
4s
4s
1
1
3d
3d
5
5
– okres IV, grupa VI B,
– okres IV, grupa VI B,
blok d
blok d

29
29
Cu – okres IV, grupa I B, blok d
Cu – okres IV, grupa I B, blok d
LANTANOWCE od 57La …..5p
6
6s
2
5d
1
4f
…..
AKTYNOWCE od 89Ac …..6p
6
7s
2
6d
1
5f
…..

REGUŁY
REGUŁY
:
:
1.
1.
Elektrony zajmują najpierw ten orbital, dla którego
Elektrony zajmują najpierw ten orbital, dla którego
suma (n+l) jest najmniejsza.
suma (n+l) jest najmniejsza.
2.
2.
Gdy dwa lub więcej orbitali ma jednakową sumę (n+l),
Gdy dwa lub więcej orbitali ma jednakową sumę (n+l),
o porządku ich zajmowania decyduje mniejsza
o porządku ich zajmowania decyduje mniejsza
wartość n.
wartość n.
3.
3.
Orbitale o jednakowych n i l a różnych m nazywamy
Orbitale o jednakowych n i l a różnych m nazywamy
zdegenerowanymi np. orbitale p [p
zdegenerowanymi np. orbitale p [p
x
x
p
p
y
y
p
p
z
z
] (trójkrotnie
] (trójkrotnie
zdegenerowane), d – pięciokrotnie.
zdegenerowane), d – pięciokrotnie.
REGUŁA HUNDA:
W orbitalach zdegenerowanych pary elektronów
powstają dopiero po obsadzeniu każdego orbitalu przez
jeden elektron. Nie sparowane elektrony na
zdegenerowanych orbitalach mają jednakowe spiny.
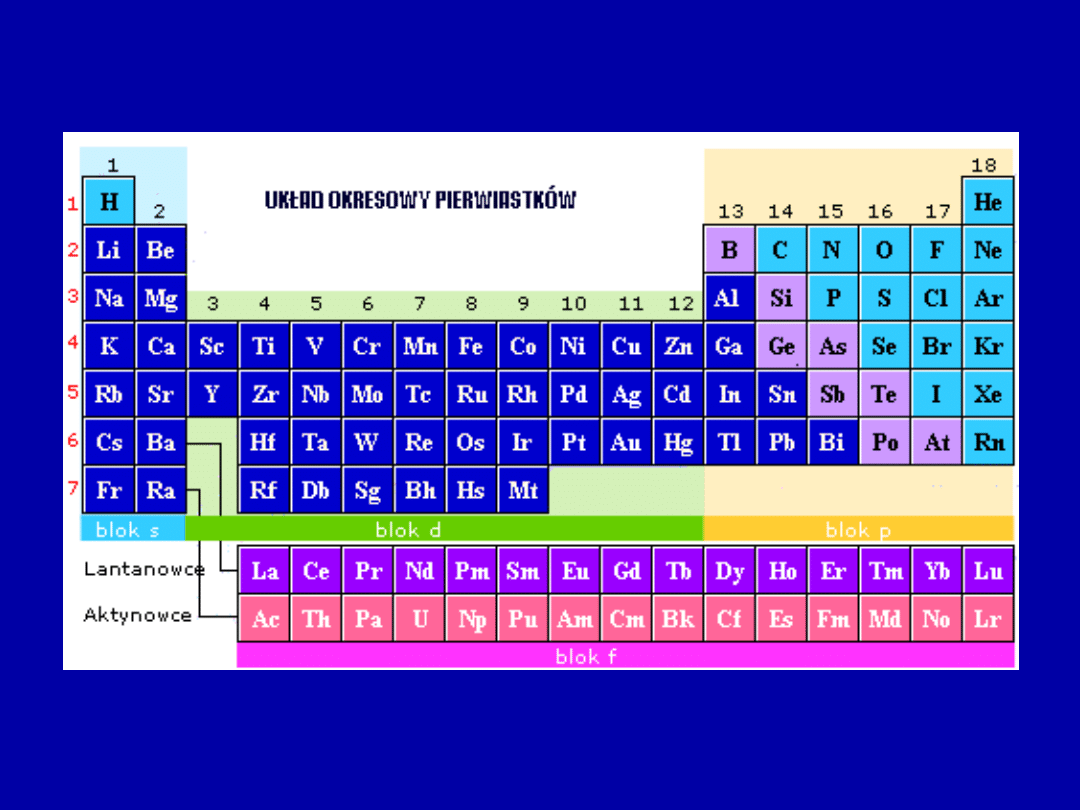

Uporządkowanie
Uporządkowanie
pierwiastków w układzie
pierwiastków w układzie
okresowym
okresowym
Właściwości chemiczne i fizyczne pierwiastka wynikają z liczby i
Właściwości chemiczne i fizyczne pierwiastka wynikają z liczby i
sposobu ich rozmieszczenia na orbitalach.
sposobu ich rozmieszczenia na orbitalach.
Periodyczne powtarzanie cech fizykochemicznych pierwiastków
Periodyczne powtarzanie cech fizykochemicznych pierwiastków
wynika z powtarzającego się podobieństwa rozkładu na
wynika z powtarzającego się podobieństwa rozkładu na
zewnętrznych powłokach.
zewnętrznych powłokach.
e
e

Układ okresowy Thompsona – Bohra
Układ okresowy Thompsona – Bohra
Grupa I A – pierwiastki posiadające 1 elektron na orbitalu
Grupa I A – pierwiastki posiadające 1 elektron na orbitalu
typu s.
typu s.
Grupa II A – pierwiastki posiadające 2 elektrony na
Grupa II A – pierwiastki posiadające 2 elektrony na
orbitalu typu s ostatniej powłoki.
orbitalu typu s ostatniej powłoki.
Obie te grupy należą do bloku s.
Obie te grupy należą do bloku s.
Grupy od III A do VIII A to pierwiastki bloku p.
Grupy od III A do VIII A to pierwiastki bloku p.
Grupy od I B do VIII B – pierwiastki bloku d.
Grupy od I B do VIII B – pierwiastki bloku d.
Pierwiastki rozbudowujące orbitale f należą do bloku f.
Pierwiastki rozbudowujące orbitale f należą do bloku f.

Pionowe kolumny
Pionowe kolumny
– grupy odpowiadają liczbie elektronów
– grupy odpowiadają liczbie elektronów
na ostatniej powłoce.
na ostatniej powłoce.
Poziome szeregi
Poziome szeregi
– okresy odpowiadają liczbie powłok
– okresy odpowiadają liczbie powłok
elektronowych.
elektronowych.
Liczba porządkowa
Liczba porządkowa
= liczbie protonów w jądrze i
= liczbie protonów w jądrze i
elektronów na powłokach.
elektronów na powłokach.
Pierwiastki grup głównych (A)
Pierwiastki grup głównych (A)
– posiadają elektrony
– posiadają elektrony
walencyjne na orbitalach s i p ostatniej powłoki.
walencyjne na orbitalach s i p ostatniej powłoki.
Pierwiastki grup pobocznych (B)
Pierwiastki grup pobocznych (B)
– zwane także
– zwane także
przejściowymi mają elektrony walencyjne na orbitalach
przejściowymi mają elektrony walencyjne na orbitalach
s ostatniej powłoki i na orbitalach d przedostatniej
s ostatniej powłoki i na orbitalach d przedostatniej
powłoki.
powłoki.
Pierwiastki wewnątrzprzejściowe
Pierwiastki wewnątrzprzejściowe
– mają elektrony
– mają elektrony
walencyjne na orbitalach s ostatniej, d
walencyjne na orbitalach s ostatniej, d
1
1
z
z
przedostatniej, oraz f powłoki 3- od końca.
przedostatniej, oraz f powłoki 3- od końca.

Elektroujemność i potencjał jonizacyjny w układzie
Elektroujemność i potencjał jonizacyjny w układzie
okresowym
okresowym
Potencjał jonizacyjny
Potencjał jonizacyjny
– praca jaką należy wykonać, aby
– praca jaką należy wykonać, aby
wynieść elektron poza obręb oddziaływania jądra.
wynieść elektron poza obręb oddziaływania jądra.
W układzie okresowym potencjał jonizacyjny najniższy
W układzie okresowym potencjał jonizacyjny najniższy
posiadają pierwiastki zawierające mało elektronów na
posiadają pierwiastki zawierające mało elektronów na
powłokach ( I, II grupa) i dużo powłok ( VI, VII) – rośnie
powłokach ( I, II grupa) i dużo powłok ( VI, VII) – rośnie
on w układzie okresowym od lewej do prawej i od dołu
on w układzie okresowym od lewej do prawej i od dołu
do góry. Najniższy potencjał jonizacyjny ma Cs.
do góry. Najniższy potencjał jonizacyjny ma Cs.
Powinowactwo elektronowe
Powinowactwo elektronowe
– zdolność przyciągania
– zdolność przyciągania
dodatkowych elektronów na powłokę walencyjną.
dodatkowych elektronów na powłokę walencyjną.

Charakterystyka cząstek
Charakterystyka cząstek
elementarnych
elementarnych
Trwałe
Trwałe
I.Elektrony = negatony
: , β, β-
e
Ładunek jednostkowy ujemny = 1,6 · 10
-19
C
Masa = 1/1837 m
p
lub 0,000548 D
II.Protony:
p
p
1
1
,
Posiadają jednostkowy ładunek dodatni = 1,6 · 10
-19
C
m
p
= 1,0078 D ( jednostki masy atomowej )
n
n
1
0
,
III.Neutrony:
Pozbawione ładunku
m
n
= 1,0086 D

Nietrwałe
Nietrwałe
Lekkie: neutrino, antyneutrino: ładunek k = 0
Pozytony: ładunek + 1,6 · 10
-19
C m =
m
e
Mezony:
,
mm = 0,118 D
Średnie: mezony Π i antymezony m = 0,158
D
ładunek: ± 1,6 · 10
-19
C
Ciężkie: bariony i antybariony
protony, neutrony = nukleony
hiperony
o spinach s = ½ - fermiony
s = liczbie całkowitej –
bozony
Nobel z fizyki 1995
Kwarki – najpóźniej odkryte cząstki elementarne z których
zbudowane są protony i neutrony

Rodzina I górny i dolny
Rodzina I górny i dolny
Rodzina II dziwny i powabny
Rodzina II dziwny i powabny
KWARKI
KWARKI
Rodzina III denny i szczytowy
Rodzina III denny i szczytowy
•
Elektron i neutrino elektr.
•
Mion i neutrino mionowe LEPTONY
•
Taon i neutrino taonowe

PODSTAWOWE DEFINICJE
PODSTAWOWE DEFINICJE
DALTON = jednostka masy atomowej równa 1/12 masy
DALTON = jednostka masy atomowej równa 1/12 masy
izotopu węgla
izotopu węgla
12
12
C
C
Względna masa atomowa
Względna masa atomowa
– liczba określająca ile razy
– liczba określająca ile razy
masa atomowa danego pierwiastka jest większa od
masa atomowa danego pierwiastka jest większa od
1/12 masy
1/12 masy
12
12
C
C
Liczba masowa
Liczba masowa
„A” – określa sumę protonów i
„A” – określa sumę protonów i
neutronów w jądrze
neutronów w jądrze
Liczba atomowa
Liczba atomowa
„Z” – określa liczbę protonów w jądrze
„Z” – określa liczbę protonów w jądrze
Pierwiastek chemiczny
Pierwiastek chemiczny
– rodzaj materii której wszystkie
– rodzaj materii której wszystkie
atomy mają jednakową liczbę atomową
atomy mają jednakową liczbę atomową

Izotopy
Izotopy
: atomy których jądra posiadają jednakową
: atomy których jądra posiadają jednakową
liczbę protonów a różnią się liczbą neutronów
liczbę protonów a różnią się liczbą neutronów
np.
H
H
H
3
1
2
1
1
1
,
,
i
C
C
14
6
12
6
,

STANDARDOWY MODEL
STANDARDOWY MODEL
BUDOWY MATERII U PROGU
BUDOWY MATERII U PROGU
XXI WIEKU
XXI WIEKU
Wszystko co istnieje składa się z kwarków które
Wszystko co istnieje składa się z kwarków które
zawsze występują w parach z leptonami. Naruszenie
zawsze występują w parach z leptonami. Naruszenie
symetrii leptonów z kwarkami burzy poprawność
symetrii leptonów z kwarkami burzy poprawność
matematyczną modelu standardowego.
matematyczną modelu standardowego.
- Kwark w języku niemieckim to głupstwo, drobnostka
- Kwark w języku niemieckim to głupstwo, drobnostka

Kwarki i leptony zgrupowane są w 3 rodzinach:
Kwarki i leptony zgrupowane są w 3 rodzinach:
I
I
Rodzina to kwarki:
Rodzina to kwarki:
dolny (d) i górny (u)
dolny (d) i górny (u)
oraz leptony:
oraz leptony:
elektron (e) i neutrino elektronowe
elektron (e) i neutrino elektronowe
(
(
ν
ν
e
e
)
)
Kwarki obdarzone są ładunkiem o wartości 1/3 lub 2/3
Kwarki obdarzone są ładunkiem o wartości 1/3 lub 2/3
ładunku elektronu.
ładunku elektronu.
Bardzo trudno było odkryć neutrino a przy jego braku
Bardzo trudno było odkryć neutrino a przy jego braku
trudno było uzasadnić zasadę
trudno było uzasadnić zasadę
zachowania energii
zachowania energii
, gdyż
, gdyż
podczas rozpadu promieniotwórczego część energii
podczas rozpadu promieniotwórczego część energii
ginęła.
ginęła.
Dopiero odkrycie neutrina, które z olbrzymią łatwością
Dopiero odkrycie neutrina, które z olbrzymią łatwością
przenika materię unosząc brakującą część energii
przenika materię unosząc brakującą część energii
pozwoliło na potwierdzenie tej zasady. Fermi odkrył
pozwoliło na potwierdzenie tej zasady. Fermi odkrył
neutrino w 1931 roku, a doświadczalne jego istnienie
neutrino w 1931 roku, a doświadczalne jego istnienie
potwierdzono 25 lat później.
potwierdzono 25 lat później.
Tryliony neutrin wypełniają kosmos a ich miliardy w każdej
sekundzie przenikają nasze ciało – ale złapać ich było
bardzo trudno – dlatego aż 25 lat trzeba było czekać na
potwierdzenie ich istnienia.

II rodzina to kwarki
II rodzina to kwarki
: dziwny (s) i powabny (c)
: dziwny (s) i powabny (c)
oraz leptony
oraz leptony
: mion (
: mion (
μ
μ
) i neutrino mionowe (
) i neutrino mionowe (
ν
ν
μ
μ
)
)
Te cząstki zaliczane do cięższych można otrzymać w
Te cząstki zaliczane do cięższych można otrzymać w
akceleratorze, ale natychmiast po wyprodukowaniu
akceleratorze, ale natychmiast po wyprodukowaniu
rozpadają się.
rozpadają się.
Istnieje teoria, że powstały one po wielkim wybuchu, który
Istnieje teoria, że powstały one po wielkim wybuchu, który
zapoczątkował istnienie wszechświata. Rozpadały się
zapoczątkował istnienie wszechświata. Rozpadały się
one w miarę jego chłodzenia i rozszerzania – do końca
one w miarę jego chłodzenia i rozszerzania – do końca
jednak nie określono roli jaką spełniła ta rodzina.
jednak nie określono roli jaką spełniła ta rodzina.
W połowie lat 70-tych XX wieku Martin Perl odkrył nową
W połowie lat 70-tych XX wieku Martin Perl odkrył nową
cząstkę Taon – który stanowił zaczątek nowej rodziny.
cząstkę Taon – który stanowił zaczątek nowej rodziny.
III rodzina to kwarki
III rodzina to kwarki
: denny (b) i szczytowy (t) – top
: denny (b) i szczytowy (t) – top
oraz leptony
oraz leptony
: taon (
: taon (
τ
τ
) i neutrino (
) i neutrino (
ν
ν
τ
τ
)
)
Ostatnia odkryta cząstka z tej rodziny to kwark szczytowy
Ostatnia odkryta cząstka z tej rodziny to kwark szczytowy
– top z roku 1994
– top z roku 1994

Czy rodzin jest więcej ?
Czy rodzin jest więcej ?
Na poziomie obecnej wiedzy – nie.
Na poziomie obecnej wiedzy – nie.
Ale – być może budowa potężniejszych akceleratorów
Ale – być może budowa potężniejszych akceleratorów
zbliżonych parametrami do piekła bardzo wczesnego
zbliżonych parametrami do piekła bardzo wczesnego
wszechświata pozwoli na wykrycie hipotetycznych w progu
wszechświata pozwoli na wykrycie hipotetycznych w progu
XXI wieku cząstek –
XXI wieku cząstek –
Preonów
Preonów
z których byłyby zbudowane
z których byłyby zbudowane
kwarki.
kwarki.
-
W nauce może się jeszcze wiele zdarzyć
W nauce może się jeszcze wiele zdarzyć
Obok kwarków istnieje 8 gluonów (g)
Obok kwarków istnieje 8 gluonów (g)
- są to kleje, które wiążą kwarki w
- są to kleje, które wiążą kwarki w
Hadrony – stanowiące
Hadrony – stanowiące
obecnie granicę rozwijalności materii
obecnie granicę rozwijalności materii
.
.
Kwarki i glony to jak dotąd składniki doskonałe, które nie
Kwarki i glony to jak dotąd składniki doskonałe, które nie
istnieją samoistnie ale powiązane ze sobą.
istnieją samoistnie ale powiązane ze sobą.

Światem cząstek elementarnych rządzą
Światem cząstek elementarnych rządzą
4 typy oddziaływań:
4 typy oddziaływań:
- silne
- silne
- słabe
- słabe
- elektromagnetyczne
- elektromagnetyczne
- grawitacyjne (ultrasłabe)
- grawitacyjne (ultrasłabe)
Kwarki
Kwarki
podlegają oddziaływaniom: silnym, słabym i
podlegają oddziaływaniom: silnym, słabym i
elektromagnetycznym
elektromagnetycznym
Leptony
Leptony
– elektromagnetycznym i słabym
– elektromagnetycznym i słabym
Neutrina
Neutrina
– tylko słabym
– tylko słabym
Ultrasłabym oddziaływaniom grawitacyjnym podlegają
Ultrasłabym oddziaływaniom grawitacyjnym podlegają
wszystkie cząstki materii, są to zawsze przyciągające
wszystkie cząstki materii, są to zawsze przyciągające
oddziaływania.
oddziaływania.

Nośniki oddziaływań:
Nośniki oddziaływań:
Silnych – gluony (g)
Silnych – gluony (g)
Elektromagnetycznych – fotony (
Elektromagnetycznych – fotony (
γ
γ
)
)
Słabych – bozony (w i z)
Słabych – bozony (w i z)
Model standardowy opisuje całość zjawisk mikroświata.
Model standardowy opisuje całość zjawisk mikroświata.
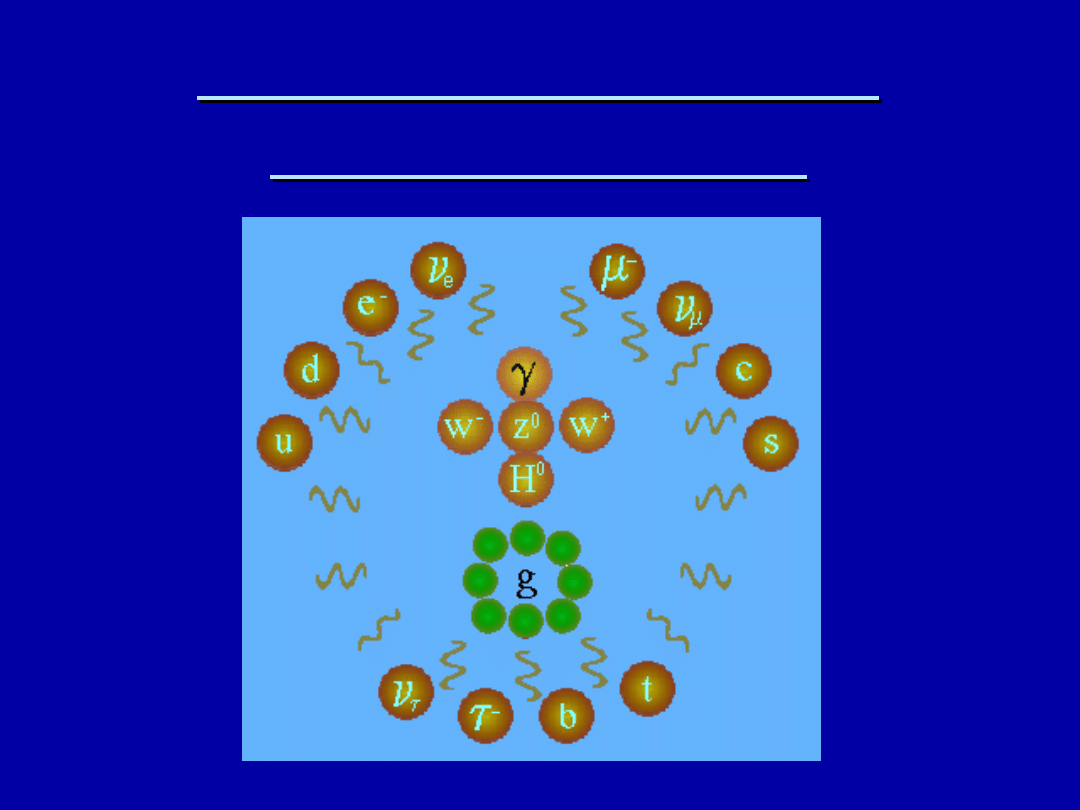
WSZYSTKIE CZĄSTKI
WSZYSTKIE CZĄSTKI
WSZECHŚWIATA
WSZECHŚWIATA

Te 25 cząstek elementarnych (oraz ich antycząstki, nie
Te 25 cząstek elementarnych (oraz ich antycząstki, nie
pokazane na rysunku) tworzy cały Wszechświat.
pokazane na rysunku) tworzy cały Wszechświat.
Pozwalają wyjaśnić wszystkie zachodzące w nim
Pozwalają wyjaśnić wszystkie zachodzące w nim
zdarzenia. Materia składa się z kwarków (u – górny, d –
zdarzenia. Materia składa się z kwarków (u – górny, d –
dolny, c – powabny, s – dziwny, b – denny, t- szczytowy)
dolny, c – powabny, s – dziwny, b – denny, t- szczytowy)
i leptonów (e – elektron,
i leptonów (e – elektron,
ν
ν
e
e
– neutrino elektronowe,
– neutrino elektronowe,
μ
μ
–
–
mion,
mion,
ν
ν
μ
μ
– neutrino mionowe,
– neutrino mionowe,
τ
τ
– taon,
– taon,
ν
ν
τ
τ
– neutrino
– neutrino
taonowe), które łączą się w trzy rodziny.
taonowe), które łączą się w trzy rodziny.
Na materię działają różne siły, które sprawiają że świat
Na materię działają różne siły, które sprawiają że świat
jest pełen zjawisk: elektrycznych, magnetycznych,
jest pełen zjawisk: elektrycznych, magnetycznych,
promieniotwórczych, jądrowych. Pola tych sił składają
promieniotwórczych, jądrowych. Pola tych sił składają
się z kwantów, czyli też cząstek. To te wewnątrz
się z kwantów, czyli też cząstek. To te wewnątrz
rysunku, czyli
rysunku, czyli
γ
γ
– foton, W
– foton, W
+
+
, W
, W
-
-
, Z
, Z
0
0
– bozony
– bozony
pośredniczące, H
pośredniczące, H
0
0
– cząstka Higgsa, której jeszcze nie
– cząstka Higgsa, której jeszcze nie
znaleziono, g – osiem glonów (różniące się ładunkiem
znaleziono, g – osiem glonów (różniące się ładunkiem
silnym, czyli jak mówią fizycy – kolorem).
silnym, czyli jak mówią fizycy – kolorem).

Nagrodę Nobla w dziedzinie fizyki w 1999 r. otrzymali
Nagrodę Nobla w dziedzinie fizyki w 1999 r. otrzymali
dwaj Holendrzy: Gerarduus’t Hooft prof. W Ultrechcie i
dwaj Holendrzy: Gerarduus’t Hooft prof. W Ultrechcie i
Martinus J. G. Veltman – emerytowany prof. z Bilthoven.
Martinus J. G. Veltman – emerytowany prof. z Bilthoven.
Dzięki ich badaniom (obliczeniom) przetestowano model
Dzięki ich badaniom (obliczeniom) przetestowano model
standardowy atomu w wielu eksperymentach i
standardowy atomu w wielu eksperymentach i
stwierdzono że opisuje on niezwykle dokładnie to co
stwierdzono że opisuje on niezwykle dokładnie to co
dzieje się rzeczywiście na poziomie mikroświata. Wielkości
dzieje się rzeczywiście na poziomie mikroświata. Wielkości
oddziaływań mikrocząstek między sobą – wyliczone przez
oddziaływań mikrocząstek między sobą – wyliczone przez
tych uczonych zgadzają się co do promili z danymi
tych uczonych zgadzają się co do promili z danymi
doświadczalnymi, które można było przeprowadzić w
doświadczalnymi, które można było przeprowadzić w
akceleratorach cząstek elementarnych, które rozróżniają
akceleratorach cząstek elementarnych, które rozróżniają
struktury o rozmiarach około 10
struktury o rozmiarach około 10
-16
-16
cm czyli 100 milionów
cm czyli 100 milionów
razy mniejsze od rozmiarów atomów (10
razy mniejsze od rozmiarów atomów (10
-8
-8
cm).
cm).
Wydzielono dwie grupy cząstek elementarnych:
Wydzielono dwie grupy cząstek elementarnych:
Fermiony = leptony i kwarki
Fermiony = leptony i kwarki
Bozony
Bozony

Leptony
Leptony
: elektron, mion i taon, oraz ich neutrina „czują”
: elektron, mion i taon, oraz ich neutrina „czują”
oddziaływania elektromagnetyczne i słabe oddziaływania
oddziaływania elektromagnetyczne i słabe oddziaływania
które odpowiedzialne są za reakcje jądrowe.
które odpowiedzialne są za reakcje jądrowe.
Kwarki
Kwarki
: za pośrednictwem oddziaływań silnych
: za pośrednictwem oddziaływań silnych
dominujących w jądrach atomowych zapewniają im
dominujących w jądrach atomowych zapewniają im
stabilność
stabilność
Leptonów i kwarków jest dokładnie tyle samo i istnieje
Leptonów i kwarków jest dokładnie tyle samo i istnieje
między nimi jednoznaczna odpowiedniość
między nimi jednoznaczna odpowiedniość
Fermiony to materia
Fermiony to materia
Bozony
Bozony
odpowiadają za różnorodne oddziaływania, są
odpowiadają za różnorodne oddziaływania, są
cząstkami „przenoszącymi oddziaływania” elementarne
cząstkami „przenoszącymi oddziaływania” elementarne
Bozony W i Z są nośnikami oddziaływań słabych a 8
Bozony W i Z są nośnikami oddziaływań słabych a 8
gluonów g – przenoszą oddziaływania silne. Foton
gluonów g – przenoszą oddziaływania silne. Foton
γ
γ
–
–
przenosi elektromagnetyczne oddziaływania a nie
przenosi elektromagnetyczne oddziaływania a nie
zaobserwowany do tej pory
zaobserwowany do tej pory
grawiton jest nośnikiem sił
grawiton jest nośnikiem sił
grawitacyjnych ultra słabych
grawitacyjnych ultra słabych
.
.
Źródłem każdego oddziaływania jest ładunek.
Źródłem każdego oddziaływania jest ładunek.
Źródłem
Źródłem
fotonów są ładunki elektryczne
fotonów są ładunki elektryczne
, a ładunki oddziaływań
, a ładunki oddziaływań
słabych i silnych noszą nazwę
słabych i silnych noszą nazwę
zapachu i koloru
zapachu i koloru
.
.

LEPTONY
LEPTONY
ładunek
elektrycz
ny
zapach
masa
[GeV/c
2
]
0
ν
e
< 2 ∙ 10
- 8
neutrino e
-1
e
5,18 ∙ 10
-
4
elektron
0
ν
μ
<2,5 ∙ 10
4
neutrino μ
-1
μ
0,106
mion
0
ν
τ
<3,5 ∙ 10
2
neutrino
taonowe
-1
τ
1,784
taon

KWARKI
KWARKI
ładunek
elektrycz
ny
zapach
masa
[GeV/c
2
]
+2/3
u górny
4 ∙ 10
3
-1/3
d dolny
7 ∙ 10
3
+2/3
c
powab
ny
1,5
-1/3
s dziwny
0,15
+2/3
t
szczyto
wy
78
-1/3
b denny
4,7

Bozon
y
γ
W
-
W
+
Z
0
q
Ładun
ek
0
-1
+1
0
0
Masa
GeV/c
2
0
81
81
92
0

Oddziaływania
Grawitac
yjne
Elektrosłabe
Silne
Odpowiedzia
lne za
stabilność
jądra
Słabe
Elektro
magnetyczne
Działa na:
Energię i
masę
zapach
Ładunek
elektronów
Kolor
Cząstki pośredniczące
Grawiton W
-
Z
0
W
+
ultrasła
be
γ (foton)
g (gluon)
Siła w
porównani
u z
oddziaływa
niami
Elektrycznymi
dwóch
kwarków
„u” w
odległości
10
-18 m
10
41
0.8
1
25
3 ·10
-17 m
10
41
10
4
1
60

JEDNOSTKI
JEDNOSTKI
Zgodnie ze wzorem Einsteina E = mc
Zgodnie ze wzorem Einsteina E = mc
2
2
c - prędkość światła
c - prędkość światła
m = E/c
m = E/c
2
2
1eV – to energia elektronu przyśpieszonego przez różnicę
1eV – to energia elektronu przyśpieszonego przez różnicę
potencjału 1V
potencjału 1V
1GeV (Giga eV) = 10
1GeV (Giga eV) = 10
9
9
V
V
1eV – odpowiada masie 1,78268 · 10
1eV – odpowiada masie 1,78268 · 10
-33
-33
g
g
1GeV = 1,78268 · 10
1GeV = 1,78268 · 10
-33
-33
· 10
· 10
9
9
= 1,78268 · 10
= 1,78268 · 10
-25
-25
g
g
Masa protonu
Masa protonu
w tych jednostkach
w tych jednostkach
2
938
,
0
c
GeV
m
p
a w Daltonach m
p
=
1,0078D

Dzięki pracom Holendrów można było wyliczyć masę
Dzięki pracom Holendrów można było wyliczyć masę
ostatniego kwarka – najcięższego t czyli szczytowego,
ostatniego kwarka – najcięższego t czyli szczytowego,
który odkryto kilkanaście lat później. Jego odkrycie
który odkryto kilkanaście lat później. Jego odkrycie
udowodniło że matematyczny model elektrosłabych
udowodniło że matematyczny model elektrosłabych
oddziaływań poprawnie opisuje rzeczywistość.
oddziaływań poprawnie opisuje rzeczywistość.
Została do wykrycia cząstka Higginsa – która musi
Została do wykrycia cząstka Higginsa – która musi
istnieć. Jest ona prawdopodobnie źródłem masy dla
istnieć. Jest ona prawdopodobnie źródłem masy dla
wszystkich innych cząstek elementarnych.
wszystkich innych cząstek elementarnych.
W 1999 r. nagrodę nobla w dziedzinie chemii otrzymał
W 1999 r. nagrodę nobla w dziedzinie chemii otrzymał
Egipcjanin – Achmed Zewail za konstrukcję aparatu
Egipcjanin – Achmed Zewail za konstrukcję aparatu
fotograficznego w którym czas ekspozycji równy jest
fotograficznego w którym czas ekspozycji równy jest
jednej femtosekundzie = 10
jednej femtosekundzie = 10
-15
-15
s. Odpowiada to czasowi
s. Odpowiada to czasowi
łączenia się cząstek podczas reakcji chemicznych .
łączenia się cząstek podczas reakcji chemicznych .
Pozwala krok po kroku śledzić ruchy atomów.
Pozwala krok po kroku śledzić ruchy atomów.

TYPY WIĄZAŃ CHEMICZNYCH
TYPY WIĄZAŃ CHEMICZNYCH
1.
1.
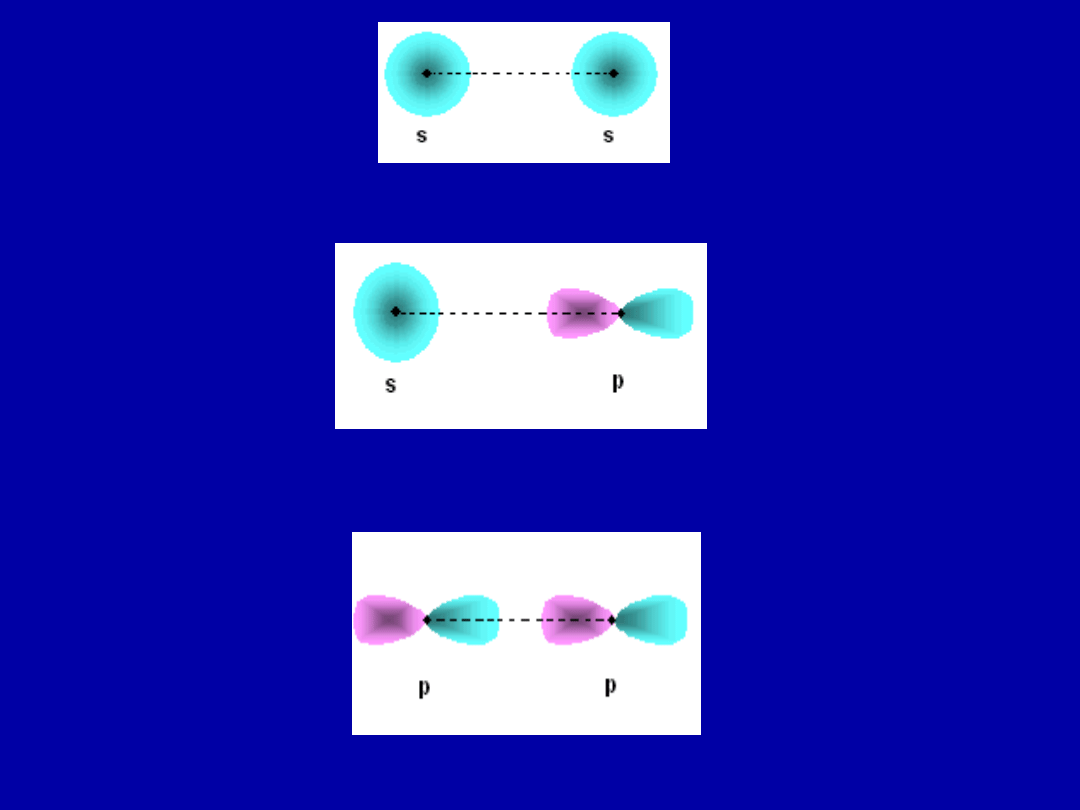
Wiązanie atomowe
Wiązanie atomowe
– polega na tworzeniu
– polega na tworzeniu
wspólnych par elektronowych pochodzących od
wspólnych par elektronowych pochodzących od
obu związanych atomów – prowadzi to do
obu związanych atomów – prowadzi to do
zwiększenia gęstości elektronowej pomiędzy
zwiększenia gęstości elektronowej pomiędzy
dwoma jądrami atomów które uczestniczą w
dwoma jądrami atomów które uczestniczą w
tworzeniu wiązania. Wiążące się atomy dążą do
tworzeniu wiązania. Wiążące się atomy dążą do
osiągnięcia minimum energii – czemu odpowiada
osiągnięcia minimum energii – czemu odpowiada
maksymalne nakładanie się ich orbitali wiążących.
maksymalne nakładanie się ich orbitali wiążących.
Rozkład wykazuje obrotową symetrię wokół linii
Rozkład wykazuje obrotową symetrię wokół linii
łączącej oba jądra. Wiązanie wykazujące taką
łączącej oba jądra. Wiązanie wykazujące taką
symetrię nazywa się σ.
symetrię nazywa się σ.
e
H H
H O
H Cl
O O

Wiązania atomowe można podzielic na :
Wiązania atomowe można podzielic na :
- atomowe niespolaryzowane – gdy wspólne pary
- atomowe niespolaryzowane – gdy wspólne pary
znajdują się w połowie długości wiązania
znajdują się w połowie długości wiązania
- atomowe spolaryzowane – wspólne pary przesunięte są
- atomowe spolaryzowane – wspólne pary przesunięte są
w stronę pierwiastka któremu mniej brakuje do oktetu –
w stronę pierwiastka któremu mniej brakuje do oktetu –
bardziej elektroujemnego np. H – Cl wspólna para
bardziej elektroujemnego np. H – Cl wspólna para
elektronowa przesunięta jest w stronę chloru
elektronowa przesunięta jest w stronę chloru
Wiązania atomowe niespolaryzowane
Wiązania atomowe niespolaryzowane
Powstają wtedy gdy różnica elektroujemności 0 ≤ ΔE ≤ 0,4
Powstają wtedy gdy różnica elektroujemności 0 ≤ ΔE ≤ 0,4
Spolaryzowane: 0,4 < ΔE ≤
Spolaryzowane: 0,4 < ΔE ≤
1,7
1,7
Jonowe: 1,7 < ΔE ≤
Jonowe: 1,7 < ΔE ≤
3,3
3,3
e
e

2.
2.
Wiązania jonowe
Wiązania jonowe
Powstają pomiędzy pierwiastkami leżącymi w układzie
Powstają pomiędzy pierwiastkami leżącymi w układzie
okresowym w skrajnych grupach I, II – VI, VII
okresowym w skrajnych grupach I, II – VI, VII
Polegają na oddaniu przez pierwiastki mniej
Polegają na oddaniu przez pierwiastki mniej
elektroujemne (które wtedy przejdą w jony dodatnie)
elektroujemne (które wtedy przejdą w jony dodatnie)
pierwiastkom bardziej elektroujemnym (które tworzą
pierwiastkom bardziej elektroujemnym (które tworzą
jony ujemne)
jony ujemne)
e
Na
0
– 1 Na
+
E = 0,7
ΔE = 2,1
Cl
0
+ 1 Cl
-
E = 2,8
Wzajemne oddziaływanie utworzonych jonów nazywa się
wiązaniem jonowym
e
e
3.
3.
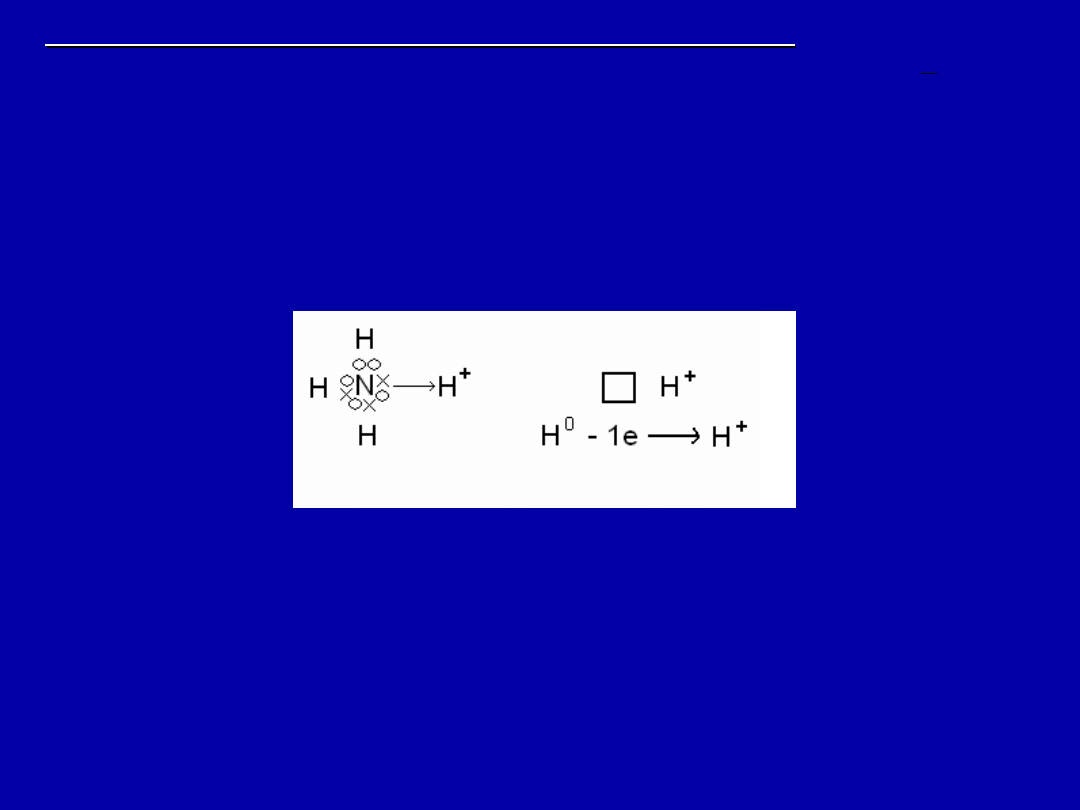
Wiązanie semipolarne lub koordynacyjne
Wiązanie semipolarne lub koordynacyjne
Podobne jest do wiązania atomowego ale wiążąca para
Podobne jest do wiązania atomowego ale wiążąca para
pochodzi od jednego pierwiastka (donora) a obierana
pochodzi od jednego pierwiastka (donora) a obierana
jest przez akceptor który ma pusty orbital walencyjny
jest przez akceptor który ma pusty orbital walencyjny
e
Numer
grupy
A
Liczba e
walencyjnyc
h
B = 8 - A
Liczba wiązań
atomowych
e = A –
B
Liczba
wolnych
e
D = e /2
Liczba
wiązań
koordynacyjny
ch
IV
C, Si
4
4
0
0
V
N, P
5
3
2
1
VI
S, Cr
6
2
4
2
VII
Cl, Br, J
Mn
7
1
konieczne
6
3
możliwe

WIĄZANIE METALICZNE
WIĄZANIE METALICZNE
Występuje pomiędzy atomami metalu w stanie stałym.
Różni się od pozostałych wiązań istnieniem swobodnych
niezwiązanych z pojedynczymi atomami, a przynależnych
wszystkim atomom metalu. W sieci krystalicznej każdy
atom metalu otoczony jest większą liczbą takich samych
atomów (najczęściej 8 – 12).
Węzły sieci przestrzennej metalu osadzone są przez
dodatnio naładowane rdzenie, zwane też zrębami
atomowymi. Ich walencyjne tworzą gaz elektronowy.
Metale w stanie gazowym nie wykazują cech
charakteryzujących je w stanie stałym i ciekłym. Gazowy
metal jest przeźroczysty, nie przewodzi prądu
elektrycznego w sposób metaliczny, a wymaga
uprzedniego zjonizowania tak jak inne gazy. W metalach
w postaci pary istnieją związki dwuatomowe z typowymi
wiązaniami atomowymi – każdy atom przekazuje do tego
wiązania jeden i jeden orbital.
e
e
e
WŁASNOŚCI METALI - WYNIKAJĄCE Z OBECNOŚCI WIĄZANIA
WŁASNOŚCI METALI - WYNIKAJĄCE Z OBECNOŚCI WIĄZANIA
METALICZNEGO
METALICZNEGO
1.
1.
Dobre przewodnictwo cieplne i elektryczne.
Dobre przewodnictwo cieplne i elektryczne.
2.
2.
Połysk metaliczny.
Połysk metaliczny.
3.
3.
Plastyczność – klepalność, kowalność.
Plastyczność – klepalność, kowalność.
4.
4.
Malejące przewodnictwo elektryczne przy
Malejące przewodnictwo elektryczne przy
podgrzaniu.
podgrzaniu.
5.
5.
Metale oddające więcej elektronów walencyjnych
Metale oddające więcej elektronów walencyjnych
do tworzenia sieci krystalicznej mają strukturę
do tworzenia sieci krystalicznej mają strukturę
krystaliczną twardszą
krystaliczną twardszą
-
-
potasowce z jednym elektronem walencyjnym tworzą
potasowce z jednym elektronem walencyjnym tworzą
miękkie struktury o t.t. niskich Rb t.t. = 38,9
miękkie struktury o t.t. niskich Rb t.t. = 38,9
o
o
C ; Cs t.t. =
C ; Cs t.t. =
28,7
28,7
o
o
C
C
-
-
wapniowce – dwa walencyjne do sieci t.t. Ca = 383
wapniowce – dwa walencyjne do sieci t.t. Ca = 383
o
o
C
C
t.t. Ba = 714
t.t. Ba = 714
o
o
C
C

WŁAŚCIWOŚCI KRYSZTAŁÓW O WIĄZANIU JONOWYM
WŁAŚCIWOŚCI KRYSZTAŁÓW O WIĄZANIU JONOWYM
1. Sole tworzą krystaliczne sieci jonowe, ich kryształy nie
1. Sole tworzą krystaliczne sieci jonowe, ich kryształy nie
przewodzą prądu, stopione – przewodzą prąd.
przewodzą prądu, stopione – przewodzą prąd.
2. Rozpuszczają się w rozpuszczalnikach polarnych, a ich
2. Rozpuszczają się w rozpuszczalnikach polarnych, a ich
roztwory przewodzą prąd.
roztwory przewodzą prąd.
3. Temperatury topnienia są wysokie > 500
3. Temperatury topnienia są wysokie > 500
o
o
C
C
Temperatury wrzenia wysokie:
Temperatury wrzenia wysokie:
NaCl t.t. = 801
NaCl t.t. = 801
o
o
C t.w. = 1413
C t.w. = 1413
o
o
C
C

WŁAŚCIWOŚCI KRYSZTAŁÓW O WIĄZANIACH ATOMOWYCH
WŁAŚCIWOŚCI KRYSZTAŁÓW O WIĄZANIACH ATOMOWYCH
1.
1.
Nie przewodzą prądu nawet stopione
Nie przewodzą prądu nawet stopione
2.
2.
Są rozpuszczalne w rozpuszczalnikach niepolarnych
Są rozpuszczalne w rozpuszczalnikach niepolarnych
lub słabo polarnych
lub słabo polarnych
3.
3.
Powstają z tych samych pierwiastków lub z
Powstają z tych samych pierwiastków lub z
pierwiastków o podobnej elektroujemności
pierwiastków o podobnej elektroujemności
4.
4.
Wiązania sieciowe tworzą się przez uwspólnienie
Wiązania sieciowe tworzą się przez uwspólnienie
wszystkich elektronów walencyjnych lub ich części
wszystkich elektronów walencyjnych lub ich części
5.
5.
Wzór elementu w krysztale jest wzorem związku
Wzór elementu w krysztale jest wzorem związku
6.
6.
Mają niskie temperatury topnienia i wrzenia
Mają niskie temperatury topnienia i wrzenia
7.
7.
Reakcje w roztworach zachodzą wolniej niż reakcje w
Reakcje w roztworach zachodzą wolniej niż reakcje w
roztworach związków jonowych
roztworach związków jonowych

Związki kompleksowe
Związki kompleksowe
Nagroda Nobla 1893 r. – Werner
Nagroda Nobla 1893 r. – Werner
Są to związki o złożonej budowie których podstawowym
Są to związki o złożonej budowie których podstawowym
wiązaniem jest wiązanie koordynacyjne – wtórne.
wiązaniem jest wiązanie koordynacyjne – wtórne.
Tworzą je głównie pierwiastki bloku „ d” lub grup pobocznych
Tworzą je głównie pierwiastki bloku „ d” lub grup pobocznych
wg. Mendelejewa.
wg. Mendelejewa.
Dążąc do utworzenia struktury gazu szlachetnego efekt l.a.
Dążąc do utworzenia struktury gazu szlachetnego efekt l.a.
przyłączają jony lub cząstki obojętne posiadające kompletne –
przyłączają jony lub cząstki obojętne posiadające kompletne –
ale wolne pary elektronowe. Pierwiastki te noszą nazwę
ale wolne pary elektronowe. Pierwiastki te noszą nazwę
atomów centralnych
atomów centralnych
natomiast cząsteczki przyłączane zwane
natomiast cząsteczki przyłączane zwane
są
są
ligandami
ligandami
.
.
Mogą to być jony: F
Mogą to być jony: F
-
-
, Cl
, Cl
-
-
, I
, I
-
-
, CN
, CN
-
-
, OH
, OH
-
-
, S
, S
-2
-2
lub cząstki obojętne: H
lub cząstki obojętne: H
2
2
O [ akwa ]
O [ akwa ]
NH
NH
3
3
[ amina ]
[ amina ]
CO [ karbonylo]
CO [ karbonylo]
[ Co(NH
[ Co(NH
3
3
)
)
6
6
]
]
+3
+3
3Cl
3Cl
-
-
Nobel Wernera
Nobel Wernera

Liczba koordynacyjna
Liczba koordynacyjna
– liczba przyłączonych przez atom
– liczba przyłączonych przez atom
ligandów. Określa ona liczbę brakujących par elektronów
ligandów. Określa ona liczbę brakujących par elektronów
na powłokach walencyjnych pierwiastka centralnego.
na powłokach walencyjnych pierwiastka centralnego.
Najczęściej wynosi ona 2, 4 lub 6
Najczęściej wynosi ona 2, 4 lub 6
np. w reakcji:
np. w reakcji:
FeSO
FeSO
4
4
+ 6 NaCN
+ 6 NaCN
Na
Na
4
4
[Fe(CN)
[Fe(CN)
6
6
] + Na
] + Na
2
2
SO
SO
4
4
Jon żelaza ma strukturę ostatnich powłok następującą:
Jon żelaza ma strukturę ostatnich powłok następującą:

Fe
Fe
+2
+2
ma na powłokach walencyjnych 6 pustych orbitali, może więc
ma na powłokach walencyjnych 6 pustych orbitali, może więc
koordynować 6 jonów
koordynować 6 jonów
mających wolną parę
mających wolną parę
e
W ten sposób żelazo uzyskuje konfigurację kryptonu
29
Cu
+2
1s
2
2s
2
2p
6
3s
2
3p
6
4s
0
3d
10
4p
0
Posiada 4 puste orbitale 4s i 3 orbitale 4p, tworzy związek
kompleksowy 2.
tetraamin
a
47
Ag
+
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
0
4d
10
5p
0
Liczba koordynacyjna srebra najczęściej wynosi 2
2
4
3
]
[
NH
Cu

Jeżeli dodatni jon metalu koordynuje cząsteczki obojętne
Jeżeli dodatni jon metalu koordynuje cząsteczki obojętne
[H
[H
2
2
O, NH
O, NH
3
3
] to powstaje
] to powstaje
kation kompleksowy
kation kompleksowy
o ładunku
o ładunku
równym dodatniemu ładunkowi jonu centralnego.
równym dodatniemu ładunkowi jonu centralnego.
Jeżeli zaś ligandami są jony ujemne [Cl
Jeżeli zaś ligandami są jony ujemne [Cl
-
-
, CN
, CN
-
-
] to ładunek
] to ładunek
jonu kompleksowego równy jest sumie algebraicznej
jonu kompleksowego równy jest sumie algebraicznej
ładunków. Jon kompleksowy i towarzyszące mu jony
ładunków. Jon kompleksowy i towarzyszące mu jony
ostatecznie tworzą związek obojętny np. [Cu(NH
ostatecznie tworzą związek obojętny np. [Cu(NH
3
3
)
)
4
4
]SO
]SO
4
4
,
,
K
K
4
4
[Fe(CN)
[Fe(CN)
6
6
].
].
Rodzaje oddziaływań
Rodzaje oddziaływań
Jon – dipol
Jon – dipol
[Cu(NH
[Cu(NH
3
3
)
)
4
4
]
]
+2
+2
[Mg(H
[Mg(H
2
2
O)
O)
6
6
]
]
+2
+2
Jon – jon
Jon – jon
[FeF
[FeF
6
6
]
]
-3
-3
[Fe(CN)
[Fe(CN)
6
6
]
]
-4
-4

PRAKTYCZNE ZNACZENIE KOMPLEKSÓW
PRAKTYCZNE ZNACZENIE KOMPLEKSÓW
1. Są lepiej rozpuszczalne niż związki jonowe
1. Są lepiej rozpuszczalne niż związki jonowe
AgCl [Ag(NH
AgCl [Ag(NH
3
3
)
)
2
2
]Cl
]Cl
nierozpuszczalny w wodzie rozpuszczalny w wodzie
nierozpuszczalny w wodzie rozpuszczalny w wodzie
Cu(OH)
Cu(OH)
2
2
[Cu(NH
[Cu(NH
3
3
)
)
4
4
](OH)
](OH)
2
2
AgI Na
AgI Na
3
3
[Ag(S
[Ag(S
2
2
O
O
3
3
)
)
2
2
]
]
3
2
2
O
S
Na
OH
NH
4
OH
NH
4

2. Jony skompleksowane posiadają inne barwy
2. Jony skompleksowane posiadają inne barwy
Cu
Cu
+2
+2
– niebieski [Cu(NH
– niebieski [Cu(NH
3
3
)
)
4
4
]
]
+2
+2
szafirowy
szafirowy
Fe
Fe
+3
+3
– żółty [Fe(CNS)
– żółty [Fe(CNS)
6
6
]
]
-3
-3
krwistoczerwony
krwistoczerwony
3.
3.
Związki chelatowe
Związki chelatowe
– są to kompleksy w których ligandy
– są to kompleksy w których ligandy
są donorami dwóch lub więcej par elektronowych
są donorami dwóch lub więcej par elektronowych
występujących w różnych atomach tej samej cząsteczki.
występujących w różnych atomach tej samej cząsteczki.
Takie ligandy nazywamy czynnikami chelatującymi. Są to
Takie ligandy nazywamy czynnikami chelatującymi. Są to
najczęściej związki organiczne zawierające N, S, jako
najczęściej związki organiczne zawierające N, S, jako
miejsce reaktywne [chela = kleszcze, nożyce]. Związki
miejsce reaktywne [chela = kleszcze, nożyce]. Związki
chelatowe mają budowę pierścieniową, najtrwalsze są
chelatowe mają budowę pierścieniową, najtrwalsze są
kompleksy 5 lub 6 członowe, wliczając w to atom
kompleksy 5 lub 6 członowe, wliczając w to atom
centralny.
centralny.

W zależności od liczby par elektronowych czynniki
W zależności od liczby par elektronowych czynniki
chelatujące nazywamy jedno lub wielokleszczowymi.
chelatujące nazywamy jedno lub wielokleszczowymi.
Uchwycenie atomu centralnego w dwa kleszcze powoduje
Uchwycenie atomu centralnego w dwa kleszcze powoduje
zamaskowanie jego charakteru nieorganicznego, a cały
zamaskowanie jego charakteru nieorganicznego, a cały
kompleks zachowuje się jak związek organiczny. Chelaty
kompleks zachowuje się jak związek organiczny. Chelaty
są na ogół trwalsze od kompleksów niechelatowych.
są na ogół trwalsze od kompleksów niechelatowych.
Znanym związkiem chelatujacym jest kwas
Znanym związkiem chelatujacym jest kwas
etylenodiaminotetraoctowy lub jego sól sodowa [EDTA]
etylenodiaminotetraoctowy lub jego sól sodowa [EDTA]

Kompleksy z tymi samymi ligandami są tym trwalsze im
Kompleksy z tymi samymi ligandami są tym trwalsze im
mniejszy jest promień jonu centralnego.
mniejszy jest promień jonu centralnego.
Najsłabsze
Najsłabsze
są akwokompleksy do których należą
są akwokompleksy do których należą
wszystkie jony metali w wodzie. W roztworach
wszystkie jony metali w wodzie. W roztworach
kompleksy mniej trwałe przechodzą w trwalsze, ale
kompleksy mniej trwałe przechodzą w trwalsze, ale
stopniowo.
stopniowo.

Kompleksy występujące w przyrodzie
Kompleksy występujące w przyrodzie
Żelazo – porfirynowy w hemie hemoglobiny, związany z
Żelazo – porfirynowy w hemie hemoglobiny, związany z
białkami krwi i mięśni [ mioglobina ].
białkami krwi i mięśni [ mioglobina ].
Fe
Fe
+2
+2
związany jest czterema wiązaniami [ dwa jonowe,
związany jest czterema wiązaniami [ dwa jonowe,
dwa koordynacyjne ] z azotami pierścieni pirolowych, 5
dwa koordynacyjne ] z azotami pierścieni pirolowych, 5
wiązaniem – koordynacyjnym z białkiem, a 6 z tlenem
wiązaniem – koordynacyjnym z białkiem, a 6 z tlenem
[ łatwo odczepialnym – dlatego przenosi tlen]
[ łatwo odczepialnym – dlatego przenosi tlen]
Porfiryny
Porfiryny
występują jeszcze w innych białkach –
występują jeszcze w innych białkach –
katalazy
katalazy
katalizujące rozkład H
katalizujące rozkład H
2
2
O
O
2
2
, inne enzymy
, inne enzymy
Cytochromy
Cytochromy
– żelazo może zmieniać stopień utlenienia
– żelazo może zmieniać stopień utlenienia
nie tracąc aktywności biologicznej.
nie tracąc aktywności biologicznej.
Witamina B
Witamina B
12
12
(kat. cent. – Co)
(kat. cent. – Co)
chlorofil
chlorofil
, celuroplazmina, transferyna
, celuroplazmina, transferyna
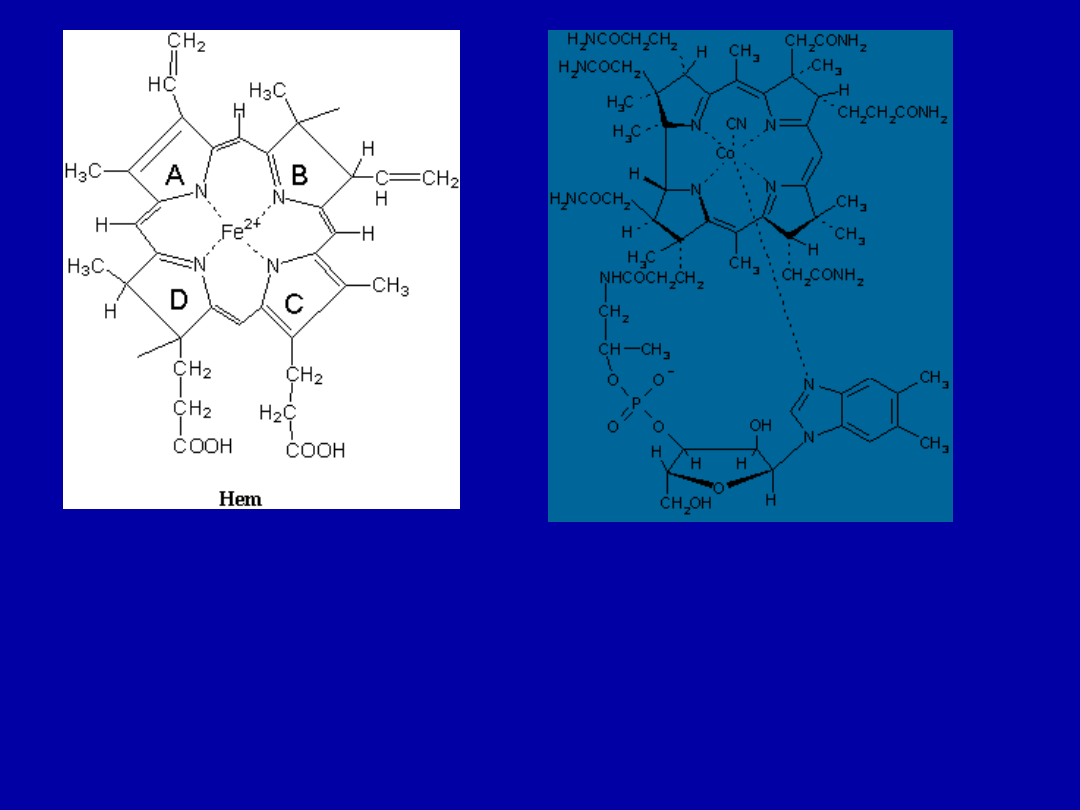
Wzór strukturalny hemu Witamina B
12
-
cyjanokobaltamina

ODDZIAŁYWANIA MIĘDZYCZĄSTECZKOWE – SIŁY VAN DER
ODDZIAŁYWANIA MIĘDZYCZĄSTECZKOWE – SIŁY VAN DER
WAALSA
WAALSA
A. Między cząsteczkami obojętnymi
- efekty kulombowskiego elektrostatycznego przyciągania
i odpychania zachodzące pomiędzy jądrami i
elektronami różnych cząsteczek obojętnych
- siły magnetyczne związane z istnieniem momentów
magnetycznych
- siły dyspersyjne związane z powstawaniem i zanikaniem
chwilowych dipoli na skutek ruchów atomów w
cząsteczkach są to siły przyciągania i odpychania
chwilowego cząsteczek

B.
B.
Między cząsteczkami polarnymi
Między cząsteczkami polarnymi
- sprzężenie elektrostatyczne
- sprzężenie elektrostatyczne
- sprzężenie dipolowe – cząsteczka polarna indukuje
- sprzężenie dipolowe – cząsteczka polarna indukuje
powstanie momentu dipolowego w cząsteczce
powstanie momentu dipolowego w cząsteczce
niepolarnej
niepolarnej
- wiązanie wodorowe !!! najważniejsze – jest to
- wiązanie wodorowe !!! najważniejsze – jest to
oddziaływanie elektrostatyczne miedzy dodatnim
oddziaływanie elektrostatyczne miedzy dodatnim
biegunem wodoru jednej cząsteczki polarnej z
biegunem wodoru jednej cząsteczki polarnej z
ujemnym biegunem drugiej cząsteczki polarnej.
ujemnym biegunem drugiej cząsteczki polarnej.
Najczęściej powstaje ono w związkach w których
Najczęściej powstaje ono w związkach w których
występują wiązania H – O ; H – N ; H – S ; H – X (F, Cl,
występują wiązania H – O ; H – N ; H – S ; H – X (F, Cl,
Br, I)
Br, I)
- energia wiązania wodorowego jest znacznie mniejsza od
- energia wiązania wodorowego jest znacznie mniejsza od
wiązania atomowego
wiązania atomowego
- długość wiązania wodorowego jest większa od
- długość wiązania wodorowego jest większa od
atomowego
atomowego

Energia
wiązania
atomowego
[kJ/M]
Energia
wiązania
wodorowego
[kJ/M]
H –
O
464
12,3 – 33,4
H –
N
389
16,7 – 28,2
H –
F
564
20,9 – 33,4
Np.
Długość
X – H······Y X –
H
at. wod.
0,27 nm
0,19nm

Wiązanie to prowadzi do
Wiązanie to prowadzi do
asocjacji
asocjacji
np. cząsteczki HF tworzą długie zygzakowate łańcuchy t
np. cząsteczki HF tworzą długie zygzakowate łańcuchy t
w
w
29,2
29,2
o
o
K w tej temperaturze cząsteczce pary odpowiada
K w tej temperaturze cząsteczce pary odpowiada
masa molowa 68,8 tzn. jest 3,4 razy większa od M
masa molowa 68,8 tzn. jest 3,4 razy większa od M
HF
HF
czyli
czyli
że
że
cząsteczka pary ma budowę H
cząsteczka pary ma budowę H
3
3
F
F
3
3
i H
i H
4
4
F
F
4
4
– zasocjowane 3 -
– zasocjowane 3 -
4 cząsteczki
4 cząsteczki
Również porównując temperaturę wrzenia wody i innych
Również porównując temperaturę wrzenia wody i innych
związków o podobnej masie molowej wyraźnie widać, że
związków o podobnej masie molowej wyraźnie widać, że
woda jest zasocjowana
woda jest zasocjowana
tw
tw
H20
H20
= 100
= 100
o
o
C m
C m
H20
H20
= 18 C
= 18 C
2
2
H
H
6
6
tt =
tt =
-86,6
-86,6
o
o
C
C
tw
tw
CH4
CH4
= -161,6
= -161,6
o
o
C m
C m
CH4
CH4
= 16 m
= 16 m
C2H6
C2H6
= 30
= 30
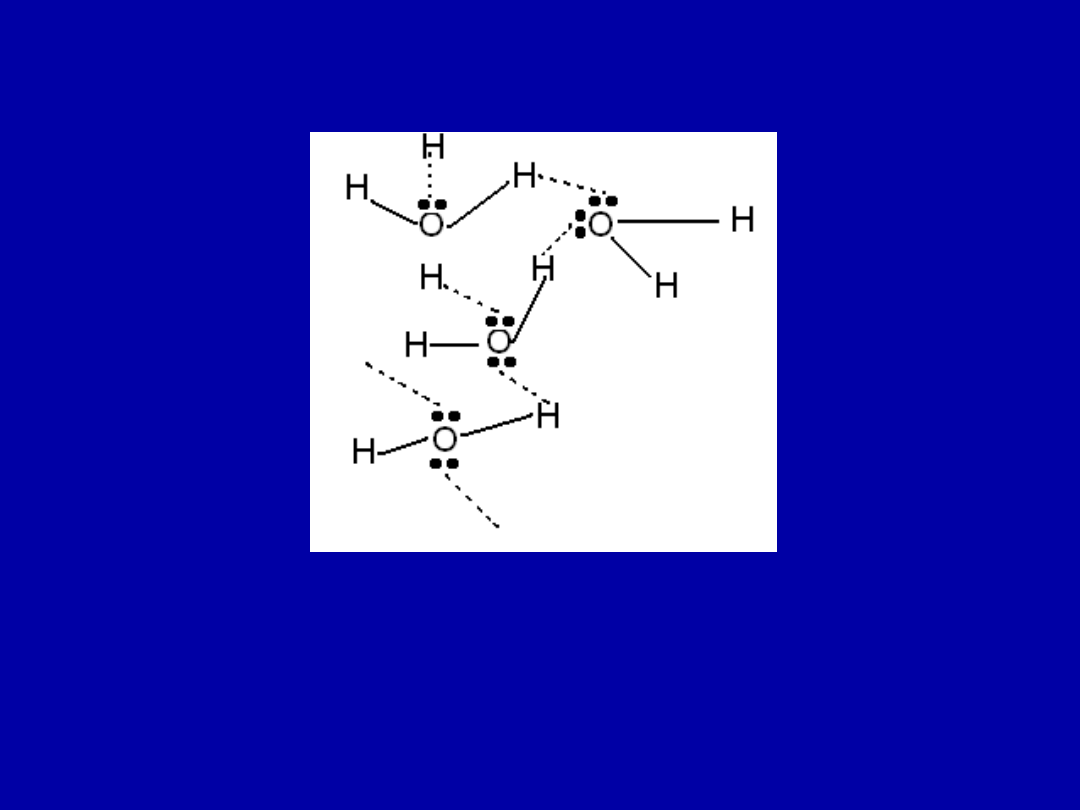
Każdy atom „O” w wodzie jest otoczony 4 H
Każdy atom „O” w wodzie jest otoczony 4 H
Wiązanie takie występuje w alkoholach, aminach,
białkach, kwasach nukleinowych – warunkuje ono
aktywność biologiczną wielu enzymów.

STANY SKUPIENIA MATERII
STANY SKUPIENIA MATERII
KINETYCZNA TEORIA BUDOWY MATERII
KINETYCZNA TEORIA BUDOWY MATERII
- Podstawowe elementy znajdują się w ciągłym ruchu
- Podstawowe elementy znajdują się w ciągłym ruchu
– energia własna
– energia własna
- Istnieją między nimi siły wzajemnego oddziaływania
- Istnieją między nimi siły wzajemnego oddziaływania
– przyciąganie
– przyciąganie
W zależności od stopnia uporządkowania cząsteczek
W zależności od stopnia uporządkowania cząsteczek
lub atomów i tego który rodzaj oddziaływań przeważa
lub atomów i tego który rodzaj oddziaływań przeważa
– przyciąganie czy energia własna, materia
– przyciąganie czy energia własna, materia
występuje w 3 stanach:
występuje w 3 stanach:
- gazowym – wysoka energia własna, małe
- gazowym – wysoka energia własna, małe
przyciąganie międzycząsteczkowe
przyciąganie międzycząsteczkowe
- ciekłym – maleje energia własna a rosną siły
- ciekłym – maleje energia własna a rosną siły
przyciągania cząsteczek
przyciągania cząsteczek
- stałym – mała energia, duże siły oddziaływań
- stałym – mała energia, duże siły oddziaływań
międzycząsteczkowych
międzycząsteczkowych

STAN GAZOWY
STAN GAZOWY
GAZ DOSKONAŁY – wyidealizowany stan materii
GAZ DOSKONAŁY – wyidealizowany stan materii
spełniający kilka warunków:
spełniający kilka warunków:
- cząsteczki gazu zachowują się jak jednorodne kule
- cząsteczki gazu zachowują się jak jednorodne kule
doskonale sprężyste
doskonale sprężyste
- objętość własna cząsteczek jest znikomo mała w
- objętość własna cząsteczek jest znikomo mała w
porównaniu z objętością zajmowaną przez mol gazu
porównaniu z objętością zajmowaną przez mol gazu
- cząsteczki znajdujące się w ciągłym chaotycznym ruchu
- cząsteczki znajdujące się w ciągłym chaotycznym ruchu
zderzają się sprężyście, zgodnie z prawami mechaniki
zderzają się sprężyście, zgodnie z prawami mechaniki
zderzeń sprężystych
zderzeń sprężystych
- do zderzenia ruch cząsteczek jest prostoliniowy, bez
- do zderzenia ruch cząsteczek jest prostoliniowy, bez
żadnego uprzywilejowanego kierunku
żadnego uprzywilejowanego kierunku
Żaden z gazów rzeczywistych nie spełnia tych warunków,
Żaden z gazów rzeczywistych nie spełnia tych warunków,
dopiero w wysokich temperaturach i przy dużych
dopiero w wysokich temperaturach i przy dużych
rozrzedzeniach zbliżają się one do tego idealnego modelu.
rozrzedzeniach zbliżają się one do tego idealnego modelu.

PRAWA GAZÓW DOSKONAŁYCH
PRAWA GAZÓW DOSKONAŁYCH
1. Boyle’a i Mariotta
1. Boyle’a i Mariotta
W stałej T objętość gazu jest odwrotnie proporcjonalna
W stałej T objętość gazu jest odwrotnie proporcjonalna
ciśnienia
ciśnienia
T = const.
T = const.
T
T
0
0
≠ T
≠ T
1
1
0
1
1
0
V
V
p
p
1
1
1
0
0
0
T
V
p
T
V
p
1
1
0
0
1
p
T
V
p
V
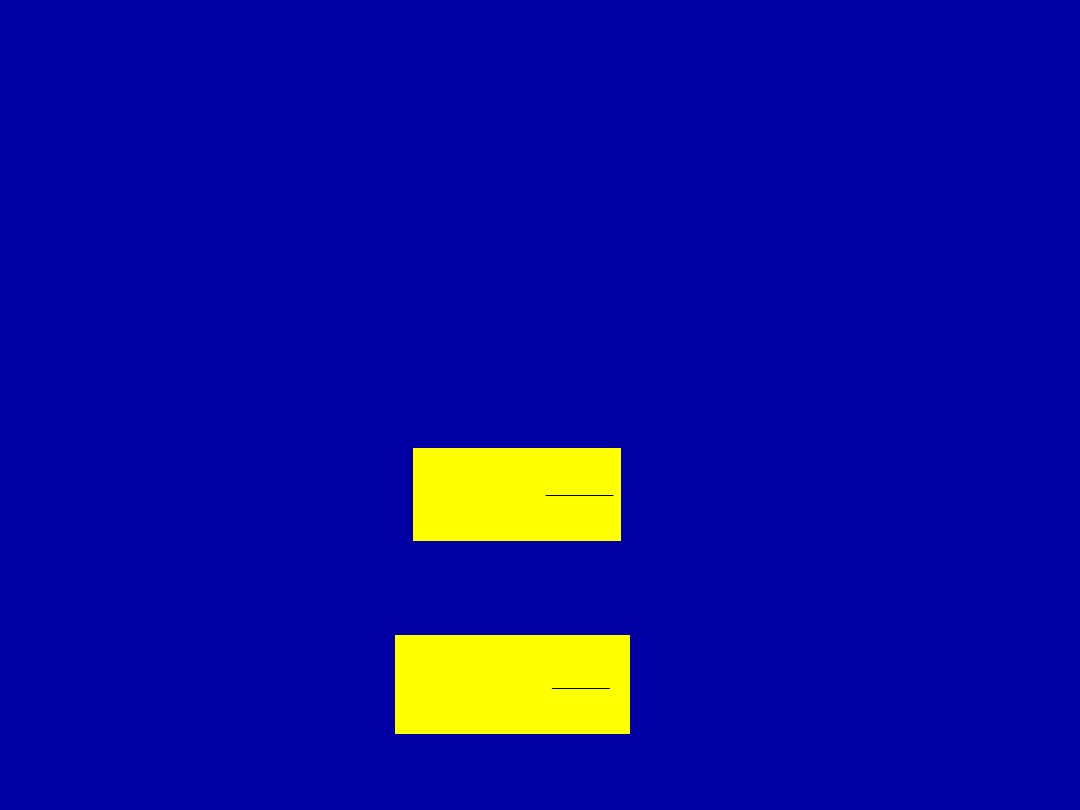
2. Gay – Lussaca
2. Gay – Lussaca
Przy stałym P objętość danej masy gazu podczas
Przy stałym P objętość danej masy gazu podczas
ogrzewania zwiększa się z każdym stopniem o 1/273
ogrzewania zwiększa się z każdym stopniem o 1/273
objętości jaką gaz ten zajmuje w temp. 0
objętości jaką gaz ten zajmuje w temp. 0
o
o
C
C
p = const
p = const
lub
lub
273
0
0
t
V
V
V
)
273
1
(
0
C
t
V
V
o

Wprowadzając T w stopniach Kelwina [ stały jej punkt to
Wprowadzając T w stopniach Kelwina [ stały jej punkt to
temperatura punktu potrójnego wody T = 273,16 K lub
temperatura punktu potrójnego wody T = 273,16 K lub
0,098
0,098
o
o
C]
C]
Prawo Gay – Lussaca ma postać:
Prawo Gay – Lussaca ma postać:
Przy p = const V/T = const
Przy p = const V/T = const
0
0
T
T
V
V

3.
3.
Równanie gazu doskonałego – podsumowanie 1,2:
Równanie gazu doskonałego – podsumowanie 1,2:
[ R ] – stała gazowa
[ R ] – stała gazowa
lub pV = RT dla 1 mola gazu
lub pV = RT dla 1 mola gazu
przyjmując:
przyjmując:
T = 273K p = 1 atm
T = 273K p = 1 atm
V = 22,4 dm
V = 22,4 dm
3
3
/mol
/mol
Wyliczono R = 0,082 dm
Wyliczono R = 0,082 dm
3
3
∙ atm ∙ K ∙ mol
∙ atm ∙ K ∙ mol
-1
-1
lub R = 8,314 J/mol ∙ K
lub R = 8,314 J/mol ∙ K
R – nie zależy od ilości i rodzaju gazu
R – nie zależy od ilości i rodzaju gazu
const
T
pV

Dla n moli gazu jest to równanie Clapeyrona
Dla n moli gazu jest to równanie Clapeyrona
Prawo to może być uogólnione dla wszystkich gazów, bo jak z
Prawo to może być uogólnione dla wszystkich gazów, bo jak z
prawa Avogadra wynika – jednakowe objętości wszystkich
prawa Avogadra wynika – jednakowe objętości wszystkich
gazów przy takim samym p i T zawierają taką samą liczbę
gazów przy takim samym p i T zawierają taką samą liczbę
cząsteczek.
cząsteczek.
Dla 1 mola jest to 6,02 ∙ 10
Dla 1 mola jest to 6,02 ∙ 10
23
23
objętość molowa zawsze
objętość molowa zawsze
wynosi 22,4 dm
wynosi 22,4 dm
3
3
/mol.
/mol.
mola
gazu
M
m
n
RT
M
m
pV
nRT
pV

Stała Boltzmana
Stała Boltzmana
Prawo Clapeyrona dla gazów rzeczywistych
Prawo Clapeyrona dla gazów rzeczywistych
1.
1.
W gazach rzeczywistych duży wpływ wywierają
W gazach rzeczywistych duży wpływ wywierają
oddziaływania międzycząsteczkowe.
oddziaływania międzycząsteczkowe.
2.
2.
Nie może być pominięta objętość własna ich
Nie może być pominięta objętość własna ich
cząsteczek.
cząsteczek.
]
/
[
10
02
,
6
314
,
8
10
02
,
6
23
23
K
J
R
k

•
oddziaływania międzycząsteczkowe są tym większe im
oddziaływania międzycząsteczkowe są tym większe im
wartość energii tych oddziaływań bliższa jest energii
wartość energii tych oddziaływań bliższa jest energii
kinetycznej wyrażonej przez iloczyn k ∙ T
kinetycznej wyrażonej przez iloczyn k ∙ T
•
odstępstwa od doskonałości są tym większe im wyższe
odstępstwa od doskonałości są tym większe im wyższe
jest ciśnienie, a niższa temperatura
jest ciśnienie, a niższa temperatura
•
odstępstwa od doskonałości najlepiej widać na tzw.
odstępstwa od doskonałości najlepiej widać na tzw.
współczynniku ściśliwości
współczynniku ściśliwości
Dla gazów doskonałych z = 1
Dla gazów doskonałych z = 1
Uwzględniając poprawki na oddziaływania
Uwzględniając poprawki na oddziaływania
międzycząsteczkowe i objętość własną cząsteczek van
międzycząsteczkowe i objętość własną cząsteczek van
der Waals zaproponował równanie dla gazu
der Waals zaproponował równanie dla gazu
rzeczywistego:
rzeczywistego:
RT
pV
z

dla 1 mola
dla 1 mola
- poprawka na ciśnienie, tzw. ciśnienie wewnętrzne
- poprawka na ciśnienie, tzw. ciśnienie wewnętrzne
b – poprawka na objętość własną cząsteczek, np. dla CO
b – poprawka na objętość własną cząsteczek, np. dla CO
2
2
b
b
= 42,7 cm/M
= 42,7 cm/M
Równanie van der Waalsa dla dowolnej ilości gazu
Równanie van der Waalsa dla dowolnej ilości gazu
rzeczywistego:
rzeczywistego:
RT
b
V
V
a
p
)
)(
(
2
2
V
a
RT
M
m
b
M
m
V
V
a
M
m
p
]
[
]
)
(
[
2
2

STAN CIEKŁY
STAN CIEKŁY
- ograniczenie energii własnej cząsteczek przez oddziaływania
- ograniczenie energii własnej cząsteczek przez oddziaływania
międzycząsteczkowe
międzycząsteczkowe
- swobodny ruch cząsteczek powoduje że ciecze nie mają
- swobodny ruch cząsteczek powoduje że ciecze nie mają
określonego kształtu ale już określona ilość cieczy ma stałą
określonego kształtu ale już określona ilość cieczy ma stałą
objętość
objętość
- ciecze tworzą swobodną powierzchnię graniczną
- ciecze tworzą swobodną powierzchnię graniczną
- gęstość cieczy w mniejszym stopniu niż u gazów zależy od T i
- gęstość cieczy w mniejszym stopniu niż u gazów zależy od T i
p
p
- struktura cieczy jest quasi – statyczna tzn. w cieczy istnieją
- struktura cieczy jest quasi – statyczna tzn. w cieczy istnieją
obszary uporządkowania przypominające sieć krystaliczną,
obszary uporządkowania przypominające sieć krystaliczną,
jednak ich istnienie ma charakter dynamiczny, tworzą się na
jednak ich istnienie ma charakter dynamiczny, tworzą się na
krótko i zanikają, a w ich miejsce powstają nowe
krótko i zanikają, a w ich miejsce powstają nowe
- stan ciekły ograniczają dwie temperatury: topnienia i wrzenia
- stan ciekły ograniczają dwie temperatury: topnienia i wrzenia
(krystalizacji)
(krystalizacji)
(skraplania)
(skraplania)

Wielkości charakteryzujące ciecze
Wielkości charakteryzujące ciecze
1.
1.
Temperatury: topnienia i wrzenia – t.t i t.w
Temperatury: topnienia i wrzenia – t.t i t.w
2.
2.
Lepkość
Lepkość
3.
3.
Napięcie powierzchniowe
Napięcie powierzchniowe
Lepkość - to tarcie wewnętrzne pomiędzy
Lepkość - to tarcie wewnętrzne pomiędzy
poruszającymi się warstwami cieczy.
poruszającymi się warstwami cieczy.
Istnieje ścisłe powiązanie:
Istnieje ścisłe powiązanie:
PŁYNNOŚĆ = ODWROTNOŚĆ LEPKOŚCI
PŁYNNOŚĆ = ODWROTNOŚĆ LEPKOŚCI
Wyróżnia się lepkość:
Wyróżnia się lepkość:
•
bezwzględną – dynamiczna i kinematyczna
bezwzględną – dynamiczna i kinematyczna
•
względną – umowną w porównaniu z wodą
względną – umowną w porównaniu z wodą
Jednostką lepkości dynamicznej jest 1 P [ poise]
Jednostką lepkości dynamicznej jest 1 P [ poise]

Lepkość cieczy
Lepkość cieczy
– równa jest 1 P jeśli siła potrzebna do
– równa jest 1 P jeśli siła potrzebna do
przesunięcia warstwy 1 cm
przesunięcia warstwy 1 cm
2
2
cieczy z prędkością 1 cm/s
cieczy z prędkością 1 cm/s
względem drugiej takiej warstwy oddalonej od niej o 1
względem drugiej takiej warstwy oddalonej od niej o 1
cm równa jest 10
cm równa jest 10
5
5
N.
N.
Lepkość kinematyczna
Lepkość kinematyczna
Jest to stosunek lepkości dynamicznej do ciężaru
Jest to stosunek lepkości dynamicznej do ciężaru
właściwego cieczy
właściwego cieczy
]
/
[
2
s
cm
ρ = gęstość cieczy g / cm
3
Jednostką lepkości kinematycznej jest Stockes.
Pomiar lepkości cieczy polega na pomiarze czasu
przepływu określonej ilości cieczy przez rurkę kapilarną w
ściśle określonej temperaturze [ wiskozymetry ].

Lepkość względna Englera
Lepkość względna Englera
Określa ona stosunek czasu przepływu 200cm
Określa ona stosunek czasu przepływu 200cm
3
3
danej
danej
cieczy przez kalibrowany otwór lepkościomierza w ściśle
cieczy przez kalibrowany otwór lepkościomierza w ściśle
określonej temperaturze, do czasu przepływu takiej
określonej temperaturze, do czasu przepływu takiej
samej ilości wody destylowanej w temp. 20
samej ilości wody destylowanej w temp. 20
o
o
C.
C.
- woda została wybrana jako wzorzec, ponieważ jej
- woda została wybrana jako wzorzec, ponieważ jej
lepkość kinematyczna w t = 20,2
lepkość kinematyczna w t = 20,2
o
o
C równa jest
C równa jest
1 St.
1 St.

NAPIĘCIE POWIERZCHNIOWE
NAPIĘCIE POWIERZCHNIOWE
- każda cząsteczka w głębi cieczy jest równomiernie
- każda cząsteczka w głębi cieczy jest równomiernie
otoczona innymi cząsteczkami, jej siły wzajemnych
otoczona innymi cząsteczkami, jej siły wzajemnych
oddziaływań są wysycane, ich wypadkowa = 0
oddziaływań są wysycane, ich wypadkowa = 0
- natomiast cząsteczki powierzchniowe doznają tylko
- natomiast cząsteczki powierzchniowe doznają tylko
jednostronnych oddziaływań od strony cieczy, bo ich
jednostronnych oddziaływań od strony cieczy, bo ich
oddziaływania z cząsteczkami gazu są bardzo małe
oddziaływania z cząsteczkami gazu są bardzo małe
- wypadkowa tych sił działa prostopadle do powierzchni i
- wypadkowa tych sił działa prostopadle do powierzchni i
skierowana jest do wnętrza cieczy, ulega więc
skierowana jest do wnętrza cieczy, ulega więc
jednostronnemu wciąganiu do wnętrza cieczy, tak więc
jednostronnemu wciąganiu do wnętrza cieczy, tak więc
cząsteczki powierzchniowe wywierają na
cząsteczki powierzchniowe wywierają na
wnętrze cieczy
wnętrze cieczy
ciśnienie zwane powierzchniowym albo wewnętrznym
ciśnienie zwane powierzchniowym albo wewnętrznym
- na skutek działania tych sił ciecze dążą do zmniejszenia
- na skutek działania tych sił ciecze dążą do zmniejszenia
liczby cząsteczek na powierzchni, zmniejsza się
liczby cząsteczek na powierzchni, zmniejsza się
powierzchnia swobodna cieczy, dla tego krople cieczy
powierzchnia swobodna cieczy, dla tego krople cieczy
mają kształt kulisty jako najmniejszy przy danej
mają kształt kulisty jako najmniejszy przy danej
objętości
objętości

Tak więc w warstwie powierzchniowej cieczy istnieją siły
Tak więc w warstwie powierzchniowej cieczy istnieją siły
zmniejszające powierzchnię
zmniejszające powierzchnię
działające wzdłuż powierzchni
działające wzdłuż powierzchni
w każdym jej punkcie. Jest to właśnie
w każdym jej punkcie. Jest to właśnie
Napięcie powierzchniowe
Napięcie powierzchniowe
σ
σ
Jest ono niezależne od wielkości powierzchni, ale od
Jest ono niezależne od wielkości powierzchni, ale od
charakteru cieczy i temperatury
charakteru cieczy i temperatury
- każda ciecz wykazuje charakterystyczne dla siebie
- każda ciecz wykazuje charakterystyczne dla siebie
σ
σ
Jednostki napięcia powierzchniowego
Jednostki napięcia powierzchniowego
Można je podawać w jednostkach pracy na jednostkę
Można je podawać w jednostkach pracy na jednostkę
powierzchni
powierzchni
- jest to praca potrzebna do zwiększenia powierzchni
- jest to praca potrzebna do zwiększenia powierzchni
swobodnej cieczy o 1m
swobodnej cieczy o 1m
2
2
[J/m
[J/m
2
2
]
]
W jednostkach siły na jednostkę długości [N/m]
W jednostkach siły na jednostkę długości [N/m]

Napięcie powierzchniowe różnych cieczy:
Napięcie powierzchniowe różnych cieczy:
t = 18
t = 18
o
o
C
C
σ
σ
H2O
H2O
= 0,073 N/m
= 0,073 N/m
σ
σ
CH3OH
CH3OH
= 0,022 N/m
= 0,022 N/m
σ
σ
Hg
Hg
= 0,491 N/m
= 0,491 N/m
t = 20
t = 20
o
o
C
C
σ
σ
C6H6
C6H6
= 0,0289 N/m
= 0,0289 N/m
Istnienie energii powierzchniowej wskazują proste
Istnienie energii powierzchniowej wskazują proste
doświadczenia
doświadczenia
Utrzymywanie się leżącej żyletki na powierzchni cieczy
Utrzymywanie się leżącej żyletki na powierzchni cieczy
Możliwość rozciągnięcia cieczy w formie błonki na ramce
Możliwość rozciągnięcia cieczy w formie błonki na ramce

Zależność napięcia powierzchniowego czystych cieczy od
Zależność napięcia powierzchniowego czystych cieczy od
temperatury
temperatury
- napięcie
- napięcie
σ
σ
maleje ze wzrostem T
maleje ze wzrostem T
- zwiększenie powierzchni cieczy wiąże się z
- zwiększenie powierzchni cieczy wiąże się z
pochłanianiem ciepła
pochłanianiem ciepła
- ciepło pochłonięte przy zwiększeniu powierzchni o 1cm
- ciepło pochłonięte przy zwiększeniu powierzchni o 1cm
2
2
nazywamy
nazywamy
ciepłem tworzenia powierzchni
ciepłem tworzenia powierzchni
- w temperaturze krytycznej, kiedy zanika granica między
- w temperaturze krytycznej, kiedy zanika granica między
cieczą i parą
cieczą i parą
σ
σ
uzyskuje wartość „0”
uzyskuje wartość „0”

Napięcie powierzchniowe roztworów
Napięcie powierzchniowe roztworów
-
-
większość związków dodanych do cieczy zmniejsza jej
większość związków dodanych do cieczy zmniejsza jej
napięcie powierzchniowe
napięcie powierzchniowe
- wpływ substancji rozpuszczonej na
- wpływ substancji rozpuszczonej na
σ
σ
zależy od tego czy
zależy od tego czy
jej stężenie w warstwie powierzchniowej jest większe
jej stężenie w warstwie powierzchniowej jest większe
czy mniejsze niż w głębi roztworu
czy mniejsze niż w głębi roztworu
- wszystkie związki hydrofilowe [elektrolity] dla których
- wszystkie związki hydrofilowe [elektrolity] dla których
oddziaływanie z wodą jest bardzo duże zwiększają
oddziaływanie z wodą jest bardzo duże zwiększają
napięcie σ np. jony mocnych elektrolitów ulegając
napięcie σ np. jony mocnych elektrolitów ulegając
dysocjacji otaczają się cząsteczkami wody i wciągane są
dysocjacji otaczają się cząsteczkami wody i wciągane są
w głąb roztworu i dlatego ich stężenie w warstwie
w głąb roztworu i dlatego ich stężenie w warstwie
powierzchniowej jest mniejsze niż w głębi roztworu
powierzchniowej jest mniejsze niż w głębi roztworu
- związki hydrofilowe – nie zwilżalne [należą tu głównie
- związki hydrofilowe – nie zwilżalne [należą tu głównie
związki organiczne] albo rozpuszczają się w sposób
związki organiczne] albo rozpuszczają się w sposób
ograniczony, albo rozpuszczone gromadzą się w
ograniczony, albo rozpuszczone gromadzą się w
warstwie powierzchniowej np. mydła
warstwie powierzchniowej np. mydła
Takie gromadzenie się substancji przy powierzchni
Takie gromadzenie się substancji przy powierzchni
oddzielającej dwie fazy nazywa się
oddzielającej dwie fazy nazywa się
adsorpcją
adsorpcją
.
.

STAN SZKLISTY
STAN SZKLISTY
Szkłem nazywamy każdą substancję organiczną lub
Szkłem nazywamy każdą substancję organiczną lub
nieorganiczną, która przy ochłodzeniu przeszła w
nieorganiczną, która przy ochłodzeniu przeszła w
sposób ciągły ze stanu zwykłej cieczy (o lepkości 10p)
sposób ciągły ze stanu zwykłej cieczy (o lepkości 10p)
do stanu w którym jej lepkość jest większa niż 10
do stanu w którym jej lepkość jest większa niż 10
13
13
p.
p.
Szkła przy lepkości 10
Szkła przy lepkości 10
8
8
– 10
– 10
9
9
p tworzą stan plastyczny.
p tworzą stan plastyczny.
Wykorzystywane to jest przy formowaniu szkła poprzez
Wykorzystywane to jest przy formowaniu szkła poprzez
ciągnięcie, wydmuchiwanie, prasowanie.
ciągnięcie, wydmuchiwanie, prasowanie.
W stanie szklistym nie można otrzymać metali, soli,
W stanie szklistym nie można otrzymać metali, soli,
kwasów, tlenków ani gazów szlachetnych
kwasów, tlenków ani gazów szlachetnych
gdyż mają
gdyż mają
one zdefiniowane typy wiązań – jonowe, atomowe,
one zdefiniowane typy wiązań – jonowe, atomowe,
metaliczne. Natomiast substancje o wiązaniach typu
metaliczne. Natomiast substancje o wiązaniach typu
mostków wodorowych czy tlenków można otrzymać w
mostków wodorowych czy tlenków można otrzymać w
stanie szklistym.
stanie szklistym.

STAN STAŁY
STAN STAŁY
ciała krystaliczne
ciała krystaliczne
ciała bezpostaciowe – izotropowe brak ostrego przejścia
ciała bezpostaciowe – izotropowe brak ostrego przejścia
do
do
stanu ciekłego
stanu ciekłego

Podstawowe cechy kryształów
Podstawowe cechy kryształów
- stan pełnego uporządkowania atomów lub jonów w
- stan pełnego uporządkowania atomów lub jonów w
dowolnym kierunku
dowolnym kierunku
- tworzenie kształtu regularnych wielościanów wypukłych
- tworzenie kształtu regularnych wielościanów wypukłych
ograniczonych płaskimi ścianami
ograniczonych płaskimi ścianami
- anizotropia kryształów – zależność ich właściwości od
- anizotropia kryształów – zależność ich właściwości od
kierunku np. właściwości mechaniczne : twardość,
kierunku np. właściwości mechaniczne : twardość,
wytrzymałość, przewodnictwo elektryczne, cieplne itp.
wytrzymałość, przewodnictwo elektryczne, cieplne itp.
- zewnętrzna forma kryształu jest ściśle związana z
- zewnętrzna forma kryształu jest ściśle związana z
budową wewnętrzną
budową wewnętrzną
- podstawową jednostką kryształu jest komórka sieciowa –
- podstawową jednostką kryształu jest komórka sieciowa –
jest to najmniejszy element przestrzenny tworzący sieć
jest to najmniejszy element przestrzenny tworzący sieć
trójwymiarową, określany za pomocą trzech krawędzi a,
trójwymiarową, określany za pomocą trzech krawędzi a,
b, c oraz trzech kątów
b, c oraz trzech kątów
α, β, γ
α, β, γ
pomiędzy krawędziami, są
pomiędzy krawędziami, są
to tzw.
to tzw.
parametry sieci przestrzennej
parametry sieci przestrzennej

Komórka sieciowa powtarza się w przestrzeni po
Komórka sieciowa powtarza się w przestrzeni po
przesunięciu translacyjnym w kierunku jednej z krawędzi
przesunięciu translacyjnym w kierunku jednej z krawędzi
o dowolną całkowitą ilość odległości translacyjnych
o dowolną całkowitą ilość odległości translacyjnych
(odległość dwóch analogicznych węzłów leżących na
(odległość dwóch analogicznych węzłów leżących na
prostej sieciowej).
prostej sieciowej).
lp.
układ
parametry
kształty komórki
1
regularny
a = b = c
α = β = γ =
90
o
sześcian
2
tetragonal
ny
a = b ≠ c
α = β = γ =
90
o
prostopadłościan
o podstawie
kwadratu
3
heksagonal
ny
a = b ≠ c
α = β = 90
o
γ = 120
o
prostopadłościan
o podstawie
romboidalnej
4
trygonalny
a = b = c
α = β = γ ≠
90
o
romboedr
5
rombowy
a ≠ b ≠ c
α = β = γ =
90
o
prostopadłościan
o podstawie
prostokąta
6
jednoskośn
y
a ≠ b ≠ c
α = γ = 90
o
β ≠ 90
o
równoległościan
7
trójskośny
a ≠ b ≠ c
α ≠ β ≠ γ
równoległościan
PODSTAWOWE UKŁADY KRYSTALOGRAFICZNE

RÓWNOWAGI FAZOWE
RÓWNOWAGI FAZOWE
UKŁAD:
UKŁAD:
Stan skupienia materii wraz z zawartą w nim energią
Stan skupienia materii wraz z zawartą w nim energią
Układ fizycznie jednorodny
Układ fizycznie jednorodny
– każda najmniejsza jego część
– każda najmniejsza jego część
wykazuje te same cechy co cały układ – jest jednorodny pod
wykazuje te same cechy co cały układ – jest jednorodny pod
względem fizycznym i chemicznym
względem fizycznym i chemicznym
Układ fizycznie niejednorodny
Układ fizycznie niejednorodny
– różne jego części wykazują
– różne jego części wykazują
różne właściwości i zwane są fazami. Są to części
różne właściwości i zwane są fazami. Są to części
jednorodne układu oddzielone od innych jego części
jednorodne układu oddzielone od innych jego części
powierzchnią rozdziału np. lód i woda.
powierzchnią rozdziału np. lód i woda.
Stopień swobody układu niejednorodnego
Stopień swobody układu niejednorodnego
: liczba parametrów
: liczba parametrów
zewnętrznych [ p, t, c ] które można zmienić nie powodując
zewnętrznych [ p, t, c ] które można zmienić nie powodując
zaniku żadnej z faz.
zaniku żadnej z faz.

REGUŁA FAZ GIBBSA
REGUŁA FAZ GIBBSA
Liczba stopni swobody układu równa jest różnicy
Liczba stopni swobody układu równa jest różnicy
liczby składników i faz powiększonej o 2
liczby składników i faz powiększonej o 2
s = n – f + 2
s = n – f + 2
s – liczba stopni swobody
s – liczba stopni swobody
n – liczba składników
n – liczba składników
f – liczba faz
f – liczba faz
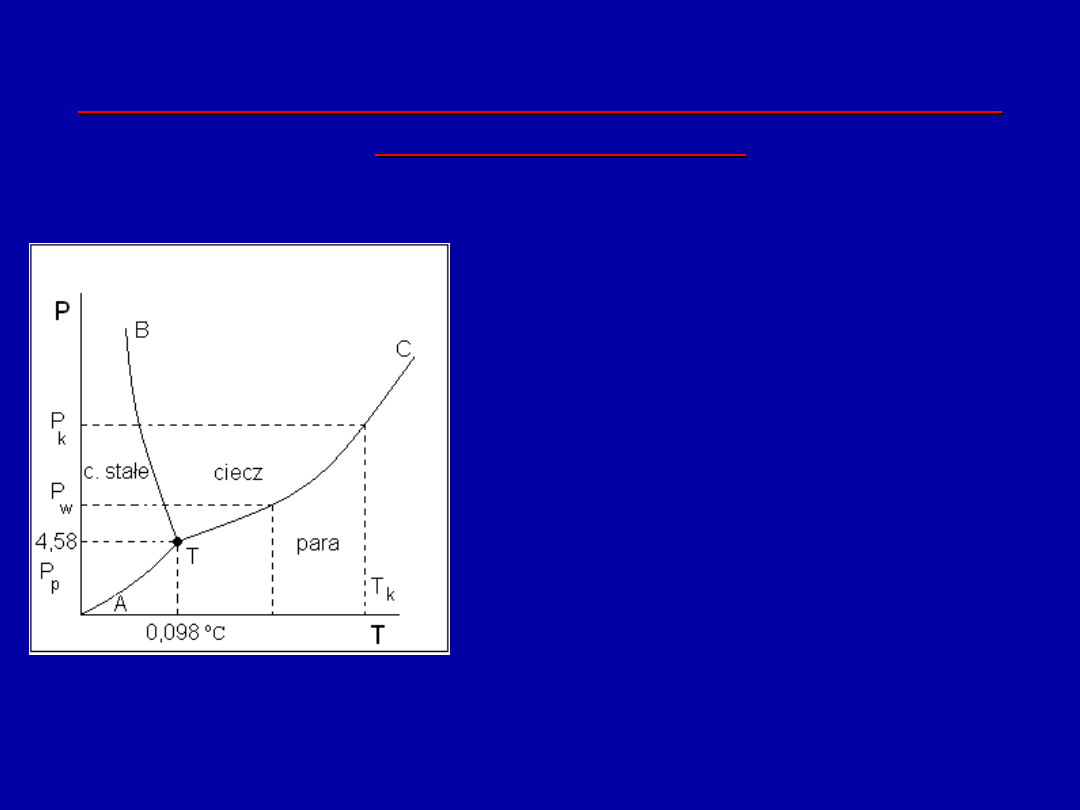
RÓWNOWAGI FAZOWE DLA UKŁADU n = 1 f = 3 NA
RÓWNOWAGI FAZOWE DLA UKŁADU n = 1 f = 3 NA
PRZYKŁADZIE WODY
PRZYKŁADZIE WODY
Diagram fazowy wody:
P
p
= 4,58 mmHg = 601,44 hPa
P
w
= 1 atm = 1013 hPa
P
k
= 217 atm = 219821 hPa
T – temperatura punktu potrójnego H
2
O t = 0,098
o
C T =
273,14
o
K
T
w
= 100
o
C T
k
= 374
o
C
Krzywe: TA; TB; TC – równowag
2-fazowych
T – Punkt potrójny wody: 3-
fazowy

A.
A.
Równowagi fazowe w głębi cieczy, pary, ciała stałego
Równowagi fazowe w głębi cieczy, pary, ciała stałego
n = 1 f = 1
n = 1 f = 1
s = 1 – 1 + 2 = 2
s = 1 – 1 + 2 = 2
Można zmienić dwa parametry nie powodując zaniku
Można zmienić dwa parametry nie powodując zaniku
żadnej z faz
żadnej z faz
B.
B.
Równowagi fazowe wzdłuż krzywych
Równowagi fazowe wzdłuż krzywych
TA – sublimacji – resublimacji
TA – sublimacji – resublimacji
TB – topnienia – krzepnięcia
TB – topnienia – krzepnięcia
TC – parowania – skraplania
TC – parowania – skraplania
n = 1 f = 2
n = 1 f = 2
s = 1 – 2 + 2 = 1
s = 1 – 2 + 2 = 1
układ 1 – zmiennej
układ 1 – zmiennej
W PUNKCIE POTRÓJNYM T
W PUNKCIE POTRÓJNYM T
n = 1 f = 3
n = 1 f = 3
s = 1 – 3 + 2 = 0
s = 1 – 3 + 2 = 0
Brak stopni swobody – układ „0” zmiennych
Brak stopni swobody – układ „0” zmiennych

RÓWNOWAGI FAZOWE DLA UKŁADU n = 2 LOTNEGO
RÓWNOWAGI FAZOWE DLA UKŁADU n = 2 LOTNEGO
ROZPUSZCZLNIKA I NIELOTNEJ SUBSTANCJI
ROZPUSZCZLNIKA I NIELOTNEJ SUBSTANCJI
ROZPUSZCZONEJ f = 1
ROZPUSZCZONEJ f = 1
W układzie takim prężność par substancji rozpuszczonej
W układzie takim prężność par substancji rozpuszczonej
jest nieznaczna, a nad roztworem w postaci pary
jest nieznaczna, a nad roztworem w postaci pary
znajduje się tylko rozpuszczalnik
znajduje się tylko rozpuszczalnik
- Prężność pary nad roztworem P
- Prężność pary nad roztworem P
A
A
P
P
A
A
= P
= P
A
A
0
0
∙ x
∙ x
A
A
P
P
A
A
0
0
– prężność pary nad czystym rozpuszczalnikiem
– prężność pary nad czystym rozpuszczalnikiem
x
x
A
A
- ułamek molowy rozpuszczalnika w roztworze
- ułamek molowy rozpuszczalnika w roztworze
x
x
B
B
- ułamek molowy substancji rozpuszczonej w
- ułamek molowy substancji rozpuszczonej w
roztworze
roztworze
x
x
A
A
+ x
+ x
B
B
= 1 x
= 1 x
B
B
= 1 - x
= 1 - x
A
A

Obniżenie prężności pary nad roztworem
Obniżenie prężności pary nad roztworem
Δp = P
Δp = P
A
A
0
0
- P
- P
A
A
0
0
∙ x
∙ x
A
A
= P
= P
A
A
0
0
(1 - x
(1 - x
A
A
)
)
lub
lub
Δp = P
Δp = P
A
A
0
0
∙ x
∙ x
B
B
bo x
bo x
B
B
= 1 - x
= 1 - x
A
A
I PRAWO RAOULTA
I PRAWO RAOULTA
Obniżenie prężności pary rozpuszczalnika nad roztworem
Obniżenie prężności pary rozpuszczalnika nad roztworem
jest wprost proporcjonalne do ułamka molowego
jest wprost proporcjonalne do ułamka molowego
substancji rozpuszczonej.
substancji rozpuszczonej.
- Im większy ułamek molowy x
- Im większy ułamek molowy x
B
B
– bardziej stężony roztwór,
– bardziej stężony roztwór,
tym większe obniżenie prężności pary.
tym większe obniżenie prężności pary.
T
T
A
A
0
0
– temperatura wrzenia rozpuszczalnika
– temperatura wrzenia rozpuszczalnika
T
T
B
B
– temperatura wrzenia roztworu
– temperatura wrzenia roztworu

II PRAWO RAOULTA
II PRAWO RAOULTA
Podwyższenie temperatury wrzenia roztworu jest wprost
Podwyższenie temperatury wrzenia roztworu jest wprost
proporcjonalne do stężenia molalnego roztworu.
proporcjonalne do stężenia molalnego roztworu.
m
m
S
S
– masa substancji rozpuszczonej
– masa substancji rozpuszczonej
w – masa rozpuszczalnika
w – masa rozpuszczalnika
L
L
P
P
– ciepło parowania 1g rozpuszczalnika
– ciepło parowania 1g rozpuszczalnika
k
k
e
e
= molarne podwyższenie T
= molarne podwyższenie T
W
W
rozpuszczalnika jest to
rozpuszczalnika jest to
podwyższenie T
podwyższenie T
W
W
po rozpuszczeniu 1M substancji w
po rozpuszczeniu 1M substancji w
1000g rozpuszczalnika.
1000g rozpuszczalnika.
w
M
m
ke
T
s
S
W
1000
P
L
RT
ke
1000
2
III PRAWO RAOULTA
III PRAWO RAOULTA
Obniżenie T
Obniżenie T
K
K
roztworów jest wprost proporcjonalne do
roztworów jest wprost proporcjonalne do
stężenia molalnego roztworów.
stężenia molalnego roztworów.
w
M
m
K
T
S
S
K
K
1000
K
K
– stała krioskopowa
K
K
L
RT
K
1000
2
Jest to molarne obniżenie T
K
rozpuszczalnika – zależy od
ciepła topnienia L
K

WYZNACZANIE CIĘŻARÓW CZĄSTECZKOWYCH W OPARCIU
WYZNACZANIE CIĘŻARÓW CZĄSTECZKOWYCH W OPARCIU
O PRAWO RAOULTA
O PRAWO RAOULTA
Z I prawa:
Z I prawa:
m
m
b
b
– masa molowa substancji rozpuszczonej
– masa molowa substancji rozpuszczonej
Z II prawa:
Z II prawa:
w – waga rozpuszczalnika
w – waga rozpuszczalnika
A
B
A
A
B
m
p
m
M
P
M
0
w
T
m
ke
M
B
B
1000

Z III prawa:
Z III prawa:
m
m
B
B
– masa substancji rozpuszczonej
– masa substancji rozpuszczonej
w
T
m
k
M
B
k
B
1000

PRAWA RAOULTA DLA DWÓCH CIECZY MIESZAJĄCYCH SIĘ
PRAWA RAOULTA DLA DWÓCH CIECZY MIESZAJĄCYCH SIĘ
NIEOGRANICZENIE
NIEOGRANICZENIE
W Daltona prężność pary nad takimi roztworami równa
W Daltona prężność pary nad takimi roztworami równa
jest sumie prężności par obu cieczy
jest sumie prężności par obu cieczy
Dla każdego ze składników prężność par równa jest jego
Dla każdego ze składników prężność par równa jest jego
prężności nad czystym składnikiem razy jego ułamek
prężności nad czystym składnikiem razy jego ułamek
molowy w roztworze.
molowy w roztworze.
B
A
P
P
P
A
A
A
x
P
P
0
B
B
B
x
P
P
0
1
B
A
x
x
B
A
x
x
1

czyli
czyli
B
B
A
A
x
P
x
P
P
0
0
lub
B
B
B
A
A
x
P
x
P
P
P
0
0
0
0
0
0
)
(
A
B
A
B
P
x
P
P
P

I Prawo
I Prawo
A
B
x
A
=
1
x
B
=
1
x
B
=
0
x
A
=
0
P
B
– prężność par benzenu
P
A
– prężność par toluenu
P - prężność par nad roztworem obu
cieczy

Prawa Raoulta spełniają:
Prawa Raoulta spełniają:
benzen + dichloroetan
heksan + heptan
woda + metanol
ciekły N
2
+ ciekły O
2
są to tzw. roztwory doskonałe
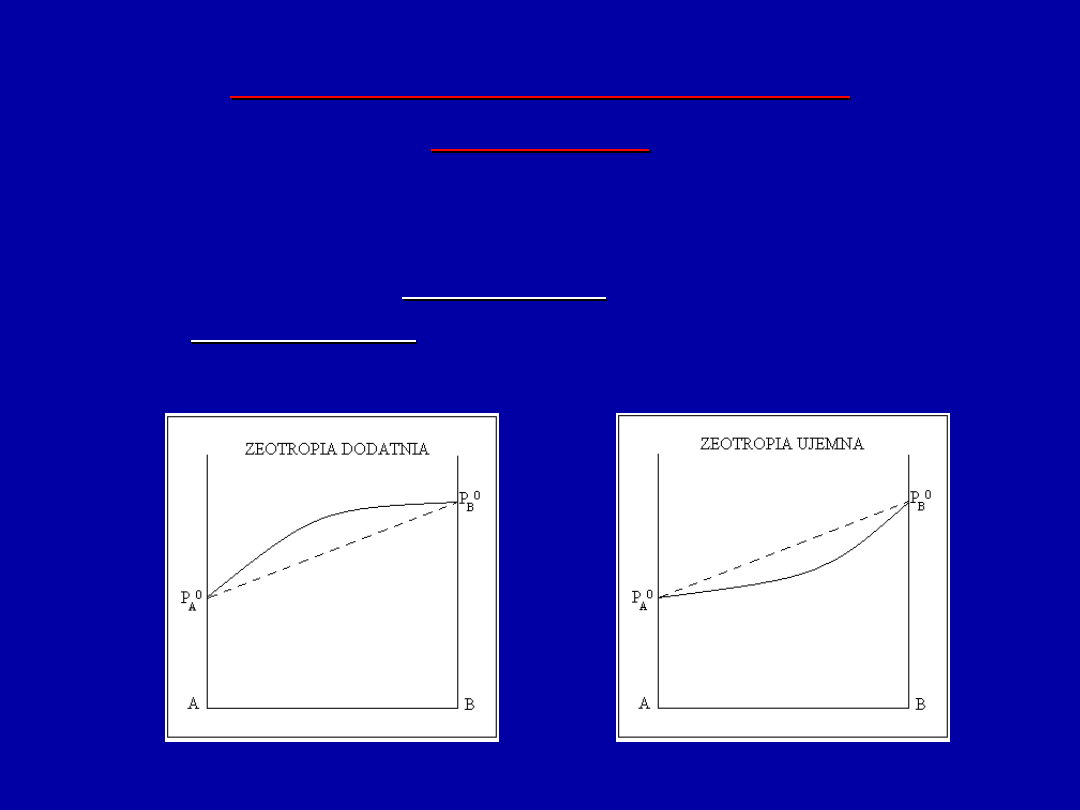
ODCHYLENIA OD PRAW RAOULTA –
ODCHYLENIA OD PRAW RAOULTA –
AZEOTROPY
AZEOTROPY
Mieszanina cieczy wykazujących odchylenia od praw
Mieszanina cieczy wykazujących odchylenia od praw
Raoulta nazywają się
Raoulta nazywają się
zeotropami
zeotropami
gdy te odchylenia są
gdy te odchylenia są
małe, lub
małe, lub
azeotropami
azeotropami
gdy na krzywych pojawiają się
gdy na krzywych pojawiają się
wyraźne maksima lub minima. Odchylenia mogą być
wyraźne maksima lub minima. Odchylenia mogą być
ujemne lub dodatnie.
ujemne lub dodatnie.
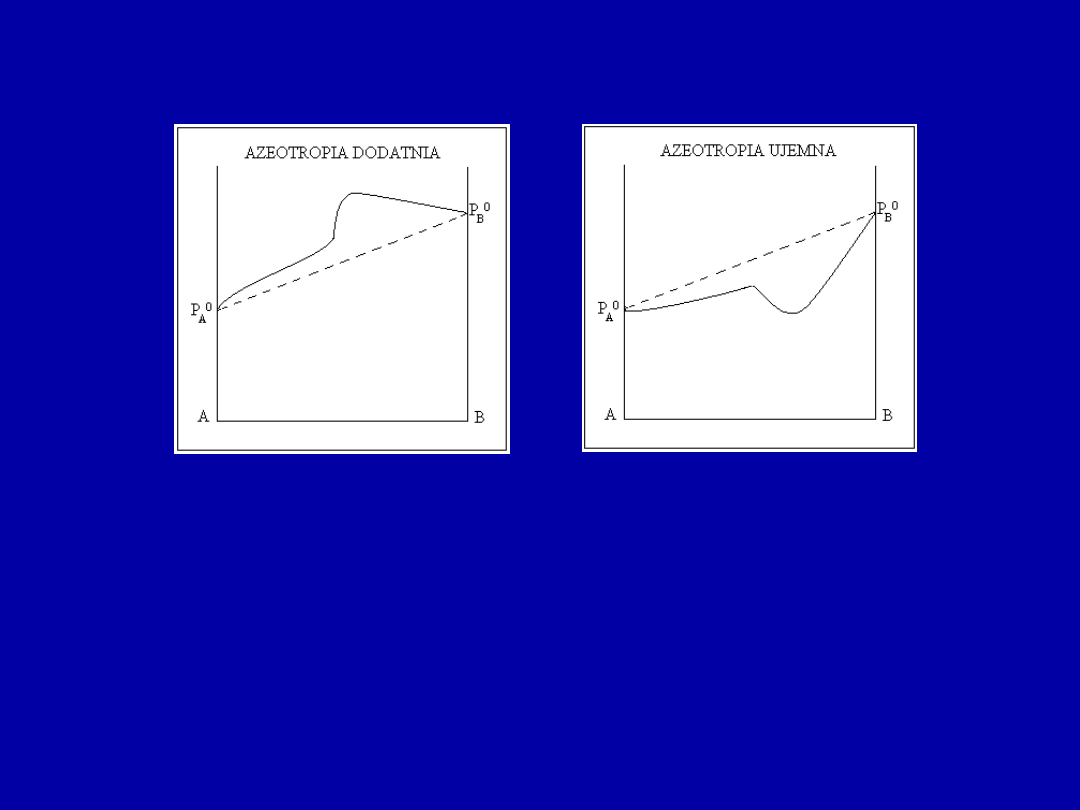

II Prawo – Temperatury wrzenia a skład cieczy i pary
II Prawo – Temperatury wrzenia a skład cieczy i pary
Proces przejścia cieczy w parę i ponowne skroplenie
Proces przejścia cieczy w parę i ponowne skroplenie
nazywa się
nazywa się
destylacją
destylacją
. Proces przejścia cieczy w parę w
. Proces przejścia cieczy w parę w
zależności od T można przedstawić na wykresie w
zależności od T można przedstawić na wykresie w
układzie współrzędnych: T i % skład cieczy.
układzie współrzędnych: T i % skład cieczy.
Destylacja
Destylacja
– metoda rozdziału cieczy o różnych
– metoda rozdziału cieczy o różnych
temperaturach wrzenia.
temperaturach wrzenia.
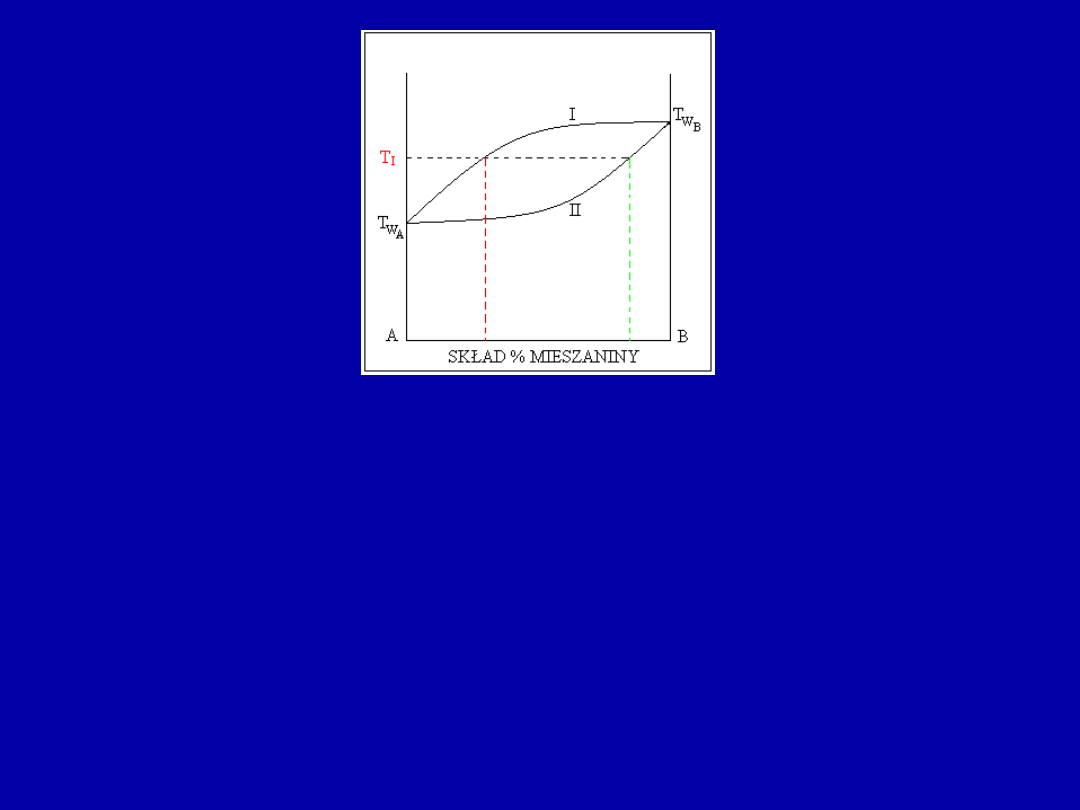
I Krzywa składu pary
II Krzywa składu cieczy
T
W
A
, T
W
B
– temperatury wrzenia czystych A lub B
T
W
A
< T
I
< T
W
B
W tej temperaturze para bogatsza jest w składnik o
niższej temperaturze wrzenia [A] – bardziej lotny
(
……….
).
Ciecz natomiast w TI bogatsza jest w składnik mniej lotny
(
……….
).
Całkowite rozdzielenie takich dwóch cieczy możliwe jest
tylko na drodze tzw. rektyfikacji.
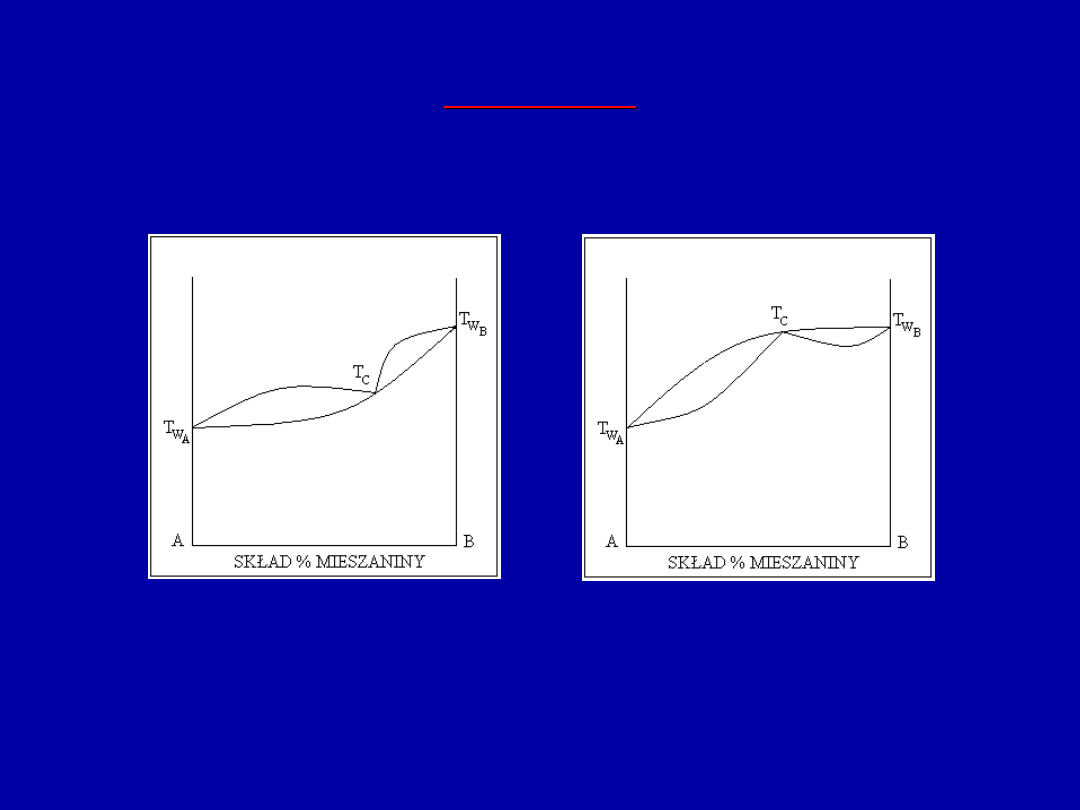
Odchylenia
Odchylenia
Na obu wykresach w temperaturze T
Na obu wykresach w temperaturze T
C
C
skład cieczy jest
skład cieczy jest
identyczny ze składem pary. Mieszanina cieczy destyluje tak
identyczny ze składem pary. Mieszanina cieczy destyluje tak
jak by to była jedna substancja. Punkt ten nazywa się
jak by to była jedna substancja. Punkt ten nazywa się
punktem azeotropowym.
punktem azeotropowym.

RÓWNOWAGA CHEMICZNA
RÓWNOWAGA CHEMICZNA
1.
1.
Prawo działania mas
Prawo działania mas
Równowaga chemiczna jest równowagą o charakterze
Równowaga chemiczna jest równowagą o charakterze
dynamicznym tzn. tyle ile produktów powstaje w
dynamicznym tzn. tyle ile produktów powstaje w
jednostce czasu, tyle samo ich przekształca się w
jednostce czasu, tyle samo ich przekształca się w
substraty.
substraty.
Układ znajduje się w stanie równowagi gdy jego
Układ znajduje się w stanie równowagi gdy jego
parametry nie zależą od czasu. Każda reakcja
parametry nie zależą od czasu. Każda reakcja
przebiega z określoną szybkością, której miarą jest
przebiega z określoną szybkością, której miarą jest
zmiana stężenia substratów lub produktów w
zmiana stężenia substratów lub produktów w
jednostce czasu.
jednostce czasu.

Dla reakcji
Dla reakcji
k
k
1
1
i k
i k
2
2
– stałe szybkości reakcji
– stałe szybkości reakcji
a, b, c, d – współczynniki stechiometryczne
a, b, c, d – współczynniki stechiometryczne
przy T = const V
przy T = const V
1
1
= V
= V
2
2
ustala się stan równowagi
ustala się stan równowagi
k
k
1
1
[A]
[A]
a
a
∙ [B]
∙ [B]
b
b
= k
= k
2
2
[C]
[C]
c
c
∙ [D]
∙ [D]
d
d
-
-
jest to stała stężeniowa równowagi, która nie
jest to stała stężeniowa równowagi, która nie
zależy od stężenia poszczególnych
zależy od stężenia poszczególnych
reagentów, zmienia się tylko przy zmianie T.
reagentów, zmienia się tylko przy zmianie T.
dD
cC
V
V
bB
aA
2
1
Szybkość reakcji
V
1
= k
1
[A]
a
∙ [B]
b
I reakcji odwrotnej
V
2
= k
2
[C]
c
∙ [D]
d
C
K
k
k
2
1

b
a
d
c
C
B
A
D
C
k
k
K
]
[
]
[
]
[
]
[
2
1
Równanie na stałą równowagi jest matematycznym
wyrazem Prawa działania mas
Guldberga – Waagego:
W stanie równowagi chemicznej w stałej T stosunek
iloczynu stężeń molowych produktów do iloczynu stężeń
molowych substratów jest wielkością stałą
charakterystyczną dla danej reakcji.
Jeżeli stała szybkości:
k
1
>> k
2
to w stanie równowagi znajdują się produkty w znacznie
większych stężeniach niż substraty – reakcje takie będą
praktycznie nieodwracalne.

2. Wpływ czynników zewnętrznych na równowagę
2. Wpływ czynników zewnętrznych na równowagę
a) REGUŁA PRZEKORY – le CHATERIERA – BRAUNA
a) REGUŁA PRZEKORY – le CHATERIERA – BRAUNA
Pod wpływem czynników zewnętrznych takich jak: zmiana
Pod wpływem czynników zewnętrznych takich jak: zmiana
stężenia roztworu, ciśnienia dla reakcji w stanie
stężenia roztworu, ciśnienia dla reakcji w stanie
gazowym czy temperatury – równowaga chemiczna
gazowym czy temperatury – równowaga chemiczna
ulega przesunięciu albo na korzyść produktów albo na
ulega przesunięciu albo na korzyść produktów albo na
korzyść substratów.
korzyść substratów.
Kierunek przesunięcia równowagi określa reguła przekory:
Kierunek przesunięcia równowagi określa reguła przekory:
Jeżeli na układ w stanie równowagi działa czynnik
Jeżeli na układ w stanie równowagi działa czynnik
zewnętrzny, to w układzie zajdą takie zmiany, które
zewnętrzny, to w układzie zajdą takie zmiany, które
będą niwelowały efekty tego działania, prowadząc do
będą niwelowały efekty tego działania, prowadząc do
ponownego ustalenia równowagi – układ broni się przed
ponownego ustalenia równowagi – układ broni się przed
zakłócaniem stanu równowagi z zewnątrz
zakłócaniem stanu równowagi z zewnątrz
.
.

Umiejętność doboru odpowiedniego bodźca zewnętrznego
Umiejętność doboru odpowiedniego bodźca zewnętrznego
powodującego przesunięcie równowagi w pożądanym
powodującego przesunięcie równowagi w pożądanym
kierunku jest bardzo ważne np. dla reakcji syntezy NH
kierunku jest bardzo ważne np. dla reakcji syntezy NH
3
3
Jeżeli zwiększymy [H
Jeżeli zwiększymy [H
2
2
], to najpierw zmaleje [N
], to najpierw zmaleje [N
2
2
], a
], a
wzrośnie [NH
wzrośnie [NH
3
3
], czyli że zmiany w układzie doprowadzą
], czyli że zmiany w układzie doprowadzą
stosunki stężeń produktów i substratów do ustalenia
stosunki stężeń produktów i substratów do ustalenia
nowego stanu równowagi odpowiadającemu ich nowym
nowego stanu równowagi odpowiadającemu ich nowym
stężeniom – czyli po zwiększeniu [H
stężeniom – czyli po zwiększeniu [H
2
2
] zwiększy się szybkość
] zwiększy się szybkość
syntezy NH
syntezy NH
3
3
.
.
Q
NH
H
N
3
2
2
2
3
3
2
2
2
3
]
][
[
]
[
H
N
NH
K

Rozważając tą reakcję jako przykład reakcji gazowej :
Rozważając tą reakcję jako przykład reakcji gazowej :
1Vmol N
1Vmol N
2
2
+ 3Vmol H
+ 3Vmol H
2
2
2Vmol NH
2Vmol NH
3
3
Razem: 4V substratów
Razem: 4V substratów
2V produktów
2V produktów
V ~ p 4p
V ~ p 4p
2p
2p
Jeżeli V = const. ciśnienie po syntezie maleje. W odwrotnym
Jeżeli V = const. ciśnienie po syntezie maleje. W odwrotnym
kierunku działa temperatura. Reakcja syntezy NH
kierunku działa temperatura. Reakcja syntezy NH
3
3
jest
jest
egzoenergetyczna – jeżeli nie odprowadzimy ciepła
egzoenergetyczna – jeżeli nie odprowadzimy ciepła
powstającego podczas syntezy NH
powstającego podczas syntezy NH
3
3
, to wzrost
, to wzrost
temperatury zwiększy szybkość reakcji rozkładu NH
temperatury zwiększy szybkość reakcji rozkładu NH
3
3
.
.
Warunki korzystne dla syntezy NH
Warunki korzystne dla syntezy NH
3
3
to:
to:
1. Zwiększenie ciśnienia substratów
1. Zwiększenie ciśnienia substratów
2. Szybkie chłodzenie produktów
2. Szybkie chłodzenie produktów

Ogólnie dla reakcji gazowych
Ogólnie dla reakcji gazowych
1.
1.
Wzrost ciśnienia sprzyja reakcjom przebiegającym ze
Wzrost ciśnienia sprzyja reakcjom przebiegającym ze
zmniejszeniem objętości produktów
zmniejszeniem objętości produktów
2.
2.
Obniżenie ciśnienia ułatwia przebieg reakcji ze
Obniżenie ciśnienia ułatwia przebieg reakcji ze
zwiększeniem objętości produktów
zwiększeniem objętości produktów
3.
3.
Gdy ΔV = 0 czyli V
Gdy ΔV = 0 czyli V
sub
sub
= V
= V
prod
prod
ciśnienie nie jest
ciśnienie nie jest
czynnikiem regulującym stan równowagi
czynnikiem regulującym stan równowagi
np. H
np. H
2
2
+ I
+ I
2
2
2HJ
2HJ
1 V
1 V
mol
mol
+ 1V
+ 1V
mol
mol
2 V
2 V
mol
mol
Podsumowanie:
Podsumowanie:
Pod wpływem czynników zewnętrznych stan równowagi
Pod wpływem czynników zewnętrznych stan równowagi
może przesunąć się w kierunku wzrostu stężeń produktów lub
może przesunąć się w kierunku wzrostu stężeń produktów lub
substratów ale stała równowagi K zależy tylko od temperatury.
substratów ale stała równowagi K zależy tylko od temperatury.

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
Rzeczywistą szybkość reakcji w danej chwili
Rzeczywistą szybkość reakcji w danej chwili
określamy jako stosunek nieskończenie małej zmiany c do
określamy jako stosunek nieskończenie małej zmiany c do
nieskończenie małego czasu
nieskończenie małego czasu
dt
dc
dt
dc
dt
dc
T
c
V
p
s
T
0
lim
Mierząc „V” ubytkiem c
sub
, przed ich pochodną
umieszczamy (-) bo w miarę przebiegu reakcji c
sub
systematycznie maleje.
Natomiast przed pochodną produktów (+) bo ich stężenie
w czasie reakcji rośnie.

W równaniu kinetycznym:
W równaniu kinetycznym:
Wykładniki a i b noszą nazwę rzędów reakcji w stosunku
Wykładniki a i b noszą nazwę rzędów reakcji w stosunku
do odpowiednich reagentów, suma a + b = r nazywa się
do odpowiednich reagentów, suma a + b = r nazywa się
ogólnym rzędem reakcji.
ogólnym rzędem reakcji.
Rząd reakcji jest liczbą całkowitą lub ułamkową
Rząd reakcji jest liczbą całkowitą lub ułamkową
spełniającą nierówność:
spełniającą nierówność:
r ≤ 3
r ≤ 3
Współczynniki a i b dobierane są doświadczalnie.
Współczynniki a i b dobierane są doświadczalnie.
Rząd reakcji
Rząd reakcji
: wynikający z matematycznego opisu reakcji
: wynikający z matematycznego opisu reakcji
jest pojęciem związanym
jest pojęciem związanym
z całym procesem stanowiącym sumę procesów
z całym procesem stanowiącym sumę procesów
elementarnych
elementarnych
.
.
b
a
prod
B
A
k
dt
dc
V

Reakcje I rzędu
Reakcje I rzędu
: to takie których szybkość oznaczona
: to takie których szybkość oznaczona
doświadczalnie zmienia się proporcjonalnie do stężenia
doświadczalnie zmienia się proporcjonalnie do stężenia
jednej z substancji reagujących
jednej z substancji reagujących
. Jej szybkość przedstawia
. Jej szybkość przedstawia
równanie kinetyczne I rzędu:
równanie kinetyczne I rzędu:
Dla znalezienia c substratu po czasie t bardziej przydatna
Dla znalezienia c substratu po czasie t bardziej przydatna
jest forma scałkowana w granicach c
jest forma scałkowana w granicach c
0
0
przy t = 0 do c po
przy t = 0 do c po
czasie t.
czasie t.
c = c
c = c
0
0
– x gdzie x = ubytek stężenia substancji po
– x gdzie x = ubytek stężenia substancji po
czasie t
czasie t
lub
lub
c
k
dt
dc
V
I
c
c
t
k
I
0
ln
1
c
c
t
k
I
0
log
3
,
2

Wynika stąd że log c
Wynika stąd że log c
0
0
/c jest wprost proporcjonalny do t
/c jest wprost proporcjonalny do t
czyli dla reakcji I rzędu wykres log c w zależności od t jest
czyli dla reakcji I rzędu wykres log c w zależności od t jest
linią prostą tzn. stosunek zmiany stężeń w czasie jest
linią prostą tzn. stosunek zmiany stężeń w czasie jest
stały.
stały.
Reakcje II rzędu
Reakcje II rzędu
: są to reakcje których szybkość
: są to reakcje których szybkość
oznaczona doświadczalnie jest proporcjonalna do iloczynu
oznaczona doświadczalnie jest proporcjonalna do iloczynu
stężeń dwóch substratów, lub do kwadratu c
stężeń dwóch substratów, lub do kwadratu c
2
2
lub
lub
Po scałkowaniu równanie przyjmuje formę:
Po scałkowaniu równanie przyjmuje formę:
2
1
c
c
k
dt
dc
V
II
2
c
k
II
2
0
1
0
0
0
1
2
2
1
log
)
(
3
,
2
c
c
c
c
c
c
t
k
II

Jeżeli c
Jeżeli c
1
1
= c
= c
2
2
wzór jest prosty:
wzór jest prosty:
Reakcje III rzędu
Reakcje III rzędu
: spotyka się je stosunkowo rzadko, gdyż
: spotyka się je stosunkowo rzadko, gdyż
większość reakcji można rozłożyć na szereg reakcji I lub II
większość reakcji można rozłożyć na szereg reakcji I lub II
rzędu. Jednak jeśli takie reakcje występują to:
rzędu. Jednak jeśli takie reakcje występują to:
lub
lub
c
c
t
c
c
k
II
0
0
Dla reakcji II rzędu wykres log c w zależności od t nie jest
linią prostą ale taki przebieg ma zależność odwrotności
stężenia 1/c
od t.
3
2
1
c
c
c
k
V
III
3
c
k
V
III

Gdy: c
Gdy: c
1
1
= c
= c
2
2
= c
= c
3
3
= c
= c
Reakcje „0” rzędu
Reakcje „0” rzędu
: są to reakcje których szybkość nie
: są to reakcje których szybkość nie
zależy od stężenia
zależy od stężenia
V = k
V = k
0
0
Oznacza to że ilość substancji ulegających przemianie
Oznacza to że ilość substancji ulegających przemianie
w jednostce czasu jest stała, niezależna od stężenia
w jednostce czasu jest stała, niezależna od stężenia
substancji reagujących.
substancji reagujących.
Niektóre równania kinetyczne reakcji przyjmują
Niektóre równania kinetyczne reakcji przyjmują
bardzo skomplikowaną postać, wskazuje to na złożony
bardzo skomplikowaną postać, wskazuje to na złożony
przebieg wielu procesów jednostkowych reakcji. Do opisu
przebieg wielu procesów jednostkowych reakcji. Do opisu
reakcji złożonych potrzebne jest więcej niż jedno równanie
reakcji złożonych potrzebne jest więcej niż jedno równanie
stechiometryczne i więcej równań kinetycznych.
stechiometryczne i więcej równań kinetycznych.
2
2
0
2
2
0
2
c
c
t
c
c
k
III

REAKCJE NASTĘPCZE – ŁAŃCUCHOWE
REAKCJE NASTĘPCZE – ŁAŃCUCHOWE
To takie reakcje których produkt jednej jest substratem
To takie reakcje których produkt jednej jest substratem
następnej. Mogą one przebiegać z różnym szybkościami.
następnej. Mogą one przebiegać z różnym szybkościami.
Całkowita szybkość reakcji [ wypadkowa ] określa wtedy
Całkowita szybkość reakcji [ wypadkowa ] określa wtedy
szybkość reakcji przebiegającej najwolniej
szybkość reakcji przebiegającej najwolniej
.
.
Sprzężenie takie wykazują reakcje przemiany materii w
Sprzężenie takie wykazują reakcje przemiany materii w
organizmach żywych.
organizmach żywych.
okres półtrwania t
okres półtrwania t
1/2
1/2
= okres połowicznej przemiany
= okres połowicznej przemiany
Jest to następna wielkość charakteryzująca kinetykę
Jest to następna wielkość charakteryzująca kinetykę
reakcji. Określa czas po którym stężenie substratu
reakcji. Określa czas po którym stężenie substratu
zmniejszy się o połowę w stosunku do stężenia
zmniejszy się o połowę w stosunku do stężenia
początkowego.
początkowego.
Wartość t
Wartość t
1/2
1/2
obliczmy podstawiając do równania na stałą
obliczmy podstawiając do równania na stałą
szybkości c = c
szybkości c = c
0
0
/2 gdzie c
/2 gdzie c
0
0
– stężenie początkowe.
– stężenie początkowe.
Dla reakcji I rzędu:
Dla reakcji I rzędu:
czyli
czyli
Dla reakcji II rzędu:
Dla reakcji II rzędu:
0
0
2
1
0
0
2
1
ln
2
ln
1
2
ln
1
c
c
t
c
c
t
k
I
I
I
k
k
t
693
,
0
2
ln
2
1
0
2
1
1
c
k
t
II
Dla reakcji III rzędu:
Dla reakcji III rzędu:
Okres półtrwania dla tych reakcji jest odwrotnie
Okres półtrwania dla tych reakcji jest odwrotnie
proporcjonalny do kwadratu stężenia początkowego.
proporcjonalny do kwadratu stężenia początkowego.
Dla reakcji „0” rzędu
Dla reakcji „0” rzędu
2
0
2
1
2
3
c
k
t
III
0
0
2
1
2 k
c
t
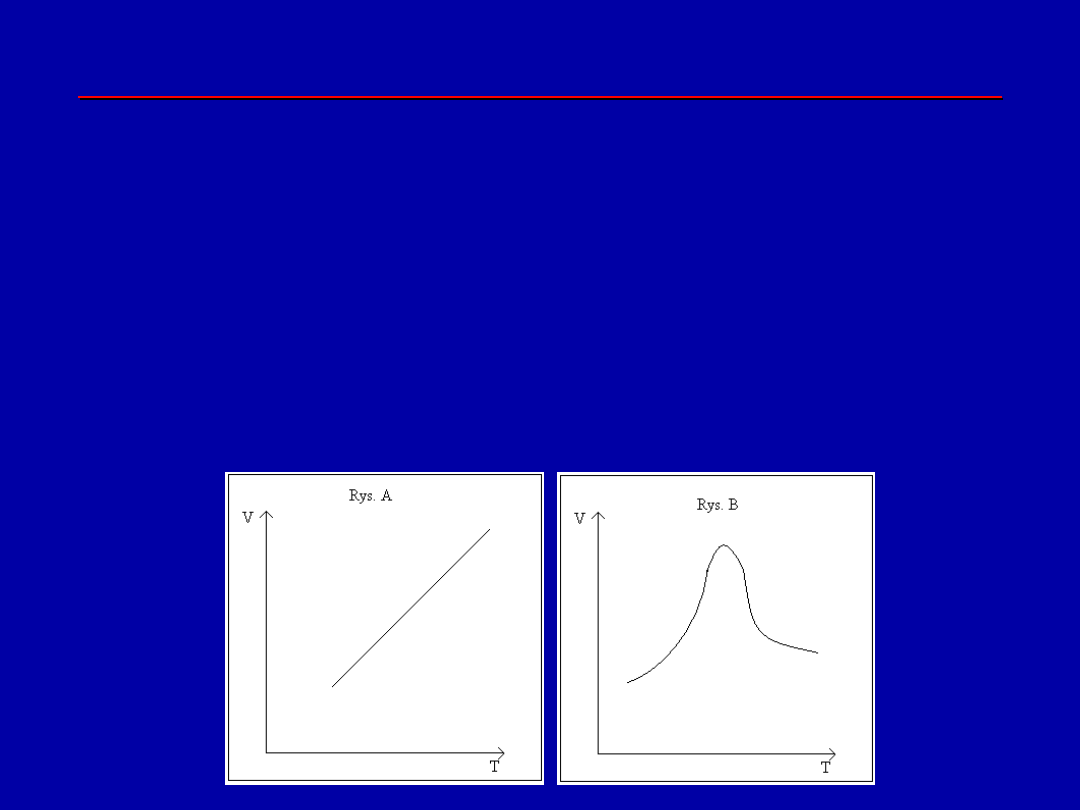
ZALEŻNOŚĆ SZYBKOŚCI REAKCJI OD TEMPERATURY
ZALEŻNOŚĆ SZYBKOŚCI REAKCJI OD TEMPERATURY
Ze wzrostem T wzrasta:
Ze wzrostem T wzrasta:
- prędkość poruszających się cząsteczek
- prędkość poruszających się cząsteczek
- energia kinetyczna cząsteczek
- energia kinetyczna cząsteczek
- liczba zderzeń efektywnych
- liczba zderzeń efektywnych
- energia zderzeń
- energia zderzeń
Dla reakcji endotermicznych szybkość rośnie z
Dla reakcji endotermicznych szybkość rośnie z
temperaturą w sposób wykładniczy
temperaturą w sposób wykładniczy

Znanych jest cały szereg reakcji katalizowanych przez
Znanych jest cały szereg reakcji katalizowanych przez
enzymy, których szybkość przyjmuje wartość max np. w
enzymy, których szybkość przyjmuje wartość max np. w
temperaturze 36
temperaturze 36
0
0
C (rys. B).
C (rys. B).
Dla reakcji przebiegających wg. zależności wykładniczej
Dla reakcji przebiegających wg. zależności wykładniczej
(rys. A) – większość reakcji ma zastosowanie
(rys. A) – większość reakcji ma zastosowanie
Reguła van’t
Reguła van’t
Hoffa
Hoffa
:
:
W reakcjach jednofazowych podwyższenie temperatury
W reakcjach jednofazowych podwyższenie temperatury
o 10
o 10
0
0
C zwiększa szybkość reakcji 2-4 krotnie. Wpływ T jest
C zwiększa szybkość reakcji 2-4 krotnie. Wpływ T jest
większy przy niskich temperaturach - zbliżonych do T =
większy przy niskich temperaturach - zbliżonych do T =
20
20
0
0
C.
C.
Współczynnik temperaturowy reakcji Q
Współczynnik temperaturowy reakcji Q
– wskazuje ile
– wskazuje ile
razy wzrośnie stała szybkości reakcji przy wzroście
razy wzrośnie stała szybkości reakcji przy wzroście
temperatury o 10
temperatury o 10
0
0
C.
C.
T
T
k
k
Q
10

ENERGIA AKTYWACJI
ENERGIA AKTYWACJI
Aby zderzenia były efektywne - doprowadziły do
Aby zderzenia były efektywne - doprowadziły do
utworzenia nowych wiązań, zderzające się cząsteczki
utworzenia nowych wiązań, zderzające się cząsteczki
muszą posiadać
muszą posiadać
energię większą od energii granicznej
energię większą od energii granicznej
charakterystycznej dla ich stanu podstawowego
charakterystycznej dla ich stanu podstawowego
.
.
Ten „nadmiar” energii – zwany
Ten „nadmiar” energii – zwany
energią aktywacji
energią aktywacji
zostaje
zostaje
zużyty na:
zużyty na:
- rozluźnienie wiązań w substratach
- rozluźnienie wiązań w substratach
- przegrupowanie atomów i elektronów w produktach
- przegrupowanie atomów i elektronów w produktach
pośrednich
pośrednich
- pokonanie sił odpychania pomiędzy cząsteczkami
- pokonanie sił odpychania pomiędzy cząsteczkami
substratów
substratów

Z energią aktywacji wiąże się pojęcie
Z energią aktywacji wiąże się pojęcie
stanu przejściowego
stanu przejściowego
lub
lub
kompleksu aktywnego
kompleksu aktywnego
który jest:
który jest:
- krótkotrwały
- krótkotrwały
- w stanie energetycznym niezbędnym do zajścia reakcji –
- w stanie energetycznym niezbędnym do zajścia reakcji –
osiągnął odpowiednią energię aktywacji
osiągnął odpowiednią energię aktywacji
- rozpadając się może dawać zarówno substraty jak i
- rozpadając się może dawać zarówno substraty jak i
produkty
produkty
Możliwość utworzenia przejściowego kompleksu
Możliwość utworzenia przejściowego kompleksu
aktywnego zmniejsza próg energii aktywacji ponieważ
aktywnego zmniejsza próg energii aktywacji ponieważ
stopniowe powstawanie kompleksu powoduje
stopniowe powstawanie kompleksu powoduje
„słabnięcie” wiązań pierwotnych a wzmocnienie nowych.
„słabnięcie” wiązań pierwotnych a wzmocnienie nowych.
Zapotrzebowanie na energię jest więc częściowo
Zapotrzebowanie na energię jest więc częściowo
kompensowane przez energię uwalnianą podczas
kompensowane przez energię uwalnianą podczas
tworzenia nowych wiązań.
tworzenia nowych wiązań.
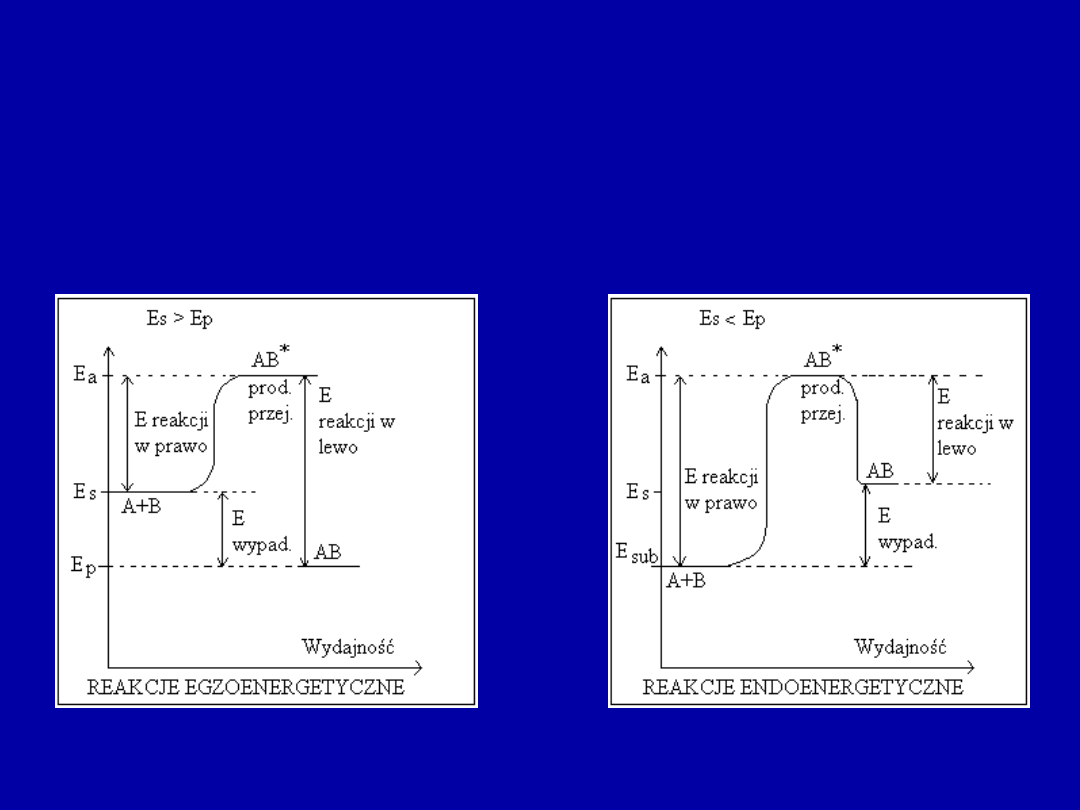
Szybkość reakcji zależeć będzie od:
Szybkość reakcji zależeć będzie od:
- stężenia kompleksu aktywnego
- stężenia kompleksu aktywnego
- szybkości jego rozpadu
- szybkości jego rozpadu

Energia
aktywac
ji
kJ/mol
Czas
połowiczne
j
przemiany t
1/2
reakcja I
rzędu t =
27
o
C
62,7
0,007 s
83,6
14,0 s
104,5
13,0 godz.
125,4
38,0 godz.
Bardzo szybko przebiegają reakcje jonowe w roztworach.
Ich energia aktywacji jest tak mała, że prawie każde
zderzenie może być efektywne.
Bardzo wolno zachodzą reakcje cząsteczkowe w chemii
organicznej w temperaturze 20oC większość z nich nie
zachodzi. Należy wtedy zastosować substancje obniżające
energię aktywacji.

KATALIZATORY
KATALIZATORY
Katalizator przyśpiesza reakcję, obniżając energię
Katalizator przyśpiesza reakcję, obniżając energię
aktywacji. Jest to możliwe poprzez zmianę mechanizmu
aktywacji. Jest to możliwe poprzez zmianę mechanizmu
reakcji.
reakcji.
Katalizatory same uczestniczą w reakcji chemicznej a po jej
Katalizatory same uczestniczą w reakcji chemicznej a po jej
zakończeniu pozostają niezmienione.
zakończeniu pozostają niezmienione.
Kataliza może być jedno lub wieloetapowa. W I etapie może
Kataliza może być jedno lub wieloetapowa. W I etapie może
zachodzić wiązanie substratu z katalizatorem i tworzenie
zachodzić wiązanie substratu z katalizatorem i tworzenie
nietrwałego związku przejściowego kA.
nietrwałego związku przejściowego kA.
II etap – rozkład związku kA pod działaniem substratu B i
II etap – rozkład związku kA pod działaniem substratu B i
powstanie produktu AB, a równocześnie uwalnia się
powstanie produktu AB, a równocześnie uwalnia się
katalizator.
katalizator.
kA* + B
kA* + B
kAB*
kAB*
AB + k
AB + k
kompleks
kompleks
aktywny
aktywny

Aby katalizowana reakcja miała dużą szybkość powstające
Aby katalizowana reakcja miała dużą szybkość powstające
związki przejściowe nie mogą być zbyt trwałe.
związki przejściowe nie mogą być zbyt trwałe.
Różnica między procesem katalizowanym nie polega na
Różnica między procesem katalizowanym nie polega na
sposobie pokonywania bariery energetycznej. Przy
sposobie pokonywania bariery energetycznej. Przy
udziale katalizatora tych barier jest większa liczba,
udziale katalizatora tych barier jest większa liczba,
ale są niżej energetyczne.
ale są niżej energetyczne.
Zmniejszenie energii aktywacji zależy od aktywności
Zmniejszenie energii aktywacji zależy od aktywności
katalizatora.
katalizatora.
Katalizator nie zmienia
Katalizator nie zmienia
:
:
- położenia równowagi reakcji
- położenia równowagi reakcji
- termodynamicznych warunków reakcji
- termodynamicznych warunków reakcji
- ilości otrzymanych produktów z określonej ilości substratów
- ilości otrzymanych produktów z określonej ilości substratów
Zmienia
Zmienia
: jedynie szybkość dochodzenia reakcji do stanu
: jedynie szybkość dochodzenia reakcji do stanu
równowagi.
równowagi.

Cechy charakterystyczne katalizatora
Cechy charakterystyczne katalizatora
- aktywność: efektywnie mają działać nawet jego małe
- aktywność: efektywnie mają działać nawet jego małe
dawki, gdyż jest on regenerowany w czasie reakcji.
dawki, gdyż jest on regenerowany w czasie reakcji.
Katalizatory są tym aktywniejsze im silniej obniżają
Katalizatory są tym aktywniejsze im silniej obniżają
energię aktywacji
energię aktywacji
- selektywność lub specyficzność: np. reagują tylko z
- selektywność lub specyficzność: np. reagują tylko z
substancją „A” lub katalizują tylko jedną możliwą
substancją „A” lub katalizują tylko jedną możliwą
reakcję
reakcję
- odporność na starzenie: powodujące zmianę jego
- odporność na starzenie: powodujące zmianę jego
struktury krystalicznej, zmieniające liczbę centrów
struktury krystalicznej, zmieniające liczbę centrów
aktywnych, prowadzące nawet do utraty aktywności
aktywnych, prowadzące nawet do utraty aktywności
- odporność na zatrucia: zdolność zachowania aktywności
- odporność na zatrucia: zdolność zachowania aktywności
nawet w obecności zanieczyszczeń występujących w
nawet w obecności zanieczyszczeń występujących w
niewielkich ilościach
niewielkich ilościach

INHIBITOR
INHIBITOR
– to katalizator który tworzy związek
– to katalizator który tworzy związek
przejściowy o wyższej barierze energetycznej, trwały z
przejściowy o wyższej barierze energetycznej, trwały z
trudem przechodzący w produkt.
trudem przechodzący w produkt.
KATALIZA HOMOGENICZNA
KATALIZA HOMOGENICZNA
– katalizator i substraty
– katalizator i substraty
znajdują się w tej samej fazie.
znajdują się w tej samej fazie.
KATALIZA HETEROGENICZNA
KATALIZA HETEROGENICZNA
– katalizator jest
– katalizator jest
najczęściej w fazie stałej, a katalizuje proces w gazach lub
najczęściej w fazie stałej, a katalizuje proces w gazach lub
cieczach.
cieczach.
W takich procesach duże znaczenie mają procesy
W takich procesach duże znaczenie mają procesy
adsorpcji substratów na powierzchni katalizatora.
adsorpcji substratów na powierzchni katalizatora.
Taka kataliza obejmuje cały szereg procesów.
Taka kataliza obejmuje cały szereg procesów.
3
2
2
2
2
5
2
SO
O
SO
O
V

DYFUZJA I OSMOZA
DYFUZJA I OSMOZA
Dyfuzja
Dyfuzja
– to samoistne mieszanie się cząsteczek
– to samoistne mieszanie się cząsteczek
różnych substancji spowodowane kinetycznym ruchem
różnych substancji spowodowane kinetycznym ruchem
cząsteczek.
cząsteczek.
- Przemieszczanie się cząsteczek w przestrzeni lub w
- Przemieszczanie się cząsteczek w przestrzeni lub w
roztworze zachodzi zawsze z przestrzeni o
roztworze zachodzi zawsze z przestrzeni o
wyższym
wyższym
stężeniu do przestrzeni o stężeniu niższym
stężeniu do przestrzeni o stężeniu niższym
, nawet
, nawet
wbrew zasadzie ciężkości.
wbrew zasadzie ciężkości.
- Dyfuzja najszybciej zachodzi w gazach a najwolniej w
- Dyfuzja najszybciej zachodzi w gazach a najwolniej w
ciałach stałych, ale zawsze wzrasta wraz z
ciałach stałych, ale zawsze wzrasta wraz z
temperaturą.
temperaturą.

Ilościowo proces dyfuzji ujmuje prawo Ficka
Ilościowo proces dyfuzji ujmuje prawo Ficka
- określając liczbę moli substancji rozpuszczonej (n)
- określając liczbę moli substancji rozpuszczonej (n)
przechodzącą w jednostce czasu przez powierzchnię
przechodzącą w jednostce czasu przez powierzchnię
roztworu o przekroju A pomiędzy punktami o różnicy stężeń
roztworu o przekroju A pomiędzy punktami o różnicy stężeń
Δc,
Δc,
odległymi o Δx
odległymi o Δx
D – współczynnik dyfuzji ilościowo równy ilości substancji
D – współczynnik dyfuzji ilościowo równy ilości substancji
dyfundującej w jednostce czasu przez „A” = 1 cm
dyfundującej w jednostce czasu przez „A” = 1 cm
2
2
gdy Δc/Δx = 1
gdy Δc/Δx = 1
Δc/Δx = gradient stężenia – jest to spadek stężenia Δc
Δc/Δx = gradient stężenia – jest to spadek stężenia Δc
przypadający na odcinek Δx
przypadający na odcinek Δx
x
c
DA
n

Szybkość dyfuzji w gazach zależy od
Szybkość dyfuzji w gazach zależy od
:
:
- temperatury, powierzchni wymiany
- temperatury, powierzchni wymiany
- gradientu ciśnienia pomiędzy gazem w cieczy i nad cieczą
- gradientu ciśnienia pomiędzy gazem w cieczy i nad cieczą
- odwrotnie proporcjonalna do „M” gazu, długości drogi
- odwrotnie proporcjonalna do „M” gazu, długości drogi
dyfuzji, lepkości cieczy
dyfuzji, lepkości cieczy
Rozpuszczalność gazów w cieczach zależy od
Rozpuszczalność gazów w cieczach zależy od
:
:
- rodzaju obu substancji, ich polarności
- rodzaju obu substancji, ich polarności
- podobny rozpuszczalnik rozpuszcza podobne substancje
- podobny rozpuszczalnik rozpuszcza podobne substancje
[polarny – polarny]
[polarny – polarny]
- reakcji towarzyszących rozpuszczaniu
- reakcji towarzyszących rozpuszczaniu
- temperatury i ciśnienia i prawo Henry’ego
- temperatury i ciśnienia i prawo Henry’ego
T = const.
T = const.
p
k
m

p
k
m
T = const
T = const
.
.
[m] masa rozpuszczonego gazu w określonej objętości
cieczy jest wprost proporcjonalna do ciśnienia parcjalnego
(p) gazu nad roztworem.
k- współczynnik proporcjonalności zależny od T, rodzaju
gazu i rozpuszczalnika
- rozpuszczalność gazu w cieczy maleje ze wzrostem T
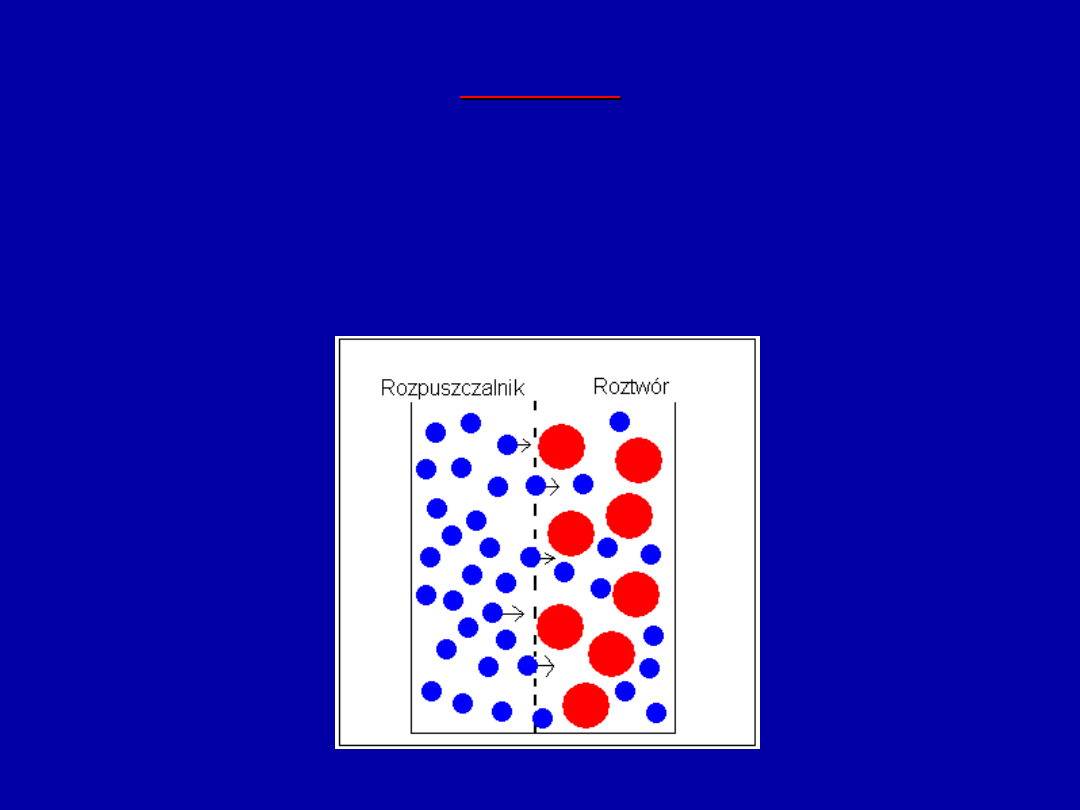
OSMOZA
OSMOZA
Jednostronna dyfuzja rozpuszczalnika przez błonę
Jednostronna dyfuzja rozpuszczalnika przez błonę
półprzepuszczalną oddzielającą rozpuszczalnik i
półprzepuszczalną oddzielającą rozpuszczalnik i
roztwór.
roztwór.

Przez małe otwory błony półprzepuszczalnej mogą
Przez małe otwory błony półprzepuszczalnej mogą
przenikać tylko małe cząsteczki rozpuszczalnika. Od
przenikać tylko małe cząsteczki rozpuszczalnika. Od
strony roztworu część przejść w błonie blokowana jest
strony roztworu część przejść w błonie blokowana jest
przez większe cząsteczki substancji rozpuszczonej. Na
przez większe cząsteczki substancji rozpuszczonej. Na
skutek przenikania rozpuszczalnika do roztworu maleje
skutek przenikania rozpuszczalnika do roztworu maleje
stężenie roztworu, zwiększa się jego objętość, wzrasta
stężenie roztworu, zwiększa się jego objętość, wzrasta
ciśnienie hydrostatyczne. Wraz ze wzrostem ciśnienia
ciśnienie hydrostatyczne. Wraz ze wzrostem ciśnienia
hydrostatycznego maleje szybkość osmozy (przenikanie
hydrostatycznego maleje szybkość osmozy (przenikanie
rozpuszczalnika).
rozpuszczalnika).
Ciśnienie hydrostatyczne przy którym ustaje osmoza
Ciśnienie hydrostatyczne przy którym ustaje osmoza
nazywa się ciśnieniem osmotycznym.
nazywa się ciśnieniem osmotycznym.
Przy takim ciśnieniu liczba cząstek rozpuszczalnika
Przy takim ciśnieniu liczba cząstek rozpuszczalnika
przenikających przez błonę w obie strony jest jednakowa.
przenikających przez błonę w obie strony jest jednakowa.
Van’t Hoff uważał że cząsteczki substancji rozpuszczonej
Van’t Hoff uważał że cząsteczki substancji rozpuszczonej
przypominają swym zachowaniem cząsteczki gazu
przypominają swym zachowaniem cząsteczki gazu
doskonałego wypełniającego dostępną przestrzeń.
doskonałego wypełniającego dostępną przestrzeń.
Wobec tego dla ciśnienia osmotycznego roztworu można
Wobec tego dla ciśnienia osmotycznego roztworu można
wyprowadzić zależność podobną do prawa Clapeyrona:
wyprowadzić zależność podobną do prawa Clapeyrona:
c – stężenie molalne roztworu – dla rozcieńczonych r-rów
c – stężenie molalne roztworu – dla rozcieńczonych r-rów
wodnych = C
wodnych = C
m
m
V – objętość roztworu
V – objętość roztworu
n - liczba moli substancji rozpuszczonej
n - liczba moli substancji rozpuszczonej
R – stała gazowa T – temperatura
R – stała gazowa T – temperatura
o
o
K
K
cRT
V
n
c
nRT
V

Ciśnienie osmotyczne
Ciśnienie osmotyczne
roztworu równe jest ciśnieniu, jakie
roztworu równe jest ciśnieniu, jakie
wywarła by substancja rozpuszczona gdyby jako gaz w
wywarła by substancja rozpuszczona gdyby jako gaz w
danej T zajęła objętość taką jak roztwór.
danej T zajęła objętość taką jak roztwór.
Wynika stąd że
Wynika stąd że
:
:
- w T = const. W roztworach nieelektrolitów
- w T = const. W roztworach nieelektrolitów
Π
Π
~ c [stężenia]
~ c [stężenia]
czyli ilości cząsteczek osmotycznie czynnych
czyli ilości cząsteczek osmotycznie czynnych
- wielkość
- wielkość
Π
Π
przy V = const. i T = const. nie zależy od
przy V = const. i T = const. nie zależy od
substancji rozpuszczonej ani od rodzaju rozpuszczalnika,
substancji rozpuszczonej ani od rodzaju rozpuszczalnika,
ale od liczby osmotycznie czynnych indywiduów, którymi
ale od liczby osmotycznie czynnych indywiduów, którymi
mogą być cząsteczki nieelektrolitu, jony itp.
mogą być cząsteczki nieelektrolitu, jony itp.
- ciśnienie
- ciśnienie
Π
Π
jest wprost proporcjonalne do T jeśli V = const.
jest wprost proporcjonalne do T jeśli V = const.
- równe objętości roztw. o jednakowym
- równe objętości roztw. o jednakowym
Π
Π
zawierają
zawierają
jednakową liczbę cząsteczek osmotycznie czynnych jeżeli
jednakową liczbę cząsteczek osmotycznie czynnych jeżeli
ich „V” jest taka sama
ich „V” jest taka sama
- roztwory równocząsteczkowe mają takie same
- roztwory równocząsteczkowe mają takie same
Π
Π
-
-
Π
Π
roztworów zawierających kilka substancji osmotycznie
roztworów zawierających kilka substancji osmotycznie
czynnych równe jest Σ
czynnych równe jest Σ
Π
Π
poszczególnych składników
poszczególnych składników
- w roztworach elektrolitów o dużym stopniu dysocjacji
- w roztworach elektrolitów o dużym stopniu dysocjacji
każdy jon jest odpowiedzialny za
każdy jon jest odpowiedzialny za
Π
Π

inRT
Współczynnik izotoni
e
teoretyczn
e
erymenta
i
ln
exp
= poprawka dla elektrolitów
Warunek konieczny dla osmozy
Różna liczba cząstek osmotycznie czynnych po obu
stronach błony półprzepuszczalnej.
Roztwory izoosmotyczne – posiadają jednakowe Π przy
takiej samej ilości osmotycznie czynnych cząsteczek.
Jednostką Π jest Osmol. Jest to Π jakie w t = 0
o
C wywiera
roztwór nie dysocjującego o c = 1M/kg rozpuszczalnika.
Roztwory takie względem wody wykazują ciśnienie Π =
22690 hPa = 22,4 atm

Naturalne błony półprzepuszczalne
Naturalne błony półprzepuszczalne
- jelita, pęcherz moczowy
- jelita, pęcherz moczowy
Roztwory izotoniczne
Roztwory izotoniczne
– takie dwa roztwory, które
– takie dwa roztwory, które
oddzielone błoną półprzepuszczalną, nie wykazują
oddzielone błoną półprzepuszczalną, nie wykazują
żadnego ciśnienia Π np. 0,85 – 0,90 % NaCl i krew
żadnego ciśnienia Π np. 0,85 – 0,90 % NaCl i krew
Roztwory hipertoniczne
Roztwory hipertoniczne
– roztwory o Π wyższym niż
– roztwory o Π wyższym niż
inne roztwory. [plazmoliza krwinek – obkurczanie]
inne roztwory. [plazmoliza krwinek – obkurczanie]
Roztwory hipotoniczne
Roztwory hipotoniczne
– jeżeli ich Π jest niższe od
– jeżeli ich Π jest niższe od
innych roztworów
innych roztworów
Krwinka umieszczona w takim roztworze pobiera
Krwinka umieszczona w takim roztworze pobiera
H
H
2
2
O, najpierw pęcznieje, następnie pęka
O, najpierw pęcznieje, następnie pęka
wydzielając hemoglobinę – [hemoliza] krwinek w
wydzielając hemoglobinę – [hemoliza] krwinek w
0,45% roztworze NaCl
0,45% roztworze NaCl

UKŁADY DYSPERSYJNE
UKŁADY DYSPERSYJNE
W zależności od stopnia rozdrobnienia substancji
W zależności od stopnia rozdrobnienia substancji
rozpuszczonej wyróżnia się 3 typy układów
rozpuszczonej wyróżnia się 3 typy układów
dyspersyjnych:
dyspersyjnych:
1.
1.
Roztwory właściwe – rozdrobnienie cząstek
Roztwory właściwe – rozdrobnienie cząstek
mniejsze od 10
mniejsze od 10
-7
-7
cm
cm
2.
2.
Roztwory koloidalne – cząstki substancji
Roztwory koloidalne – cząstki substancji
rozpuszczonej mają wymiary 10
rozpuszczonej mają wymiary 10
-7
-7
– 10
– 10
-5
-5
cm
cm
3.
3.
Mieszaniny niejednorodne – zawiesiny o cząstkach
Mieszaniny niejednorodne – zawiesiny o cząstkach
>10
>10
-5
-5
[rozdrobnienie mechaniczne]
[rozdrobnienie mechaniczne]

CECHY CHARAKTERYSTYCZNE TYCH UKŁADÓW
CECHY CHARAKTERYSTYCZNE TYCH UKŁADÓW
I. Roztwory
właściwe
II. Koloidy
III. Zawiesiny
1. nie
widoczne
w ultra-
mikroskopie
1. przechodz
ą przez
ultrasączki
3.
dyfundują,
dializują
1. widoczne w
ultramikro-
skopie
2. przechodzą
przez bibułę
ultrasączka
3. nie dyfundują
4. nie dializują lub
bardzo wolno
5. wykazują ruchy
Browna
6. wykazują małe
wartości
ΔT
w
i ΔT
k
i Π
1. widoczne w
mikroskopie
2. nie przechodzą
przez zwykłą
bibułę
3. nie dyfundują
4. nie dializują
5. nie wykazują
ruchów Browna
I. Rodzaje układów koloidalnych
I. Rodzaje układów koloidalnych
faza
rozproszo
na
faza
rozpraszają
ca
koloid
przykład
gaz
ciecz
ciało stałe
gaz
gaz
gaz
---
aerozol ciekły
aerozol stały
---
mgła
dym, kurz
gaz
ciecz
ciało stałe
ciecz
ciecz
ciecz
piana
emulsja
zole =
roztwory
koloidowe
mydlana, piwna
mleko, majonez,
krem
zole tlenków
metali,
wodorotlenków,
farby,
polimery, lakiery
gaz
ciecz
ciało stałe
ciało stałe
ciało stałe
ciało stałe
piana trwała
emulsja stała
zole stałe
pumeks, styropian
opale, galaretki
szkło rubinowe,
barwne kryształy

II. Podział ze względu na wymiary cząstek
II. Podział ze względu na wymiary cząstek
- monodyspersyjne – trzy wymiary cząstek jednakowe
- monodyspersyjne – trzy wymiary cząstek jednakowe
- polidyspersyjne – cząstki mają różne wymiary
- polidyspersyjne – cząstki mają różne wymiary
III. Zachowanie po odparowaniu suchej pozostałości
III. Zachowanie po odparowaniu suchej pozostałości
- odwracalne typu żelatyny, gumy arabskiej
- odwracalne typu żelatyny, gumy arabskiej
- nieodwracalne – lakiery
- nieodwracalne – lakiery

IV. Stosunku fazy rozproszonej i ośrodka rozpraszającego
IV. Stosunku fazy rozproszonej i ośrodka rozpraszającego
- liofilowe: siarczki i wodorotlenki metali
- liofilowe: siarczki i wodorotlenki metali
- liofobowe: siarka koloidalna
- liofobowe: siarka koloidalna
Najważniejsze i najbardziej rozpowszechnione są układy
Najważniejsze i najbardziej rozpowszechnione są układy
cieczy w cieczy i ciała stałe w cieczy – zole (większość
cieczy w cieczy i ciała stałe w cieczy – zole (większość
płynów ustrojowych).
płynów ustrojowych).
zol żel
zol żel
PEPTYZACJA
KOAGULACJA

zol
zol
– pojedyncze cząstki są od siebie izolowane przez
– pojedyncze cząstki są od siebie izolowane przez
rozpuszczalnik
rozpuszczalnik
żel
żel
– konsystencja galarety w której substancja
– konsystencja galarety w której substancja
rozpuszczona tworzy sieć przestrzenną a rozpuszczalnik
rozpuszczona tworzy sieć przestrzenną a rozpuszczalnik
wypełnia w niej puste miejsca
wypełnia w niej puste miejsca
Rozdrobnienie koloidalne wykazuje bardzo dużą
Rozdrobnienie koloidalne wykazuje bardzo dużą
powierzchnię fazy rozproszonej, np. 1g ciała stałego o
powierzchnię fazy rozproszonej, np. 1g ciała stałego o
strukturze sześcianu o wymiarze 1 cm
strukturze sześcianu o wymiarze 1 cm
2
2
ma powierzchnię 6
ma powierzchnię 6
cm
cm
2
2
, po rozdrobnieniu do 10
, po rozdrobnieniu do 10
-5
-5
cm otrzymuje się 10
cm otrzymuje się 10
15
15
sześcianów cząstek koloidalnych co daje 6 ∙ 10
sześcianów cząstek koloidalnych co daje 6 ∙ 10
-5
-5
∙ 10
∙ 10
15
15
cm
cm
2
2
= 60m
= 60m
2
2
. Koloidy mają więc zdolność sorbowania na
. Koloidy mają więc zdolność sorbowania na
swojej powierzchni dużej ilości jonów z roztworu.
swojej powierzchni dużej ilości jonów z roztworu.
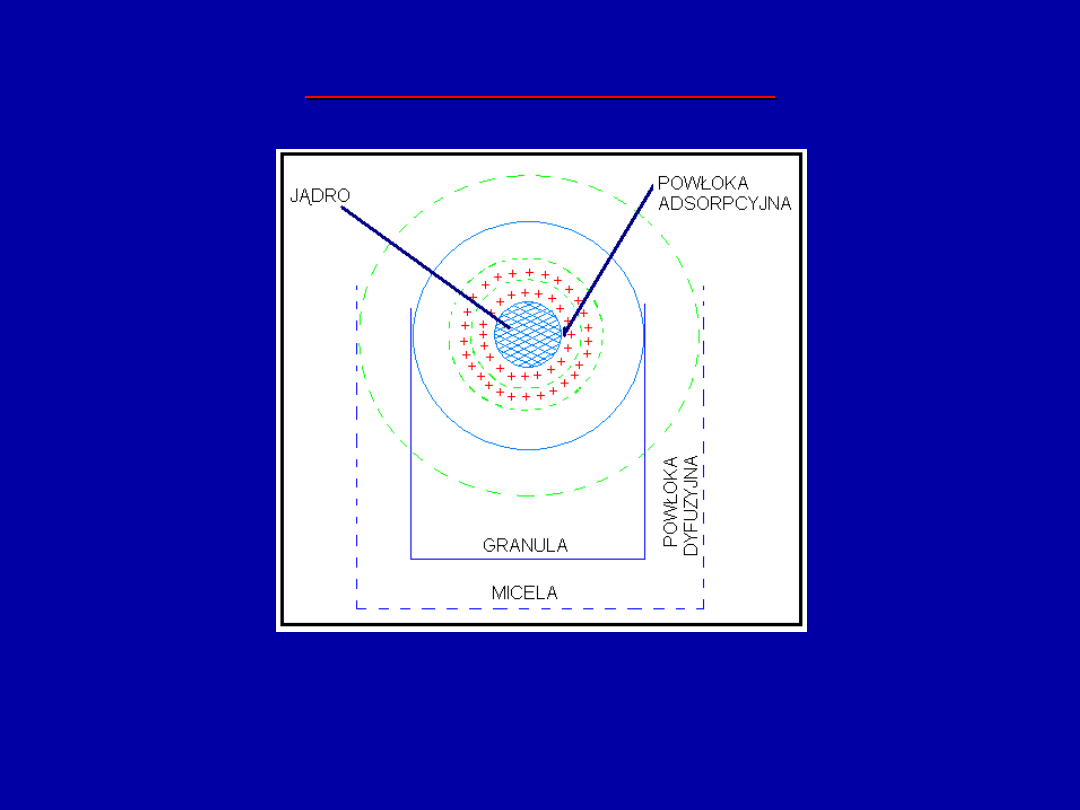
BUDOWA MICELI KOLOIDU
BUDOWA MICELI KOLOIDU
GRANULA = JĄDRO + POWŁOKA ADSORPCYJNA
GRANULA = JĄDRO + POWŁOKA ADSORPCYJNA
MICELA = GRANULA + POWŁOKA DYFUZYJNA
MICELA = GRANULA + POWŁOKA DYFUZYJNA

Roztwory micelarne
Roztwory micelarne
– ich cząsteczki mają niewielkie
– ich cząsteczki mają niewielkie
rozmiary i niewielkie ciężary cząsteczkowe: mydła,
rozmiary i niewielkie ciężary cząsteczkowe: mydła,
detergenty, kwasy żółciowe. Jeżeli ich stężenie jest
detergenty, kwasy żółciowe. Jeżeli ich stężenie jest
niewielkie, to ich właściwości zbliżone są do właściwości
niewielkie, to ich właściwości zbliżone są do właściwości
roztworów rzeczywistych.
roztworów rzeczywistych.
Roztwory molekularne
Roztwory molekularne
– koloidy o dużych rozmiarach
– koloidy o dużych rozmiarach
cząsteczek i dużych ciężarach cząsteczkowych:
cząsteczek i dużych ciężarach cząsteczkowych:
wielkocząsteczkowe biopolimery, kwasy nukleinowe,
wielkocząsteczkowe biopolimery, kwasy nukleinowe,
białka, polisacharydy.
białka, polisacharydy.
Emulsje
Emulsje
– koloidy tworzone przez tłuszcze, glikolipidy,
– koloidy tworzone przez tłuszcze, glikolipidy,
fosfolipidy.
fosfolipidy.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
- Slide 116
- Slide 117
- Slide 118
- Slide 119
- Slide 120
- Slide 121
- Slide 122
- Slide 123
- Slide 124
- Slide 125
- Slide 126
- Slide 127
- Slide 128
- Slide 129
- Slide 130
- Slide 131
- Slide 132
- Slide 133
- Slide 134
- Slide 135
- Slide 136
- Slide 137
- Slide 138
- Slide 139
- Slide 140
- Slide 141
- Slide 142
- Slide 143
- Slide 144
- Slide 145
- Slide 146
- Slide 147
- Slide 148
- Slide 149
- Slide 150
- Slide 151
- Slide 152
- Slide 153
- Slide 154
- Slide 155
- Slide 156
- Slide 157
- Slide 158
- Slide 159
- Slide 160
- Slide 161
- Slide 162
Wyszukiwarka
Podobne podstrony:
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Chemia ogolna wyklady 5 6 2012 Nieznany
CHEMIA OGÓLNA
Chemia ogolna zagadnienia na zaliczenie wykla
Jasiorski, chemia ogólna, Opracowane zagadninia na kolowium
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
przemiany jadrowe, Nauka, CHEMIA, Szkoła, Chemia ogólna
download, chemia ogólna
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
więcej podobnych podstron