
MECHANIKA
KWANTOWA

Wszystkie cząstki mają tę własność, że czasem, w
niektórych eksperymentach zachowują się jak fale, a
czasem jak zwykłe cząstki. Wzory
obowiązują zawsze
IDEA DE BROGLIE’A
h
p
hf
E
Potrzebny jest nowy język i nowy aparat matematyczny do opisu takich
tworów
MECHANIKA KWANTOWA
ilość
elektronów
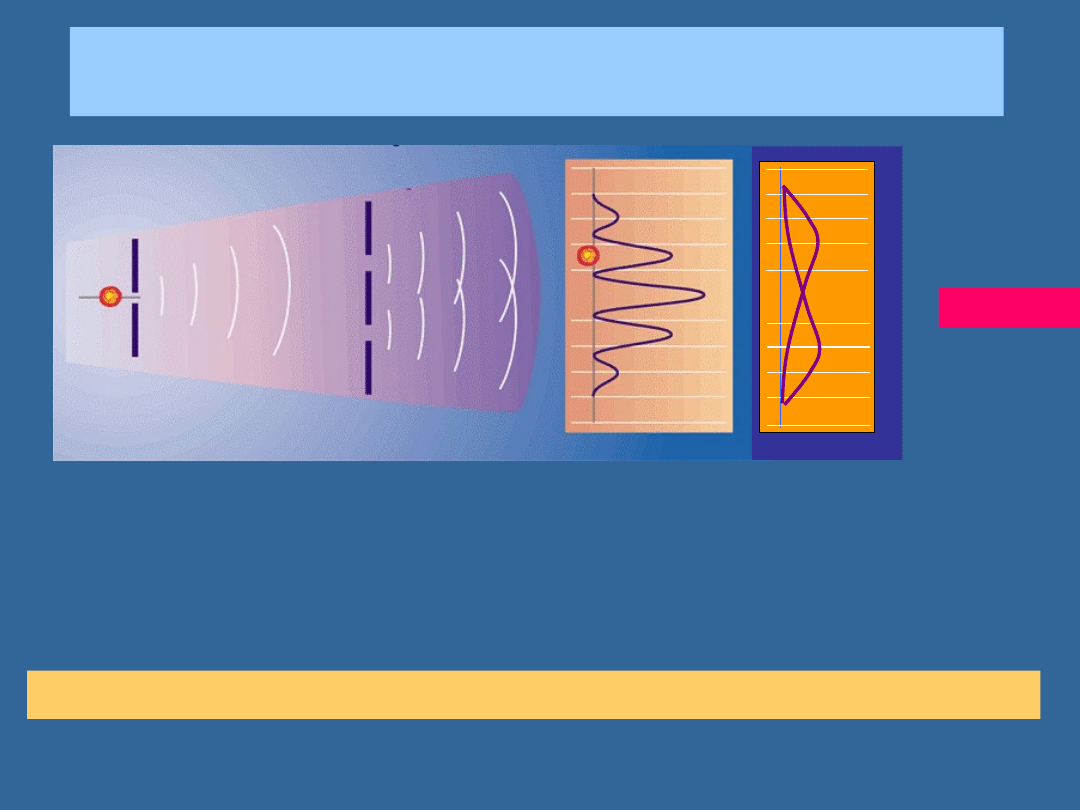
PRZEJŚCIE CZĄSTEK PRZEZ SZCZELINY:
ELEKTRONY
Elektrony:
Davisson, Germer, 1927
Jönsson, 1961
interfer
Dyfrakcja elektronów na sieci krystalicznej jest klasyczną metodą badania
struktury
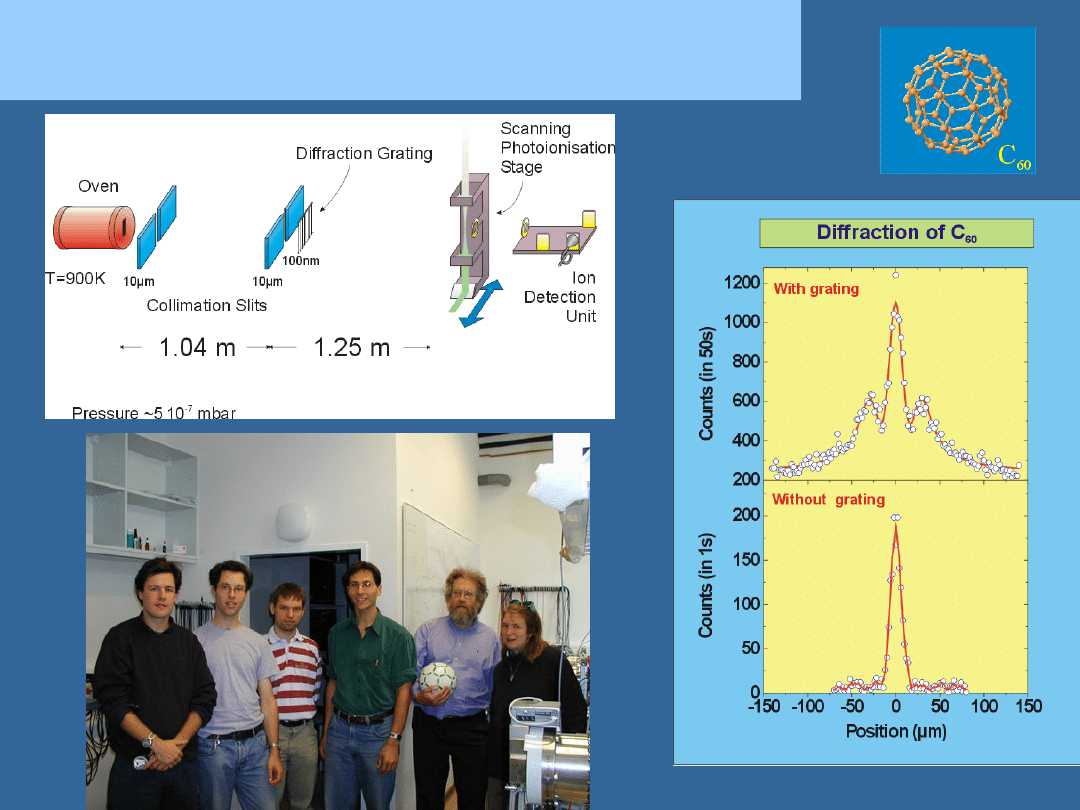
A. Zillinger, 1999
PRZEJŚCIE CZĄSTEK PRZEZ SZCZELINY:
FULERENY
0
50000
100000
150000
200000
0
100
200
300
400
500
600
Fe
3
O
4
N
at
ęż
e
n
ie
czas przelotu długość fali
neutronu
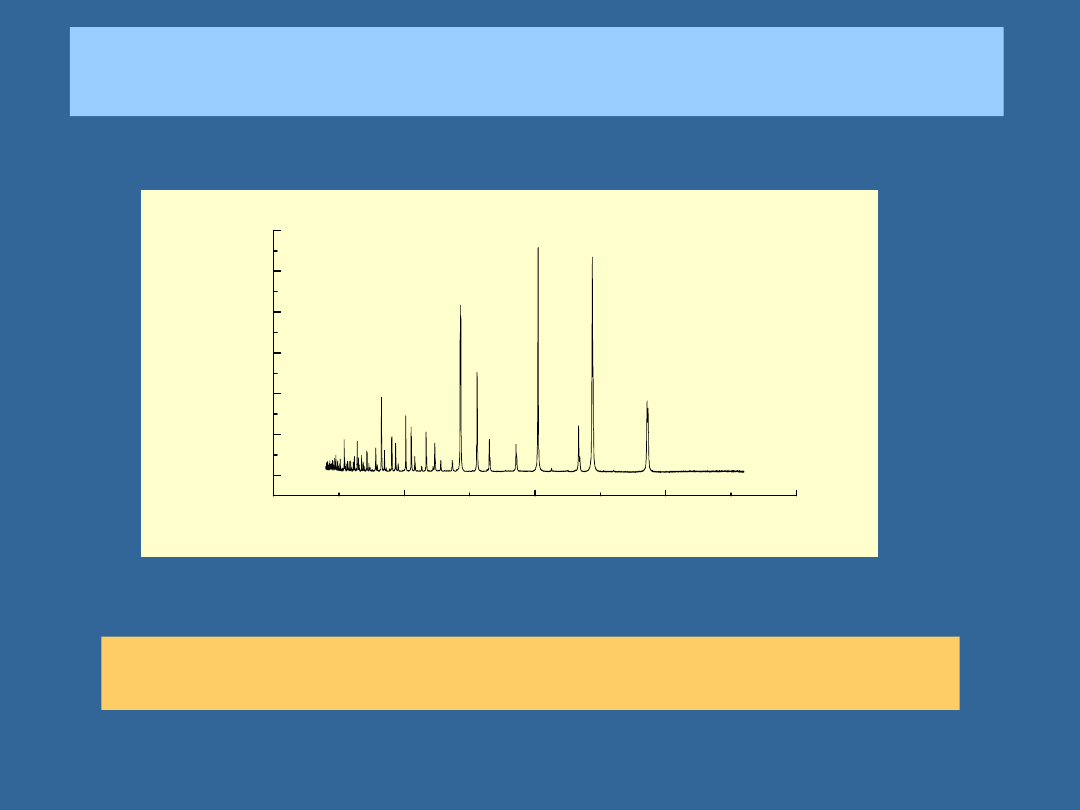
Dyfrakcja neutronów jest klasyczną metodą badania struktury i
ułożenia momentów magnetycznych
PRZEJŚCIE CZĄSTEK PRZEZ SZCZELINY:
NEUTRONY

FUNKCJA FALOWA I RÓWNANIE SCHRÖDINGERA
Paradoks interferencji cząstek na szczelinach, lub zjawiska fotoelektrycznego
może być rozwiązany przyjmując, że opis cząstki wymaga podania amplitudy
prawdopodobieństwa
(x, y, z, t)
(funkcji falowej) , która jest funkcją
położenia i czasu.
Prawdopodobieństwo, znalezienia cząstki w chwili t w miejscu (x,y,z) jest
kwadratem modułu funkcji falowej
P(x, y, z, t)= l(x, y, z, t)l
2
Jeśli interesują nas tylko stany cząstek które nie zależą od czasu (tj.
stany o określonej energii), to wystarczy rozwiązać równanie
Schrödingera niezależne od czasu
)
x
(
E
)
x
(
))
x
(
V
dx
d
m
2
(
2
2
2
równanie na funkcje
własne (x) i wartości
własne E
Jak znaleźć funkcję
falową?

Nie jest możliwa jednoczesna znajomość pewnych własności „cząstek”
Wielkości, które nie mogą być jednocześnie określone nazywają się
wielkościami „
komplementarnymi
”
ZASADA NIEOZNACZONOŚCI HEISENBERGA
- Nie jest możliwe jednoczesne określenie pędu cząstki i jej położenia
x* p
x
-Czym krótszy czas pomiaru, tym mniej dokładny jest pomiar energii
E* t
- Nie jest możliwe jednoczesne określenie szczeliny przez którą
„cząstka” przechodzi i zobaczenie efektu interferencyjnego

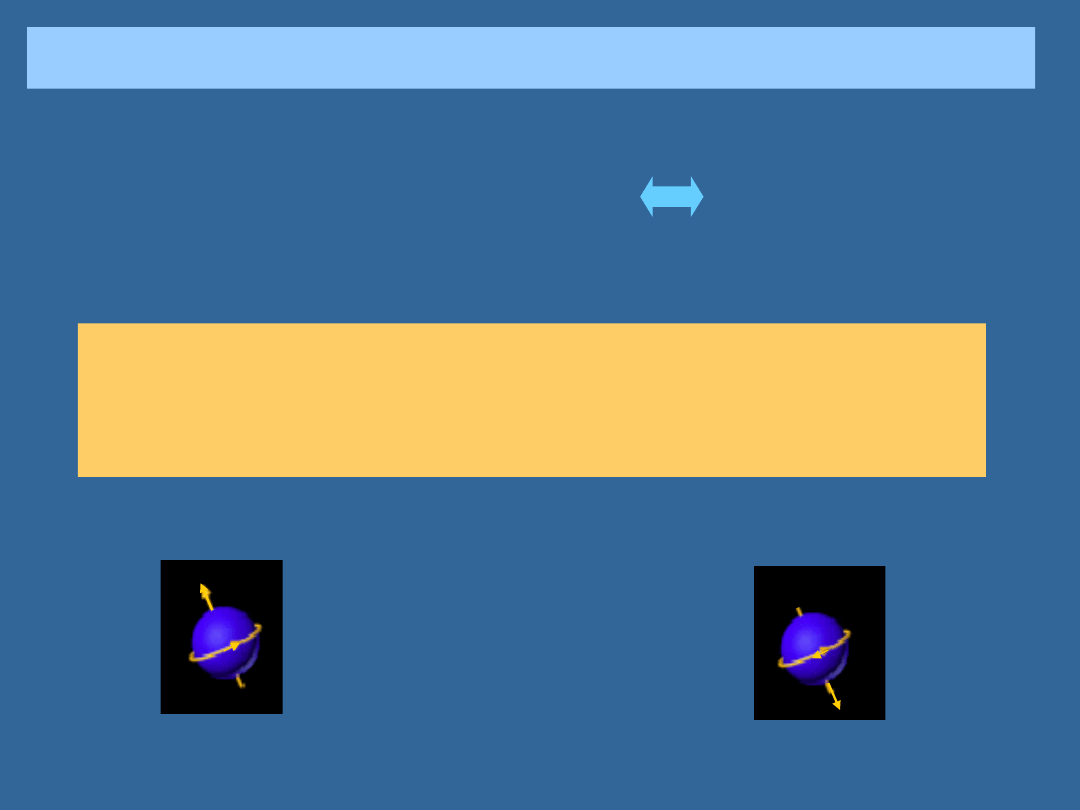
DWA RODZAJE CZĄSTEK: FERMIONY I BOZONY
BOZONY
FERMIONY
Fotony (i inne cząstki o spinie h/2
lub wielokrotności)
Jeśli elektron, lub inna cząstka o spinie
“połówkowym” jest w pewnym stanie
kwantowym, to żadna inna taka
cząstka w tym samym stanie znaleźć
się nie może. (Zakaz Pauliego)
prawdopodobieństwo tego, że do
grupy cząstek w tym samym stanie
dojdzie jeszcze jedna jest tym
większe, im więcej cząstek już w
tym stanie przebywa.
budowa atomów, układ okresowy,
własności materii
lasery,
nadprzewodnictwo
Elektrony ( i wszystkie innych cząstki
o wewnętrznym momencie pędu,
spinie, równym 1/2 h/2, lub
nieparzystej wielokrotności)
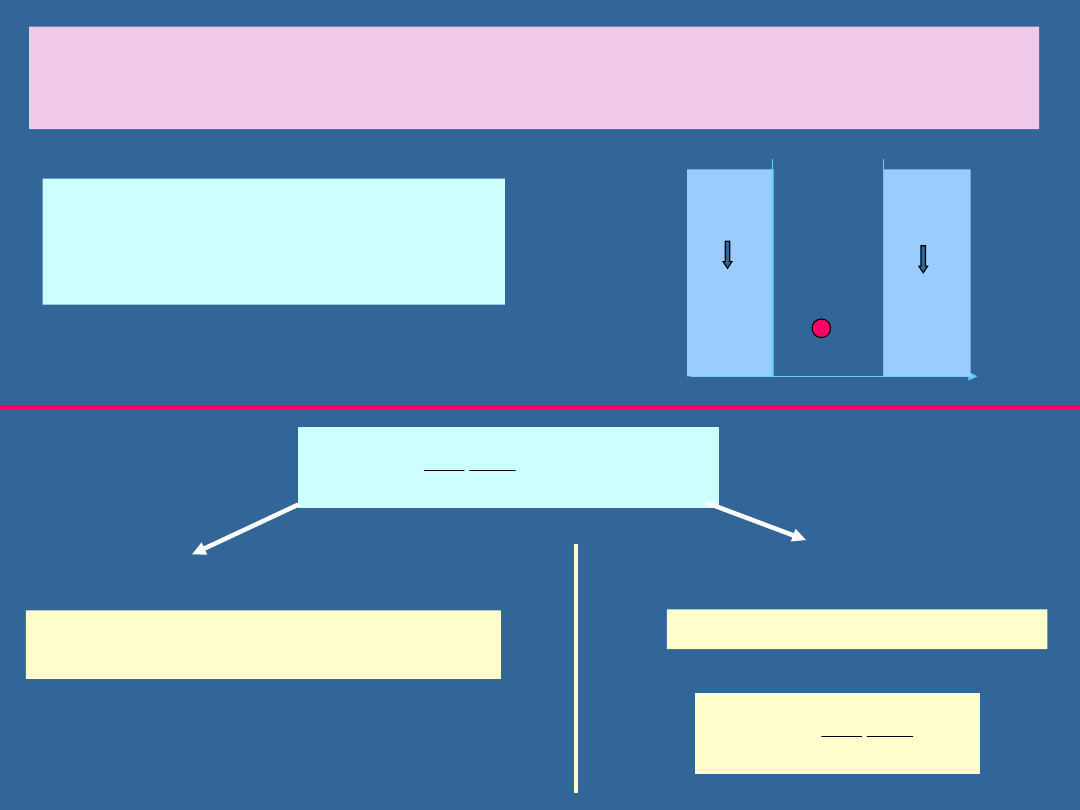
PRZYKŁAD:
ELEKTRON W NIESKOŃCZONEJ STUDNI
POTENCJAŁU
(x)=
0
V=
V=0
V=
(x)=
0
x
0
L
Znaleźć możliwe energie E i
odpowiadające im funkcje falowe
(x) elektronu w nieskończonej
studni potencjału
)
x
(
dx
d
m
2
)
x
(
E
2
2
2
Elektron nie może być w tym
obszarze: (x)=0 dla x<0 i x>L
)
x
(
)
x
(
V
)
x
(
dx
d
m
2
)
x
(
E
2
2
2
ROZWIĄZANIE
elektron jest swobodny
x<0 i x>L
V(x)=
0<x<L V(x)=0
równanie Schrödingera
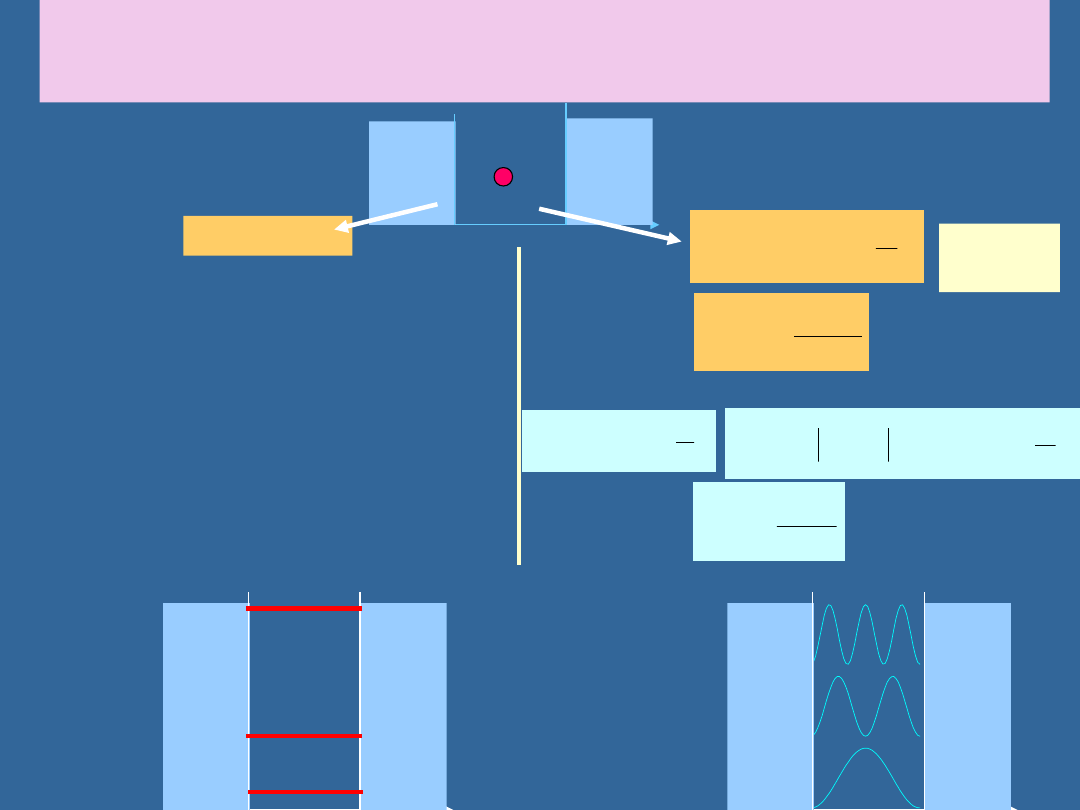
ELEKTRON W NIESKOŃCZONEJ STUDNI POTENCJAŁU:
ROZWIĄZANIE
x
L
n
sin
A
)
x
(
n
n=1,2,3
...
Odgadnięte
rozwiązanie
2
2
2
2
n
mL
2
n
E
x
L
2
sin
A
)
x
(
)
x
(
P
2
2
2
2
2
Np.. dla
n=2
x
L
2
sin
A
)
x
(
2
2
2
2
2
mL
2
E
(x)=0
(x)=
0
V=0
(x)=
0
x
0
L
x
n=1
n=2
n=3
Dozwolon
e energie
n=1
n=2
n=3
P
n
(x)
Prawdopo
dobieństw
a
Elektrony ( i wszystkie innych cząstki o
wewnętrznym momencie pędu, spinie,
równym 1/2 h/2, 3/2 h/2, 5/2 h/2, itd,
ogólnie: o spinie “połówkowym”: protony
neutrony...): podlegają zakazowi Pauliego.
ELEKTRON JEST FERMIONEM;
Zakaz Pauliego
Jeśli elektron, lub inna cząstka o spinie “połówkowym” jest
w pewnym stanie kwantowym, to żadna inna taka cząstka
w tym samym stanie znaleźć się nie może.
FERMIONY
To są dwa różne stany kwantowe
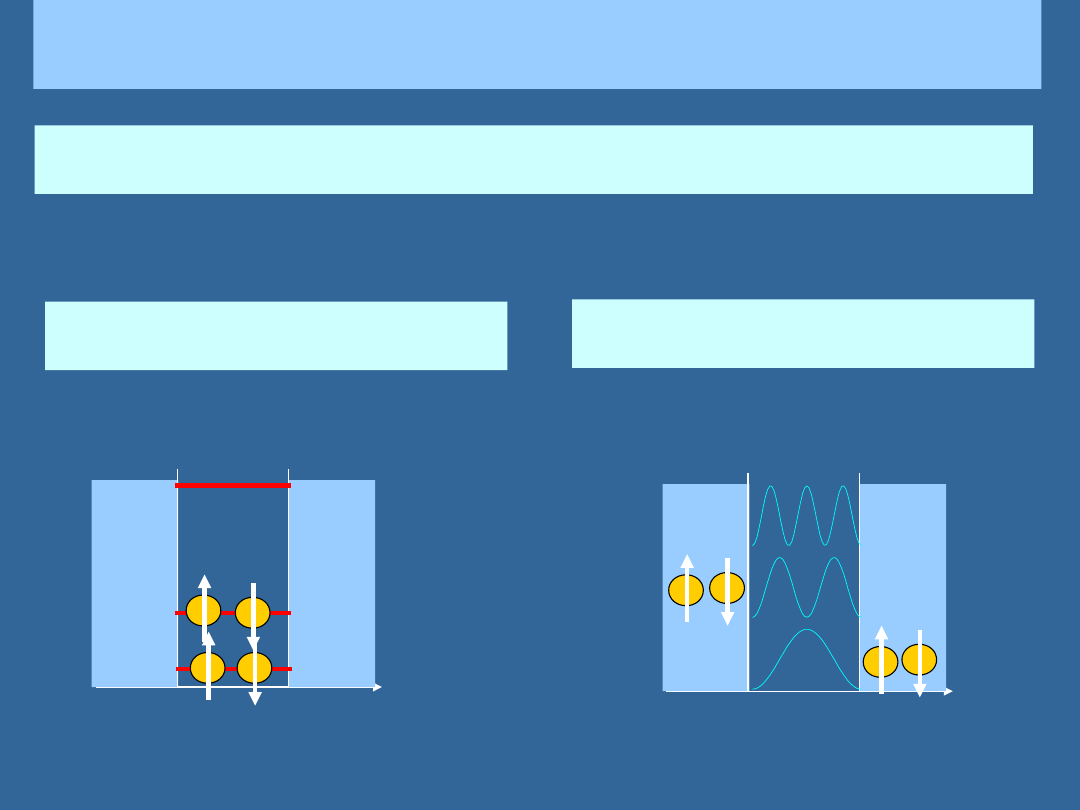
ELEKTRONY W NIESKOŃCZONEJ STUDNI POTENCJAŁU
Jeśli do studni potencjału „wrzuci” się wiele elektronów, to rozłożą się one tak,
aby zakaz Pauliego był spełniony
x
0
L
n=1
n=2
n=3
Możliwe energie elektronu (energie
własne)
Możliwe stany elektronu (funkcje
własne)
x
0
L
n=1
n=2
n=3
P
n
(x)
Np. 4 elektrony w studni potencjału
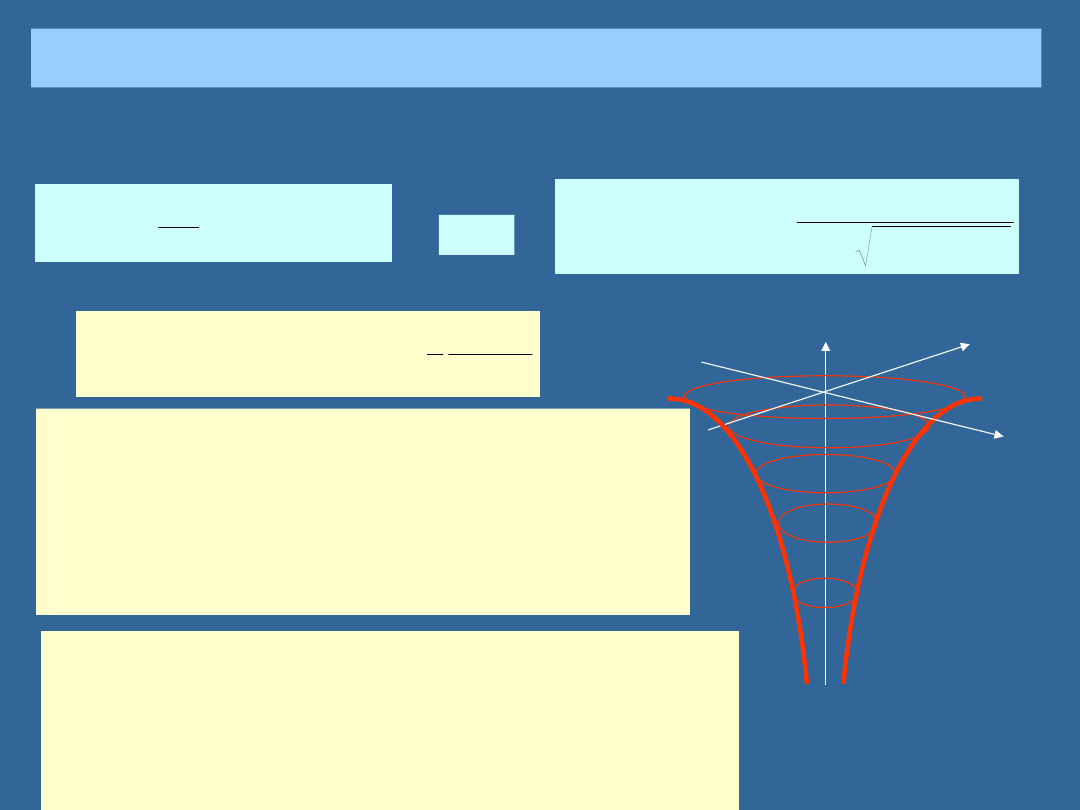
ELEKTRONY W ATOMIE WODORU
Elektron w atomie wodoru
2
2
2
0
2
z
y
x
4
e
)
z
,
y
,
x
(
V
)
r
(
V
)
r
(
)
r
(
V
)
r
(
m
2
)
r
(
E
2
oraz
Rozwiązanie
2
0
2
2
4
n
m
,
l
,
n
h
n
me
8
1
E
E
);
r
(
)
r
(
l
V(r)
x
y
Funkcja falowa zależy od 4 parametrów::
-n (główna liczba kwantowa)
- l (azymutalna liczba kwantowa)
- m
l
( magnetyczna liczba kwantowa).
-s (spinowa liczba kwantowa)
Natomiast energia określona jest tylko przez główna
liczbę kwantową
1
,
1
s
l
m
l
lub
l
,
1
l
,
2
l
,
.....
,
2
l
,
1
l
,
l
m
1
n
l
0
lub
1
n
,
......
,
2
,
1
,
0
l
.....
,
3
,
2
,
1
n
l
l
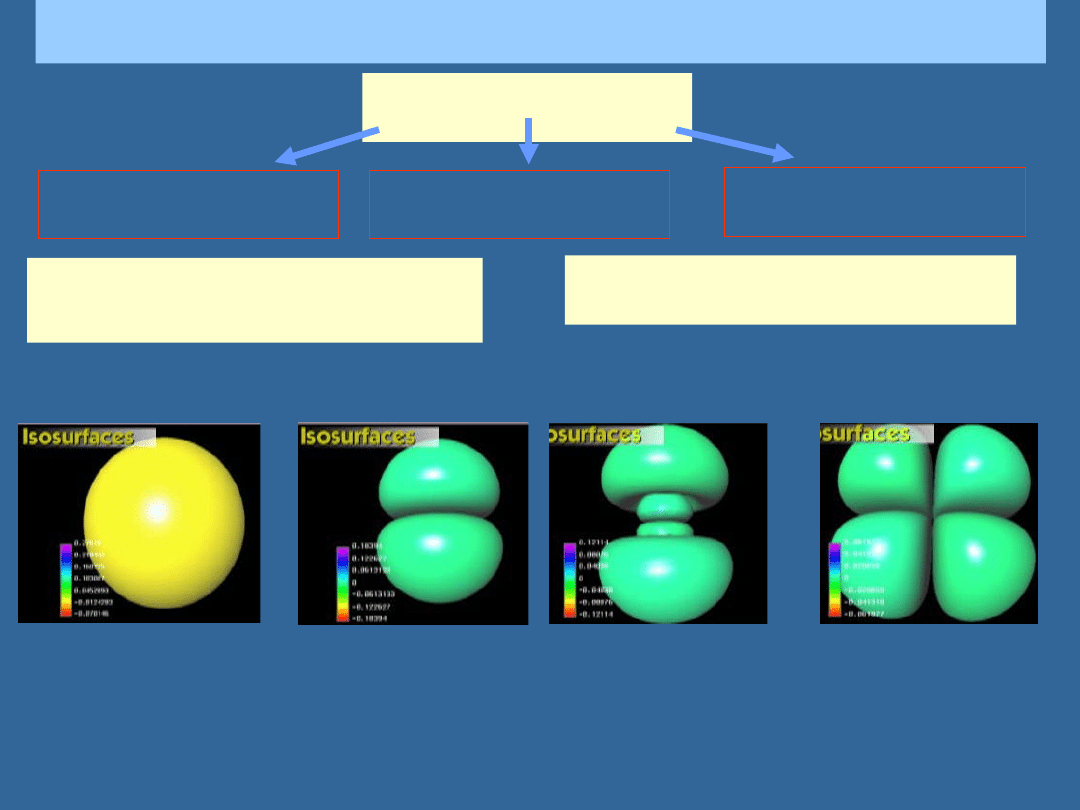
STANY ELEKTRONÓW W ATOMACH
Energia każdego
elektronu
Potencja kulombowski
jądra
Potencja kulombowski
innych elektronów
Mechanika kwantowa:
zakaz Pauliego
Funkcja falowa zależy od liczb
kwantowych n, l, m
l
Energia zależy od liczb
kwantowych n, l, m
l
, s
Stany p
2
p
3p
Stany d
3d
Stany s
2s

PRZYKŁAD: STANY ELEKTRONÓW W ATOMACH W
PRZYBLIŻENIU MAŁEJ ENERGII ODDZIAŁYWANIA
Liczy się tylko potencjał kulombowski jądra, czyli energia każdego elektronu
zależna jest tylko od liczby n
1
1,
s
l
m
l
lub
l
1,
l
2,
l
,
.....
2,
l
1,
l
l,
m
1
n
l
0
lub
1
n
,
......
2,
1,
0,
l
.....
3,
2,
1,
n
l
l
I orbita n = 1: 1 stan: wodór
stany s (l=0)
stany
p
(l=1)
stany s (l=0)
I orbita pełna n = 1: 2 stany:
hel
I orbita pełna, n = 2: l=0, m
l
=0: lit
I orbita pełna, n = 2: l=0, m
l
=0, l=1,
m
l
=-1, 0, 1: azot
I orbita pełna, n = 2: l=0, m
l
=0, l=1,
m
l
=-1, 0, 1: neon
powłoka 1
powłoka 2

STANY ELEKTRONÓW W ATOMACH
0
20
40
60
80
en
e
rg
ia
5d
4f
6s
5p
4d
5s
4p
3d
4s
3p
3s
2p
2s
1s
Z
Ze względu na oddziaływanie między elektronami regularne zapełnianie powłok
jest zaburzone dla atomów o większych Z

UKŁAD OKRESOWY PIERWIASTKÓW
uklad
okresowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
Fizyka 2 4 Mech kwant 1
Fizyka 2 5 Mech kwant 2
MiSM Mech Kwant dla ETI [tryb zgodności]
KOTŁY OKRĘTOWE ZALICZENIE II MECH
frakcje gramulometryczne -sklad mech, gleboznawstwo
PŁYNY, Studia, Mech. płynów
Pytania z mech.gruntow GIG, AGH, Mechanika Gruntów
Lab. mech. płynów-Wizualizacja opływu walca w kanaliku, Mechanika Płynów pollub(Sprawozdania)
Egz mech 2(1), Studia, SiMR, II ROK, III semestr, Mechanika Ogólna II, Mechanika 2, Mechanika
Mech- Badanie zależności współczynnika lepkości cieczy od te, Sprawozdania - Fizyka
ME CHAR MECH
Mój projekt z mech gruntow
WEiP spr mech pł
mech w 1 2
więcej podobnych podstron