
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie, publiczne odtwarzanie i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można
dowolnie modernizować na potrzeby własne oraz do wykorzystania w szkołach podczas zajęć dydaktycznych.
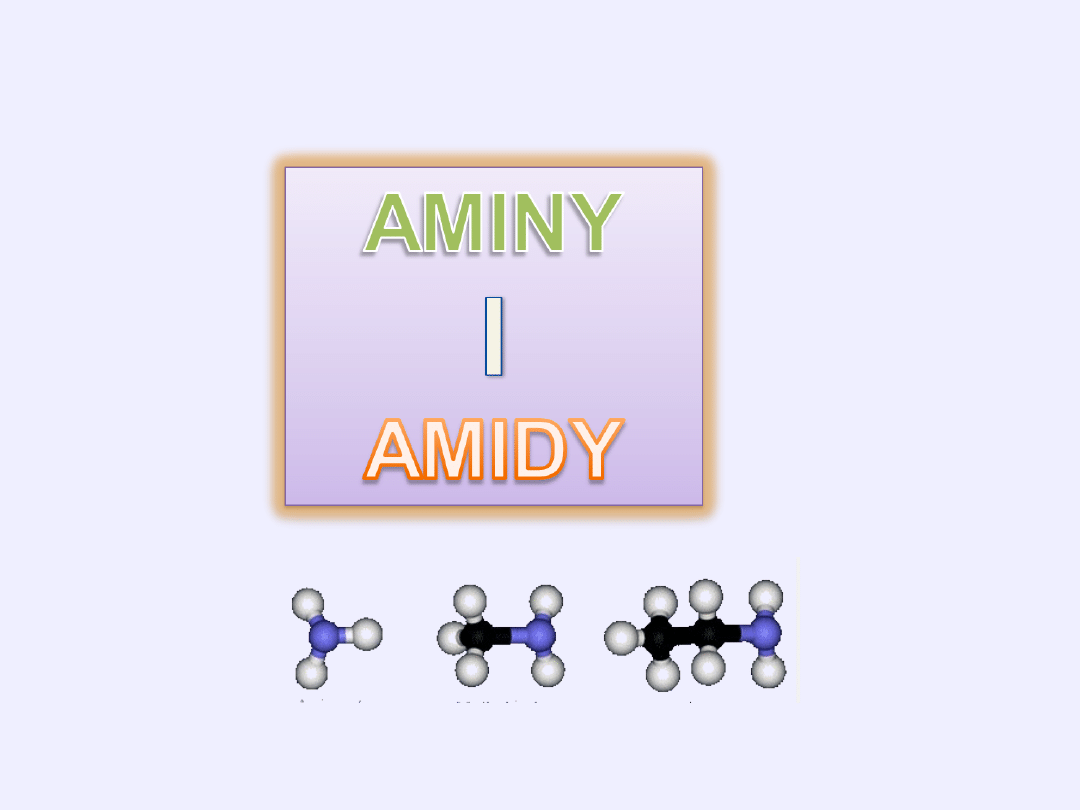

Spis treści:
Amoniak
Aminy – rzędowość
Właściwości fizyczne
Otrzymywanie amin
Nazewnictwo amin
Właściwości chemiczne
Zastosowanie amin
Amidy kwasów karboksylowych
Właściwości chemiczne amidów
Otrzymywanie amidów
Mocznik – amid kwasu węglowego
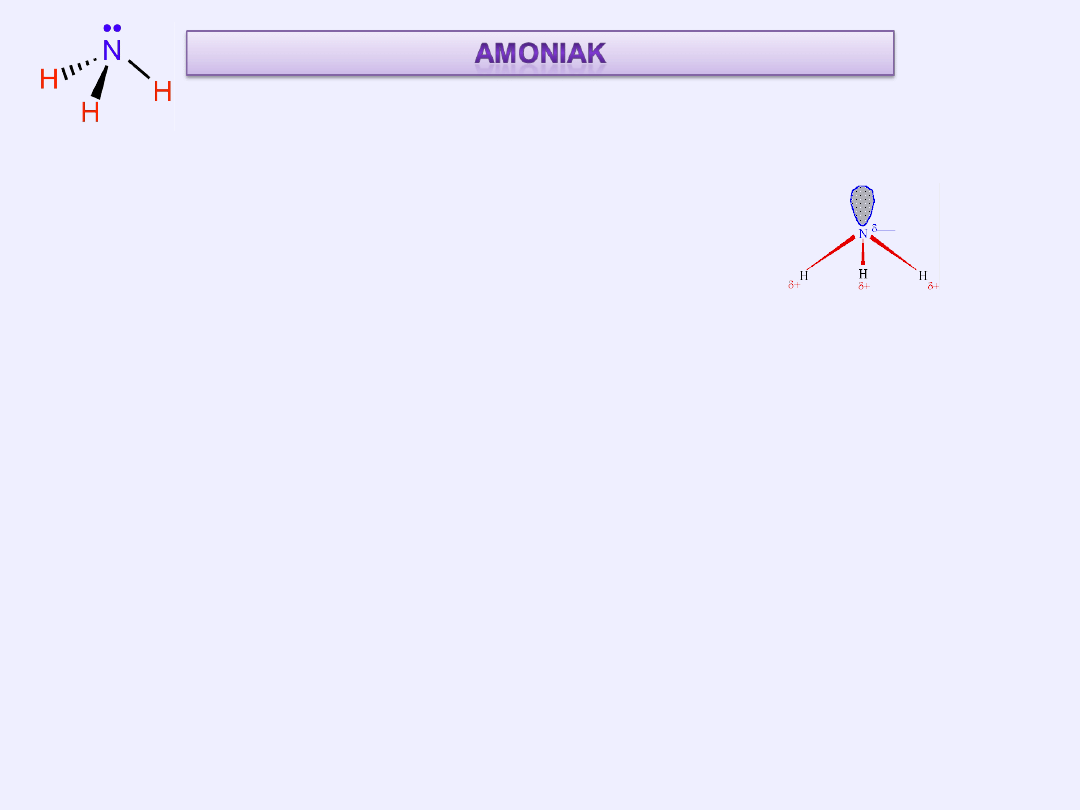
Cząsteczka amoniaku ma kształt tzw. piramidy trygonalnej.
Atom azotu wykazuje hybrydyzację sp
3
.
Trzy z powstałych orbitali tworzą wiązania z atomami wodoru,
czwarty jest zajmowany przez wolną parę elektronową.
Obecność wolnej pary elektronowej powoduje odpychanie elektronów
tworzących wiązania N-H, przez co kąt między tymi wiązaniami jest nieco
mniejszy (wynosi 106°45') niż np. między wiązaniami C-H w metanie
(109°28').
Z powodu stosunkowo dużej różnicy elektroujemności (0,84 wg Paulinga)
cząsteczka amoniaku ma dość duży moment dipolowy (μ=1,46 D).
Polarność cząsteczek amoniaku jest przyczyną tworzenia się między nimi
wiązań wodorowych.
Budowa
cząsteczki
Właściwości fizyczne
W warunkach normalnych amoniak jest bezbarwnym gazem
Zapach –charakterystyczny ostry
Rozpuszczalność – bardzo dobrze rozpuszczalny w wodzie
Gęstość ( w. normalne) - 0,771 g/dm
3
Temperatura wrzenia – (-33,3 °C ) /Ciekły amoniak wykazuje
wiele podobieństw do wody -analogicznie do niej
autodysocjuje /



OTRZYMYWANIE AMIN
1. Redukcja związków nitrowych
2. Reakcja halogenków alkilowych lub arylowych z amoniakiem lub
aminami
3. Aminowanie aldehydów lub ketonów
4. Redukcja nitryli
5. Degradacja amidów metodą Hoffmana
Redukcja związków nitrowych
CH
3
CH
C
H
3
CH
2
NO
2
CH
3
CH
C
H
3
CH
2
NH
2
[H]
NO
2
NH
2
[H]
Sn / HCl
Fe / H
2
SO
4
H
2
/ Pt
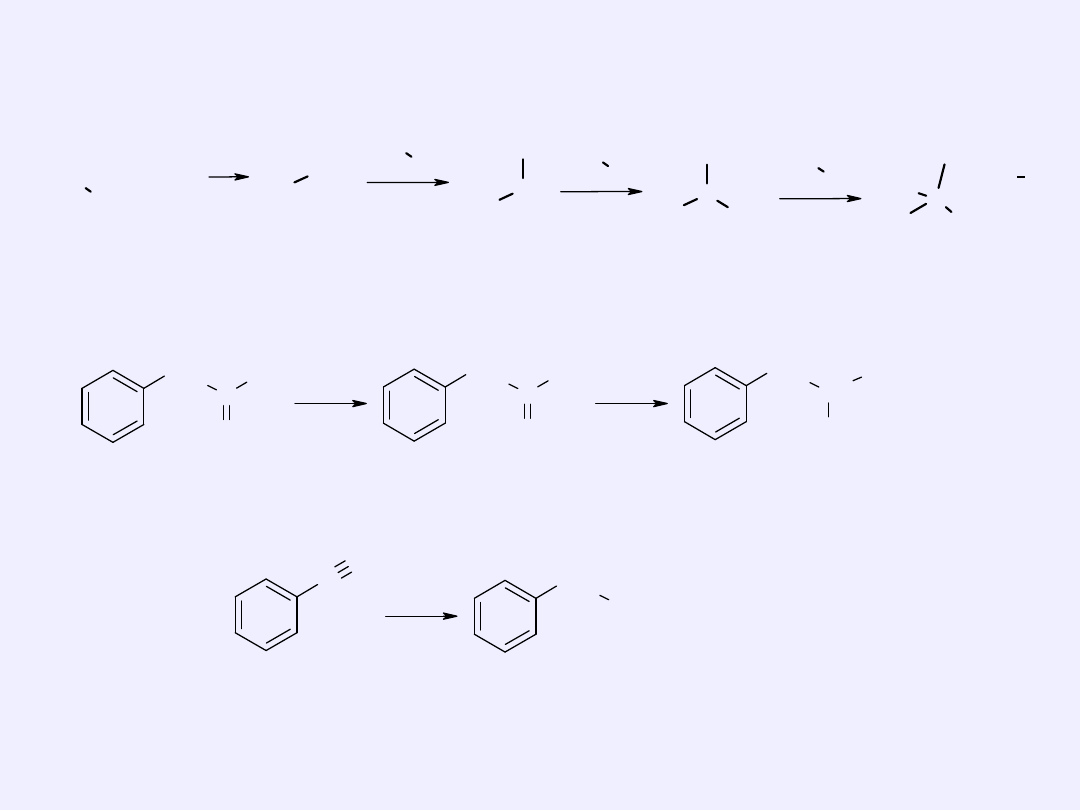
Reakcja halogenków alkilowych lub arylowych z amoniakiem lub
aminami
CH
3
Br
CH
3
NH
2
NH
3
CH
3
Br
CH
3
NH
CH
3
CH
3
Br
CH
3
Br
CH
3
N
CH
3
CH
3
CH
3
N
+
CH
3
CH
3
CH
3
Br
+
Aminowanie aldehydów lub
ketonów
CH
2
C
CH
3
O
CH
2
C
CH
3
NH
CH
2
CH
CH
3
NH
2
NH
3
[H]
Redukcja nitryli
C
N
CH
2
NH
2
[H]



WŁAŚCIWOŚCI CHEMICZNE AMIN
Z powodu obecności wolnej pary elektronowej na atomie azotu, aminy
wykazują
charakter zasadowy.
W porównaniu z amoniakiem aminy alifatyczne mają silniejszy charakter
zasadowy ( efekt silniejszego odpychania elektronów przez grupy
alkilowe), natomiast aminy aromatyczne słabszy ( sprzężnie wolnej pary
elektronowej z at. azotu z elektronami pierścienia) W przypadku amin
alifatycznych im wyższa rzędowość tym większa zasadowość.
OH
RNH
O
H
RNH
3
2
2
Aminy reagują z wodą uwalniając jony OH
( co także jest skutkiem
wolnej pary elektronowej na atomie azotu).
OH
RNH
O
H
NH
R
3
2
2
Cl
NH
CH
HCl
NH
CH
3
3
2
3
Po dodaniu na przykład zasady ponownie powstaje
amina.
O
H
NaCl
NH
CH
NaOH
Cl
NH
CH
2
2
3
3
3
zasadowość); wykazują silniejsze właściwości zasadowe niż amoniak.
Aminy aromatyczne charakteryzują się słabymi własnościami
zasadowymi, które spadają w miarę wzrostu rzędowości.
Reagują z kwasami





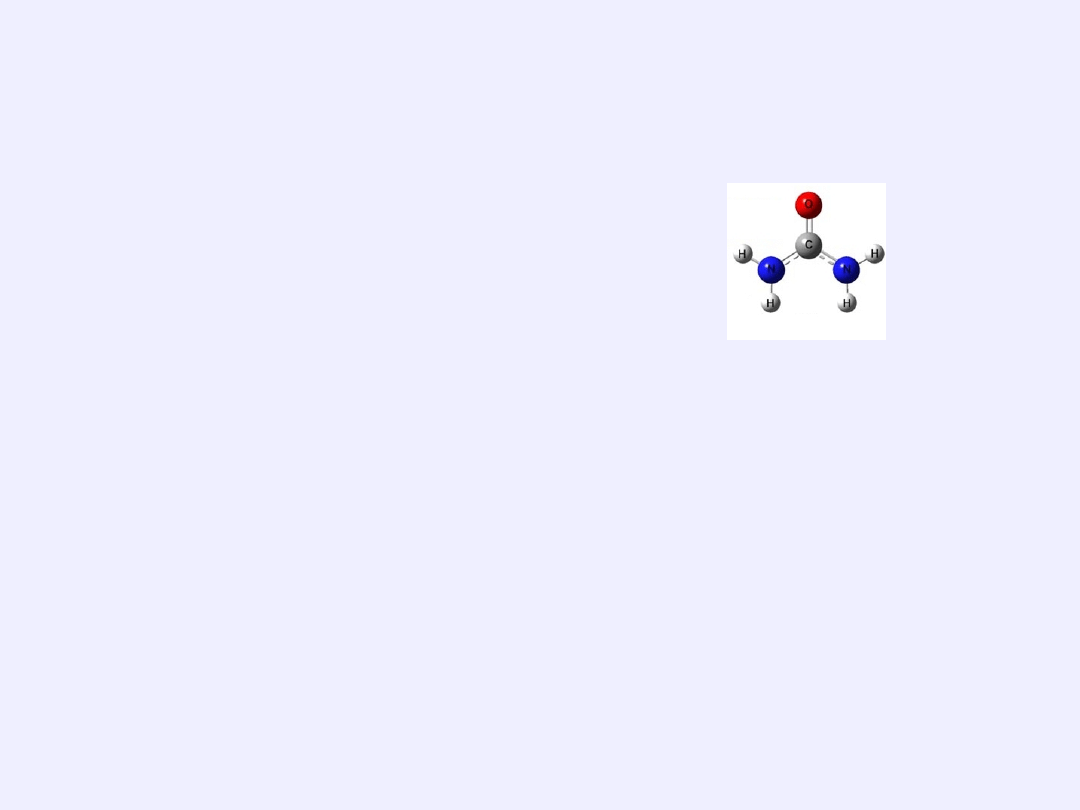
MOCZNIK – AMID KWASU WĘGLOWEGO
Mocznik
jest pierwszym związkiem organicznym, który otrzymano w
syntezie chemicznej -poza organizmem. (Friedrich Wohler – 1828)
Wzór:
CO(
NH
2
)
2
diamid kwasu weglowego (IV)
NH
2
/
O = C
\
NH
2
Jest produktem końcowym przemiany białek w organizmach
zwierzęcych, jest toksyczny, usuwany jest głównie z moczem, częściowo
przez skórę z potem.
Otrzymywanie:
Reakcja CO
2
z amoniakiem (T = 200
o
C i p = 20MPa)
NH
2
/
CO
2
+ 2
NH
3
O = C +
H
2
O
\
NH
2


Bibliografia:
„ Chemia od A do Z” M. Klimaszewska
„Chemia 2” – S. Chejwowska
Chemia - Przewodnik szkolny
http://pl.wikipedia.org/wiki
http://www.zgapa.pl
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
aminy amidy izoptyczna, Chemia, Liceum, klasa II
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
aminy amidy
Aminy i amidy - test 2, 1p
Aminy i amidy id 59174 Nieznany (2)
aminy i amidy, Technologia chemiczna pwr, Chemia organiczna
aminy-i-amidy
2 14 Organiczne związki z azotem(aminy, amidy, aminokwasy, biaka)
Aminy i amidy - test 1, 1p
aminy amidy izoptyczna, Chemia, Liceum, klasa II
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
aminy amidy
2 14 Organiczne związki z azotem(aminy, amidy, aminokwasy, biaka)
aminy amidy
Aminy analityka
wyk12 aminy
aminy 4
więcej podobnych podstron