

Aminy
– organiczne związki
chemiczne zawierające w swojej
budowie grupę aminową, będącą
organiczną pochodną amoniaku.
WZÓR
OGÓLNY

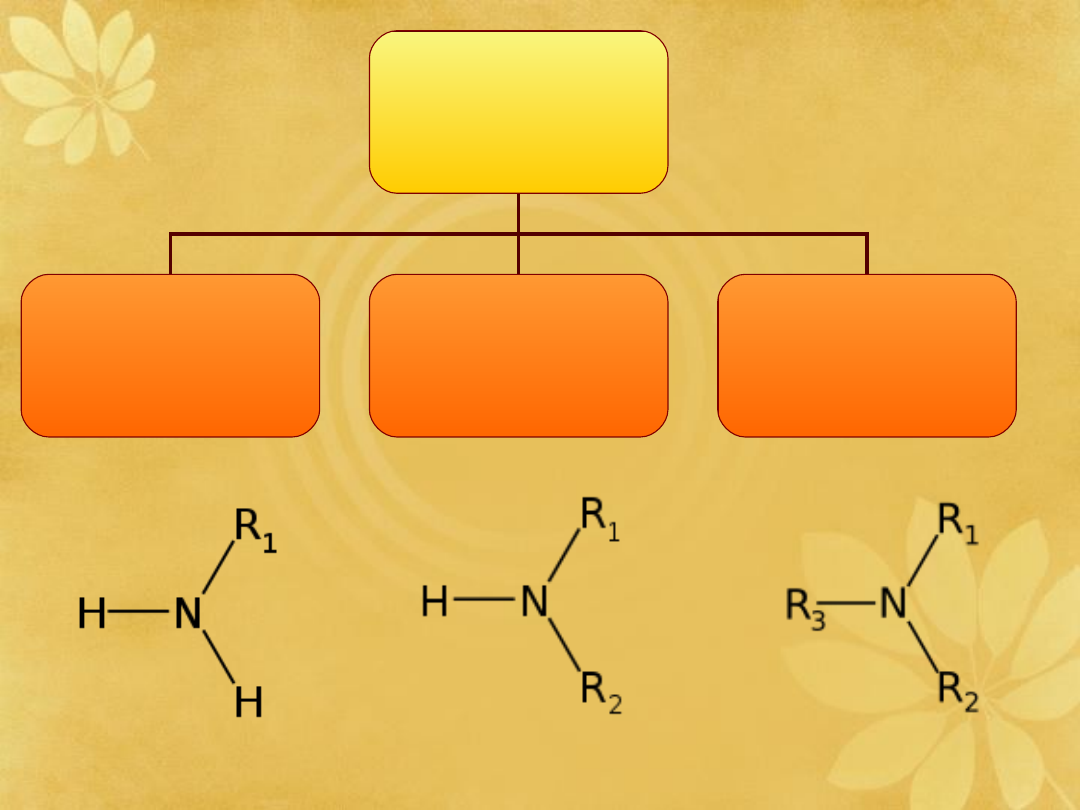
Rozróżniamy
aminy:
AMINY
I-RZĘDOWE
AMINY
II-RZĘDOWE
AMINY
III-RZĘDOWE
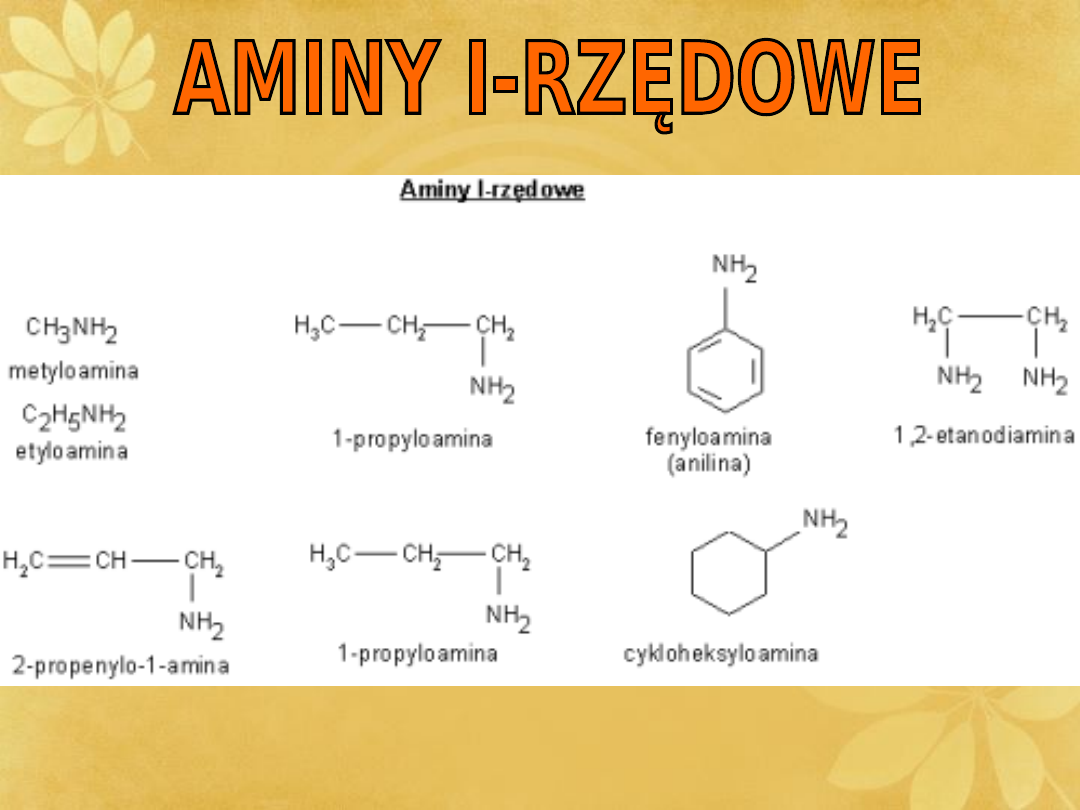
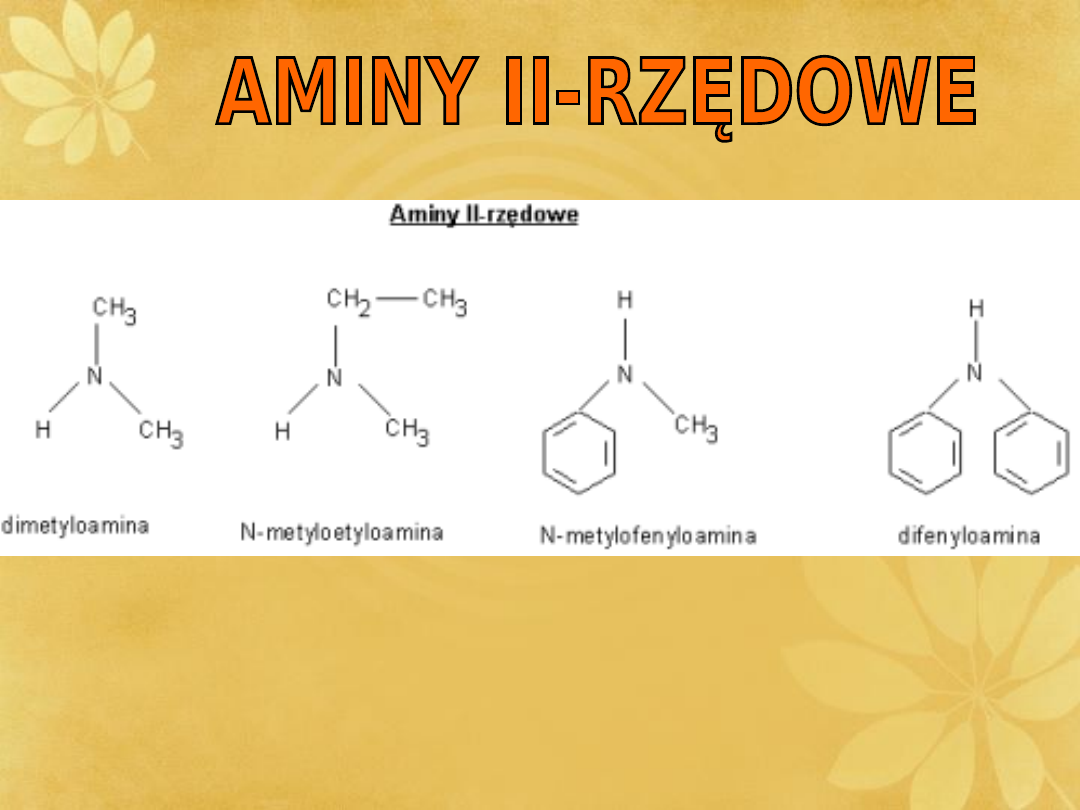
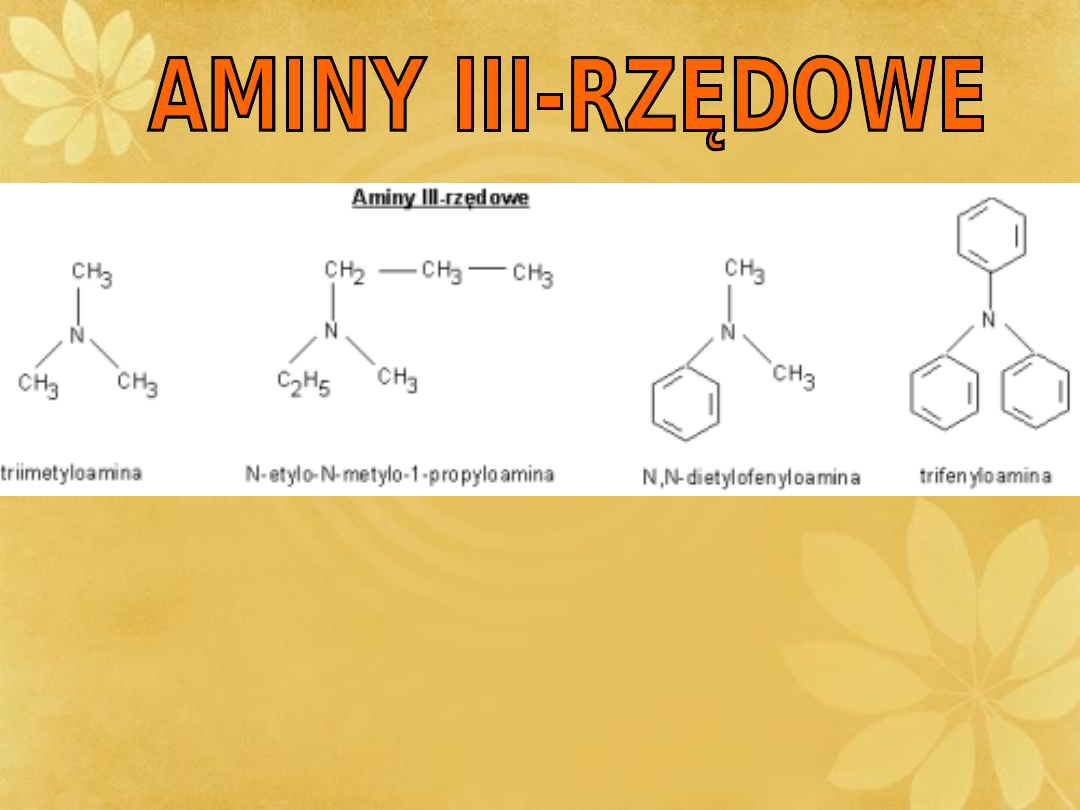

Aminy otrzymać można przez redukcję
związków nitrowych, działaniem
amoniaku lub innych amin na związki
chlorowcowe (otrzymujemy aminy
różnych rzędowości), redukcję nitryli.
Do otrzymywania amin aromatycznych
stosuje się głównie redukcję
nitrozwiązków, które w przypadku
związków aromatycznych otrzymuje się
bardzo łatwo w reakcji nitrowania
mieszaniną nitrującą.
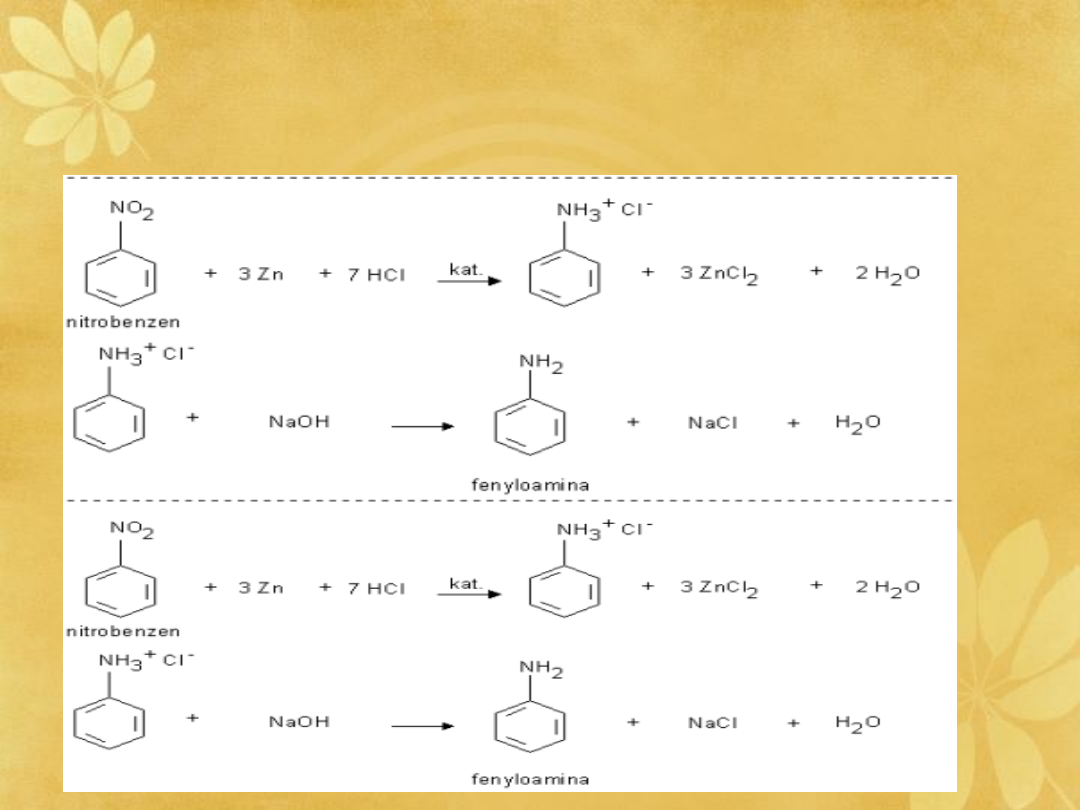
OTRZYMYWANIE amin
aromatycznych - przez redukcję
związków nitrowych
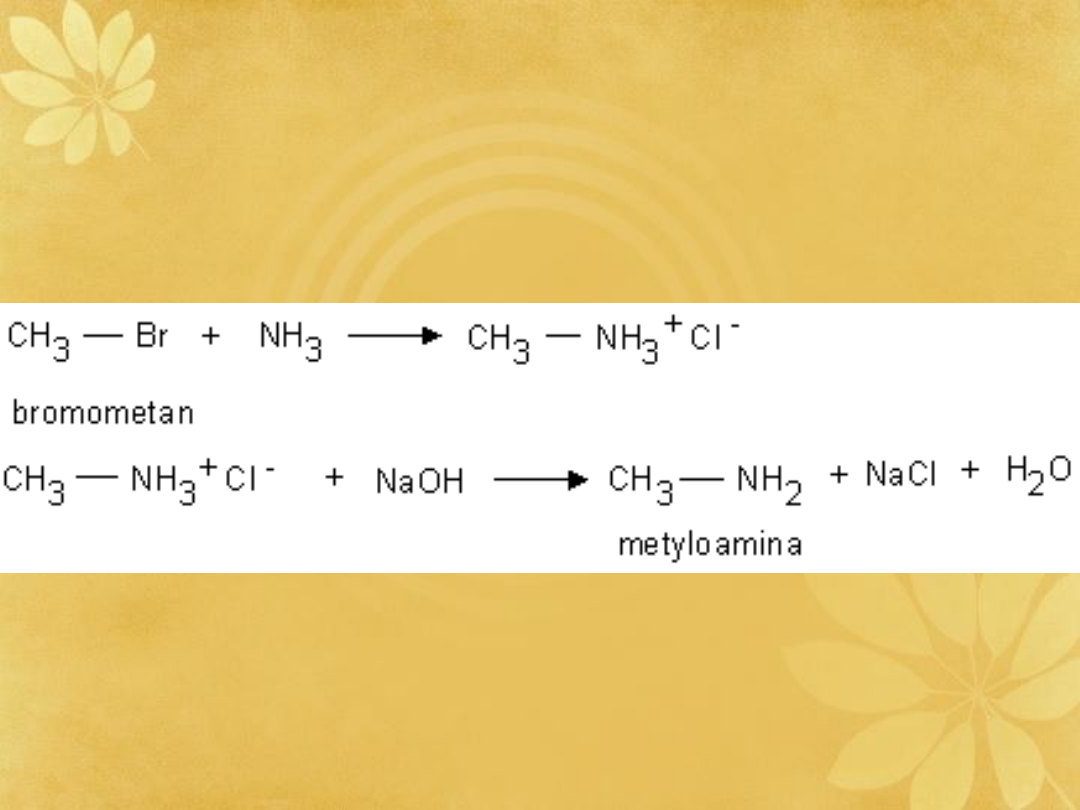
OTRZYMYWANIE amin
alifatycznych - przez
podstawienie atomu fluorowca
amoniakiem i wydzielenie
aminy zasadą

I-szo i II-go rzędowe aminy z grupami
alkilowymi mają charakterystyczny rybi
zapach. Wszystkie trzy aminy z grupami
metylowymi są dobrze rozpuszczalnymi
w wodzie gazami, podobnie jak amoniak.
Aminy z wyższymi grupami alifatycznymi
są ciekłe lub stałe i ze wzrostem
długości łańcuchów węglowych coraz
gorzej rozpuszczają się w wodzie.
Aminy aromatyczne są wysokowrzącymi
cieczami lub ciałami stałymi o ostrym,
charakterystycznym, ale nie rybim
zapachu.

Aminy mają podobnie jak amoniak właściwości zasadowe - ich roztwory
wodne zawierają jony OH-
Są to więc związki o silnych własnościach zasadowych, reagujące
chętnie z kwasami nieorganicznymi i organicznymi oraz dające odczyn
zasadowy w roztworach wodnych gdyż w wodzie podlegają one reakcji
wg. schematu:
R-NH2 + H2O -> RNH3OH <--> RNH3(+) + OH(-)
Zasadowość amin zależy od podstawników przy atomie azotu. Aminy
alifatyczne są bardziej zasadowe od amoniaku i ich zasadowość wzrasta
wraz z rzędowością, zaś w przypadku amin aromatycznych jest
dokładnie na odwrót - mają one mniej zasadowe własności od amoniaku
i spadają one ze wzrostem rzędowości, słaby charakter zasadowy amin
aromatycznych jest spowodowany oddziaływaniem wolnej pary
elektronowej grupy aminowej z sekstetem elektronowym pierścienia
aromatycznego.
Z punktu widzenia biochemii najważniejszą reakcją amin jest reakcja z
kwasami karboksylowymi prowadząca do powstania wiązań
peptydowych.
Z kolei z punktu widzenia chemii organometalicznej najważniejsze są
możliwości reakcji amin z chlorkami, bromkami i jodkami metali,
prowadzące do powstawania trwałych kompleksów tych metali:
R-NH2 + FeCl2 --> R-NH-Fe-NH-R

Aminy mają wiele ważnych zastosowań praktycznych.
Aminy alifatyczne stosowane są jako pół produkty w syntezie
organicznej, zwłaszcza do otrzymywania leków środków ochrony
roślin i tworzyw sztucznych .
Aminy aromatyczne mają podobne zastosowanie ponadto służą do
produkcji barwników.
Amidy kwasowe są to pochodne kwasów karboksylowych i
amoniaku lub amin. Mocznik- bezbarwne kryształy bez zapachu
rozpuszczalne w wodzie i alkoholu. Jest to pierwszy związek
organiczny otrzymywany syntetycznie. Występuje w pocie i moczu
ludzi i zwierząt, jako produkt przemiany białek. Otrzymujemy go
w przemyśle przez ogrzewane mieszaniny amoniaku i dwutlenku
węgla, powstaje początkowo karbaminian amonu, który następnie
rozpada się na mocznik z wydzieleniem wody. Stosowany jako
nawóz sztuczny jako surowiec do wyrobu żywic mocznikowych.
Aminy są szeroko stosowane w syntezie chemicznej, do produkcji
barwników, kosmetyków, w przemyśle farmaceutycznym.

CHRYZOIDYNA (pomarańczowy
barwnik do papieru i skóry)
AMFETAMINA
ORANŻ METYLOWY (wskaźnik
pH)
MUSKARYNA (jedna z
trucizn muchomora)
ADRENALINA (jeden z
hormonów regulujących poziom
cukru we krwi)
CZERWIEŃ KONGO
(wskaźnik pH)
KONIINA (trucizna z
rośliny szczwół plamisty
wykorzystana do
wykonania wyroku
śmierci na Sokratesie)
ORANŻ II (barwnik do wełny
i jedwabiu – włókien
białkowych)
Morfina
Heroina
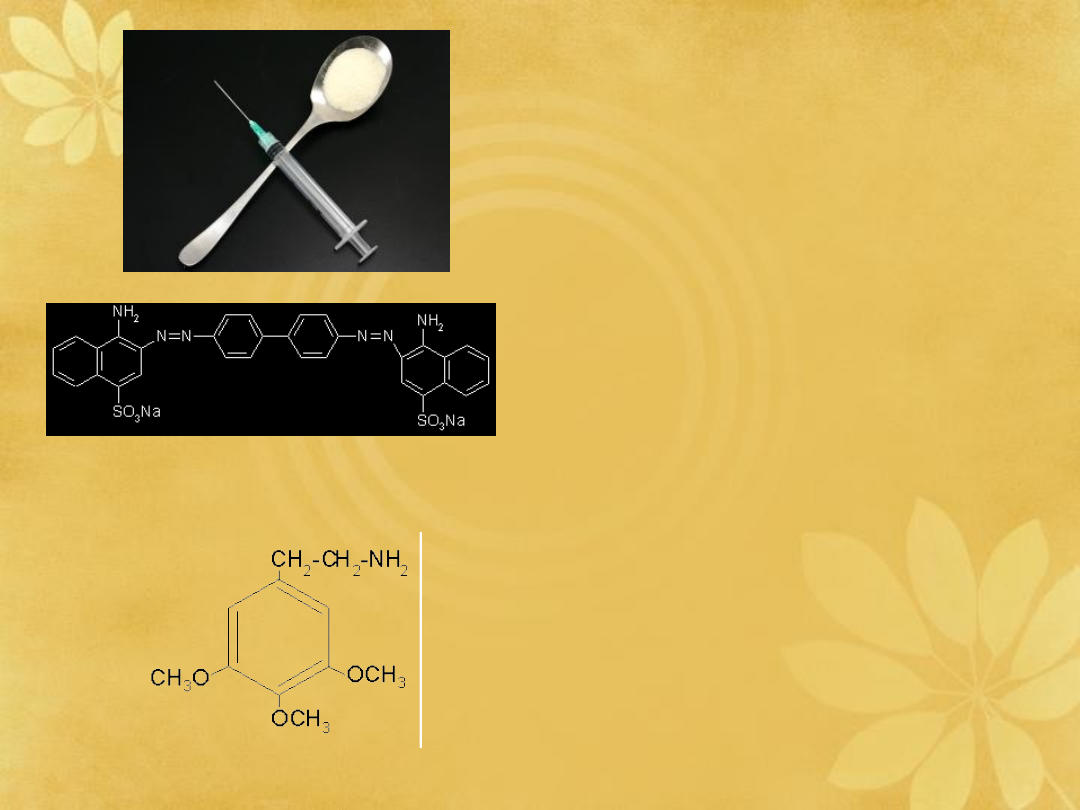
czerwień
Kongo
Heroina
Muskaryn
a

www.wikipedia.pl
www.sciaga.pl
www.mlyniec.gda.pl
www.images.google.pl
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Aminy analityka
wyk12 aminy
1 Aminy kompendium
aminy amidy izoptyczna, Chemia, Liceum, klasa II
otrzym 2 aminy w 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
aminy otrzymywanie, podstawy chemii organicznej
aminy amidy
Aminy i aminokwasy, chemia, GIMNAZJUM
aminy sprawo
BT aminy
Termin witamina pochodzi od słowa kluczowe i aminy
AMINY KATECHOLOWE, II rok, II rok CM UMK, Fizjologia, Fizjologia
aminy wlasciwosci, biologia, chemia organiczna
otrzym aminy w 2
Biologia-ściągi, aminy, Aminy
chemia, DIAZOWANIE, DIAZOWANIE- reakcja zachodząca pomiędzy kw azotawym HNO2, a solą pierwszorzędowe
Aminokwasy Aminy Kwasy nukelinowe Białka
aminy 2
więcej podobnych podstron