Mocznik
Zastosowanie
Nawóz sztuczny –w skład mocznika wchodzi ok..46.6%azotu a
więc jako nawóz sztuczny przewyższa on zawartością azotu takie
nawozy azotowe jak azotan i siarczan amonowy.
Do produkcji żywic mocznikowo –formaldehydów
Melamina
Przez polimeryzację cyjanoamidu powstaje jego trimer zwany
zwyczajowo-melaminą
W wyniku kondensacji melaminy z formaldehydem otrzymuje
się tzw. Żywice melaminowe
C NH
2
N
H
2
O
N
CH
2
C
O
N CH
2
n
n
+
2n HCHO
2n H
2
O
+
N
H
2
C N
C
N
C
N
C
N
NH
2
NH
2
N
H
2
3
katalizator
melamina
Do produkcji leków-barbiturany (środki
nasenne)
Aminy
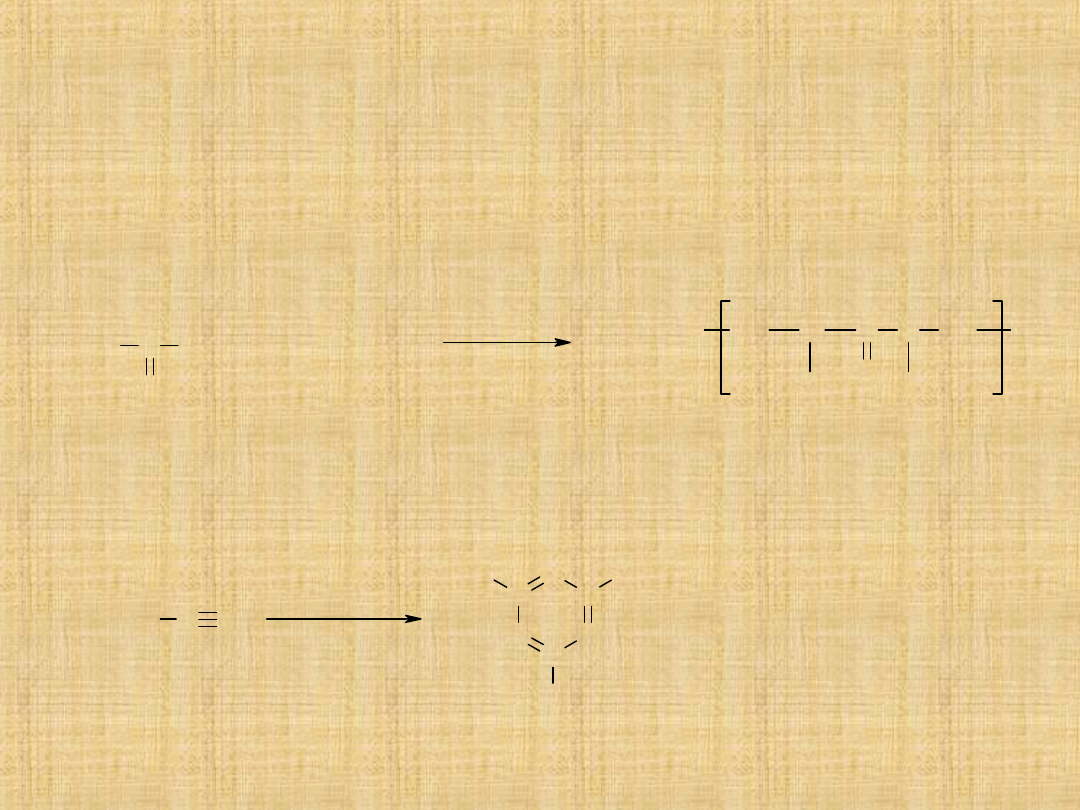
Aminy to związki o ogólnym wzorze R–NH
2
, R
2
NH lub R
3
N,
gdzie R to grupa alkilowa lub arylowa (Ar).
Aminy dzielą w zależności od liczby grup związanych z atomem
azotu się na:
pierwszorzędowe, drugorzędowe i
trzeciorzędowe
H
N
R
H
H
N
R
R
R
N
R
R
H
N
CH
3
H
metyloamina
H
N
CH
2
C
H
2
CH
3
CH
3
dietyloamina
N
H
H
anilina
N
H
difenyloamin
a
N
CH
3
CH
3
N,N-
dimetyloanilina
N
pirydy
na
Sole amin
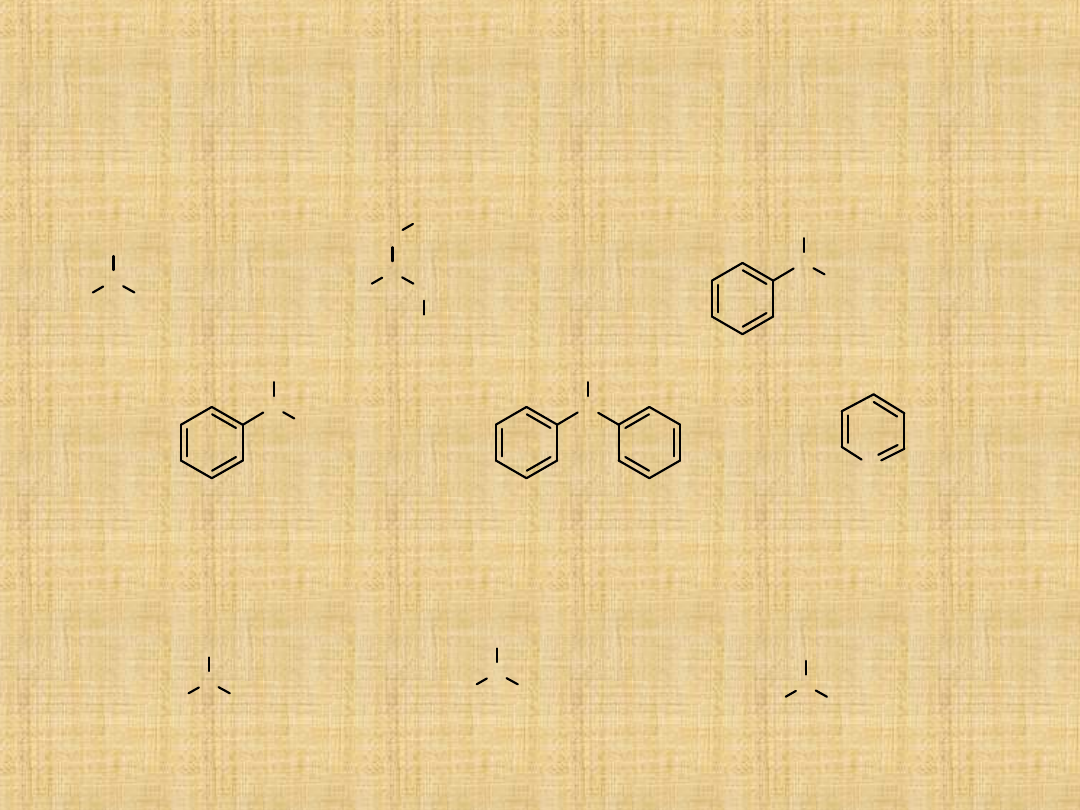
Znane są sole amoniowe pochodne amin 1° , 2 ° , 3° oraz
tzw czwartorzędowe sole amoniowe .
H
N
+
CH
3
H
H
Cl
chlorek
metyloamoniowy
H
N
+
CH
2
C
H
2
CH
3
CH
3
H
NO
3
–
azotan dietyloamoniowy
N
+
H
Br
bromek
pirydyniowy
CH
2
N
+
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
3
CH
2
CH
2
CH
3
Cl
chlorek benzylotributyloamoniowy,
TBA
Cl
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
N
+
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
chlorek didecylodimetyloamoniowy,
DDAC

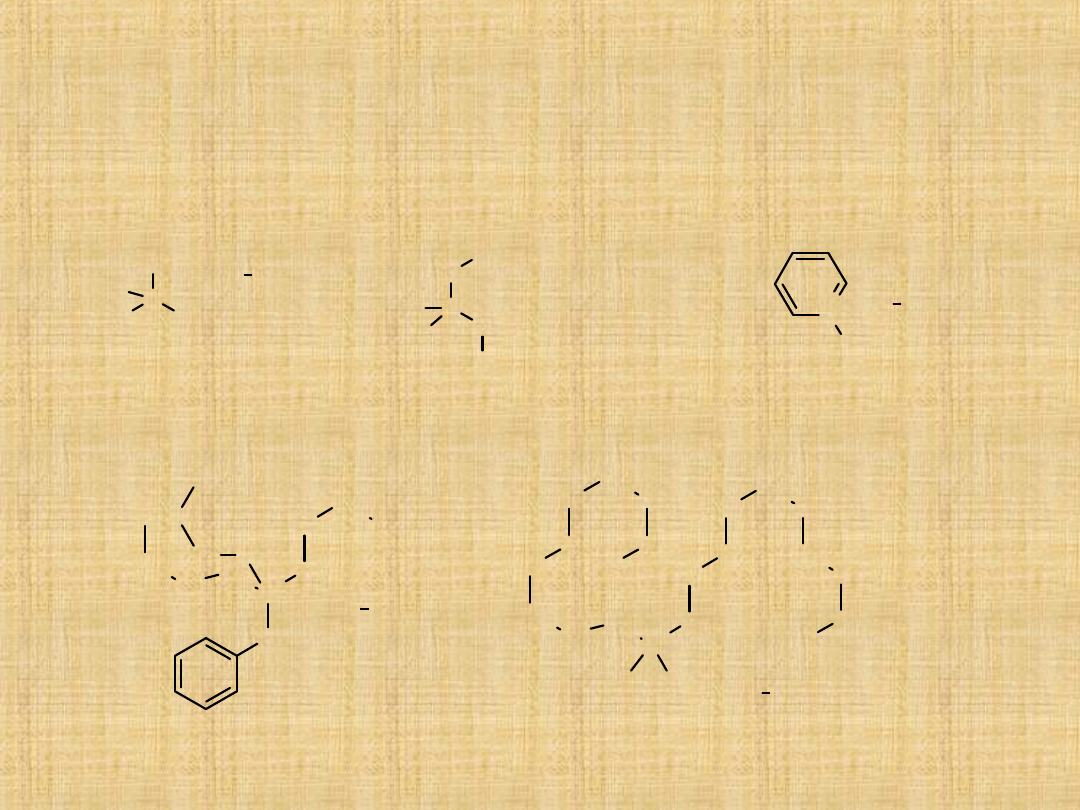
Słownictwo amin alifatycznych
Nazwy amin alifatycznych
tworzy się przez dodanie
przyrostka –amina do nazwy
grup alkilowych związanych z
atomem azotu.
Grupę –NH
2
,gdy nie jest ona
grupą główną wskazuje się
za pomocą przedrostka –
amino, np.:
Nazwy symetrycznych amin
drugo- i trzeciorzędowych tworzy
się dodając do nazw grup
alkilowych związanych z atomem
N przedrostek di- , lub tri- , oraz
przyrostek –amina, np:
Nazwy soli amin tworzy się
przez zamiane przyrostka –
amina na –amoniowy i
dodanie nazwy anionu,
np.:
CH
2
CH
3
H
N
CH
2
CH
2
CH
2
CH
3
butyloetyloamina
kwas 2-aminopropanowy
CH C
N
H
2
CH
3
OH
O
CH
2
CH
3
N
CH
2
CH
2
CH
3
CH
3
trietyloamin
a
I
C
H
3
CH
3
N
+
CH
3
H
jodek
trimetyloamoniowy
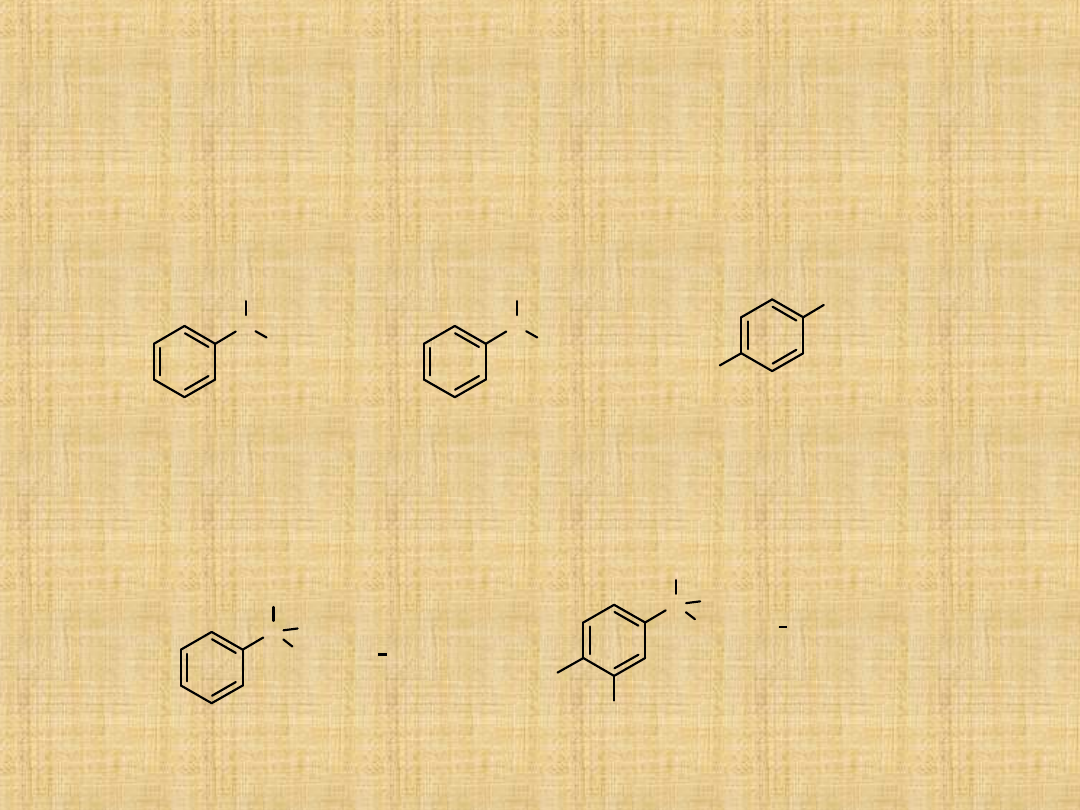
Słownictwo amin aromatycznych
Aminy aromatyczne, w których atom azotu jest bezpośrednio
związany z pierścieniem aromatycznym noszą nazwy pochodne
od najprostszej aminy aromatycznej – aniliny.
Nazwy soli amin aromatycznych tworzy się na przez zamianę
przyrostka -amina na aniliniowy i dodanie nazwy anionu
(chlorek, azotan, ...)
N
H
H
anilina
N
CH
3
CH
3
N,N-
dimetyloanilina
NH
2
O
2
N
p-
nitroanilina
N
+
H
H
H
Br
bromek
aniliniowy
N
+
CH
3
H
H
CH
3
Cl
Cl
chlorek 4-chloro-N,3-
dimetyloaniliniowy

Właściwości fizyczne amin
Podobnie jak amoniak aminy są
związkami polarnymi. Mogą
tworzyć wiązania wodorowe
między własnymi cząsteczkami a
także z wodą
Aminy są dobrze rozpuszczalne w wodzie.Temperatury wrzenia są
niższe niż odpowiadające im alkohole lub kwasy karboksylowe.
Właściwości chemiczne
Atom azotu w cząsteczce aminy,
podobnie jak i w cząsteczce
amoniaku ma wolną parę
elektronową, co sprawia, że może
on być donorem elektronów dla
odpowiednich grup lub jonów (np.
proton H
+
). Z tego względu aminy
mają charakter zasadowy – z
kwasami tworzą sole.
Jest silną zasadą Lewisa.
N
CH
3
H
H
N
CH
3
H
H
N
CH
3
H
H
H
+
CH
3
CH
3
N
CH
2
H
H
CH
3
CH
3
N
+
CH
2
H
CH
2
CH
3
CH
3
CH
3
N
+
CH
2
CH
2
CH
3
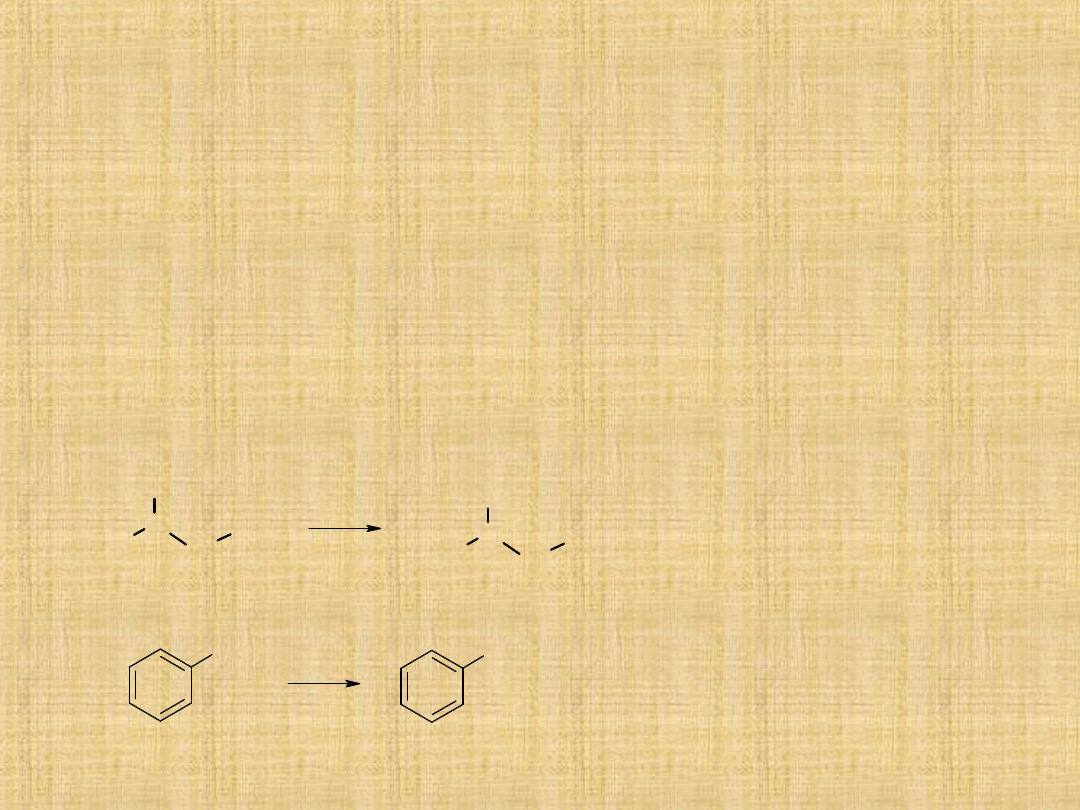
Otrzymywanie amin
1. Redukcja związków nitrowych
2. Reakcja
halogenków
alkilowych
lub
arylowych
z
amoniakiem lub aminami
3. Aminowanie aldehydów lub ketonów
4. Redukcja nitryli
5. Degradacja amidów metodą Hoffmana
Redukcja związków nitrowych
NO
2
NH
2
[H]
CH
3
CH
C
H
3
CH
2
NO
2
CH
3
CH
C
H
3
CH
2
NH
2
[H]
Sn / HCl
Fe / H
2
SO
4
H
2
/ Pt
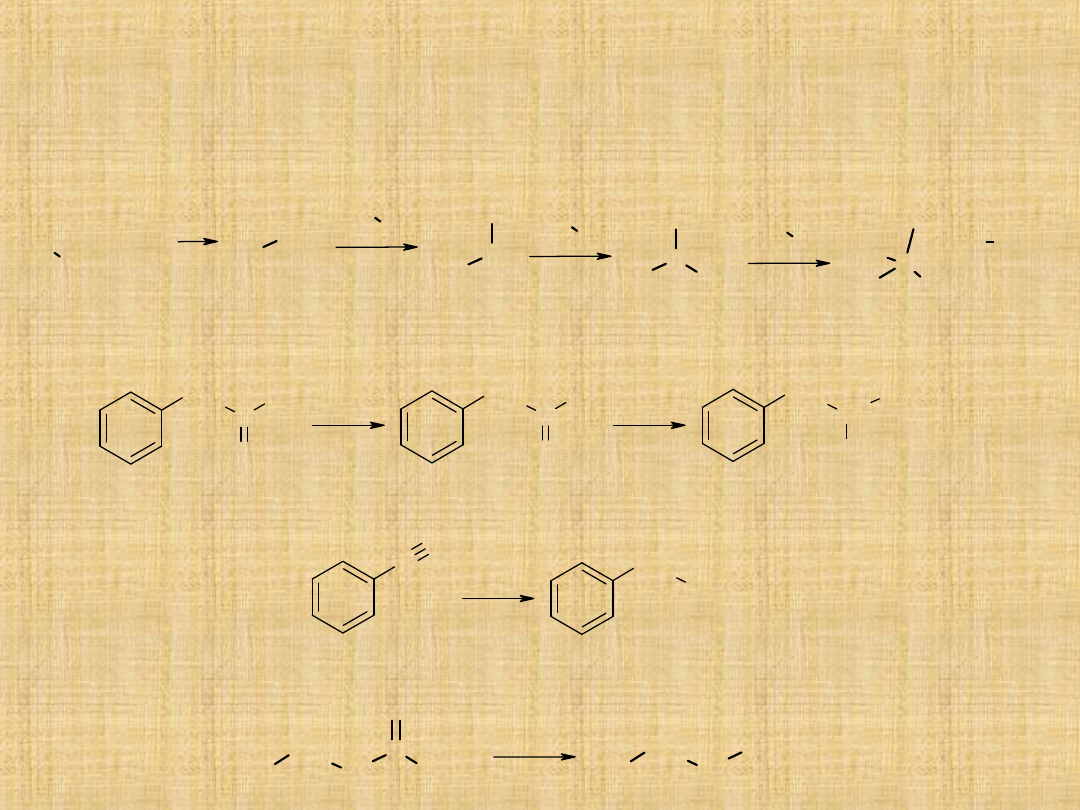
Otrzymywanie amin
Reakcja halogenków alkilowych lub arylowych z
amoniakiem lub aminami
CH
2
C
CH
3
O
CH
2
C
CH
3
NH
CH
2
CH
CH
3
NH
2
NH
3
[H]
CH
3
Br
CH
3
NH
2
NH
3
CH
3
Br
CH
3
NH
CH
3
CH
3
Br
CH
3
Br
CH
3
N
CH
3
CH
3
CH
3
N
+
CH
3
CH
3
CH
3
Br
+
Aminowanie aldehydów lub
ketonów
Redukcja nitryli
Degradacja amidów
Hoffmana
C
N
CH
2
NH
2
[H]
CH
2
CH
2
CH
3
C
NH
2
O
NaOBr
CH
2
CH
2
CH
3
NH
2
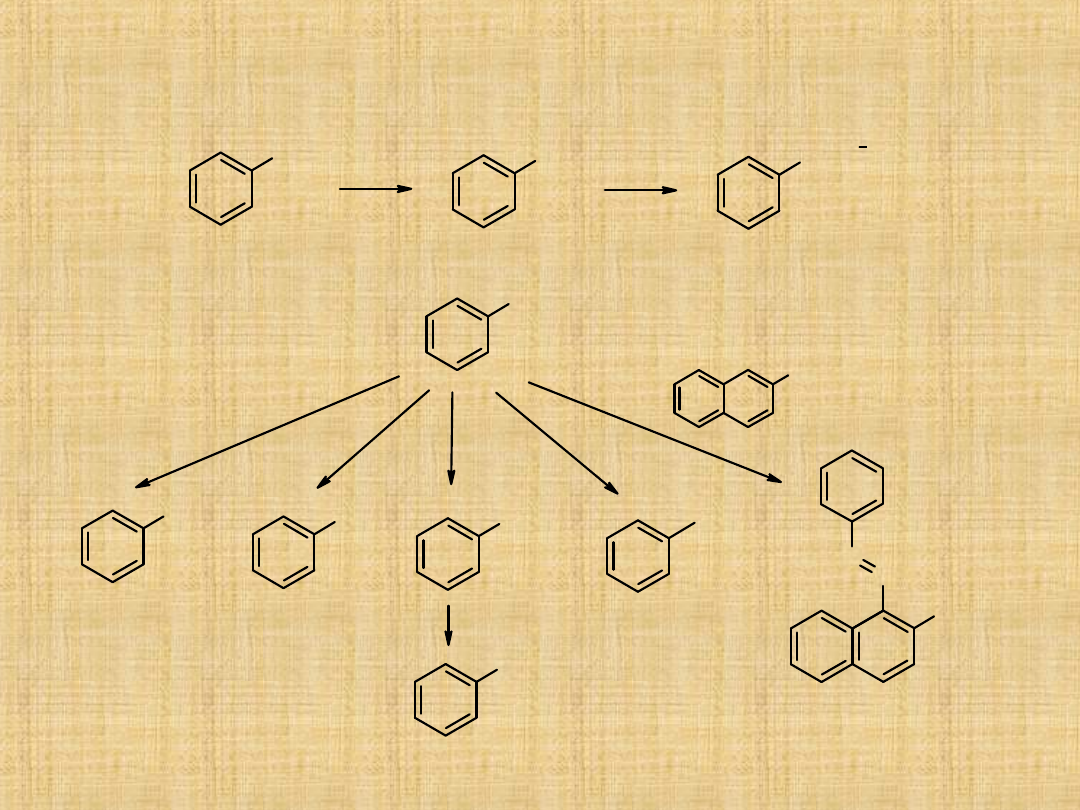
Tworzenie soli dwuazoniowych i ich reakcje
NO
2
NH
2
N
2
Cl
[H]
NaNO
2
HCl
+
N
2
OH
+
H
2
O
I
KI
CN
COOH
CuCN
Cl
CuCl
OH
OH
N
N
barwniki azowe
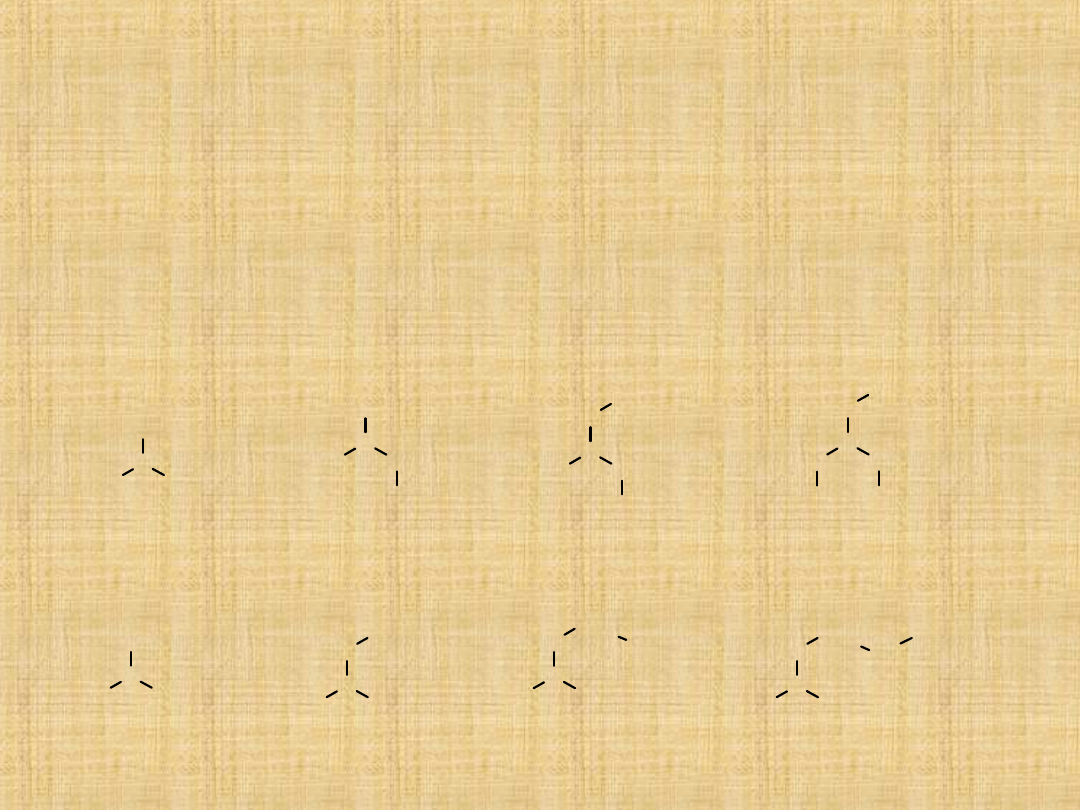
Zasadowe właściwości amin
Aminy alifatyczne
Grupy alkilowe, ze względu na efekt indukcyjny (oddają elektrony)
zwiększają zasadowość amin.
Dlatego aminy pierwszorzędowe są silniejszymi zasadami od amoniaku, a
aminy drugorzędowe od amin pierwszorzędowych
W przypadku amin trzeciorzędowych odgrywają role względy sferyczne i
aminy trzeciorzędowe są słabszymi zasadami od amin drugorzędowych.
H
N
H
H
pK
b
=
4,75
H
N
CH
2
H
CH
3
pK
b
=
3,29
H
N
CH
2
C
H
2
CH
3
CH
3
pK
b
=
3,00
C
H
2
CH
3
N
CH
2
C
H
2
CH
3
CH
3
pK
b
=
3,24
H
N
H
CH
3
pK
b
=
3,35
H
N
H
C
H
2
CH
3
CH
2
pK
b
=
3,35
CH
3
CH
2
H
N
H
C
H
2
CH
2
pK
b
=
3,39
H
N
H
C
H
2
CH
3
pK
b
=
3,29
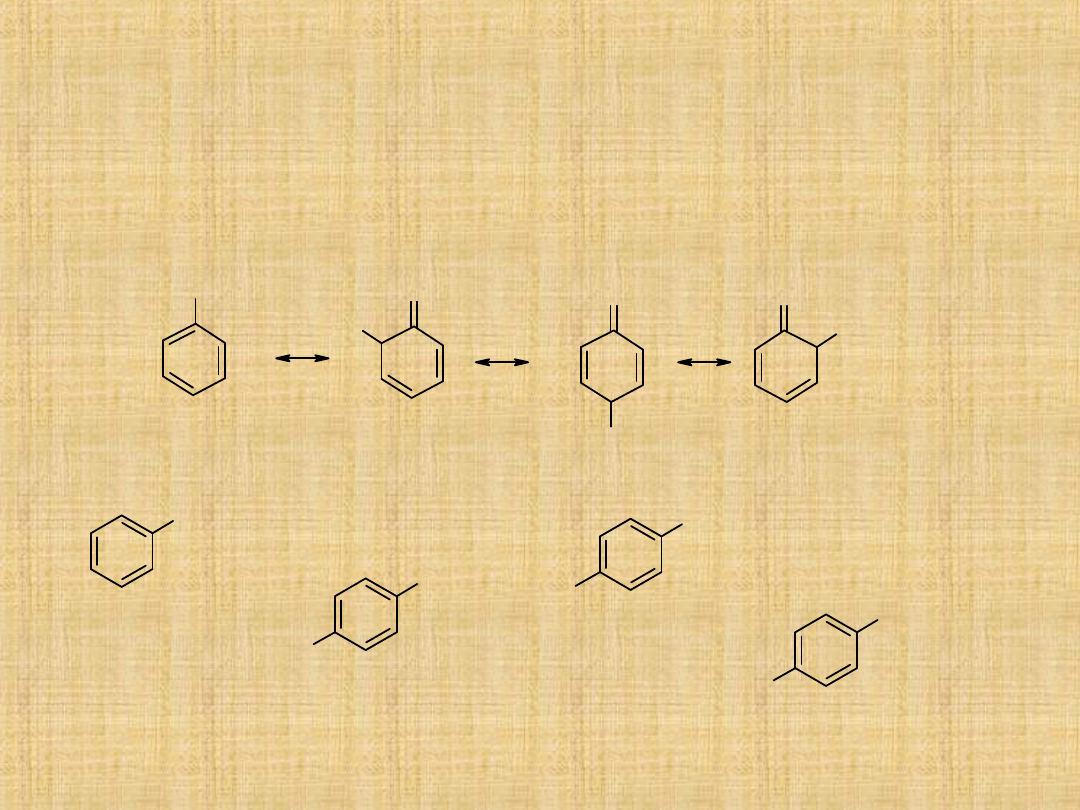
Zasadowe właściwości amin
Aminy aromatyczne
Aminy aromatyczne są słabsze od amoniaku przyczyną jest sprzężenie wolnej
pary elektronowej atomu azotu z elektronami pierścienia aromatycznego.
NH
2
NH
2
+
H
NH
2
+
H
NH
2
+
H
:
–
–
–
NH
2
pK
b
=
9,38
NH
2
C
H
3
pK
b
=
8,92
pK
b
=
10,15
NH
2
Br
pK
b
=
13,0
NH
2
O
2
N
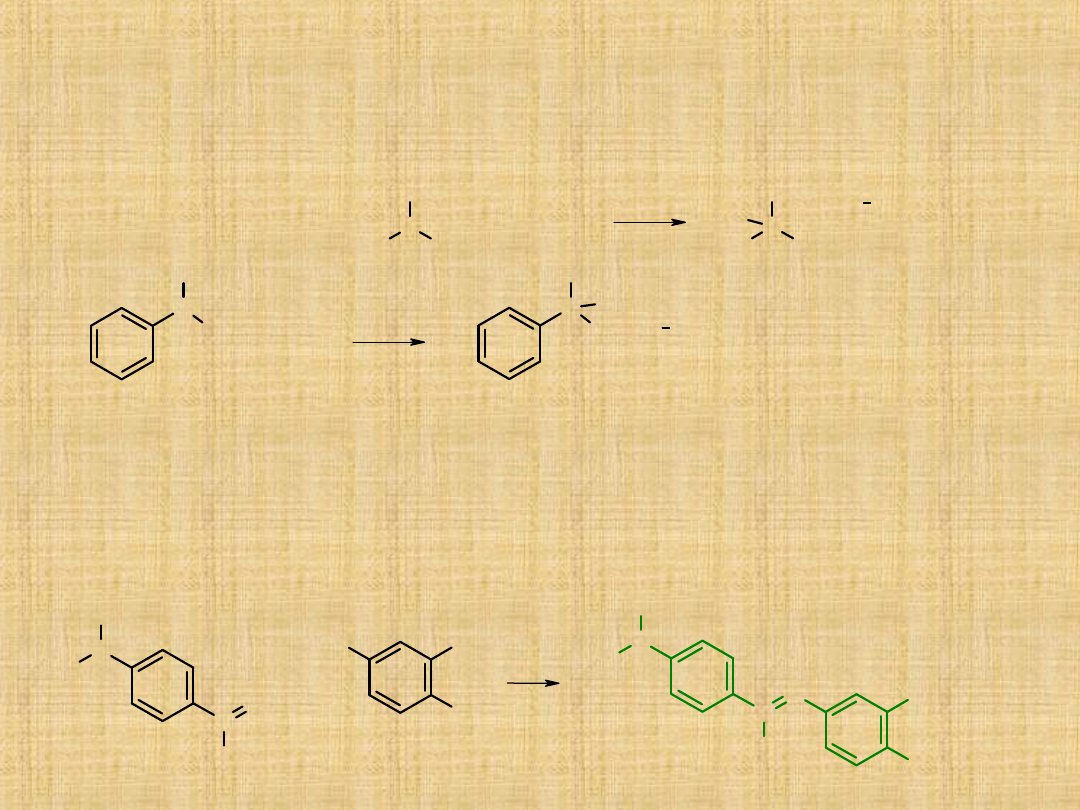
Reakcje amin
Najważniejsze reakcje amin to:
Reakcje z kwasami
Reakcje amin ze związkami karbonylowymi
Aminy reagują ze związkami zawierającymi w cząsteczce
grupę karbonylową tworząc tzw. Zasady Shiffa
R
1
CHO + H
2
N-R
2
(lub Ar) R
1
CHN-R
2
(lub Ar) +
H
2
O
H
N
+
CH
3
H
H
Cl
H
N
CH
3
H
Cl
H
+
Br
H
N
+
H
H
H
Br
N
H
H
+
NH
2
N
H
2
CH
3
C
H
3
CH
3
N
C
H
O
NH
2
N
CH
3
C
H
3
CH
3
N
C
H
+
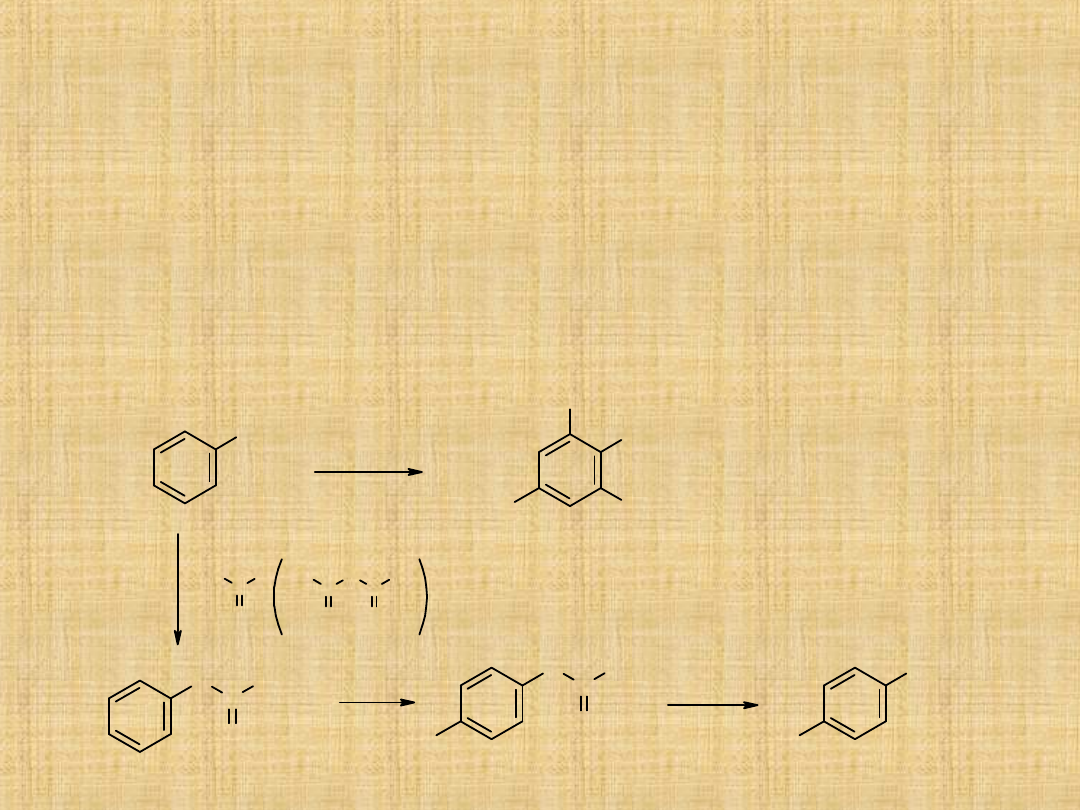
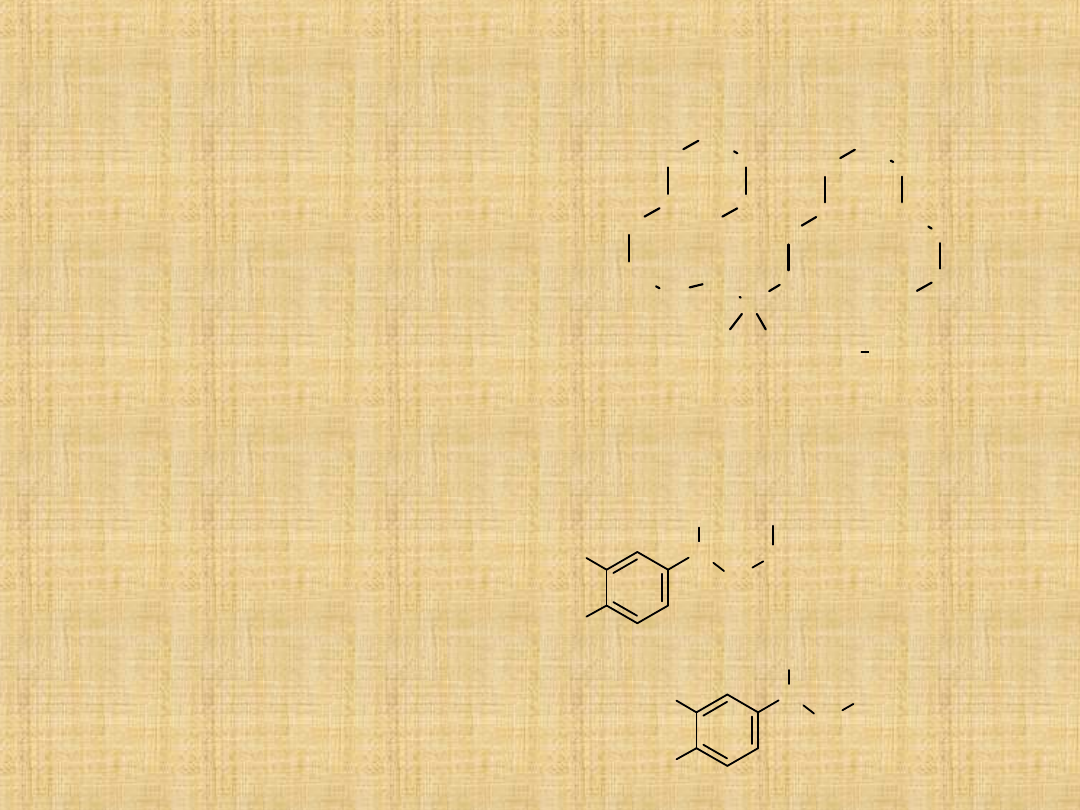
Zabezpieczanie grupy aminoej
Problemem w planowaniu reakcji chemicznych może być
niekiedy duża reaktywność amin. Dotyczy to zwłaszcza amin
aromatycznych
Podstawniki –NH
2
oraz pochodne –NHR, –NR
2
, –NHCOR są
grupami silnie aktywującymi i kierującymi w położenie –orto i
–para.
Stąd często w celu wprowadzenia tylko jednego podstawnika
stosuje się tzw. zabezpieczanie.
NH
2
Br
2
NH
2
Br
Br
Br
Cl
C
O
C
H
3
O
C
O
CH
3
C
O
C
H
3
N
H
C
O
CH
3
Br
2
N
H
C
O
CH
3
Br
NH
2
Br
H
2
O /H
+
Zastosowanie związków amoniowych
Czwartorzędowe sole amoniowe
wchodzą w skład nowoczesnych preparatów
zabezpieczających drewno przed
działaniem grzybów pleśniowych oraz
owadów i glonów. Najbardziej znany z nich
to DDAC (chlorek
didecylodimetyloamoniowy – tzw. Borman).
Dużą zaletą jest jego silne powiązanie z
drewnem. Stosowany pod farby i lakiery
zwiększa odporność biologiczną
drewnianych elementów budowlanych.
Adrenalina, noradrenalina
Są to hormony wydzielane do krwi i podnoszące
ciśnienie krwi w poczuciu niebezpieczeństwa
Adrenalina przygotowuje organizm do walki
lub ucieczki.
Noradrenalina uczestniczy w
przenoszeniu
impulsów między
włóknami nerwowymi.
Cl
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
N
+
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
chlorek didecylodimetyloamoniowy,
DDAC
CH
O
H
O
H
CH
2
OH
NH
2
CH
O
H
O
H
CH
2
OH
NH
CH
3
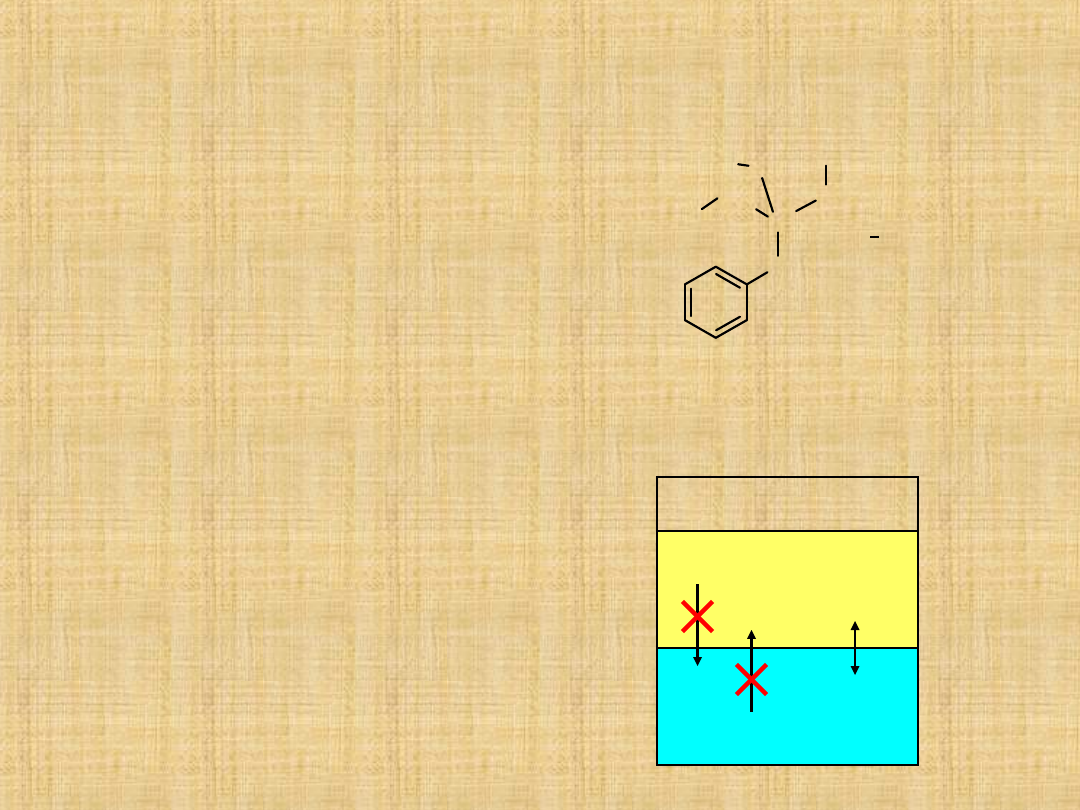
Katalizatory przeniesienia fazowego (KPF)
(Prof. Mąkosza – Warszawa)
KPF-mają za zadanie doprowadzenie do
wzajemnego kontaktu substancji o
właściwościach hydro i lipofilowych.
Katalizatorem są czwatorzędowe sole
amoniowe transportują one odczynnik
nieorganiczny z fazy wodnej w głąb fazy
organicznej.
Podobne znaczenie mają etery
koronowe.(selektywnie kompleksują
kationy o określonej średnicy).
R-Cl +NaCN R-CN +H
2
O
Katalzatorem przemiany jest Q
+
Cl
–
(TEBA)
Q
+
Cl
–
+ NaCN Q
+
CN
–
+
NaCl
Q
+
CN
–
+ R-Cl Q
+
Cl
–
+ R-CN
CH
2
N
+
CH
2
CH
2
CH
2
CH
3
CH
3
CH
3
Cl
chlorek
benzylotributyloamoniowy
TEBA
Na
+
,
CN
–
Q
+
CN
–
Q
+
CN
–
R-Cl
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
Aminy analityka
wyk12 Indukcja
Wyk12 term
aminy 4
1 Aminy kompendium
aminy amidy izoptyczna, Chemia, Liceum, klasa II
otrzym 2 aminy w 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
aminy otrzymywanie, podstawy chemii organicznej
aminy amidy
Aminy i aminokwasy, chemia, GIMNAZJUM
aminy sprawo
BT aminy
Termin witamina pochodzi od słowa kluczowe i aminy
AMINY KATECHOLOWE, II rok, II rok CM UMK, Fizjologia, Fizjologia
aminy wlasciwosci, biologia, chemia organiczna
pra-wyk12, UE Katowice FiR, prawo
więcej podobnych podstron