
Reinhard Kulessa
1
Wykład 12
8 Zastosowanie termodynamiki
statystycznej
8.1 Oddziaływanie układów S i S
’
8.2 Układ kanoniczny
8.3 Wielki układ
kanoniczny
8.4 Czynnik Gibbsa i wielka funkcja podziału
8.5 Stała oraz stała k
8.6 Własności funkcji podziału
8.7 Gazy dwu- i wieloatomowe

Reinhard Kulessa
2
8 Zastosowanie termodynamiki
statystycznej
8.1 Oddziaływanie układów S i S
’
Parametry zewnętrzne
są to parametry, które
wpływają na ruch cząstek układu, czyli na poziomy
energetyczne układu. Oddziaływanie dwóch
układów polega na wymianie pomiędzy nimi
energii lub cząstek, przy czym układy mogą być
izolowane lub nie.
1.
Oddziaływanie termiczne
-
jest to oddziaływanie
bez zmiany parametrów zewnętrznych
Przyrost energii odbywa
się
kosztem pobrania ciepła Q.
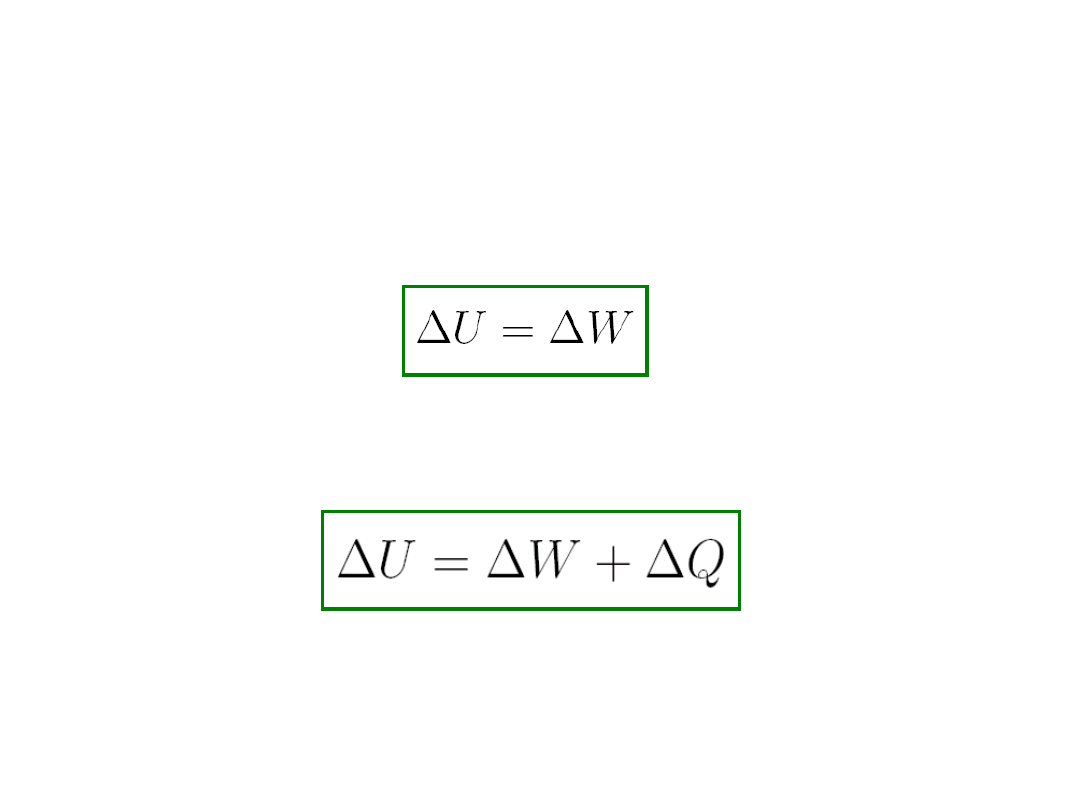
Reinhard Kulessa
3
2.
Oddziaływanie mechaniczne
(adiabatyczne)
Układy są izolowane. Mogą wymieniać energię pod
warunkiem zmiany niektórych parametrów
zewnętrznych. Przyrost średniej energii układu
izolowanego adiabatycznie jest równy pracy
makroskopowej wykonanej na układzie.
3.
Oddziaływanie ogólne
jest to oddziaływanie w
którym układy nie są izolowane i w którym nie są
stałe ich parametry zewnętrzne.
Powyższe równanie stanowi I zasadę termodynamiki
Reinhard Kulessa
4
4.
Oddziaływanie dyfuzyjne
-
jest to oddziaływanie
polegające na wymianie cząstek bez wymiany
energii
.
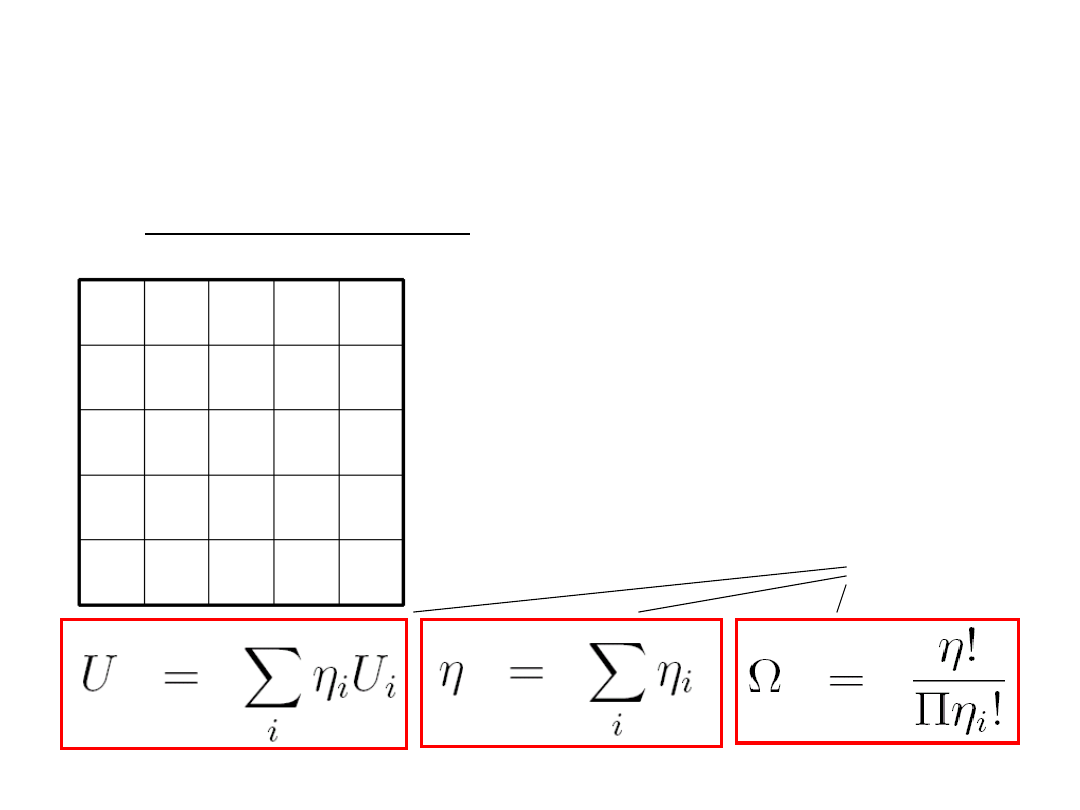
8.2 Układ kanoniczny
Mamy duży układ, który jest
zbiorem podukładów, z
których każdy ma stałą
objętość V i stałą liczbę
cząstek N.
Całkowita
energia układu jest stała
,
lecz energia pojedynczych
podukładów może się
zmieniać.
Mamy więc:
(8.1)
N,V
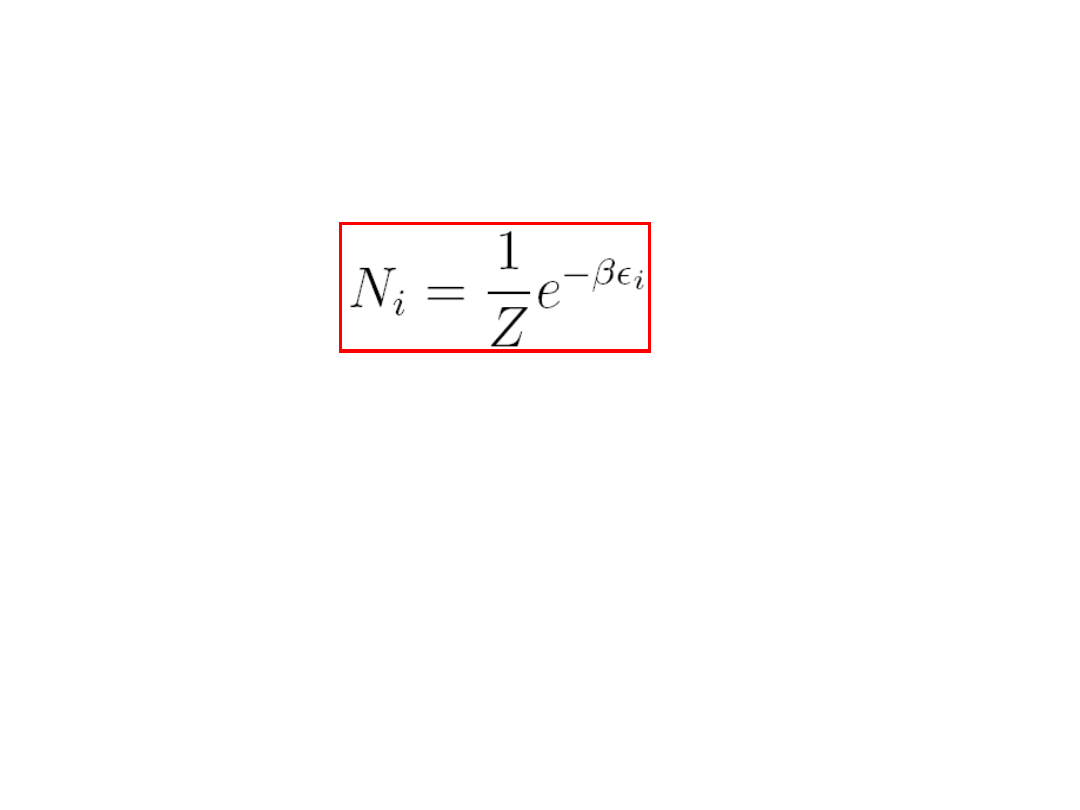
Reinhard Kulessa
5
Powyższe równania dotyczą oddziaływania
termicznego i rozkładu Maxwella-Bolzmanna.
Prawdopodobieństwo znalezienia układu w
stanie i dane jest wzorem:
(8.2)
Równanie to nazywamy rozkładem kanonicznym
pamiętając, że
Z
jest tzw. funkcją podziału, a
czynnik
nazywamy czynnikiem
Bolzmanna
.
i
e
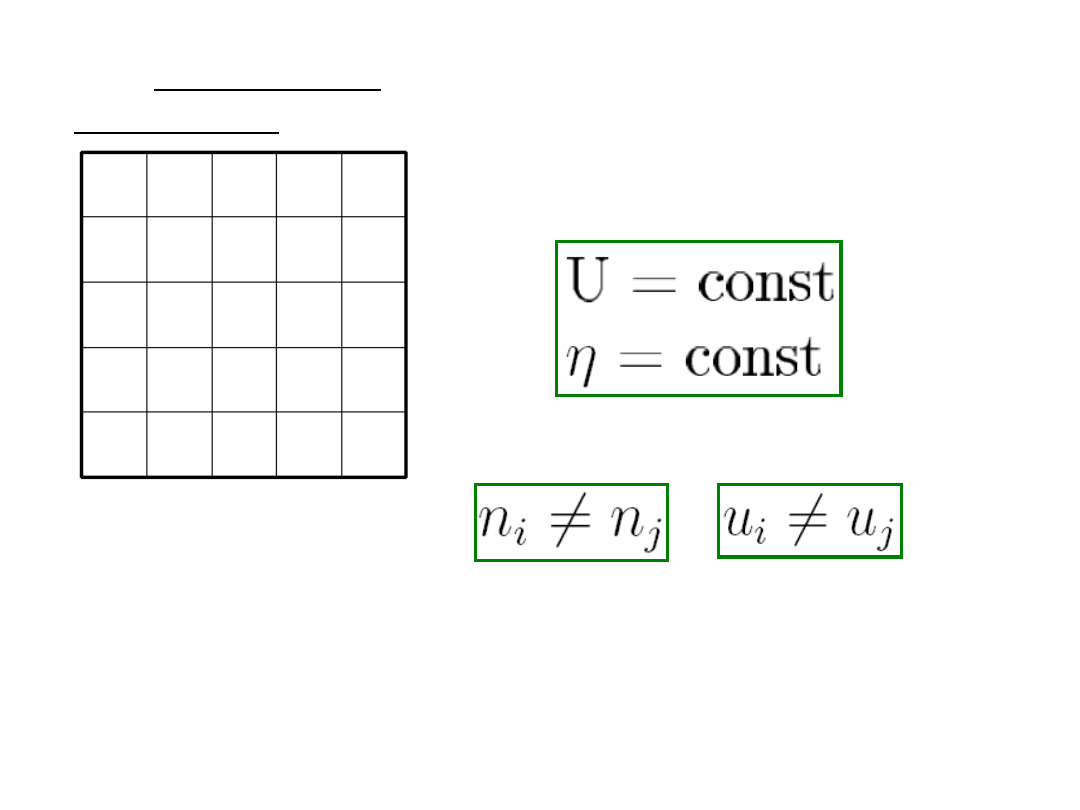
Reinhard Kulessa
6
8.3 Wielki układ
kanoniczny
V
Układ nasz posiada
podukładów o objętości V,
przy czym
Zachodzą również:
.
i
Weźmy dwa układy
(U
1
,N
1
), (U
2
,N
2
)
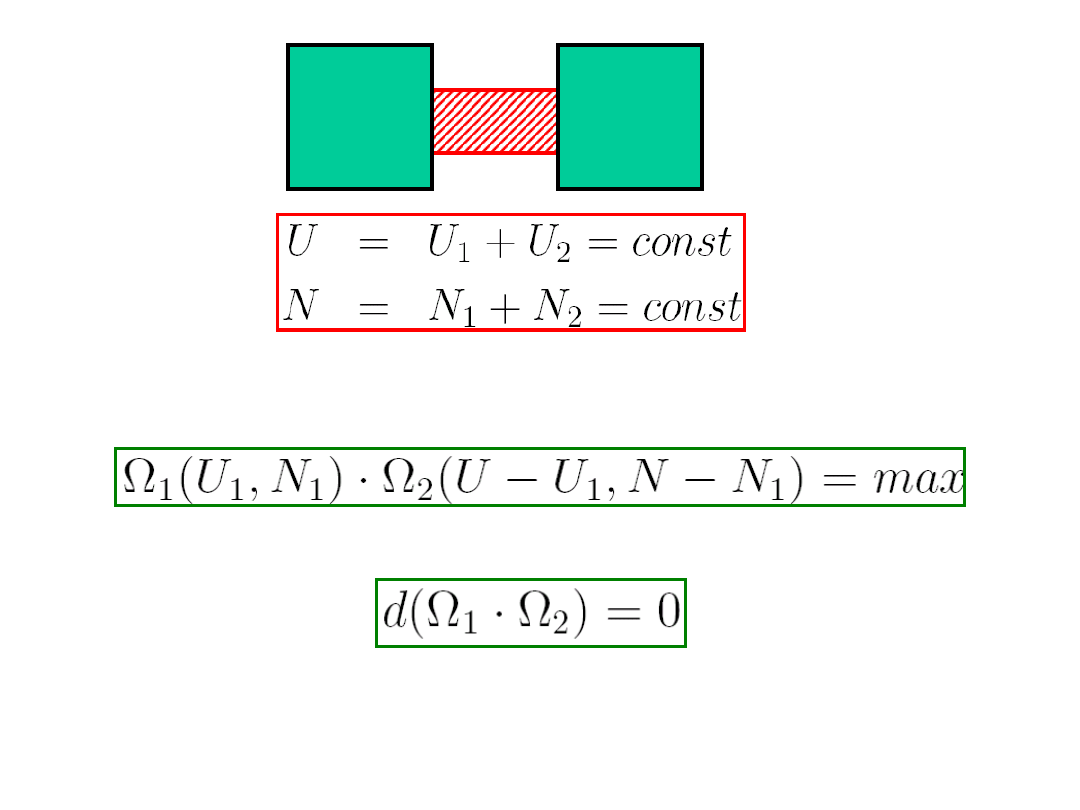
oddziaływujące termicznie i
dyfuzyjnie.Równowagę uzyskamy dla najbardziej
prawdopodobnego stanu, czyli takiego, czyli
takiego, dla którego liczba obsadzeń osiąga
maksimum
.
Reinhard Kulessa
7
U
1
N
1
U
2
N
2
(8.3)
Prawdopodobieństwo, czyli liczba stanów musi
osiągnąć maksimum ,
czyli musi być równa zeru różniczka
,
Biorąc pochodną po U
1
, U
2
, N
1
, N
2
i korzystając z
tego, że dN
2
= - dN
1
i dU
2
=-dU
1
, dzieląc przez
1
·
2
, otrzymujemy

Reinhard Kulessa
8
(8.4)
Równanie to stanowi warunek równowagi obydwu
układów. Pamiętając, że
oraz odpowiednio dla układu drugiego, otrzymujemy
zauważając, że równanie (8.4) jest pochodną
logarytmiczną
(8.5)
Równanie to jest spełnione wtedy, gdy zerują się
kwadratowe nawiasy, czyli

Reinhard Kulessa
9
(8.6)
oraz
.
W oparciu o poznaną wcześniej tożsamość
Maxwella (7.10) stwierdzamy w oparciu o lewe
równanie, że jednym z warunków równowagi jest
czyli
.
W celu przedyskutowania prawego równania
wprowadźmy pojęcie potencjału chemicznego.
Zrobiliśmy to już przy omawianiu równowagi dwóch
faz. (patrz r. (7.28) ) .
(8.7
)

Reinhard Kulessa
10
Potencjał chemiczny określa względną zmianę
możliwych stanów przy zmianie liczby cząstek.
Mamy więc
lu
b
(8.8)
.
Dla warunku równowagi uzyskujemy z równania (8.5)
(8.9)
.
Entropia będzie > 0 przy przekazie dN cząstek, gdy
2
>
1
.
Oznacza to również, że przepływ cząstek między
układami w kontakcie dyfuzyjnym odbywa się
zawsze w kierunku od większego potencjału
chemicznego do mniejszego.
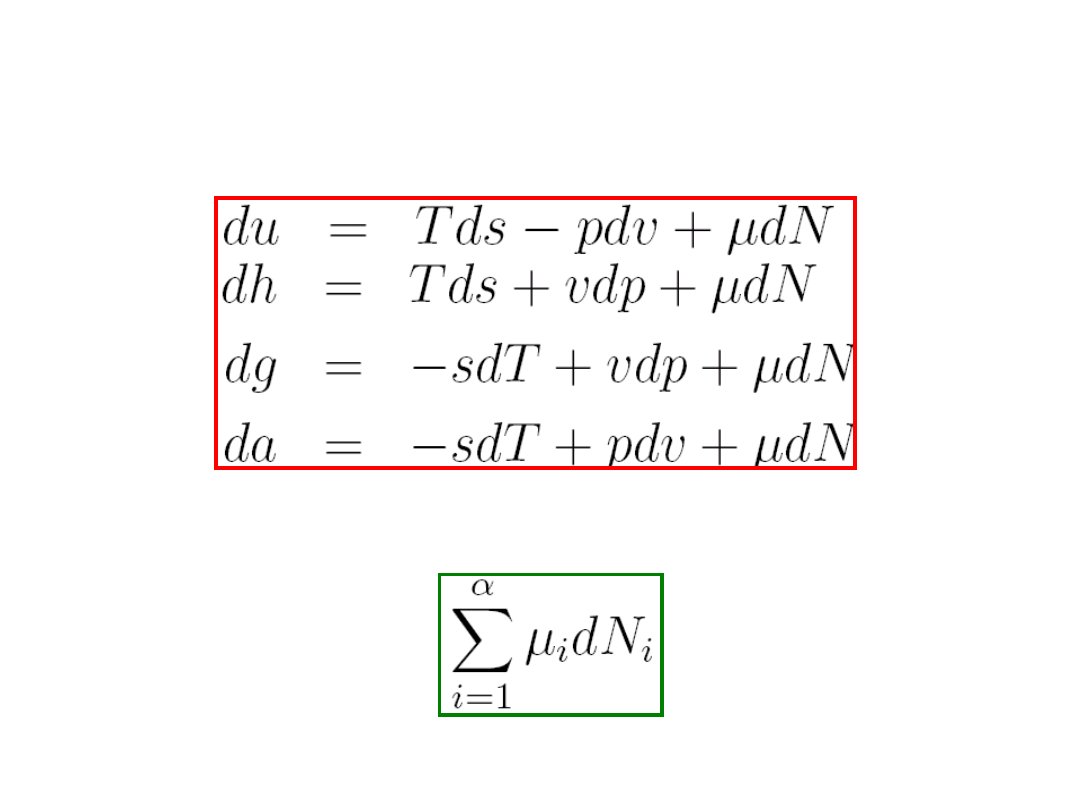
Reinhard Kulessa
11
Jeśli weźmiemy pod uwagę układ złożony z jednej
fazy, to dotychczas podane funkcje termodynamiczne
zmienią się następująco:
(8.10)
W przypadku, gdy mamy kilka
()
składników w
danej fazie, to
zastępujemy
dN
przez
.
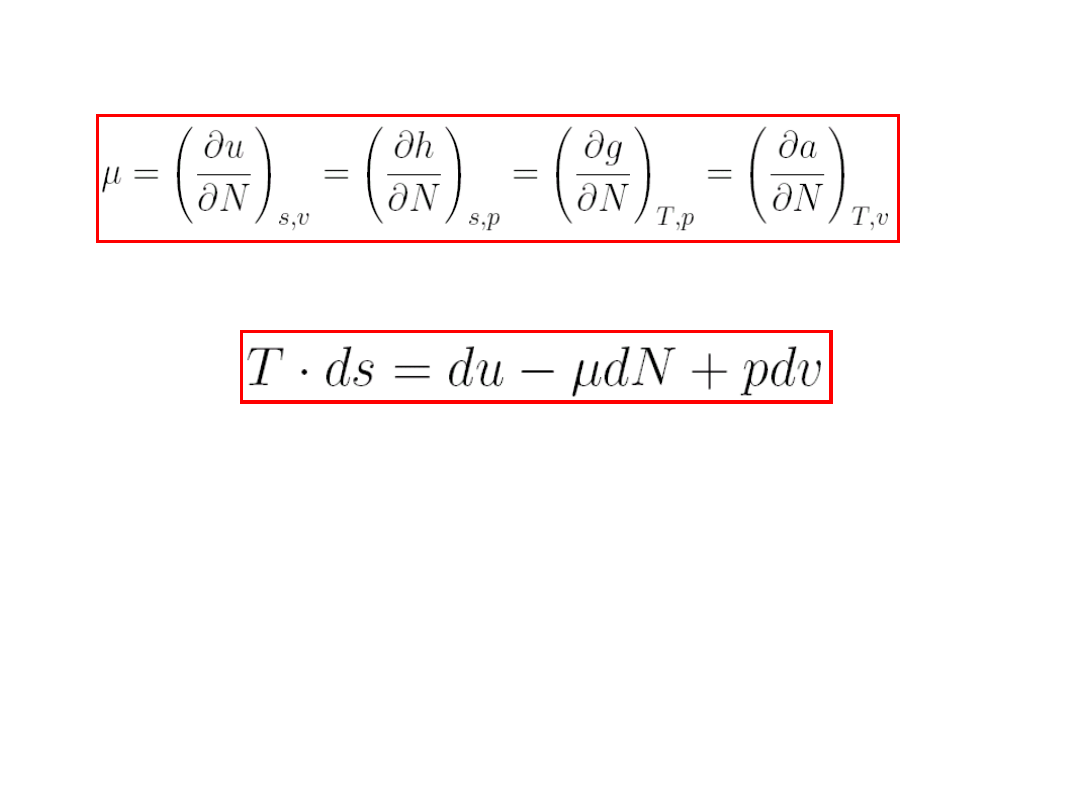
Reinhard Kulessa
12
Można więc zdefiniować potencjał chemiczny
następująco:
(8.11)
.
Wyrażenie
(8.12)
nazywa się
uogólnioną tożsamością termodynamiczną.

Reinhard Kulessa
13
8.4 Czynnik Gibbsa i wielka funkcja podziału
Zastanówmy się jakie jest prawdopodobieństwo
znalezienia układu N cząstek w stanie i o energii
i
.
Pamiętamy, że z tym układem możliwy jest
kontakt termiczny, oraz wymiana cząstek. Można
pokazać, że prawdopodobieństwo to jest równe:
(8.13)
.
Jest to tzw. wielki układ kanoniczny Gibbsa. Wyrażenie
nazywamy czynnikiem Gibbsa, a jest tzw. wielką
funkcją podziału. Jest to suma czynników Gibbsa
dla wszystkich stanów układu przy uwzględnieniu
wszystkich cząstek.
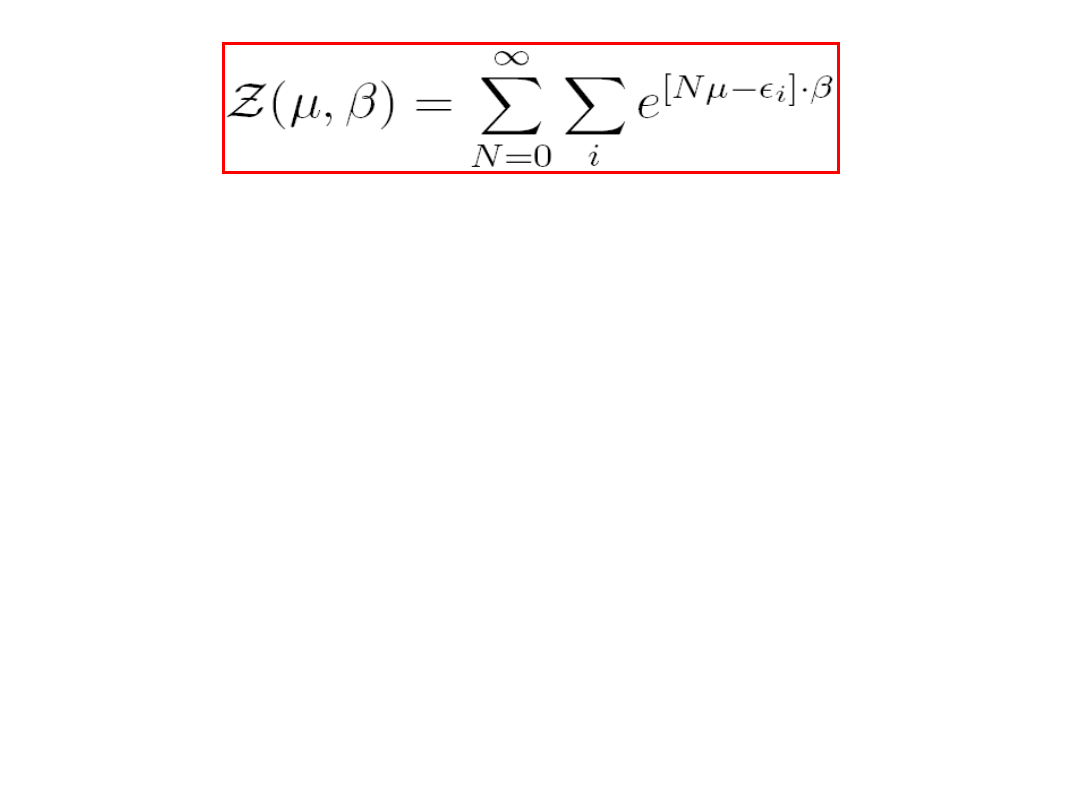
Reinhard Kulessa
14
(8.14)
Widzimy, że
gdy nie ma wymiany cząstek, czynnik
Gibbsa przechodzi w czynnik Bolzmanna
.

Reinhard Kulessa
15
8.5 Stała oraz stała k
Wyprowadźmy obecnie zależność pomiędzy a k.
Pamiętamy, że S=k ln . Rozważmy rozkład Bosego-
Einsteina.
Logarytm naturalny prawdopodobieństwa
termodynamicznego tego rozkładu dany jest wzorem
(5.21),
czyli
Wprowadzając entropię otrzymujemy:

Reinhard Kulessa
16
Pamiętamy, że zgodnie z równaniem
(7.9)
Równanie (
8.15)
przedstawia entropię dla układu
izolowanego o stałej objętości, tak, że możemy
przeprowadzić różniczkowanie. Po prostych
przekształceniach otrzymujemy
(8.15)
(8.16)
Równocześnie z rozkładu Bosego-Einsteina mamy:

Reinhard Kulessa
17
(8.17)
tak, że
,
(8.18)
.
Wiemy, że
, czyli
(8.19)
.
Również , co
daje,

Reinhard Kulessa
18
(8.20)
W oparciu o równania
(7.9), (8.18), (8.19) i (8.20)
mamy więc:
lub
(8.21)
.
Do tego samego rezultatu możemy dojść w
oparciu o inne rozkłady.

Reinhard Kulessa
19
8.6 Własności funkcji podziału
Załóżmy, że mamy zbiór mikroskopowych cząstek
spełniających statystykę Bosego-Einsteina lub
Maxwella-Bolzmanna dla g
i
>> N
i
. Wtedy,
(8.22)
,
a rozkład dla stanu równowagi będzie :
(8.23)
.
Dla g
i
>> N
i
możemy napisać w oparciu o
równanie
(8.15)
(8.24)
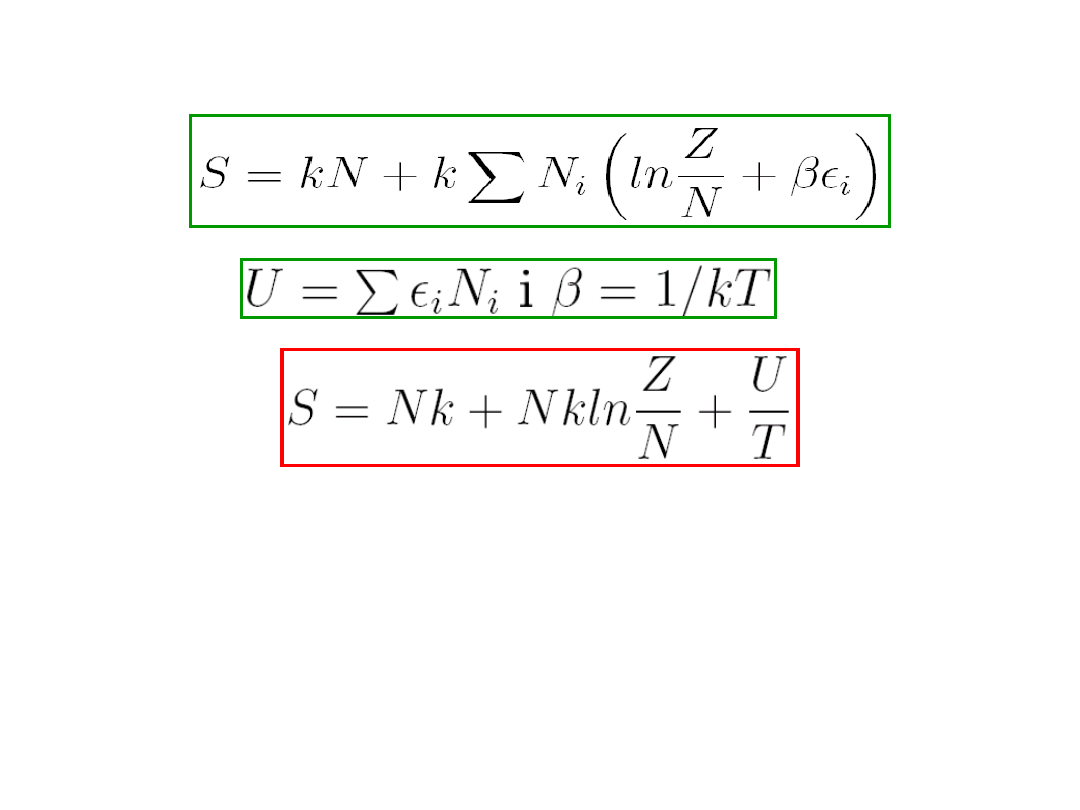
Reinhard Kulessa
20
Korzystając z równania
(8.23)
mamy
,
a ponieważ , mamy
(8.25)
Wyraziliśmy więc entropię przez funkcję podziału i
energię wewnętrzną układu.
Dla układu izolowanego
funkcja podziału zależy tylko od temperatury, bo
zarówno g
i
jak i
i
są ustalone przez warunki
kwantowo-mechaniczne.

Reinhard Kulessa
21
(8.26)
z kolei z równania
(8.23)
mamy
,
(8.27)
.
Mamy więc,
(8.2
8)
A równanie
(8.25)
przyjmuje postać
,

Reinhard Kulessa
22
(8.29)
Dla wielkiego układu kanonicznego otrzymujemy na
energię układu następujące wyrażenie:
(8.30)
.
Widzimy, że dla układu z g
i
>> N
i
U i S mogą być
wyrażone przez funkcję podziału.
Inne własności
termodynamiczne też mogą być wyrażone przez
funkcję podziału np.. funkcja Helmholza:

Reinhard Kulessa
23
(8.31)
.
Jedną z tożsamości Maxwella było:
.
(8.32)
Mamy
więc:
(8.33)
Można więc napisać entalpię i funkcję Gibbsa
następująco:
(8.34)
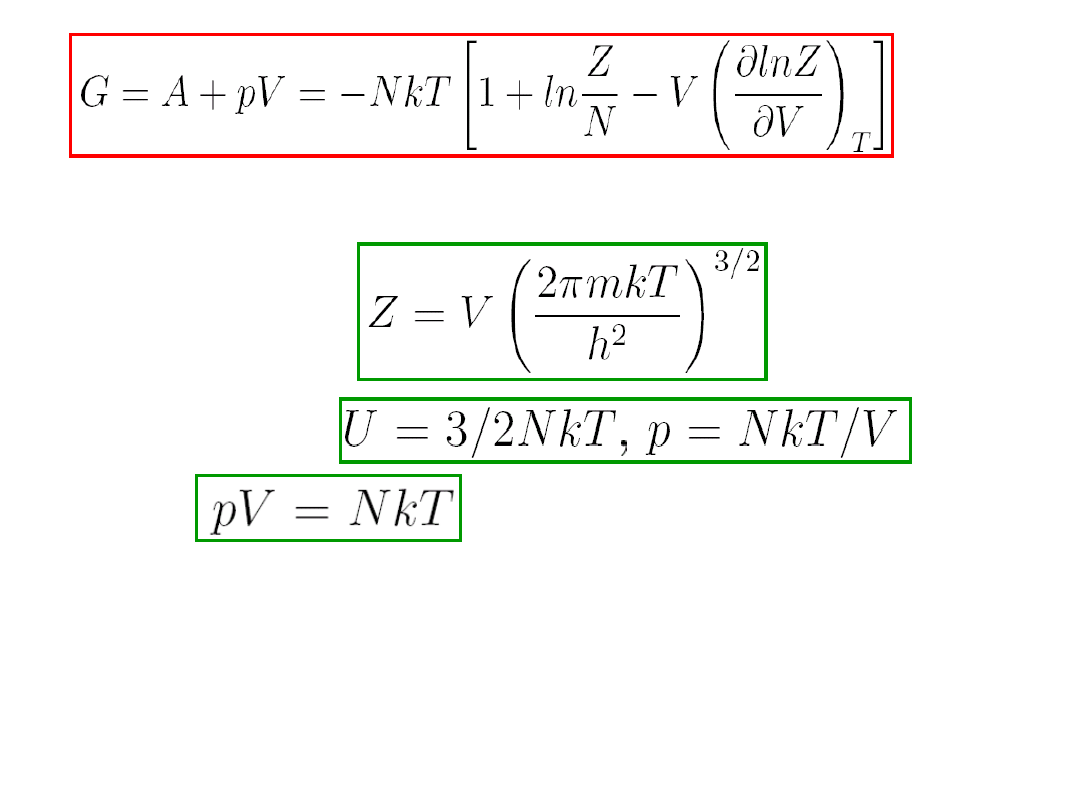
Reinhard Kulessa
24
. (8.35)
Dla idealnego gazu monoatomowego można pokazać, że:
Wynika stąd, że
czyli
,
.
Można stąd łatwo wyliczyć ciepło właściwe.
Reinhard Kulessa
25
8.7 Gazy dwu- i wieloatomowe
W paragrafie 5.4, kiedy mówiliśmy o degeneracji
stanów kwantowych podaliśmy rysunek
dwuatomowej cząstki, która mogła wykonywać
ruchy rotacyjne, wibracyjne i translacyjne(ruch
środka masy). Załóżmy,
że stosujemy graniczny przypadek statystyki
Bosego-Einsteina, czyli dla przypadku, gdy g
i
>>
N
i
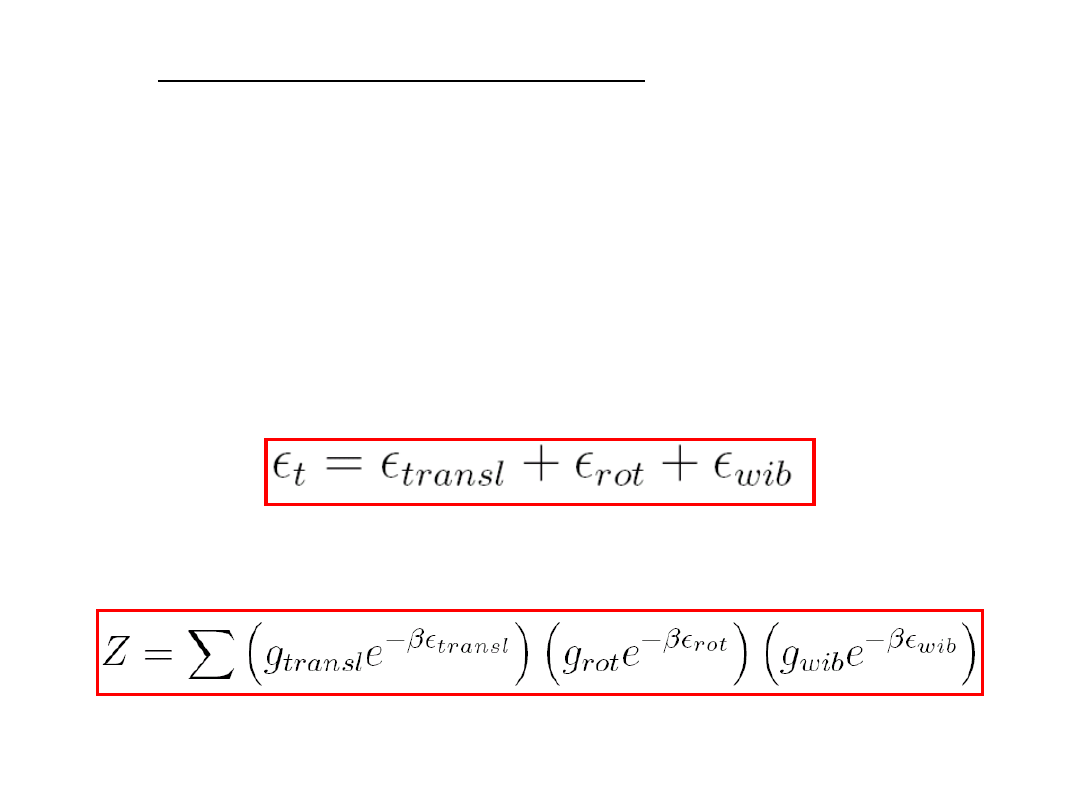
. Całkowita energia molekuły wyrazi się
następująco:
,
(8.36)
a funkcja podziału
(8.37)
.

Reinhard Kulessa
26
Kiedy każdy z tych ruchów odbywa się niezależnie,
funkcję podziału można rozdzielić:
.
Dla dwuatomowej molekuły energia rotacyjna jest dana przez:
(8.38)
gdzie j = 0,2,4.
Degeneracja poziomu rotacyjnego jest równa g
rot
= 2j+1.
Stąd
,(8.39)

Reinhard Kulessa
27
gdzie jest tzw.
charakterystyczną temperaturą rotacji.
Z kolei dla ruchów wibracyjnych otrzymamy:
(8.40)
gdzie
n=0,1,2...
,
Funkcja podziału przyjmie postać:
.
(8.41)
Definiując charakterystyczną temperaturę wibracji jako
(8.42)
,

Reinhard Kulessa
28
otrzymamy
.
(8.43)
Korzystając z r. (8.28), otrzymujemy, przyjmując
dla rotacji
. (8.44)
Możemy więc policzyć z tych równań odpowiednie
ciepła właściwe.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
wyk12 Indukcja
wyk12 aminy
Wyk4 term
term 1 info (1), AGH
In literary studies literary translation is a term of two meanings rev ag
2 1 4 9 Lab Establishing a Console Session with Tera Term
End of term tests
tif test 1 term
spr term
exam 10 I term
krocce-term-PN, Sem 3
term 2009 III 17
term 2009 III 7
term 2009 III 1
term 2009 III 14
term 8 6PUBPWKI4F7ET3VO2LCB7SFQF6GLMGTBXWX6RHI
więcej podobnych podstron