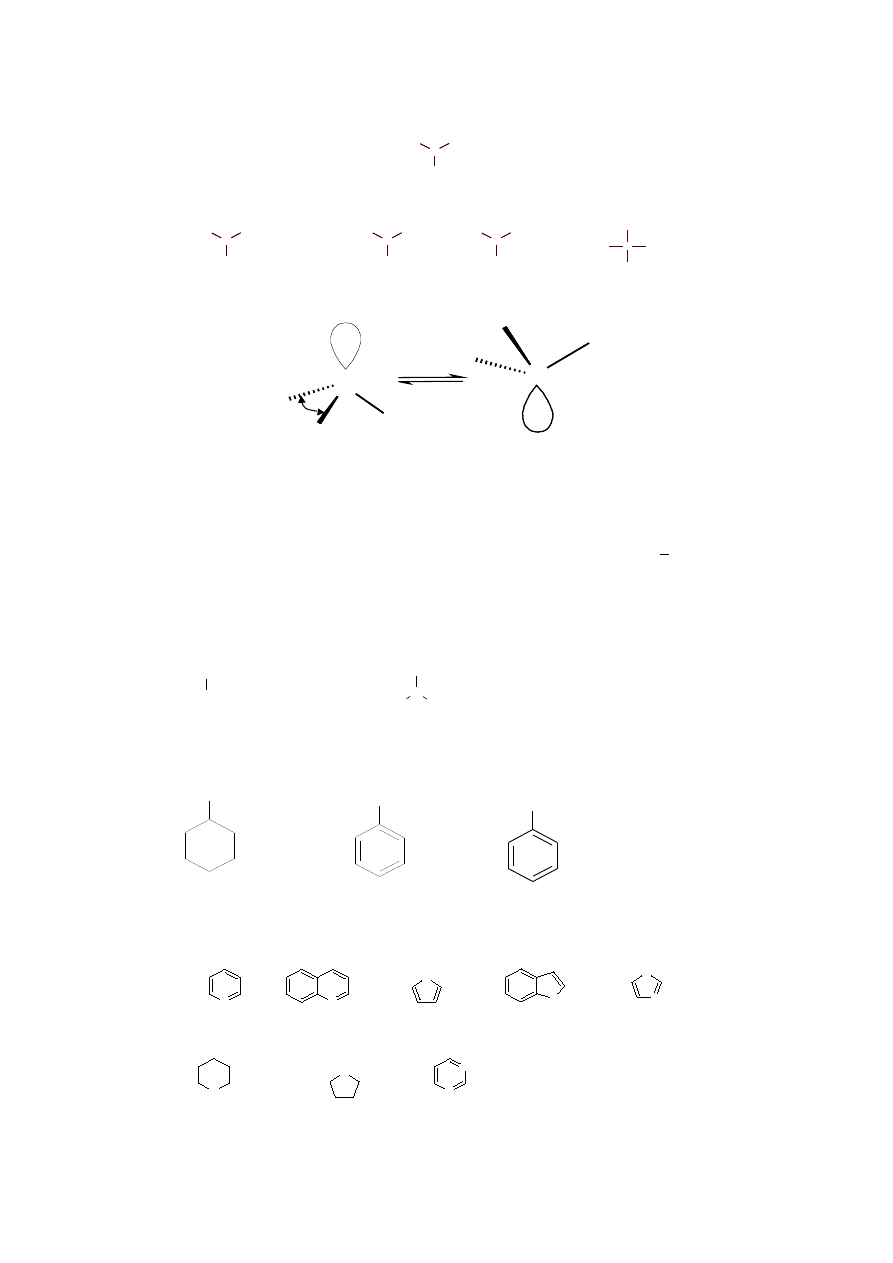
Aminy
N
H
R
H
:
N
H
R
H
:
N
H
R
R
:
N
H
R
R
:
N
R
R
R
:
N
R
R
R
:
N
H
H
H
:
N
H
H
H
:
amina
pierwszorzędowa
amina
drugorzędowa
amina
trzeciorzędowa
amoniak
N
:
N
:
N
:
N
:
inwersja
N
R
R
R
R
+
N
R
R
R
R
+
czwartorzędowa
sól amoniowa
108
o
hybrydyzacja sp
3
Nomenklatura amin
CH
3
NH
2
(CH
3
)
2
NH
(CH
3
)
3
N
(CH
3
)
4
N
+
Br
metylo
amina
di
metylo
amina
tri
metylo
amina
bromek
tetra
metylo
amoniowy
Grupa -NH
2
jako podstawnik
CH
3
CHCH
2
CH
3
NH
2
2-
amino
butan
CH
3
CHCH
2
CH
3
N
C
H
3
CH
2
CH
3
2-(
etylometyloamino
)butan
N-etylo-N-metylo-2-butanoamina
NH
2
NH
2
cykloheksyloamina
anilina
CH
2
NH
2
benzyloamina
N
N
N
H
N
H
N
H
N
H
N
N
H
N
N
pirydyna
chinolina
pirol
indol
imidazol
piperydyna
pirolidyna
pirymidyna
Atom azotu ma nr. 1
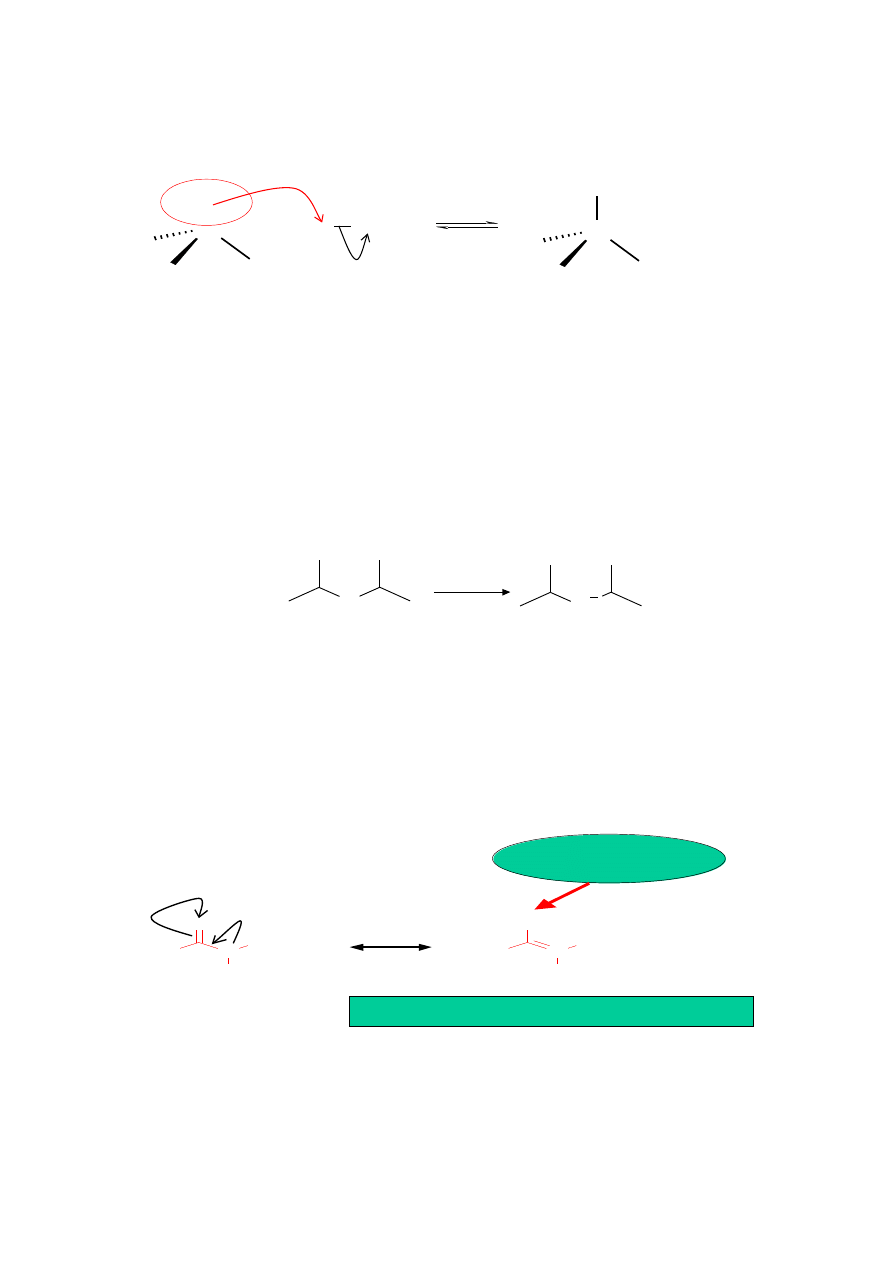
Własności zasadowe amin
N
N
+
H
H
OH
:
+
+
OH
-
OH
-
Aminy alifatyczne są mocniejszymi zasadami od amoniaku
Elektrodonorowy wpływ podstawników alkilowych stabilizuje
jon amoniowy
Grupy elektrodonorowe zwiększają zasadowość amin
„ elektroakceptorowe zmniejszają zasadowość amin
Własności kwasowe amin
n-C
4
H
9
Li +
N
H
N
Li
+
+ n-C
4
H
10
LDA
Własności kwasowo-zasadowe amin i amidów
R
N
O
H
H
: :
:
R
N
O
H
H
: :
:
R
N
O
H
H
: :
:
R
N
O
H
H
: :
:
-
+
Protonowanie
na atomie tlenu
Powstały kation jest stabilizowany
przez rezonans
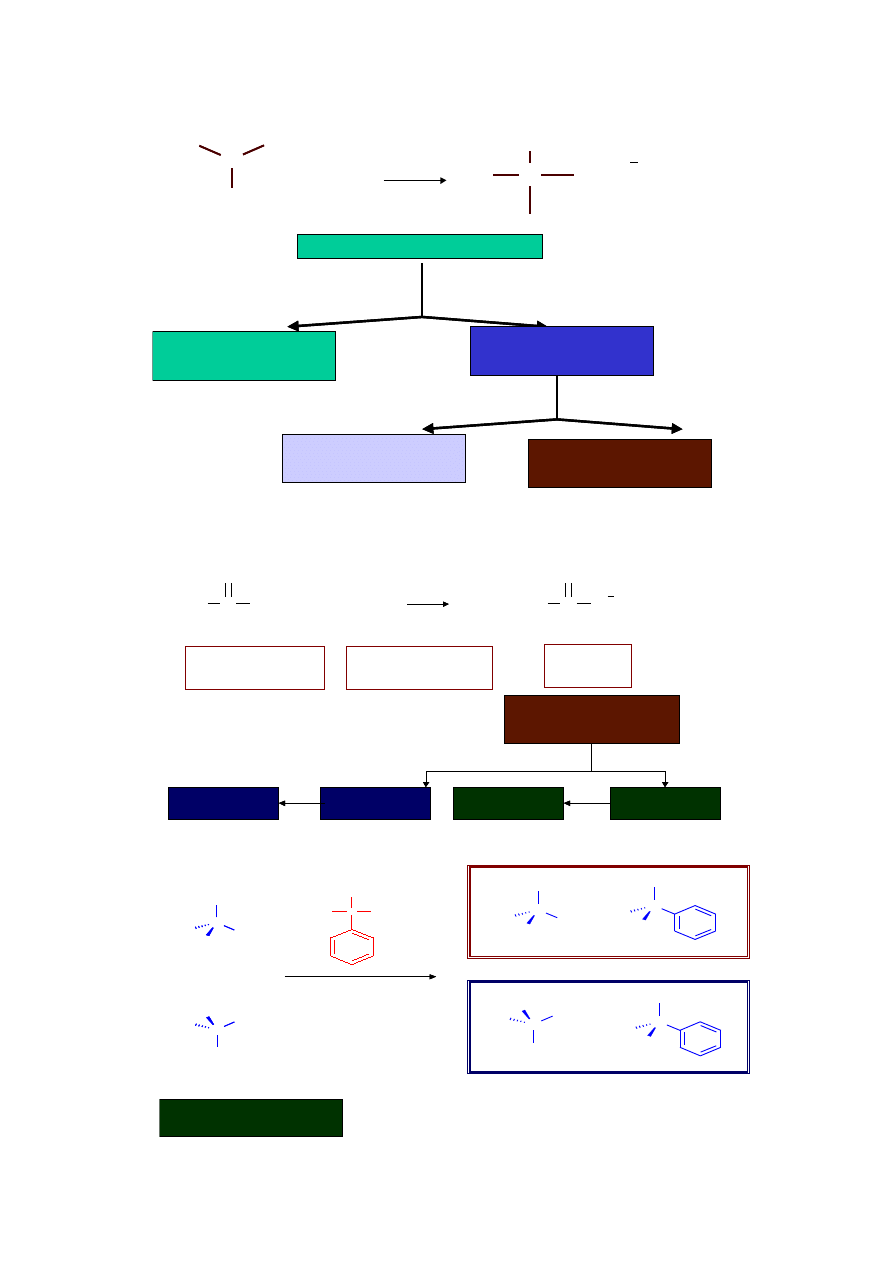
Sole amin
N
H
R
H
:
N
H
R
H
:
N
+
H
R
H
H
Cl
H Cl
+
Amina + związek obojętny
Eter, H
2
O, HCl
Eter, H
2
O, HCl
Warstwa eterowa
Związek obojętny
Warstwa wodna
sól aminy
Eter, NaOH
Eter, NaOH
Warstwa eterowa
amina
Warstwa wodna
NaCl
R C
O
O
RNH
3
+
R C
O
O
RNH
3
+
R C
OH
O
RNH
2
+
R C
OH
O
RNH
2
+
racemiczny kwas
(R, S)
enancjomerycznie
czysta amina (S)
sól (R, S)
i
(S, S)
Diastereoizomeryczne
sole amoniowe
(R, S)
(S, S)
Kwas (R)
Kwas (R)
Kwas (S)
Kwas (S)
Chiralne aminy jako odczynniki do rozdziału racematów
O
H
C
CH
3
H
COOH
(R)
O
H
C
CH
3
H
COOH
(R)
O
H
C
CH
3
H
COOH
(S)
+
O
H
C
CH
3
H
COOH
(S)
+
Racemiczny
kwas mlekowy
C
CH
3
H
NH
2
(R) –1-fenyloetyloamina
C
CH
3
H
NH
2
(R) –1-fenyloetyloamina
O
H
C
CH
3
H
COO-
C
H
3
C
H
NH
3
+
sól (R, R)
O
H
C
CH
3
H
COO-
C
H
3
C
H
NH
3
+
sól (R, R)
O
H
C
CH
3
H
COO-
C
H
3
C
H
NH
3
+
sól (S, R)
O
H
C
CH
3
H
COO-
C
H
3
C
H
NH
3
+
sól (S, R)
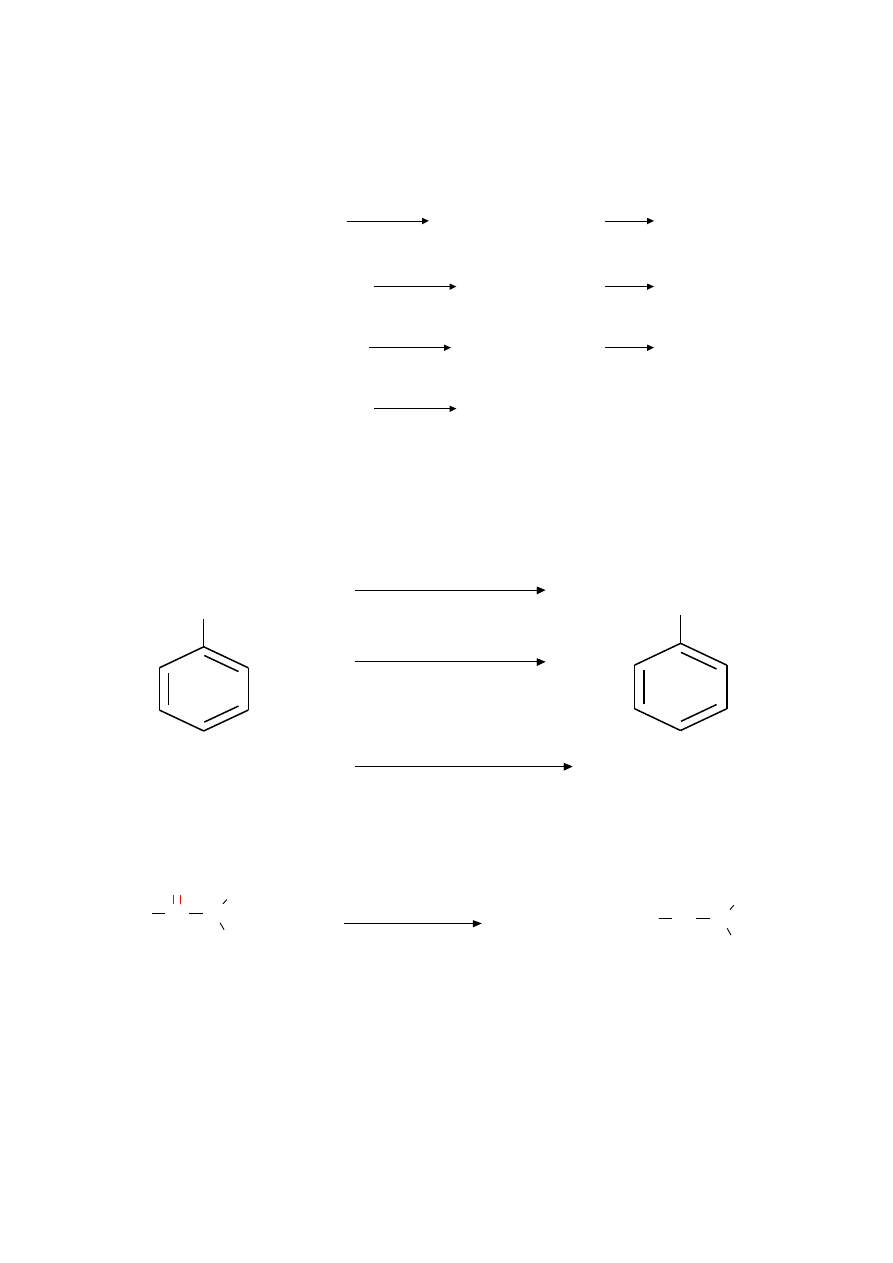
Synteza amin
Reakcje S
N
2 halogenków alkilowych
H
3
N
: + R-X RNH
3
+
X
-
RNH
2
RNH
2
+ R-X R
2
NH
2
+
X
-
R
2
NH
S
N
2
NaOH
NaOH
R
2
NH
+ R-X R
3
NH
+
X
-
R
3
N
R
3
N
+ R-X R
4
N
+
X
-
NaOH
Redukcja aromatycznych związków nitrowych
NH
2
NO
2
3H
2
, Ni
3H
2
, Ni
SnCl
2
, HCl
SnCl
2
, HCl
Zn, HCl
Zn, HCl
Redukcja amidów
LiAlH
4
R
C
O
N
R"
R'
R
C
H
2
N
R"
R'
R’ i/lub R” atom H, grupa alkilowa lub arylowa
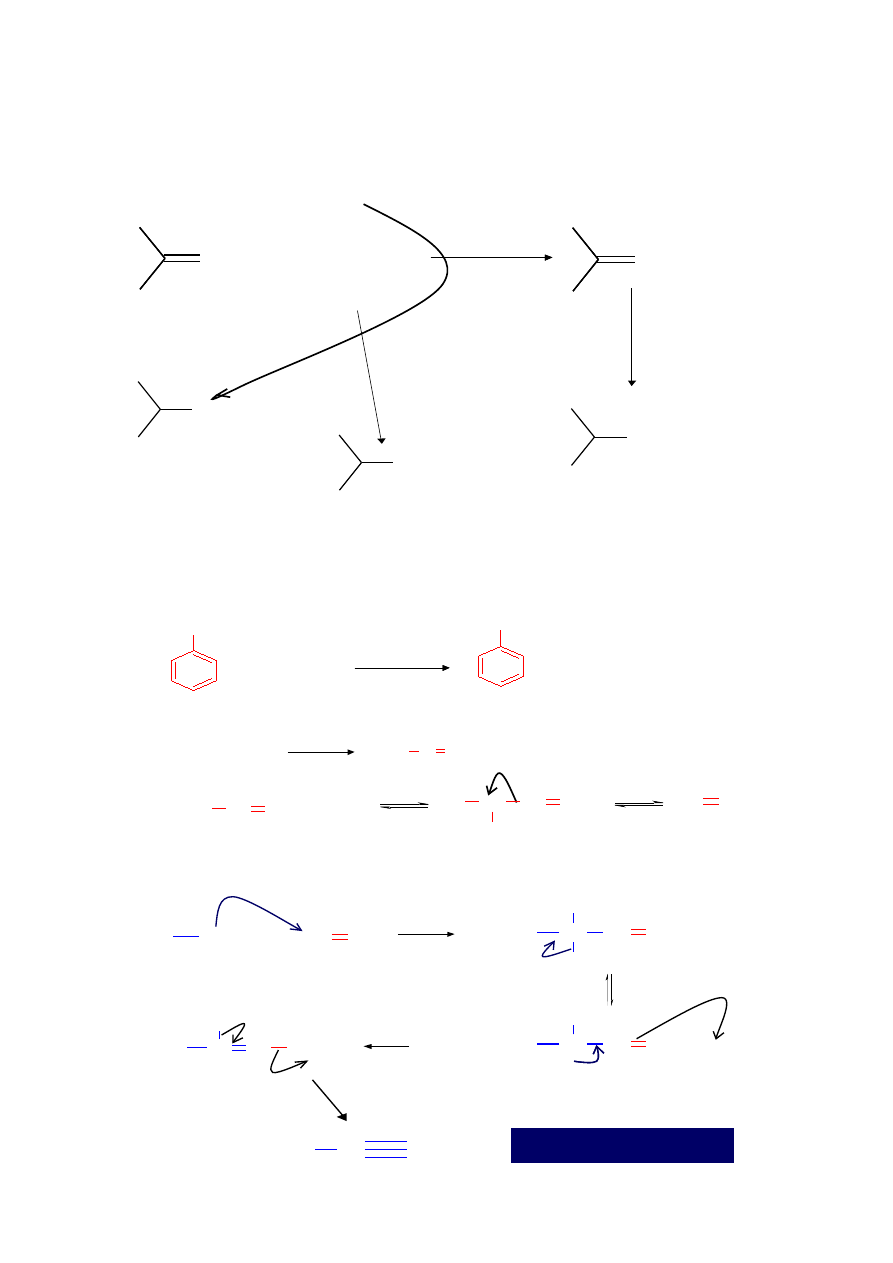
Redukcyjne aminowanie aldehydów i ketonów
NH
3
R
2
NH
O
RNH
2
N-R
+
O
RNH
2
N-R
+
H
2
, katalizator
NaBH
3
CN
NH-R
2
o
amina
NH
2
NR
2
1
o
amina
3
o
amina
Diazowanie amin aromatycznych
NH
2
HONO
N
2
+
Cl
-
N
2
+
Cl
-
+
+
2H
2
O
N O
O
H
0 – 5
o
C
H
2
O
HCl,
0 – 5
o
C
H
2
O
HCl,
NaNO
2
+ HCl
N O
O
H
:
:
:
:
:
N O
O
H
:
:
:
:
:
+
H
+
N O
O
H
H
:
:
:
N O
O
H
H
:
:
:
N O
:
:
:
+
N O
:
:
:
+
N O:
:
:
+
N O:
:
:
+
NH
2
Ar
:
+
N
N
Ar
N O
N
Ar
H
H
+
:
:
:
N O
N
Ar
H
H
+
:
:
:
N O
N
Ar
H
:
:
:
:
N O
N
Ar
H
:
:
:
:
N OH
N
Ar
H
:
:
:
+
N OH
N
Ar
H
:
:
:
+
+ H
+
+ H
+
:
Jon arylodiazoniowy
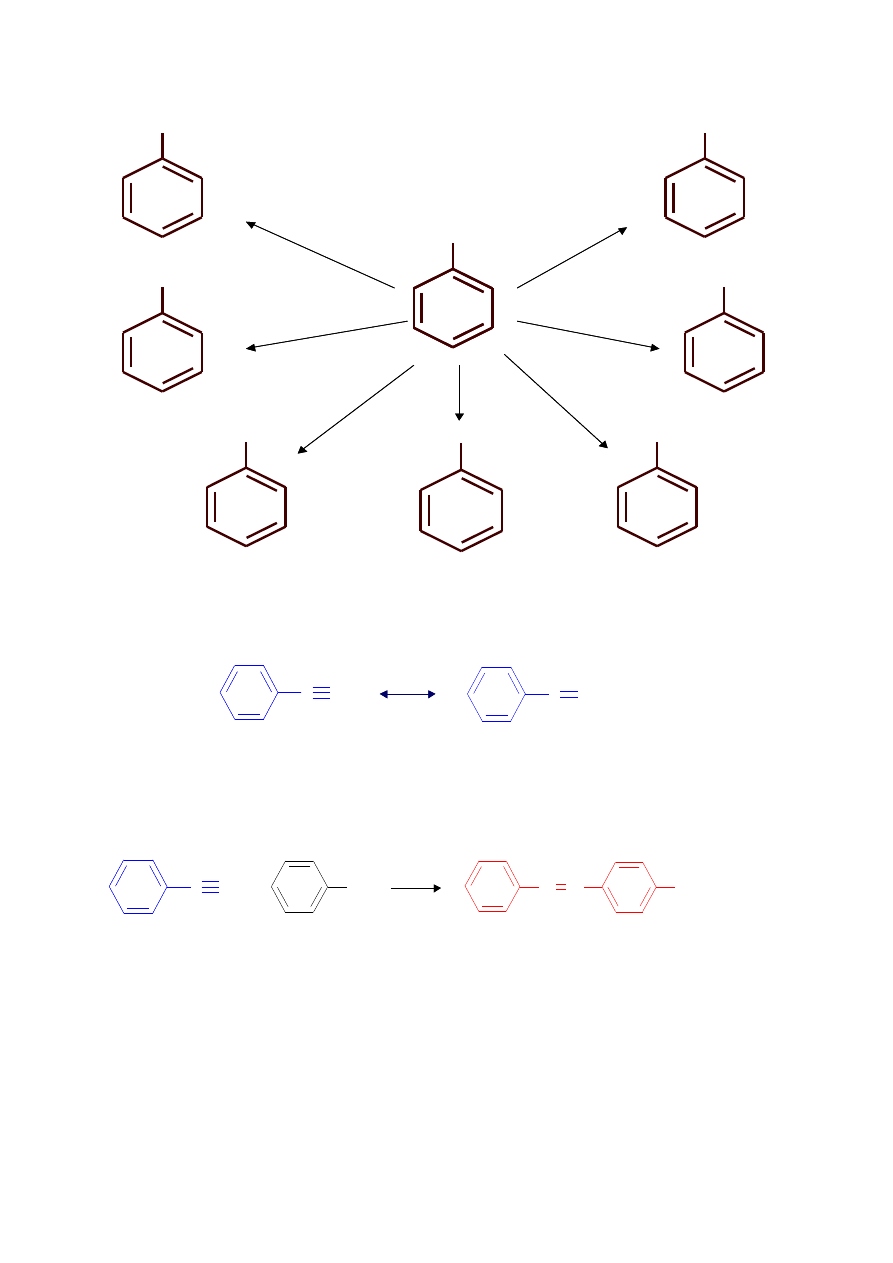
F
Cl
Br
I
H
OH
CN
H
3
PO
2
H
3
PO
2
H
2
O, H
+
H
2
O, H
+
HBF
4
HBF
4
KCN
Cu
2
(CN)
2
KCN
Cu
2
(CN)
2
HBr
Cu
2
Br
2
HBr
Cu
2
Br
2
KI
KI
HCl
Cu
2
Cl
2
HCl
Cu
2
Cl
2
N
2
+
N
2
+
N
N
:
:
N
N
:
+
+
N
N
:
:
N
N
:
+
N
N
:
+
+
N
N
:
+
OH
+
OH
N
N
OH
-
p-hydroksyazobenzen
N
N
:
+
N
N
:
+
OH
+
OH
N
N
OH
-
p-hydroksyazobenzen
Wyszukiwarka
Podobne podstrony:
Aminy analityka
wyk12 aminy
aminy 4
1 Aminy kompendium
aminy amidy izoptyczna, Chemia, Liceum, klasa II
otrzym 2 aminy w 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
aminy otrzymywanie, podstawy chemii organicznej
aminy amidy
Aminy i aminokwasy, chemia, GIMNAZJUM
aminy sprawo
BT aminy
Termin witamina pochodzi od słowa kluczowe i aminy
AMINY KATECHOLOWE, II rok, II rok CM UMK, Fizjologia, Fizjologia
aminy wlasciwosci, biologia, chemia organiczna
otrzym aminy w 2
Biologia-ściągi, aminy, Aminy
chemia, DIAZOWANIE, DIAZOWANIE- reakcja zachodząca pomiędzy kw azotawym HNO2, a solą pierwszorzędowe
Aminokwasy Aminy Kwasy nukelinowe Białka
więcej podobnych podstron