
Kontrola środowiska
wewnętrznego
Bogumiła Kurjanowicz

Układ wydzielania
wewnętrznego
• Ważny system regulacyjny organizmu
• Odgrywa istotną rolę w dostosowaniu
organizmu do wpływów czynników
zewnętrznych, warunkuje utrzymanie
homeostazy, różnicowanie i wzrost
komórek. Wywiera wpływ na syntezę i
wydzielanie innych hormonów oraz
feromonów, wydzielanie enzymów, kwasu
solnego i żółci w przewodzie pokarmowym,
syntezę i wydzielanie mleka. Wpływa na
procesy metaboliczne w komórkach,
kontroluje procesy reprodukcji oraz
równowagę jonową organizmu.

Hormon
substancja chemiczna wytwarzana i
wydzielana przez wyspecjalizowane
komórki i gruczoły, wywierająca wpływ
na komórki docelowe posiadające
receptory swoiste dla danego
hormonu. Hormony są chemicznymi
przekaźnikami w ustroju.

Hormony mogą działać na:
• komórki, przez które zostały
wydzielone-działanie autokrynne,
• sąsiednie komórki-działanie
parakrynne,
• komórki odległe; hormony
przenoszone są przez układ
krwionośny-działanie endokrynne.

Rodzaje hormonów:
Pod względem budowy chemicznej
hormony dzieli się na trzy grupy:
• I. Pochodne aminokwasu tyrozyny
• II. Pochodne cholesterolu (hormony
steroidowe)
• III. Hormony peptydowe i białkowe

Biosynteza i
wydzielanie hormonów

Hormony- pochodne
tyrozyny
Syntetyzowane i magazynowane w
tkance chromochłonnej (aminy
katecholowe) oraz w gruczole
tarczowym (tyroksyna i
trijodotyronina).

Hormony steroidowe
Prekursorem tej grupy hormonów jest
cholesterol. Przenoszony do
mitochondriów ulega przemianie do
pregnenolonu. Następne etapy
syntezy zachodzą w gładkiej siateczce
śródplazmatycznej. Hormony
steroidowe nie są gromadzone w
komórkach, lecz produkowane i
wydzielane w miarę potrzeby.

Hormony peptydowe i
białkowe
Synteza hormonów peptydowych i białkowych
rozpoczyna się od transkrypcji genu. Następnym
etapem jest translacja informacyjnego RNA
(mRNA). Translacja odbywa się w szorstkiej
siateczce śródplazmatycznej. Z siateczki
śródplazmatycznej hormon przenoszony jest do
aparatu Golgiego, gdzie może nastąpić dalsza
jego modyfikacja, np. przez przyłączenie
węglowodanów. Hormony tej grupy są
magazynowane w pęcherzykach lub
ziarnistościach sekrecyjnych.

Transport hormonów we
krwi
Hormony krążą we krwi w postaci wolnej oraz
związane z białkami osocza. Efekty biologiczne
wywierają jedynie hormony w stanie wolnym.
Większość hormonów peptydowych i
białkowych krąży w postaci wolnej, a jedynie
niewielka ich część związana jest z białkami
osocza. Odwrotna sytuacja ma miejsce w
przypadku hormonów steroidowych i hormonów
tarczycy. Hormony te przenoszone są w postaci
związanej z białkami transportującymi o
wysokiej swoistości, a jedynie niewielki ich
odsetek krąży w stanie wolnym.

Mechanizmy regulacji
wydzielania hormonów
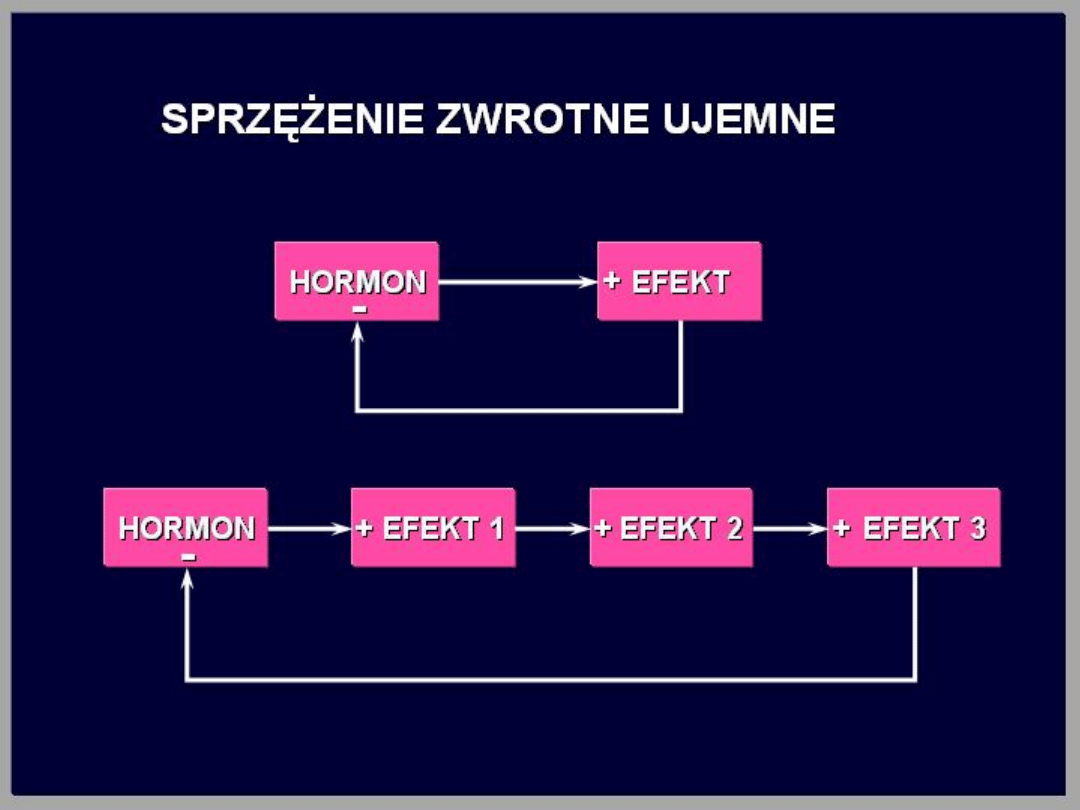
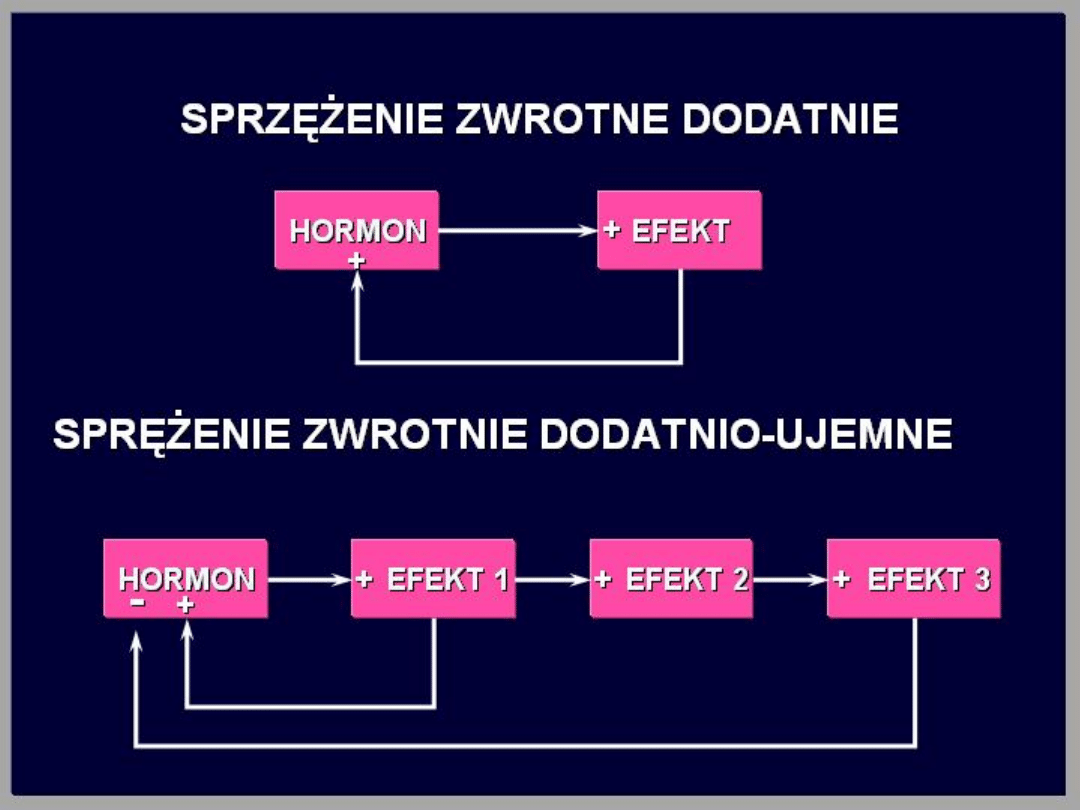
sprzężenie zwrotne: Wydzielany hormon działa na
komórkę docelową powodując wzrost wydzielania
substancji (zwykle innego hormonu). Substancja ta
działa zwrotnie, najczęściej hamująco, na gruczoł,
którego wydzielina stymulowała jej sekrecję. Jest to
ujemne sprzężenie zwrotne.
Znacznie rzadziej obserwuje się zjawisko
dodatniego sprzężenia zwrotnego. Wzrost
wydzielania hormonu powoduje w komórce docelowej
zwiększone wydzielanie substancji, która nie hamuje,
lecz powoduje dalszą stymulację wydzielania tego
hormonu

Rytmy wydzielania
hormonów
Większość hormonów nie jest wydzielana w sposób ciągły.
Wiele z nich, np. hormony podwzgórza, przysadki,
insulina wydzielane są w sposób pulsacyjny. Co pewien
czas, różny dla poszczególnych hormonów, następuje
wzrost wydzielania. Zmiana częstotliwości i amplitudy
pulsów wpływa na efekty działania hormonów.
Wydzielanie wielu hormonów podlega rytmom
okołodobowym. Rytmy dłuższe nazywane są
infradobowymi (np. 28-dniowy cykl wydzielania
hormonów płciowych u kobiet). Wydzielanie hormonów
zmienia się także zależnie od wieku. Dotyczy to np.
hormonu wzrostu, czy też hormonów wydzielanych przez
gonady.

Mechanizmy działania
hormonów
Efekt działania hormonu zapoczątkowuje
połączenie ze swoistym receptorem w
komórce efektorowej. Hormony lipofilne, do
których należą steroidy i hormony tarczycy
łatwo przenikają przez lipidowe błony
komórkowe i łączą się z receptorami
wewnątrzkomórkowymi. Regulują one
ekspresję specyficznych genów w jądrze
komórki docelowej, nasilają lub hamują
transkrypcję DNA i w ten sposób wpływają na
syntezę mRNA, a w następstwie białka.
Hormony peptydowe i białkowe oraz
katecholaminy są hormonami hydrofilnymi i
nie mogą przejść przez barierę lipidową błony
komórkowej. Działają więc poprzez swoiste
receptory znajdujące się w tej błonie.


Receptory błonowe
Wyróżnia się dwie grupy receptorów błonowych:
Receptory związane z białkiem G i receptory
związane z pojedynczą domeną przezbłonową. Do
receptorów związanych z białkiem G należą:
receptory tyreoliberyny (TRH), gonadoliberyny
(GnRH), tyreotropiny (TSH), hormonu
luteinizującego (LH), hormonu stymulującego
pęcherzyki (FSH), ludzkiej gonadotropiny
kosmówkowej (HCG), adrenokortykotropiny
(ACTH), parathormonu (PTH), glukagonu oraz
receptory α - i β-adrenergiczne.

Receptory błonowe
Do grupy receptorów związanych z
pojedynczą domeną przezbłonową należą:
receptory naskórkowego czynnika wzrostu
(EGF), insuliny, insulinopodobnego czynnika
wzrostu I i II (IGF-I i IGF-II), hormonu wzrostu
(GH), prolaktyny (PRL), cytokin. Związanie
hormonu z receptorem powoduje aktywację
lub rzadziej hamowanie jednostek
katalitycznych w błonie komórkowej. Białka
G są to białka błonowe

Większość hormonów produkowana jest przez
gruczoły wydzielania wewnętrznego:
• przysadka mózgowa,
• tarczyca,
• przytarczyce,
• nadnercza,
• wyspy Langerhansa w trzustce
• gonady.
Czynność hormonalną wykazują też inne
tkanki:
• podwzgórze,
• komórki wewnątrzwydzielnicze przewodu
pokarmowego,
• nerka,
• tkanka tłuszczowa,
• skóra.

Podwzgórze
Jest częścią ośrodkowego układu nerwowego,
połączoną włóknami nerwowymi z wszystkimi
regionami mózgu. Stanowi centrum,
przetwarzające docierające do mózgu bodźce
ze środowiska zewnętrznego i wewnętrznego
ustroju na bodźce hormonalne. W podwzgórzu
wydzielane są dwie grupy neurohormonów.
Pierwsza z nich wydzielana jest przez neurony
wyniosłości pośrodkowej. Neurohormony tej
grypy wydzielane są do krążenia wrotnego
przysadki i tą drogą docierają do przedniego
płata przysadki mózgowej. Regulują one
czynność hormonalną przedniego płata
przysadki mózgowej.

Są to następujące hormony:
• hormon uwalniający tyreotropinę (TRH)
• hormon uwalniający gonadotropiny
(GnRH)
• hormon uwalniający hormon wzrostu
(GHRH)
• hormon hamujący uwalnianie hormonu
wzrostu (somatostatyna) (SRIH)
• hormon uwalniający kortykotropinę
(CRH)
• czynnik hamujący uwalnianie
prolaktyny (dopomina) (PIF)

Do drugiej grupy należą dwa hormony:
• wazopresyna
• oksytocyna.
Hormony te są syntetyzowane w
neuronach jąder nadwzrokowych i
przykomorowych, i transportowane
przez aksony tych neuronów do
tylnego płata przysadki mózgowej.

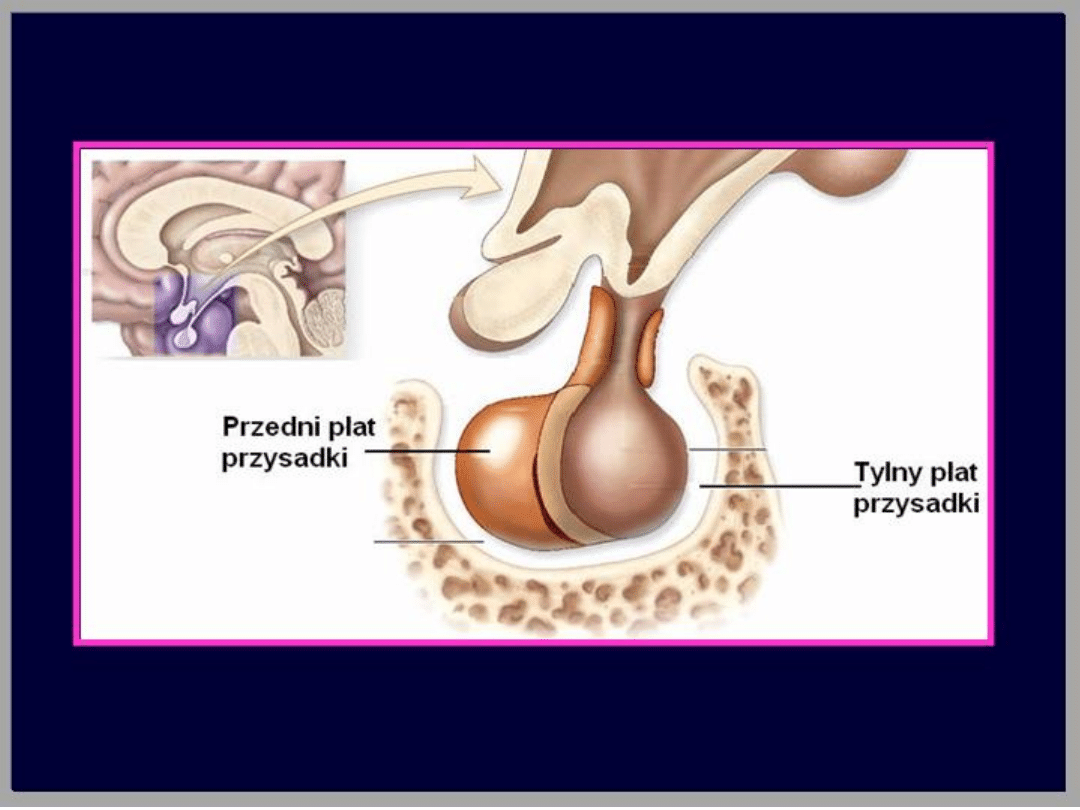
Przysadka mózgowa
Jest małym gruczołem o wadze około 0,5 g.
Położona jest w tzw. siodle tureckim-wgłębieniu
kości klinowej. Przysadkę mózgową łączy z
podwzgórzem szypuła. Przechodzą przez nią
wypustki komórek nerwowych oraz naczynia
krążenia wrotnego przysadki. Przysadka mózgowa
zbudowana jest z płata przedniego, płata tylnego
i części pośredniej. Płat przedni zbudowany jest z
komórek wydzielniczych i stanowi ⅔ całego
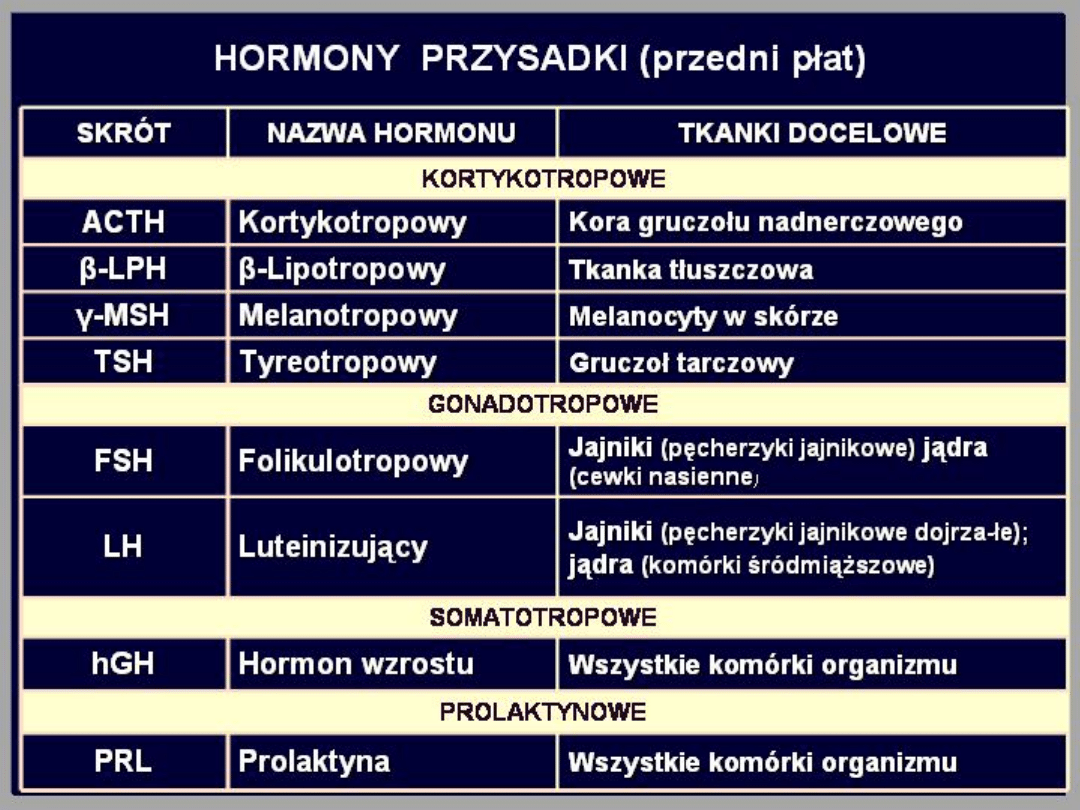
gruczołu. Komórki wydzielnicze przedniego płata
przysadki mózgowej wytwarzają 6 hormonów, a
mianowicie: hormon wzrostu (GH), prolaktynę
(PRL), adrenokortykotropinę (ACTH), hormon
tyreotropowy (TSH), hormon folikulotropowy (FSH)
i hormon luteinizujący (LH).

Hormony przysadkowe
Cztery z nich są hormonami tropowymi
(ACTH, TSH, LH, FSH), które
stymulują odpowiednio: nadnercza,
tarczycę i gonady.
Hormon wzrostu i prolaktyna nie mają
swoich gruczołów docelowych i
działają na różne komórki w
organizmie

Wydzielanie ACTH, TSH, FSH i LH regulowane
jest przez neurohormony podwzgórza oraz
przez hormony wydzielane przez docelowe
gruczoły obwodowe. Natomiast
wydzielanie hormonu wzrostu i prolaktyny
kontrolowane jest przez hormony
podwzgórza: hormon uwalniający hormon
wzrostu (GHRH), somatostatynę (SRIH) i
czynnik hamujący uwalnianie prolaktyny
(dopomina, PIF).
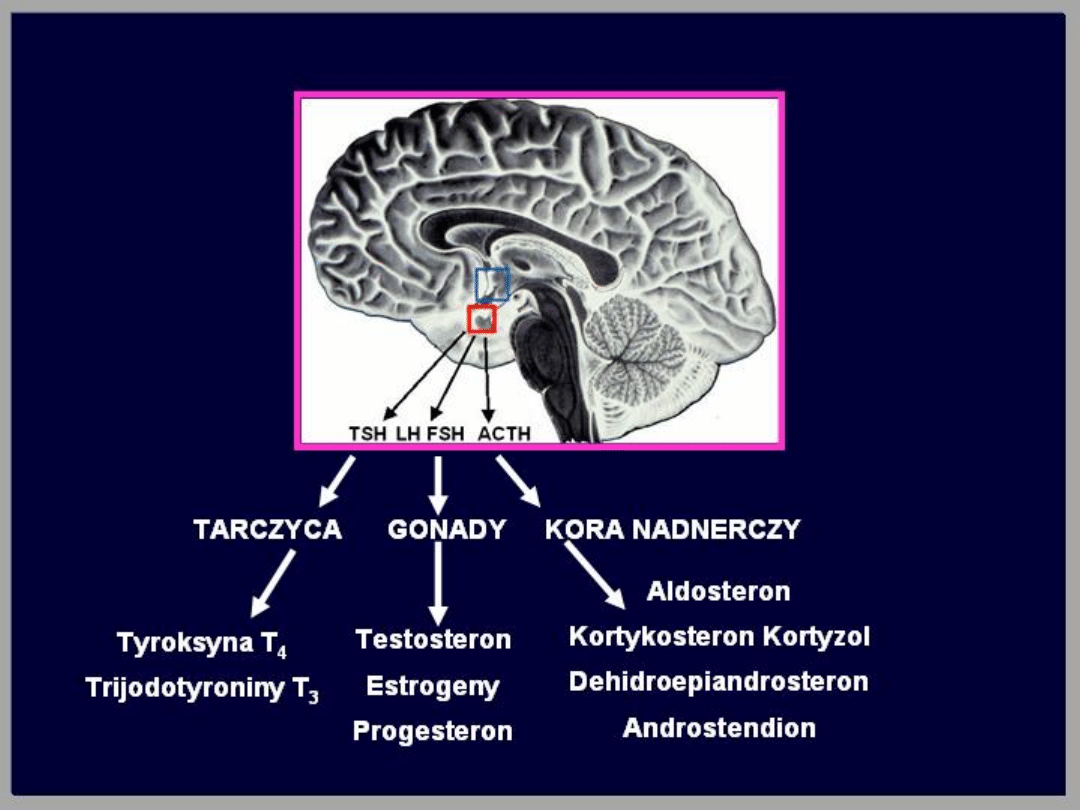

W płacie tylnym znajdują się zakończenia
aksonów neuronów jąder nadwzrokowego i
przykomorowego podwzgórza. Magazynują
one i wydzielają dwa hormony:
wazopresynę (hormon antydiuretyczny,
ADH) i oksytocynę. W części pośredniej
przysadki u zwierząt syntetyzowane są
hormony melanotropowe (MSH). U ludzi ta
część jest szczątkowa i
najprawdopodobniej nie pełni funkcji
wydzielniczej.

Adrenokortykotropina
(ACTH)
Gruczołem docelowym tego hormonu tropowego
jest kora nadnerczy. ACTH łączy się z receptorem
błonowym komórek kory nadnerczy i stymuluje
syntezę i wydzielanie steroidów, a zwłaszcza
glikokortykosteroidów i androgenów. ACTH
odgrywa niewielką rolę w regulacji wydzielania
mineralokortykosteroidów. ACTH jest wydzielane
w rytmie okołodobowym: najwyższe stężenie we
krwi występuje we wczesnych godzinach rannych,
najniższe około północy.

Adrenokortykotropina
(ACTH)
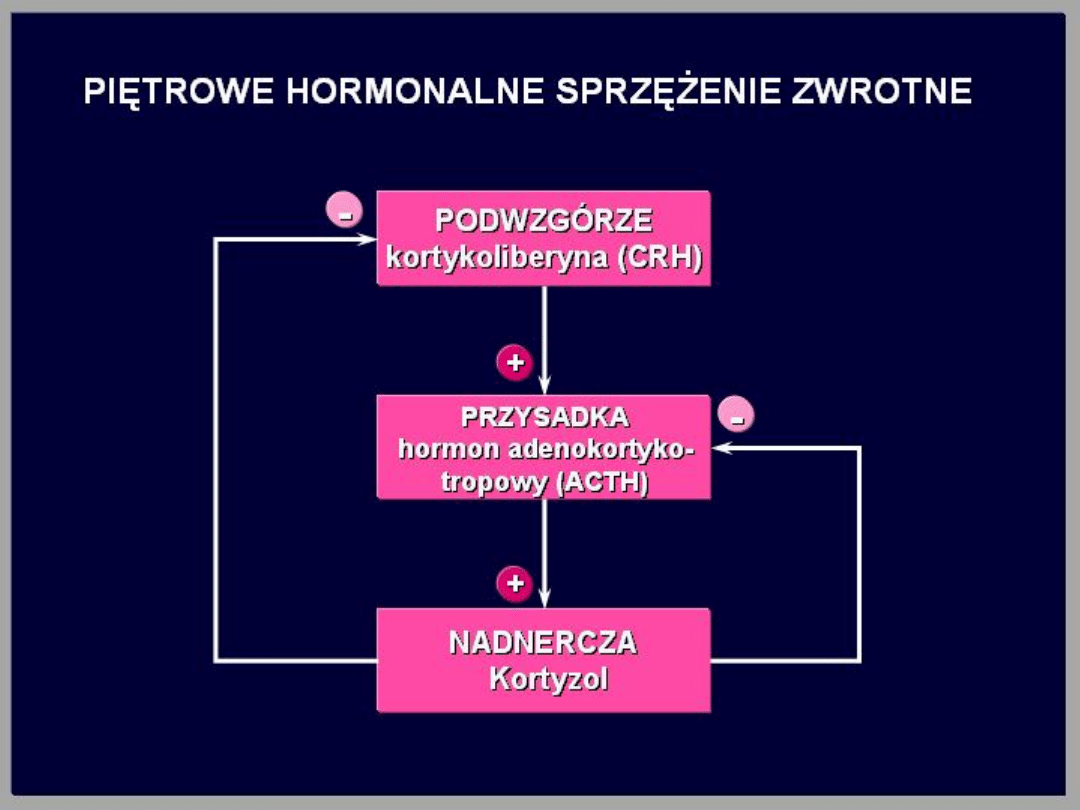
Wydzielanie ACTH jest stymulowane
przez czynniki stresowe (np.
hipoglikemia, ból, strach, gorączka,
uraz). Czynniki te powodują
zwiększenie wydzielania CRH przez
podwzgórze. Zwiększone stężenie
glikokortykosteroidów we krwi
hamuje wydzielanie CRH w
podwzgórzu i ACTH w przysadce
mózgowej

Nadmierne wydzielanie ACTH obserwuje się w
przypadku czynnych gruczolaków przysadki
oraz przez tkankę gruczołową ektopową
(znajdującą się poza korą nadnerczy).
Prowadzi ono do przerostu kory nadnerczy i
nadmiernej produkcji hormonów przez ten
gruczoł wywołując zespół hiperkortyzolemii.
Niedobór ACTH, który może być
następstwem uszkodzenia podwzgórza lub
przysadki mózgowej, prowadzi do wtórnej
niewydolności nadnerczy. Zarówno nadmiar,
jak i niedobór ACTH są stanami poważnie
zaburzającymi funkcjonowanie organizmu i
zagrażającymi życiu.

Tyreotropina (TSH)
Jest głównym regulatorem funkcji tarczycy.
Wydzielanie TSH regulowane jest przez
TRH, a także przez stężenie hormonów
tarczycy we krwi. Również somatostatyna
hamuje wydzielanie TSH. Wysokie stężenie
TSH we krwi stwierdza się najczęściej w
sytuacji niedoboru hormonów tarczycy,
obniżone zaś w przypadkach nadmiernej
produkcji hormonów przez tarczycę.
Wynika to z ujemnego sprzężenia
zwrotnego między przysadką a tarczycą

Gonadotropiny (hormon
folikulotropowy-FSH i
hormon luteinizujący-LH)
FSH u kobiet pobudza dojrzewanie pęcherzyków Graafa w jajniku i
wzmaga wydzielanie przez nie estradiolu. U mężczyzn FSH
stymuluje spermatogenezę i wytwarzanie globuliny wiążącej
hormony płciowe w jądrze. Hormon luteinizujący u kobiet
pobudza w jajniku syntezę progesteronu w pęcherzyku Graafa i
podtrzymuje funkcję wydzielniczą ciałka żółtego. U mężczyzn
stymuluje syntezę i wydzielanie testosteronu przez komórki
śródmiąższowe Leydiga w jądrze. Wydzielanie gonadotropin
stymulowane jest przez GnRH. Podwyższone stężenie estradiolu
we krwi hamuje wydzielanie LH u kobiet, zaś podwyższone
stężenie testosteronu hamuje wydzielanie LH u mężczyzn.

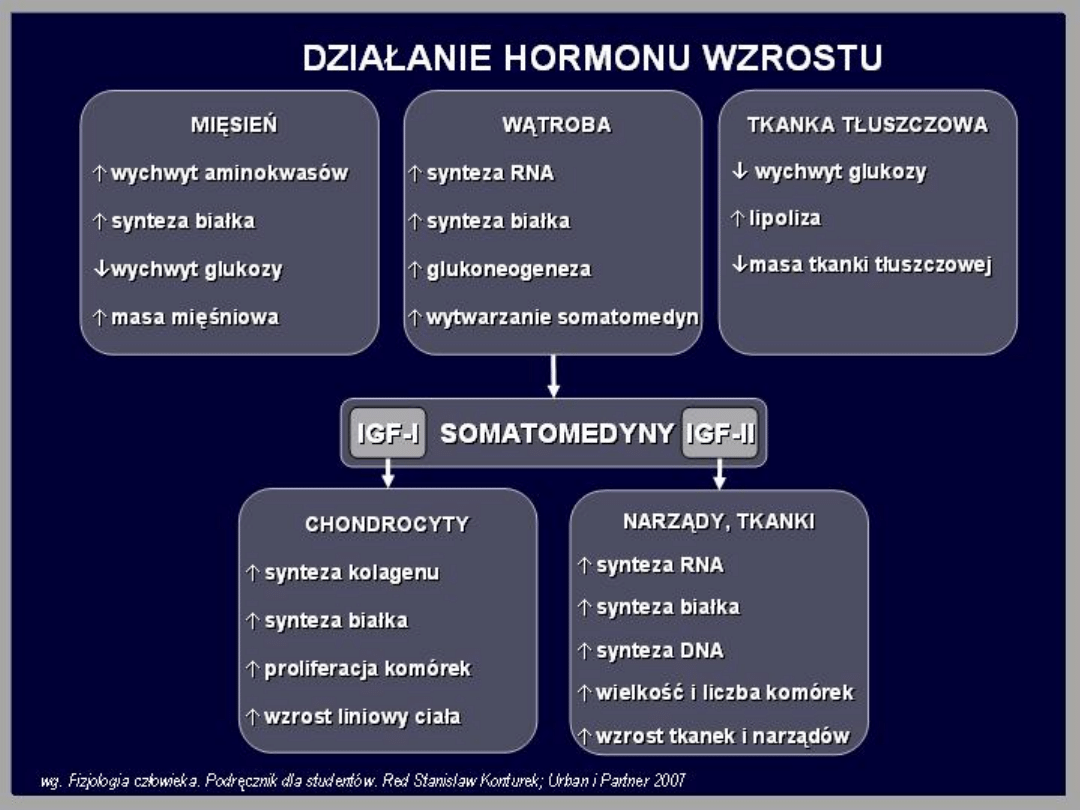
Hormon wzrostu (GH)
Hormon wzrostu jest białkiem zbudowanym ze 191 aminokwasów.
Hormon wzrostu wywiera na tkanki wpływ bezpośredni i
pośredni. Wpływ pośredni zachodzi przez stymulację
wytwarzania insulinopodobnych czynników wzrostu IGF-I i IGF-II.
Rola IGF-II jest jeszcze mało znana. Bezpośredni wpływ hormonu
wzrostu obejmuje tkankę tłuszczową, w której zwiększa lipolizę,
mięśnie szkieletowe, w których hamuje dokomórkowy transport
glukozy oraz wątrobę, w której nasila wytwarzanie glukozy.
Bezpośrednie wpływy hormonu wzrostu antagonizują działanie
insuliny i dlatego określa się je mianem przeciwinsulinowych.
IGF-I zwiększa transport aminokwasów do komórek i syntezę
białka. Czynnik ten, w organizmach rosnących, zwiększa wzrost
chrząstek nasadowych, co prowadzi do wzrostu szkieletu.
Powoduje także zwiększenie masy mięśni i trzewi.


Regulacja wydzielania
hormonu wzrostu
Wydzielanie hormonu wzrostu stymulowane jest przez GHRH
(somatoliberynę), a hamowane przez somatostatynę. Wydzielanie
hormonu wzrostu regulowane jest też przez układ sprzężenia
zwrotnego: hormon wzrostu – IGF-I. Hormon wzrostu zwiększa
wytwarzanie IGF-I. Z kolei IGF-I hamuje wydzielanie hormonu
wzrostu na dwóch drogach, a mianowicie przez działanie
bezpośrednie na przysadkę oraz przez zwiększenie wytwarzania
somatostatyny w podwzgórzu. Wydzielanie hormonu wzrostu
hamowane jest też przez zwiększone stężenie glukozy, wolnych
kwasów tłuszczowych oraz kortyzolu we krwi. Z kolei zwiększenie
wydzielania hormonu wzrostu powodują czynniki stresowe (strach,
wysiłek fizyczny, zimno), wzrost stężenia argininy i spadek stężenia
glukozy we krwi oraz sen. Wydzielanie hormonu wzrostu zmienia się
w różnych fazach życia. Najwyższe wartości występują w okresie
dojrzewania. U osób dorosłych obserwuje się stopniowy spadek
wydzielania tego hormonu. Hormon wzrostu wydzielany jest
pulsacyjnie.

Nadmierne wydzielanie hormonu wzrostu
obserwuje się w przebiegu gruczolaków
przysadki. U dzieci i młodzieży prowadzi to
do nadmiernego wzrostu (gigantyzmu). U
osób dorosłych rozwija się natomiast
zespół chorobowy zwany akromegalią.
Choroba ta charakteryzuje się
powiększaniem dystalnych części ciała
(dłonie, stopy, twarz) oraz narządów
miąższowych.

Niedobór hormonu wzrostu u dzieci jest
przyczyną niskiego wzrostu-karłowatości
przysadkowej. U osób dorosłych niedobór
hormonu wzrostu jest najczęściej
następstwem operacji, radioterapii lub
urazu okolicy przysadki mózgowej.
Klinicznie objawia się zmniejszeniem masy
mięśni, zwiększeniem ilości tkanki
tłuszczowej trzewnej, zmniejszeniem
gęstości kości, zaburzeniami gospodarki
węglowodanowej i lipidowej.

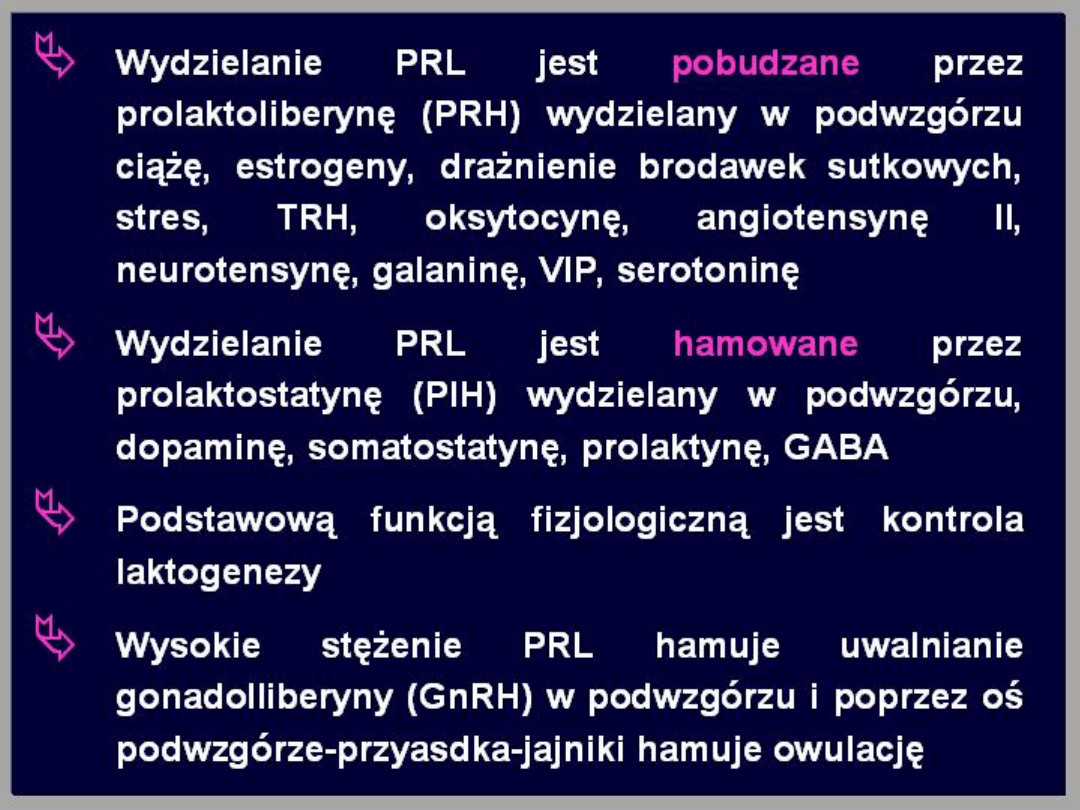
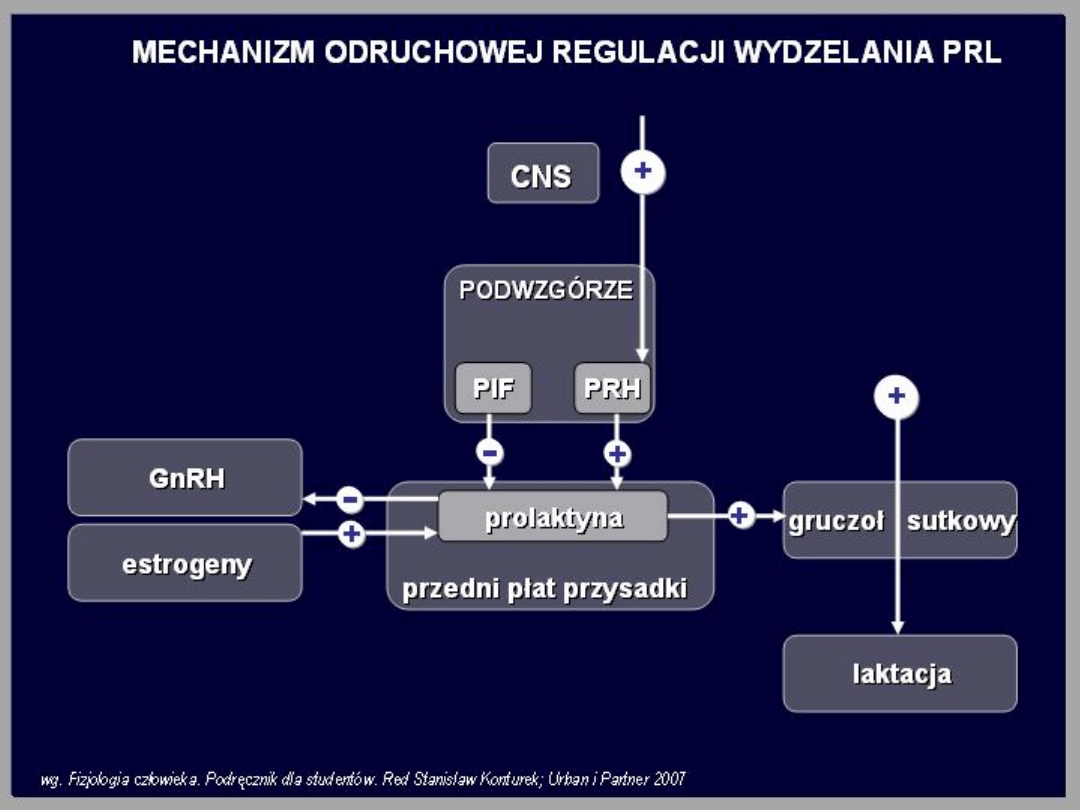
Prolaktyna (PRL)
Jest ona białkiem złożonym ze 199
aminokwasów, o budowie podobnej do
hormonu wzrostu. Występuje u obu płci. U
mężczyzn jej rola nie została poznana. U
kobiet główną rolą tego hormonu jest
stymulowanie tworzenia mleka w okresie
poporodowym. Prolaktyna bierze również
udział w rozwoju gruczołów piersiowych w
okresie dojrzewania.

Regulacja wydzielania
prolaktyny
Stężenie prolaktyny we krwi wzrasta w czasie
ciąży nawet 10-krotnie. W okresie
poporodowym stężenie tego hormonu jest
podwyższone w przypadku karmienia piersią.
Wydzielanie prolaktyny zwiększają również
czynniki stresowe oraz środki
farmakologiczne hamujące syntezę dopaminy
(dopamina jest silnym inhibitorem
wydzielania prolaktyny).
Nadmierne wydzielanie prolaktyny, np. w
przebiegu gruczolaka przysadki, powoduje
mlekotok, utratę libido, zaburzenia czynności
gonad, a nawet utratę funkcji rozrodczych

Nerwowa część przysadki
mózgowej
W tylnym płacie przysadki mózgowej
znajdują się zakończenia włókien
nerwowych wychodzących z jąder
nadwzrokowych i przykomorowych
podwzgórza. Magazynują one w
postaci pęcherzyków
neurosekrecyjnych dwa neurohormony:
oksytocynę i wazopresynę. Hormony te
przenikają do przylegających naczyń
włosowatych

Oksytocyna
Jest ona peptydem zbudowanym z 9
aminokwasów. Oksytocyna pobudza do
skurczu mięsień gładki macicy podczas
porodu. Spadek stężenia progesteronu i
podwyższenie stężenia estrogenów we krwi
zwiększają wrażliwość mięśnia macicy na
działanie oksytocyny. Hormon ten pobudza do
skurczu, w czasie ssania, komórki znajdujące
się wokół przewodów pęcherzykowych w
gruczołach piersiowych. Skurcz tych komórek
powoduje wypływanie mleka.


Regulacja wydzielania
Stężenie oksytocyny wzrasta w ostatniej fazie
porodu w czasie przesuwania się w dół płodu
i rozszerzania kanału rodnego. Obserwuje się
tu zjawisko dodatniego sprzężenia
zwrotnego: rozszerzenie kanału rodnego
zwiększa wydzielanie oksytocyny, oksytocyna
zaś nasila skurcze mięśnia macicy, co
przyczynia się do rozszerzenia kanału
rodnego. Bodźcem do wydzielania
oksytocyny jest też ssanie brodawki
sutkowej, a nawet głos czy też widok dziecka.

Wazopresyna (hormon
antydiuretyczny - ADH)
Jest ona peptydem złożonym z 9 aminokwasów, o
budowie zbliżonej do budowy oksytocyny. Główną
funkcją tego hormonu jest regulacja wydalania
wody. Działa on w nerkach na kanaliki zbiorcze.
Otwiera w nich tzw. kanały wodne, co prowadzi
do zwiększenia wchłaniania wody z płynu
kanalikowego. Na tej drodze wzrost stężenia
wazopresyny powoduje zatrzymanie wody w
ustroju. Wazopresyna działa również jako czynnik
kurczący naczynia krwionośne. Wydzielanie ADH
wzrasta w następstwie obniżenia objętości krwi
(np. w czasie krwotoku).



Gruczoł tarczowy
Tarczyca jest dwupłatowym gruczołem o
wadze 10-20 g. Położony jest poniżej
krtani, na przedniej powierzchni
tchawicy. Gruczoł ten jest bardzo
obficie unaczyniony. Jednostką
funkcjonalną gruczołu jest pęcherzyk
tarczycy. Pęcherzyk zbudowany jest z
komórek nabłonkowych. Pęcherzyki
otoczone są błoną podstawną,
oplecione są przez naczynia
włosowate

Głównymi hormonami wydzielanymi przez
tarczycę są tyroksyna (T4) i w mniejszych
ilościach trijodotyronina (T3). Obydwa te
hormony są jodowanymi pochodnymi
aminokwasu tyrozyny. Do syntezy hormonów
tarczycy niezbędny jest jod. Jod wchłaniany jest
w postaci jodku. Tarczyca wychwytuje około 120
mikrogramów jodu na dobę. Komórki tarczycy
transportują jodek czynnie z krwi krążącej do
koloidu wbrew gradientowi stężeń i gradientowi
elektrycznemu. Następnie jodek jest utleniany
przy udziale enzymu peroksydazy i przyłączany
do cząsteczek tyrozyny związanych z
tyreoglobuliną. Powstaje monojodotyrozyna,
następnie dijodotyrozyna. Dwie cząsteczki
dijodotyrozyny ulegają kondensacji tworząc
tyroksynę (T4). Natomiast T3 powstaje w wyniku
kondensacji monojodotyrozyny i dijodotyrozyny

W tarczycy zgromadzony jest zwykle zapas
T4 i T3 związanych z tyreoglobuliną.
Zabezpiecza on prawidłowe stężenia
hormonów we krwi przez co najmniej 2
miesiące. Hormony tarczycy przenoszone
są we krwi w postaci związanej z białkami.
Tylko niewielki odsetek T4 i T3 krąży w
postaci wolnej. W krążeniu znajduje się
również tzw. odwrotna T3 (rT3). Jest ona
nieaktywna biologicznie.

Działanie hormonów
tarczycy
Hormony tarczycy wchodzą do wnętrza
komórki i łączą się z receptorem w
jądrze. T3 ma znacznie większe
powinowactwo do receptorów niż T4.
Efekty działania hormonów tarczycy
uwidaczniają się po pewnym czasie od
podania tych hormonów. Jest to tzw.
okres działania utajonego. Okres ten
jest dłuższy w przypadku T4 (1-2 dni)
niż w przypadku T3 (kilka godzin)

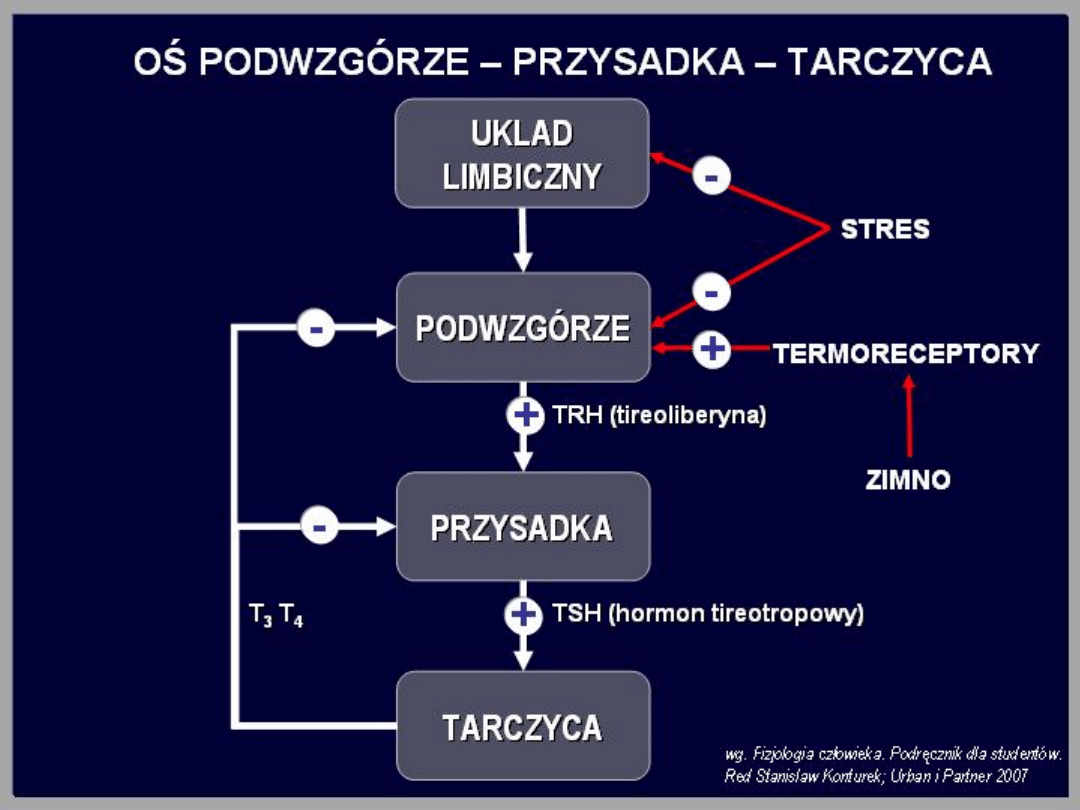
Regulacja wydzielania
hormonów tarczycy
Wszystkie etapy syntezy hormonów tarczycy
regulowane są przez tyreotropinę (TSH)
wydzielaną przez przysadkę mózgową.
Wydzielanie TSH jest z kolei stymulowane przez
tyreoliberynę (TRH) wydzielaną przez
podwzgórze. Wzrost stężenia T4 iT3 we krwi
powoduje obniżenie wydzielania TSH
(sprzężenie zwrotne ujemne). Zjawisko to
wykorzystywane jest w diagnostyce chorób
tarczycy.

W regulacji syntezy hormonów tarczycy
odgrywa też rolę ilość jodu dostarczana z
pokarmem. Ilość jodu wbudowywanego do
tyreoglobuliny jest proporcjonalna do
stężenia jodków we krwi. Niedobór jodu w
pożywieniu (poniżej 50 mikrogramów/dobę)
powoduje zmniejszone wiązanie tego
pierwiastka przez tyreoglobulinę, powstaje
więcej MIT niż DTT. W rezultacie zmniejsza
się synteza hormonów tarczycy. Zmienia się
też proporcja T4 do T3 na korzyść T3.

Obniżenie stężenia hormonów tarczycy we krwi
powoduje zwiększanie wydzielania TSH przez
przysadkę mózgową. TSH aktywuje
mechanizmy transportu jodu do komórek
tarczycy. Jednocześnie powoduje
powiększenie się gruczołu. Powiększoną
tarczycę nazywamy wolem. Duże dawki jodu
powodują hamowanie syntezy i uwalnianie
hormonów tarczycy. Zjawisko to nosi nazwę
efektu Wolffa-Chaikoffa. Może ono trwać kilka
dni, po czym funkcja tarczycy wraca do
normy.

Niedobór hormonów tarczycy prowadzi do
zwolnienia podstawowej przemiany
materii. Obserwuje się przyrost masy ciała,
wypadanie włosów, ochrypły głos, suchą
skórę. Stałymi objawami są senność i
uczucie zimna. Towarzyszy temu osłabienie
mięśni, zwolnienie czynności serca,
zmniejszenie objętości wyrzutowej serca.
Nadmiar hormonów tarczycy powoduje
chudnięcie, wzmożoną potliwość,
nerwowość, przyspieszenie czynności
serca, zaburzenie rytmu serca, osłabienie
siły mięśni.



Hormonalna regulacja
metabolizmu wapnia
W organizmie człowieka znajduje się około 1100 g Ca, z
czego 99% znajduje się w układzie kostnym.
Prawidłowe stężenie Ca w osoczu wynosi 2,2 – 2,6
mmol/l. Wapń krąży w postaci związanej z
albuminami (44%), z cytrynianem (9%) oraz jako
wapń zjonizowany ( < 50%). Wapń jest drugim
przekaźnikiem informacji w komórce, bierze udział w
procesie krzepnięcia, w aktywacji skurczu mięśni,
czynności nerwów i czynności wewnątrzwydzielniczej.
Obniżenie stężenia wapnia w osoczu może być
przyczyną wystąpienia zespołu klinicznego zwanego
tężyczką. Objawia się ona nadmierną pobudliwością
nerwów i skurczami mięśni szkieletowych. Znaczne
podwyższenie stężenia wapnia w osoczu może
powodować śpiączkę hiperkalcemiczną.

W przeciętnej diecie człowiek spożywa około 1 g Ca
dziennie (około 25 mmol). Z tego do krwi wchłania
się około 10-15 mmol. Równocześnie do światła jelita
przedostaje się z płynu międzykomórkowego około 7-
10 mmol Ca. Z kałem wydalane jest więc w ciągu
doby około 22 mmol Ca. Nerki filtrują około 250
mmol Ca na dobę, z czego około 245 mmol ulega
resorpcji zwrotnej w kanalikach nerkowych. Z
moczem wydalane jest więc jedynie około 2,5 – 5,0
mmol Ca na dobę. 7,5 – 10 mmol Ca jest wymieniane
w ciągu doby pomiędzy tzw. niewymienialną pulą Ca
w kościach a osoczem.

Metabolizm fosforanów jest związany z
metabolizmem Ca. Nie podlega jednak
tak ścisłej regulacji.
Metabolizm Ca regulowany jest przez 3
hormony:
• parathormon,
• kalcytoninę,
• witaminę D3.

Parathormon (PTH)
PTH jest hormonem peptydowym, zbudowanym z 84
aminokwasów. Wydzielany jest przez 4 małe gruczoły
przytarczyczne leżące na tylnej powierzchni gruczołu
tarczowego. Cząsteczki PTH są magazynowane w
pęcherzykach sekrecyjnych i w miarę potrzeby wydzielane
do krwi. Głównym czynnikiem regulującym wydzielanie
PTH jest stężenie Ca zjonizowanego w osoczu. Spadek
stężenia Ca we krwi powoduje wzrost wydzielania PTH, zaś
podwyższone stężenie hamuje sekrecję tego hormonu.
PTH działa poprzez receptory błonowe. PTH zwiększa
stężenie Ca w osoczu na trzy sposoby:
• w kości wiąże się z osteoklastami i powoduje resorpcję Ca,
• w nerkach zwiększa wchłanianie zwrotne Ca,
• zwiększa też tworzenie aktywnej formy witaminy D3 i na
tej drodze zwiększa wchłanianie Ca w przewodzie
pokarmowym. PTH zwiększa wydalanie fosforanów z
moczem.

Kalcytonina
Wytwarzana jest przez komórki
okołopęcherzykowe C znajdujące się w tarczycy.
Jest peptydem składającym się z 32
aminokwasów. Głównym stymulatorem
wydzielania kalcytoniny jest wzrost stężenia
jonów Ca we krwi. Kalcytonina hamuje
uwalnianie Ca z kości, zwiększa też wydalanie
Ca z moczem. W następstwie, hormon ten
obniża stężenie Ca we krwi. Fizjologiczna rola
kalcytoniny polega na obniżaniu
podwyższonego stężenia Ca we krwi po
posiłkach. Ani całkowite usunięcie tarczycy, ani
obecność wysokich stężeń kalcytoniny, np. w
przypadku nowotworów zbudowanych z
komórek C tarczycy, nie powoduje istotnych
zmian stężenia Ca w surowicy

Witamina D3
Jest dostarczana z pokarmem, a także
syntetyzowana w skórze.
Dobowe zapotrzebowanie na witaminę D3
wynosi 100-400 jednostek. Duże dawki
witaminy D mogą spowodować
hiperkalcemię i prowadzić do zatrucia.
Objawami zatrucia witaminą D3 są
nudności, wymioty, odwodnienie.
Niedobór Ca prowadzi u organizmów
rosnących do rozwoju krzywicy.

Nadnercza
Są gruczołami położonymi nad górnymi
biegunami nerek. Nadnercze waży 4-6 g.
Gruczoły te zbudowane są z części korowej i
rdzenia. Kora nadnerczy zbudowana jest z 3
warstw, są to od zewnątrz:
• kłębkowata,
• pasmowata,
• siateczkowata.
Hormony kory nadnerczy należą do grupy
hormonów steroidowych, syntetyzowane są z
cholesterolu. Każda z warstw wydziela inną
grupę hormonów.
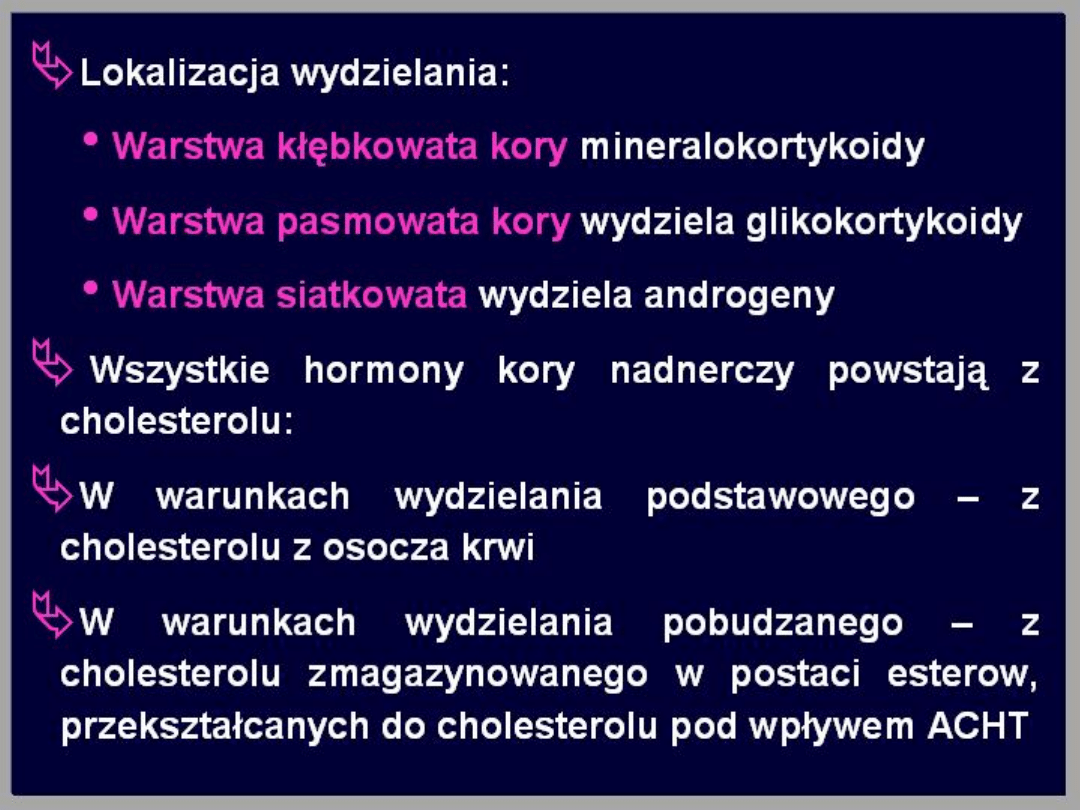

Warstwa kłębkowata
Wydziela mineralokortykosteroidy, z których
najaktywniejszym jest aldosteron. Aldosteron we
krwi znajduje się głównie w stanie wolnym
Głównym miejscem działania aldosteronu są
kanaliki dalsze i cewki zbiorcze nerek. Aldosteron
zwiększa tam reabsorpcję jonów sodu, a zwiększa
wydalanie jonów potasu i jonów wodorowych.
Zatrzymanie jonów sodu powoduje zwiększenie
objętości osocza. Zwiększa też wrażliwość
warstwy mięśniowej tętniczek na działanie
substancji zwężających naczynia. Oba te czynniki
prowadzą do wzrostu ciśnienia tętniczego

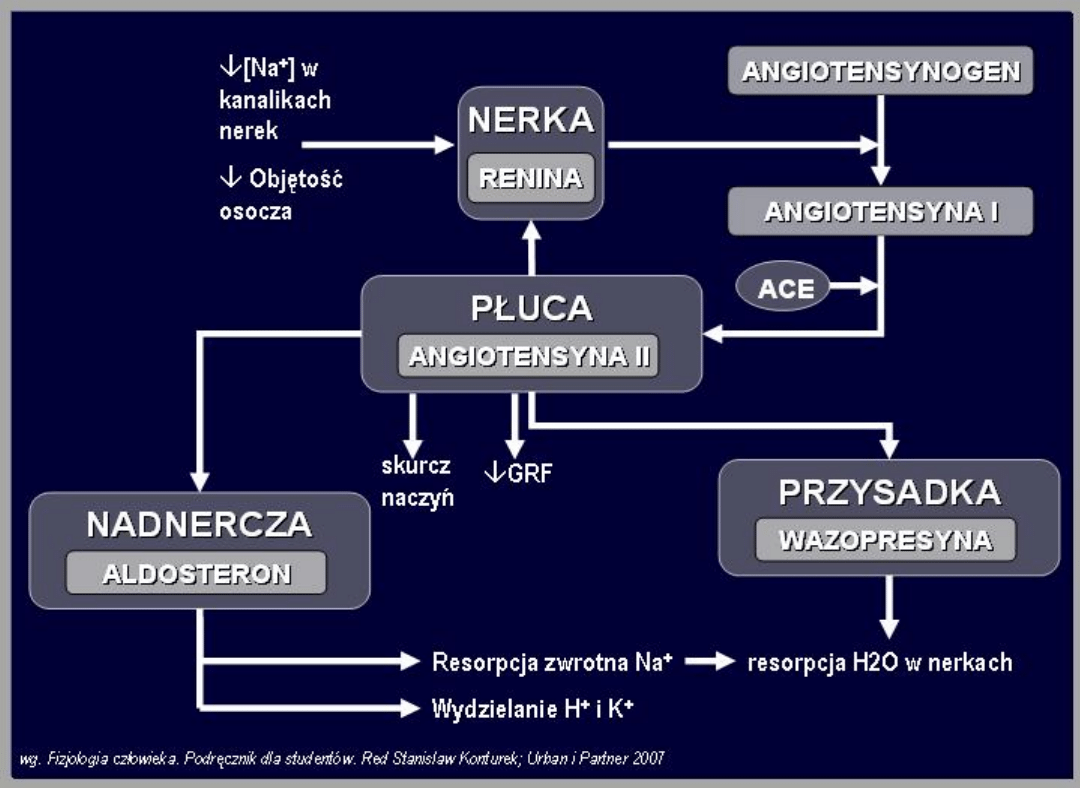
Regulacja wydzielania
aldosteronu
Głównym stymulatorem wydzielania aldosteronu jest peptyd o
nazwie angiotensyna II. Peptyd ten powstaje w wyniku
sekwencji reakcji zapoczątkowanych przez enzym
proteolityczny-reninę (układ renina - angiotensyna -
aldosteron).
Renina wytwarzana jest w nerce, w tzw. aparacie
przykłębuszkowym. Wydzielanie reniny ulega zwiększeniu w
wyniku obniżenia ciśnienia tętniczego krwi, obniżenia objętości
płynu zewnątrzkomórkowego, a także w wyniku wzrostu
aktywności układu adrenergicznego.
Renina działa na angiotensynogen. Jest to peptyd wytwarzany w
wątrobie. Renina odcina z niego dekapeptyd angiotensynę I,
która jest formą nieaktywną. Angiotensyna I ulega konwersji
do oktapeptydu angiotensyny II pod wpływem enzymu
konwertującego.
Angiotensyna II, oprócz stymulacji wydzielania aldosteronu,
obkurcza tętniczki obwodowe i w rezultacie zwiększa ciśnienie
tętnicze krwi. Angiotensyna II przekształcana jest przez enzym
angiotensynazę do heptapeptydu angiotensyny III.
Angiotensyna III również zwiększa wydzielanie aldosteronu i
kurczy naczynia krwionośne.

Warstwa pasmowata
Warstwa pasmowata wydziela
glikokortykosteroidy: kortyzol i
hydroksykortykosteron. U człowieka
głównym glikokortykosteroidem jest
kortyzol.
Kortyzol wywiera w ustroju rozległe,
zróżnicowane wpływy. Obejmują one
niemal wszystkie tkanki


Do najważniejszych należą:
1. Wpływy na metabolizm.
a. Wzmaganie katabolizmu białek. Wpływ
ten widoczny jest zwłaszcza w mięśniach
szkieletowych, kości i tkance limfatycznej.
Nadmiar kortyzolu prowadzi do zwiększonego
wydalania azotu i ujemnego bilansu azotowego.
b. Stymulacja glukoneogenezy i
glikogenezy w wątrobie.
c. Przeciwinsulinowe działanie w tkankach.
Kortyzol hamuje stymulujący wpływ insuliny na
transport glukozy do komórek. Działanie to w
połączeniu ze wzmożeniem produkcji glukozy
prowadzi do zwiększenia stężenia glukozy we
krwi.
d. Kortyzol umożliwia aktywację lipolizy
przez aminy katecholowe w tkance tłuszczowej.
Jest to tzw. wpływ przyzwalający.

2. Komórki krwi. Kortyzol zwiększa liczbę
krwinekczerwonych, granulocytów
obojętnochłonnych oraz płytek krwi.
Zmniejsza liczbę limfocytów, leukocytów
zasadochłonnych i kwasochłonnych.
3. Układ odpornościowy. Kortyzol hamuje
reakcje immunologiczne, alergiczne i zapalne.
4. Układ krążenia. Kortyzol zwiększa wrażliwość
naczyń na noradrenalinę, co prowadzi do
wzrostu ciśnienia tętniczego.
5. Nerki. Kortyzol zwiększa wielkość filtracji
kłębkowej.
6. Układ nerwowy. Zarówno nadmiar, jak też
niedobór kortyzolu prowadzi do zmian
osobowości. Wskazuje to, że hormon ten
bierze udział w regulacji niektórych funkcji
OUN.

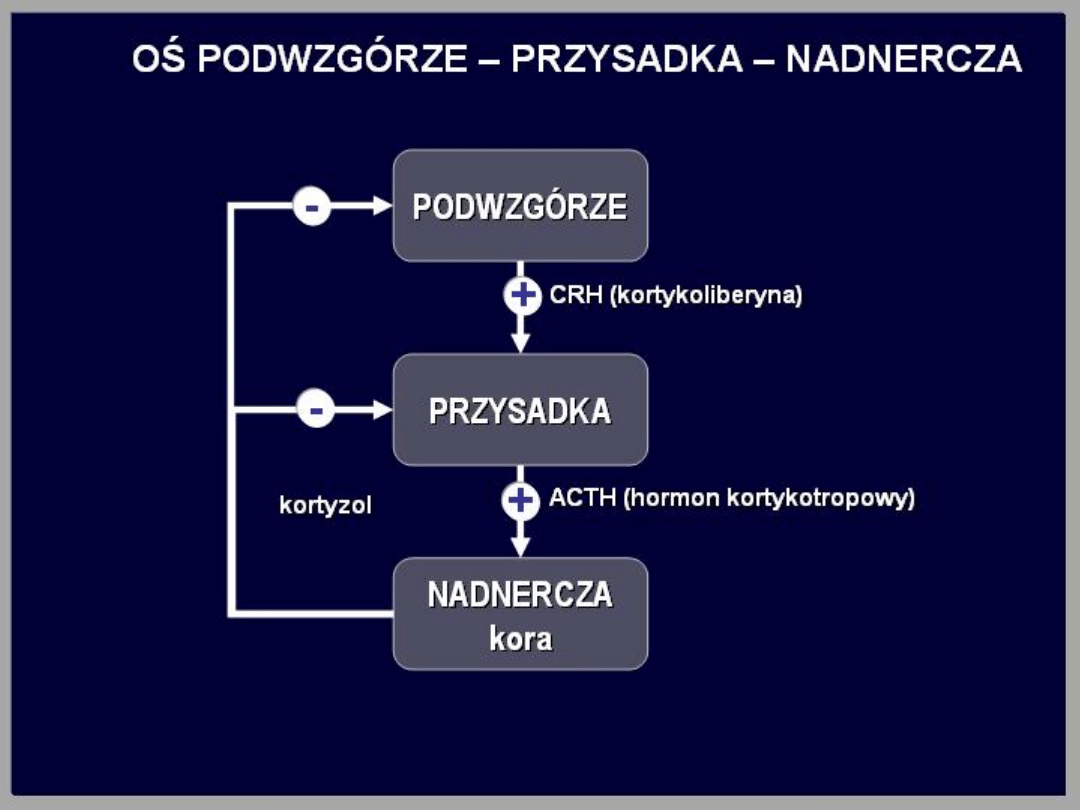

Wydzielanie kortyzolu znajduje się pod wyłączną
kontrolą ACTH. Wzrost stężenia ACTH we krwi
powoduje szybki wzrost wydzielania kortyzolu. Z
kolei wzrost stężenia kortyzolu we krwi hamuje
zwrotnie wydzielanie ACTH. Jest to klasyczne
sprzężenie zwrotne ujemne. Kortyzol hamuje
wydzielanie ACTH bezpośrednio oraz przez
hamowanie wydzielania CRH w podwzgórzu. Zmiany
wydzielania kortyzolu są zgodne z dobowym rytmem
wydzielania ACTH. Najwyższe stężenie we krwi
występuje o godz. 6-8 rano, najniższe zaś około
północy.

Warstwa siatkowata
W warstwie tej wytwarzane są u obu płci
androgeny: dehydroepiandrosteron (DHEA) i
androstendion. Tuż przed okresem
pokwitania gwałtownie wzrasta wydzielanie
DHEA. Zjawisko to nosi nazwę adrenarche.
Odpowiada on za przyspieszenie tempa
wzrastania w tym okresie. Wydzielanie
androgenów nadnerczowych znajduje się
pod kontrolą ACTH.

Nadmierne wydzielanie hormonów kory
nadnerczy może być spowodowane rozrostem
poszczególnych warstw kory w postaci
autonomicznych guzów, lub też pod wpływem
nadmiernego wydzielania ACTH. Nadmierne
wydzielanie aldosteronu powoduje
podwyższenie ciśnienia tętniczego,
zwiększenie stężenia sodu i obniżenie stężenia
potasu w surowicy (zespół Conna). Nadmierne
wydzielanie kortyzolu powoduje powstawanie
tzw. zespołu Cushinga. Składa się na niego
m.in. nasilenie katabolizmu (ścieńczenie skóry,
zaniki mięśni), odkładanie tkanki tłuszczowej w
obrębie brzucha i karku, osteoporoza i
złamania patologiczne kości, wzrost stężenia
cukru we krwi, wzrost ciśnienia tętniczego.

Niedobór hormonów nadnerczy
występuje wskutek uszkodzenia
autoimmunologicznego lub usunięcia
chirurgicznego gruczołów. Prowadzi
do obniżenia ciśnienia tętniczego,
obniżenia stężenia sodu,
podwyższonego stężenia potasu,
obniżenia stężenia glukozy we krwi.
Nieleczona niedoczynność nadnerczy
prowadzi do zapaści i śmierci

Rdzeń nadnerczy
Rdzeń nadnerczy zbudowany jest z
komórek chromochłonnych. Hormonami
wytwarzanymi przez rdzeń nadnerczy
są katecholaminy: adrenalina (80%),
noradrenalina (20%) i dopomina (ilości
śladowe). W czasie życia płodowego
komórki rdzenia nadnerczy wytwarzają
tylko noradrenalinę, natomiast
bezpośrednio po porodzie zaczynają
wytwarzać adrenalinę.



Działanie katecholamin
Adrenalina:
• podnosi ciśnienie skurczowe, a
obniża ciśnienie rozkurczowe,
• przyspiesza czynność serca,
• silniej aktywuje glikogenolizę w
wątrobie i w mięśniach szkieletowych
niż noradrenalina,
• zwiększa silniej niż noradrenalina
stężenie glukozy we krwi.

Noradrenalina:
• zwiększa ciśnienie skurczowe i
rozkurczowe,
• zwalnia częstość skurczów serca,
• wywiera silniejsze działanie
lipolityczne w tkance tłuszczowej niż
adrenalina,
• powoduje większy wzrost stężenia
wolnych kwasów tłuszczowych we
krwi niż adrenalina.

Układ adrenergiczny został nazwany
układem pracy i walki. Hormony rdzenia
nadnerczy mobilizowane są w sytuacjach
stresu (np. zagrożenie życia, zimno,
wysiłek fizyczny, hipoglikemia).
Natychmiastowym efektem ich działania
jest przyspieszenie częstości i
zwiększenie siły skurczów serca, skurcz
obwodowych naczyń krwionośnych,
podwyższenie ciśnienia tętniczego krwi,
rozszerzenie oskrzeli oraz mobilizacja
substratów energetycznych: glukozy i
wolnych kwasów tłuszczowych

Trzustka
Wewnątrzwydzielniczą czynność trzustki pełnią
komórki tworzące tzw. wyspy Langerhansa.
Stanowią one 1-2% masy gruczołu. U człowieka
znajduje się 1-2 milionów wysp. Najwięcej wysp
znajduje się w ogonie trzustki, mniej w trzonie i
głowie tego narządu. W wyspach znajdują się 4
rodzaje komórek:
• Komórki A (α) wydzielają glukagon
• Komórki B (β) wydzielają insulinę
• Komórki D (δ) wydzielają somatostatynę
• Komórki F (PP) wydzielają polipeptyd
trzustkowy


Insulina:
• obniża stężenia glukozy we krwi,
• stymuluje syntezę glikogenu w
mięśniach i w wątrobie,
• hamuje wytwarzanie glukozy w
wątrobie,
• zwiększa syntezę ciał tłuszczowych,
• nasila syntezę białka i hamuje jego
rozkład.


Glukagon:
• zmniejszony poziom glukozy we krwi
powoduje jego wyrzut z trzustki,
• odpowiada za mobilizację
substratów energetycznych w ustroju
(glukoza i wolne kwasy tłuszczowe),
• nasila proces glikogenolizy (rozpadu
glikogenu).



Somatostatyna:
• hamuje wydzielanie insuliny i
glukagonu,
• może opóźniać opróżnianie żołądka i
pęcherzyka żółciowego,
• może zmniejszać wydzielanie
enzymów trawiennych przez
trzustkę.

Polipeptyd trzustkowy
(PP):
• jest silnym inhibitorem sekrecji
enzymów trzustkowych,
• hamuje obkurczanie się pęcherzyka
żółciowego.

Gruczoły płciowe- Gonada
żeńska – jajnik
Estrogeny (estradiol):
• w okresie dojrzewania pobudzają wzrost macicy i
gruczołów piersiowych, wpływają na rozmieszczenie
tkanki tłuszczowej w ustroju, uczestniczą w zrastaniu
nasad kostnych,
• u dojrzałych kobiet, w czasie cyklu miesiączkowego,
powodują wydzielanie wodnistego śluzu szyjkowego,
wpływają na dojrzewanie i rogowacenie nabłonka
pochwy,
• w czasie ciąży wywołują rozrost mięśnia macicy oraz
zwiększenie przepływu krwi przez ten narząd,
• zwiększają wrażliwość mięśnia macicy na działanie
oksytocyny,
• powodują rozrost przewodów w gruczołach sutkowych.


Progesteron:
• powoduje wzrost temperatury ciała i
powstanie gęstego śluzu szyjkowego,
• hamuje wydzielanie LH przez przysadkę
mózgową,
• w ciąży zmniejsza kurczliwość mięśnia
macicy i powoduje wzrost płacików i
pęcherzyków w gruczołach piersiowych,
• zmniejsza liczbę receptorów dla estrogenów
w błonie śluzowej macicy.
Relaksyna:
• w okresie ciąży zmiękcza więzadła kanału
rodnego oraz szyjkę macicy.


Gonada męska – jądro
Androgeny (testosteron):
• w okresie płodowym stymulują powstawanie
drugorzędowych cech płciowych męskich,
• odpowiadają łącznie z FSH za gametogenezę,
• w okresie pokwitania stymulują powiększenie
jąder i prącia, odpowiadają za wystąpienie
owłosienia łonowego i owłosienia na twarzy,
• wywierają działanie anaboliczne – rozrost
mięśni szkieletowych,
• przyspieszają wzrost,
• powodują zarastanie nasad kostnych,
• wpływają na wzrost popędu płciowego.



Termoregulacja

Termoregulacja
Termoregulacja
• Zespół reakcji behawioralnych i
fizjologicznych utrzymujących
temperaturę ciała na optymalnym
poziomie.
• Najwyższa wydajność procesów
enzymatycznych.
• Utrzymanie stałej temperatury ciała
wymaga współpracy ze sobą wielu
czynników a gdy któryś z nich zawiedzie
występują zaburzenia i choroby.

Termoregulacja
Termoregulacja
• Fizjologiczne mechanizmy
termoregulacji 31º - 41 º C.
• Przy temperaturze wyższej lub
niższej mechanizmy te zanikają.

Termoregulacja
chemiczna
• polega na regulacji ilości ciepła
wytwarzanego w organizmie w
procesach biochemicznych,

Termoregulacja fizyczna
• polega ona mechanicznym
ograniczeniom tracenia ciepła przez
organizm

Termoregulacja
behawioralna
• związana jest z odpowiednim
zachowaniem człowieka w różnych
temperaturach

Temperatura ciała
Temperatura ciała
• Temperatura optymalna jest cechą
osobniczą.
• Fizjologia i patofizjologia

5 stanów termicznych
5 stanów termicznych
• Zgodnie z teorią set point:
– Normotermia.
– Gorączka.
– Anapreksja.
– Hipertermia.
– Hipotermia.

Normotermia
Normotermia
• Stan fizjologiczny

Gorączka
Gorączka
• Stan patofizjologiczny. Wywołany
zewnątrzpochodnym czynnikiem
patologicznym.

Anapreksja
Anapreksja
• Lustrzane odbicie gorączki,
wywołana np. wpływem leków
anestetycznych.

Hipertermia
Hipertermia
• Stan patologiczny, załamany
mechanizm utraty ciepła,
temperatura ciała jest wyższa od
temperatury optymalnej.

Temperatura ciała
człowieka
• Temperatury poszczególnych
narządów znacznie się różnią. Jest to
związane z inną aktywnością
metaboliczną oraz wystawieniem na
środowisko zewnętrzne.

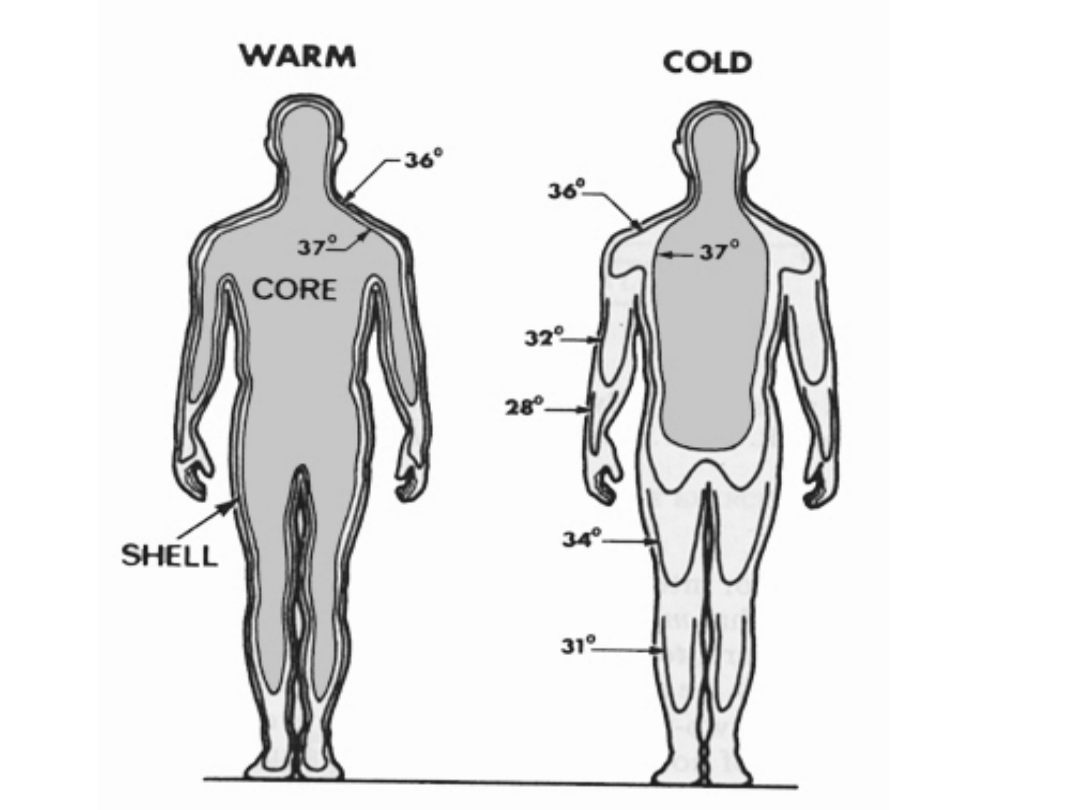
Temperatura skóry
• wynosi ok. 33-34°C i zależy od
umiejscowienia na ciele
• narząd ten jest najbardziej narażony
na gwałtowne zmiany temperatury
czasami dochodzące do 30 ° C
• podskórna tkanka tłuszczowa jest
dobrym izolatorem i chroni głębiej
położone organy

Temperatura ciała
człowieka
• Najgorętszym narządem w stanie spoczynku
jest wątroba (37,2 °C), której wysokie tempo
metabolizmu zapewnia stały dopływ energii
cieplnej.
• Organem bardzo wrażliwym na zmiany
temperatury jest mózg (37 °C), w którym
podwyższenie temperatury do 41,5 °C
powoduje nieodwracalne uszkodzenia
neuronów i zgonu
• Najbardziej stabilną temperaturę u człowieka
stwierdzono w prawej komorze serca

• Mięśnie szkieletowe są przykładem
narządu, którego temperatura jest
zależna od stanu czynnościowego:
W spoczynku wynosi ok 36 °C
Podczas intensywnego wysiłku może
dochodzić do 42 °C (w udach)

Mierzenie temperatury
• metoda rektalna (odbytnicza): daje
najbardziej zbliżone wartości do
temperatury wątroby i mózgu
• mierzenia temperatury w dole
pachwinowym: 36,6°C
• pod językiem 37,0°C
• Temperatura mierzona w odbycie/ jamie
ustnej (tzw. temperatura wewnętrzna o ok.
0,6ºC wyższa niż temperatura powierzchni
skóry – mierzona pod pachą.

Dobowe zmiany
temperatury
• najniższa we wczesnych godzinach
porannych
• najwyższa wieczorem
• Zmiany wynoszą średnio 0,5-0,8°C
• u kobiet występują cykliczne zmiany
temperatury związane z cyklem
menstruacyjnym- podczas owulacji
wzrasta o ok. 0,4 °C

Normy
Normy
• Rano:
– Pod pachą: 36,0° C
– W odbytnicy: 36,5° C
• Po południu:
– Pod pachą: 37,2° C
– W odbytnicy: 37,8° C
• Średnio norma:
– Pod pachą: 36,6° C
– W odbytnicy: 37,2° C

Ontogeneza
Ontogeneza
• Prawidłowa ciepłota ciała mierzona w
odbycie wynosi:
– zaraz po urodzeniu: 37,6° - 38,1°C;
– kilka godzin później: 36,5° - 37°C;
– od drugiej doby życia: 36,9° - 37,4°C.
• Osoby starsze:
– Temperatura nawet o 1° niższa.

Źródła ciepła w organizmie
• podstawowe procesy metaboliczne (BMR -
Basal metabolic rate) prowadzonych w
każdej komórce organizmu, wpływają na nie:
– Aktywność ruchowa
– Ekspozycja na działanie zimna lub ciepła
– Przyjmowanie gorących pokarmów i płynów
– Wdychanie ciełego powietrza
– Diatermia
• mięśnie szkieletowe
• układ pokarmowy

Przewodnictwo cieplne
tkanek
To ilość ciepła oddawana przez 1m²
powierzchni ciała w ciągu 1h przy
różnicy temperatur miedzy
powierzchnią, a wnętrzem ciała
wynoszącej 1°C

Sposoby wymiany ciepła z
otoczeniem
• Konwekcja (przewodzenie) -
przenoszenie ciepła ze środowiska
cieplejszego do zimniejszego. Z wnętrza
ciała na obwód organizmu a następnie ze
skóry do środowiska(np. przez ruchy
powietrza). Szybkość tej wymiany zależy od
różnicy temperatur tych dwóch ciał w
bezpośrednim kontakcie oraz od wartości
ich przewodnictw cieplnych. Dlatego w
środowisku wodnym człowiek traci ciepło
25x szybciej niż na powietrzu
atmosferycznym. Spożywanie pokarmów
oraz wydalanie kału i moczu jest również
powodem konwekcji ciepła z/do środowiska.

Sposoby wymiany ciepła z
otoczeniem
• Promieniowanie cieplne. Człowiek (jak każdy inny
obiekt) zyskuje energię cieplną z promieniowania
krótkofalowego pochodzącego od gorącego źródła
(np. słońce, ognisko) i traci je wypromieniowywując
do chłodniejszego środowiska.
• Parowanie potu odgrywa podstawową rolę w
chłodzeniu skóry oraz krwi w naczyniach
krwionośnych skóry. Zjawisko to polega na traceniu
energii cieplnej wywołane parowaniem cieczy np.
wody. W przypadku wody jest to bardzo skuteczna
metoda chłodzenia spowodowana dużą pojemnością
cieplną i dużym ciepłem parowania. Przy normalnej
temperaturze skóry całkowite wyparowanie 1l potu
usuwa z organizmu 580kcal ciepła.

Temperatu
ra
otoczenia
Tracenie ciepła przez człowieka
(37°C) na sposób:
°C
Konwekcji
przewodzenia
Promieniowani
a
cieplnego
Parowania
potu
23
10%
67%
23%
30
33%
41%
26%
35
6%
4%
90%

Termoregulacja
Termoregulacja
Układ termoregulacji jak każdy odruch
składa się z drogi aferentnej i
efernetnej, a składają się na nią:
• Termoreceptory i termodetektory
• Ośrodek termoregulacji
• Efektory układu termoregulacji

Termoreceptory i
termodetektory
• Termoreceptory obwodowe:
Występują w skórze a ich całkowita ilość szacowana jest na
2 mln. Dzielą się na receptory ciepła i ziemna, a podział
jest utworzony tylko pod względem kryterium
czynnościowego. Dośrodkowe włókna nerwowe reagują
na zmienną częstotliwość wyładowań w określonym
zakresie temperatury. Oba typy receptorów reagują na
zmiany temperatury przejściowym gwałtownym
zwiększeniem wyładowań a potem stabilizują się na
odpowiednim poziomie charakterystycznym dla
temperatur dla receptorów zimna w przedziale 15-34
°C
a
dla receptorów ciepła 38-43
°C
. Termoreceptorów
wrażliwych na zimno jest więcej niż wrażliwych na
ciepło.Powyższe receptory mogą dostarczać informacji o
bezwzględnej temperaturze oraz jej zmianach, także do
świadomości człowiek, co umożliwia odczuwanie ciepła i
zimna i termoregulacji behawioralnej Występowanie tych
receptorów nie ogranicza się tylko do powierzchni ciała,
ale także w mięśniach, górnych drogach oddechowych
ścianach naczyń żylnych i niektóre odcinki

Zasady działania
termoreceptorów obwodowych:
1. Termoreceptory wrażliwe na zimno
są liczniejsze od receptorów
wrażliwych na ciepło
2. Częstotliwość wyładowań przy stałej
temp. Skóry wynosi ok 10 na s. Zaś
każdy receptor ma własną
charakterystyczną dla siebie
temperaturę oraz maksymalną
częstotliwość wyładowań.

3. Dośrodkowe włókna nerwowe związane z
receptorami zimna reagują na gwałtowne
obniżenie temperatury powierzchni skóry
przejściowym wybuchem wyładowań ,po
którym ich częstotliwość maleje, reguluje
się i pozostaje na poziomie temperatury
skóry 15-34 °C.
4. Dośrodkowe włókna nerwowe związane z
receptorami ciepła reagują przejściowym,
dużym wzrostem częstotliwości na wzrost
temperatury skóry, po czym ich
częstotliwość ustala się na poziomie 38-
43 °C.

• Termodetektory (termo wrażliwe
neurony)
Znajdują się w przedniej części podwzgórza i
szyjnej części rdzenia kręgowego. Reagują
na miejscowe zmiany temperatury krwi
przepływającej do mózgu zwiększając
częstotliwość wyładowań i przekazując go do
ośrodka termoregulacji. Stosunek jonów Na+
do Ca2+ w podwzgórzu warunkuje
wrażliwość termodetektorów na zmiany
temperatury krwi dopływającej do mózgowia.
Przesunięcie tego stosunku na korzyść
kationów sodowych powoduje przestawienie
termostatu biologicznego na wyższą
temperaturę i odwrotnie wzrost stężenia
kationów wapniowych w podwzgórzu obniża
wzorzec temperatury ciała.

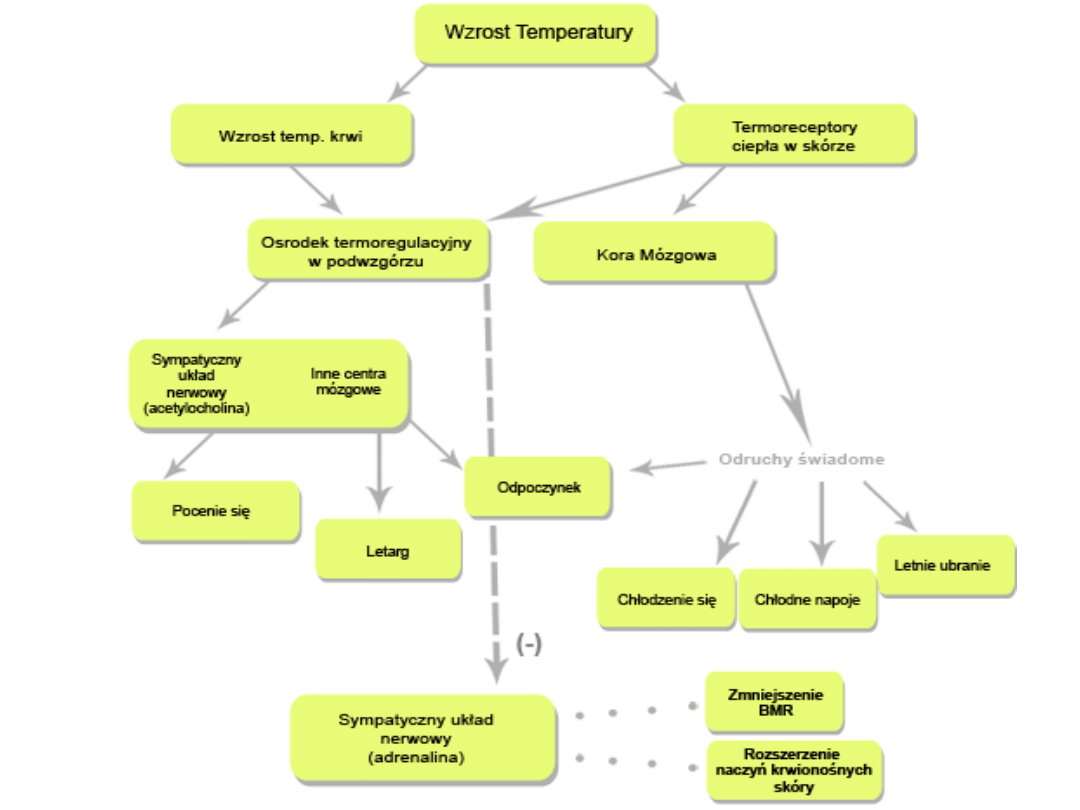
Ośrodek termoregulacji
• Znajduje się w podwzgórzu. Jest
dwuczęściowy, zaś obie części są ze
sobą ściśle połączone
• Przednią cześć stanowi ośrodek
eliminacji ciepła regulujący jego
utratę
• W tylnej, ośrodek zachowania
ciepła, który odpowiedzialny jest za
zatrzymywanie ciepła w organizmie i
stymulacje jego wytwarzania.

Ośrodek zachowania
ciepła
• Uszkodzenie tylnej części podwzgórza znosi
reakcje termoregulacyjne chroniące przed
oziębianiem (skurcz naczyń krwionośnych skóry,
podwyższenie tempa przemiany materii), nie
wpływając na mechanizmy usuwana ciepła z
organizmu w gorącym środowisku
• Tylna cześć podwzgórza bierze udział w
przetwarzaniu informacji termicznych płynących
z receptorów obwodowych, choć nie jest do
końca wytłumaczony ten skomplikowany proces.

Rdzeń kręgowy
• również zawiera elementy termo wrażliwe,
które są umieszczone na ścianach rdzenia.
Jednak ich liczebność jest mniejsza i wynosi
tylko 25-50% tego, co w podwzgórzu
• oziębienie tego odcinka rdzenia kręgowego
wywołuje drżenie mięśni w przeciągu kilku
sekund. Intensywność reakcji na bodziec
zależy nie tylko od niego, ale także od
temperatury podwzgórza i skóry

Efektory układu
termoregulacji:
• Efektory termoregulacji fizycznej: układ
krążenia i gruczoły potowe
• Efektory termoregulacji chemicznej:
mięśnie szkieletowe, wątroba, tkanka
tłuszczowa.
Zmiana ich stanu czynnościowego prowadzi
do:
• Zmniejszenia utraty ciepła
• Zmniejszenia lub zwiększenia tempa
wytwarzania w organizmie ciepła
metabolicznego

Układ krążenia
• Rozszerzenie naczyń krwionośnych
skóry oraz wzrost skórnego przepływu
krwi powoduje zwiększenie
przenoszenia ciepła z wnętrza na
powierzchnie ciała, towarzyszy temu
kompensacyjne zmniejszenia przepływu
krwi przez trzewny obszar naczyniowy i
nerki.
• Termoregulacyjnemu zwężeniu naczyń
krwionośnych skóry towarzyszy
przemieszczeni krwi do głębiej
położonych naczyń krwionośnych.

Gruczoły potowe
• Pobudzane cholinergicznymi
włóknami współczulnymi
• Aktywacja następuje pod wpływem
stymulacji ośrodkowych
termodetrktorów wrażliwych na
wzrost temperatury wewnętrznej.
• Pracują w zakresie teemperatur
otoczenia: 20-40°C.

Mięśnie szkieletowe
• Wzost napięcia, drżenie, praca mięśni stanowią
źródło ciepła
• Wzrost napięcia mieśniowego lub drżenie
powodowane jest nasileniem impulsacji nerwowej
docierającej do mieśni za posrednictwem neuronów
ruchowych α w rdzeniu kręgowym lub motoneuronów
γ pobudzających odruchy proprioceptywne.
• Drżenie powoduje powstawanie ciepła w omal
wszystkich mięsniach szkieletowych.
• Wydzielanie ciepła przez mięśnie na drodze
bezdrżeniowej pobudzane jest układem
adrenergicznym i uwalnianiem hormonów
ciepłotwórczych ( amin katecholowych, glukagonu,
trójjodotyroniny) przy niskiej temperaturze otoczenia
i spadkiem wewnętrznej temperatury ciała.
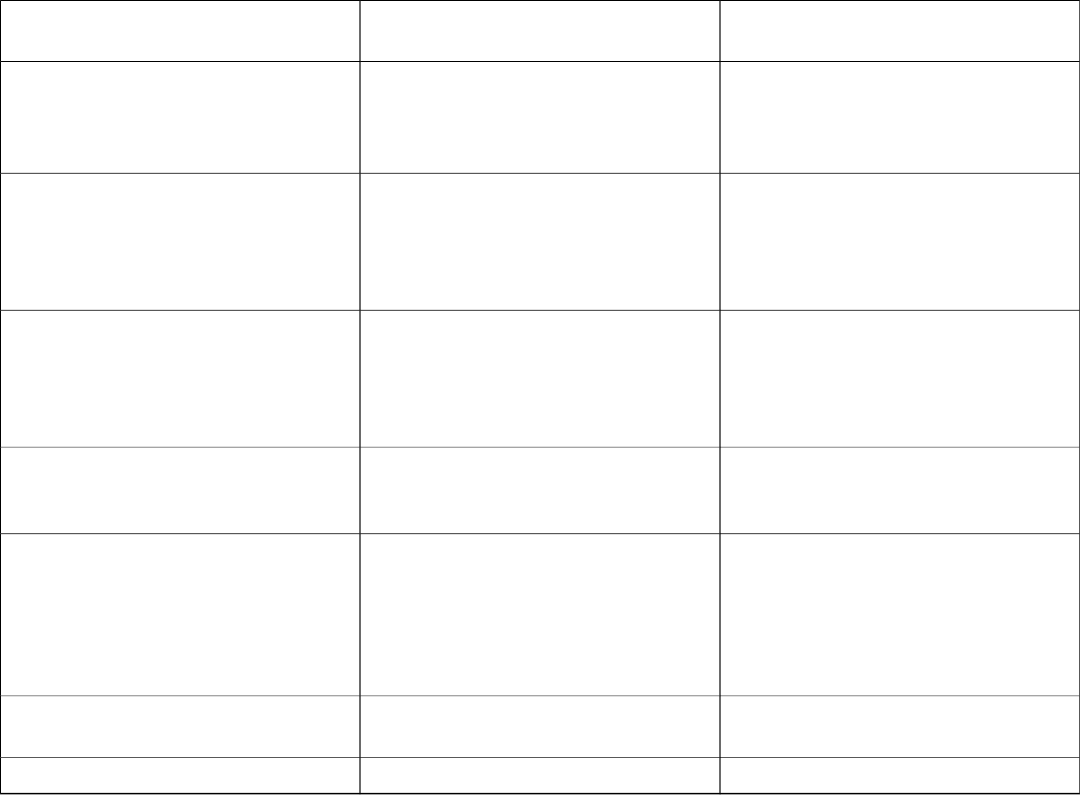
Efektor
Reakcja na obniżoną
temperaturę
Reakcja na podwyższoną
temperaturę
Mięśnie gładkie w
powierzchniowych naczyniach
krwionośnych
Skurcz mięśni powodujący
zmniejszenie średnicy naczyń
krwionośnych w skórze, co
ogranicz a utratę ciepła
Rozluźnienie mięśni powoduje
zwiększony napływ do skóry
gdzie ciepło jest odprowadzane
do otoczenia
Gruczoły potowe
Brak produkcji potu
Wydzielanie potu na
powierzchnię skóry, gdzie
paruje. Jest to endotermiczny
proces i powoduje ochłodzenie
skóry
Włókna mięśniowe włosów
skóry
Skurcz powodujący jeżenie się
włosów na skórze, zwiększenie
grubości nieruchomej
warstewki powietrza, która
izoluje ciało
Rozluźnienie, włosy kładą się na
skórze, aby nie zaburzać
parowania potu ze skóry
Mięśnie szkieletowe
Dreszcze, wywołujące falowy
skurcz produkujący spore ilości
ciepła
Brak dreszczy
Rdzeń nadnerczy i tarczyca
Wydzielanie odpowiednio
adrenaliny i tyroksyny i
trójjodotyroniny zwiększające
podstawowy metabolizm (BMR)
a co za tym idzie i produkcje
ciepła
Brak sekrecji adrenaliny i
hormonów tarczycy
Zachowanie
Zwijanie się w pozycję płodową,
kulenie się, ubieranie się w
Rozciąganie się, znajdywanie
cienia,
cieplejsze ubrania
ubieranie się w lekkie ubrania

Adaptacja do zmiennych
warunków termicznych
• Habitacja- psychczne przyzwyczajenie
się do stałego bądź powtarzającego się
narażania organizmu na działanie
zimna lub gorąca.
• Aklimatyzacja- korzystne zmiany
fizjologiczne, dzięki którym granice
tolerancji środowiska termicznego
znacznie sie poszarzają
• Aklimacja- wpływ zmian klimatycznych
powodujących się przystosowanie się.

Adaptacja do zimna
• Aklimatyzacja hipotermiczna- zmniejszanie
wytwarzanie ciepła i obniżanie temperatury
wewnętrznej obniża odczuwanie
dyskomfprtu jako reakcji na zimno
• Adaptacja izolacyjna- zwiększenie grubości
podskórnej tkanki tłuszczowej i zdolności
skurczu naczyń obwodowych.
• Adaptacja metebolioczna- przetrwnie lub
pojawienie się brunatnej tkanki tłuszczowej
u dorosłych, co pozwala na większe
pozyskiwanie ciepła na drodze
bezdrżeniowej.

Termoreguacja podczas
wysiłków fizycznych
• Wzrost metabolizmu pracujących
mięśni powoduje wzrost temperatury
ciała, ponieważ 75% pozyskiwanei
energii jest w postacj cieplnej.
• Wzrost temperatury sięga 38-42 °C
podczas pracy mięśni
• Powoduje to wzrost przepływu krwi
przez mięśnie i przenoszenie ciepła
do wnętrza ciała.

• Temperatura wnętrza ciała ulega
stponiowemu podwyższeniu.
• Podczas długotrwałych wysiłków (30-40
min) temperatura wewnętrzna
organizmu stabilizuje się.
• Usuwanie nadmiaru ciepła
powstającego podczas wysiłku
fizycznego odbywa się na drodze
parowania potu.
• Przy dużej wilgotności powietrza
parowanie potu nie zachodzi co
zwiększa ryzyko hipertermii.

Reakcje termoregulacyje podczas
wysiłku zależą również od czynników
nietermicznych:
• Stan nawodnienia organizmu
• Rodzaj wykorzystywanych
substratów energetycznych,
• Stopnia wytrenowania
• Wieku
• Fazy cyklu menstruacyjnego u kobiet.

Literatura:
• Anna Jaskólska, Artur Jaskólski; „Podstawy
fizjologii wysiłku fizycznego”; AWF Wrocław
2005
• Włdysław Z. Traczyk, Andrzej Trzebski;
„Fizjologia człowieka z elementami fizjologii
stosowanej i klinicznej”; PZWL 2004
• Bożena Czarkowska-Pączek i Jacek
Przybylski „Zarys fizjologii wysiłku
fizycznego”
• Stanisław Konturek „Fizjologia człowieka t.
V”
•
•
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
- Slide 116
- Slide 117
- Slide 118
- Slide 119
- Slide 120
- Slide 121
- Slide 122
- Slide 123
- Slide 124
- Slide 125
- Slide 126
- Slide 127
- Slide 128
- Slide 129
- Slide 130
- Slide 131
- Slide 132
- Slide 133
- Slide 134
- Slide 135
- Slide 136
- Slide 137
- Slide 138
- Slide 139
- Slide 140
- Slide 141
- Slide 142
- Slide 143
- Slide 144
- Slide 145
- Slide 146
- Slide 147
- Slide 148
- Slide 149
- Slide 150
- Slide 151
- Slide 152
- Slide 153
- Slide 154
Wyszukiwarka
Podobne podstrony:
Kontrola srodowiska wewnetrznego
Kontrola wymiarów wewnętrznych, Studia, metrologia
fizjologia wykł, Pobudliwość- zdolność reagowania na bodźce pochodzące ze środowiska wewnętrznego lu
program studiów Kontrola i audyt wewnętrzny w ŚWSZ w katowicach, Audyt Wewnętrzny, Audyt Wewnętrzny
I Środowisko wewnętrzne
Fizjologia - Kontrola Środowiska Wewn, Fizjologia
Srodowisko wewnetrznee, giełdyfizj
kontrola temperatury wewnętrzej
OSTATECZNA Łukowska, M (2011) Mechanizmy kontroli głębokości zanurzenia przestrzennego w środowisko
informacja na temat kontroli finansowej i audytu wewnętrznego
Dziennik Ustaw z 03 r Nr 6 poz w ROZPORZĄDZENIE w sprawie metod wewnętrznej kontroli produkcji żywn
k4wyklad Kontrola wewnętrzna system HACCP oraz systemy BRC IFS
13. Pytania kontrolne, ochrona środowiska
09.Karta kontroli wewnętrznej, Haccp-Dokumentacja-przykład
AUDYT SYSTEMU KONTROLI WEWNĘTRZNEJ
Wewnętrzne instalacje sanitarne, Inżynieria Środowiska, Różne
kontrola wewnętrzna - teoria i pratyka, materiały
pytania z audytu od 18 do 22, Audyt i kontrola wewnętrzna
więcej podobnych podstron