
Transport entropii
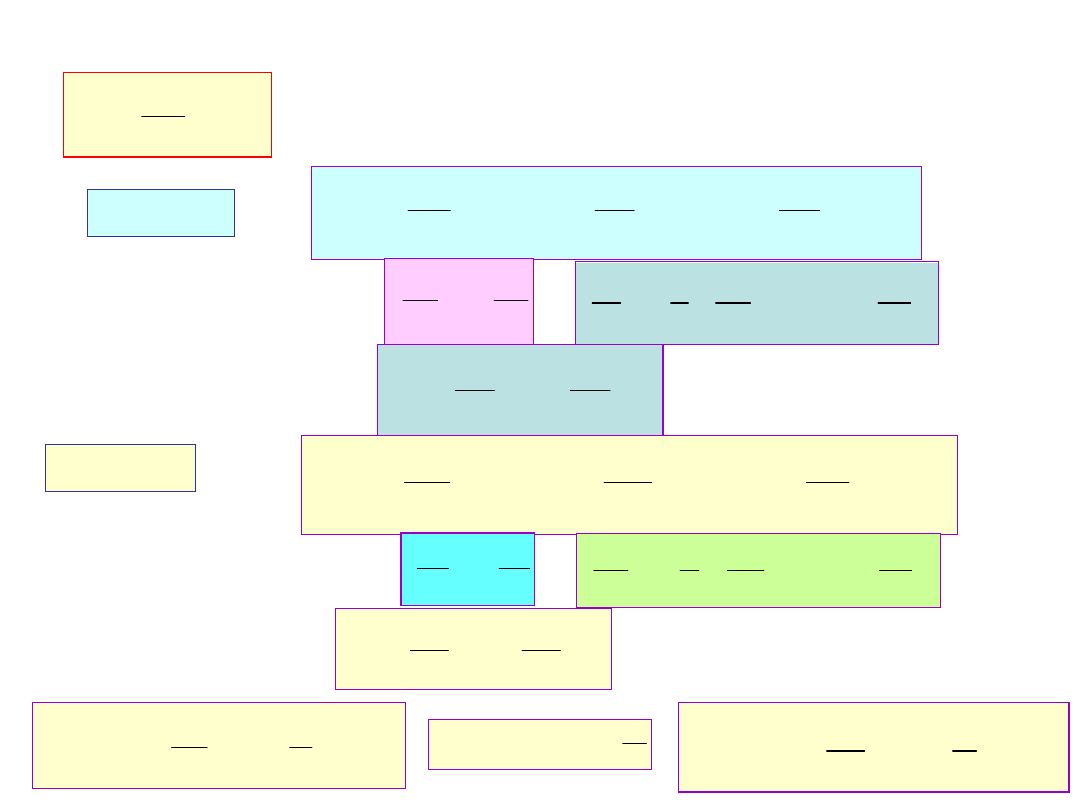
S
-entropia, odróżnia procesy odwracalne
dS = Qel /T
od nieodwracalnych
dS Qel /T
d
d
el
i
Q
S
S
T
=
+
d
i
S
-produkcja entropii wewnątrz układu
dS
- transport entropii z otoczenia
def
,
,
,
d
d
d
d
p
p T
T
S
S
S
S
T
p
T
p
x
x
x
x
� �
� �
�
�
�
� �
=
+
+
� �
� �
� �
�
�
�
� �
� �
� �
S (T,p,)
p
p
C
S
T
T
�
� �=
� �
�
� �
1
p
T
T
S
H
V
V
p
T
p
T
�
�
� �
� �
�
�
�
� �
=
-
=-
�
�
� �
� �
� �
�
�
�
� �
�
�
� �
� �
�
�
d
d
d
p
C
nR
S
T
p
T
p
=
-
(
)
( )
,
ln
p
T p
T
R
p
=
-
d
d
S
S
S (T,V,
)
,
,
,
d
d
d
d
V
T
V T
S
S
S
S
T
V
T
V
x
x
x
x
� �
�
�
�
� �
� �
=
+
+
� �
� �
� �
�
�
�
� �
� �
� �
V
V
C
S
T
T
�
� �=
� �
�
� �
1
T
T
V
S
U
p
p
V
T
V
T
�
�
�
�
�
� �
�
�
� �
=
+
=
�
�
� �
�
�
� �
�
�
�
� �
�
�
� �
�
�
d
d
d
V
C
nR
S
T
V
T
V
=
+
(
)
,
d
d
o
V
C
R
S T V
T
V b
T
V
=
+
+
�
�
(
)
,
d
d
'
o
p
C
R
S T p
T
p b
T
p
=
-
+
�
�
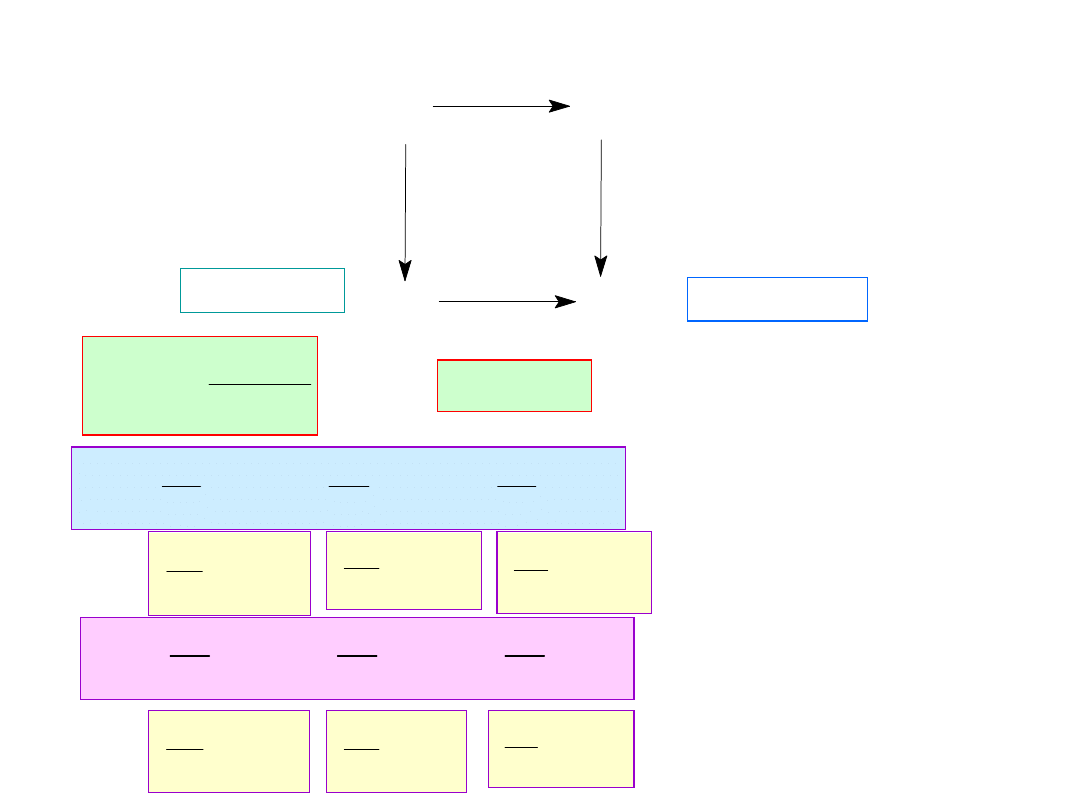
+ pV
+ pV
-TS
-TS
U
H
F
G
H,G (T,p,
)
U,F (T,V,
)
F = U TS
G = H TS
. .,
. .,
. .,
p f k
p f k
p f k
H
S
T
D
D
=
,
,
,
d
d
d
d
V
T
V T
F
F
F
F
T
V
T
V
x
x
x
x
� �
�
�
�
� �
� �
=
+
+
� �
� �
� �
�
�
�
� �
� �
� �
,
V
F
S
T
x
�
� � =-
� �
�
� �
,
T
F
p
V
x
�
� � =-
� �
�
� �
,
V T
F
A
x
� �
�
=-
� �
�
� �
,
,
,
d
d
d
d
p
T
p T
G
G
G
G
T
V
T
p
x
x
x
x
� �
� �
�
�
�
� �
=
+
+
� �
� �
� �
�
�
�
� �
� �
� �
,
p
G
S
T
x
�
� � =-
� �
�
� �
,
T
G
V
p
x
� �
�
=
� �
�
� �
,
V T
G
A
x
� �
�
=-
� �
�
� �
. .,
0
p f k
G
D
=

1.Mol tlenu o temperaturze 300 K rozprężono izotermicznie od V
1
= 10 dm
3
do V
2
= 20 dm
3
,
przy czym gaz przesunął tłok obciążony ciśnieniem 10
5
Pa. Obliczyć zmiany entropii układu i
otoczenia. Ile entropii wyprodukowano w tym procesie? Odp.: 5,76 J/K, -3,33 J/K, 2,43 J/K.
2. Obliczyć S układu, gdy trzy mole metanu (spełniającego parametry gazu doskonałego ogrzano
i sprężono od temp. 25
o
C i ciśnienia 1 atm do temp. 125
o
C i ciśnienia 5 atm. Odp.: -11,27 J/K.
3. Obliczyć entropię molową CO w 200ºC pod ciśnieniem 50,67·105 N/m
2
wiedząc, że w 25ºC i pod ciśnieniem 1 atm jest ona równa 197,9 J·mol
–1
K
–1
, oraz,
że:
= 28,41 + 4,10·10
–3
T – 0,46·105T
–2
[J·mol
–1
K
–1
]. Odp.: 179,06 J·mol
–1
K
–1
,CO
o
p
C
o
300
S
R
/
V
2
5
C
o
4. Obliczyć pracę i ciepło oraz zmiany energii wewnętrznej, entalpii, entropii, energii swobodnej
i entalpii swobodnej w procesie adiabatycznego, quasi-statycznego rozprężenia 1 mola CO
od objętości 1 dm
3
do objętości 10 dm
3
. Temperatura początkowa gazu wynosiła 300 K,
a jego entropia standardowa w tej temperaturze
= 198,0 JK
–1
mol
–1
. Przyjąć
Odp.: W = U = –3754 J, Q = 0, H = –5255 J, S = 0, F = 27,2 kJ, G = 25,7
kJ.
niezależne od temperatury.
5. Jak zmieni się entropia podczas przeprowadzenia 2 moli ciekłego amoniaku o
temperaturze –40ºC w amoniak gazowy o temperaturze 200ºC pod stałym ciśnieniem
1013,25 hPa mając dane:
C
p
(NH
3
, c) = 74,82 J·mol
–1
K
–1
C
p
(NH
3
, g) = 33,61 + 29,26·10
–4
T + 21,32·10
–6
T
2
J·mol
–1
K
–1
.
Molowe ciepło parowania amoniaku w temperaturze wrzenia 239,7 K i pod ciśnieniem 1 atm
wynosi H = 23,24 kJ/mol. Odp.: wzrośnie o 248,7 J/K

6. Obliczyć zmianę entropii, entalpii swobodnej i energii swobodnej podczas izotermicznego,
odwracalnego rozprężania 1 mola azotu od objętości 1 dm
3
do 10 dm
3
w temperaturze 273 K,
traktując azot jak gaz doskonały. Odp.: 19,14 J/K, -5,23 kJ/mol
2
3
o
p
298
o
S
7. Obliczyć W, S i G, gdy 0,5 mola helu o temperaturze 298 K pod ciśnieniem
zostaje odwracalnie ogrzane pod stałym ciśnieniem o 30 K. Hel traktować jak gaz doskonały. Przyjąć
= 126 J/mol·K. Odp.: –124,9 J; 0,997 J/K; –1957J
Odp.: T
2
=253,3 K,
8 . 2 mole metanu znajdujące się w warunkach standardowych (T
1
=298 K, p=10
5
Pa) rozpręża się
adiabatycznie przesuwając tłok obciążony ciśnieniem 4,0 · 10
4
Pa do wyrównania
ciśnień po obu
stronach tłoka. Obliczyć temperaturę końcową układu, oraz S i F tego procesu.
Metan spełnia
równanie stanu sztywnych kul (b = 42,8 · 10
−6
m
3
· mol
−1
). Standardowa molowa
entropia metanu
w temperaturze 298 K wynosi
o
S
298
1
2,213
S
J K
-
D =
�
kJ
F
29
,
13
= 186,19 J · K
−1
· mol
−1
.
9. Mol pary wodnej pod ciśnieniem 5,065·10
4
Pa w temperaturze 383 K
skomprymowano do ciśnienia
1,013·10
5
Pa, następnie ochłodzono pod stałym ciśnieniem do temperatury 373 K i
skroplono.
Obliczyć zmianę entropii i entalpii swobodnej wody traktując parę wodną jako gaz
doskonały.
W 373 K i ciśnieniu 1,013·10
5
Pa ciepło parowania wynosi 40,67 kJ/mol. Ciepło
molowe (Cp
o
)
przyjmuje się za równe 30,13+11,310
-3
T [J/molK] dla pary i za równe 75,31
[J/molK] dla wody
w całym zakresie temperatur. Wartość standardowej molowej entropii ciekłej wody
wynosi 66,56 J/molK,
pary wodnej 188,65 J/molK. Odp.: S = – 115,68 J/molK, G = 4121 J
10. Obliczyć zmianę entropii, gdy zmiesza się 100 g wody o temperaturze 10
o
C z 200
g wody
o temperaturze 40
o
C, aż do uzyskania stałej temperatury w naczyniu izolowanym
adiabatycznie.
Molowa pojemność cieplna wody wynosi 75,2 Jmol
-1
K
-1
Odp.:T
x
=303 K, S=1,397
JK
-1
.
1. Mol tlenu o temperaturze 300 K rozprężono izotermicznie od V
1
= 10 dm
3
do V
2
= 20 dm
3
,
przy czym gaz przesunął tłok obciążony ciśnieniem 10
5
Pa. Obliczyć zmiany entropii układu i
otoczenia. Ile entropii wyprodukowano w tym procesie? Odp.: 5,76 J/K, -3,33 J/K, 2,43 J/K.
2
1
ln
5,76 /
ukl
V
S
R
J K
V
D
=
=
5,76 /
ukl
i
Q
S
S
J K mol
T
D
= +D =
�
2
1
(
) 10
prac
Q
W p
V V
kJ
=-
=
-
=
4
10
3,33 /
300
Q
J K mol
T
=
=
�
2,43 /
i
S
J K mol
D =
�
d
d
d
V
T
S
S
S
T
V
T
V
�
�
� �
� �
=
+
� �
� �
�
�
� �
� �
V
V
S
C
T
T
�
� �=
� �
�
� �
T
V
S
p
nR
V
T
V
�
�
� � � �
=
=
� � � �
�
�
� � � �
2. Obliczyć S układu, gdy trzy mole metanu (spełniającego parametry gazu
doskonałego ogrzano
i sprężono od temp. 25
o
C i ciśnienia 1 atm do temp. 125
o
C i ciśnienia 5 atm. Odp.:
-11,27 J/K.
C
V
= 3R,
2
1
1
2
398
1
ln
ln
3
4ln
ln
11,27 /
298
5
p
T
p
S n C
R
R
J K
T
p
�
�
�
�
D =
+
= �
+
=-
�
�
�
�
�
�
�
�
d
d
d
p
T
S
S
S
T
p
T
p
� �
�
�
� �
=
+� �
� �
�
�
� �
� �
p
p
C
S
T
T
�
� �=
� �
�
� �
;
p
T
S
V
nR
p
T
p
� �
�
�
� �
=-
=-
� �
� �
�
�
� �
� �
3. Obliczyć entropię molową CO w 200ºC pod ciśnieniem 50,67·10
5
N/m
2
wiedząc,
że w 25ºC i pod ciśnieniem 1 atm jest ona równa 197,9 J·mol
–1
K
–1
, oraz, że:
,CO
p
C
d
= 28,41 + 4,10·10
–3
T – 0,46·10
5
T
–2
[J·mol
–1
K
–1
]. Odp.: 179,06 J·mol
–1
K
–1
(
)
5
5
1
5
(
)
50,7610
1,01310
1
473
298
2
473
473
473
5
1,01310
1
298
3
2
298
298
298
5
2
2
ln
0,46 10
28,41
ln
473
0,46 10
1
1
197,9
ln
473 298
298
2
473
298
pf
T
o
p CO
Pa
Pa
K
K
T
Pa
K
C
p
S
S
dT R
T
p
p
dT
S
dT
dT R
T
T
p
�
�
�
- 3
- 3
=
+
+
=
�
+
+ 4,1�
10
-
+
=
� �
�
+28,41
+4,1�
10
-
+
-
�
�
�
�
�
� �
�
5
5
1,013 10
ln
179,06 /
50,67 10
R
J K
�
+
=
�

o
300
S
R
/
V
2
5
C
o
4. Obliczyć pracę i ciepło oraz zmiany energii wewnętrznej, entalpii, entropii, energii swobodnej
i entalpii swobodnej w procesie adiabatycznego, quasi-statycznego rozprężenia 1 mola CO
od objętości 1 dm
3
do objętości 10 dm
3
. Temperatura początkowa gazu wynosiła 300 K,
a jego entropia standardowa w tej temperaturze
= 198,0 JK
–1
mol
–1
. Przyjąć
Odp.: W = U = –3754 J, Q = 0, H = –5255 J, S = 0, F = 27,2 kJ, G = 25,7
kJ.
niezależne od temperatury
7
5
p
V
C
C
k =
=
1
1
2
1
2
119,4
V
T
T
K
V
k -
� �
=
=
� �
� �
6
1
1
2,494 10
pocz
RT
p
Pa
V
=
=
�
(
)
2
1
3,754 /
o
V
W
U C T T
kJ mol
=D =
-
=-
(
)
2
1
5,255 /
o
p
H C T T
kJ mol
D =
-
=-
0
S
6
300
300
2,2494 10
ln
198
ln
171,36 /
pocz
p p
pocz
o
T
K
T
K
o
o
p
S
S
R
R
J mol K
p
p
=
=
=
�
=
-
=
-
=
�
3754 171,36 (119,4 300) 27,194 /
F
U S T
kJ mol
D =D - D =-
-
�
-
=
5255 171,36 (119,4 300) 25,69 /
G
H S T
kJ mol
D =D - D =-
-
�
-
=

2
1
( )
( )
pf
pf
T
T
o
o
o
p c
pf
p g
pf
T
T
C
H
C
S n
dT n
n
dT
T
T
T
D
D =
+
+
�
�
(
)
3
4
6
2
2
239,7
23,24 10
473,15
2 74,82ln
2
2 33,61ln
2 29,26 10 (473,15 239,7)
233,15
239,7
239,7
21,32 10
2
473,15 239,7
248,7 /
2
S
J K
-
-
�
D = �
+
+ �
+ �
� �
-
+
�
�
-
=
5.
Jak zmieni się entropia podczas przeprowadzenia 2 moli ciekłego amoniaku o
temperaturze –40ºC w amoniak gazowy o temperaturze 200ºC pod stałym ciśnieniem
1013,25 hPa mając dane:
C
p
(NH
3
, c) = 74,82 J·mol
–1
K
–1
C
p
(NH
3
, g) = 33,61 + 29,26·10
–4
T + 21,32·10
–6
T
2
J·mol
–1
K
–1
.
Molowe ciepło parowania amoniaku w temperaturze wrzenia 239,7 K i pod ciśnieniem 1 atm
wynosi H = 23,24 kJ/mol. Odp.: wzrośnie o 248,7 J/K

2
1
ln
19,14 /
V
S R
J K
V
D =
=
0
U
H
D =D =
273 19,14
5,23 /
F
G
T S
kJ mol
D =D =- D =-
�
=-
d
d
d
V
T
S
S
S
T
V
T
V
�
�
� �
� �
=
+
� �
� �
�
�
� �
� �
V
V
S
C
T
T
�
� �=
� �
�
� �
T
V
S
p
R
V
T
V
�
�
� � � �
=
=
� � � �
�
�
� � � �
6. Obliczyć zmianę entropii, entalpii swobodnej i energii swobodnej podczas izotermicznego,
odwracalnego rozprężania 1 mola azotu od objętości 1 dm
3
do 10 dm
3
w temperaturze 273 K,
traktując azot jak gaz doskonały. Odp.: 19,14 J/K, -5,23 kJ/mol
;
2
3
o
p
o
S
2
3
1
1
1,834 10
nRT
V
m
p
-
=
=
�
2
3
2
2
2,019 10
nRT
V
m
p
-
=
=
�
2
1
(
)
124,9
W
p V V
J
=-
-
=-
328
( )
298
0,997 /
o
p c
C
S n
dT
J K
T
D =
=
�
338
298
331,8
623,55 /
o
p
H n C dT
J
J mol
D =
=
=
�
2
3
1(
298 )
298
2
2
3
ln
126
ln
129,4 /
3
o
o
p
p
o
T
K
T
K
o
p
S
S
R
R
J mol K
p
=
=
=
=
-
=
-
=
�
2
1
129,4 2 0,997 131,4 /
S
S
S
J mol K
= +D =
+ �
=
�
2 2
1 1
(
)
3914,45 /
G
H
T S TS
J mol
D =D -
-
=-
1
3914,45
1957
2
G
J
J
D =- �
=-
7. Obliczyć W, S i G, gdy 0,5 mola helu o temperaturze 298 K pod ciśnieniem
zostaje odwracalnie ogrzane pod stałym ciśnieniem o 30 K. Hel traktować jak gaz doskonały.
Przyjąć:
= 126 J/mol·K. Odp.: –124,9 J; 0,997 J/K; –1957J
o
S
298
1
4,426
S
J K
-
D =
�
kJ
F
29
,
13
2
1
1
2
2
1
1
3 1
253,3
4 4
V
V
p
T C
R
p
p
T
T
K
C
R
p
�
�
+
�
�
�
�
�
�
=
=
+
=
�
�
+
�
�
2
1
1
2
ln
ln
4,426 /
p
T
p
S n C
R
J K
T
p
�
�
D =
+
=
�
�
�
�
2
1
1
2
ln
ln
2,213 /
p
T
p
S C
R
J mol K
T
p
D =
+
=
�
)
(
1
1
2
2
S
T
S
T
U
F
1
1
1
2
1
2
S
nT
S
n
nS
T
T
T
nC
F
V
(
)
(
)
2 3 253,3 298
253,3 2 186,19 4,427
2 298 186,19
13294
F
R
J
D = �
-
-
�
+
- � �
=
�
�
�
�
2
1
2
1
2
1
2
1
2
2
1
d
(
)
(
)
T
V
V
prac
T
T
T
U n C T nC T T
p
V V
p nR
p
p
D
�
�
=
=
-
=-
-
=-
-
�
�
�
�
�
1
2
1
2
1
2
;
nRT
nRT
V
nb V
nb
p
p
=
+
=
+
d
d
d
p
T
S
S
S
T
p
T
p
� �
�
�
� �
=
+
� �
� �
�
�
� �
� �
p
p
C
S
T
T
�
� �=
� �
�
� �
p
T
S
V
R
p
T
p
� �
�
�
� �
=-
=-
� �
� �
�
�
� �
� �
d
d
d
V
T
S
S
S
T
V
T
V
�
�
� �
� �
=
+
� �
� �
�
�
� �
� �
V
V
S
C
T
T
�
� �=
� �
�
� �
T
V
S
p
R
V
T
V
�
�
� � � �
=
=
� � � �
�
�
� � � �
8 . 2 mole metanu znajdujące się w warunkach standardowych (T
1
=298 K, p=10
5
Pa) rozpręża się
adiabatycznie przesuwając tłok obciążony ciśnieniem 4,0 · 10
4
Pa do wyrównania ciśnień po obu
stronach tłoka. Obliczyć temperaturę końcową układu, oraz S i F tego procesu. Metan spełnia
równanie stanu sztywnych kul (b = 42,8 · 10
−6
m
3
· mol
−1
). Standardowa molowa entropia metanu
w temperaturze 298 K wynosi
= 186,19 J · K
−1
· mol
−1
.
C
V
= 3R
;
;
;
;
Odp.: T
2
=253,3 K
2
1
373
,
1
,
2
383
373
ln
ln
115,68 /
373
383
373
p
o
p pary
par
par
o
p pary
p
C
H
H
R
p
S
dp
dT
R
C
J mol K
p
T
p
D
D
D =-
+
-
=
+
-
=-
�
�
�
(
)
373
3
2
2
3
,
383
11,3 10
30,13 ( 10)
373 383
40,67 10
41,057 /
2
o
p pary
par
H
C
dT
H
kJ mol
-
�
D =
- D
=
�-
+
-
-
� =-
�
4
4
5
5
383
5.06510
,
5.06510
1,01310
1,(
, 383 )
,( 298 )
298
1,01310
3
383
188,65 30,13ln
11,3 10 (383 298)
ln0,5 202,93 /
298
o
Pa
p pary
p
Pa
p
Pa
para T
K
para t
K
Pa
C
R
S
S
dT
dp
T
p
R
J mol K
�
=
�
=
�
=
=
�
-
=
+
-
=
+
+
�
-
-
=
�
�
�
2 2
1 1
(
)
G
H
T S TS
D =D -
-
2
1
1 1
[ (
)
]
41057 [373(202,93 115,68) 383 202,93] 4121
G
H T S
S TS
J
D =D -
+D -
=-
-
-
-
�
=
9. Mol pary wodnej pod ciśnieniem 5,065·10
4
Pa w temperaturze 383 K skomprymowano do ciśnienia
1,013·10
5
Pa, następnie ochłodzono pod stałym ciśnieniem do temperatury 373 K i skroplono.
Obliczyć zmianę entropii i entalpii swobodnej wody traktując parę wodną jako gaz doskonały.
W 373 K i ciśnieniu 1,013·10
5
Pa ciepło parowania wynosi 40,67 kJ/mol. Ciepło molowe (C
p
o
)
przyjmuje się za równe 30,13+11,310
-3
T [J/molK] dla pary i za równe 75,31 [J/molK] dla wody
w całym zakresie temperatur. Wartość standardowej molowej entropii ciekłej wody wynosi 66,56 J/molK,
pary wodnej 188,65 J/molK. Odp.: S = – 115,68 J/molK, G = 4121 J
G = H TS;

1 1
2 2
1
2
303
x
nT n T
T
K
n n
+
=
=
+
1
2
303
303
1
1
2
283
313
100 75,2
200 75,2
1,397
18
18
x
x
T
T
o
o
p
p
T
T
C
C
S n
dT n
dt
dT
dT
J K
T
T
T
T
-
D =
+
=
+
=
�
�
�
�
�
10. Obliczyć zmianę entropii, gdy zmiesza się 100 g wody o temperaturze 10
o
C z 200 g wody
o temperaturze 40
o
C, aż do uzyskania stałej temperatury w naczyniu izolowanym adiabatycznie.
Molowa pojemność cieplna wody wynosi 75,2 Jmol
-1
K
-1
Odp.:T
x
=303 K, S=1,397 JK
-1
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
18 entropia i II zasada termodynamiki
5 Wykład Ch F II zasada1
II Zasada Termodynamiki
14. Związek pędu z II zasadą dynamiki, Fizyka - Lekcje
13. II zasada termodynamiki
2 7 II zasada termodynamiki i sprawnosc cyklu?rnota
7. II zasada, Fizyka - Lekcje
II ZASADA TERMODYNAMIKI ENTROPIA 2
13 II zasada termodynamikiid 14454
Wykład Ch F II zasada
I i II zasada Termodynamiki
18 entropia i II zasada termodynamiki
II zasada termodynamiki
kubica,biofizyka, I i II zasada termodynamiki w opisie układów biologicznych
więcej podobnych podstron