1
Termochemia
Waldemar Ufnalski
Wprowadzenie do termodynamiki
chemicznej
Wykład 15
165
170
175
180
3
0
0
5
0
0
7
0
0
9
0
0
1
1
0
0
T/K
H
0
/(
k
J/
m
o
l)
-120
-110
-100
-90
3
0
0
7
0
0
1
1
0
0
1
5
0
0
T/K
0
/(
k
J/
m
o
l)

2
15.1. Fakty
doświadczalne i ich
znaczenie praktyczne
Wykład 15

3
Fakty doświadczalne i ich znaczenie ...
Umowne warunki prowadzenia
procesu:
-układ nie elektrochemiczny (W =
W
obj
)
- T = const (T
końcowa
= T
początkowa
)
oraz
a) P=const Q
P
= H
H > 0: ...endotermiczny;
H < 0: ...egzotermiczny
b) V = const Q
V
= U
U > 0: ...endoenergetyczny;
U < 0: ...egzoenergetyczny

4
Fakty doświadczalne i ich znaczenie ...
Znaczenie:
- Energetyka „cieplna” - wytwarzanie
energii elektrycznej kosztem ciepła
spalania paliw kopalnych
- Ogrzewanie pomieszczeń (jw.)
- Silniki cieplne pojazdów
- Technologia chemiczna (zbilansowanie
efektów cieplnych procesów egzo- i
endotermicznych daje znacze
oszczędności energii i obniża koszty
wytwarzania.
- Istnienie organizmów żywych -
szczególnie zwierzęta stałocieplne istnieją
dzięki bilansowi efektów przemian egzo- i
endotermicznych.

5
15.2. Efekty cieplne
przemian chemicznych i
ich standaryzacja
Wykład 15

6
Efekty cieplne przemian - standaryzacja
...
Efekt cieplny reakcji
chemicznej:
m
n
m
m
S
S
S
S
S
S
,
,
,
2
2
1
1
2
2
1
1
(1
)
substraty =
produkty
Zapis równania stechiometrycznego
(IUPAC):
k
k
R
R
R
2
2
1
1
0
Przykła
d:
(2
)
y)
tradycyjn
(zapis
2
3
3
2
2
NH
N
H
IUPAC)
wg
(zapis
2
3
0
3
2
2
NH
N
H
Substratom przypisuje się ujemne
współczynniki stechiometryczne
7
Efekty cieplne przemian - standaryzacja
...
Układ zamknięty w którym przebiega
reakcja (2):
(3
)
ilości
początkowe
Miara zaawansowania
reakcji:
Relacje:
(4
)
Współrzędna (postęp)
reakcji
0
0
2
0
1
k
n
n
n
,
,
k
n
n
n
,
,
2
1
ilości
chwilowe
k
k
k
n
n
n
n
n
n
0
2
0
2
2
1
0
1
1
[mol]
0
i
i
i
n
n

8
Efekty cieplne przemian - standaryzacja
...
Układ zamknięty w którym przebiega
reakcja (2):
(6
)
Różniczka zupełna np.
(5a):
(5a/b
)
Każda ekstensywna funkcja stanu
opisująca układ zamknięty w którym
przebiega jedna reakcja chemiczna jest
funkcją : współrzędnej reakcji oraz np.
temperatury i ciśnienia lub temperatury i
objętości
lub
,
,
,
,
V
T
Z
P
T
Z
d
Z
dP
P
Z
dT
T
Z
P
T
dZ
P
T
T
P
,
,
,
,
,
9
Efekty cieplne przemian - standaryzacja
...
Funkcja termodynamiczna
reakcji:
(8a/b
)
Efekty cieplne
reakcji:
(7
)
Entalpia
przemiany -
ciepło
przemiany
izobarycznej
P
T
r
Z
P
T
Z
,
,
,
P
T
r
H
P
T
H
,
,
,
V
T
r
U
V
T
U
,
,
,
Energia
przemiany -
ciepło
przemiany
izochorycznej
10
Efekty cieplne przemian - standaryzacja
...
(9
)
Standardowa entalpia reakcji (
r
H
o
) -
zmiana entalpii w wyniku pomyślanej
przemiany:
Efekty cieplne reakcji zależą od:
- temperatury (dosyć istotnie)
- ciśnienia (niezbyt istotnie)
- zaawansowania reakcji
- stężeń reagentów
- stanu skupienia reagentów (bardzo
istotnie)
Stechiometryczne
ilości substratów
w stanach
standardowych
Stechiometryczne
ilości produktów w
stanach
standardowych
T,P = const;
= 1

11
Efekty cieplne przemian - standaryzacja
...
Definicje stanów standardowych
reagentów (IUPAC).
Stan standardowy
reagenta:
1) gazowego - czysta substancja w u
doskonałego pod ciśnieniem P
o
= 100 kPa
(1 bar - dokładnie)
2) ciekłego lub stałego - czysta substancja
pod podanym ciśnieniem
3) składnika roztworu ciekłego
3a) czysta substancja pod podanym
ciśnieniem
3b) fikcyjny roztwór doskonały w sensie
prawa
Henry’ego o stężeniu 1mol/kg rozp.
UWAGA: Stan standardowy dotyczy zawsze
podanej temperatury (eksperymentu) -
standardowe funkcje reakcji są więc
funkcjami wyłącznie temperatury.

12
Standardowa entalpia reakcji -
przykłady ...
H
2(g)
+ 1/2 O
2(g)
=
H
2
O
(c)
r
H
o
(298,15 K) = -286,02
kJmol
-1
H
2(g)
+ 1/2 O
2(g)
=
H
2
O
(g)
r
H
o
(298,15 K) = -241,99
kJmol
-1
1a) Stan skupienia
reagenta:
1b) Stan skupienia
reagenta:
HCl
(g)
+ NaOH
(s)
= NaCl
(s)
+ H
2
O
(c)
r
H
o
(298,15 K) = -177,88
kJmol
-1
HCl
(g)
+ NaOH
(aq)
= NaCl
(aq)
+ H
2
O
(c)
r
H
o
(298,15 K) = -131,13
kJmol
-1
HCl
(aq)
+ NaOH
(aq)
= NaCl
(aq)
+ H
2
O
(c)
r
H
o
(298,15 K) = -55,93
kJmol
-1

13
Standardowa entalpia reakcji -
przykłady ...
N
2(g)
+ 3 H
2(g)
= 2
NH
3(g)
r
H
o
(298,15 K) = -91,44
kJmol
-1
r
H
o
(500,00 K) = -99,39
kJmol
-1
2) Wpływ temperatury:
3) Zapis równania
stechiometrycznego:
N
2(g)
+ 3 H
2(g)
= 2
NH
3(g)
r
H
o
(298,15 K) = -91,44
kJmol
-1
1/2N
2(g)
+ 3/2 H
2(g)
=
NH
3(g)
r
H
o
(298,15 K) = -45,72
kJmol
-1
14
Standardowa entalpia reakcji ...
Związek z rzeczywistym efektem
cieplnym H...
Substraty w
stanach
standardowych
(T,P
o
)
Produkty w
stanach
standardowych
(T,P
o
)
Rzeczywiste
czyste substraty
(T,P)
Rzeczywiste
czyste produkty
(T,P)
Mieszanina
reagentów przed
reakcją (T,P)
Mieszanina
reagentów po
reakcji (T,P)
r
H =
r
H
o
+ (H
3
- H
1
) + (H
4
- H
2
)
r
H
o
r
H
H
2
H
1
H
4
H
3

15
Standardowa entalpia reakcji ...
Związek z rzeczywistym efektem
cieplnym
r
H...
1) Wpływ ciśnienia na entalpię gazów i faz
skondensowanych jest niezbyt istotny
2) Entalpie residualne gazów w zakresie
umiarkowanych ciśnień są niewielkie w
porównaniu H reakcji
3) Entalpie mieszania nieelektrolitów są
rzędu 1 kJ/mol
Wniosek:
H reakcji prowadzonych pod
umiarkowanymi ciśnieniami wyłącznie z
udziałem reagentów stanowiących fazy
czyste, roztworów nieelektrolitów oraz
mieszanin reagentów gazowych jest
praktycznie równy H
o
16
Standardowa entalpia reakcji ...
Związek między
r
H
o
oraz
r
U
o
...
substr
o
i
i
o
substr
substr
o
i
i
o
substr
U
U
H
H
)
o
P
(T,
ych
standardow
stanach
w
Substraty
prod
o
i
i
o
prod
prod
o
i
i
o
prod
U
U
H
H
©
©
)
o
P
(T,
ych
standardow
stanach
Produkty w
r
H
o
,
r
U
o
T,P
o
=
const
substr
o
i
i
prod
o
i
i
o
substr
o
prod
o
r
H
H
H
H
H
'
substr
o
i
i
prod
o
i
i
o
substr
o
prod
o
r
U
U
U
U
U
'
(10
a)
(10
b)

17
Standardowa entalpia reakcji ...
Związek między H
o
oraz
U
o
...
(1
1)
(12
)
V
P
U
V
P
U
U
V
P
U
V
P
U
H
r
o
o
r
substr
r
o
o
i
i
prod
o
i
i
substr
o
o
i
i
prod
i
o
o
i
i
o
r
'
'
substr
i
i
prod
i
i
r
V
V
V
'
Wobec V
gaz
>>
V
skond
o
g
r
gazowe
substr
i
i
gazowe
prod
i
i
r
P
RT
V
V
V
'
RT
U
H
g
o
o
(13
)

18
15.3. Tablice
standardowych efektów
cieplnych reakcji -
prawo Hessa
Wykład 15

19
Tablice efektów cieplnych - prawo
Hessa ...
Bezpośredni pomiar efektów cieplnych
reakcji - kalorymetria...
Wymagania:
1. Selektywność - w układzie powinna
jedna reakcja w myśl znanego równania
stechiometrycznego
2. Szybkość - umiarkowana
3. Nieodwracalność - przebieg aż do
wyczerpania się substratu nie wziętego
w nadmiarze.
Warunki te spełniają reakcje:
1. spalania (w tlenie lub fluorze)
2. uwodarniania
3. jonowe (na ogół)
4. inne...
20
Tablice efektów cieplnych - prawo
Hessa ...
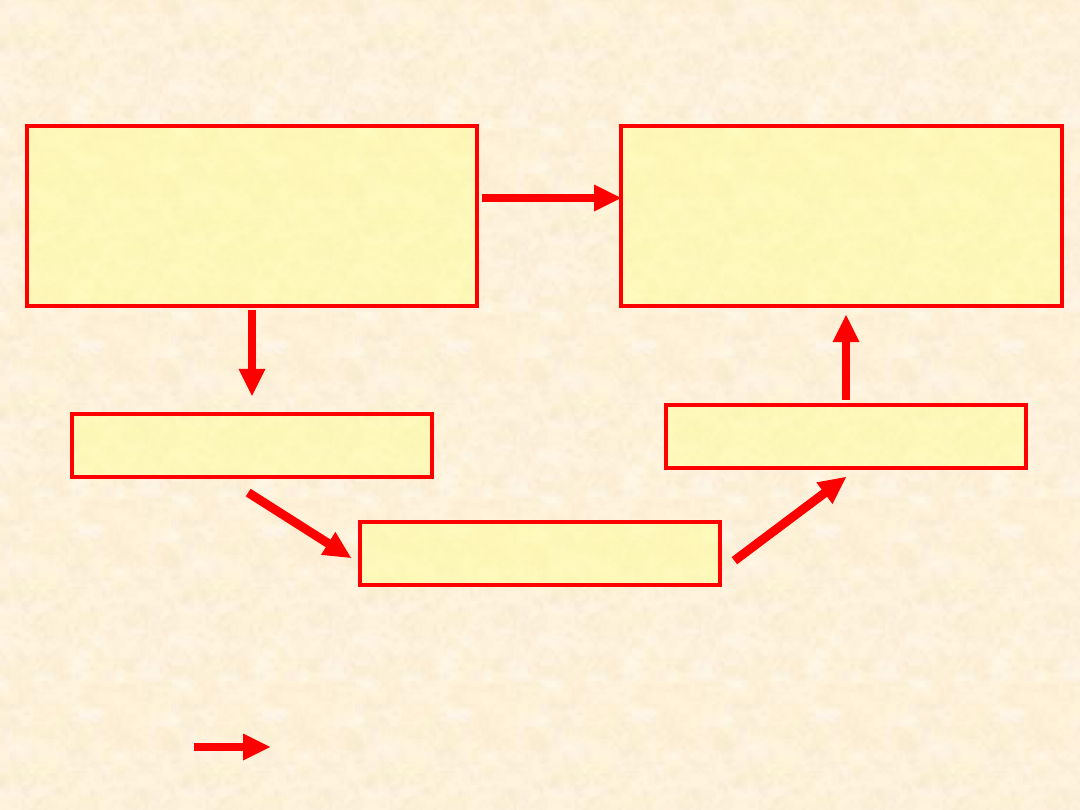
Pośrednie wyznaczenie efektu cieplnego
reakcji ...
Stan początkowy
substraty
[reagenty
pomocnicze]
r
H
x
= H
1
+ H
2
+ H
3
+
H
4
+ ....
r
H
x
H
1
Stan końcowy
produkty
[reagenty
pomocnicze]
Stan pośredni
I
Stan pośredni
II
Stan pośredni
III
H
3
H
3
H
4
P=con
st
r
U
x
= U
1
+ U
2
+ U
3
+
U
4
+ ....
V=con
st
21
Tablice efektów cieplnych ...
Standardowa entalpia
tworzenia ...
tw
H
o
(T
)
T, P
o
=const
Ilości
stechiometryczne
substancji
prostych w
odmianach
termodynamicznie
trwałych w stanach
standardowych
1 mol substancji
(produktu) w
stanie
standardowym
Przykłady „reakcji
tworzenia”...
g
4
g
2
grafit
CH
H
2
C
1
o
tw
mol
kJ
74,90
K
298,15
H
Δ
(c)
3
2(g)
2
1
g
2
grafit
OH
CH
O
H
2
C
1
o
tw
mol
kJ
57
238
K
298,15
H
Δ
,

22
Tablice efektów cieplnych ...
Przykłady „reakcji
tworzenia”...
g
g
2
2
1
g
2
2
1
HI
H
I
1
o
tw
mol
kJ
65
5
K
500,0
H
Δ
,
c
2
g
2
2
1
g
2
O
H
O
H
1
o
tw
mol
kJ
02
286
K
298,15
H
Δ
,
g
2
g
2
2
1
g
2
O
H
O
H
1
o
tw
mol
kJ
99
241
K
298,15
H
Δ
,
g
g
2
2
1
S
2
2
1
HI
H
I
1
o
tw
mol
kJ
38
26
K
298,15
H
Δ
,

23
Tablice efektów cieplnych ...
Przykłady „reakcji
tworzenia”...
c
4
2
g
2
rombowa
g
2
SO
H
2O
S
H
1
o
tw
mol
kJ
40
801
K
298,15
H
Δ
,
aq
4
2
g
2
rombowa
g
2
SO
H
aq
2O
S
H
1
o
tw
mol
kJ
10
908
K
298,15
H
Δ
,
g
2
g
2
O
O
1
o
tw
mol
kJ
00
0
K
298,15
H
Δ
,
g
3
g
2
2
3
O
O
1
o
tw
mol
kJ
4
142
K
298,15
H
Δ
,
c
4
3
g
2
bialy
g
2
2
3
PO
H
2O
P
H
1
o
tw
mol
kJ
1
925
K
298,15
H
Δ
,
24
Tablice efektów cieplnych ...
Wykorzystanie
tw
H
o
...
ych
standardow
stanach
w
substratów
ryczne
stechiomet
Ilosci
m
2
2
1
1
m
S
S
S
ych
standardow
stanach
w
produktów
ryczne
stechiomet
Ilosci
n
2
2
1
1
n
P
P
P
r
H
o
ych
standardow
stanach
w
trwalych
icznie
termodynam
odmianach
w
proste
Substancje
substraty
o
i
tw
i
H
produkty
o
i
tw
i
H
substraty
o
i
tw
i
produkty
o
i
tw
i
o
r
H
H
H
reagenty
o
i
tw
i
o
r
H
H
(14a)
(14b)
25
Tablice efektów cieplnych ...
Standardowa entalpia
spalania ...
spal
H
o
(
T)
T, P
o
=const
1 mol substancji
spalanej +
stechiometryczna
ilość ditlenu w
stanach
standardowych
Produkty spalania
w stanach
standardowych
(H
2
O
(c)
, CO
2(g)
,
N
2(g)
....)
26
Tablice efektów cieplnych ...
Wykorzystanie
spal
H
o
...
ych
standardow
stanach
w
substratów
ryczne
stechiomet
Ilosci
m
2
2
1
1
m
S
S
S
ych
standardow
stanach
w
produktów
ryczne
stechiomet
Ilosci
n
2
2
1
1
n
P
P
P
r
H
o
ych
standardow
stanach
w
spalania
Produkty
substraty
o
i
spal
i
H
produkty
o
i
spal
i
H
produkty
o
i
spal
i
substraty
o
i
spal
i
o
r
H
H
H
reagenty
o
i
spal
i
o
r
H
H
(15a)
(15b)

27
15.4. Wpływ
temperatury na
standardowy efekt
cieplny reakcji - prawo
Kirchhoffa
Wykład 15
28
Prawo Kirchhoffa (P
o
=const) ...
substraty
o
i
i
produkty
o
i
i
o
r
T
H
T
H
T
H
(16
)
substraty
P
o
i
i
produkty
P
o
i
i
P
o
r
T
T
H
T
T
H
T
T
H
(17
)
T
C
T
T
H
o
P
P
o
r
substraty
o
i
P
i
produkty
o
i
P
i
o
P
r
T
C
T
C
T
C
,
,
reagenty
o
i
P
i
o
P
r
T
C
T
C
,
(18
)
Standardowa pojemność cieplna
reakcji:
(19
a)
(19
b)
29
Prawo Kirchhoffa (P
o
=const) ...
Przykład wzoru
roboczego :
(20
)
3
2
1
1
K
T
d
K
T
c
K
T
b
a
K
mol
J
T
C
r
r
r
r
o
P
r
Gdzie
:
.....
..........
reagenty
i
i
r
reagenty
i
i
r
d
d
a
a
(21
)
4
0
4
1
3
0
3
1
2
0
2
1
0
1
0
1
4
3
2
1
0
T
T
d
T
T
c
T
T
b
T
T
a
T
H
dT
T
C
T
H
r
r
r
r
o
r
T
T
P
r
o
r
Warunek: ciągłość C
P
(T) - brak przemian
fazowych
30
H
o
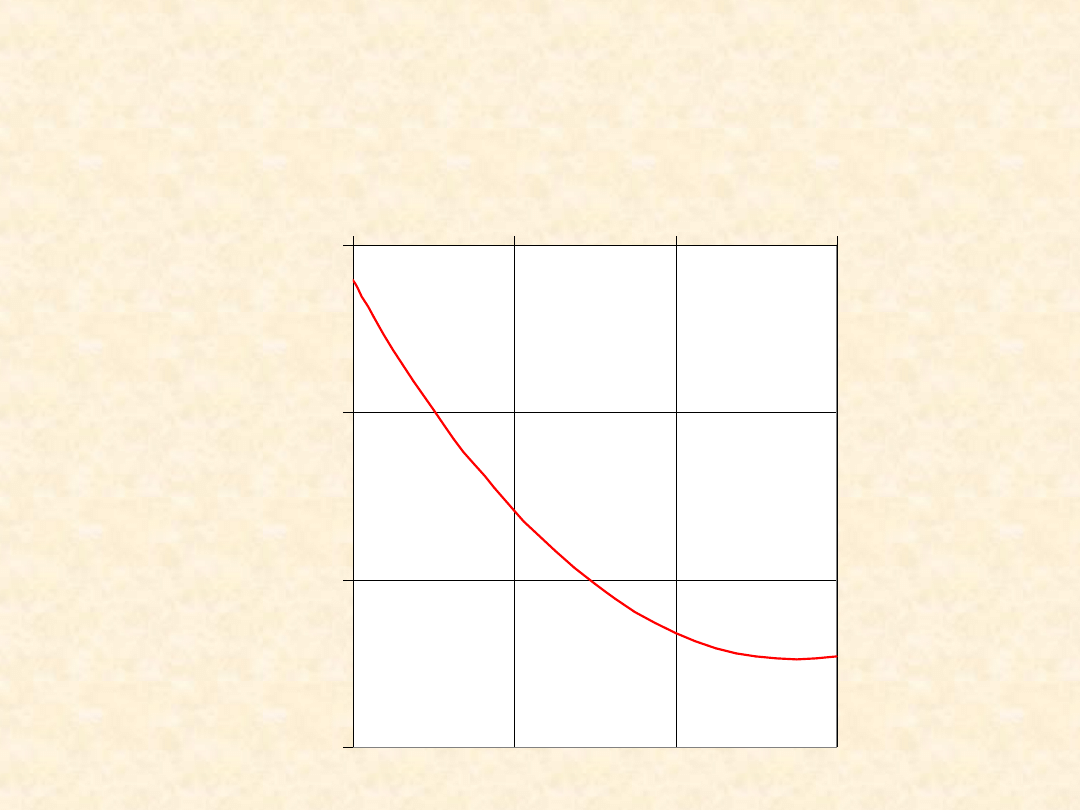
(T): N
2(g)
+ 3H
2(g)
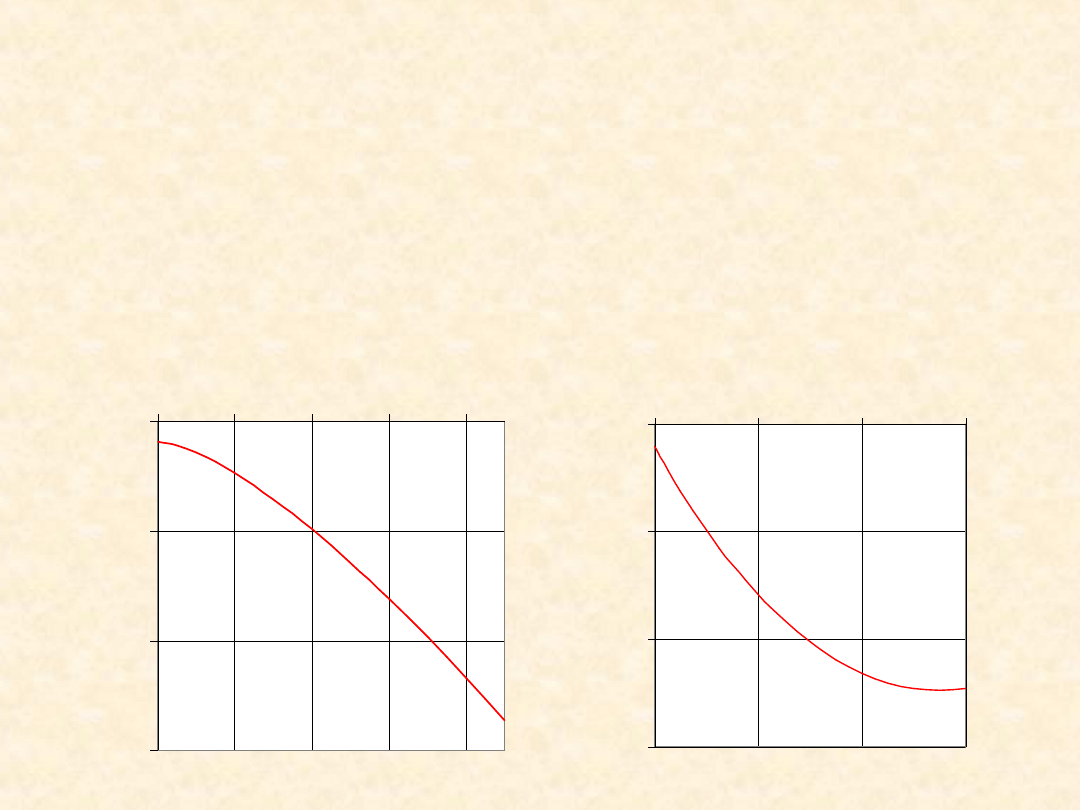
= 2 NH
3(g)
-120
-110
-100
-90
3
0
0
7
0
0
1
1
0
0
1
5
0
0
T/K
0
/(
k
J/
m
o
l)
31
H
o
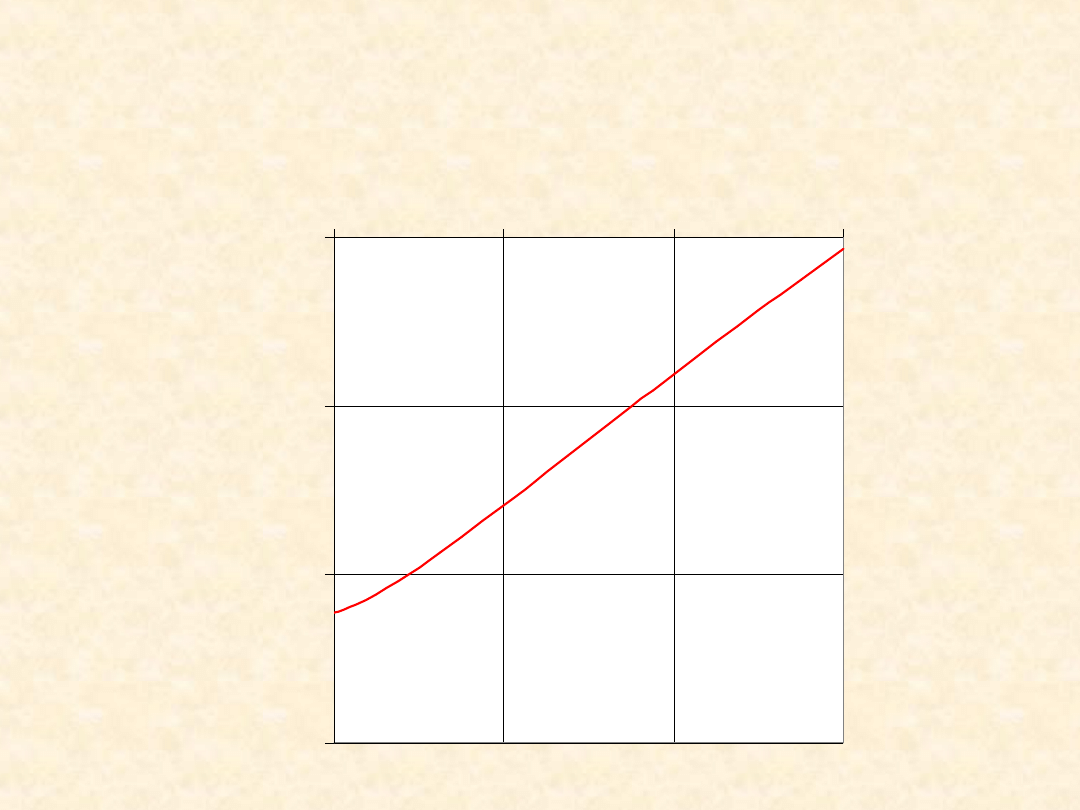
(T): CO
(g)
+ H
2
O
(g)
= CO
2(g)
+
H
2(g)
-45
-40
-35
-30
3
0
0
7
0
0
1
1
0
0
1
5
0
0
T/K
H
0
/(
k
J/
m
o
l)
32
H
o
(T): CaCO
3(s)
= CaO
(s)
+ CO
2(g)
165
170
175
180
3
0
0
5
0
0
7
0
0
9
0
0
1
1
0
0
T/K
H
0
/(
k
J/
m
o
l)
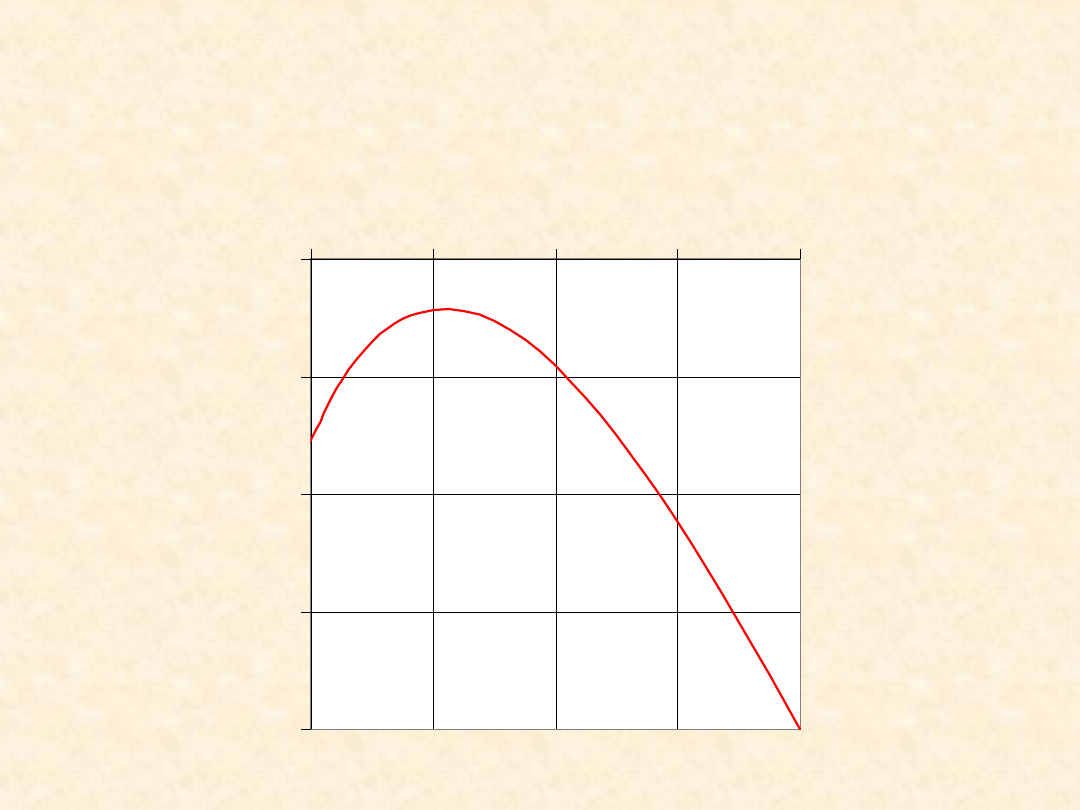
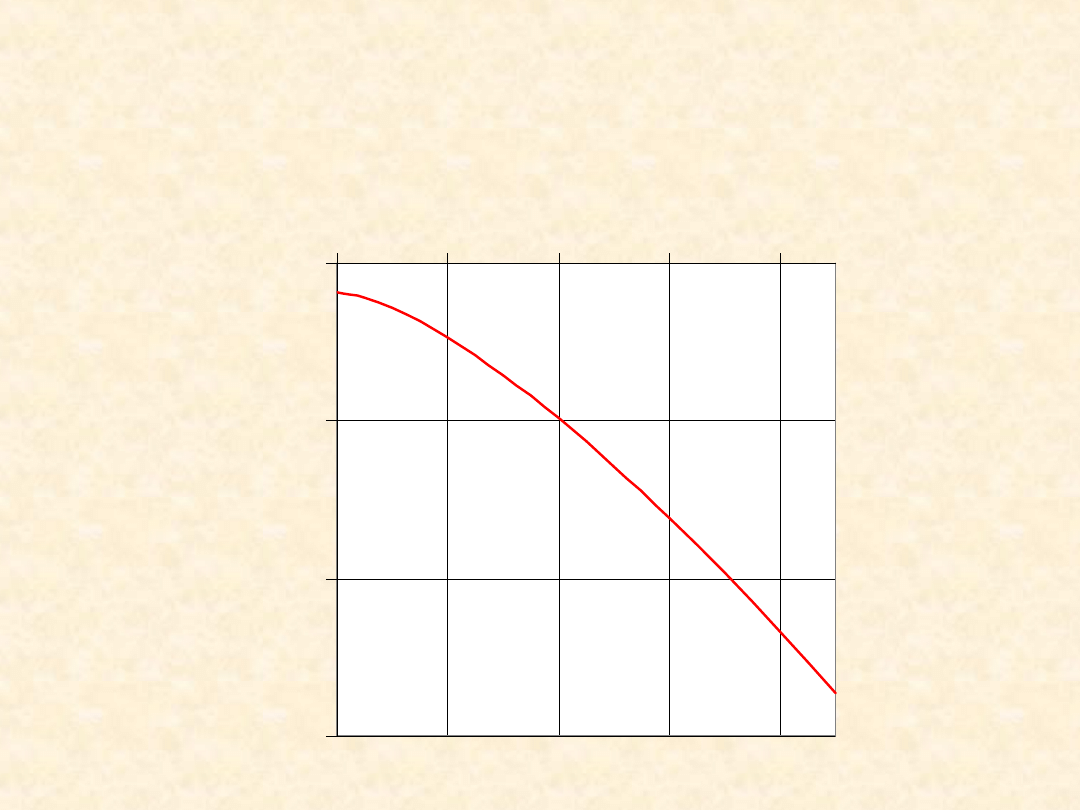
33
H
o
(T): C
(s)
+ CO
2(g)
= 2 CO
(g)
170
171
172
173
174
3
0
0
5
0
0
7
0
0
9
0
0
1
1
0
0
T/K
H
0
/(
k
J/
m
o
l)

34
15.5. Termochemiczne
właściwości substancji
organicznych
Wykład 15

35
Termochemiczne właściwości
substancji...
Wielkości makroskopowe:
1)
konstytutywne
- zależne od natury
wiązań (grup atomów) oraz ich
wzajemnego usytuowania
2)
addytywne
- jednakowym elementom
(atomom, wiązaniom, grupom) przypisuje
się udział niezależny od natury elementów
sąsiednich.
Analiza korelacyjna korelacje
- wiążą właściwości fizykochemiczne
substancji ze strukturą drobin
- umożliwiają szacowanie właściwości
fizykochemicznych substancji na
podstawie założonej rzeczywistej lub
domniemanej struktury drobin.
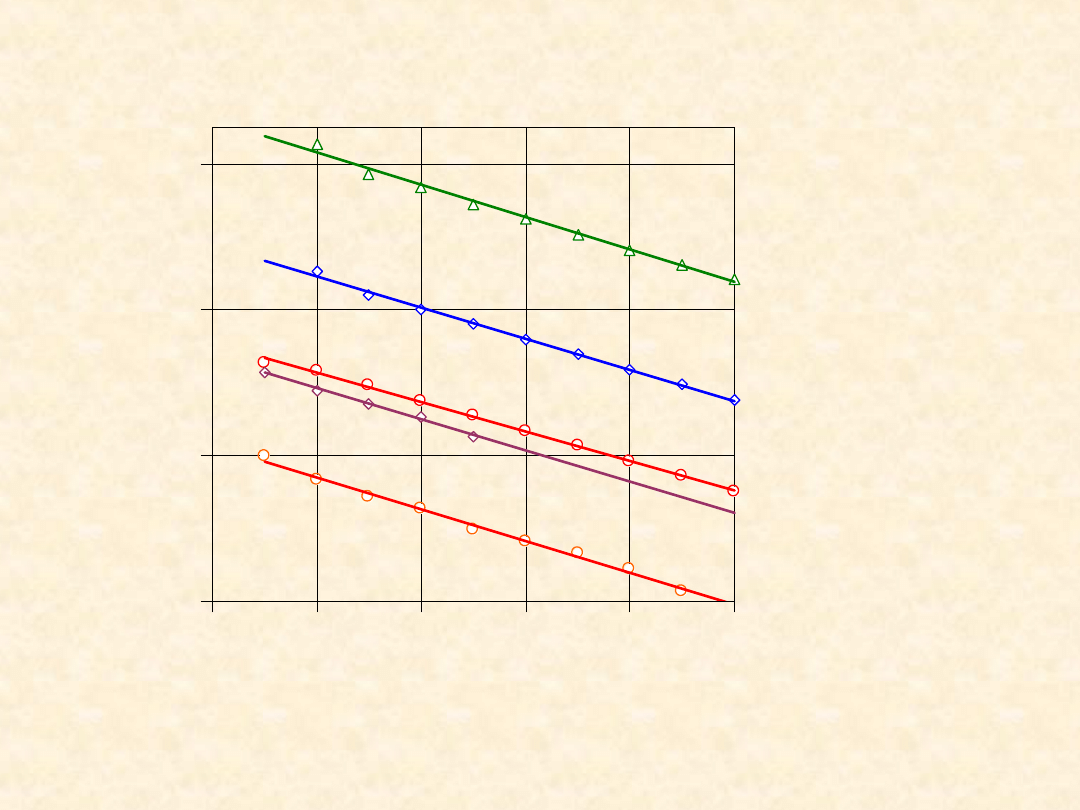
36
Termochemiczne właściwości
substancji...
tw
H
o
(298,2
K)
1) n-
alkany
2) 1,n-
alkeny
3) 1,n-
alkiny
4) 1,n-
alkanole
5) 1,n-R-Cl
-400
-200
0
200
0
2
4
6
8
10
Liczba atomów węgla
tw
H
o
/(
J/
m
o
l
K
)
1
2
3
4
5
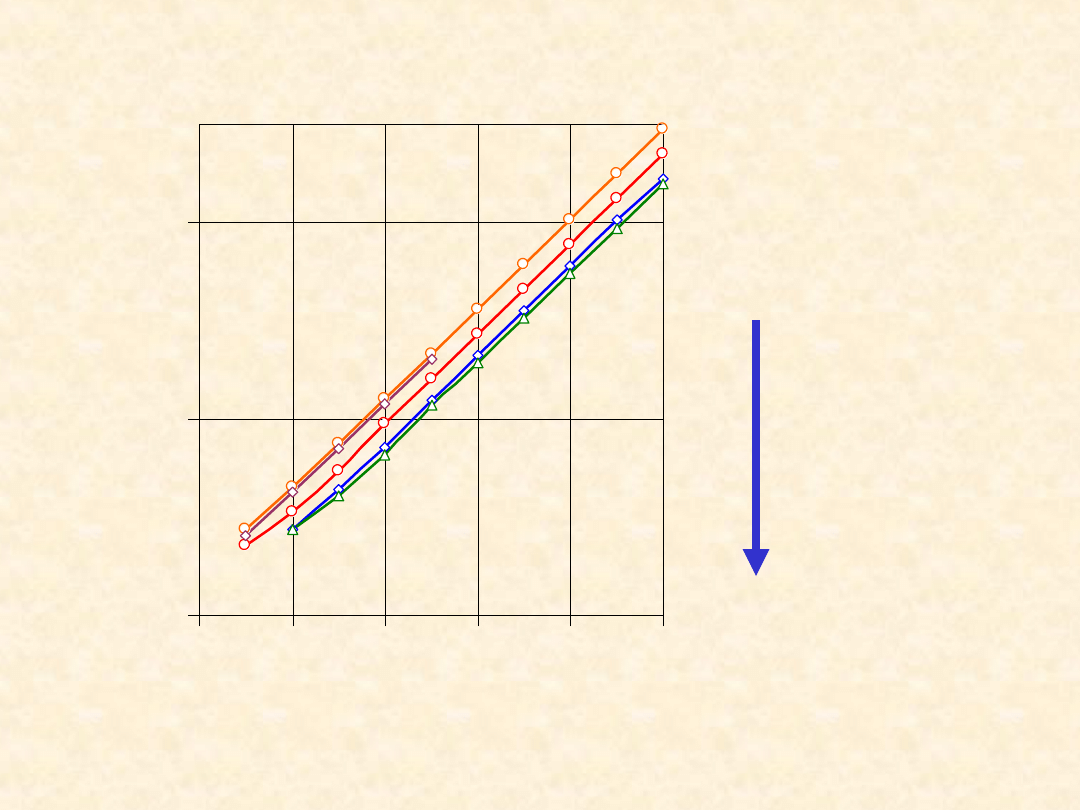
37
Termochemiczne właściwości
substancji...
C
P
o
(298,2K
)
1,n-
alkanole
1,n-R-Cl
n-alkany
1,n-alkeny
1,n-alkiny
0
100
200
0
2
4
6
8
10
Liczba atomów węgla
C
o
p
/(
J/
m
o
l
K
)
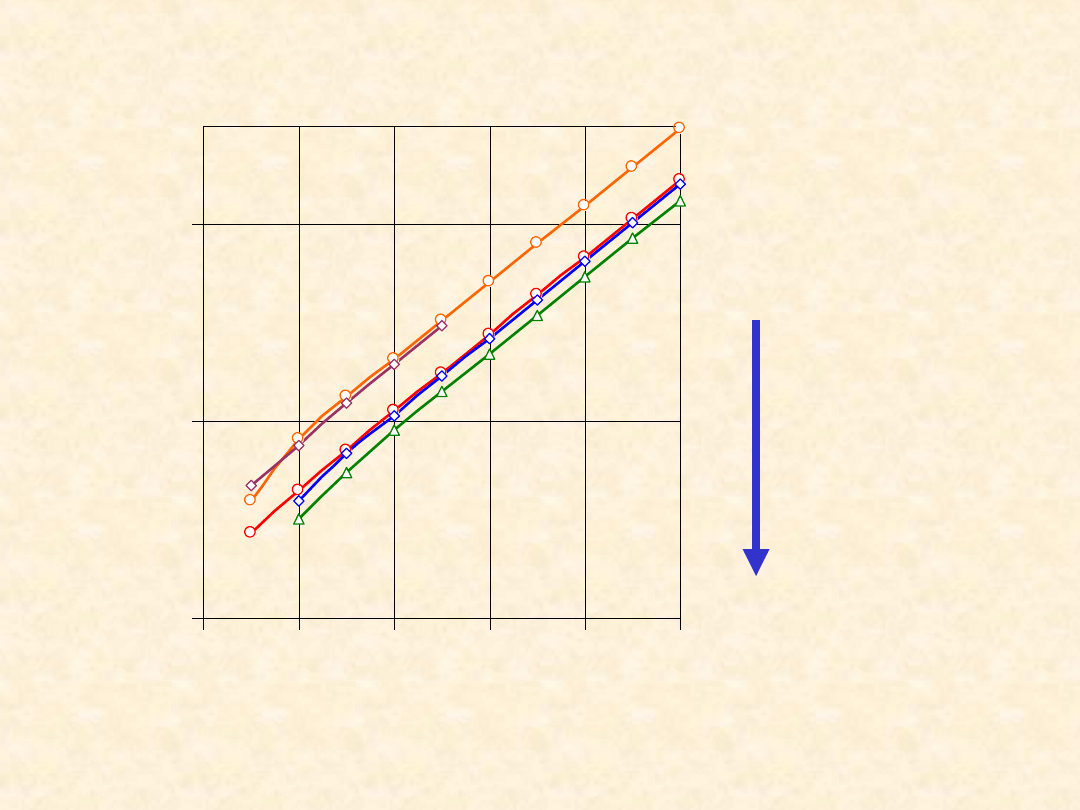
38
Termochemiczne właściwości
substancji...
S
o
(298,2K)
1,n-
alkanole
1,n-R-Cl
n-alkany
1,n-alkeny
1,n-alkiny
100
300
500
0
2
4
6
8
10
Liczba atomów węgla
S
o
/(
J/
m
o
l
K
)

39
Termochemiczne właściwości
substancji...
Wnioski:
1) Opisane funkcje termodynamiczne
gazowych związków alifatycznych są z
dosyć dobrym przybliżeniem wielkościami
addytywnymi.
2) Atomom lub wiązaniom można
przypisać udziały - wartość odpowiedniej
funkcji szacuje się sumując udziały
(najprostsza jest korelacja Bensona)

40
Termochemiczne właściwości
substancji...
Termochemiczna energia wiązań:
1) Każdemu wiązaniu przypisuje się
określony udział w energii drobiny (1
mola swobodnych drobin)
2) Efekt energetyczny rozpadu 1 mola
substancji w stanie gazu doskonałego na
swobodne atomy jest równy sumie energii
wiązań (popularne tablice Ketelaara lub
Offermatta)
41
Wykorzystanie energii wiązań...
o
doskonaleg
gazu
stanie
w
substratów
ryczne
stechiomet
Ilosci
m
2
2
1
1
m
S
S
S
o
doskonaleg
gazu
stanie
w
produktów
ryczne
stechiomet
Ilosci
n
2
2
1
1
n
P
P
P
r
U
o
o
doskonaleg
gazu
stanie
Atomy w
substraty
i
i
E
n
produkty
i
i
substraty
i
i
o
r
E
n
E
n
U
(22a)
(22b)
Termochemiczne właściwości
substancji...
produkty
i
i
E
n
reagenty
i
i
o
r
E
n
U

42
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
chemia 15 2014
Chemia kosmetyczna 1 15
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Chemia fizyczna 15 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 15
Chemia fizyczna 15, chemia fizyczna, chemia, FIZYCZNA, 15, Ćwiczenie 15
Chemia kosmetyczna II Roszczenko 14 15
Ćwiczenie 15, Chemia fizyczna
Ćwiczenie Chemia 1 (11 10 – 15 10 2010 r )
wykladChK-15, Chemia UŁ, teoretyczna wykład
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Opis(15), Nauka, Chemia
Ch w10 15.12, Studia (Geologia,GZMIW UAM), I rok, Chemia
15.krzychu, Rok I, chemia fizyczna, chemia fizyczna-protokoły
okładka-sb lab 15, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
CHEMIA ŻYWNOŚCI 15
więcej podobnych podstron