
Wyk
Wyk
ł
ł
ad 15
ad 15
Aminy aktywne biologicznie - leki sulfamidowe
Aminy aktywne biologicznie - alkaloidy
Aminy aktywne biologicznie - katecholaminy
Aminokwasy
Zwi
ą
zki heterocykliczne
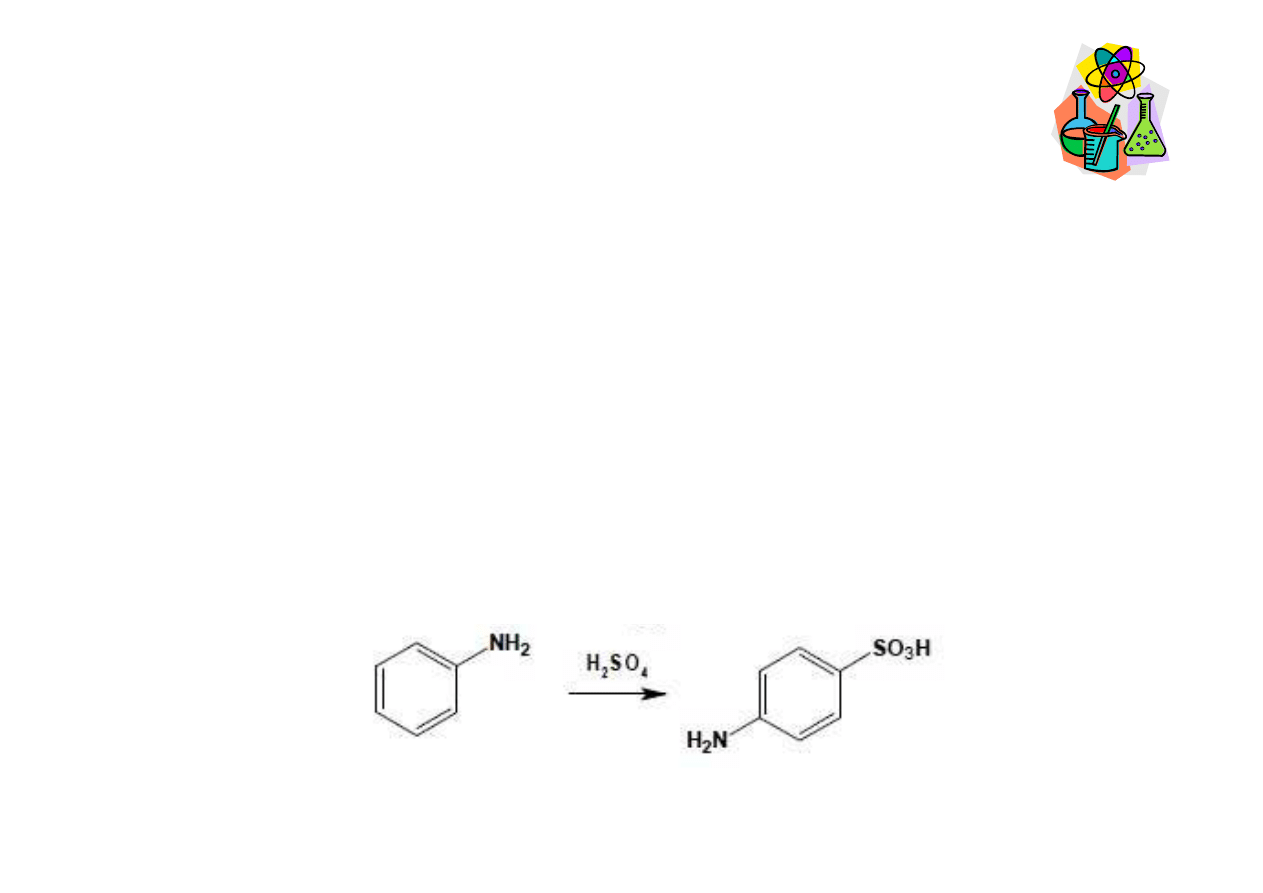
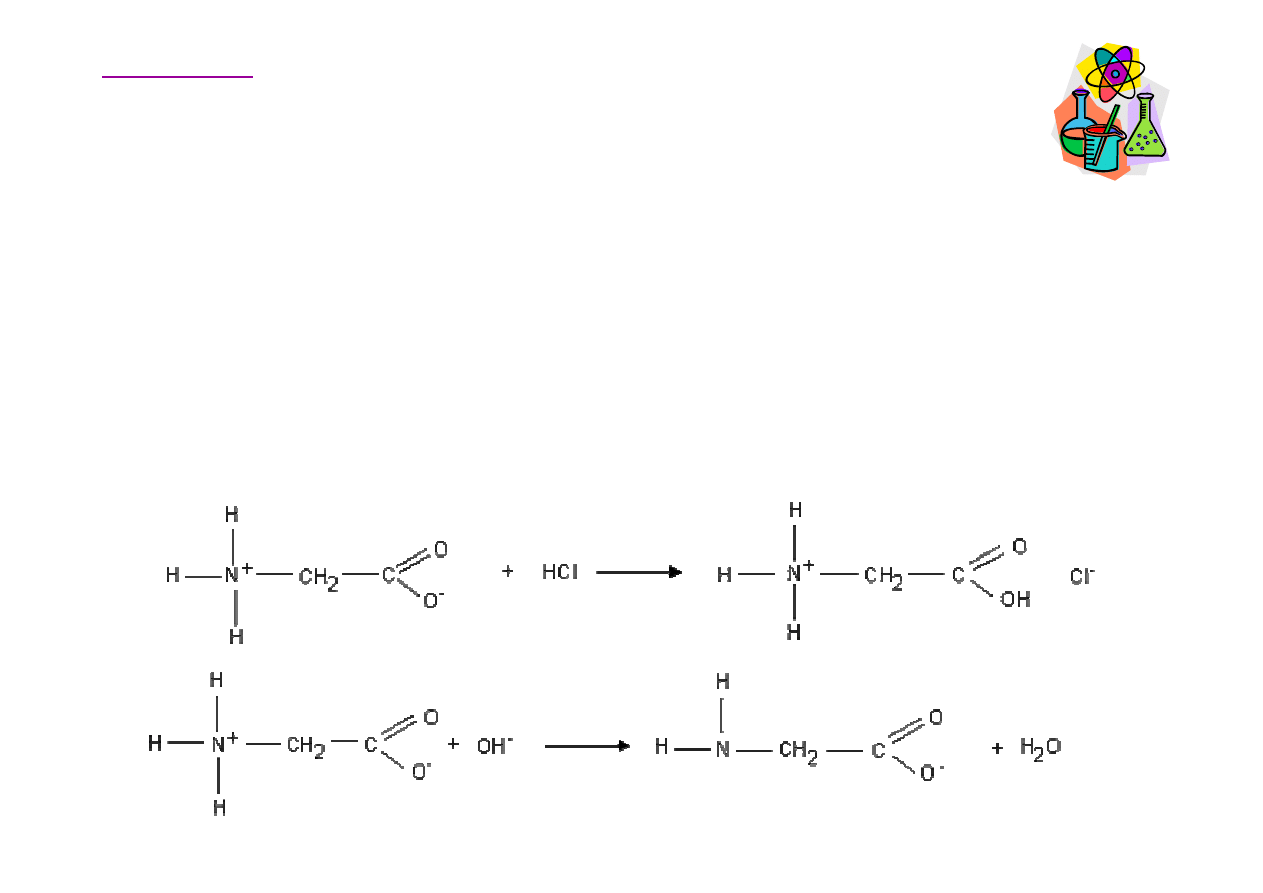
Sulfonowanie amin aromatycznych
Produkt sulfonowania aniliny otrzymuje si
ę
poprzez
pra
ż
enie jej soli – wodorosiarczanu anilinowego, w
temperaturze 180-220°C. G łównym produktem jest izomer
para, kwas sulfanilowy.
Aminy aktywne biologicznie
http://www.e-biotechnologia.pl/Artykuly/sulfonowanie-kwas-sulfanilowy
temp.
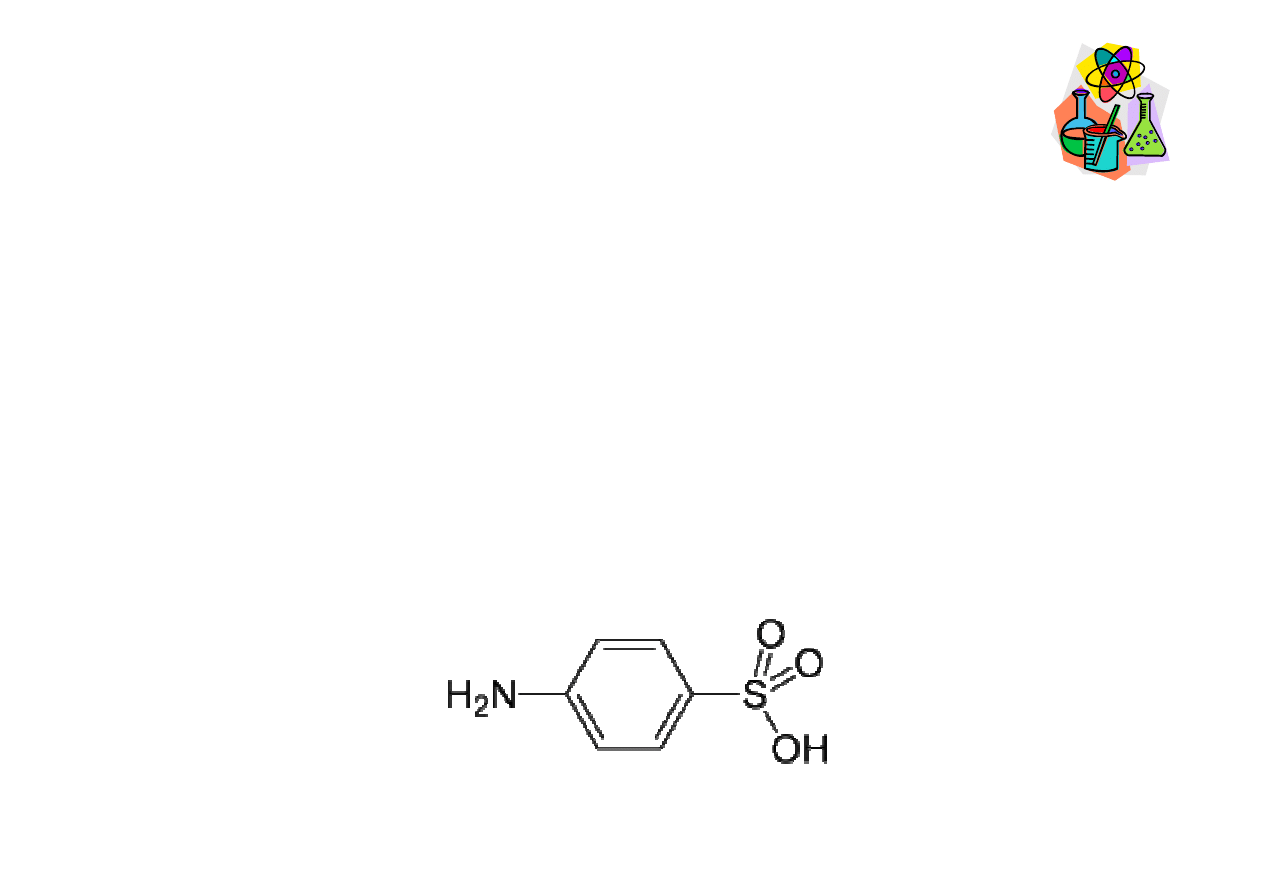
Sulfonowanie amin aromatycznych
Kwas sulfanilowy (kwas p-aminobenzenosulfonowy)
charakteryzuje si
ę
bardzo wysok
ą
temperatur
ą
topnienia (jak
na zwi
ą
zek aromatyczny, np. anilina -6 °C) (288°C) oraz
prawie nie rozpuszcza si
ę
w wodzie (podczas gdy grup
ę
sulfonow
ą
cz
ę
sto wprowadza si
ę
do cz
ą
steczek, aby zwi
ę
kszy
ć
ich rozpuszczalno
ść
w wodzie).
Aminy aktywne biologicznie
http://pl.wikipedia.org/wiki/Kwas_sulfanilowy
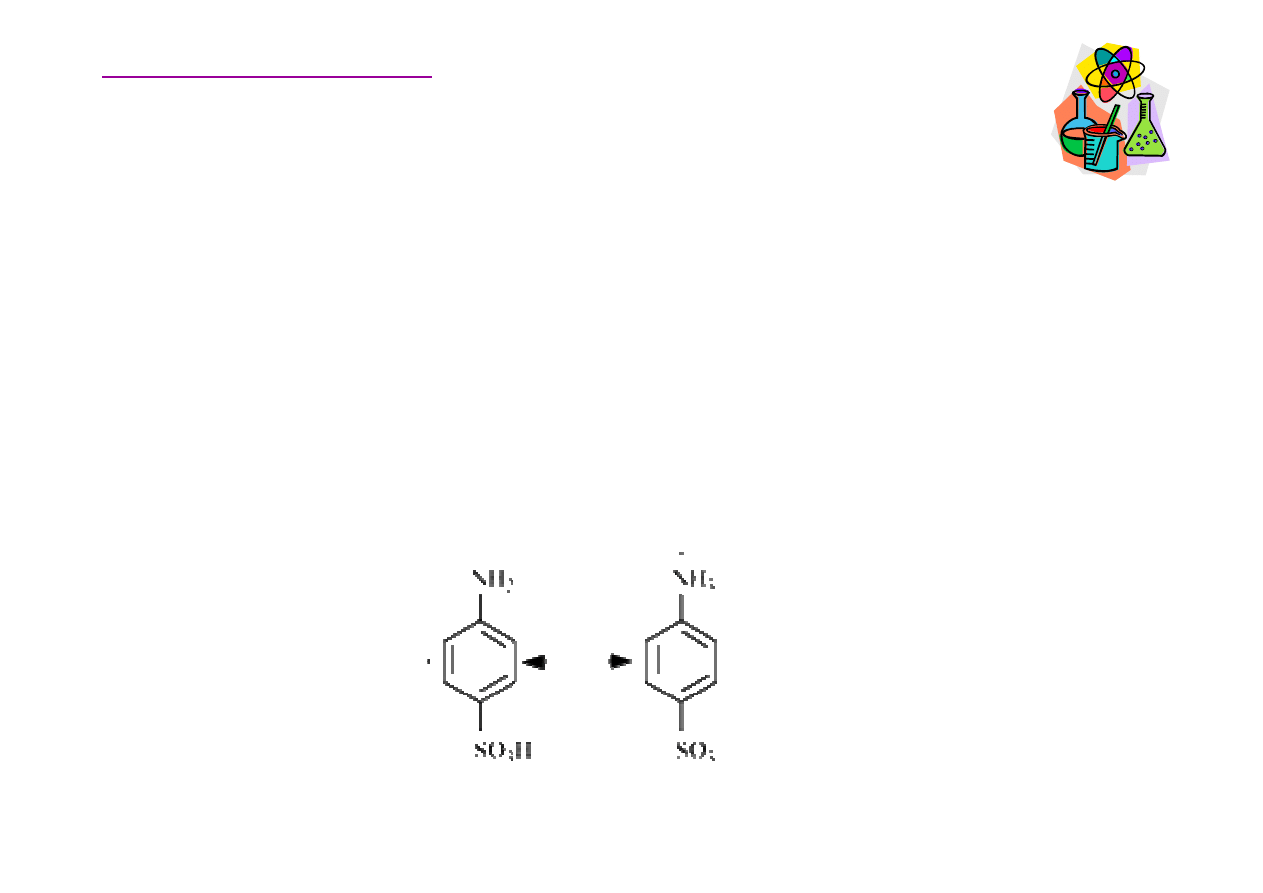
Sulfonowanie amin aromatycznych
W cz
ą
steczce kwasu sulfanilowego grupa kwasowa
przekazuje proton grupie aminowej, sama zyskuje ładunek
ujemny. Wynika to z tego,
ż
e grupa –NH
2
jest silniejsz
ą
zasad
ą
ni
ż
grupa SO
3
-
.
p-NH
2
-Ph-SO
3
H --> pNH
3
+
-Ph-SO
3
-
(Zwitterion)
Aminy aktywne biologicznie
www.meritnation.com
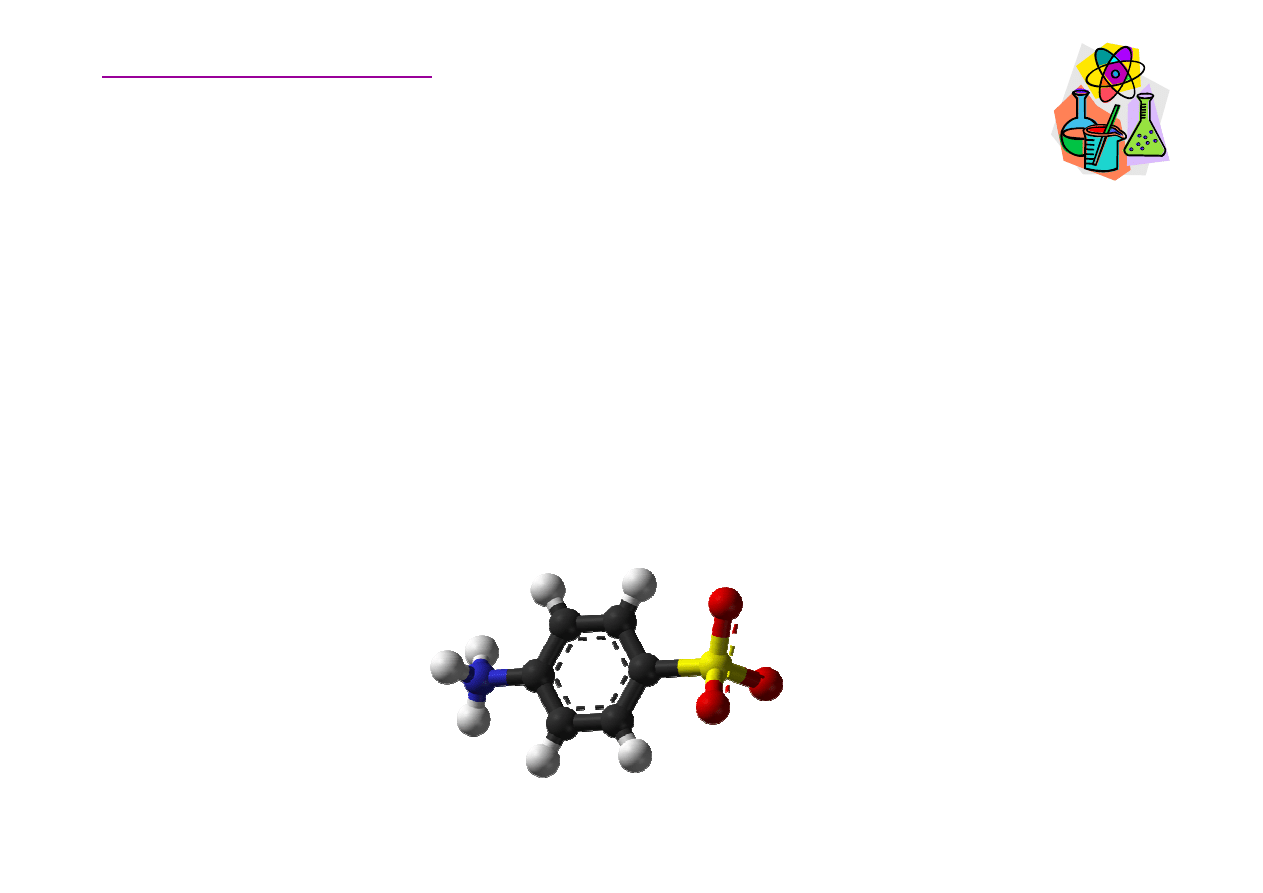
Sulfonowanie amin aromatycznych
Cz
ą
steczka kwasu sulfanilowego jest jonem obojnaczym
(niem. Zwitterion). Jon ten jest produktem reakcji mi
ę
dzy
dwiema grupami: kwasow
ą
i zasadow
ą
, które s
ą
fragmentami tej samej cz
ą
steczki.
p-NH
2
-Ph-SO
3
H --> pNH
3
+
-Ph-SO
3
-
(Zwitterion)
Aminy aktywne biologicznie
http://commons.wikimedia.org/wiki/File:Sulfanilic-acid-zwitterion-3D-balls-A.png

Sulfonowanie amin aromatycznych
Wysoka temperatura topnienia i słaba rozpuszczalno
ść
w
wodzie to charakterystyczne wła
ś
ciwo
ś
ci soli. W roztworze
zasadowym jon OH
-
odci
ą
ga proton od słabo zasadowej
grupy NH
2
i powstaje jon p-aminobenzenosulfonianowy (II)
rozpuszczalny w wodzie.
p-NH
3
+
-Ph-SO
3
-
+ OH
-
--> pNH
2
-Ph-SO
3
-
+ H
2
O
Aminy aktywne biologicznie
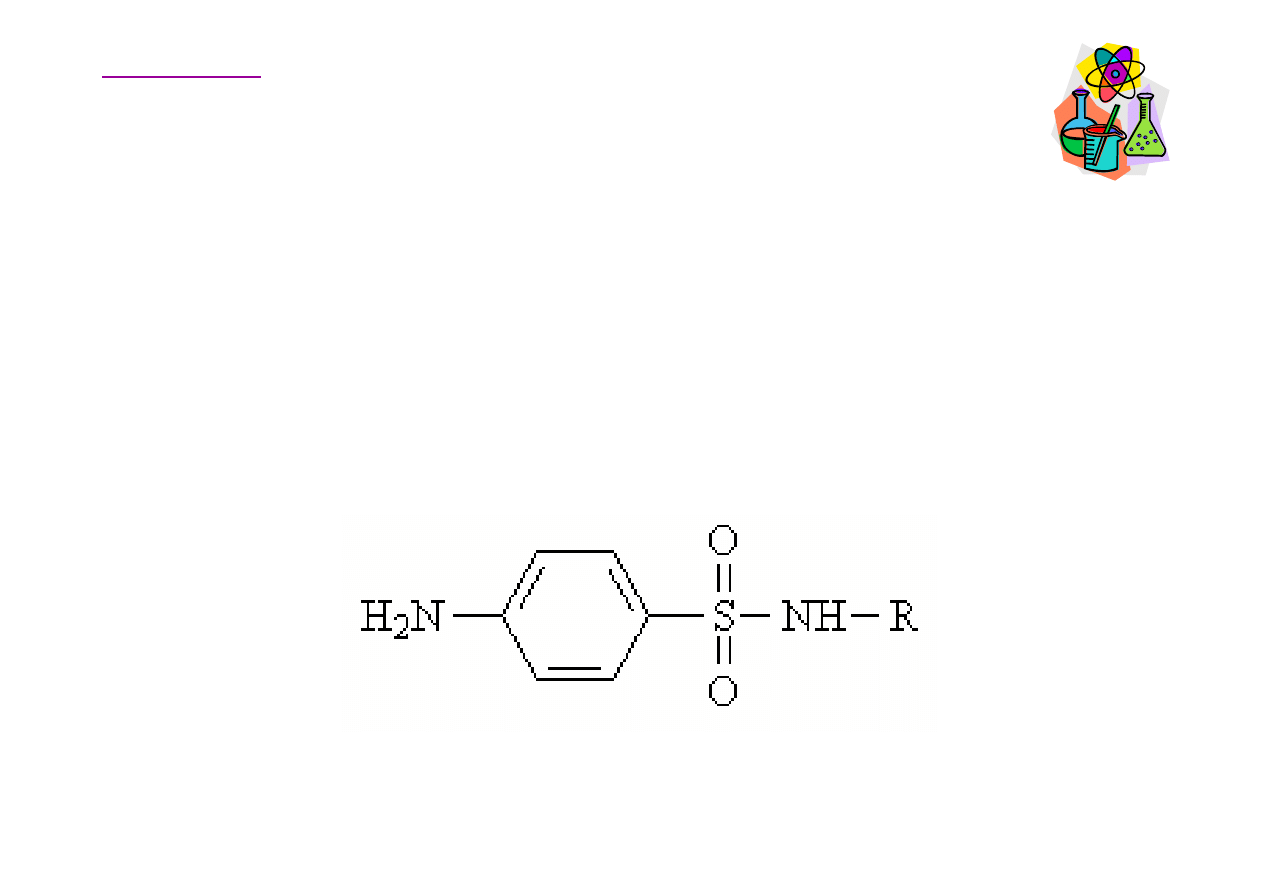
Leki sulfamidowe
Amid kwasu sulfanilowego (sulfanilamid) i niektóre jego
podstawione pochodne maj
ą
du
ż
e znaczenie w medycynie
jako leki sulfamidowe (sulfoamidy, sulfamidy) o działaniu
bakteriostatycznym.
Aminokwasy.
http://pl.wikipedia.org/wiki/Sulfonamidy
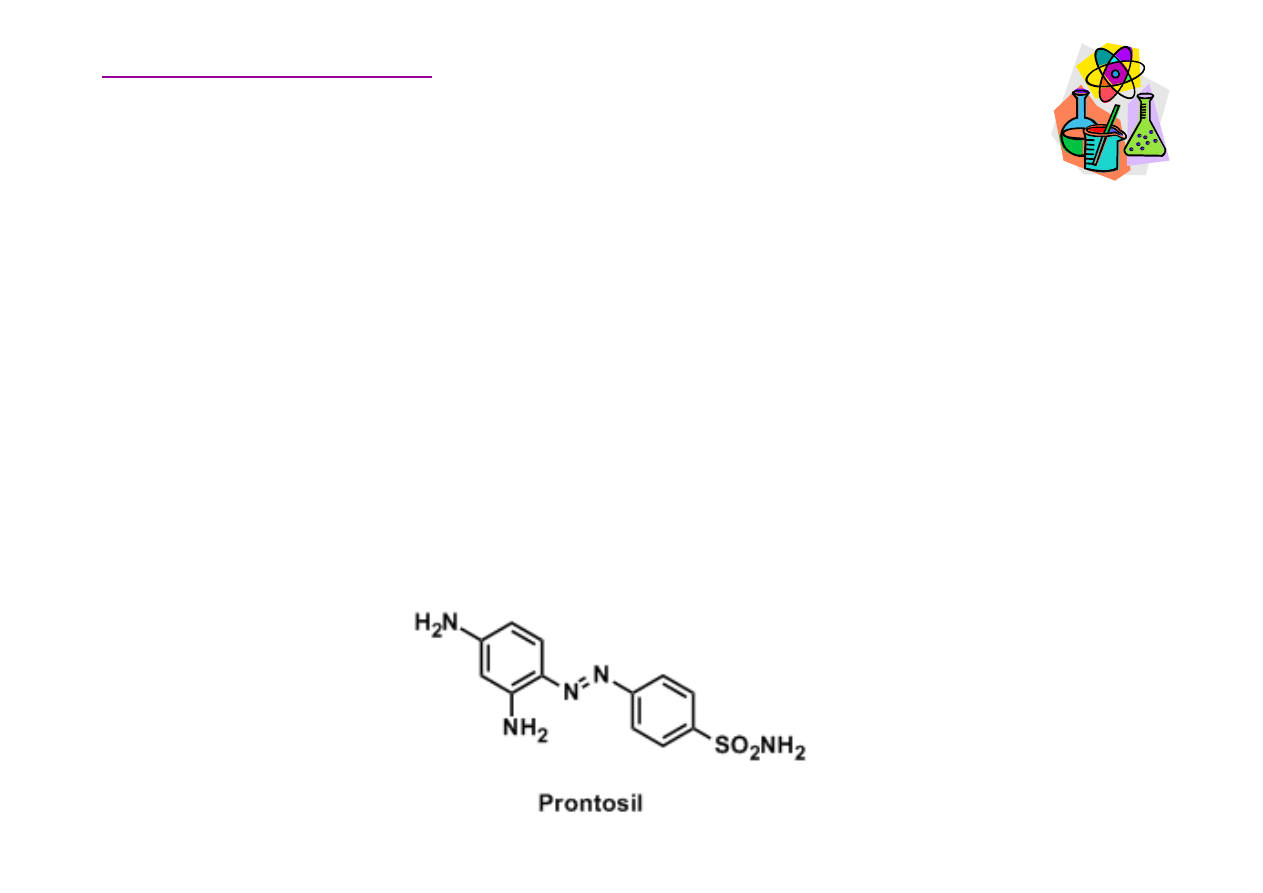
Leki sulfamidowe
Historycznie rzecz bior
ą
c Prontosil był pierwszym
antybiotykiem w ogóle i protoplast
ą
antybiotyków z rodziny
sulfonamidów. Lek ten został odkryty w roku 1932 przez
Gerharda Domagk’a (w laboratoriach firmy Bayer). W roku 1939
Domagk został uhonorowany Nagrod
ą
Nobla w dziedzinie
fizjologii i medycyny za odkrycie antybakteryjnych wła
ś
ciwo
ś
ci
Prontosilu.
Aminy aktywne biologicznie
http://www.newchemistry.eu/2009/01/11/prontosil-antybiotyk/
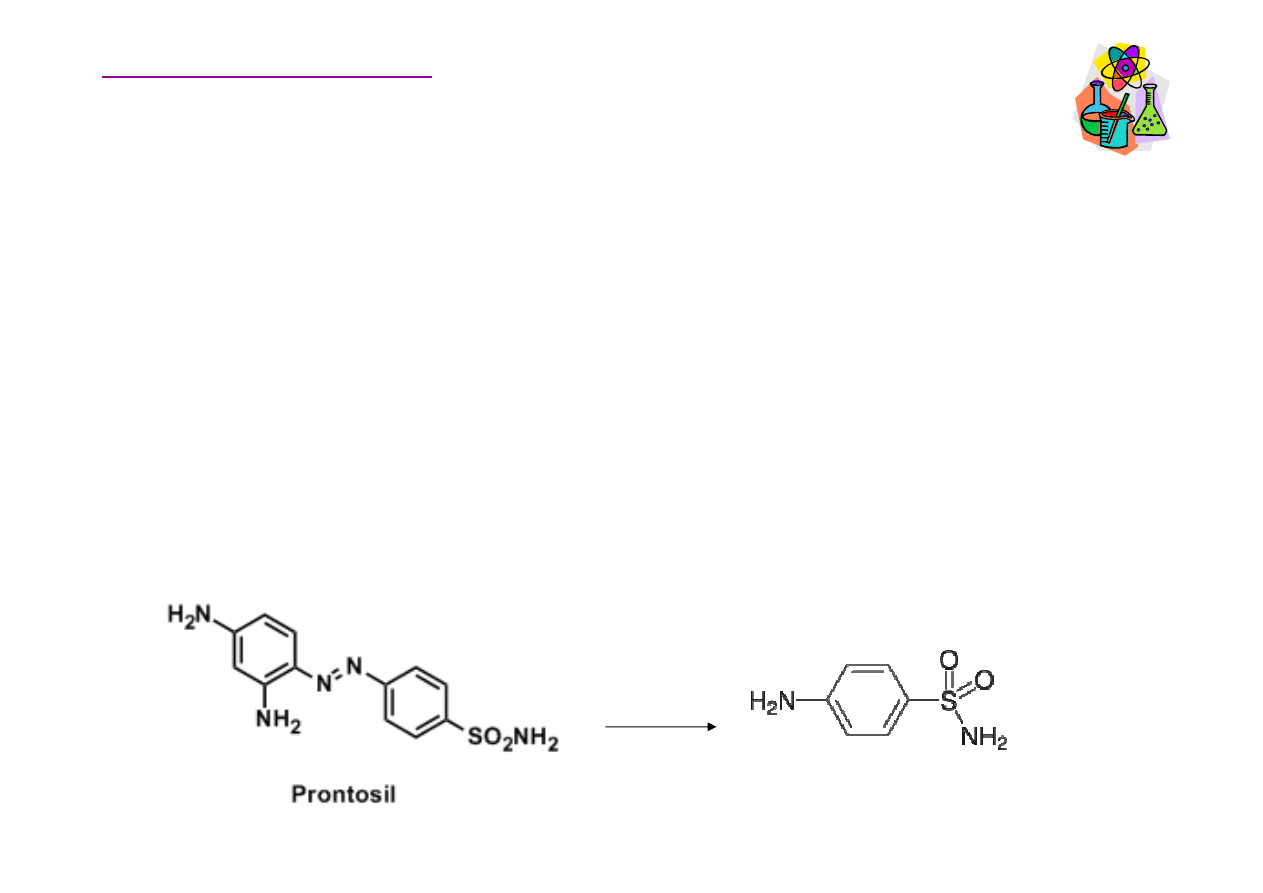
Leki sulfamidowe
W roku 1935, dr Ernest Fourneau i współpracownicy (w Instytucie
Pasteura w Pary
ż
u) odkryli,
ż
e Prontosil (czerwony barwnik azowy)
jest metabolizowany do sulfanilamidu (para-
aminobenzenosulfonamidu), du
ż
o prostszej, bezbarwnej cz
ą
steczki.
Dlatego Prontosil jest prolekiem - substancj
ą
nieaktywn
ą
lub słabo
aktywn
ą
biologicznie, która po przemianach metabolicznych in vivo
przekształca si
ę
w produkty o działaniu farmakologicznym.
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Sulfanilamide
http://www.newchemistry.eu/2009/01/11/prontosil-antybiotyk/
sulfanilamid
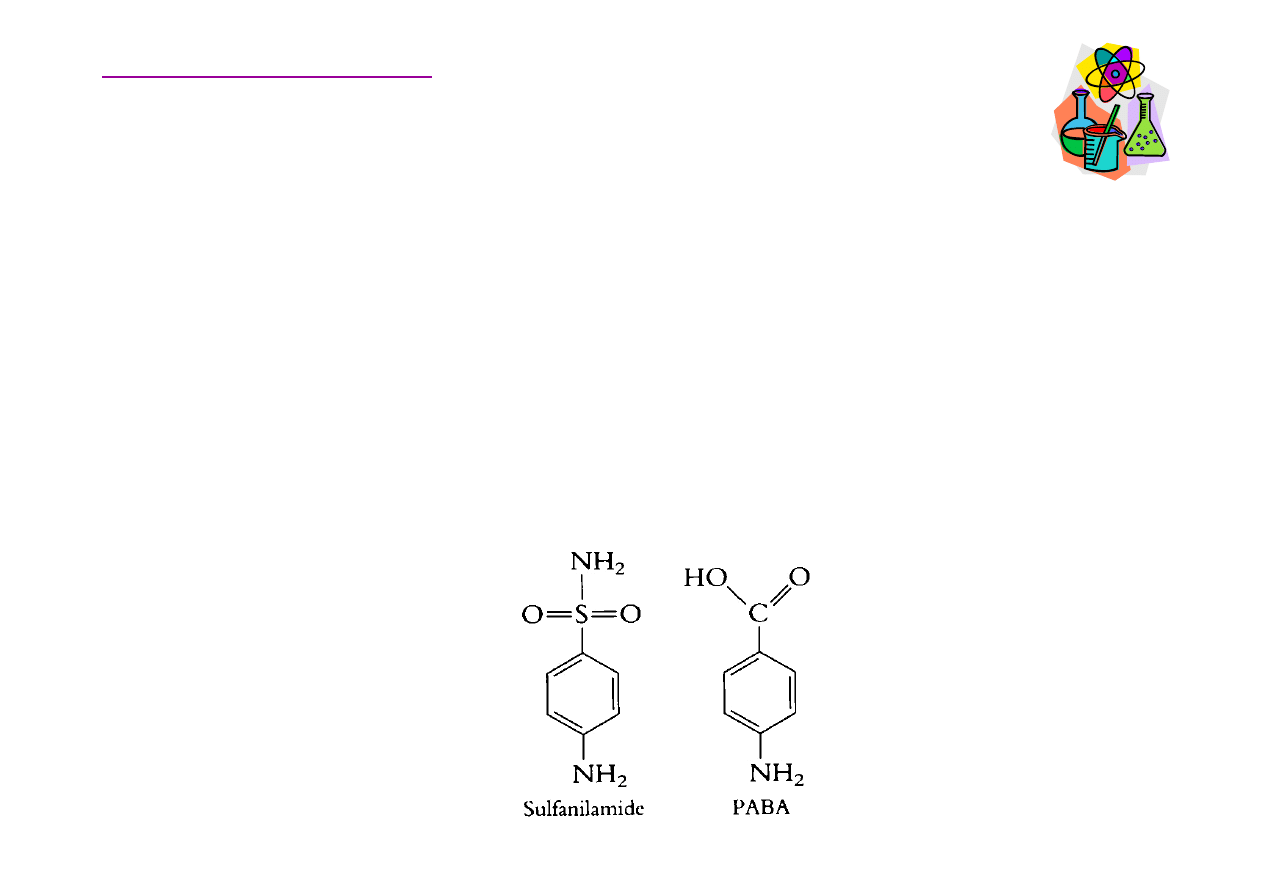
Leki sulfamidowe
Pomi
ę
dzy sulfanilamidem a kwasem p-aminobenzoesowym
(PABA) istnieje du
ż
e podobie
ń
stwo strukturalne. Te oba zwi
ą
zki
współzawodnicz
ą
w procesie syntezy kwasu foliowego. Dlatego
sulfonamidy maj
ą
działanie bakteriostatyczne, hamuj
ą
wzrost i
podziały bakterii, nie zabijaj
ą
ich. Ludzie, w przeciwie
ń
stwie do
bakterii, otrzymuj
ą
kwas foliowy w pokarmie.
Aminy aktywne biologicznie
http://www.life.umd.edu/classroom/bsci424/BSCI223WebSiteFiles/CompetitiveInhibitor.htm
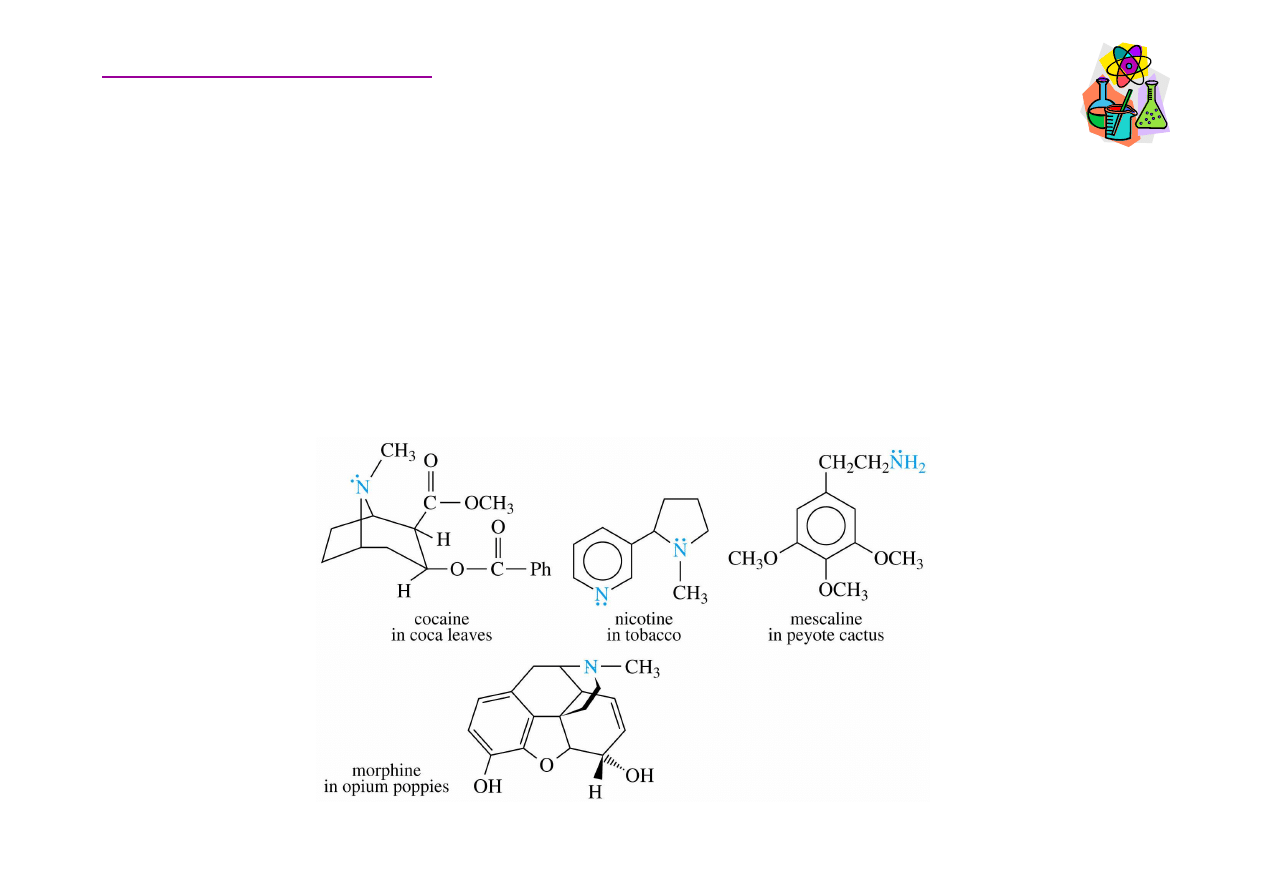
Alkaloidy
Biologicznie aktywne aminy pochodzenia ro
ś
linnego nazywamy alkaloidami
(nazwa nawi
ą
zuje do ich zasadowego charakteru). Alkaloidy podane
zwiarz
ę
tom wywołuj
ą
wiele ró
ż
ne fizjologiczne efekty. Wiele toksycznych
alkaloidów podawanych w odpowiednio małych dawkach stanowi skuteczne
leki na liczne choroby i dolegliwo
ś
ci (np. morfina, kodeina, chinina).
Aminy aktywne biologicznie
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch19.html
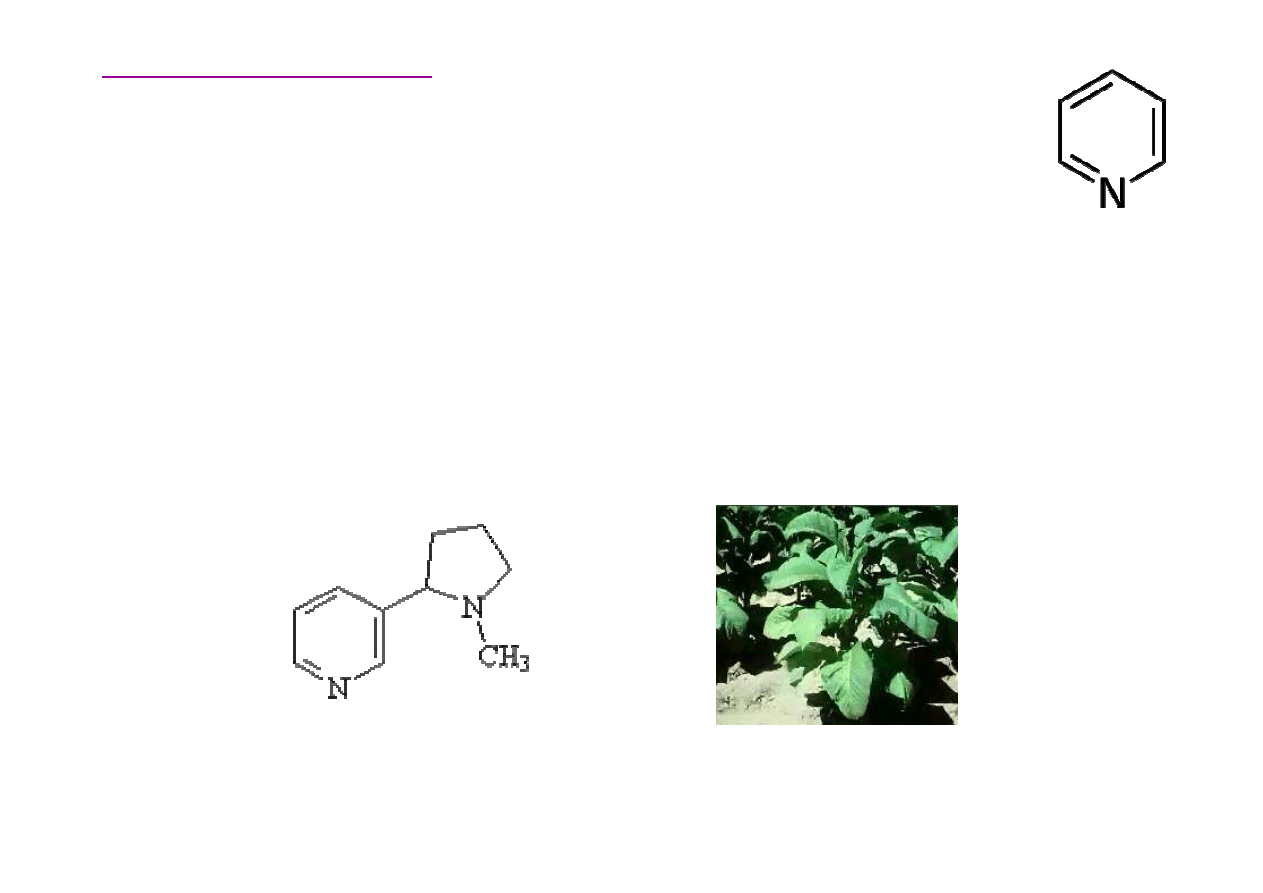
Alkaloidy zawieraj
ą
ce pier
ś
cie
ń
pirydynowy
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Heterocyclic_compound
Głównym alkaloidem w li
ś
ciach tytoniu jest nikotyna. W
niskich dawkach (1–3 mg) wykazuje działanie
stymuluj
ą
ce, co jest głównym powodem, dla którego
palenie tytoniu sprawia przyjemno
ść
. W du
ż
ych dawkach
mo
ż
e powodowa
ć
m.in. depresj
ę
, wymioty, biegunk
ę
.
Li
ś
cie tytoniu
nikotyna
http://www.ch.ic.ac.uk/rzepa/mim/drugs/html/nicotine.htm
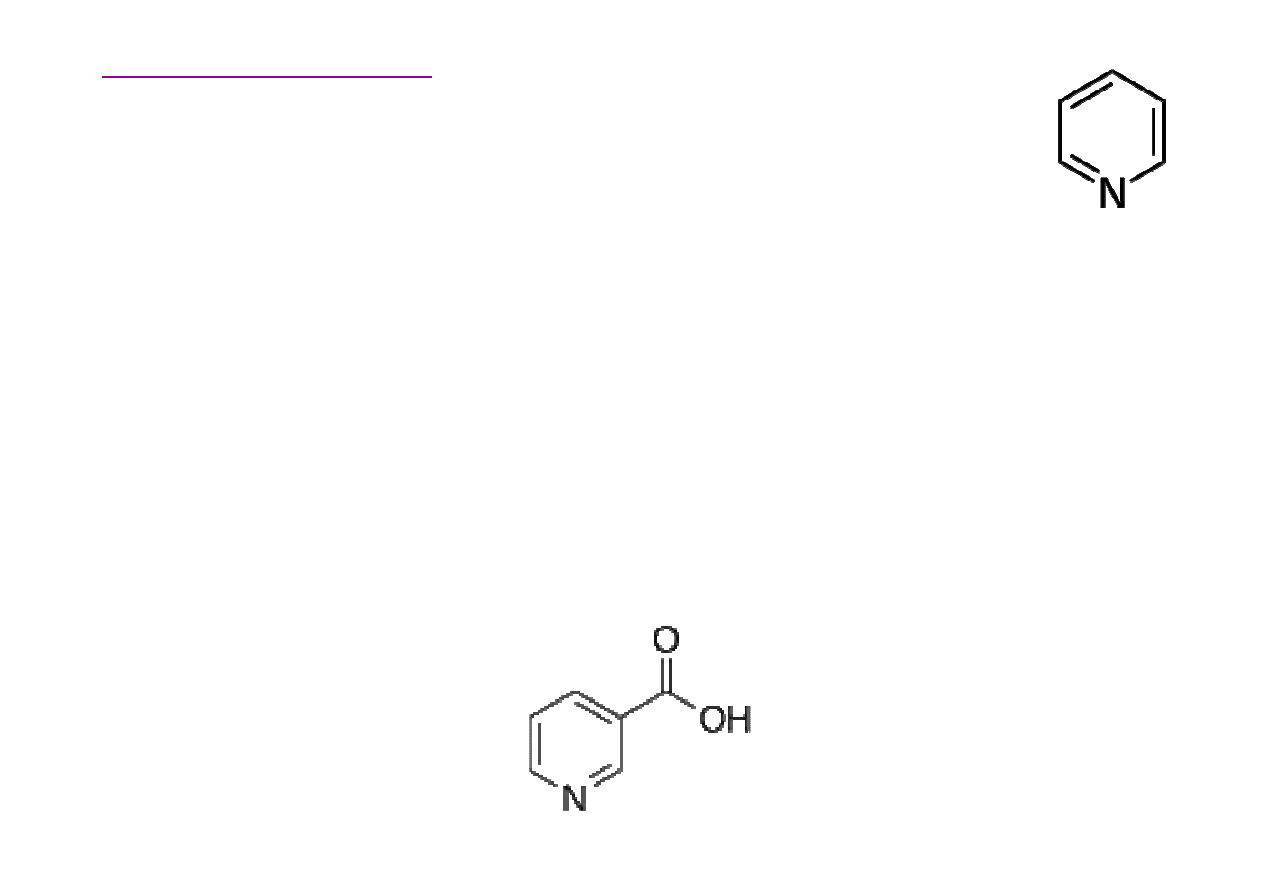
Alkaloidy zawieraj
ą
ce pier
ś
cie
ń
pirydynowy
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Heterocyclic_compound
http://en.wikipedia.org/wiki/Niacin
Nikotyna mo
ż
e zosta
ć
utleniona do kwasu nikotynowego (niacyna,
witamina B3). W komórkach niacyna jest wprowadzana do
dinukleotydu nikotynoamidoadeninowego (NAD) i fosforanu
dinukleotydu nikotynoamidoadeninowego (NADP). NADP i NAD
s
ą
koenzymami w procesach oksydoredukcyjnych, uczestnicz
ą
w
procesach transferu elektronów i protonów.
Kwas nikotynowy
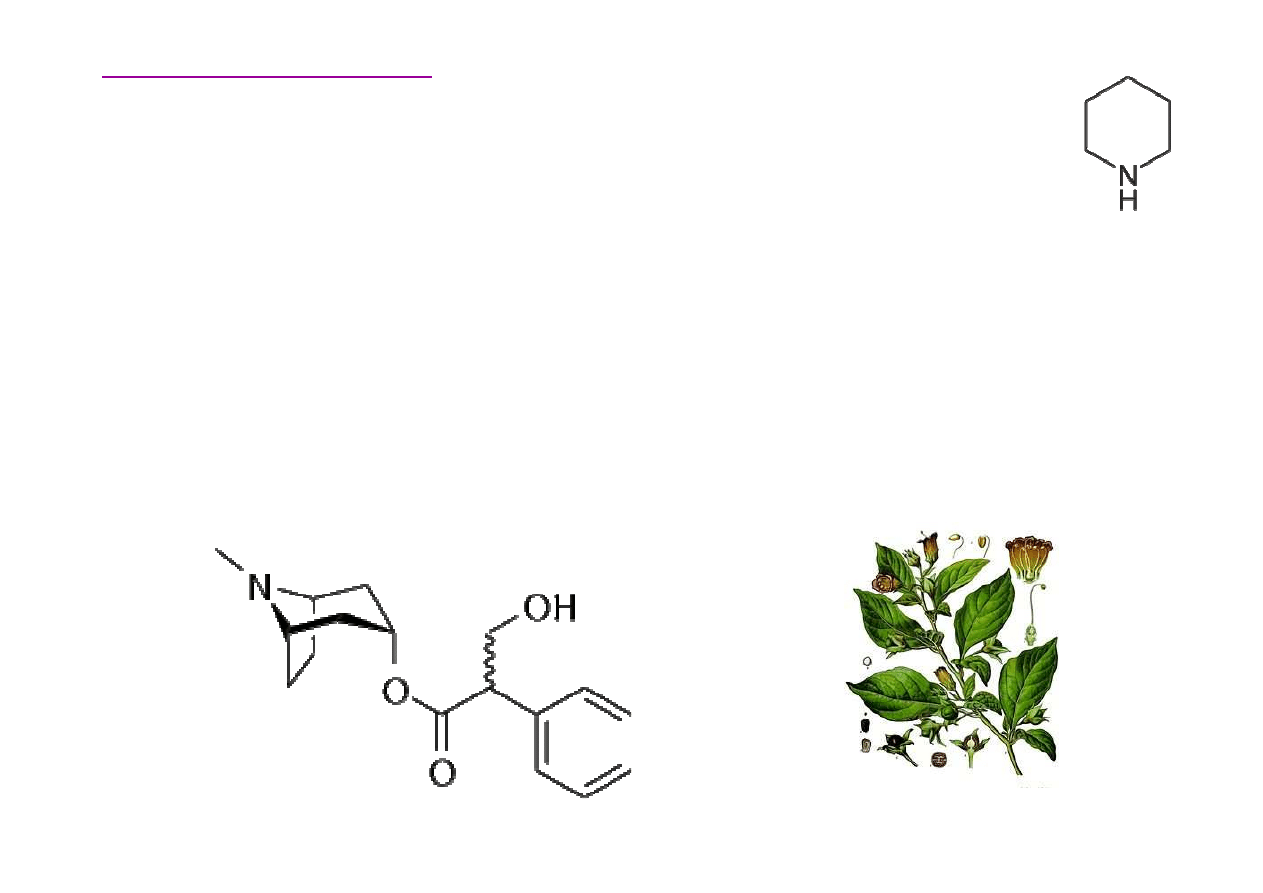
Alkaloidy zawieraj
ą
ce pier
ś
cie
ń
piperydynowy
Wielle alkaloidów zawiera pier
ś
cie
ń
piperydynowy. Nale
ż
y
do nich atropina, wyst
ę
puj
ą
ca w wielu ro
ś
linach rodziny
psiankowatych (Solanacee), np. w li
ś
ciach i korzeniach
pokrzyku wilczej jagody (Atropa belladonna). Stosowana
jako lek rozkurczowy i
ś
rodek rozszerzaj
ą
cy
ź
renice.
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Piperidine
http://en.wikipedia.org/wiki/Atropine
http://pl.wikipedia.org/wiki/Pokrzyk_wilcza_jagoda
Pokrzyk wilcza jagoda
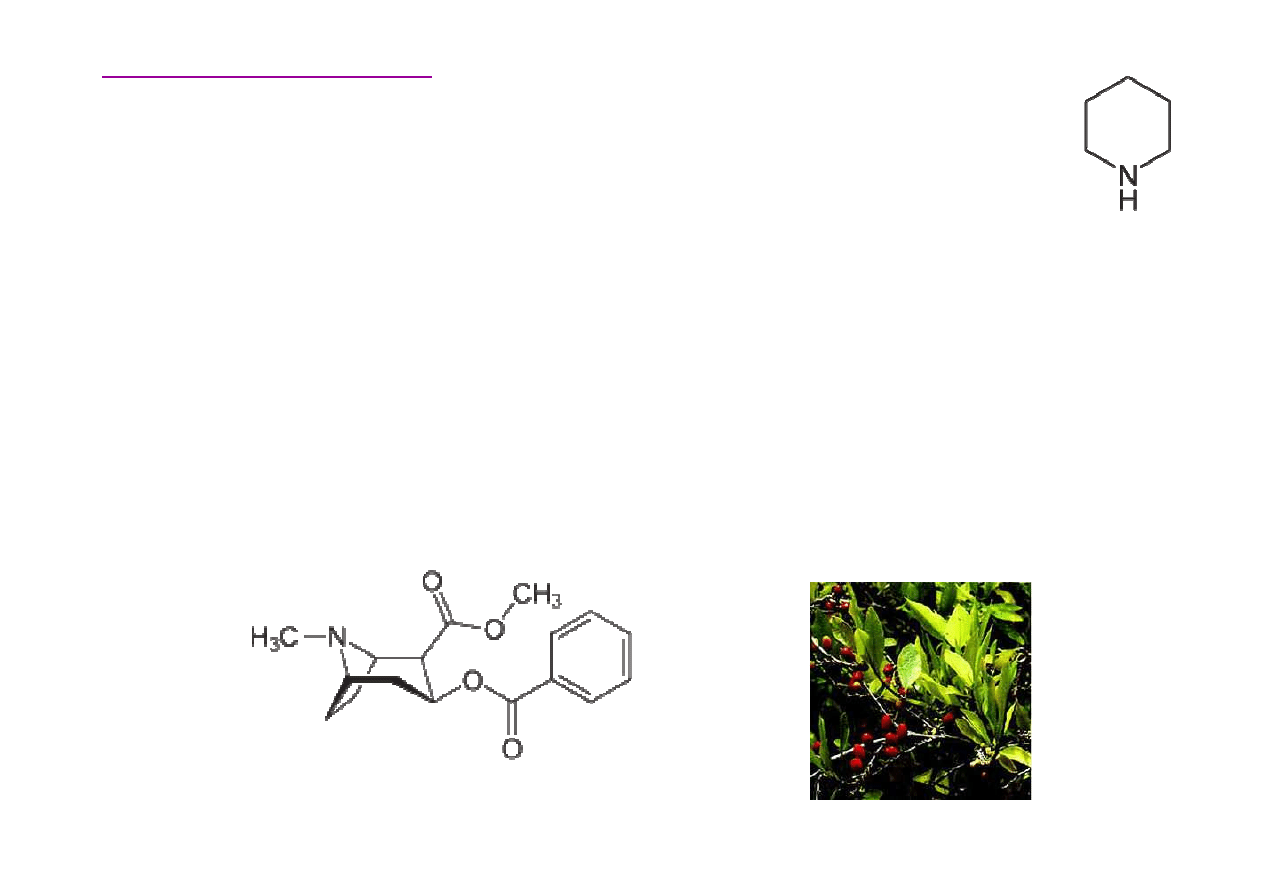
Alkaloidy zawieraj
ą
ce pier
ś
cie
ń
piperydynowy
Innym alkaloidem zawieraj
ą
cym pier
ś
cie
ń
piperydynowy jest kokaina
pozyskiwana z li
ś
ci krasnodrzewu pospolitego (koki) (Erythroxylon coca).
W małych dawkach jest stymulantem, wpływa dodatnio na poziom
dopaminy – odpowiedzialnej za o
ś
rodki przyjemno
ś
ci w mózgu. Kokaina
bardzo silnie uzale
ż
nia psychicznie, powoduj
ą
c zmiany w mózgu. W
medycynie stosowano kokain
ę
jako lokalny
ś
rodek znieczulaj
ą
cy.
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Piperidine
http://en.wikipedia.org/wiki/Cocaine
http://pl.wikipedia.org/wiki/Krasnodrzew_pospolity
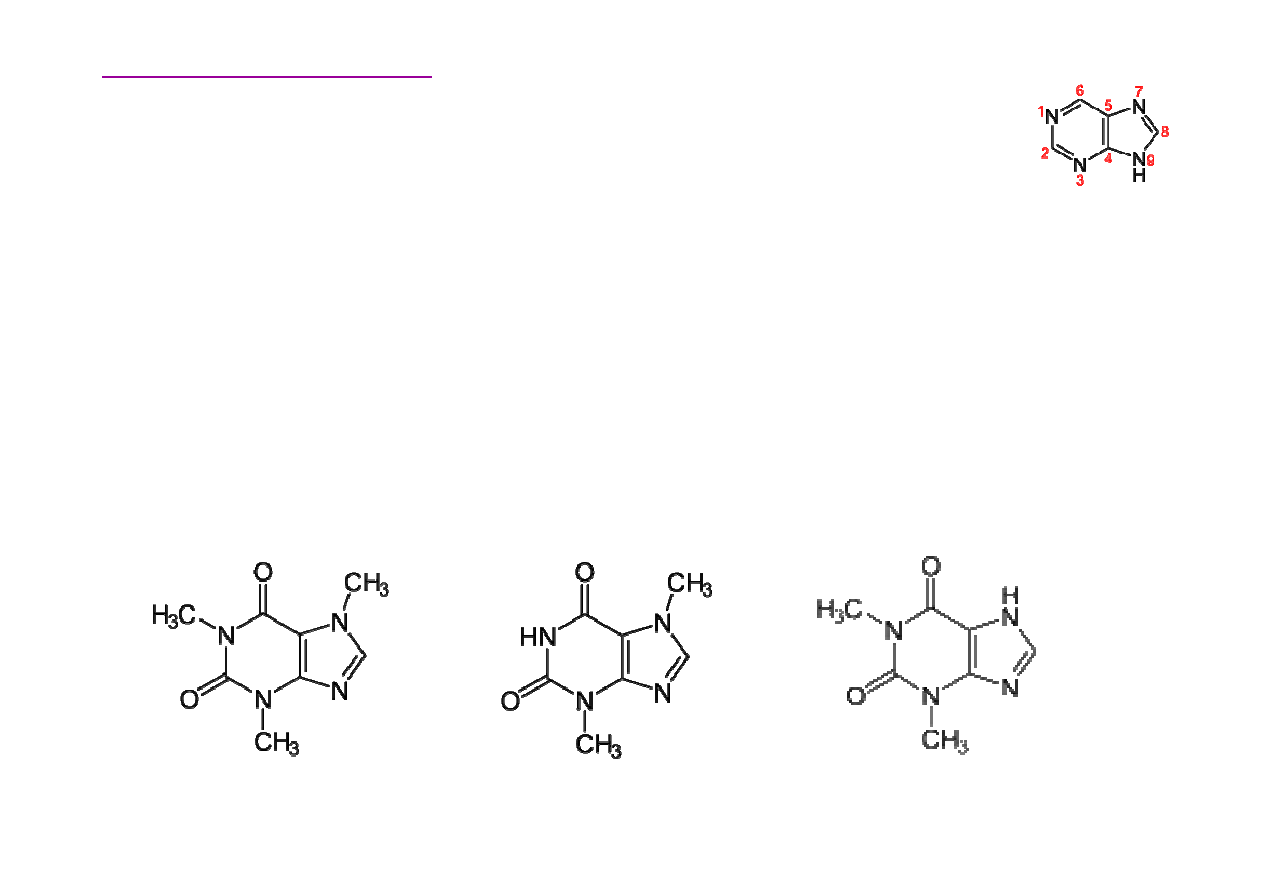
Alkaloidy zawieraj
ą
ce pier
ś
cie
ń
purynowy
Alkaloidy purynowe wyst
ę
puj
ą
u około 100 gatunków ro
ś
lin,
najwa
ż
niejsze z nich to kofeina, główny alkaloid kawy
arabskiej (Coffea arabica), teobromina, główny alkaloid
nasion kakaowca (Theobroma cacao) i teofilina wyst
ę
puj
ą
ca
przede wszystkim w li
ś
ciach herbaty (Thea sinensis).
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Purine
http://en.wikipedia.org/wiki/Caffeine
kofeina
teobromina
http://en.wikipedia.org/wiki/Theobromine
teofilina
http://en.wikipedia.org/wiki/Theophylline
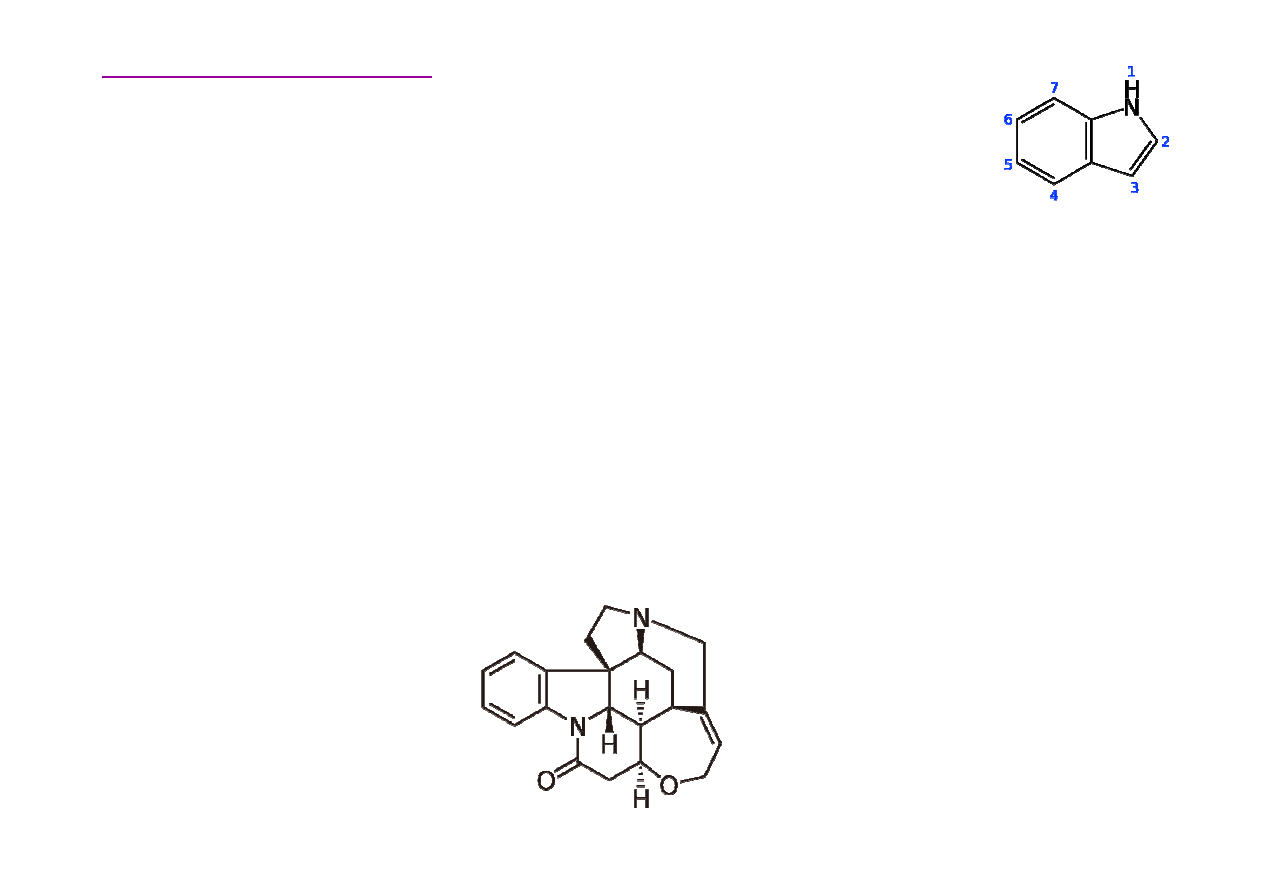
Alkaloidy zawieraj
ą
ce pier
ś
cie
ń
indolowy
Alkaloidy indolowe zawieraj
ą
w cz
ą
steczce azot w układzie
indolowym. Strychnina- alkaloid z nasion kulczyby wroniego
oka, posiadaj
ą
cy silne wła
ś
ciwo
ś
ci toksyczne
(LD50=0,16 mg/kg szczur, 1–2 mg/kg ustnie człowiek).
Wyst
ę
puje w postaci bezbarwnych kryształów o silnie gorzkim
smaku. Zatrucie skutkuje skurczami mi
ęś
ni i
ś
mierci
ą
poprzez
uduszenie.
Aminy aktywne biologicznie
http://en.wikipedia.org/wiki/Indole
http://en.wikipedia.org/wiki/Strychnine
Katecholaminy
Katecholamina (CA) z chemicznego punktu widzenia to
monoamina, zwi
ą
zek zbudowany z katecholu i reszty
aminowej.
Aminy aktywne biologicznie
katechol
http://en.wikipedia.org/wiki/Catecholamine
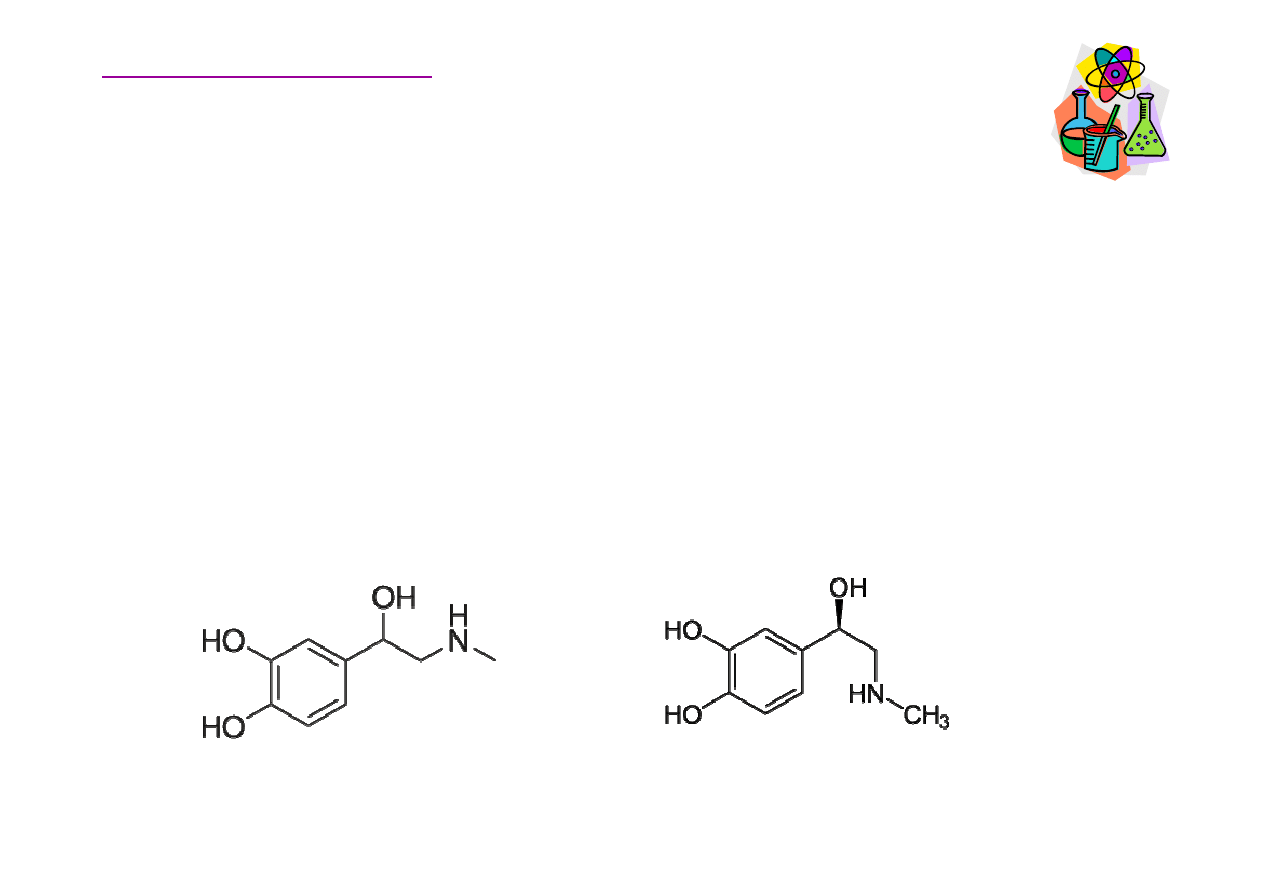
Katecholaminy
Katecholaminy s
ą
głównymi hormonami układu
sympatycznego w autonomicznym układzie nerwowym.
Adrenalina i noradrenalina s
ą
produkowane głównie przez
rdze
ń
nadnerczy w odpowiedzi na stres i wywołuj
ą
ogólne
reakcje organizmu, które przygotowuj
ą
ciało do wysiłku
fizycznego zwi
ą
zanego z walk
ą
lub ucieczk
ą
.
Aminy aktywne biologicznie
adrenalina
(epinefryna)
noradrenalina
(norepinefryna)
http://en.wikipedia.org/wiki/Catecholamine
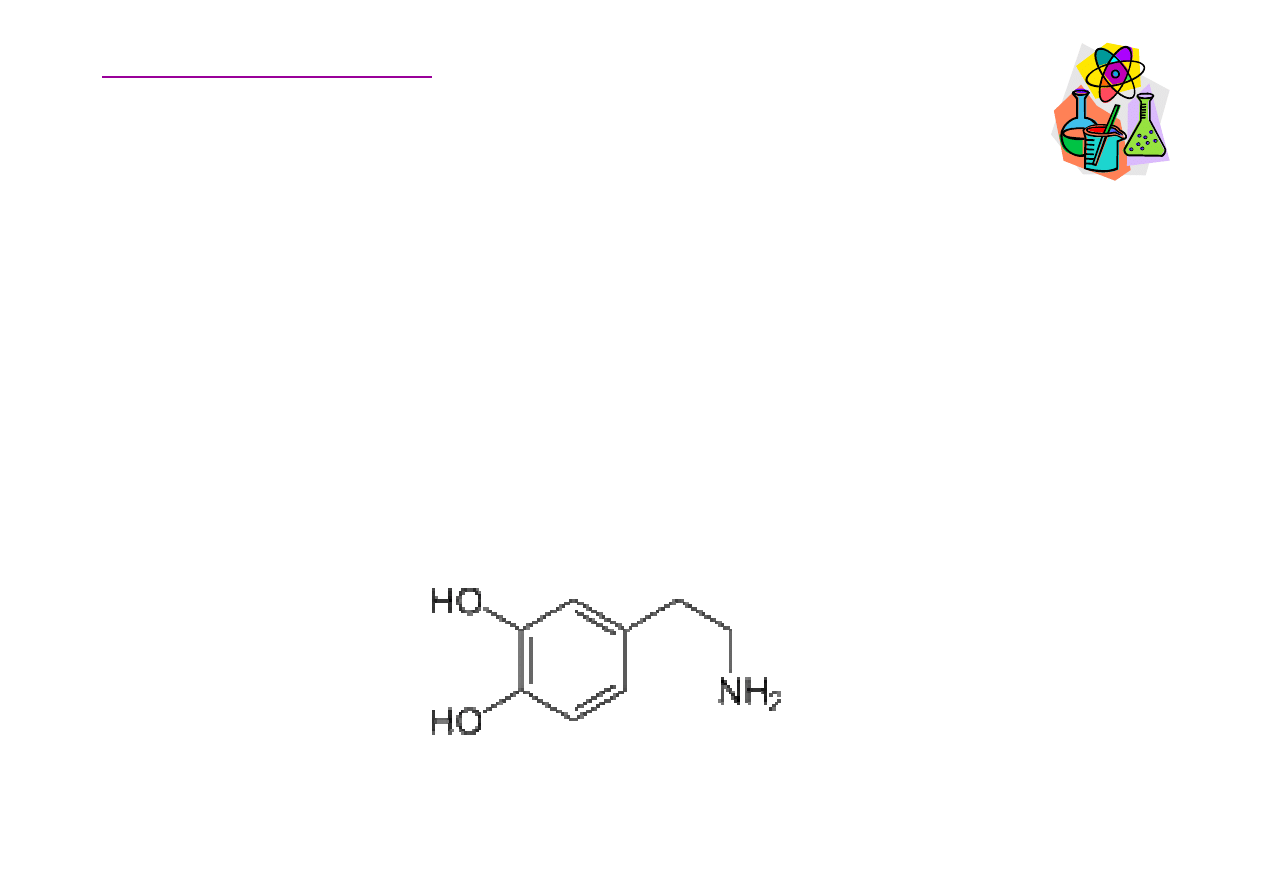
Katecholaminy
Dopamina jest neuroprzeka
ź
nikiem, syntetyzowanym i
uwalnianym przez neurony o
ś
rodkowego układu
nerwowego. Przenosi sygnały w mózgu i tkankach
obwodowych. Dopamina pełni wa
ż
n
ą
rol
ę
w przebiegu
niektórych chorób, takich jak choroba Parkinsona, ADHD,
schizofrenia i w uzale
ż
nieniach.
Aminy aktywne biologicznie
dopamina
http://en.wikipedia.org/wiki/Dopamine
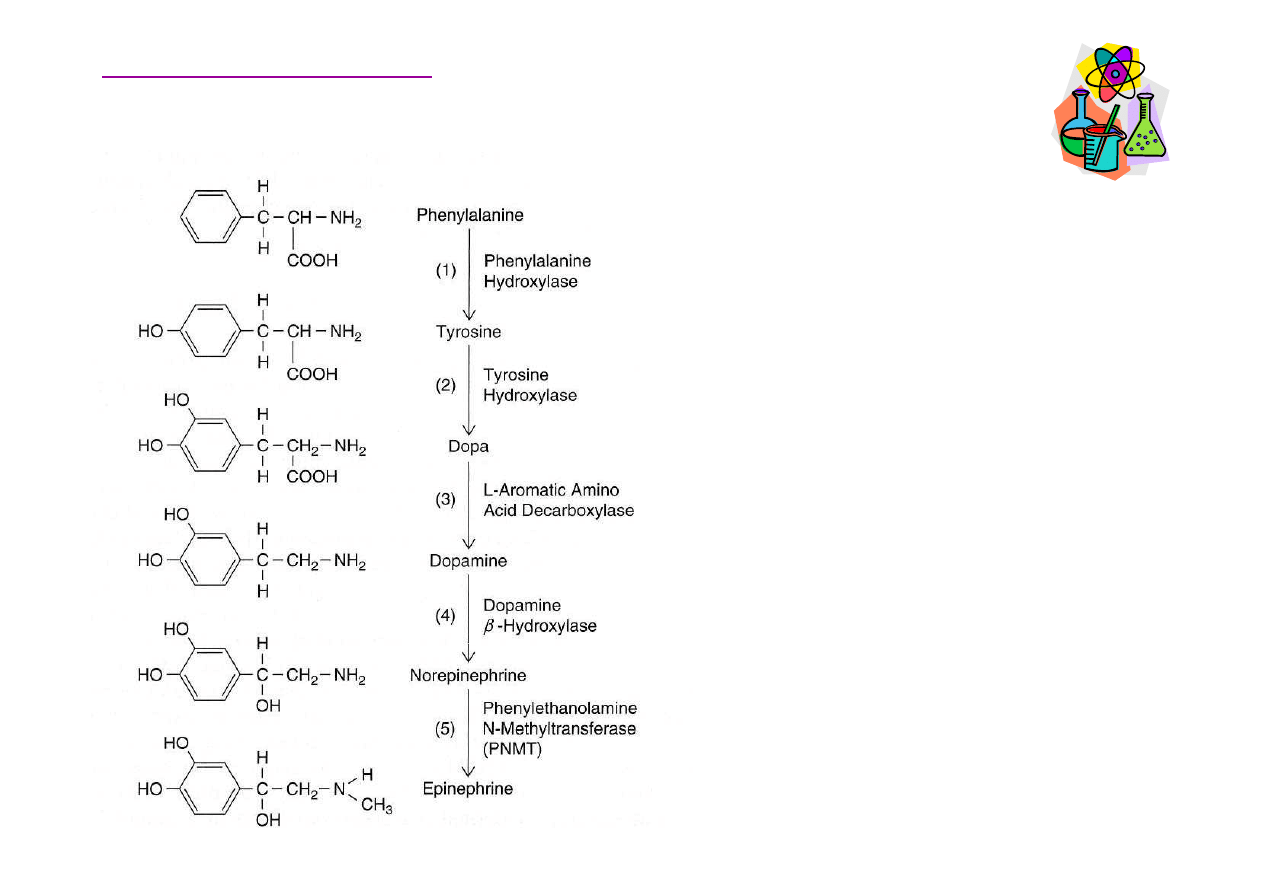
Biosynteza katecholamin
Biosynteza katecholamin
zaczyna si
ę
od
fenyloalaniny i/lub tyrozyny
(aminokwasów) w post-
synaptycznych neuronach,
o
ś
rodkowym układzie
nerwowym i w nadnerczach
(rdze
ń
).
Aminy aktywne biologicznie
http://www.trinity.edu/lespey/biol3449/lectures/lect14/Fig.14.3.jpg
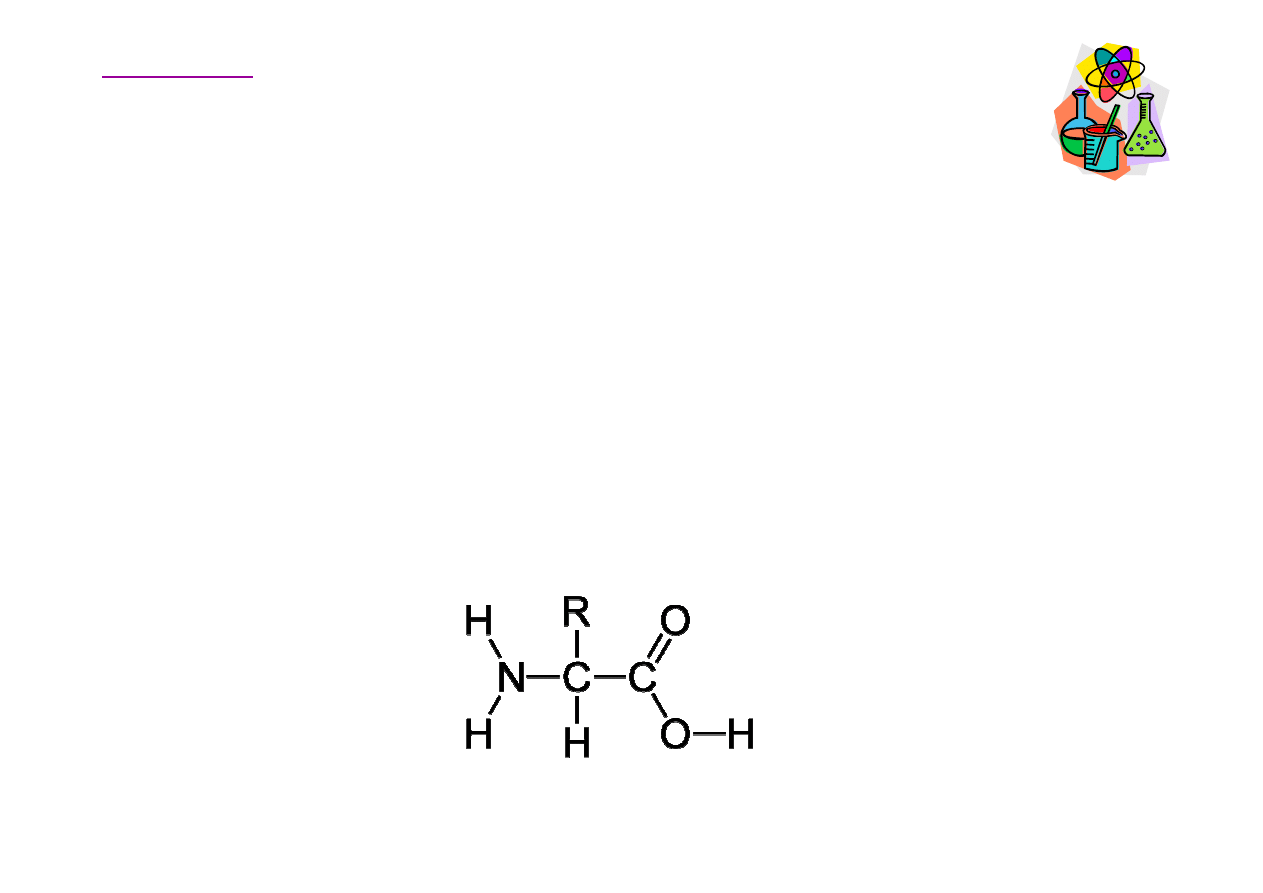
Aminokwasy
W skład białek wszystkich organizmów
ż
ywych wchodzi
głównie 20 podstawowych. Aminokwasy zbudowane s
ą
grupy aminowej (-NH
2
) i karboksylowej (-COOH) oraz
charakterystycznego dla danego aminokwasu ła
ń
cucha
bocznego (R).
Aminokwasy
http://commons.wikimedia.org/wiki/File:Alpha-amino-acid-2D-flat.png
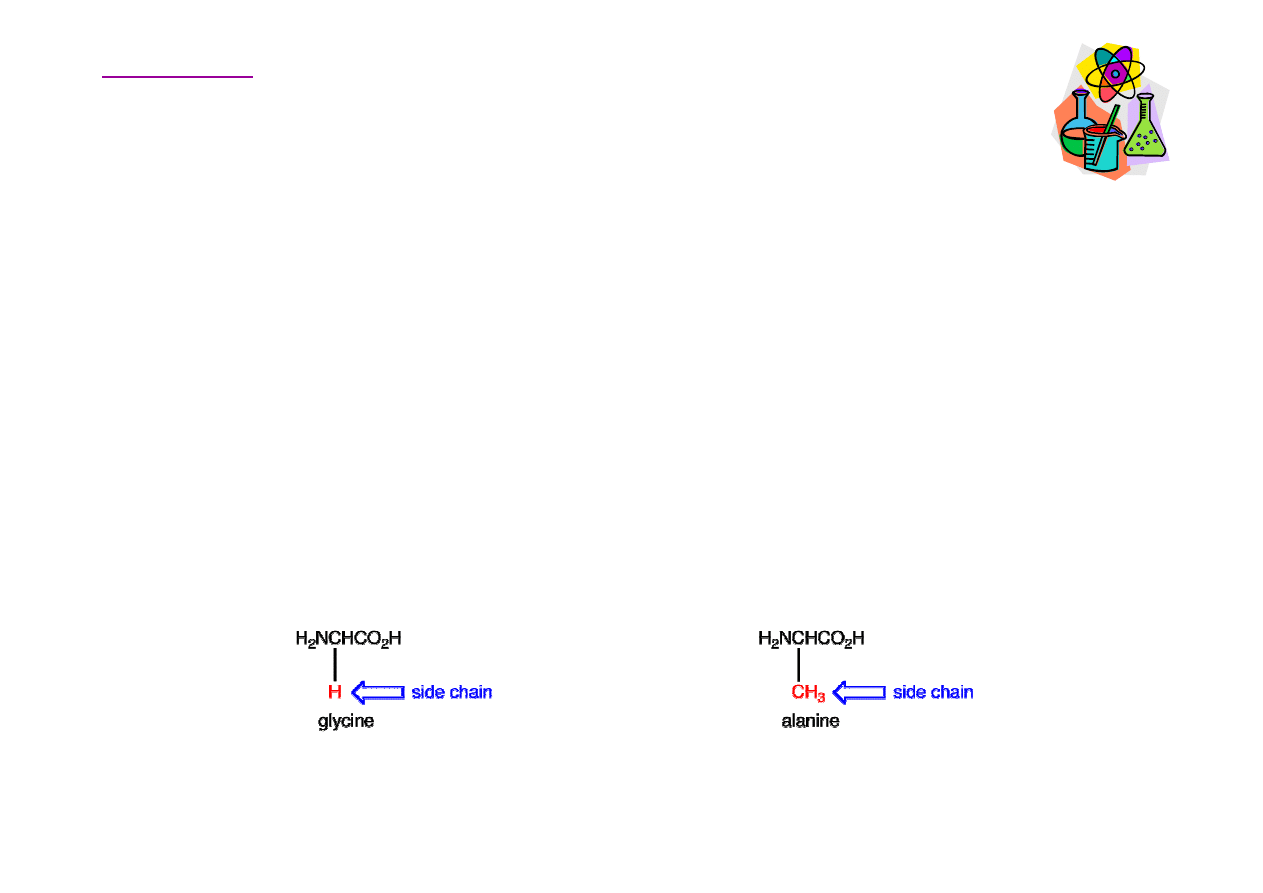
Aminokwasy
Aminokwasy ró
ż
ni
ą
si
ę
pomi
ę
dzy sob
ą
struktur
ą
ła
ń
cucha
bocznego przył
ą
czonego do w
ę
gla
α
. W zale
ż
no
ś
ci od
budowy ła
ń
cucha bocznego aminokwasy mog
ą
by
ć
podzielone na 4 grupy: aminokwasy hydrofobowe
(niepolarne), polarne oboj
ę
tne, kwa
ś
ne i zasadowe.
Aminokwasy
http://science.uvu.edu/ochem/index.php/alphabetical/s-t/side-chain/
Aminokwasy hydrofobowe (niepolarne)
W przypadku aminokwasów niepolarnych w ich
wzajemnych oddziaływaniach dominuj
ą
siły Londona i
efekty hydrofobowe. Nie tworz
ą
wi
ą
za
ń
wodorowych z
wod
ą
, a ich ła
ń
cuchy boczne s
ą
hydrofobowe.
Aminokwasy
Leucyna
Leu, L
Izoleucyna
Ile, I
Walina
Val, V
Alanina
Ala, A
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
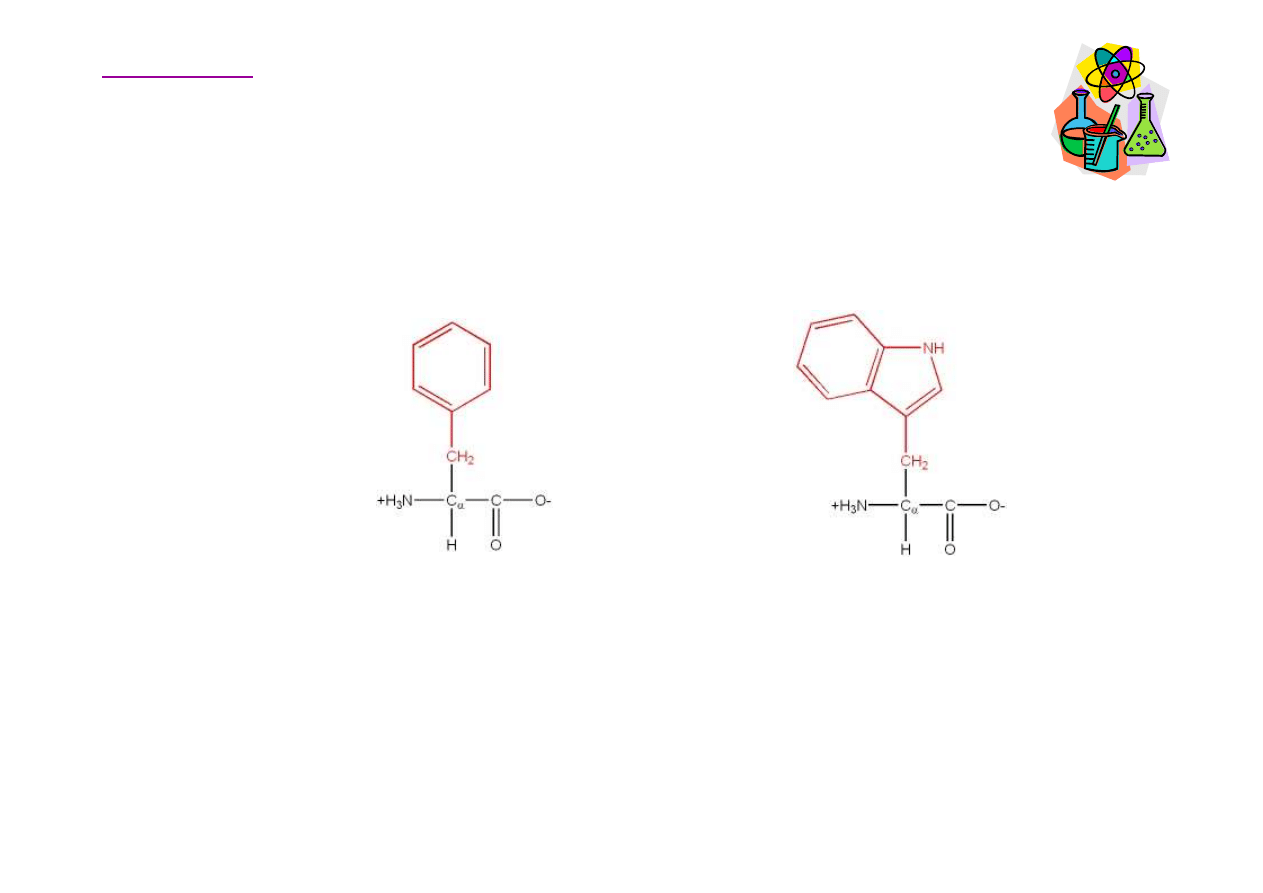
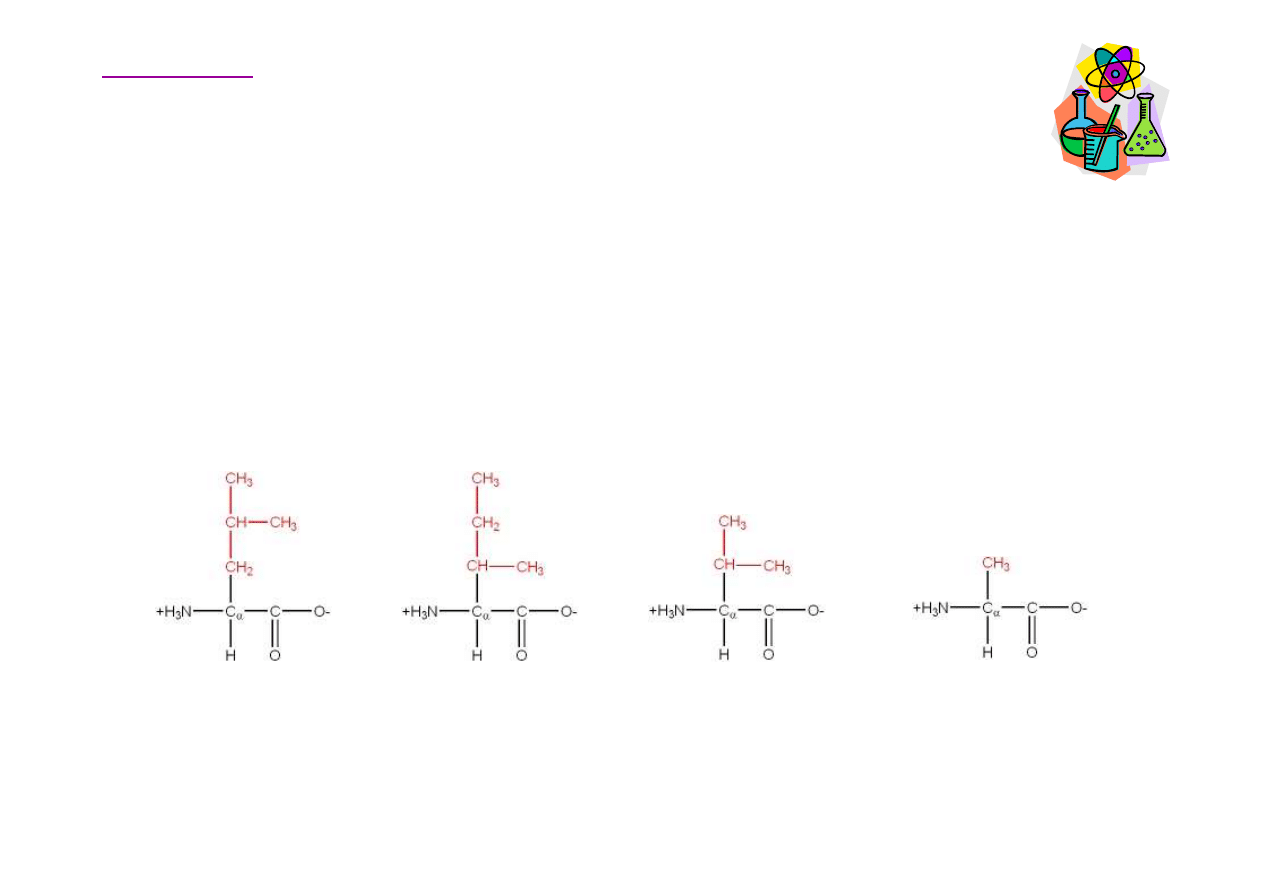
Aminokwasy hydrofobowe (niepolarne)
Aminokwasy
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
fenyloalanina
Phe, F
Tryptofan
Trp, W
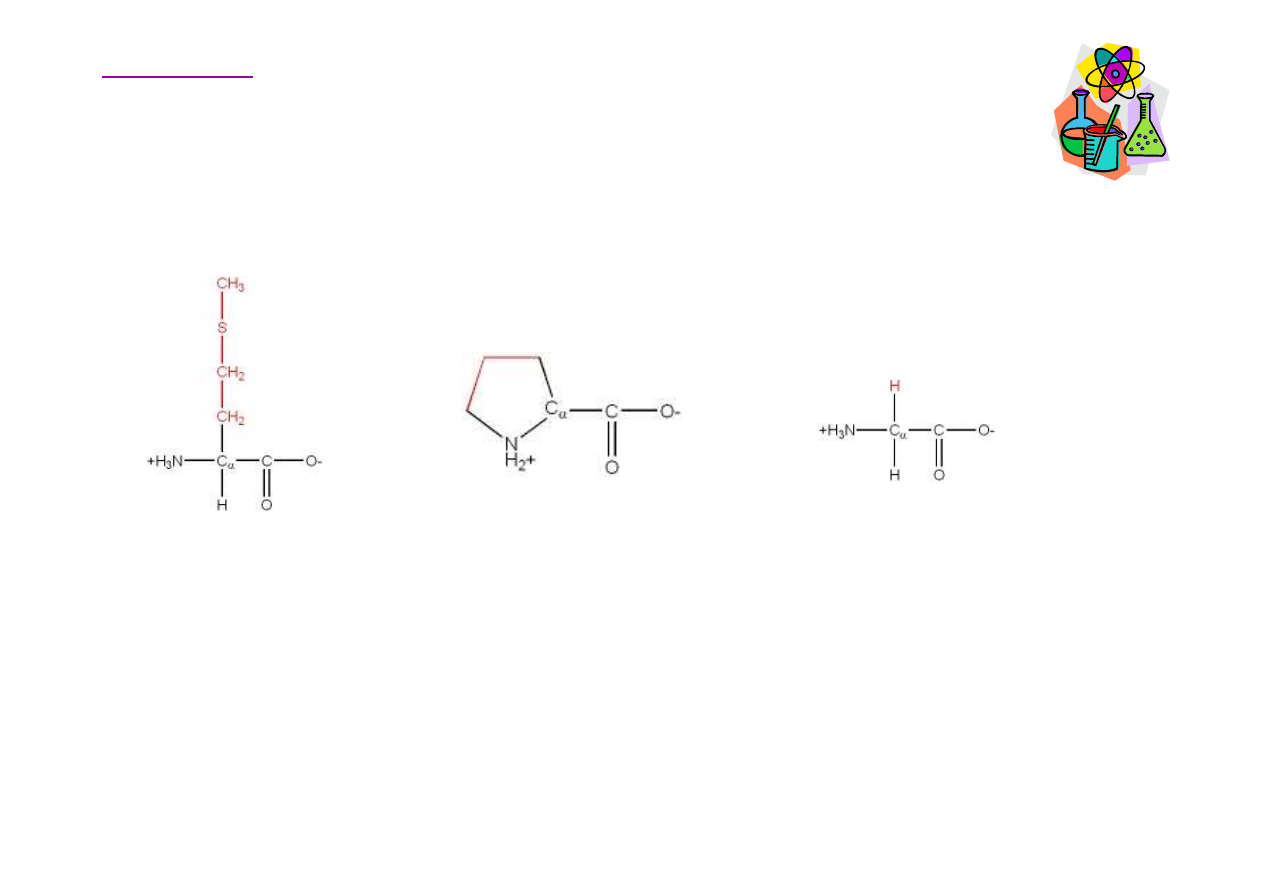
Aminokwasy hydrofobowe (niepolarne)
Aminokwasy
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
Metionina
Met, M
Prolina
Pro, P
Glicyna
Gly, G
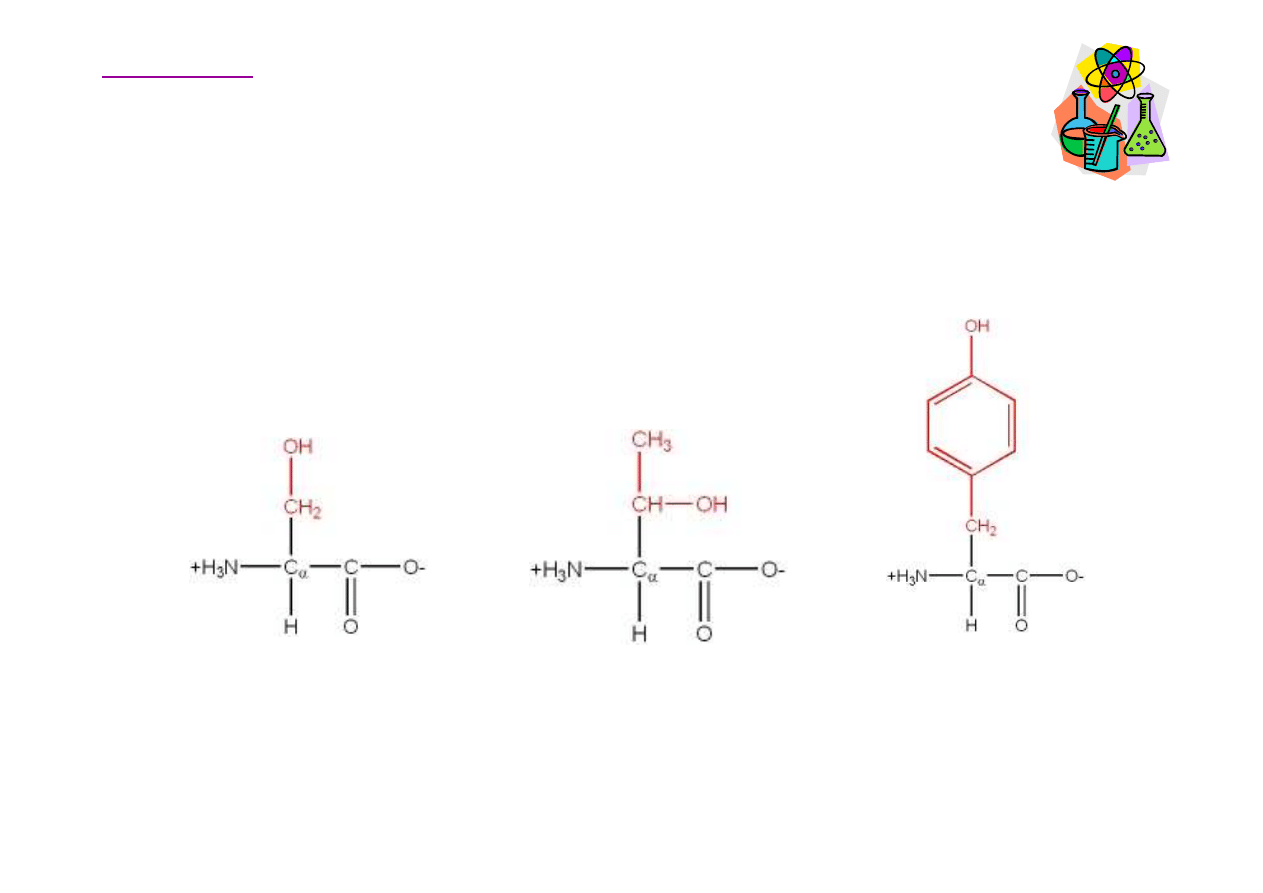
Aminokwasy polarne, oboj
ę
tne
Aminokwasy polarne, oboj
ę
tne zawieraj
ą
ła
ń
cuchy
boczne, które mog
ą
tworzy
ć
wi
ą
zania wodorowe z wod
ą
i
innymi aminokwasami.
Aminokwasy
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
Seryna
Ser, S
Treonina
Thr, T
Tyrozyna
Tyr, Y
Aminokwasy polarne, oboj
ę
tne
Aminokwasy
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
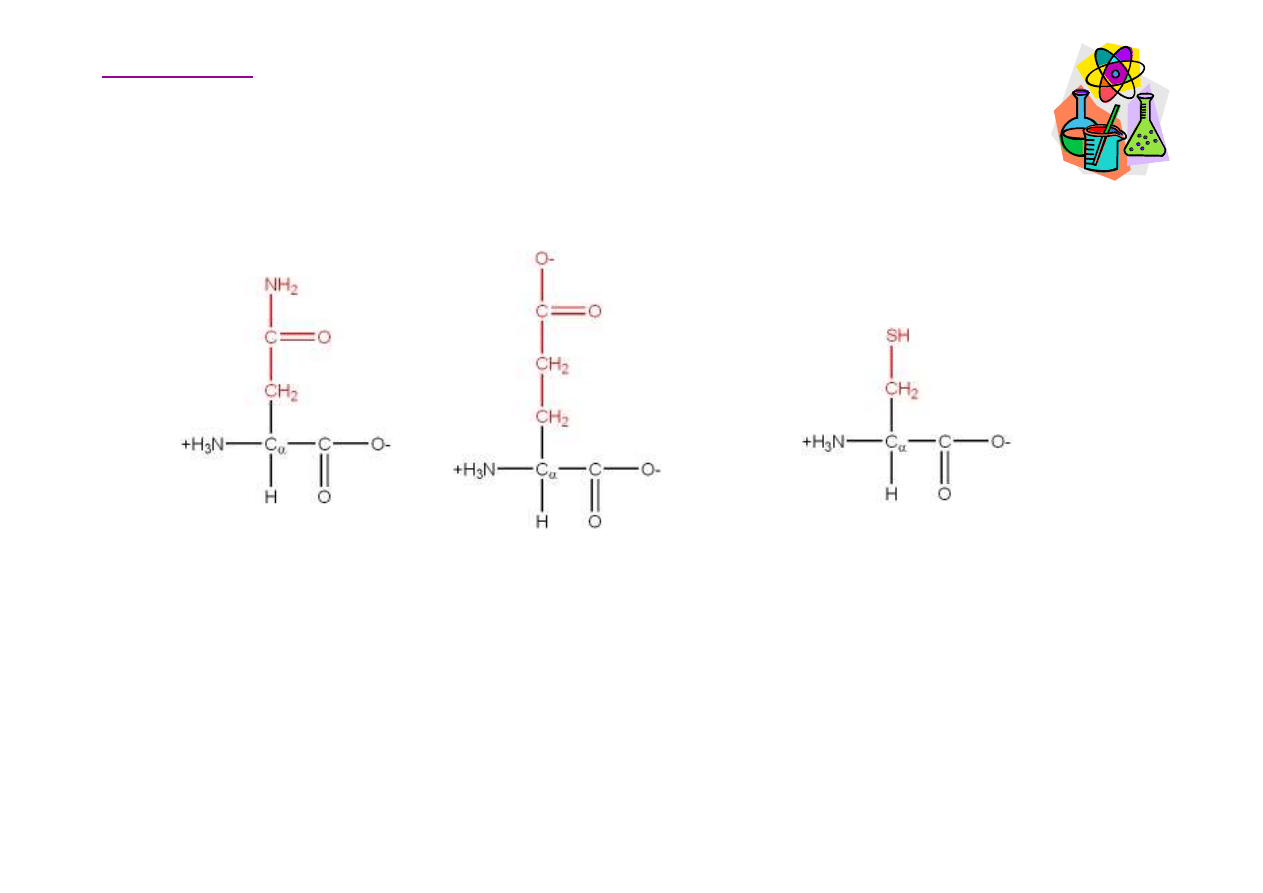
Asparagina
Asn, N
Glutamina
Gln, Q
Cysteina
Cys, C
Aminokwasy kwa
ś
ne
Aminokwas kwa
ś
ne zawieraj
ą
w ła
ń
cuchu bocznym grup
ę
karboksylow
ą
o ujemnym ładunku w oboj
ę
tnym pH. Mog
ą
tworzy
ć
wi
ą
zania wodorowe z wod
ą
i wchodzi
ć
w
oddziaływania jonowe.
Aminokwasy
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
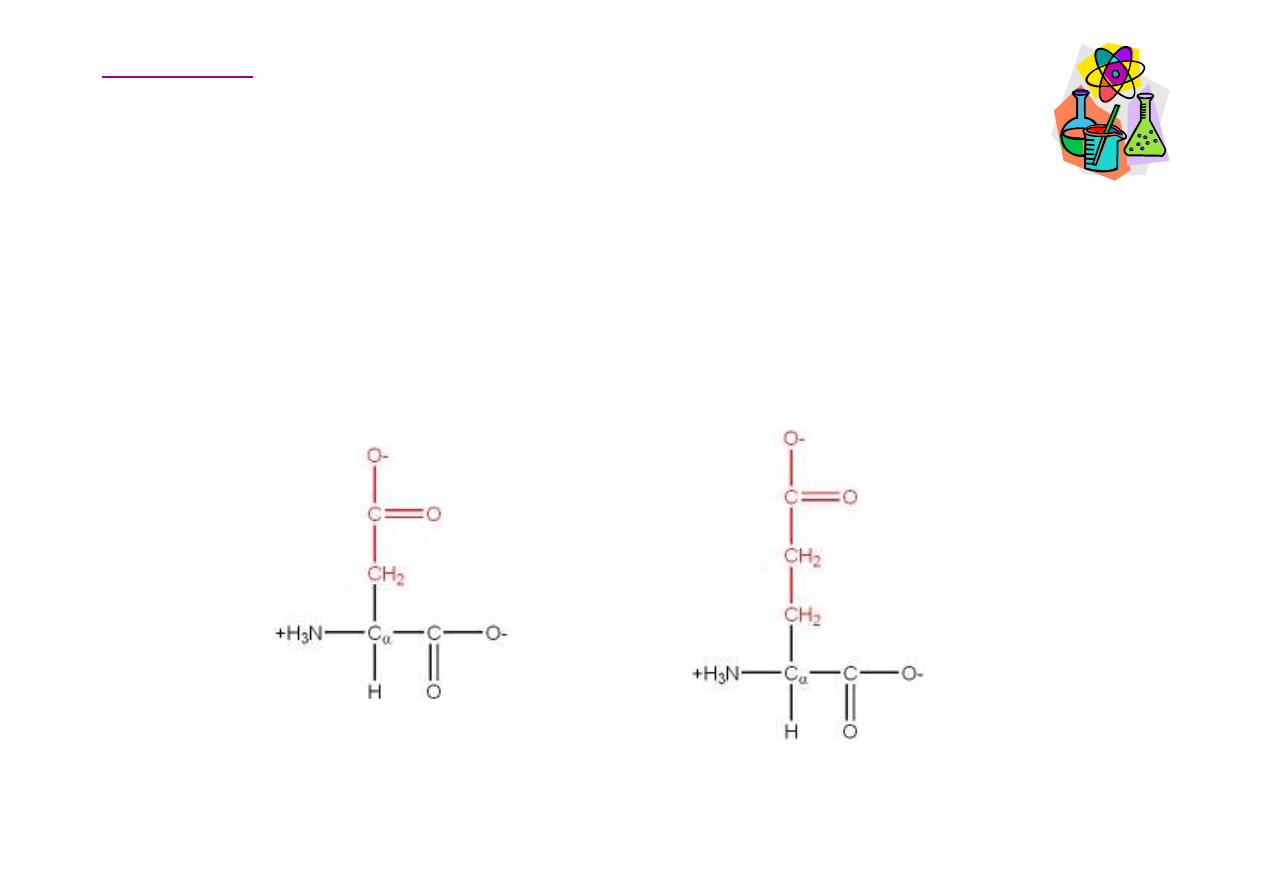
Kwas asparaginowy
Asp, D
Kwas glutaminowy
Glu, E
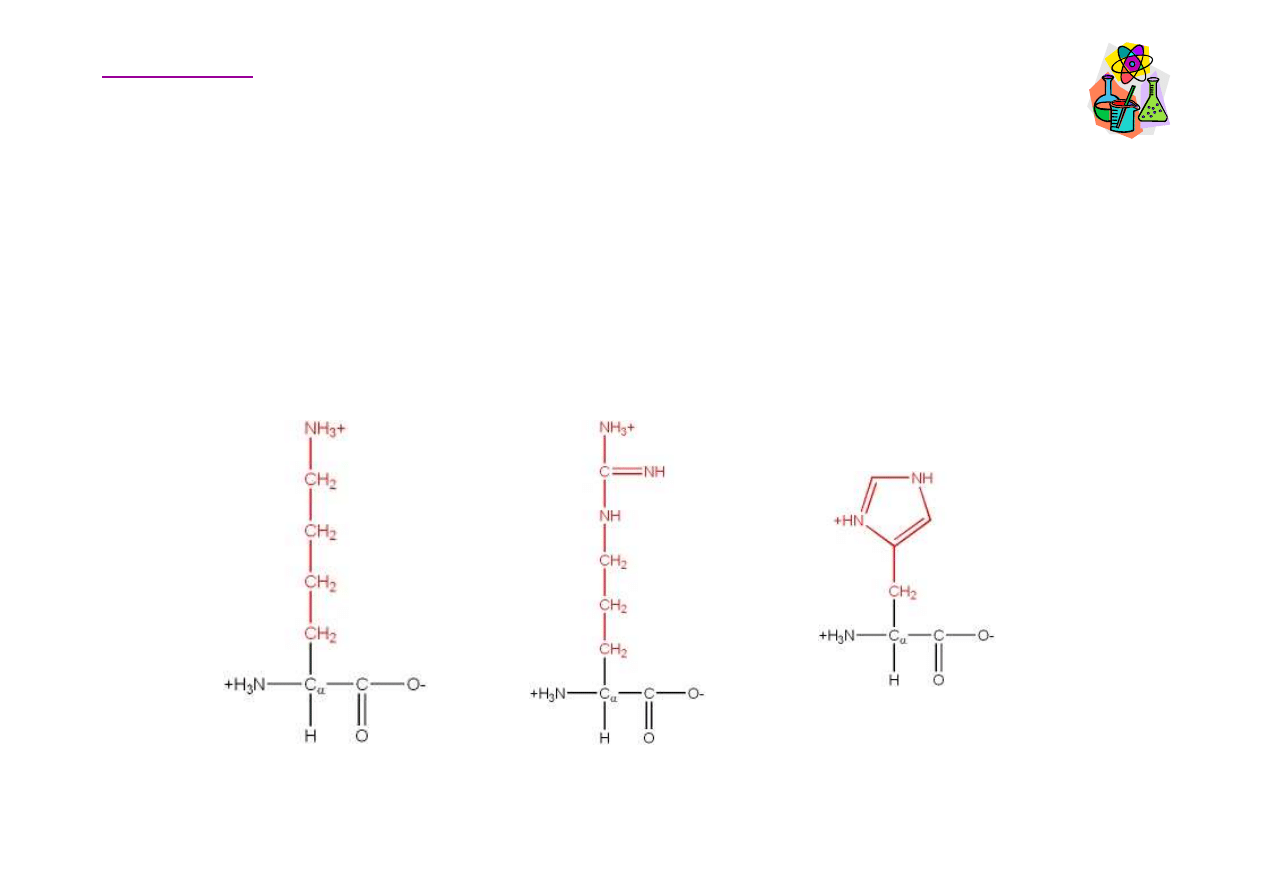
Aminokwasy zasadowe
Aminokwasy zasadowe zawieraj
ą
w ła
ń
cuchu bocznym zasad
ę
azotow
ą
(guanidyn
ę
, imidazol lub grup
ę
aminow
ą
) o dodatnim
ładunku w oboj
ę
tnym pH. Mog
ą
pełni
ć
rol
ę
donorów protonów w
reakcjach chemicznych i uczestniczy
ć
w oddziaływaniach jonowych.
Aminokwasy
http://chemwiki.ucdavis.edu/Biological_Chemistry/Proteins/Amino_Acids/Nomenclatue_of_Amino_acids
Lizyna
Lys, K
Arginina
Arg, R
Histydyna
His, H
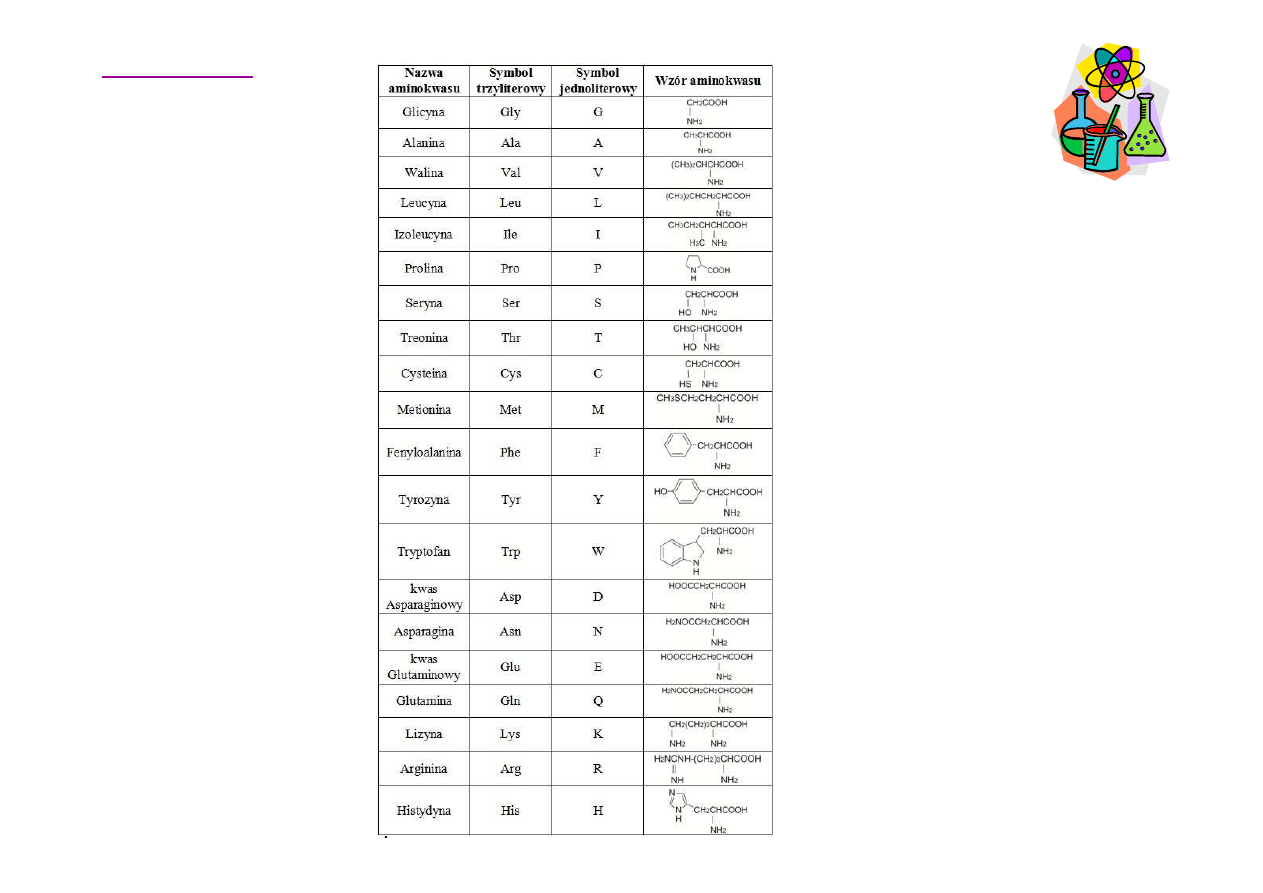
Aminokwasy
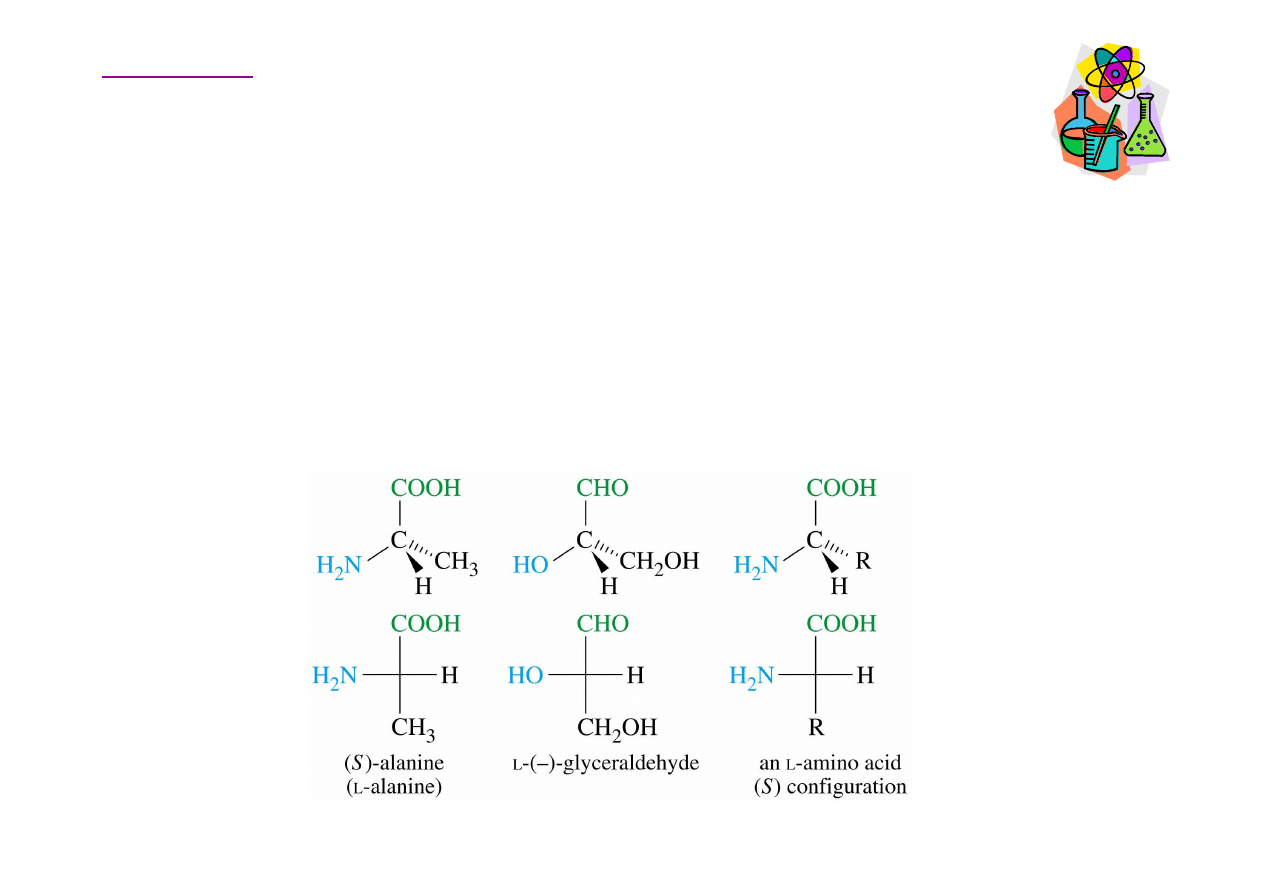
Chiralno
ść
aminokwasów
Z wyj
ą
tkiem glicyny wszystkie aminokwasy s
ą
czynne
optycznie. Prawie wszystkie aminokwasy maj
ą
konfiguracj
ę
(S), a ich budowa przypomina form
ę
L aldehydu
glicerynowego. Dlatego mówimy o aminokwasach szeregu L.
Aminokwasy
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
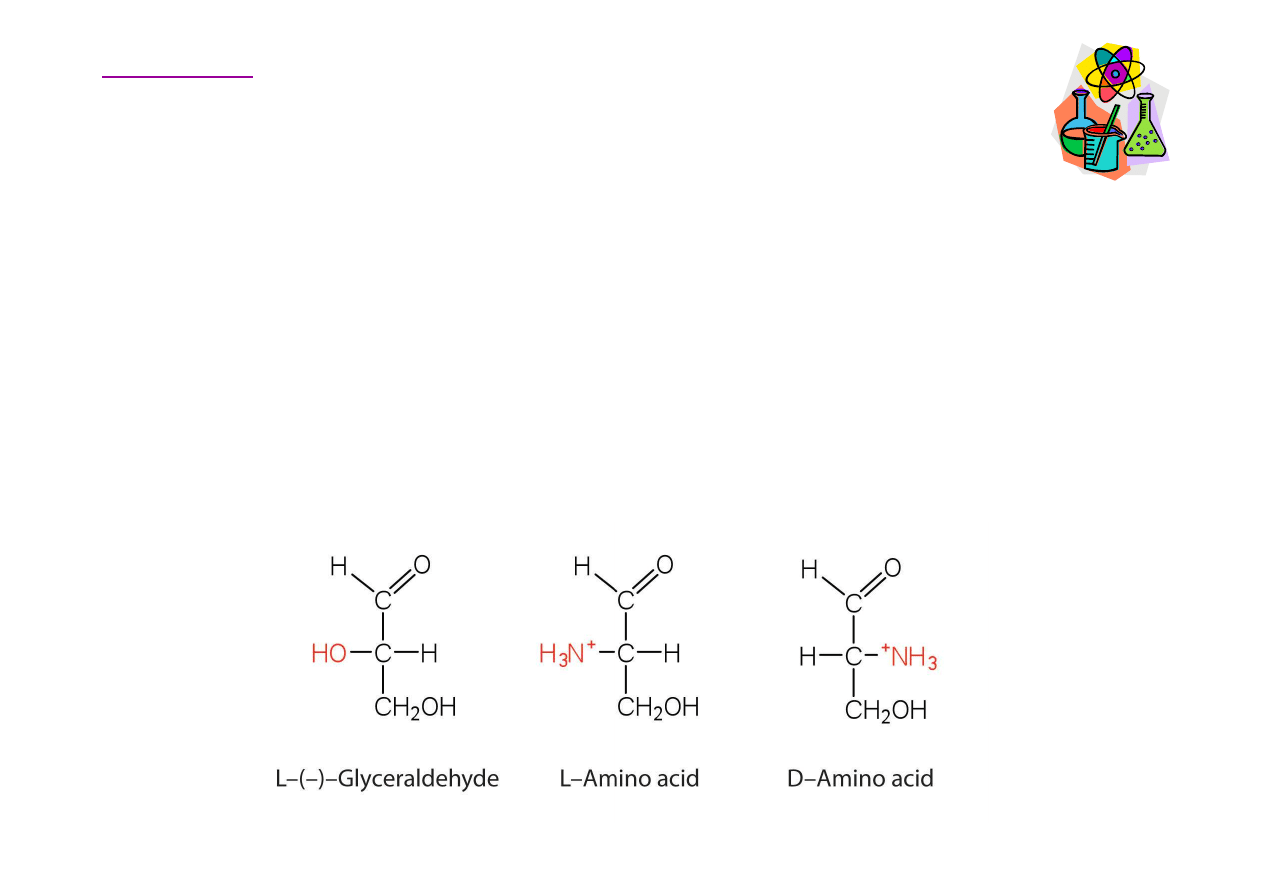
Chiralno
ść
aminokwasów
Podczas gdy wszystkie naturalnie wyst
ę
puj
ą
ce cukry nale
żą
do szeregu D,
wszystkie białka ro
ś
linne i zwierz
ę
ce zawieraj
ą
wył
ą
cznie aminokwasy
szeregu L. Aminokwasu szeregu D s
ą
wa
ż
ne dla metabolizmu i budowy
bakterii. Przykładowo, kwas D-glutaminowy i D-alanina wchodz
ą
w skład
ś
ciany komórkowej niektórych bakterii.
Aminokwasy
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-01-properties-of-amino-acids.html
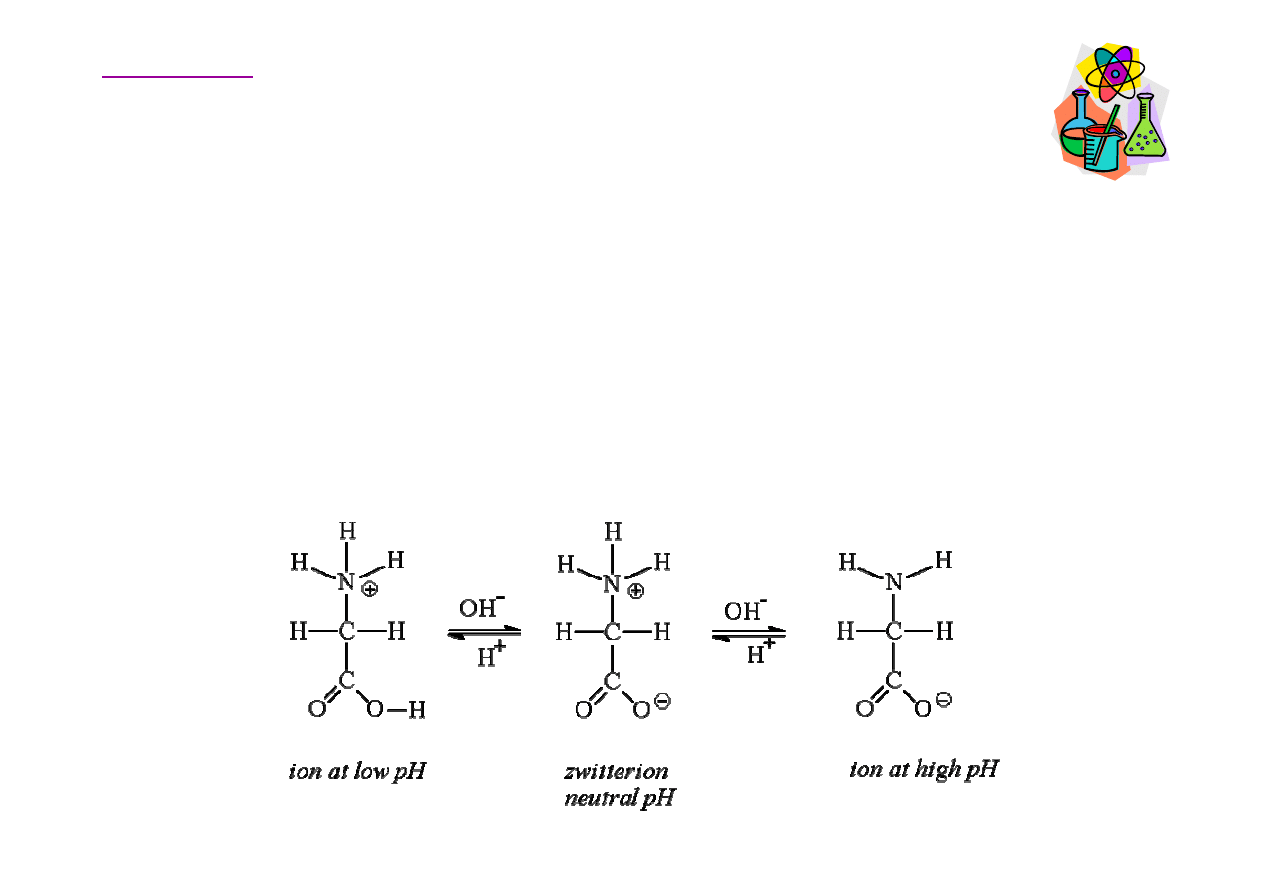
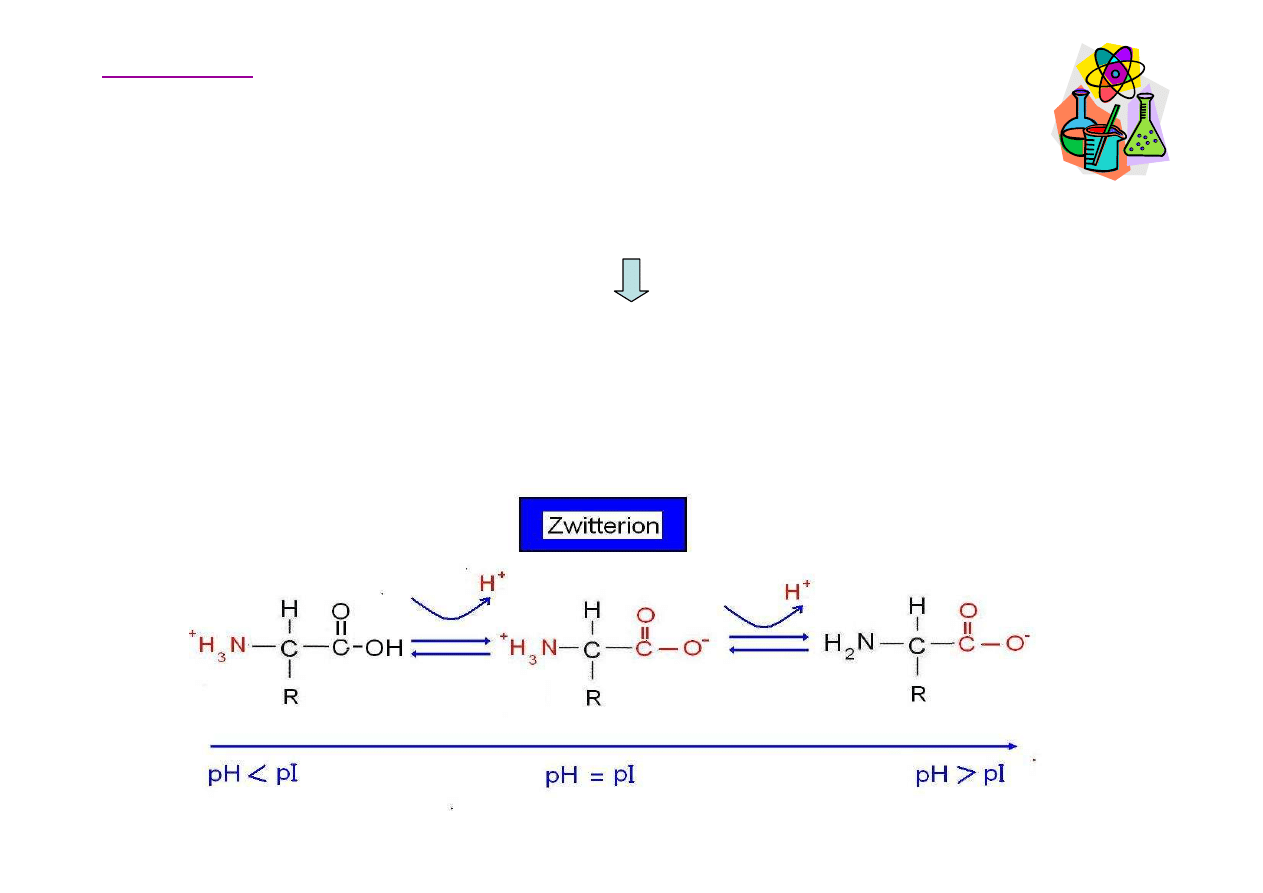
Jon dwubiegunowy (zwitterjon)
Aminokwasy zawieraj
ą
zarówno grup
ę
zasadow
ą
(-NH
2
) jak i kwa
ś
n
ą
(-COOH). Jako stała substancja wyst
ę
puj
ą
w formie tzw. jonu
dwubiegunowego (obojnaczego, niem. zwitterjon). W roztworach
wodnych ustala si
ę
równowaga pomi
ę
dzy zwitterjonem, a formami
anionowymi i kationowymi.
Aminokwasy
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
Aminokwasy – punkt izoelektryczny
O tym, jaka forma aminokwasu przewa
ż
a w roztworze,
decyduje pH roztworu i charakter danego aminokwasu. W
silnie kwa
ś
nym roztworze (niskie pH) wszystkie aminokwasy
wyst
ę
puj
ą
w postaci kationów, natomiast w silnie
zasadowym roztworze (wysokie pH) w postaci anionów.
Aminokwasy
http://www.mspatty.republika.pl/aminokwasy.html
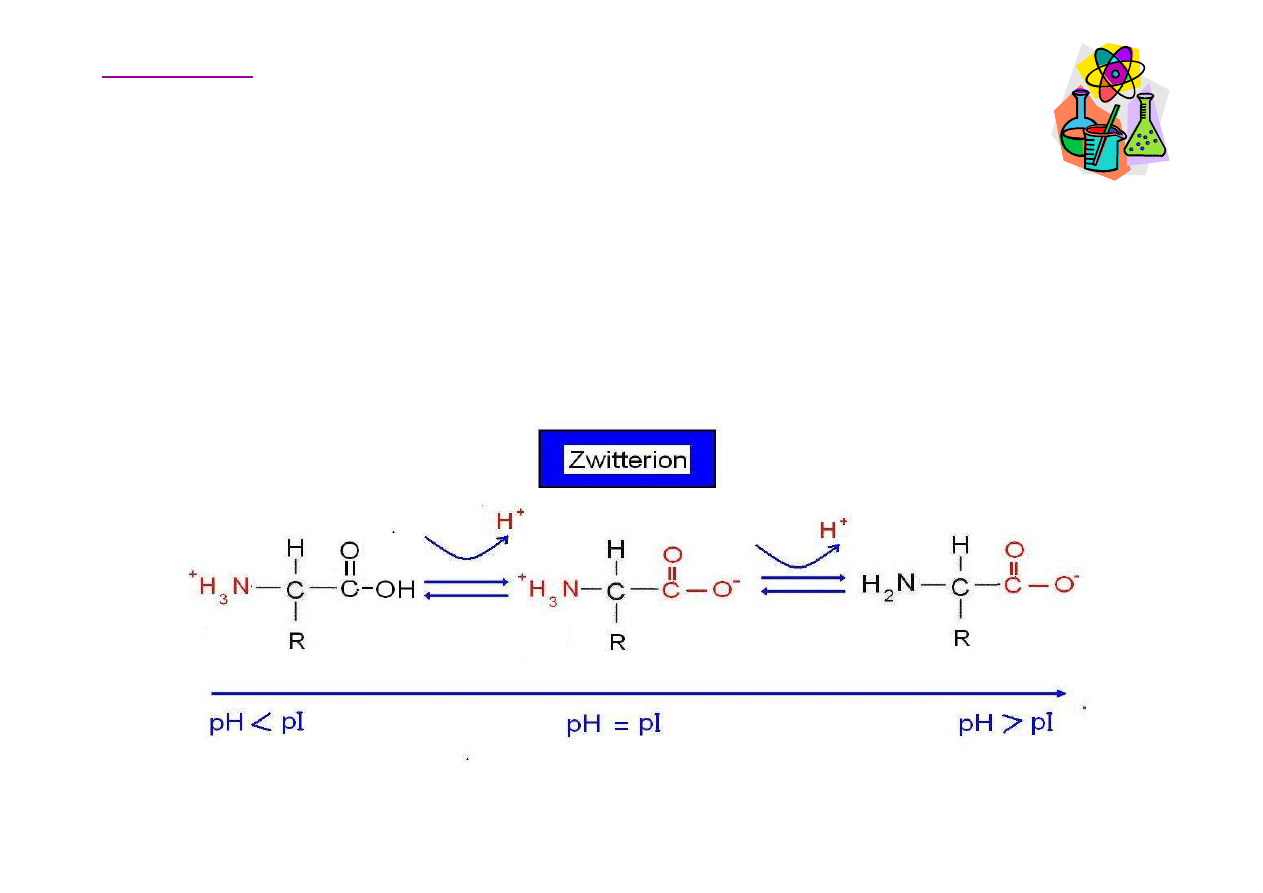
Aminokwasy – punkt izoelektryczny
Przy po
ś
redniej warto
ś
ci pH, nazywanej punktem
izoelektrycznym (pI), st
ęż
enie jonu dwubiegunowego
osi
ą
ga maksimum, st
ęż
enia anionów i kationów s
ą
sobie
równe.
Aminokwasy
http://www.foodnetworksolution.com/wiki/word/1287/isoelectric-point-
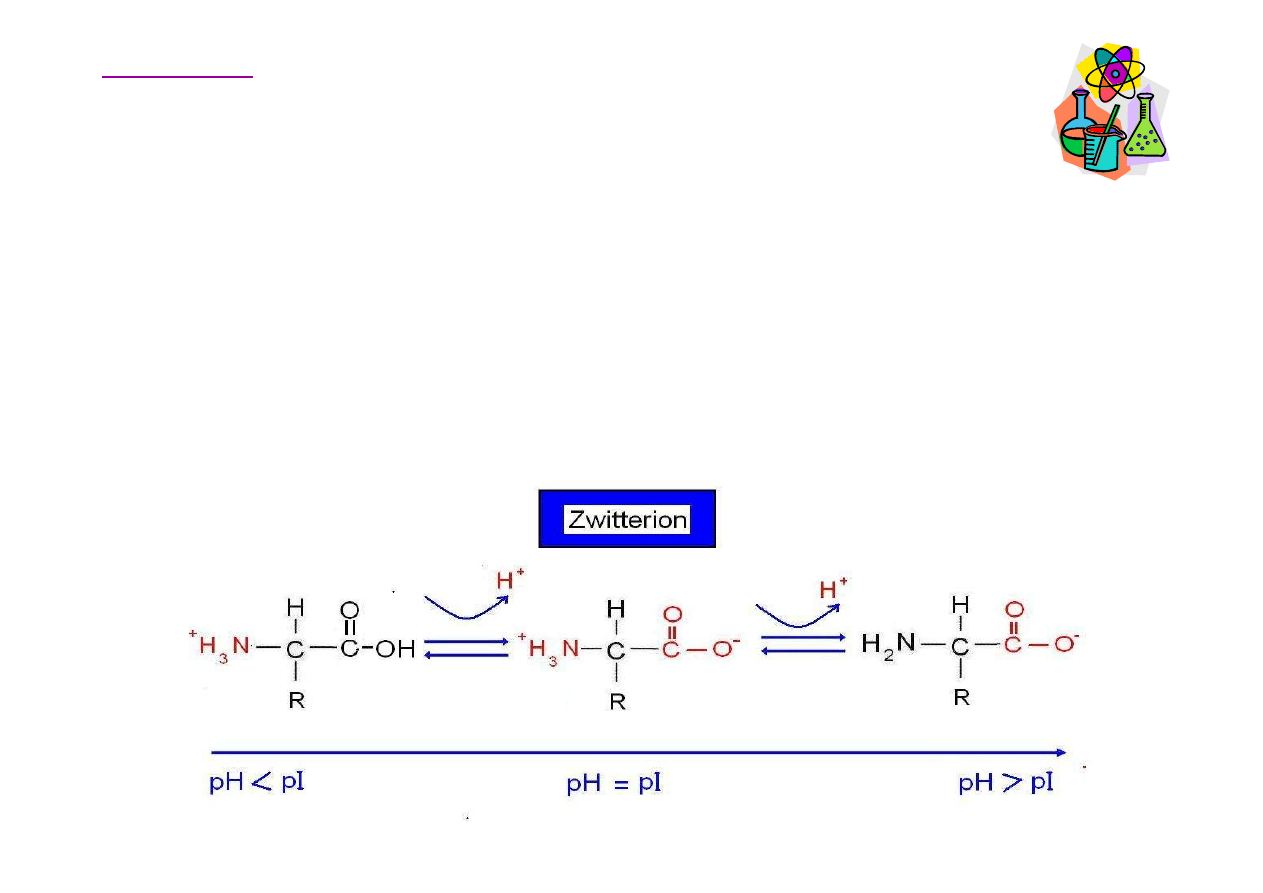
Aminokwasy – punkt izoelektryczny
Ka
ż
dy aminokwas ma wła
ś
ciwy dla siebie punkt
izoelektryczny, warto
ść
pH, w którym jego ładunek netto
jest równy 0. Poni
ż
ej swojego pI aminokwas b
ę
dzie miał
ładunek netto dodatni, powy
ż
ej ujemny.
Aminokwasy
http://www.foodnetworksolution.com/wiki/word/1287/isoelectric-point-

Aminokwasy – punkt izoelektryczny
Aminokwasy z racji posiadania dwóch grup funkcyjnych,
aminowej i karboksylowej, s
ą
zwi
ą
zkami amfoterycznymi.
Amfoteryczno
ść
– zdolno
ść
zwi
ą
zku chemicznego do
reakcji z kwasami i zarazem zasadami. Inaczej, jest to
zdolno
ść
zwi
ą
zków chemicznych do bycia w jednych
reakcjach kwasami, a w innych zasadami.
Aminokwasy
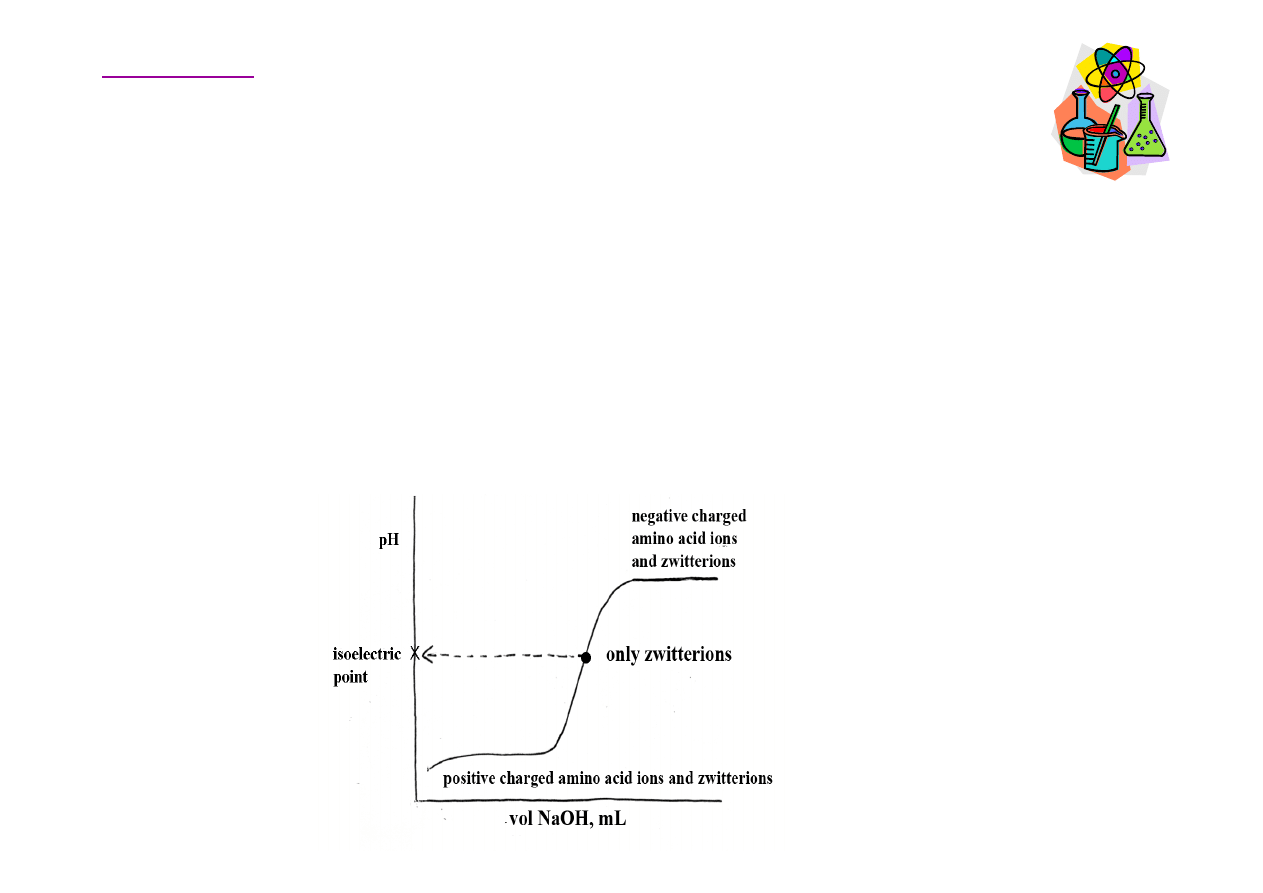
Aminokwasy – krzywa miareczkowania
Charakter amfoteryczny aminokwasów ujmuje graficznie
krzywa miareczkowania roztworów aminokwasów mocnymi
kwasami lub zasadami. Krzywa przedstawia zale
ż
no
ść
warto
ś
ci pH miareczkowanego roztworu od liczby dodanych
moli kwasu lub zasady.
Aminokwasy
http://homepages.ius.edu/DSPURLOC/C122/amino.htm
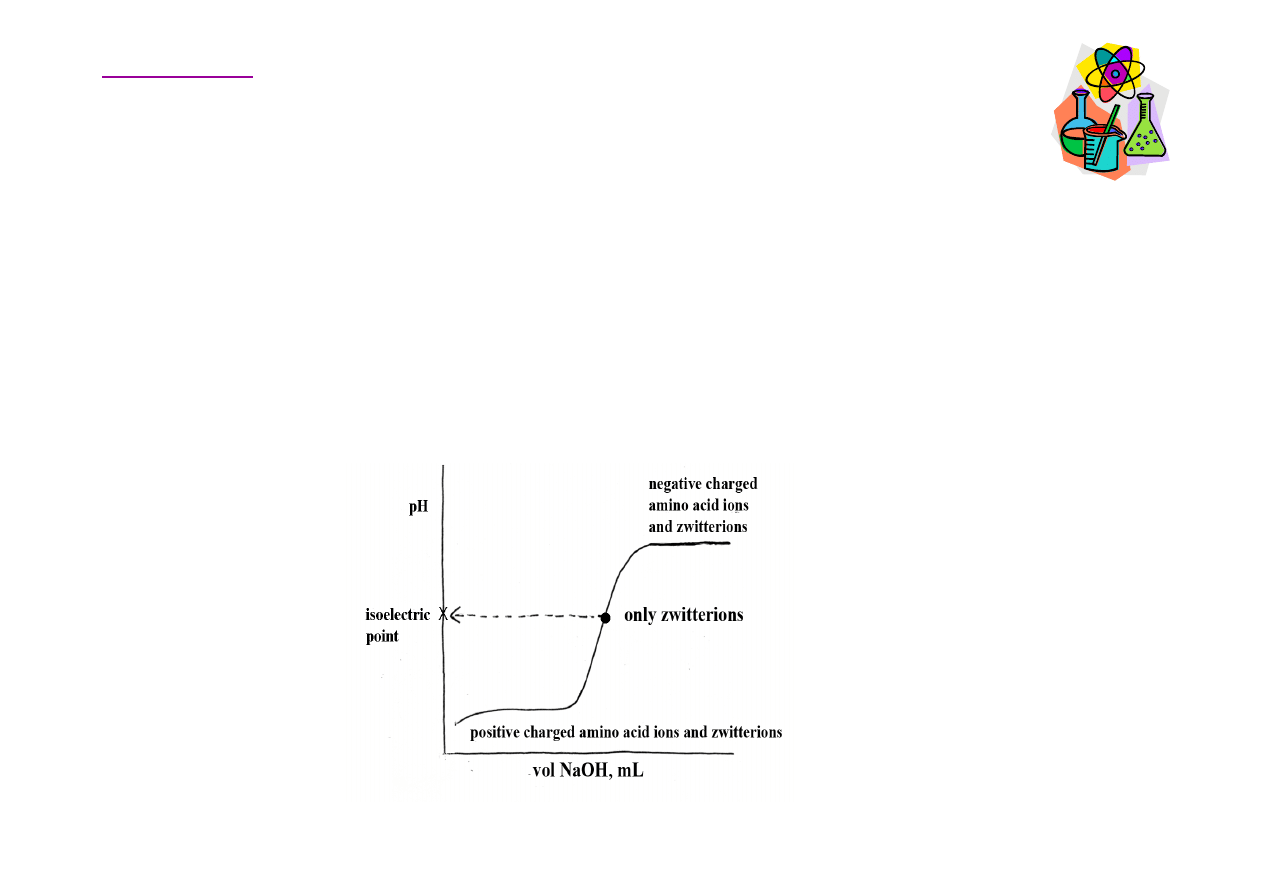
Aminokwasy – krzywa miareczkowania
Miareczkowanie roztworu aminokwasu poł
ą
czone z
jednoczesnym pomiarem pH roztworu pozwala na
do
ś
wiadczalne wyznaczenie krzywej dysocjacji
aminokwasu i okre
ś
lenie jego warto
ś
ci pI.
Aminokwasy
http://homepages.ius.edu/DSPURLOC/C122/amino.htm
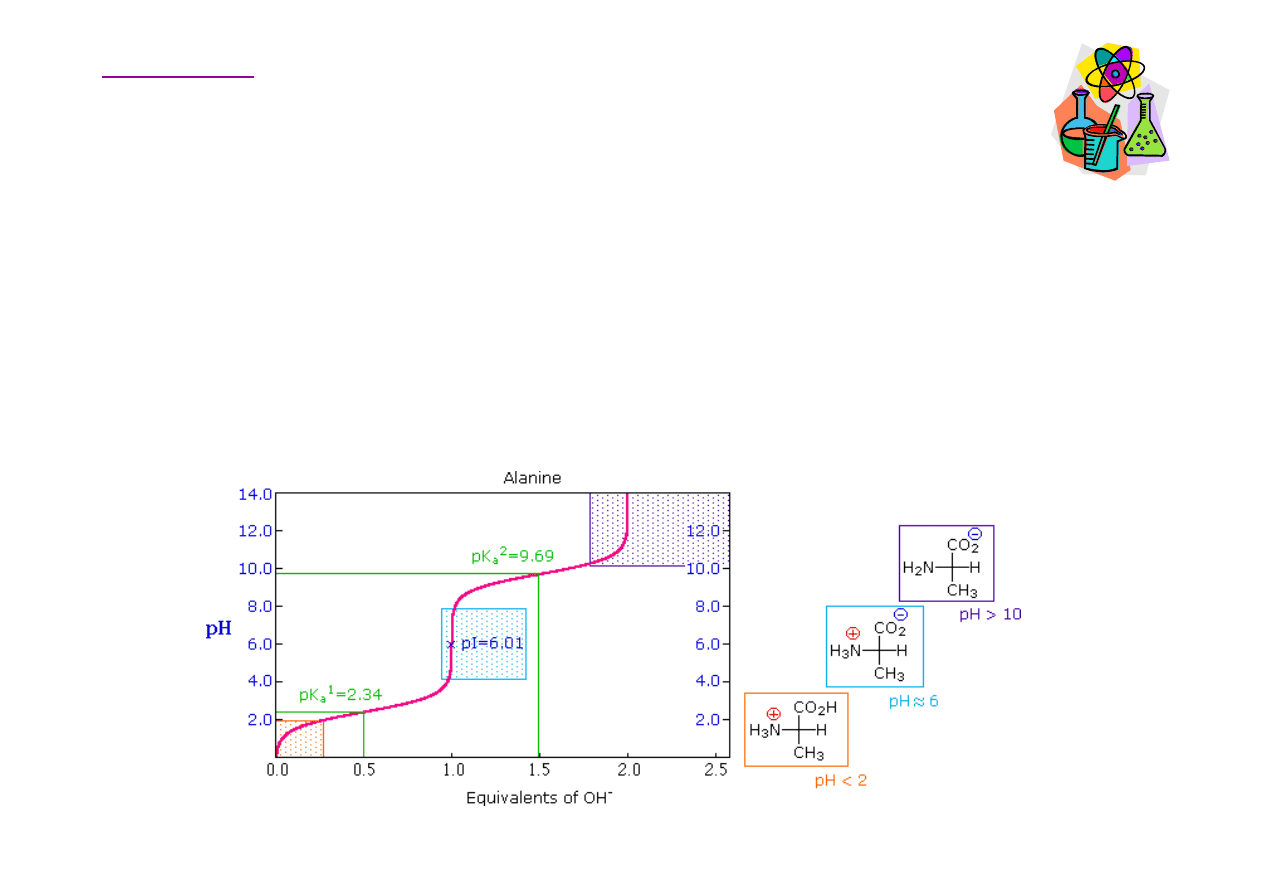
Krzywa miareczkowania alaniny
Gdy pH > 10, grupa aminowa jest oboj
ę
tn
ą
zasad
ą
, a grupa
karboksylowa wyst
ę
puje w formie COO
-
, st
ą
d cz
ą
steczka alaniny netto
ma ładunek ujemny. W po
ś
rednim pH wzrasta ilo
ść
jonu obojnaczego, a
ż
w punkcie izoelektrycznym wyst
ę
puje tylko jon obojnaczy z ładunkiem
netto równym 0. W pH< 2 grupa aminowa wyst
ę
puje w formie NH
3
+
,
grupa karboksylowa w formie COOH, ładunek netto dodatni.
Aminokwasy
http://chemwiki.ucdavis.edu/Textbook_Maps/Map%3A_Bruice_2nd_%22Essential_Organic_Chemistry%22/16%3A_The_Organic_Chemistry_of_Amino_Acids%2C_Peptides%2C_and_Proteins/16.0
4%3A_The_Isoelectric_Point
Aminokwasy – punkt izoelektryczny
.
Aminokwasy
pH = 7
Asp (pI = 3)
Ala (pI = 6.01)
Arg (pI = 10.1)
Ładunek netto = -1
Ładunek netto = +1
Ładunek netto = +1
http://www.foodnetworksolution.com/wiki/word/1287/isoelectric-point-
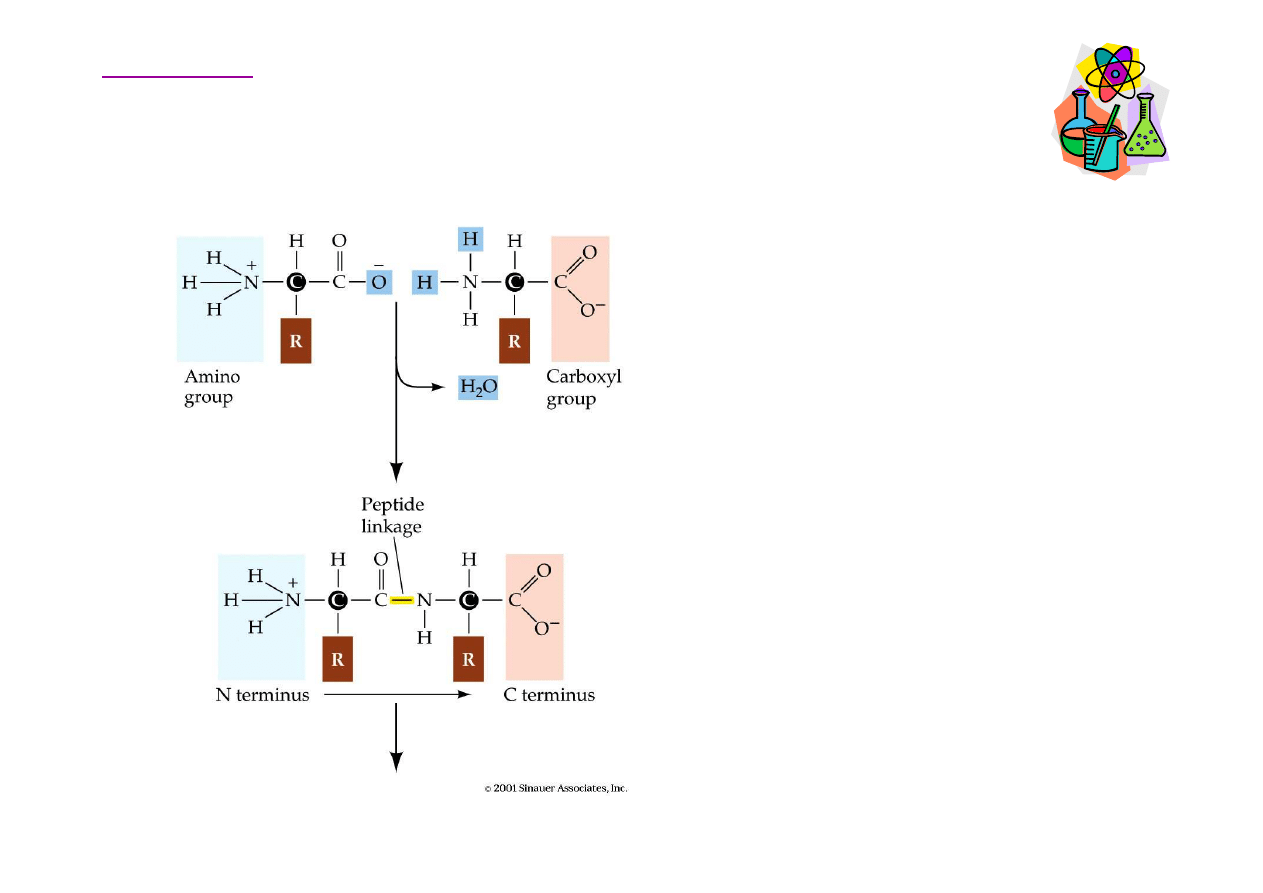
Aminokwasy – wi
ą
zanie peptydowe
Wi
ą
zanie peptydowe -
umowna nazwa wi
ą
zania
amidowego wyst
ę
puj
ą
cego
mi
ę
dzy aminokwasami
peptydów i białek. Wi
ą
zanie
peptydowe ł
ą
czy grup
ę α
-
aminow
ą
jednego
aminokwasu z grup
ą α
-
karboksylow
ą
drugiego
aminokwasu.
Aminokwasy
http://www.blc.arizona.edu/courses/schaffer/182/peptidebond.HTM
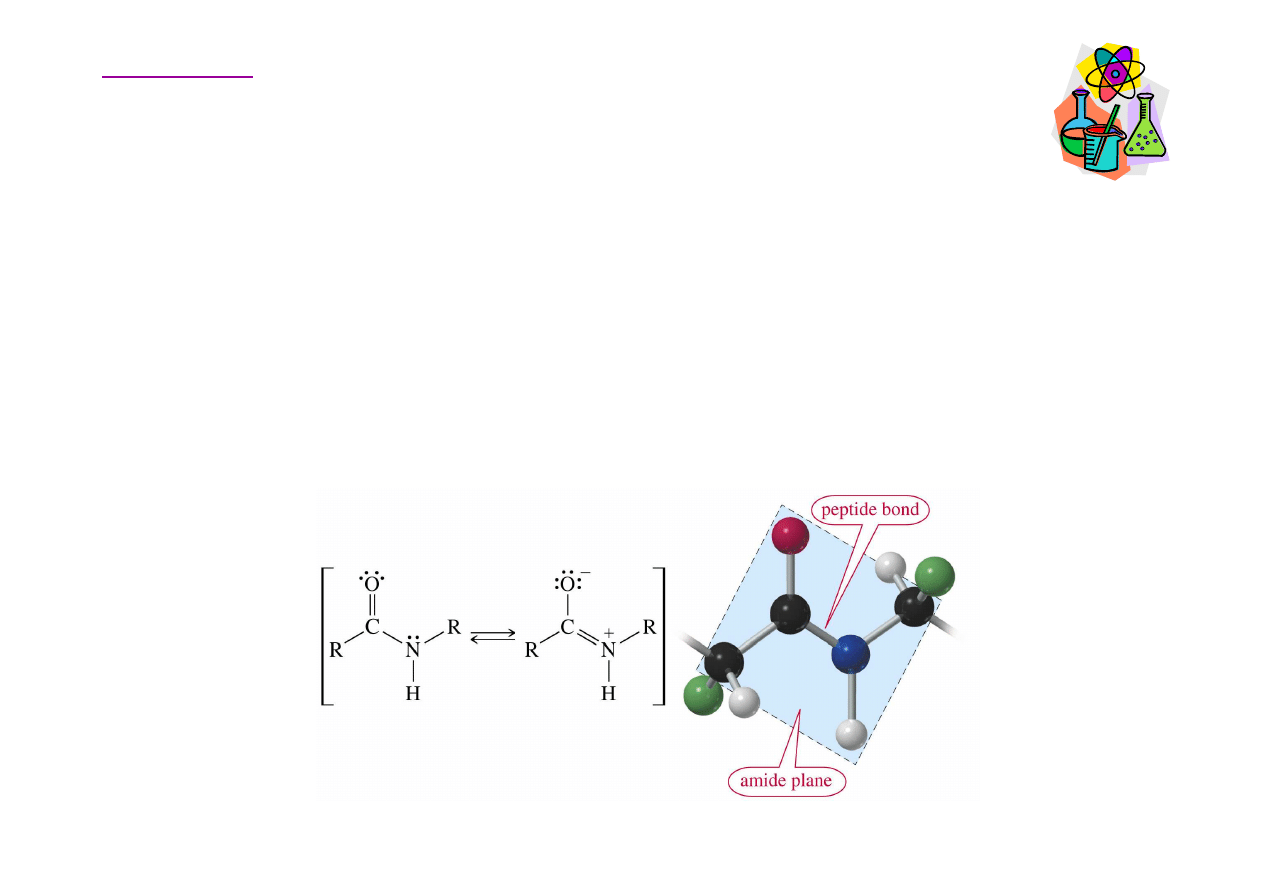
Aminokwasy – wi
ą
zanie peptydowe
Wi
ą
zanie peptydowe jest znacznie krótsze ni
ż
w przypadku
innych poł
ą
cze
ń
w
ę
gla i azotu. Jest to spowodowane
mezomerycznym charakterem wi
ą
zania peptydowego i
brakiem swobodnego obrotu wokół wi
ą
zania C-N.
Aminokwasy
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
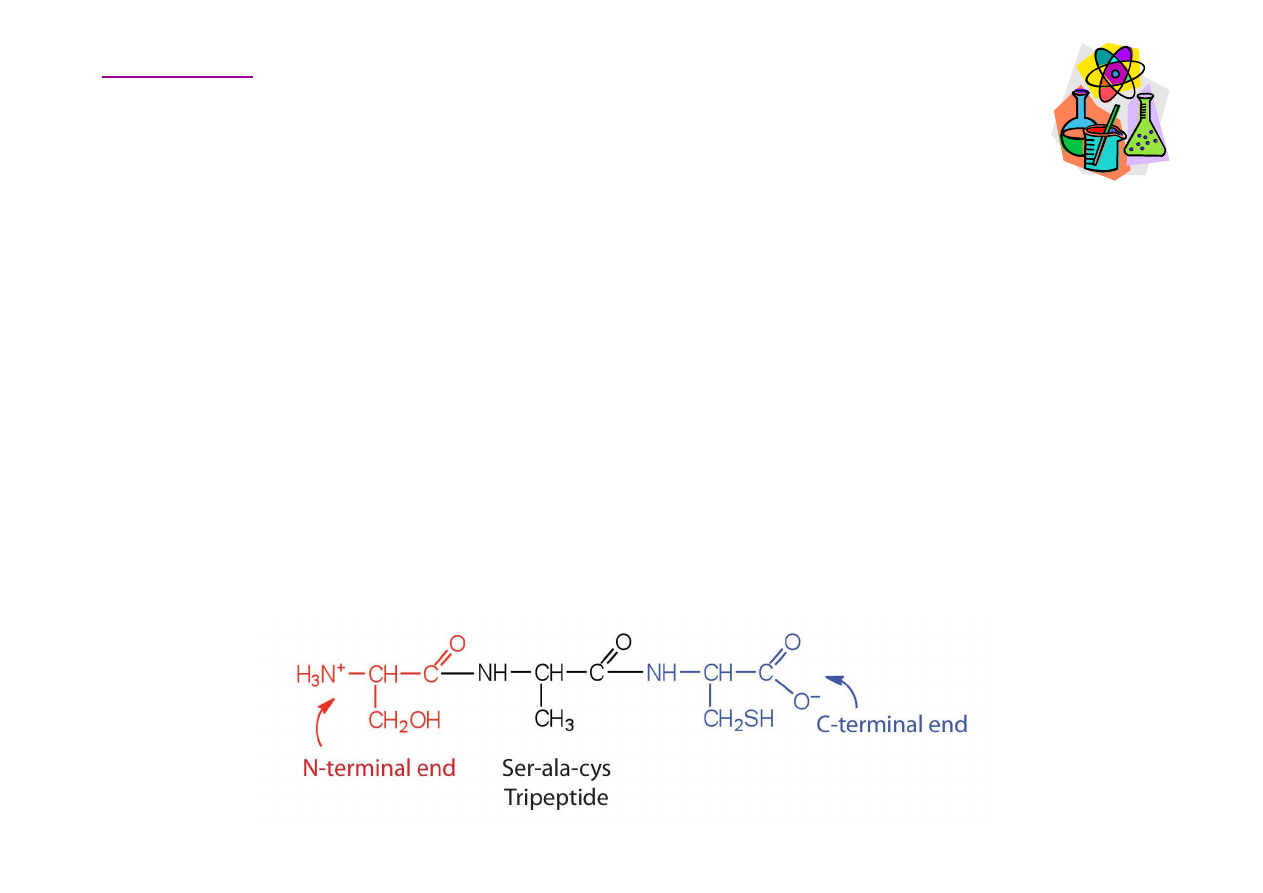
Aminokwasy – wi
ą
zanie peptydowe
Ła
ń
cuch zbudowany z dwóch reszt aminokwasowych
nazywamy dipeptydem, z trezch trójpeptydem. Zgodnie z
umow
ą
, N-terminaln
ą
(N-ko
ń
cow
ą
) reszt
ę
aminokwasu (tzn.
ugrupowanie z woln
ą
grup
ą
aminow
ą
) zapisuje si
ę
na
lewym ko
ń
cu, C-terminaln
ą
(tzn. ugrupowanie z woln
ą
grup
ą
karboksylow
ą
) zapisuje si
ę
na prawym ko
ń
cu
ła
ń
cucha cz
ą
steczki peptydu.
Aminokwasy
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-03-peptides.html
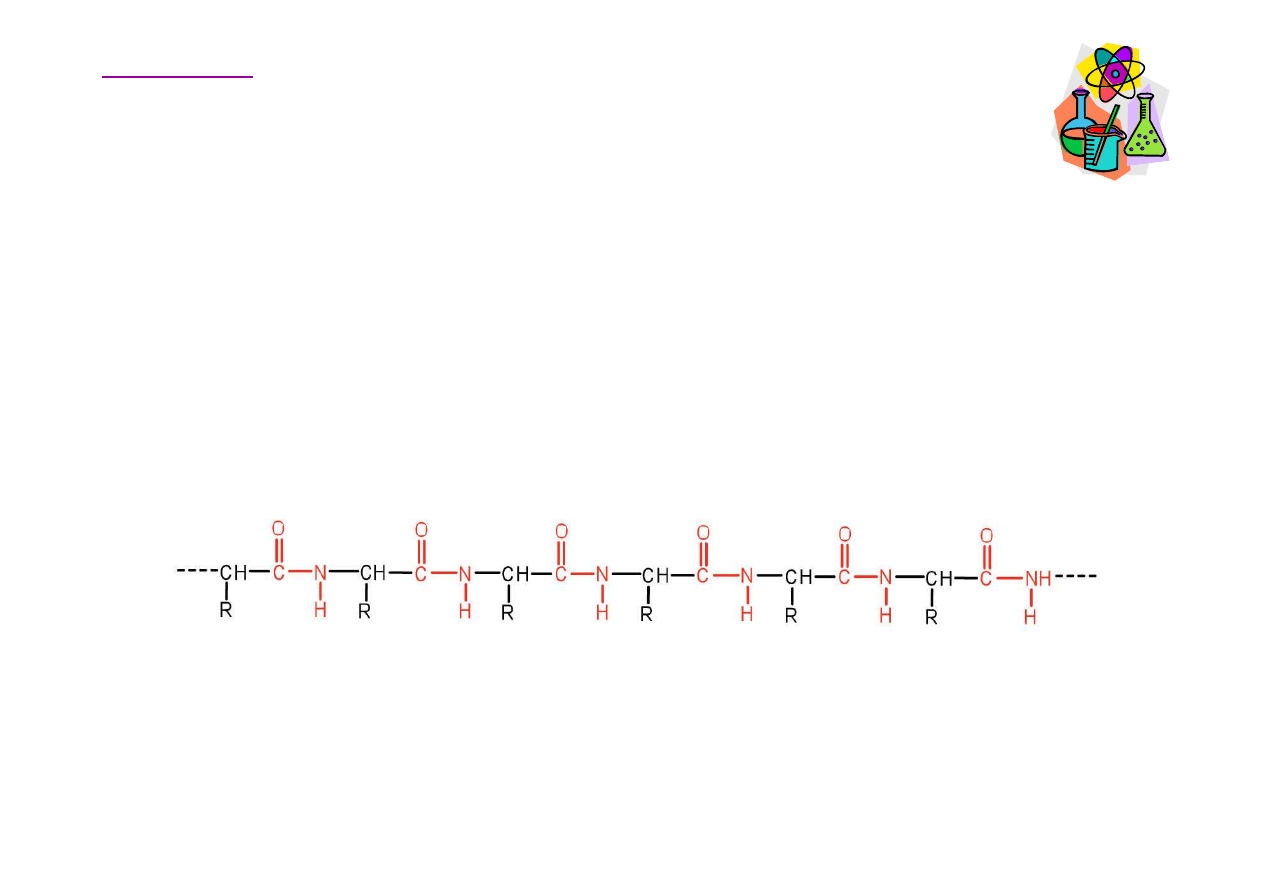
Aminokwasy – peptydy
Ogólny termin peptyd odnosi si
ę
do ła
ń
cucha
aminokwasów o nieokre
ś
lonej długo
ś
ci. Zazwyczaj
przyjmuje si
ę
,
ż
e ła
ń
cuch zbudowany z około 50
aminokwasów (lub wi
ę
cej) to białko (polipeptyd).
Aminokwasy
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-03-peptides.html
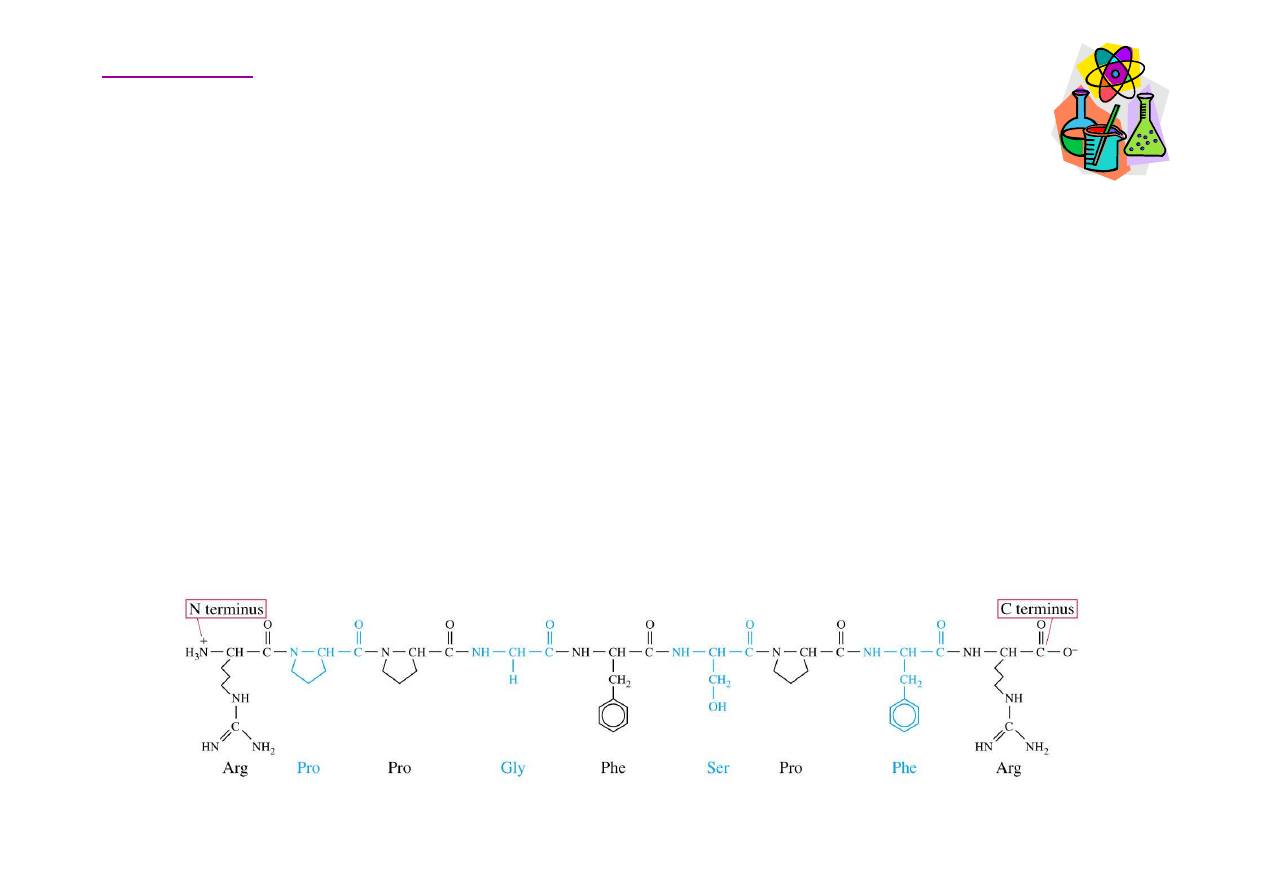
Aminokwasy – peptydy
Aby peptydy i białka mogły by
ć
fizjologicznie aktywne,
istotna jest nie tylko ilo
ść
, ale odpowiednia kolejno
ść
aminokwasów. Bradykinina, nonapeptyd wytwarzany we
krwi (hormon uczestnicz
ą
cy w reakcjach zapalnych i
alergicznych) ma nast
ę
puj
ą
c
ą
sekwencj
ę
aminokwasow
ą
:
Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg
Aminokwasy
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-03-peptides.html
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
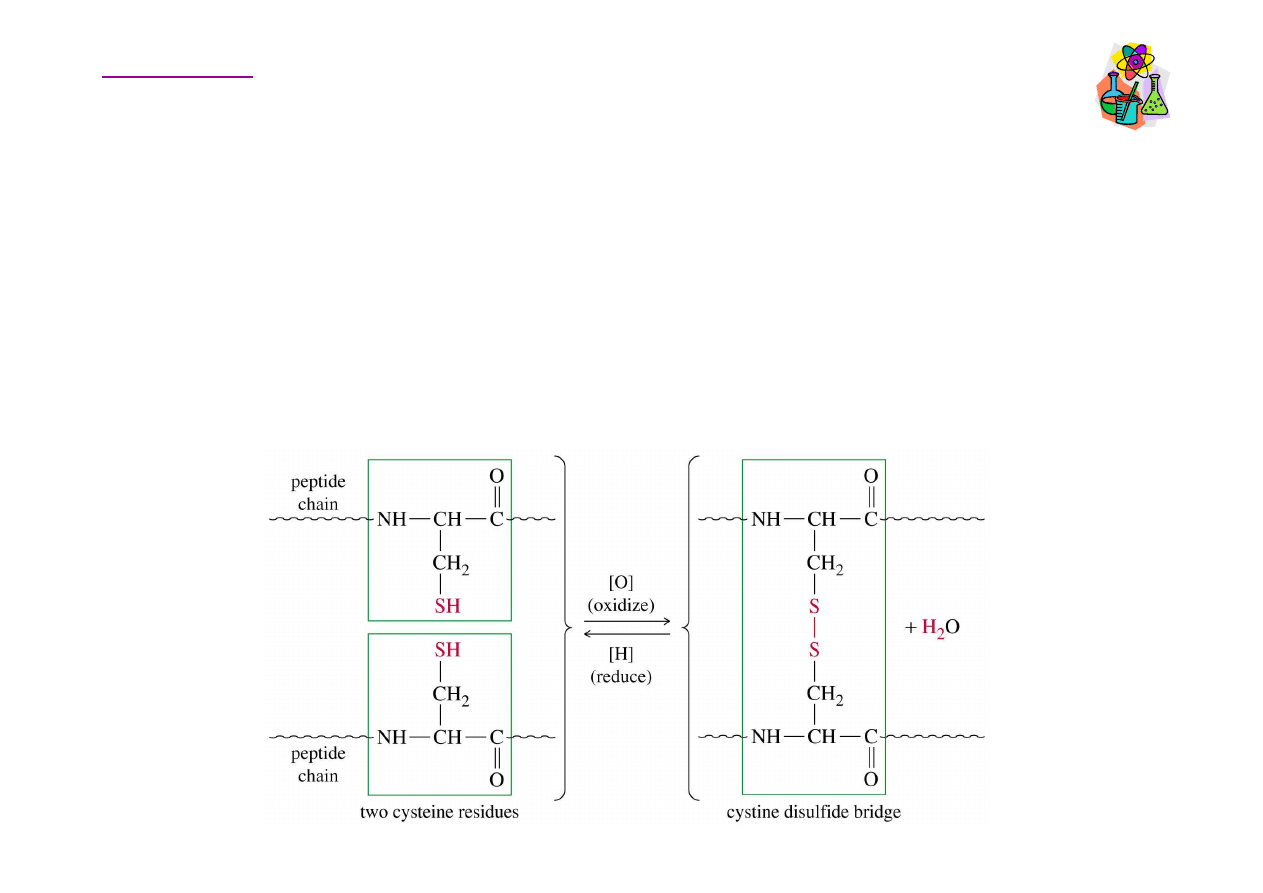
Wi
ą
zania dwusiarczkowe
Cystyna – dimer cystein, powstaje, gdy dwie reszty cysteinowe
ulegaj
ą
utlenieniu tworz
ą
c mostek dwusiarczkowy (disulfidowy)
(-S-S-). Łagodne utlenianie dwóch cz
ą
steczek zawieraj
ą
cych
ugrupowanie tiolowe (-SH) prowadzi do powstania mostka
dwusiarczkowego, ł
ą
cz
ą
cego te cz
ą
steczki.
Aminokwasy
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
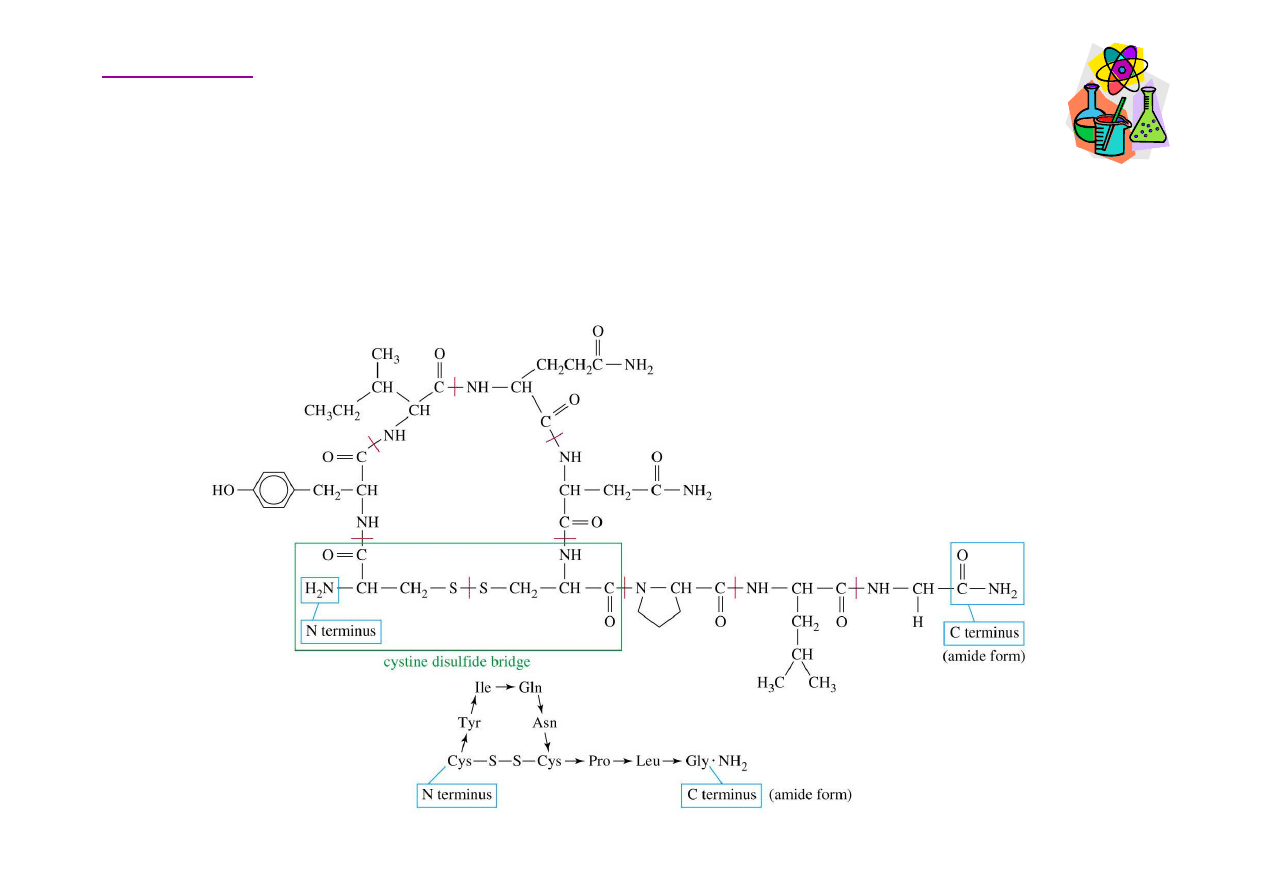
Mostek dwusiarczkowy – struktura ludzkiej
oksytocyny
Oksytocyna jest nonapeptydem zawieraj
ą
cym dwie reszty
cysteinowe (pozycje 1 i 6) ł
ą
cz
ą
ce cz
ęść
cz
ą
steczki w rodzaj p
ę
tli.
Aminokwasy
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
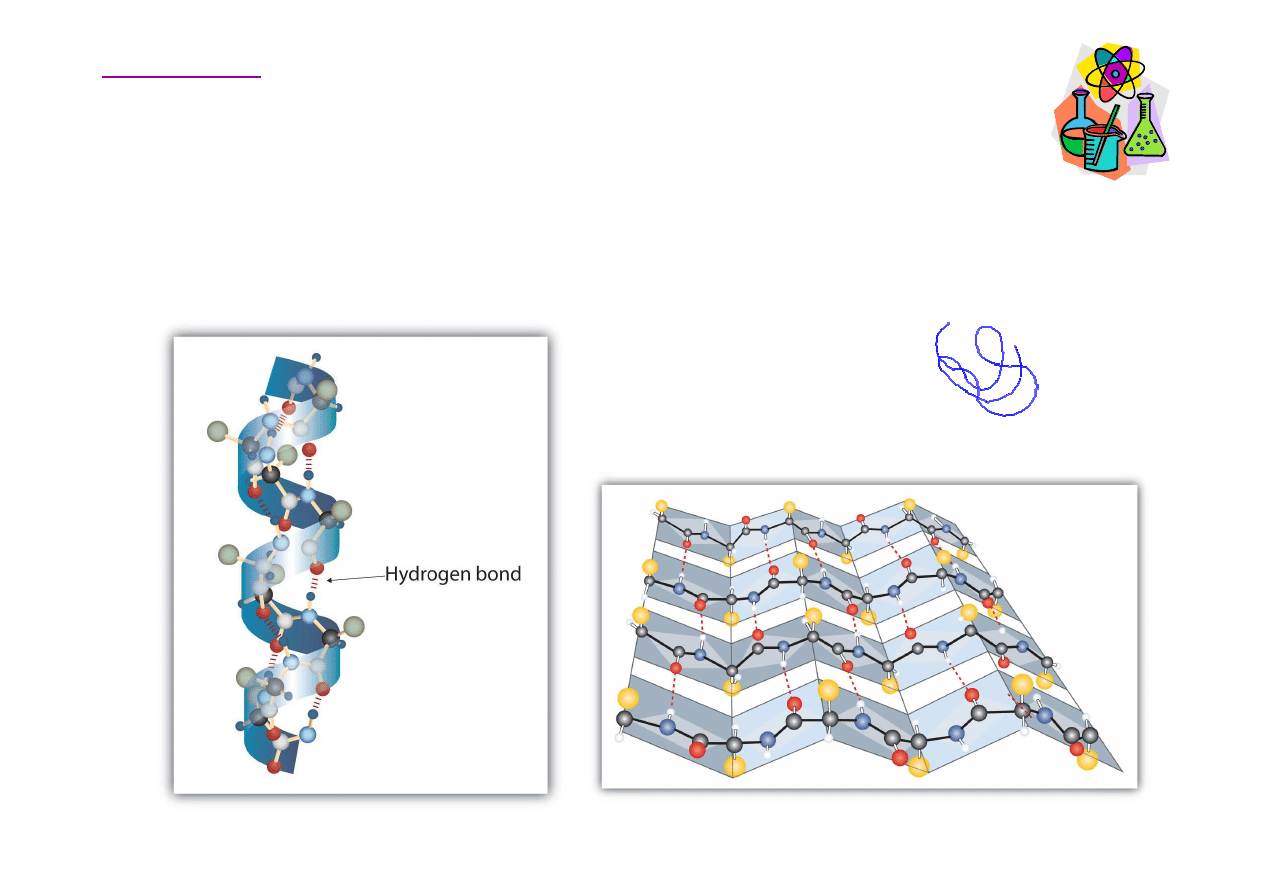
Struktura białek
Drugorz
ę
dowa struktura białek - sposób uło
ż
enia
ła
ń
cuchów w przestrzeni.
Aminokwasy.
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-04-proteins.html
α
-helisa
β
-kartka
kł
ę
bek statystyczny
http://pslc.ws/macrog/glossary.htm
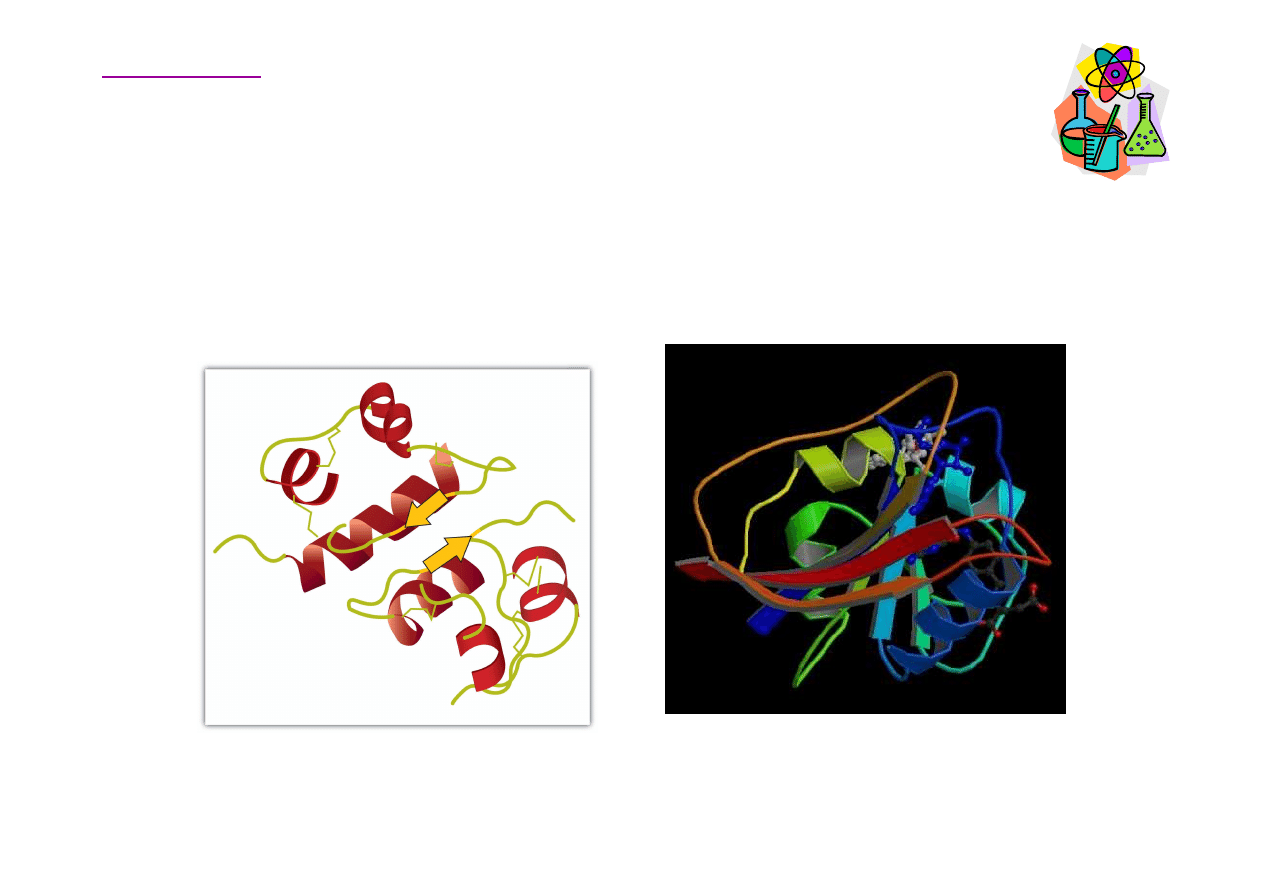
Struktura białek
Trzeciorz
ę
dowa struktura białek - wzajemny układ w
przestrzeni elementów struktury drugorz
ę
dowej.
Aminokwasy.
Trzeciorz
ę
dowa struktura insuliny
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-04-proteins.html
Trzeciorz
ę
dowa struktura
reduktazy dihydrofolianowej
http://www.chemguide.co.uk/organicprops/aminoacids/proteinstruct.html
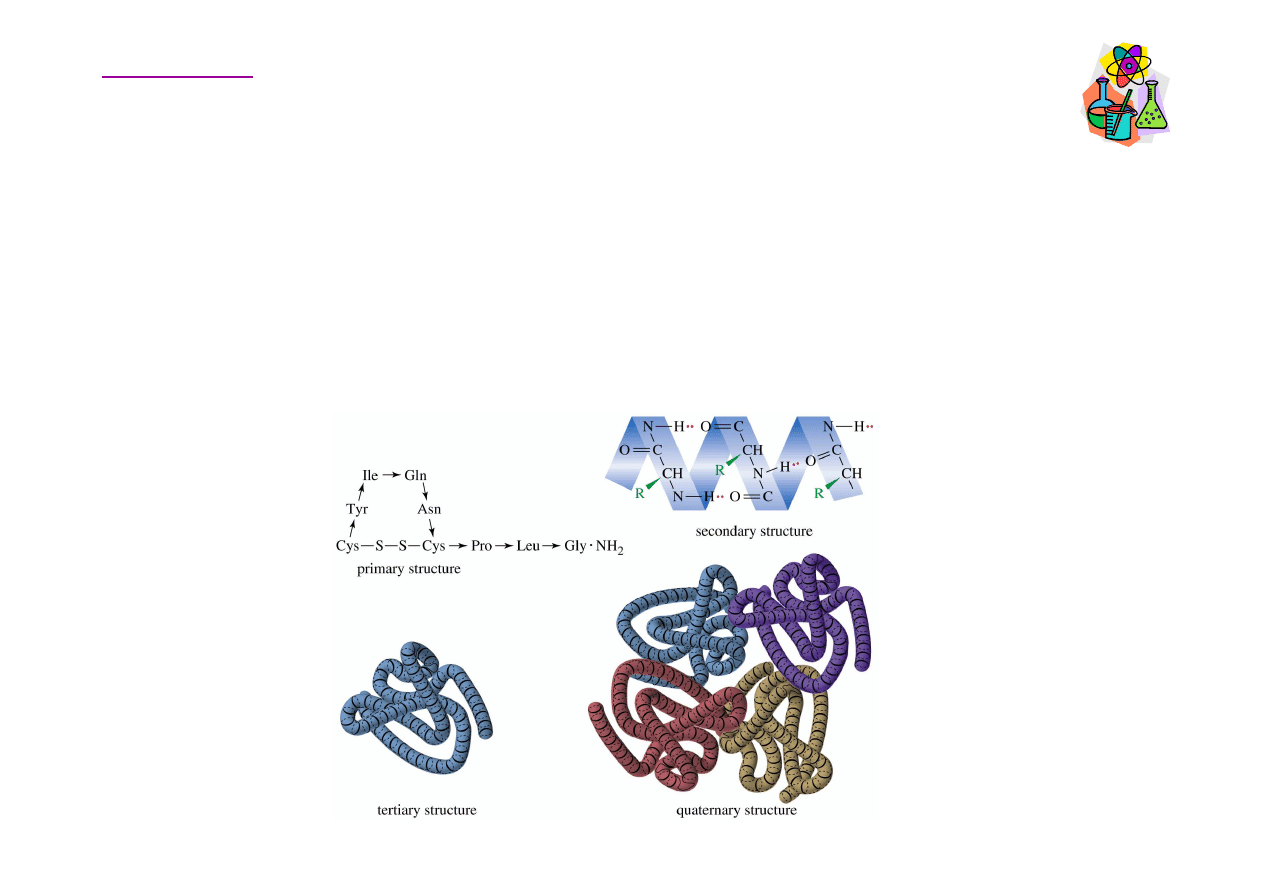
Struktura białek
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch24.html
Aminokwasy
Struktura pierwszorz
ę
dowa – liniowo poł
ą
czone aminokwasy. Struktura
drugorz
ę
dowa – sposób uło
ż
enia ła
ń
cuchów w przestrzeni (
α
-helisa,
β
-kartka,
kł
ę
bek statystyczny). Struktura trzeciorz
ę
dowa – wzajemny układ w przestrzeni
elementów struktury drugorz
ę
dowej. Czwartorz
ę
dowa struktura - wzajemny układ w
przestrzeni oraz sposób poł
ą
czenia si
ę
podjednostek, czyli osobnych ła
ń
cuchów
polipeptydowych niepoł
ą
czonych ze sob
ą
kowalencyjnie.
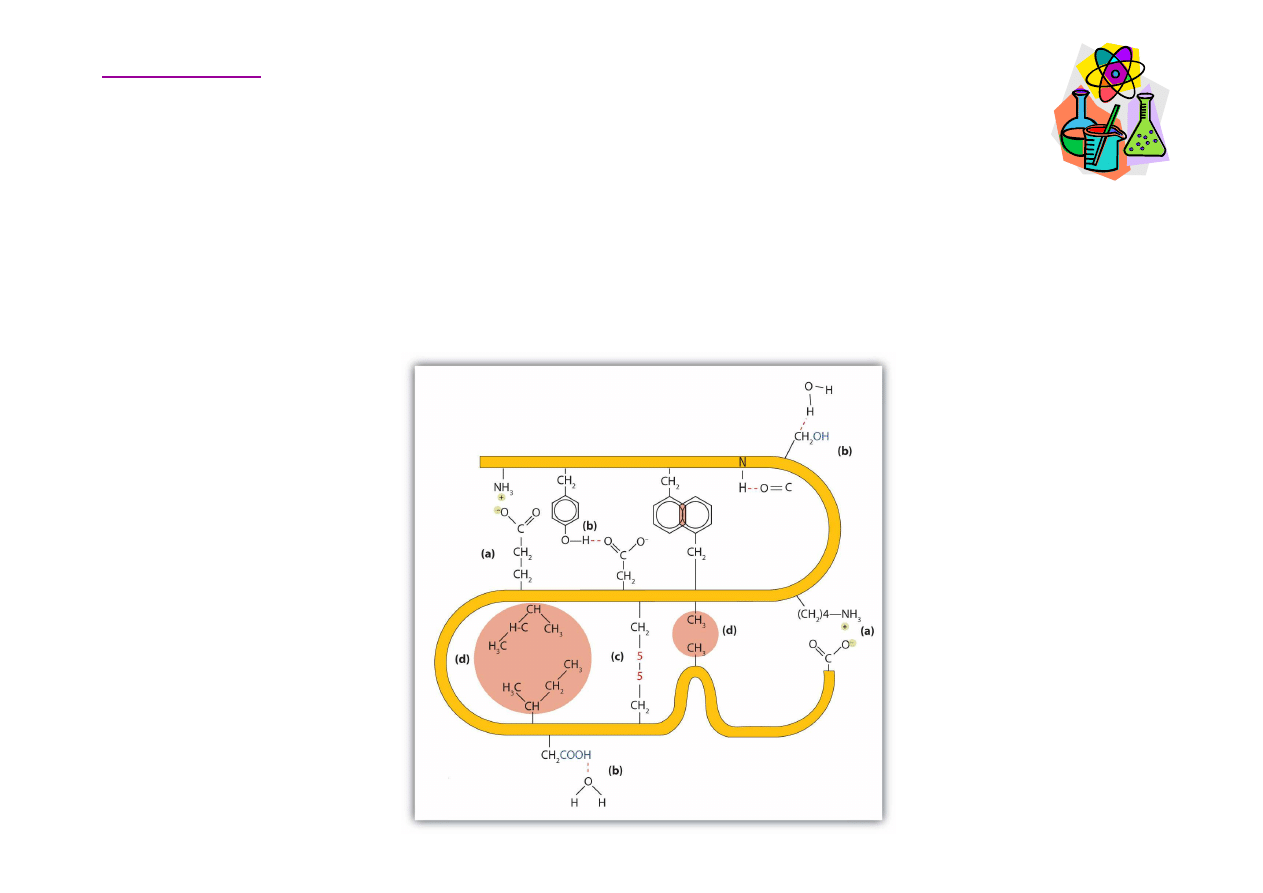
Struktura białek
Cztery rodzaje oddziaływa
ń
stabilizuj
ą
trzeciorz
ę
dow
ą
struktur
ę
białek: (a) wi
ą
zania jonowe, (b) wi
ą
zania wodorowe, (c) mostki
disiarczkowe, (d) oddziaływania hydrofobowe (siły van der Waalsa).
Aminokwasy.
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s21-04-proteins.html
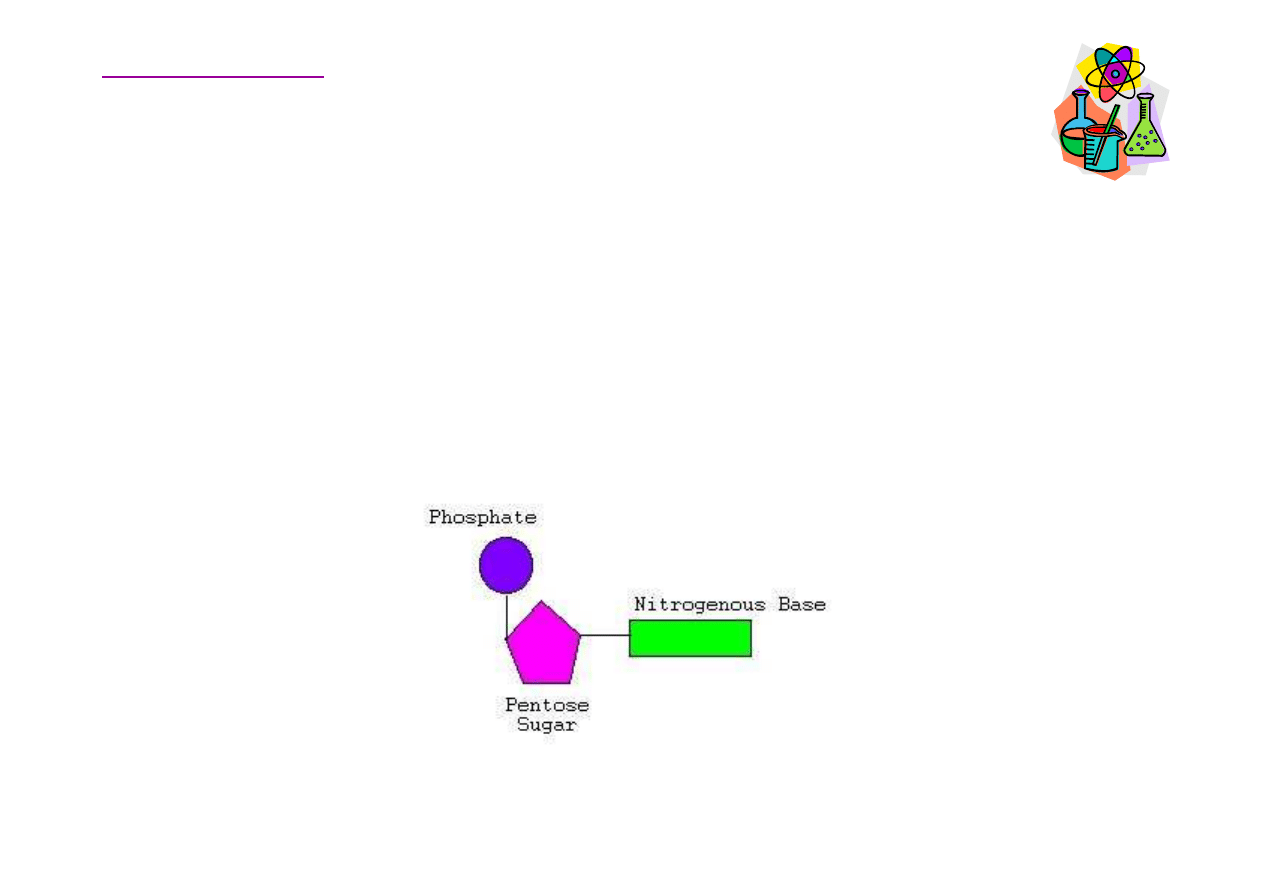
Nukleotydy
Kwasy nukleinowe zbudowane s
ą
z poł
ą
czonych ze sob
ą
,
powtarzaj
ą
cych sie monomerów – nukleotydów. Ka
ż
dy
nukleotyd zbudowany jest z trzech cz
ęś
ci: cukru – pentozy,
zasady zawieraj
ą
cej azot oraz grupy fosforanowej.
Kwasy nukleinowe
http://www.biologyjunction.com/nucleotide_model_preap.htm
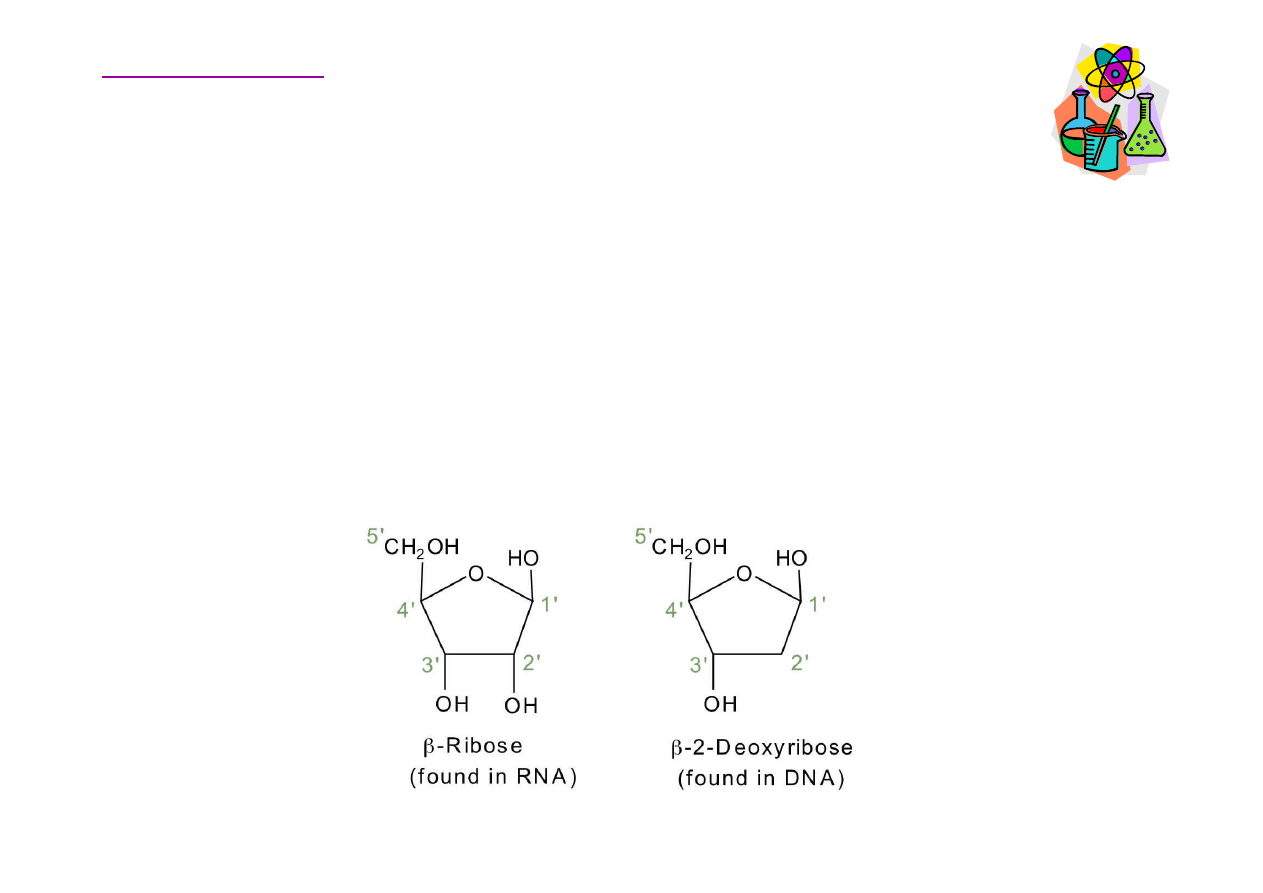
Nukleotydy – cz
ęść
cukrowa
Rybonukleotydy – w skład nukleotydu wchodzi ryboza, rybonukleotydy
buduj
ą
kwas rybonukleinowy (RNA)
Dezoksyrybonukleotydy - w skład nukleotydu wchodzi 2-
dezoksyryboza, dezoksyrybonukleotydy buduj
ą
kwas
dezoksyrybonukleinowy (DNA)
Kwasy nukleinowe
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s22-01-nucleotides.html
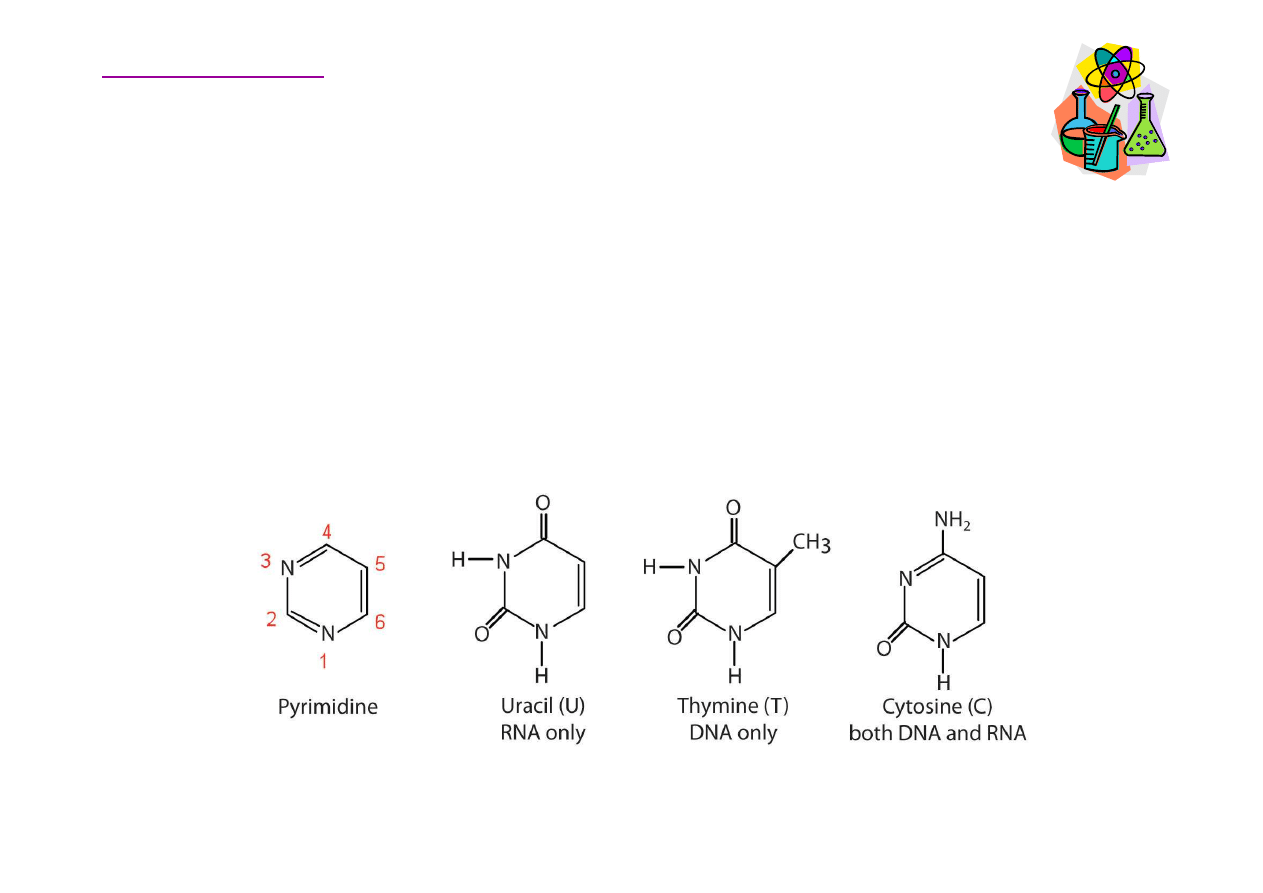
Nukleotydy – zasady azotowe (pirymidyny)
Zasady azotowe wyst
ę
puj
ą
ce w nukleotydach to
pirymidyny i puryny. Pirymidyny to heterocykliczne aminy
zawieraj
ą
ce 2 atomy azotu w sze
ś
cioczłonowym
pier
ś
cieniu – uracyl, tymina i cytozyna.
Kwasy nukleinowe
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s22-01-nucleotides.html
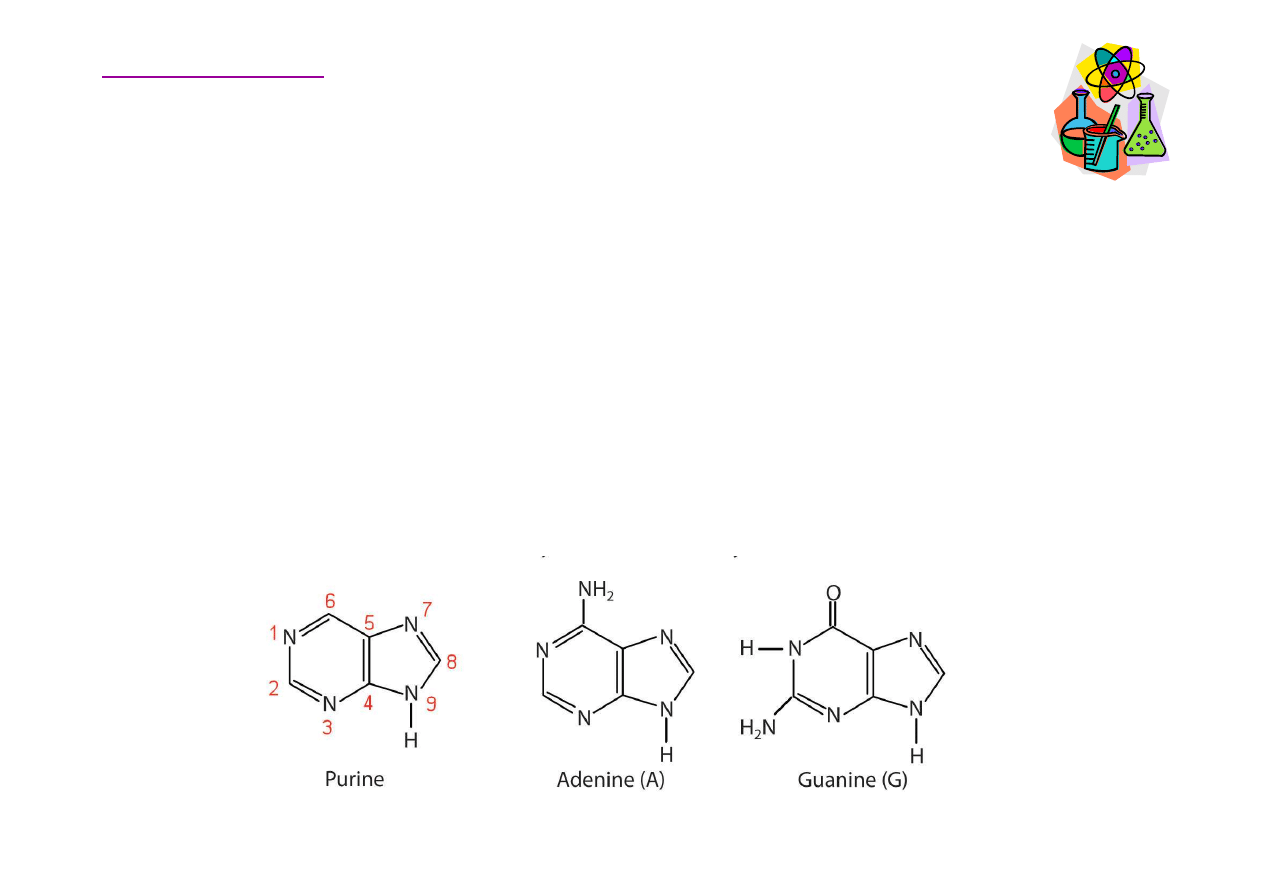
Nukleotydy - zasady azotowe (puryny)
Zasady azotowe wyst
ę
puj
ą
ce w nukleotydach to
pirymidyny i puryny. Puryny to heterocykliczne aminy
zbudowane z pier
ś
cienia pirymidynowego poł
ą
czonego z
pi
ę
cioczłonowym pier
ś
cieniem zawieraj
ą
cym dwa atomy
azotu - adenina i guanina.
Kwasy nukleinowe
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s22-01-nucleotides.html
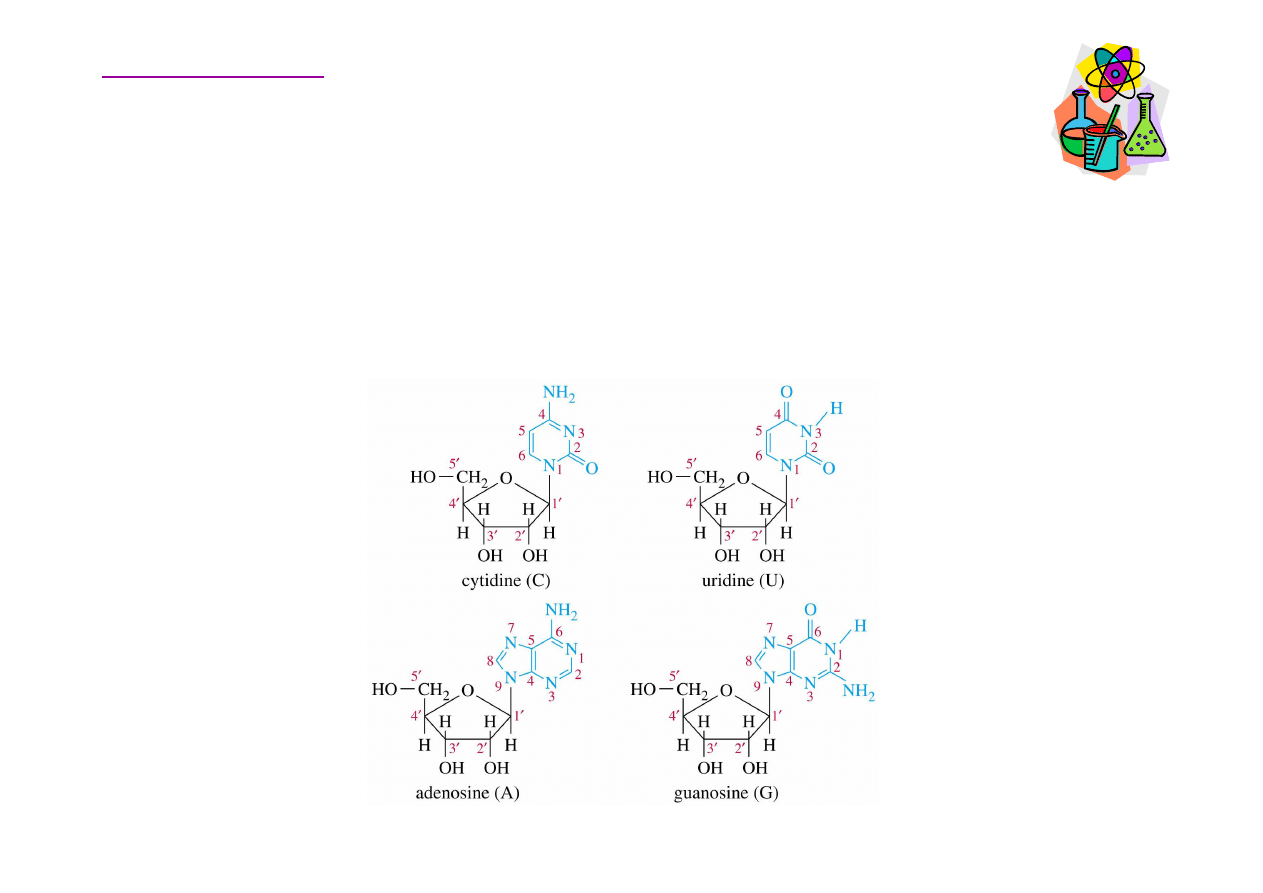
Rybonukleozydy
Wi
ą
zanie pomi
ę
dzy C1
′
rybozy a N1 zasady pirymidynowej
lub N9 zasady purynowej ł
ą
czy pentoz
ę
z zasad
ą
azotow
ą
.
Kwasy nukleinowe
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch23.html
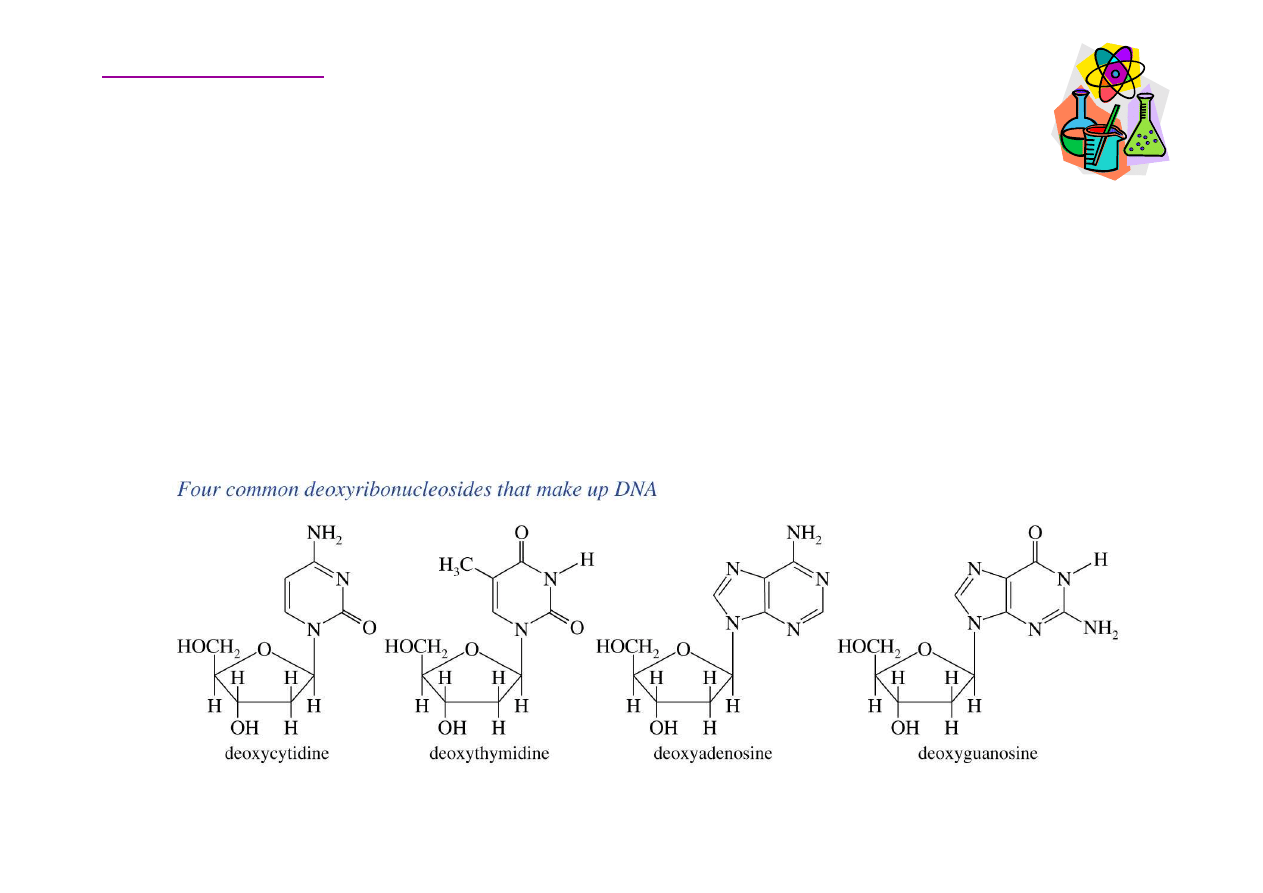
Deoksyrybonukleozydy
Wi
ą
zanie pomi
ę
dzy C1
′
2-deoksyrybozy a N1 zasady
pirymidynowej lub N9 zasady purynowej ł
ą
czy pentoz
ę
z
zasad
ą
azotow
ą
.
Kwasy nukleinowe
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch23.html
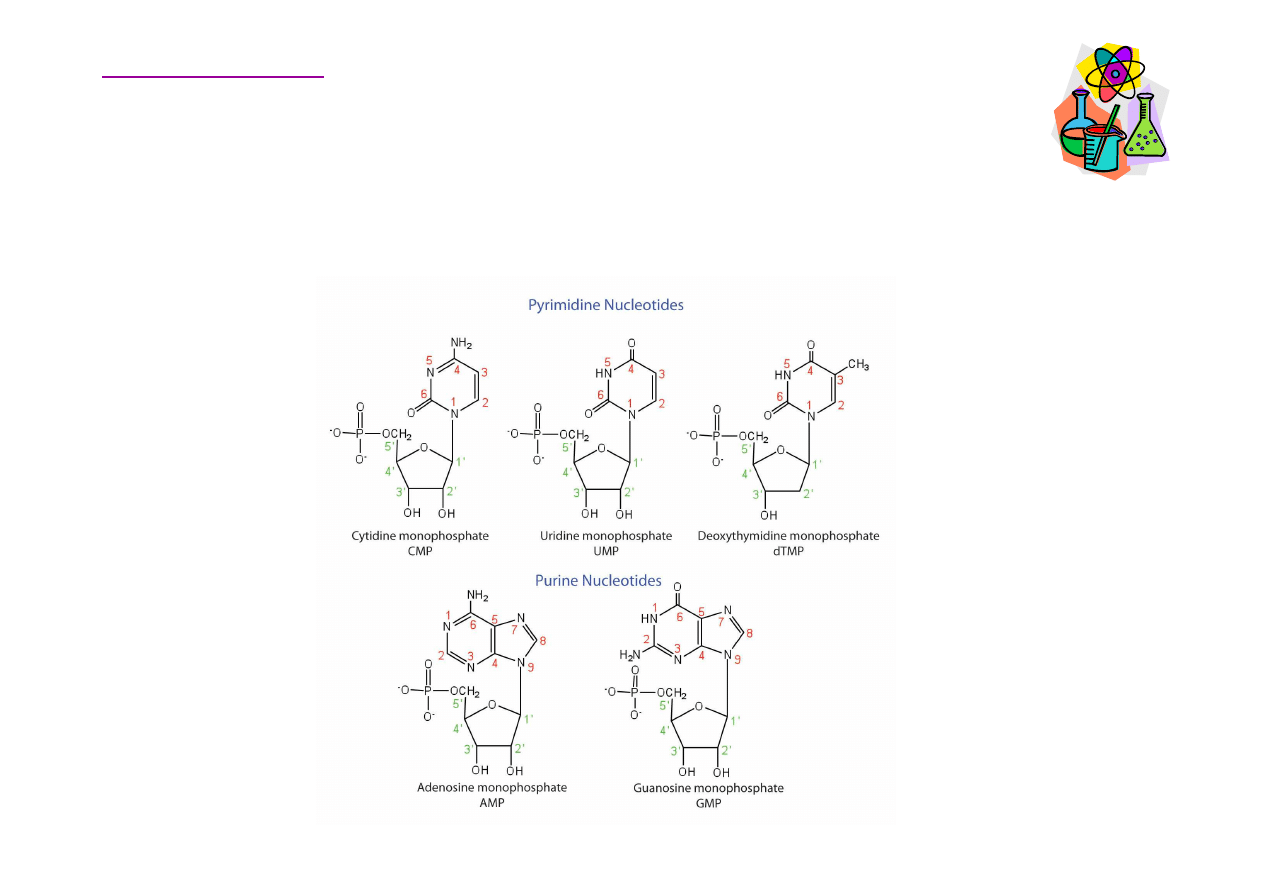
Nukleotydy pirymidynowe i purynowe
Kwasy nukleinowe
Nukleozyd + fosforan = nukleotyd
http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/s22-01-nucleotides.html
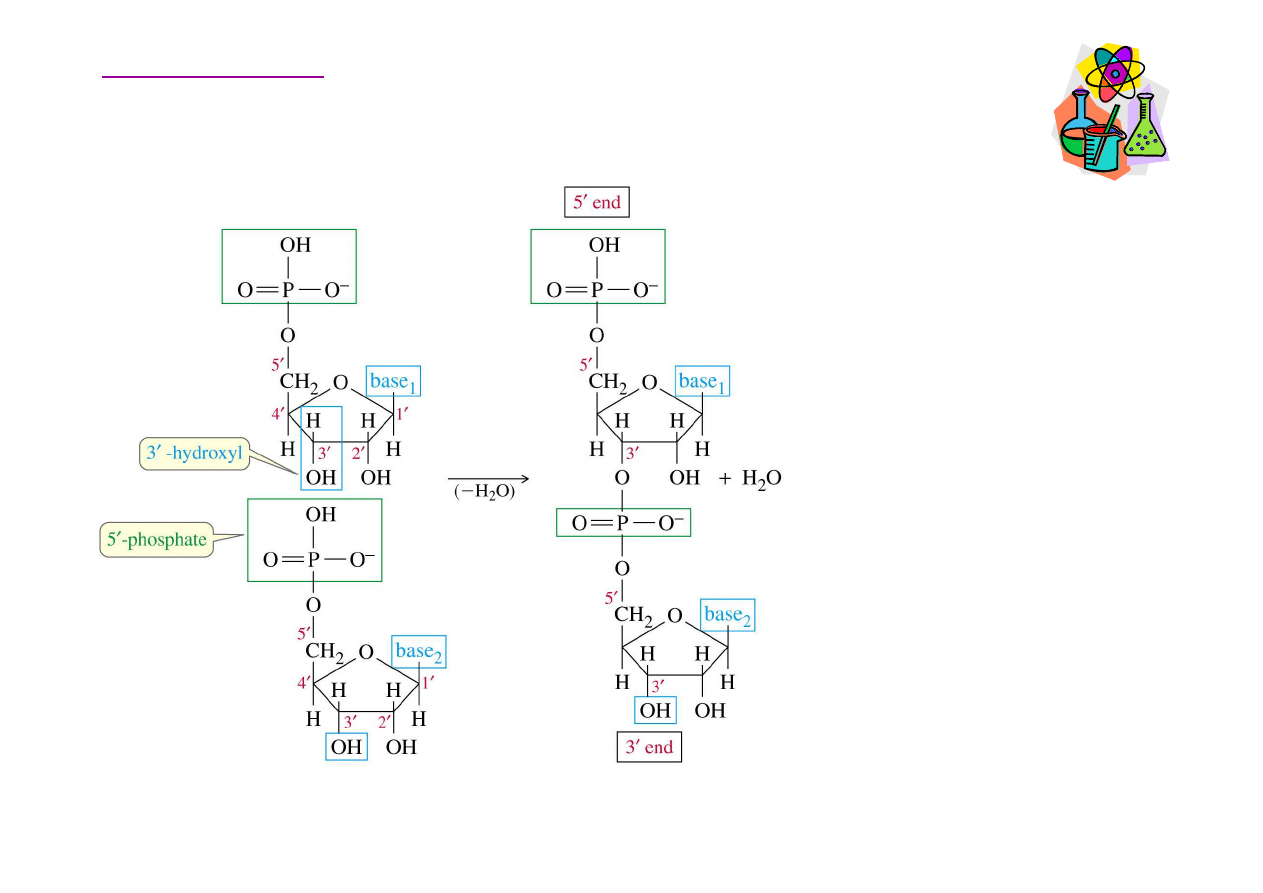
Wi
ą
zanie fosforanowe
Kwasy nukleinowe
Dwa nukleotydy s
ą
poł
ą
czone wi
ą
zaniem
fosforanowym pomi
ę
dzy
grup
ą
5'-fosforanow
ą
jednego a grup
ą
3'-
hydroksylow
ą
drugiego.
Cz
ą
steczka RNA ma
zawsze dwa ko
ń
ce: jeden
ma wolna grup
ę
3'-
hydroksylow
ą
, a drugi
woln
ą
grup
ę
5'-
fosforanow
ą
.
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch23.html
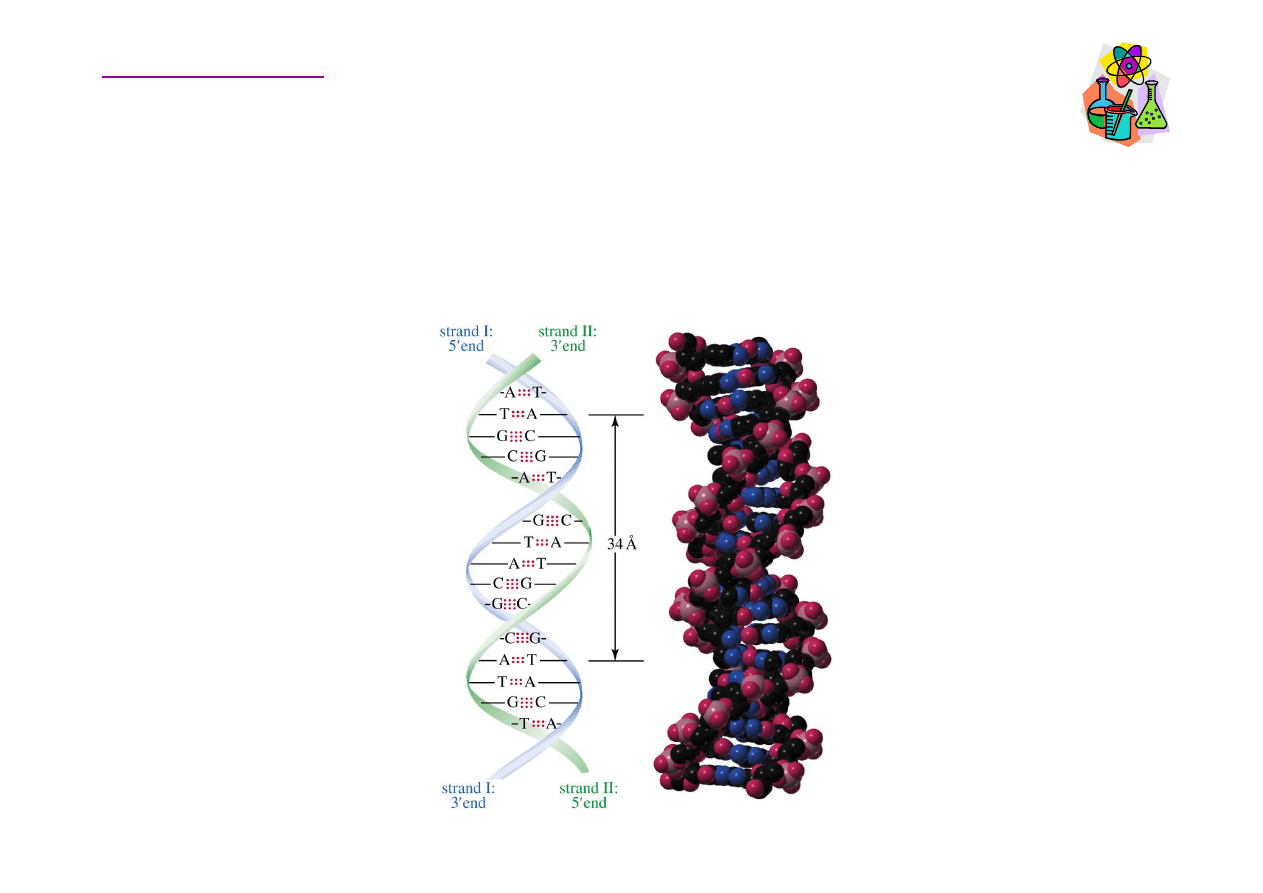
Podwójna helisa DNA
Dwie komplementarne nici s
ą
poł
ą
czone wi
ą
zaniami wodorowymi
pomi
ę
dzy parami zasad. Podwójna ni
ć
tworzy helis
ę
.
Kwasy nukleinowe
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch23.html

Dzi
ę
kuj
ę
za uwag
ę
Wyszukiwarka
Podobne podstrony:
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
mt ss w 15 2014 lato
chemia 10 2014
chemia koło 2014
chemia 14 2014
npa 15 2014
cad 1 I Cw-15 2014
CHEMIA Z TUTOREM 2014
independent trader newsletter 15, 2014
Chemia w 15
npa 15 2014
(2014) Przyjaciele Karpia 15 2014 Duża ryba
Netto 15 2014
Mini katalog 15 2014
Ćwiczenia i seminarium 1 IV rok 2014 15 druk
azga 2014 15
GiGi 4 2014 15
więcej podobnych podstron