
SPEKTROSKOPIA
UV/VIS,
SPEKTROSKOPIA IR

SPEKTROSKOPIA
to nauka o
powstawaniu i interpretacji widm
powstających w wyniku oddziaływań
wszelkiego rodzaju promieniowań na
materię rozumianą jako zbiorowisko
atomów i cząsteczek. Spektroskopia
jest też często rozumiana jako
ogólna nazwa wszelkich technik
analitycznych polegających na
generowaniu widm.

PODZIAŁ TECHNIK
SPEKTROSKOPOWYCH
Ze względu na naturę promieniowania stosowanego w
danej technice:
1.Techniki oparte na promieniowaniu
elektromagnetycznym:
spektroskopia Ramana
spektroskopia IR
spektroskopia UV-VIS
spektroskopia fourierowska
spektroskopia rentgenowska
spektroskopia NMR
spektroskopia EPR
spektroskopia dielektryczna
spektroskopia plazmowa
dichroizm kołowy

PODZIAŁ TECHNIK
SPEKTROSKOPOWYCH c.d
2.Techniki oparte na promieniowaniu cząstkami:
spektroskopia elektronowa
spektroskopia neutronowa
spektroskopia mas
spektroskopia sił atomowych
3.Techniki oparte na falach akustycznych
spektroskopia akustyczna

PODZIAŁ TECHNIK
SPEKTROSKOPOWYCH c.d
Ze względu na rodzaj oddziaływania promieniowania z
badanym ciałem:
1.Spektroskopia inwazyjna
2.Spektroskopia absorpcyjna
ESA – absorpcja ze stanów wzbudzonych
3.Spektroskopia emisyjna
4.Spektroskopia odbiciowa
spektroskopia rozproszeniowa

PARAMETRY CHARAKTERYZUJĄCE
FALĘ ELEKTROMAGNETYCZNĄ
➲
Spektroskopia UV/VIS oraz spektroskopia IR są oparte na
oddziaływaniu z falą elektromagnetyczną o różnej długości
i energii.
➲
Promieniowanie elektromagnetyczne można
scharakteryzować przez:
długość fali,
częstość (częstotliwość)
fali, amplitudę fali.
➲
Mnożąc długość fali wyrażoną w centymetrach przez
częstość wyrażoną w odwrotnych sekundach, otrzymujemy
prędkość poruszania się fali elektromagnetycznej w cm/s.
➲
Energia jednego fotonu zmienia się wprost proporcjonalnie
do częstości fali elektromagnetycznej, a jest odwrotnie
proporcjonalna do długości fali.

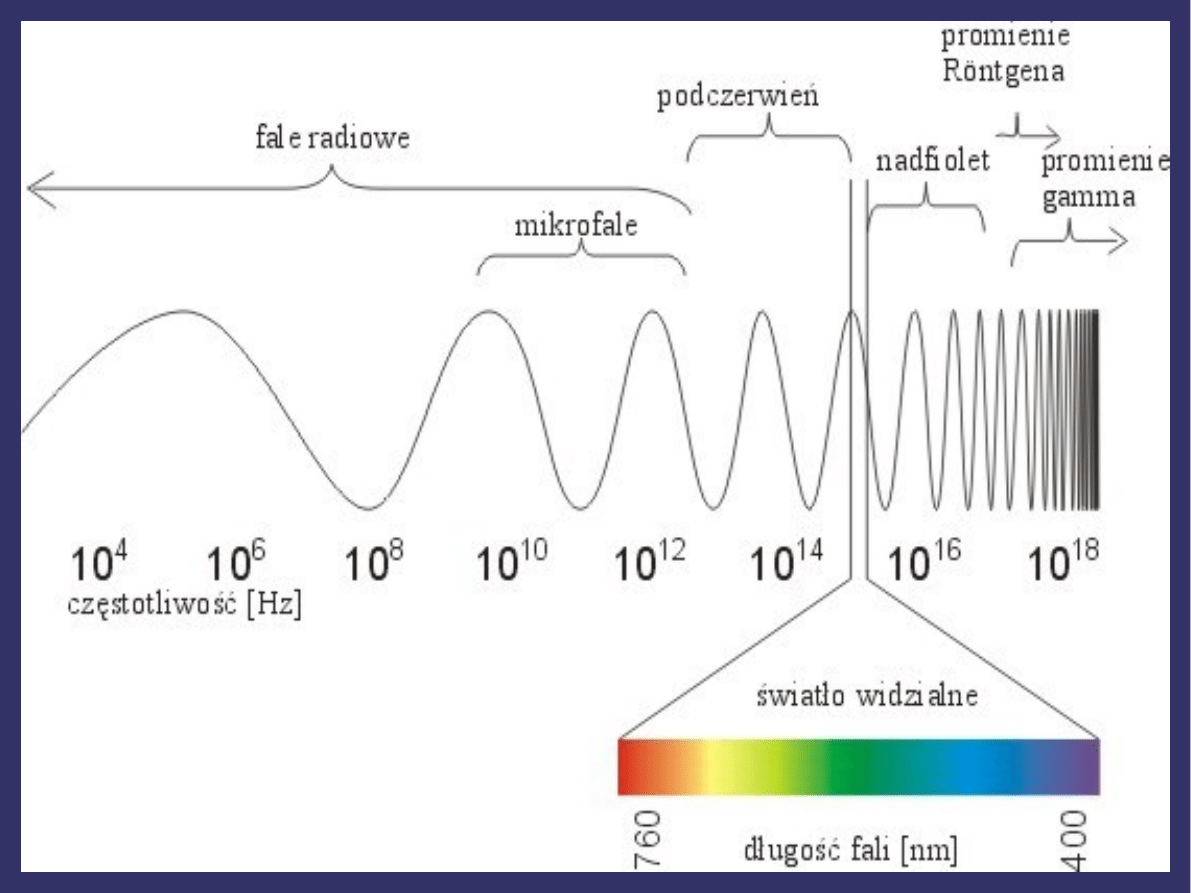
WIDMO PROMIENIOWANIA
ELEKTROMAGNETYCZNEGO
➲
Fale elektromagnetyczne można podzielić ze względu na
częstotliwość lub długość, taki podział nazywa się widmem
fal elektromagnetycznych.
➲
Obejmuje ono fale radiowe, mikrofale, promieniowanie
podczerwone, światło widzialne, promieniowanie
ultrafioletowe, promieniowanie rentgenowskie,
promieniowanie gamma.
➲
Zakresy poszczególnych rodzajów promieniowania:
Fale radiowe - od kilku mm do kilku km,
Mikrofale – 1mm-30cm,
Podczerwień - 780nm-1mm,
Światło widzialne – 380-780nm,
Ultrafiolet – 100-380nm,
Promieniowanie rentgenowskie – 5pm-10nm,
Promieniowanie gamma - <124pm.

Podstawowe terminy i
prawa rządzące
technikami
spektroskopowymi
opartymi na
promieniowaniu UV,
VIS i IR

WIDMA OPTYCZNE
➲
Zależność natężenia promieniowania
elektromagnetycznego od częstości lub
długości fali nazywamy widmem tego
promieniowania.
➲
Widmo promieniowania, obejmujące zakres
długości fal od ultrafioletu poprzez przedział
widzialny do podczerwieni, nazywane jest
widmem optycznym.

KLASYFIKACJA WIDM
OPTYCZNYCH
➲
Istnieją zasadniczo dwa rodzaje widm:
emisyjne absorpcyjne
➲
Z kolei, zarówno widma emisyjne, jak i absorpcyjne, dzieli
się na widma:
liniowe – składające się z wyraźnych oddzielonych
linii, występujące w przypadku świecenia rozrzedzonych
gazów jednoatomowych,
pasmowe – składające się z szeregu posiadających
wyraźne brzegi pasm, obserwowane przy świeceniu
cząsteczek par (pasma składają się z bardzo dużej ilości
linii), ciągłe – wysyłane przez atomy ogrzanych do
wysokiej temperatury ciał stałych i cieczy.

Liniowe widmo emisyjne azotu
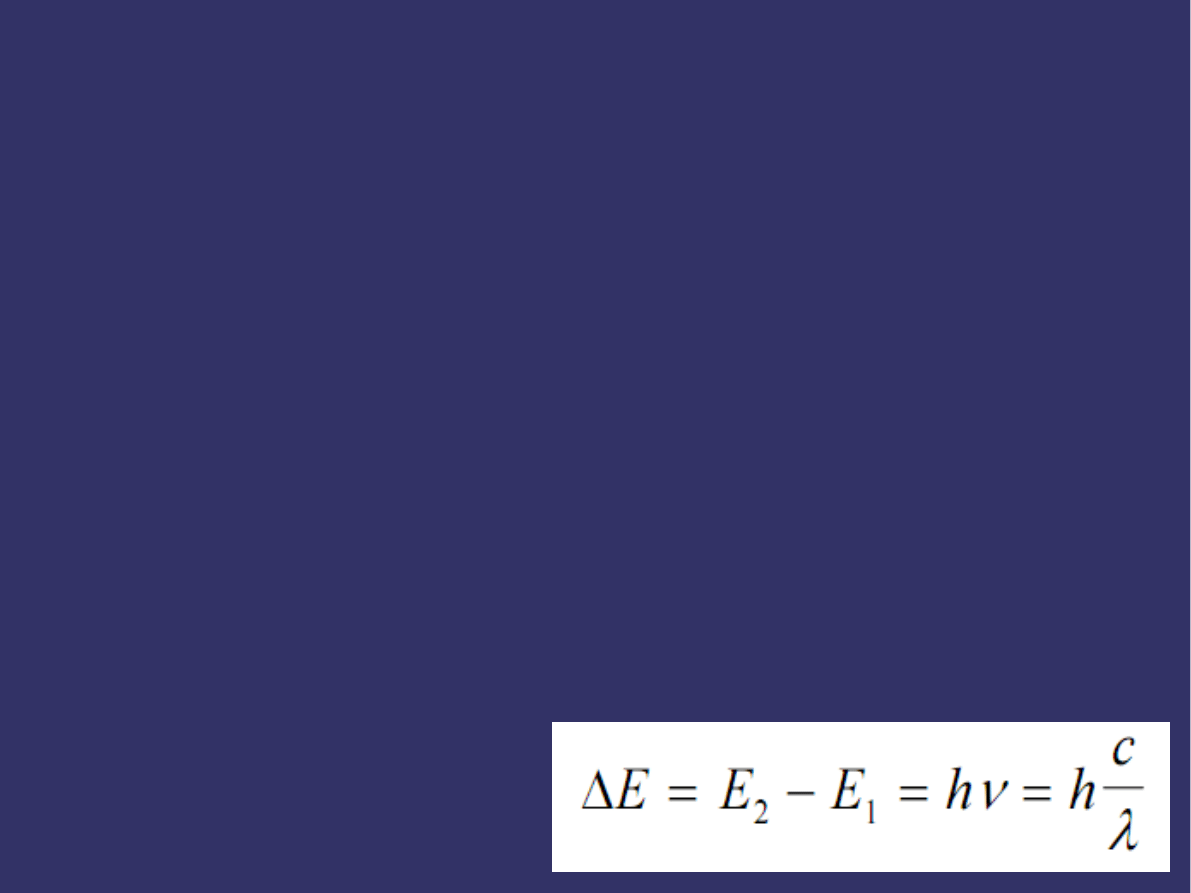
POZIOMY ENERGETYCZNE
ELEKTRONU W ATOMIE
➲
Atom znajduje się w stanie stacjonarnym wtedy, gdy nie
wypromieniowuje energii.
➲
Stan stacjonarny o najniższej, dopuszczalnej dla danego
atomu, energii nazywa się stanem podstawowym.
➲
Aby elektron mógł przejść do któregoś stanu o wyższej
energii (stanu wzbudzonego), atom musi pochłonąć
określoną porcję energii.
➲
Elektron przebywa w stanie wzbudzonym bardzo krótko
po czym wraca do stanu o mniejszej energii
wypromieniowując jej nadmiar w postaci fali świetnej.
➲
Częstość drgań emitowanego promieniowania związana
jest z różnicą energii stanów, między którymi następuje
przejście promieniste wzorem:

ORBITALE MOLEKULARNE I
PRZEJŚCIA ELEKTRONOWE
➲
Orbitale dzielimy na:
1.orbitale atomowe - orbitale te opisują wszystkie
elektrony, które w danym momencie nie uczestniczą w
tworzeniu wiązań chemicznych, ale są przypisane do
określonych jąder atomowych.
2.orbitale molekularne - orbitale
te opisują elektrony w cząsteczce, które w danym
momencie mogą (ale nie muszą) tworzyć wiązania
chemiczne. Orbitale molekularne dzielą się z kolei na:
orbitale wiążące,
orbitale antywiążące,
orbitale niewiążące

ORBITALE MOLEKULARNE I
PRZEJŚCIA ELEKTRONOWE c.d.
➲
Wśród orbitali atomowych wyróżnia się:
orbitale s - o kształcie sferycznym,
orbitale p - o kształcie "hantli" , orbitale
d i f - o bardziej złożonych kształtach w których
występuje kombinacja "hantli" i torusów.
➲
Orbitale molekularne wiążące klasyfikuje się najczęściej
na: orbitale σ - które powstają w wyniku czołowego
nałożenia się orbitali s lub p,
orbitale π - które powstają w wyniku bocznego
nałożenia się orbitali p, d lub f ,
orbitale δ - mają 2 płaszczyzny węzłowe zawierające
oś międzyjądrową.

ORBITALE MOLEKULARNE I
PRZEJŚCIA ELEKTRONOWE c.d.
➲
Dany orbital (poziom energetyczny) może pomieścić co
najwyżej dwa elektrony o różnym spinie. Podczas
wzbudzenia elektronowego elektron zostaje
przeniesiony z jednego orbitalu molekularnego na inny.
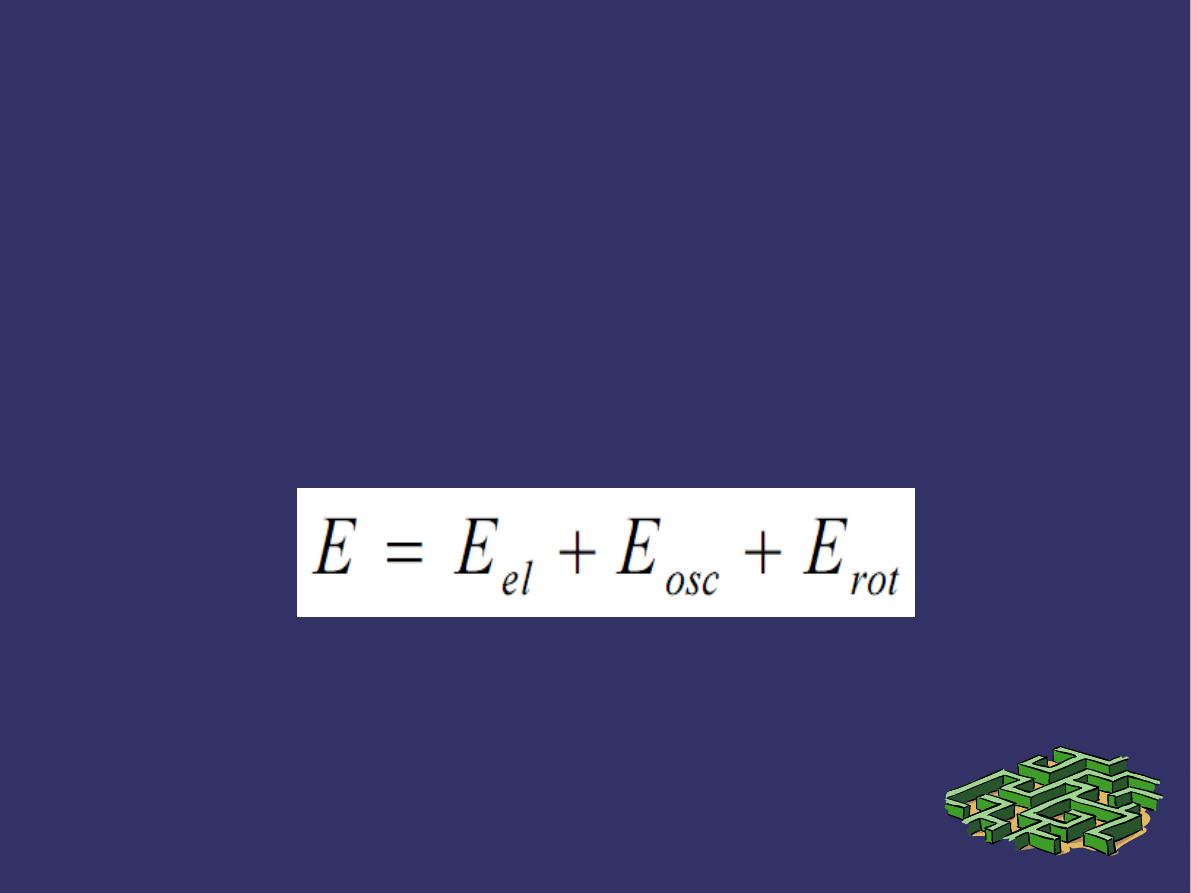
POZIOMY ENERGETYCZNE
CZĄSTECZKI
➲
Energia układu związanych ze sobą atomów, jakim jest
cząsteczka, to:
energia elektronów,
energia oscylacji,
energia rotacji cząsteczki.
➲
Energię całkowitą cząsteczki można opisać
następującym wzorem:
➲
Gdzie:
E
el
– energia elektronów,
E
os
– energia oscylacyjna,
E
r
– energia ruchu rotacyjnego.

POZIOMY ENERGETYCZNE
CZĄSTECZKI c.d.
Układ poziomów energetycznych cząsteczki można
przedstawić jako zespół poziomów elektronowych (różne
wartości E
el
, E
osc
= E
rot
= 0), każdemu z nich odpowiada
grupa poziomów oscylacyjnych (różne wartości E
osc
, E
rot
=
0), a każdemu poziomowi oscylacyjnemu odpowiadają
różne poziomy rotacyjne (różne wartości E
rot
).
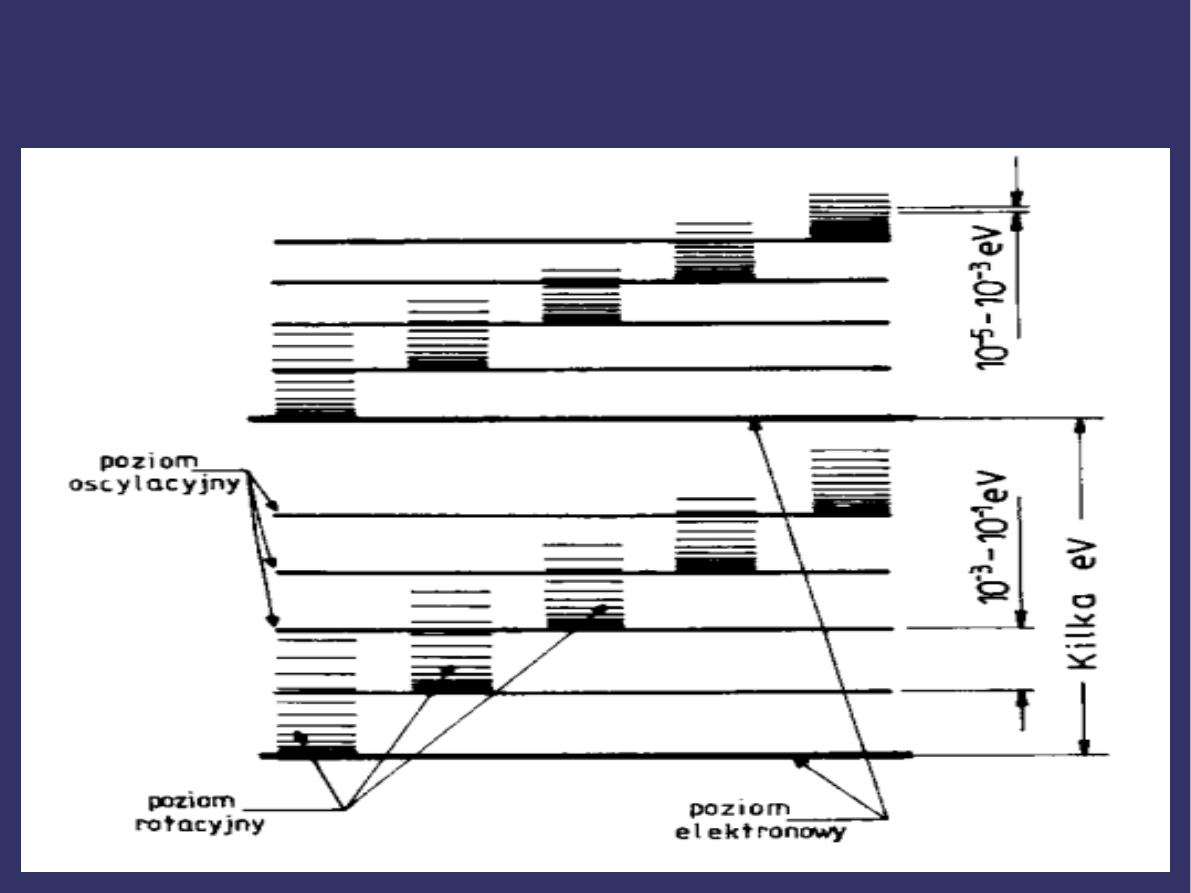
SCHEMAT UKŁADU POZIOMÓW ENERGETYCZNYCH
MOLEKUŁY DWUATOMOWEJ
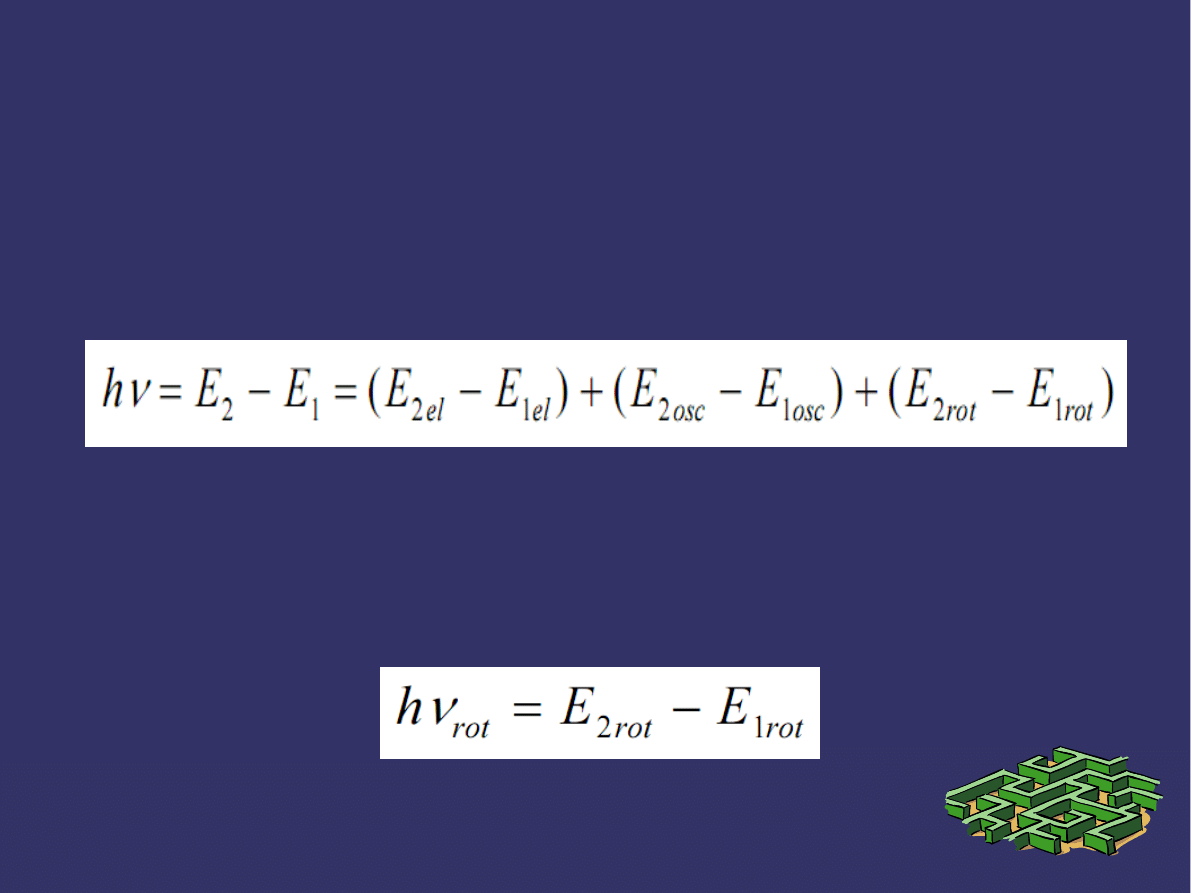
PRZEJŚCIA ENERGETYCZNE
➲
Podczas przechodzenia ze stanu o energii początkowej E
1
do stanu energii końcowej E
2
cząsteczka emituje bądź
absorbuje promieniowanie o częstości ν spełniającej relację:
➲
Jeżeli poziom energetyczny elektronów w cząsteczce
nie zmienia się i bez zmian pozostaje poziom oscylacji,
to równanie przybiera postać:
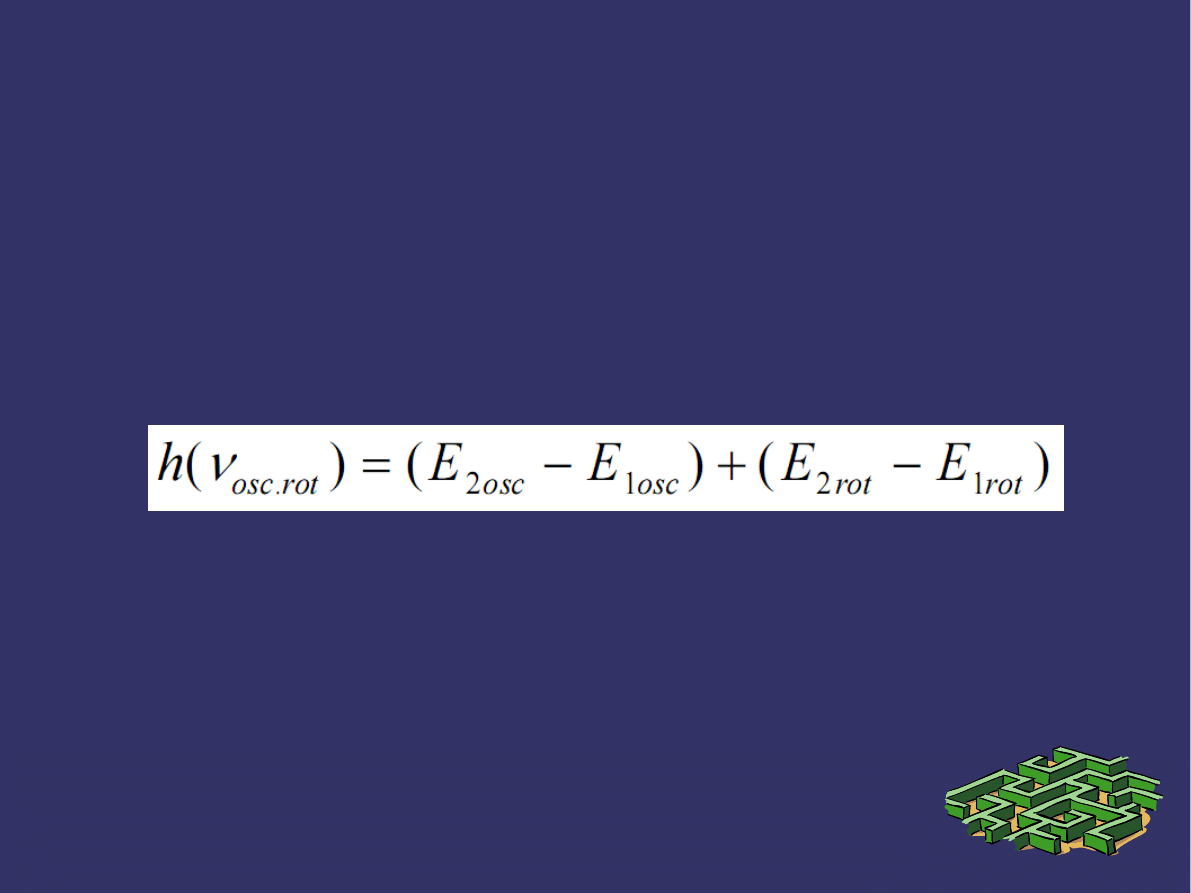
PRZEJŚCIA ENERGETYCZNE c.d.
➲
Obrazem tego są linie widma rotacyjnego w dalekiej
podczerwieni lub w zakresie mikrofalowym.
➲
Gdy zmienia się jednocześnie energia oscylacji i rotacji, wtedy
powstaje widmo złożone z poszczególnych pasm, przy czym
każde pasmo składa się z oddzielnych linii widmowych.
➲
Dla przejść oscylacyjno-rotacyjnych wzór przybiera postać:
➲
W tym przypadku do częstości oscylacyjnej dodaje się częstość
rotacyjna i widmo obserwuje się w bliskiej podczerwieni.
➲
W przypadku zmian energii w wyniku jednoczesnego przejścia
elektronowego, oscylacyjnego i rotacyjnego otrzymuje się pełne
widmo pasmowe obserwowane w zakresie widzialnym.
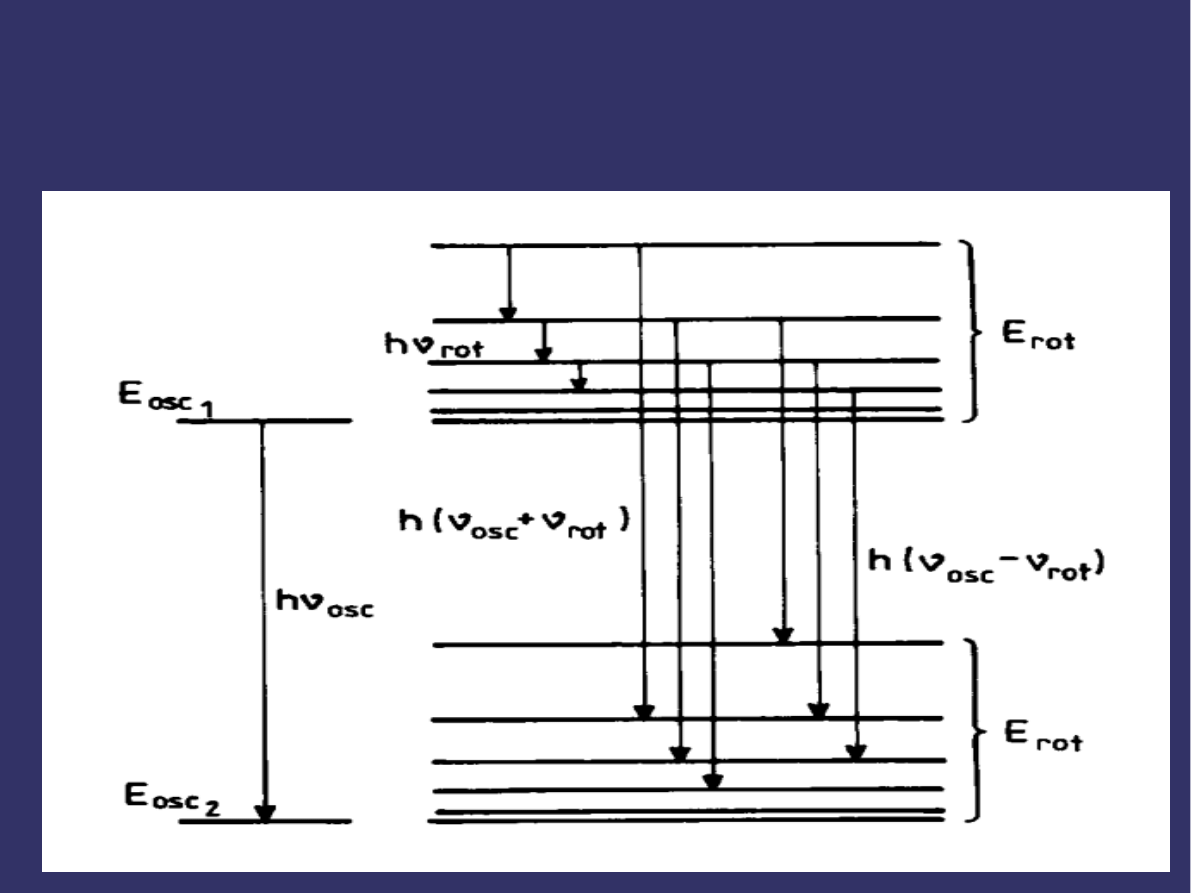
PRZEJŚCIA ENERGETYCZNE
ODPOWIEDZIALNE ZA POWSTAWANIE
WIDM ROTACYJNYCH I ROTACYJNO -
OSCYLACYJNYCH

DIAGRAM JABŁOŃSKIEGO
➲
Każda cząsteczka ma charakterystyczny dla siebie układ
poziomów energetycznych – elektronowych,
oscylacyjnych i rotacyjnych, przy czym tych ostatnich nie
obserwuje się w cieczach. W wyniku absorpcji
promieniowania UV i VIS cząsteczka przechodzi do
jednego ze stanów wzbudzonych, a następnie na różne
sposoby wytraca nadmiar energii. Procesy te przedstawia
się często schematycznie na tzw.diagramie Jabłońskiego.

ABSORPCJA I ROZPRASZANIE
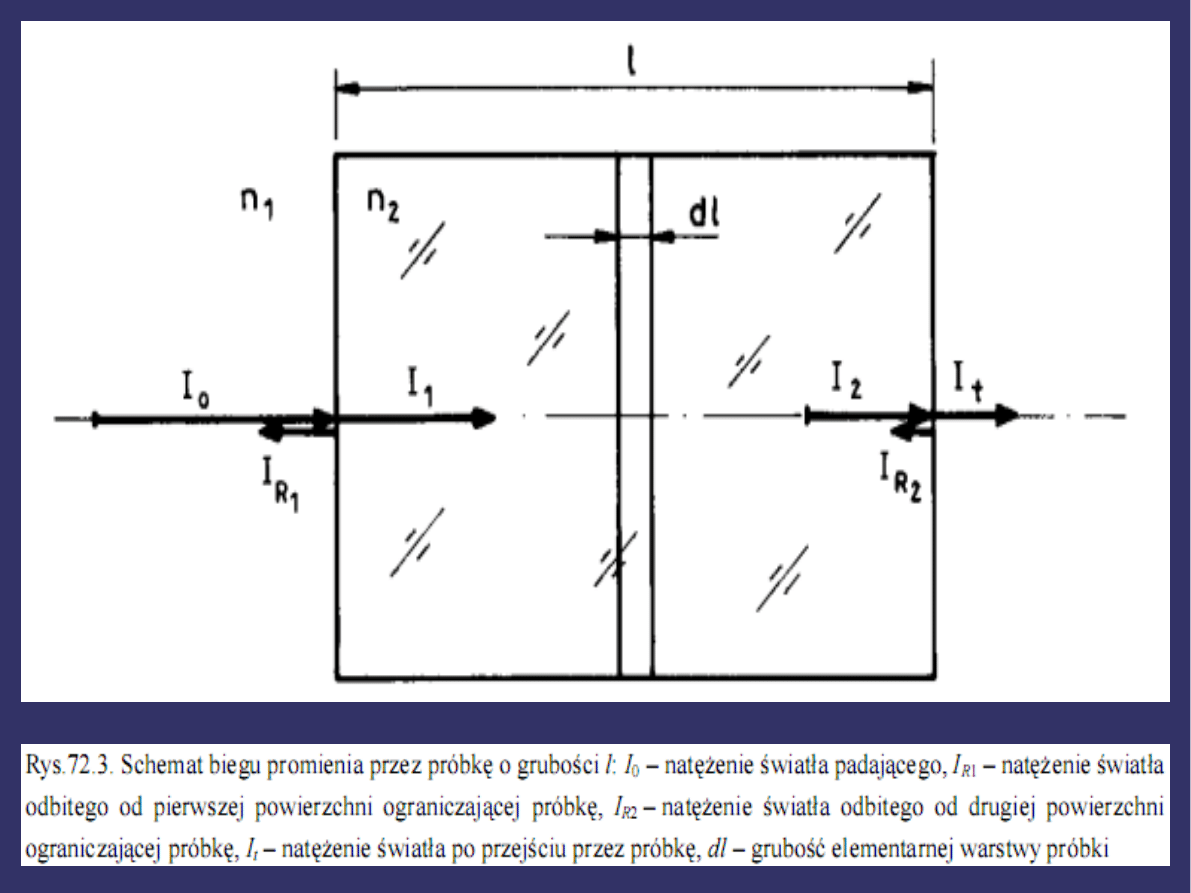
ŚWIATŁA
Jeżeli na drodze równoległej wiązki promieniowania
świetlnego ustawimy próbkę w ten sposób, by światło
padało na nią prostopadle oraz oznaczymy natężenie
światła padającego przez I
0
, to okazuje się, że natężenie
światła wychodzącego I
t
jest mniejsze od I
0
( I
t
< I
0
). Dzieje
się tak, gdyż część padającego światła odbija się na
granicach ośrodków (ściankach próbki), część jest
pochłaniana przez materiał próbki a część rozproszona.

ABSORPCJA I ROZPRASZANIE
ŚWIATŁA c.d.
➲
Pochłanianie (absorpcja) światła polega na osłabieniu
wiązki padającego światła wskutek przekształcenia
części energii świetlnej w inne formy energii, w
szczególności w energię termicznych ruchów atomów i
cząsteczek ośrodka, przez który światło przechodzi.
➲
Przez rozpraszanie światła rozumie się zjawisko
polegające na osłabieniu równoległej wiązki światła
wskutek tworzenia się fal wtórnych, rozchodzących się
we wszystkich możliwych kierunkach. Zachodzi ono w
ośrodkach optycznie niejednorodnych gdzie
współczynnik załamania zmienia się nieregularnie od
punktu do punktu.
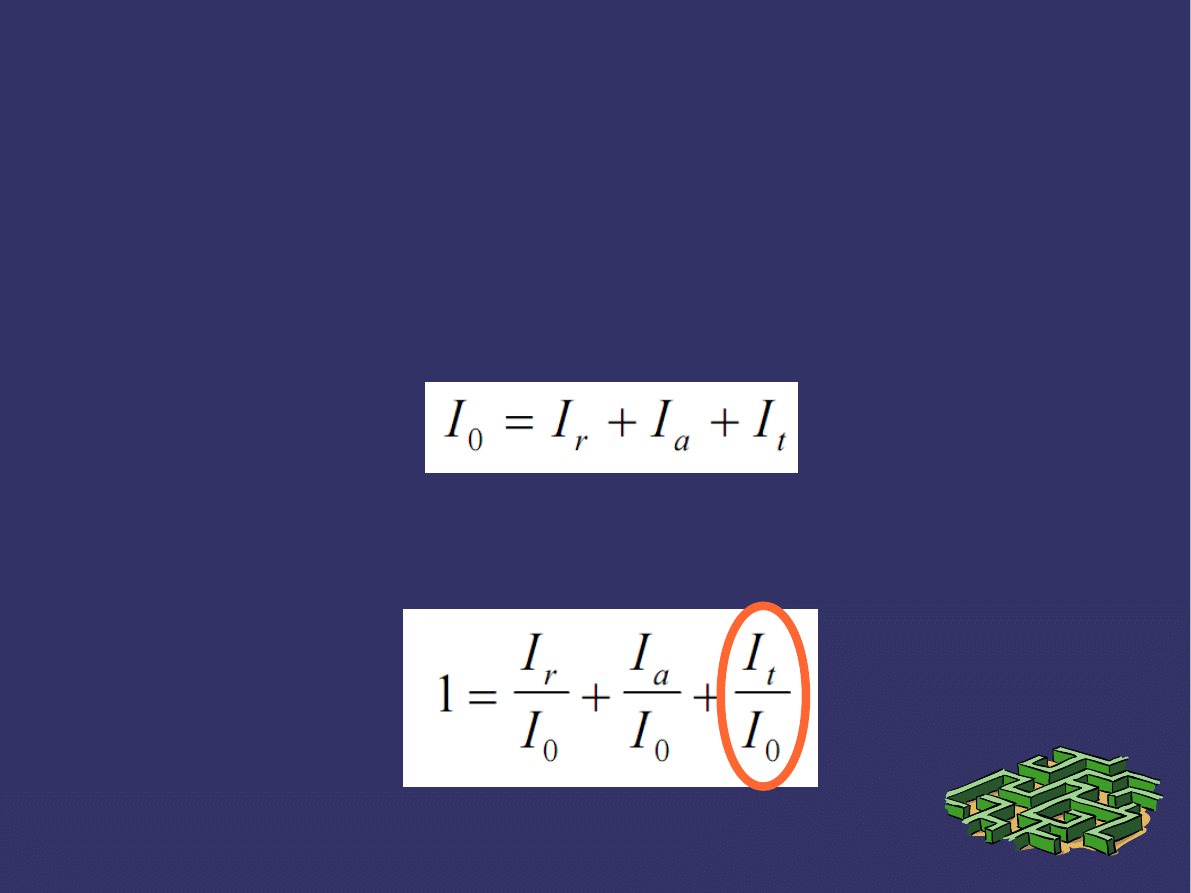
PRZECHODZENIE ŚWIATŁA PRZEZ
OŚRODKI JEDNORODNE
➲
Suma natężeń światła – odbitego I
r
, pochłoniętego I
a
i
przepuszczonego I
t
jest równa natężeniu światła padającego
I
0.
Ta relacja wynika z zasady zachowania energii.
➲
Po jej podzieleniu przez I
0
otrzymujemy:
T – współczynnik
przepuszczalnoś
ci lub transmisji
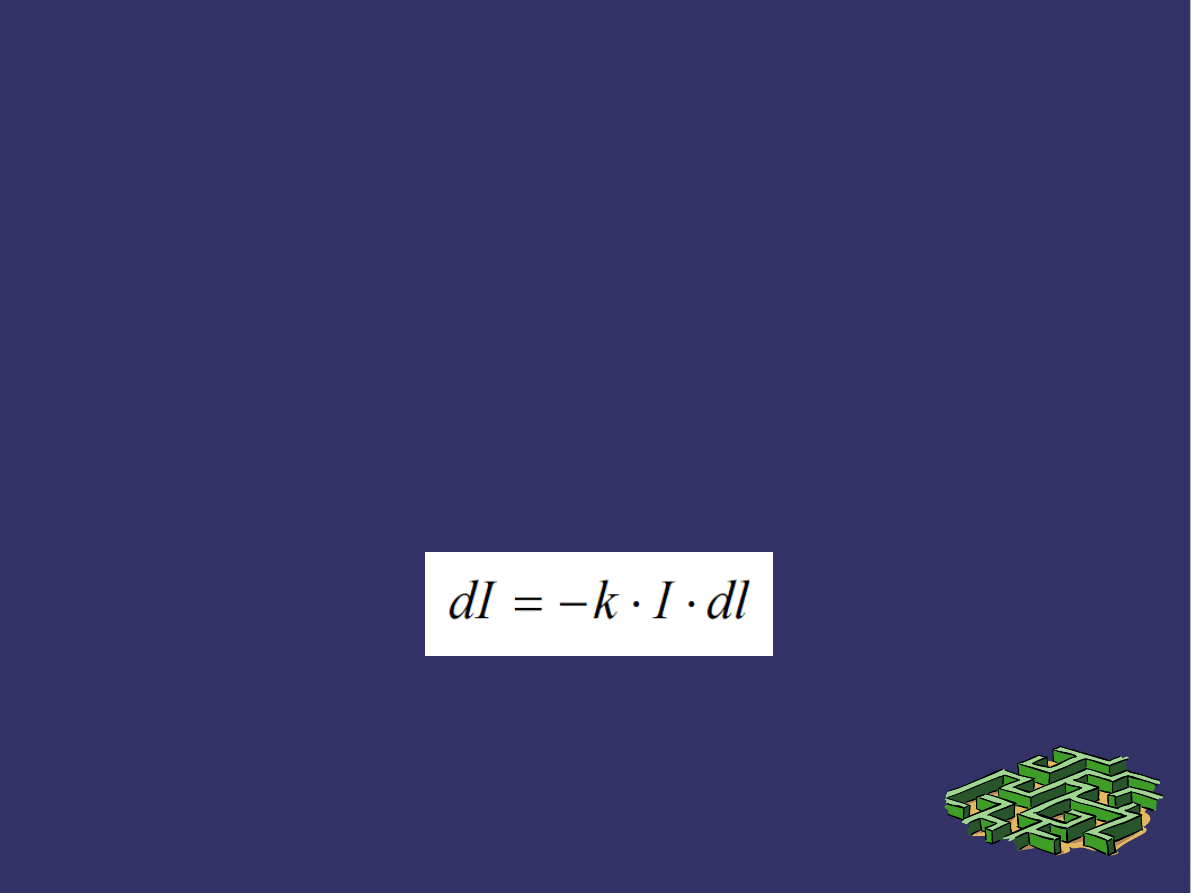
PRAWA ABSORPCJI ŚWIATŁA
➲
Przez nieskończenie cienką warstwę ośrodka biegnie
monochromatyczna wiązka promieni równoległych.
➲
Warstwa ta ma grubość dl i jest ograniczona równoległymi
powierzchniami prostopadłymi do kierunku rozchodzenia się
światła.
➲
Po przejściu przez tę warstwę natężenie światła zmniejszy
się o dI.
➲
Zmniejszenie to jest proporcjonalne do grubości warstwy dl i
do natężenia I światła wchodzącego do warstwy, a zatem
➲
Współczynnik proporcjonalności k, zależny od właściwości
substancji pochłaniającej, długości fali światła oraz
temperatury, nazywany jest współczynnikiem pochłaniania
(absorpcji) danego ośrodka.
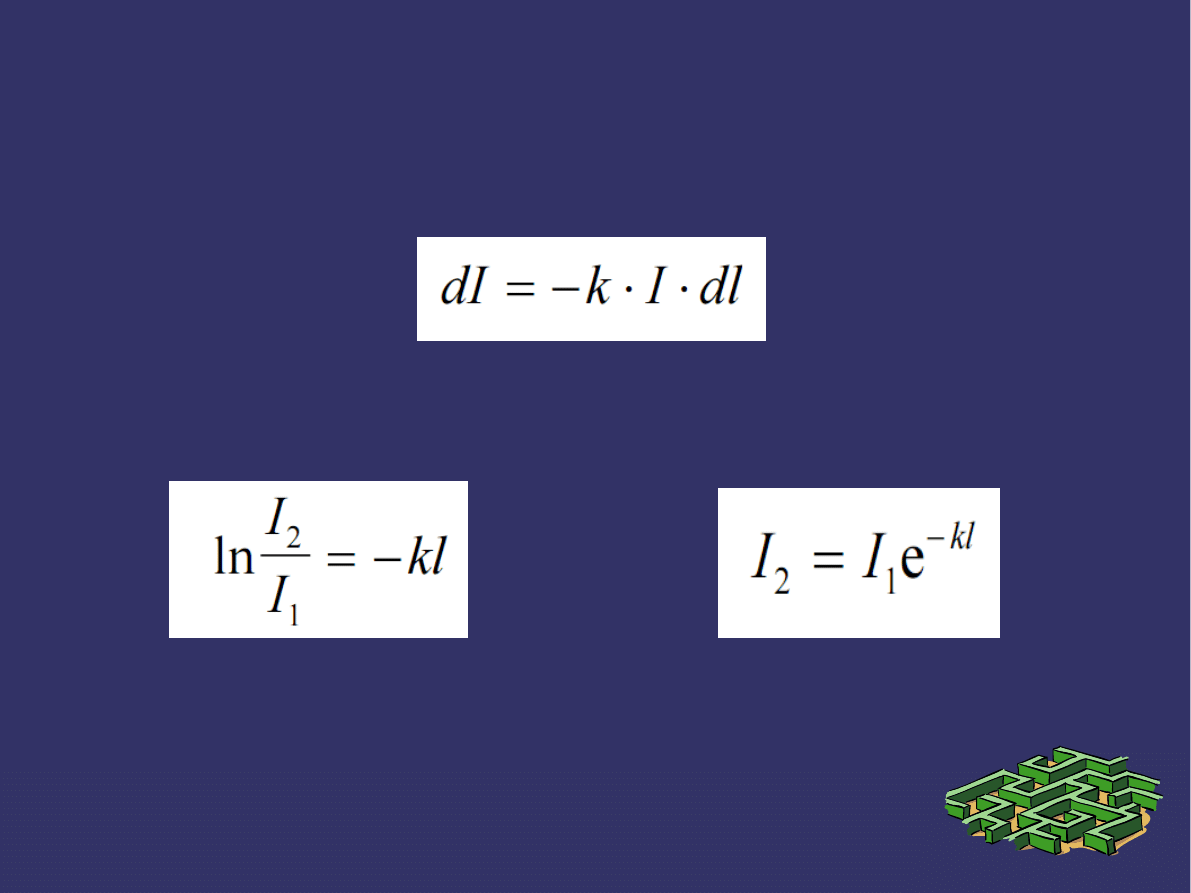
PRAWA ABSORPCJI ŚWIATŁA c.d.
Ukazane wcześniej
równanie:
Przedstawia różniczkową postać prawa Lamberta.
Można je rozwiązać, skąd otrzymujemy:
oraz
gdzie:
I
1
= I
0
– I
R1
– natężenie światła, które weszło do próbki,
I
2
= I
t
+ I
R2
– natężenie światła, które dotarło do drugiej
powierzchni próbki o grubości l.
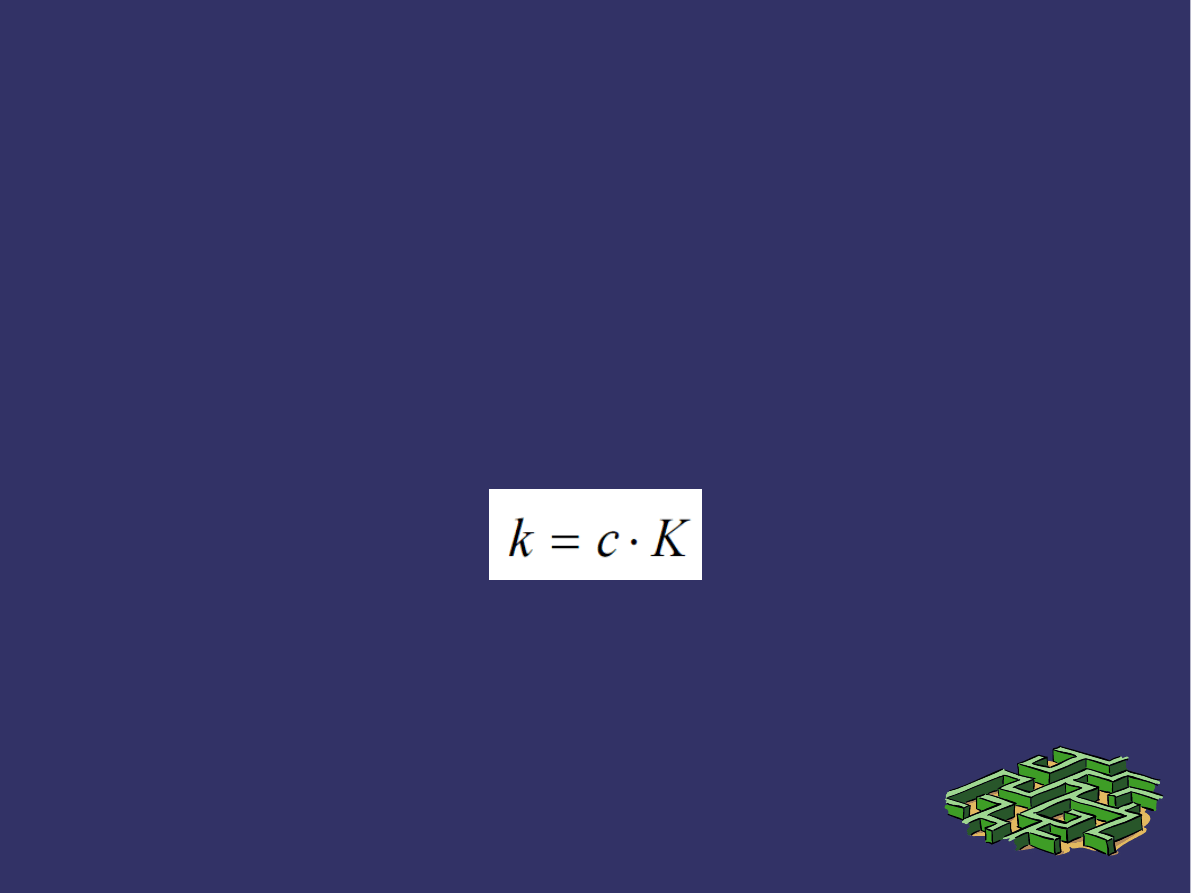
PRAWA ABSORPCJI ŚWIATŁA c.d.
➲
Zależność współczynnika absorpcji od długości fali
padającego promieniowania określa widmo absorpcyjne
danej substancji.
➲
Jeśli ośrodkiem pochłaniającym światło jest roztwór (w
nie pochłaniającym światła rozpuszczalniku), to
zazwyczaj współczynnik pochłaniania jest proporcjonalny
do koncentracji c rozpuszczonej substancji.
➲
Gdzie
c – stężenie [kmol/m
3
],
K – molarny współczynnik absorpcji.
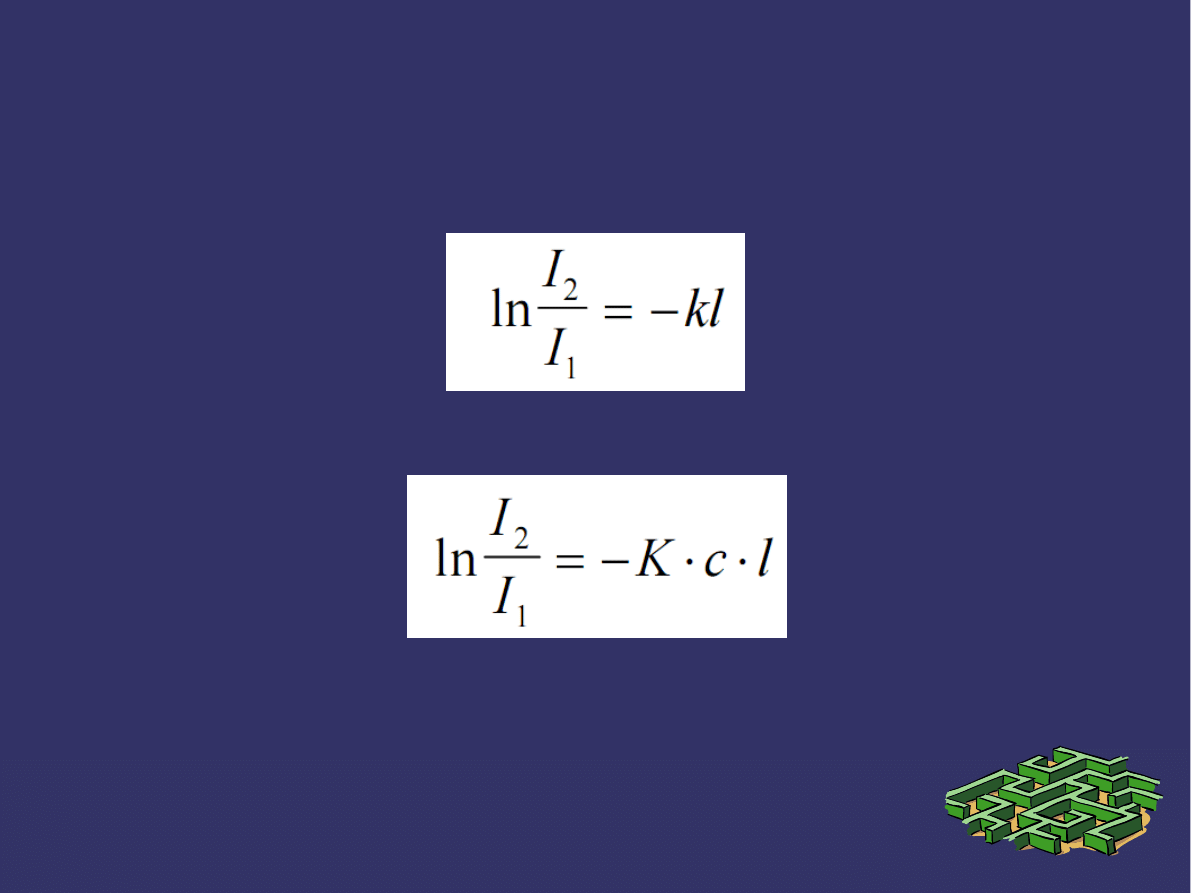
PRAWA ABSORPCJI ŚWIATŁA c.d.
Zatem w przypadku roztworów równanie:
Ma postać:
Jest to prawo Lamberta - Burgera - Beera
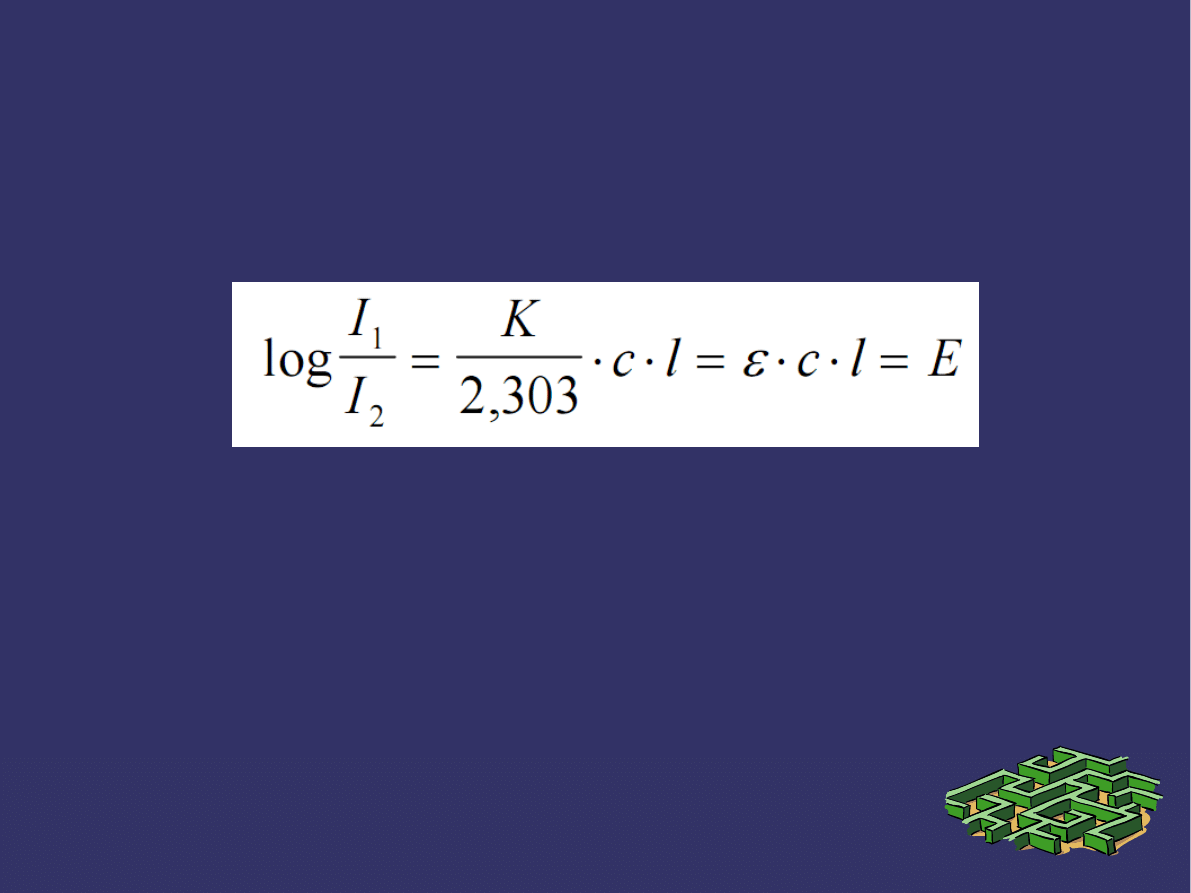
PRAWA ABSORPCJI ŚWIATŁA c.d.
➲
Inną postać tego prawa otrzymuje się przez zmianę
znaku i wprowadzenie logarytmu dziesiętnego.
➲
Gdzie
ε – molowy współczynnik ekstynkcji,
E – ekstynkcja.
➲
Znając dla danej długości fali współczynnik ekstynkcji,
ekstynkcję oraz grubość badanej próbki, można
wyznaczyć stężenie absorbenta.
➲
Zarówno analiza spektralna jakościowa jak i ilościowa,
są bardzo czułymi metodami, pozwalającymi wykrywać
śladowe ilości substancji.

UKŁADY POMIAROWE
I ZASADY POMIARÓW
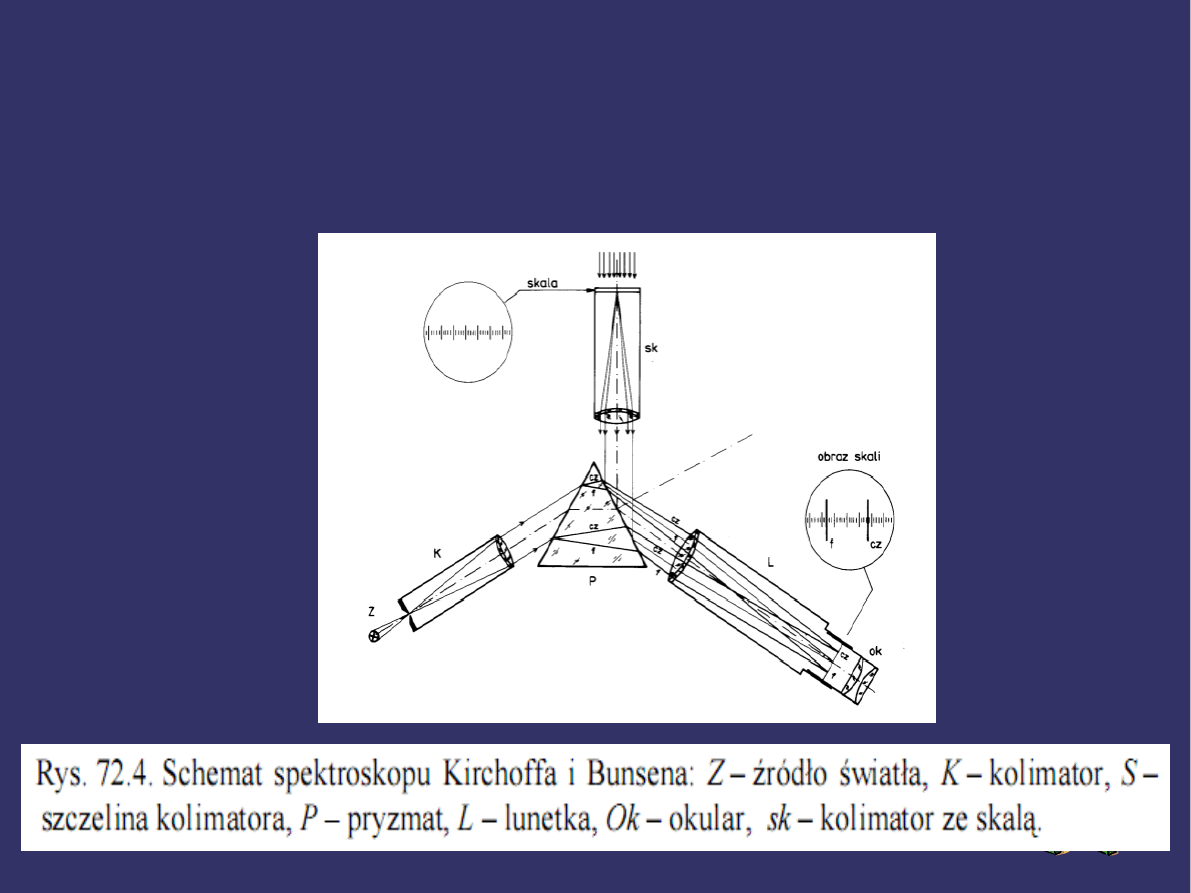
SPEKTROSKOP
Najprostszym i jednocześnie najstarszym
przyrządem spektralnym jest spektroskop
pryzmatyczny (Kirchhoffa i Bunsena). Schemat
budowy przyrządu:

SPEKTROMETR
SPEKTROGRAF
Do bardzo dokładnego wyznaczenia długości fal
świetlnych oraz współczynników załamania służy
spektrometr. Zarówno w spektroskopie, jak i
spektrometrze widma obserwuje się wizualnie.
Przyrząd, który pozwala na rejestrację widma, np. na
płycie fotograficznej, oraz na pomiar natężenia linii
widmowych nazywa się spektrografem.
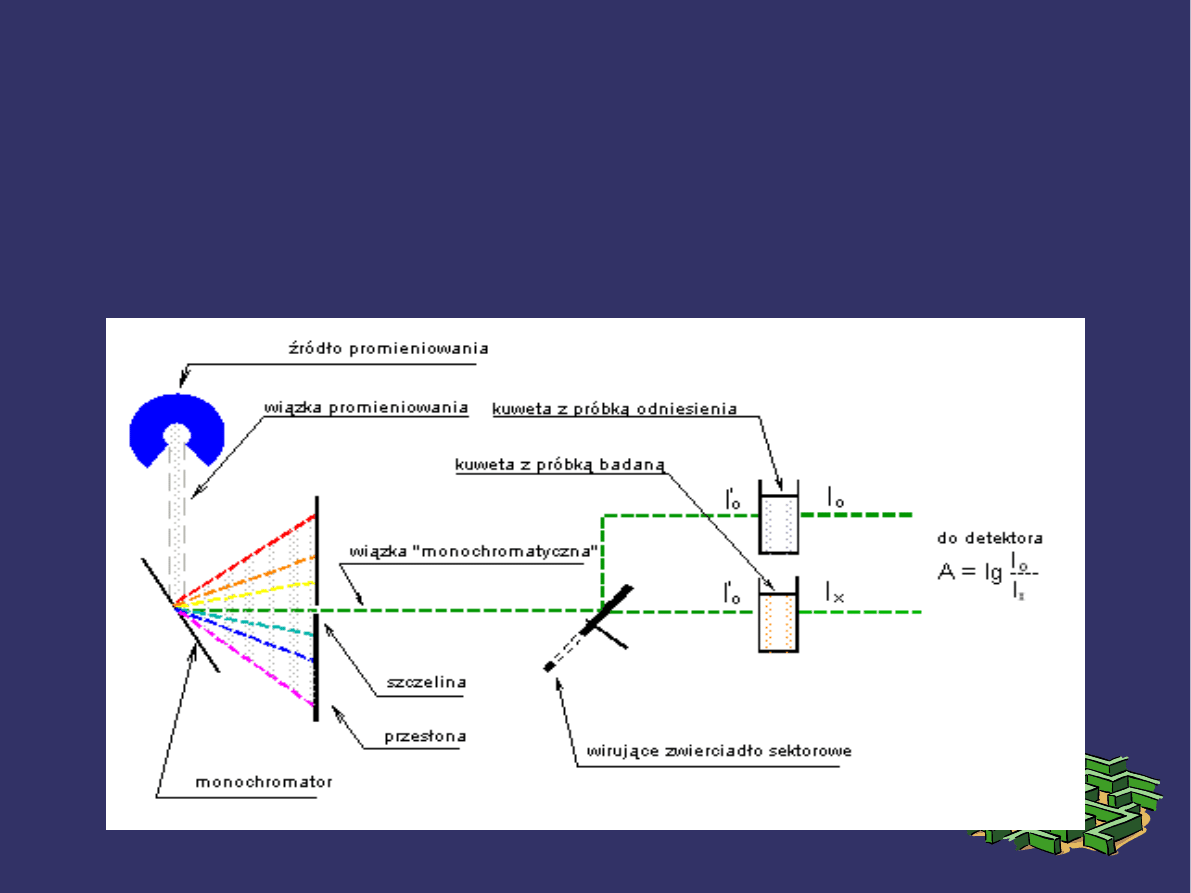
SPEKTROFOTOMETR
Jest to przyrząd, w którym intensywność wiązki świetlnej
wychodzącej ze szczeliny monochromatora mierzy się
fotometrycznie w funkcji λ. Przyrząd ten służy głównie do
rejestracji widm abosrpcyjnych.

SPEKTROSKOPIA IR

ZAKRES PODCZERWIENI W
WIDMIE PROMIENIOWANIA
ELEKTROMAGNETYCZNEGO
➲
Fragment widma elektromagnetycznego pokrywający
obszar promieniowania podczerwonego odpowiada
długościom fali od 780nm do 1mm.
➲
Jednak do celów analitycznych wykorzystuje się jedynie
obszar od 2,5μm do 25μm.
➲
Częstość w obszarze podczerwieni najczęściej wyraża
się w liczbach falowych.
➲
Liczba falowa jest odwrotnością długości fali, a
jednostką, w której się ją wyraża, są odwrotne
centymetry.
➲
Tak więc użytecznym obszarem wykorzystywanym do
celów spektroskopii IR jest obszar od ok.4000cm
-1
do
400cm
-1

ZASADA POMIARU
➲
Kwanty energii niesione przez promieniowanie
zaliczane do zakresu podczerwieni są w stanie
zmieniać energię oscylacji i rotacji cząsteczki.
➲
Jeżeli potraktujemy dwie masy (dwie części cząsteczki)
powiązane wiązaniem chemicznym jak układ fizyczny
dwóch ciał połączonych sprężyną, to energia drgań
takiego układu zależy od wielkości tych mas i
sprężystości połączenia.
➲
Energia ta (a więc i pośrednio długość fali, która może
być pochłaniana przez dany układ) jest
charakterystyczna dla danego typu wiązań.
➲
W praktyce charakterystyczny jest dla danego typu
wiązań pewien, czasami nawet dość szeroki, zakres
długości fali. Taki zakres nazywamy częstością
grupową dotyczącą danego typu wiązań.
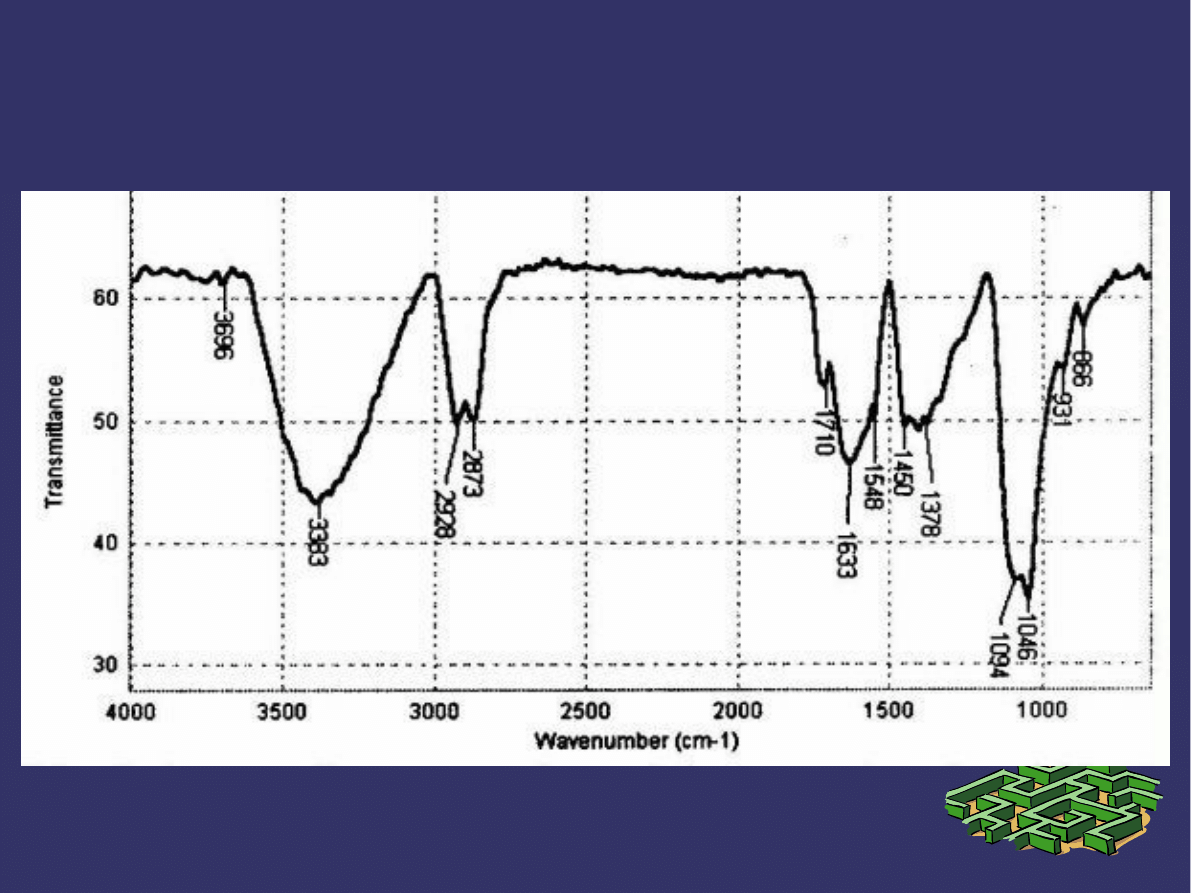
PRZYKŁADOWE WIDMO IR

INTERPRETACJA WIDM IR
➲
Pełna interpretacja widm IR jest trudna, ponieważ w
obrębie jednej cząsteczki występuje wiele różnych drgań
zginających i rozciągających, widmo zawiera bardzo wiele
różnych pików odpowiadających tym drganiom.
➲
W widmie IR obszar od ok1500cm
-1
do 400cm
-1
jest
nazywany regionem „odcisku palca”. Dlatego jeśli dwa
związki mają identyczne widma IR, prawie na pewno są
to dwa identyczne związki.
➲
Nie musimy interpretować w całości widma IR, aby
uzyskać informacje dotyczące struktury cząsteczki.
Większość grup funkcyjnych daje charakterystyczne
pasma absorpcyjne, których położenie w widmie nie
zależy od rodzaju cząsteczki.
➲
Przez znajdowanie w widmie IR charakterystycznych
pasm absorpcji odpowiadających grupom funkcyjnym,
można uzyskać informację dotyczącą struktury badanych
związków.
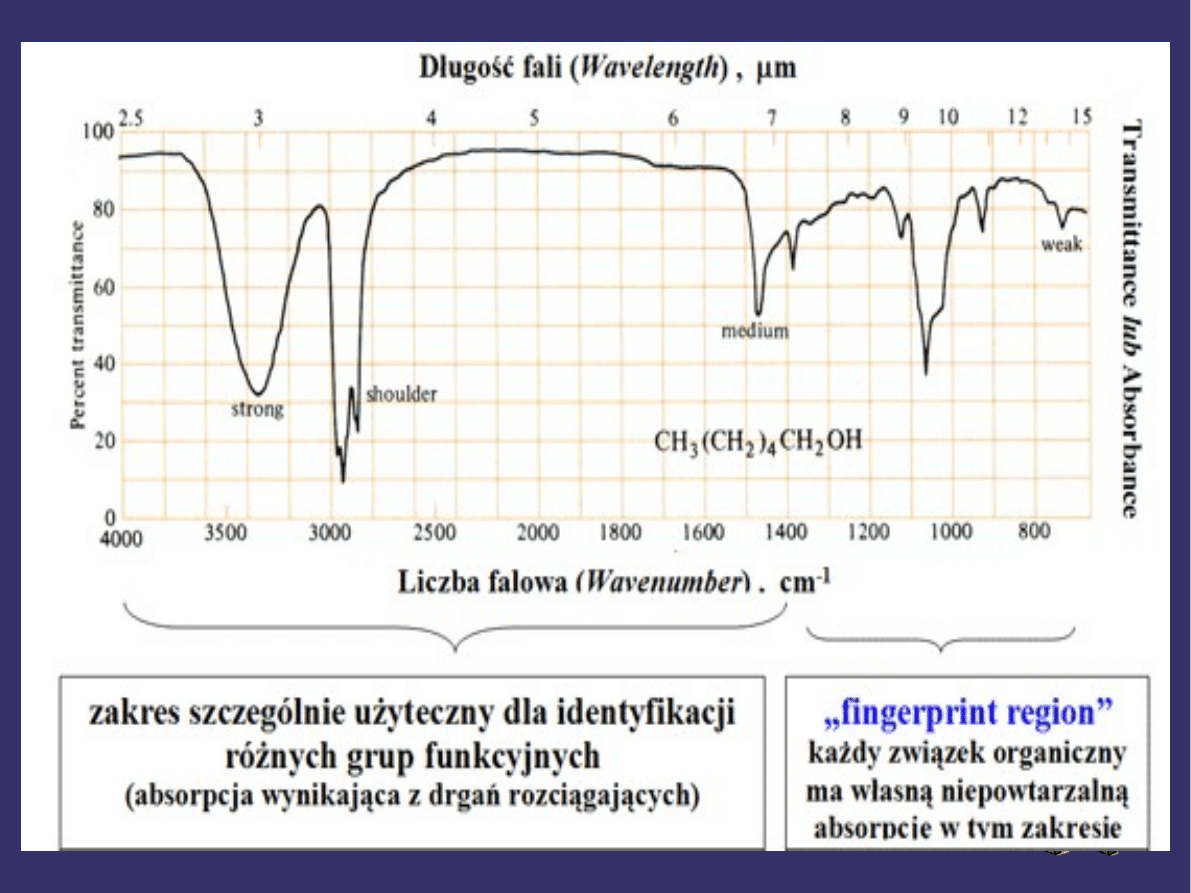
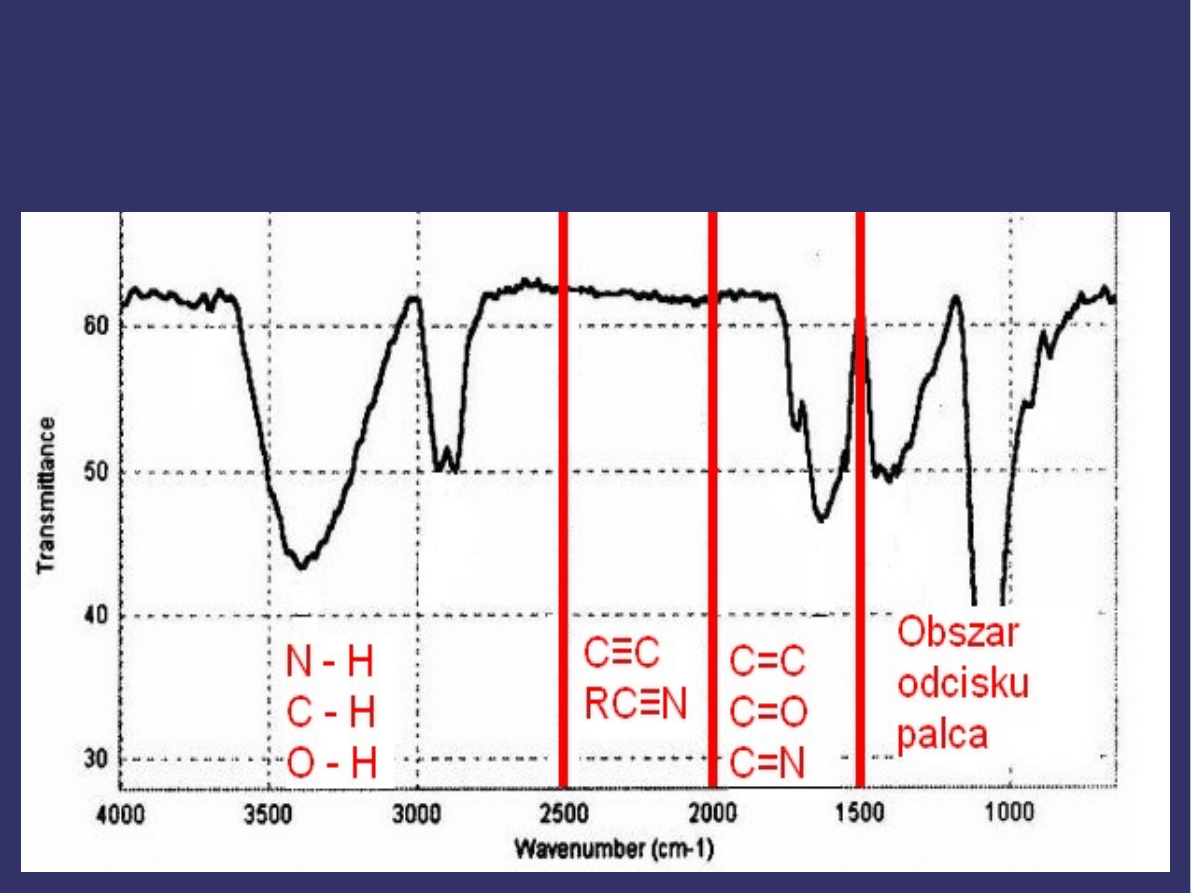
W celu łatwiejszego zapamiętania specyficznych
sygnałów absorpcyjnych w widmie IR warto podzielić
cały zakres widma IR od 4000cm
-1
do 400cm
-1
na cztery
części:

SPEKTROSKOPIA
UV/VIS

ZASADY POMIARU
➲
Promieniowanie elektromagnetyczne z zakresu ultrafioletu
(~100-380nm) i światła widzialnego (~380-780nm) niesie
kwanty energii zgodne, co do wielkości, z różnicami
poziomów energetycznych elektronów walencyjnych
cząsteczki.
➲
Z zakresu ultrafioletu wyodrębniamy tzw. zakres ultrafioletu
kwarcowego - 200-350nm. Jest to zakres wykorzystywany
do analizy spektralnej związków chemicznych.
➲
W zakresie tym pochłaniają energię układy zawierające
elektrony π (wiązania wielokrotne i pierścienie
aromatyczne) oraz układy z innymi elektronami o niskiej
energii przejścia od stanu podstawowego do wzbudzonego.
Zakres tych przejść rozciąga się dalej na zakres światła
widzialnego.

WIDMO UV 1,3-BUTADIENU
➲
1,3-butadien ma cztery orbitale molekularne π.
➲
W czasie naświetlania promieniowaniem UV 1,3-
butadien absorbuje promieniowanie i jeden z
elektronów π zostaje przeniesiony z najwyższego
obsadzonego orbitalu molekularnego (HOMO) na
najniższy nieobsadzony orbital molekularny (LUMO).
➲
Ponieważ elektron zostaje przeniesiony z orbitalu
wiążącego π na orbital antywiążący π*, przejście to
zapisujemy jako wzbudzenie π→ π*.
➲
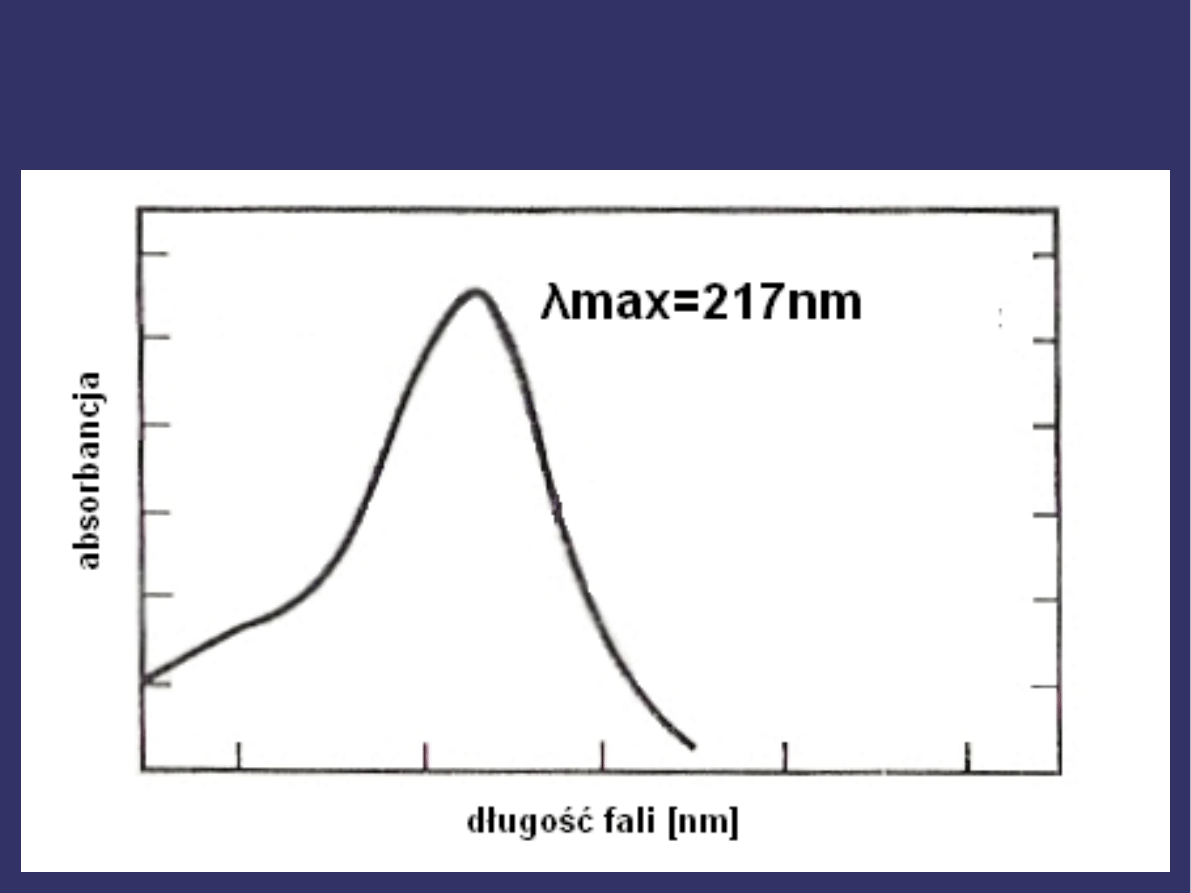
W przypadku 1,3-butadienu różnica energii pomiędzy
HOMO i LUMO odpowiada energii promieniowania o
długości fali elektromagnetycznej λ=217nm, a więc
jest to energia potrzebna do wzbudzenia
elektronowego π→ π*.
WIDMO UV 1,3-BUTADIENU c.d.

WIDMO UV 1,3-BUTADIENU c.d.
➲
W odróżnieniu od widm IR, które wykazują wiele
sygnałów rezonansowych, widma UV są najczęściej
bardzo proste – często jest to jedynie jeden prosty
sygnał. Sygnał jest najczęściej szeroki, a do celów
analitycznych definiujemy jego pozycję określając
długość fali odpowiadającej maksimum piku λ
max
.
➲
Na podstawie znajomości λ
max
i molowego
współczynnika absorpcji możemy wnioskować o
istnieniu wiązań wielokrotnych, ich sprzęganiu
(wzajemne położenie) oraz istnieniu w cząsteczce
układów aromatycznych. Spektroskopia w ultrafiolecie i
świetle widzialnym jest dość prosta w wykonaniu i
interpretacji, niesie jednak stosunkowo niewiele
informacji o budowie cząsteczki i to na dość niskim
poziomie szczegółowości.

INTERPRETACJA WIDM UV
➲
Dokładna długość fali odpowiadająca wzbudzeniu π→ π*
zależy od różnicy energii pomiędzy poziomami
energetycznymi orbitali HOMO i LUMO, a różnica ta jest
z kolei odzwierciedleniem układu sprzężonych
elektronów w cząsteczce.
➲
Rejestrując widmo UV nieznanego związku, możemy
uzyskać informacje o strukturze związku, zwłaszcza o
jego układzie sprzężonych ze sobą elektronów π.
➲
Jednym z najistotniejszych czynników wpływających na
długość fali promieniowania UV, przy której następuje
absorpcja jest zasięg sprzężenia w obrębie cząsteczki.
➲
Np.:
1,3-butadien absorbuje przy λ
max=217nm,
benzen przy λmax=254nm,
naftalen przy λmax=275nm
➲
Dłuższa fala promieniowania oznacza mniejszą energię.

BARWNE ZWIĄZKI ORGANICZNE
➲
Związki barwne zawierają układy sprzężone rozciągnięte na
tak wiele wiązań w cząsteczce, że ich widmo absorpcyjne
przechodzi z obszaru UV aż w obszar światła widzialnego.
➲
np. β-karoten ma jedenaście sprzężonych wiązań C≡C, a jego
absorpcja występuje przy λ
max
=455nm.
➲
Światło białe promieniowania słonecznego jest mieszaniną
promieniowania w zakresie widzialnym o wszystkich
długościach fali. Kiedy światło białe pada na β-karoten,
wówczas absorpcji ulega światło w zakresie 400-500nm
(światło niebieskie), natomiast reszta zostaje odbita i dociera
do naszych oczu.
➲
W ten sposób dociera do oka światło białe zubożone o zakres
odpowiadający barwie niebieskiej, co nasze zmysły
postrzegają jako kolor pomarańczowy.
➲
Jest to słuszne również dla innych substancji barwnych:
wszystkie one najczęściej zawierają w swojej strukturze
sprzężony układ elektronów π, co powoduje, że wykazują
absorpcję w zakresie światła widzialnego.

LITERATURA
➲
John mcMurry „Chemia organiczna”,
➲
Edmund Szyszko „Instrumentalne metody analityczne”,
➲
Galen W. Ewing „Metody instrumentalne w analizie
chemicznej”,
➲
Strona internetowa:
,
➲
Strona internetowa:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
materiały spektroskopia UV VIS
Spektrofotometria UV VIS Zastosowanie spektrofotometrii w Biochemii
spektrometria UV VIS spektrofluorymetria
Spektrofotometria promieni UV Vis
Spektrofotometria UV-VIS 4
Wykresy zależności dla spektrofotometrii UV VIS
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Spektroskopia UV-VIS kompleksów metali przejściowych-ćwiczenia, matury z chemii
Spektrofotometria UV VIS
materiały spektroskopia UV VIS
Spektrofotometria promieni uv vis
spektrometria UV VIS spektrofluorymetria
Instrukcja spektroskopia UV VIS
Spektroskopia UV Vis
Spektroskopia UV Vis
więcej podobnych podstron