
Temat:
Spektrofotometria
promieni UV/VIS
Gębka Marcin
Andrzejewski Jan
Majchrzycki
Adam

Wprowadzenie
Spektroskopia optyczna
obejmuje metody badania materii
przy użyciu promieniowania elektromagnetycznego, które
może być w danym układzie wytwarzane lub może z
układem oddziaływać.
Spektrometria zajmuje się rejestracją i pomiarami efektów tych
fizycznych zjawisk dostarczając szeregu informacji o układzie
i jego składnikach.
Szczególne znaczenie w analizie chemicznej mają
metody
absorbcyjne
. Do nich należy spektrofotometria absorpcyjna
w nadfiolecie (UV) i obszarze widzialnym (VIS), która opiera
się na selektywnej absorpcji promieniowania
elektromagnetycznego przez substancję w stanie gazowym,
stałym lub w fazie ciekłej. Dla zrozumienia tych zjawisk
niezbędne jest wgłębienie się w naturę promieniowania
elektromagnetycznego i materii.
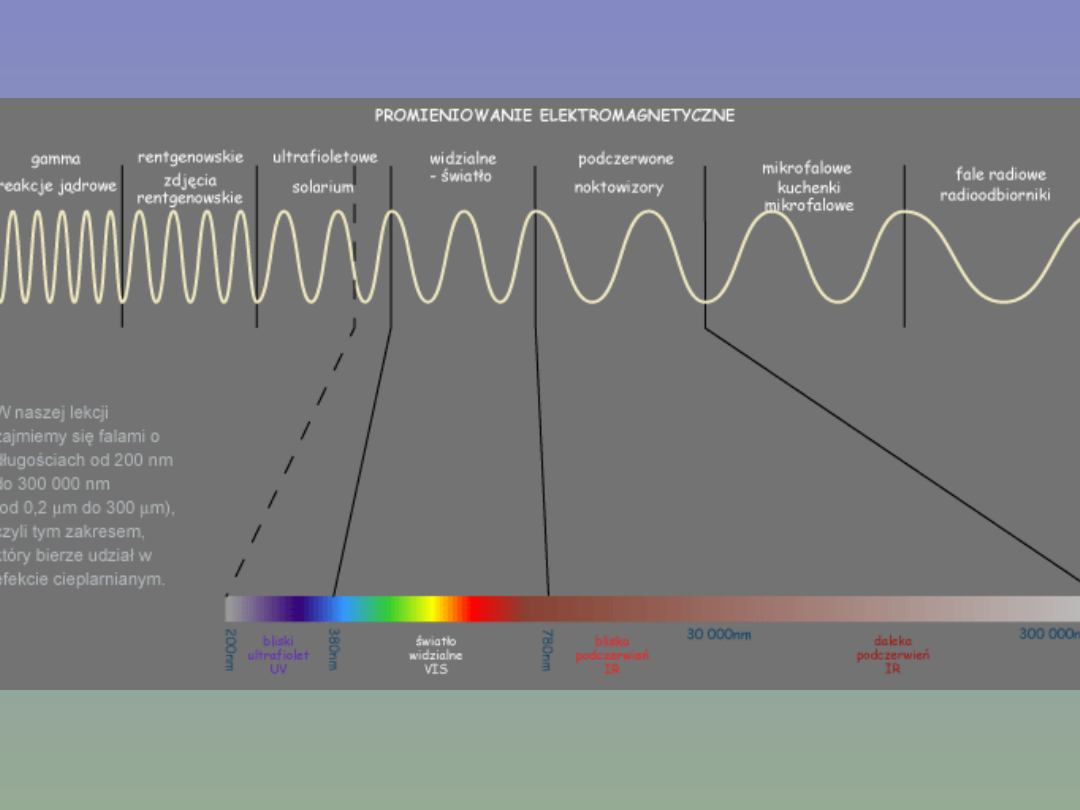
Promienie UV/VIS
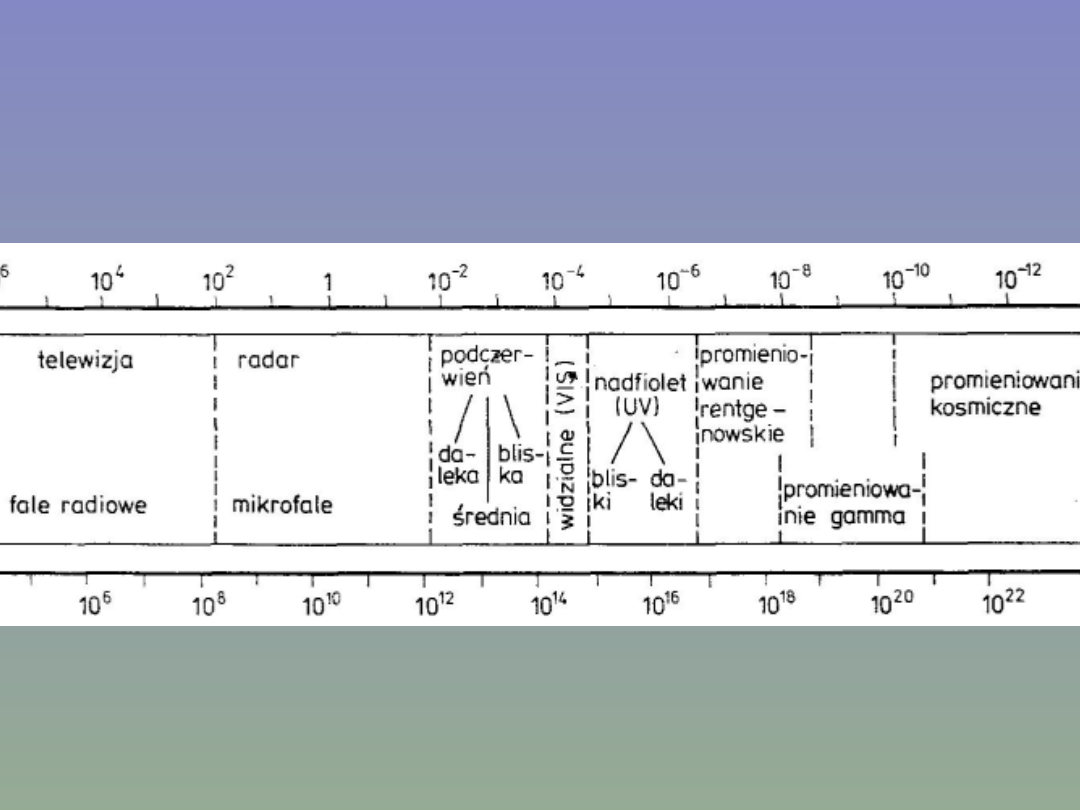
Promieniowanie elektromagnetyczne z zakresu ultrafioletu (~100-
350 nm) i światła widzialnego (~350-900 nm) niesie kwanty
energii zgodne, co do wielkości, z różnicami poziomów
energetycznych elektronów walencyjnych cząsteczki.
W wyniku adsorpcji promieniowania elektromagnetycznego
przez cząsteczki następuje wzbudzenie odpowiednich
poziomów energii a efektem mierzonym jest
widmo
.

Widmo spektroskopowe
to zarejestrowany obraz
promieniowania rozłożony na częstotliwości, długości fali lub
energie, które zostało wyemitowane albo weszło w kontakt z
analizowaną substancją przeszło przez nią lub zostało przez nią
odbite. Widma są w stanie dostarczyć szeregu cennych
informacji o analizowanej substancji. Analizą i tłumaczeniem
mechanizmów powstawania widm zajmuje się spektroskopia,
metoda badawcza wykorzystywana w wielu dziedzinach nauk
doświadczalnych, głównie fizyce i chemii i w zastosowaniach
praktycznych (np. w medycynie).
Najprostsze widma jednowymiarowe mają zwykle postać wykresu,
na którym na osi pionowej zaznacza się zwykle intensywność
promieniowania (lub stopień jego absorpcji - dla widm
absorpcyjnych), a na osi poziomej liczbową charakterystykę
używanego w danej spektroskopii promieniowania , np. długość
fali, częstotliwość lub energię. Widma przedstawia się czasem
również w postaci paska świetlnego uzyskiwanego na ekranie
lub na filmie fotograficznym.
Widmo emisyjne azotu.
Przykład widma H

W związkach organicznych:
Absorbcja promieniowania w zakresie UV- VIS
jest związana z przejściami elektronów
walencyjnych (elektrony δ i π) oraz
elektronów wolnych par elektronowych
(elektrony n). W cząsteczkach związków
organicznych występują następujące orbitale
molekularne:
- orbitale wiążące σ,
- orbitale niewiążące n,
- orbitale antywiążące σ*, π*.
Kolejność poziomów energetycznych
poszczególnych orbitali i możliwości przejść
przedstawiono na rys.7.2.
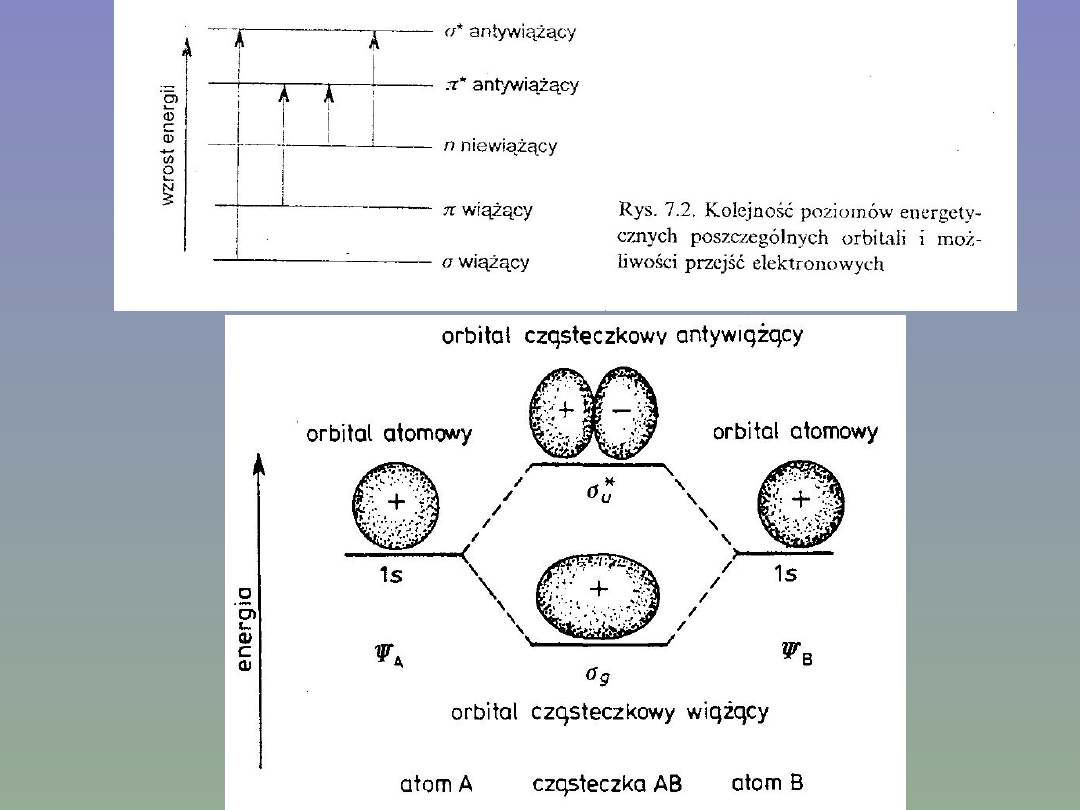

Gdy w wyniku oddziaływania kationu metalu d-
elektronowego z ligandem (cząsteczka H
2
0 lub inny
ligand) powstanie związek kompleksowy, wówczas
zdegenerowane orbitale d rozszcze-piają się na grupy o
różnych wartościach energii, a przejścia elektronowe
pomiędzy poszczególnymi grupami orbitali od-bywają
się w wyniku absorpcji lub emisji promieniowania.
Rozszczepienie orbitali jest uzależnione od typu symetrii
powstającego kompleksu.
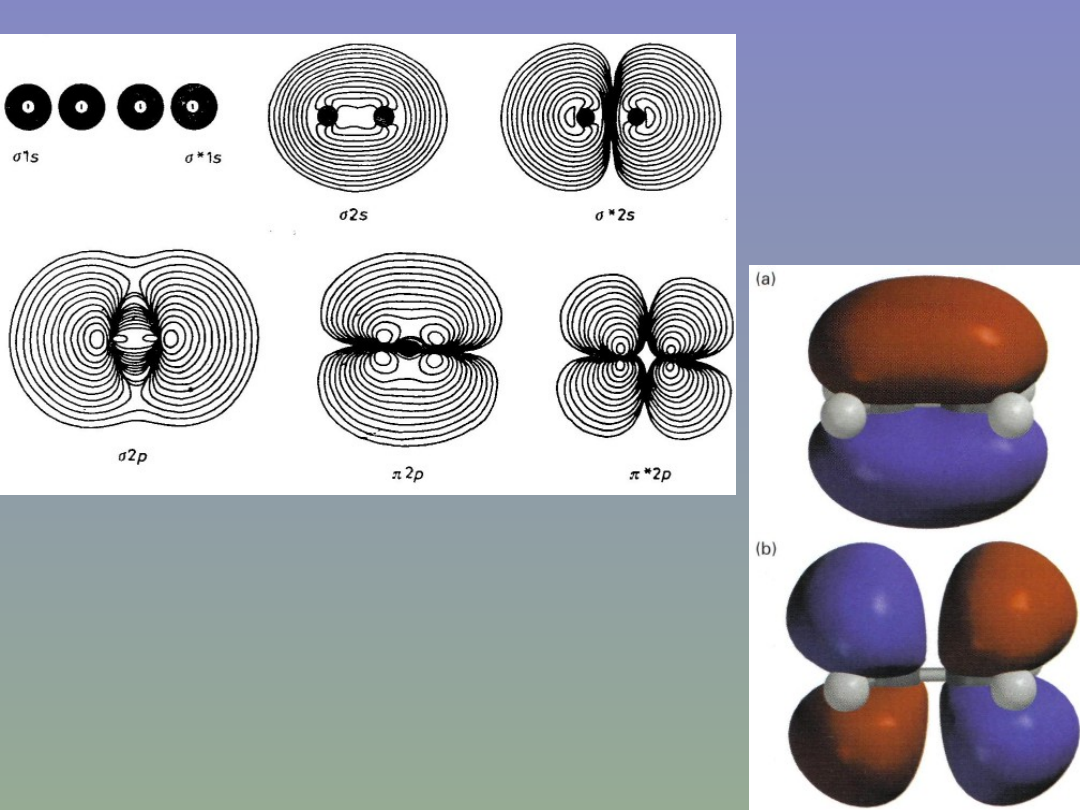
Rozkłady gęstości ładunku elektronowego
odpowiadające różnym orbitalom w
cząsteczce O
2
.

I prawo absorbcji
(
Lamberta
)
Wiązka promieniowania monochromatycznego po
przejściu przez jednorodny ośrodek absorbujący o
grubości b ulega osłabieniu wg równania:
I – natężenie promieniowania po przejściu ośrodek
absorbujący
I
0
– natężenie wiązki promieniowania
monochormatycznego padającego na jednorodny
ośrodek absorbujący
b - grubość warstwy absorbującej
k – współczynnik absorbcji
kb
e
I
I
0
kb
I
I
kb
I
I
0
0
log
log

Stosunek I/I
0
nazwano
transmitancją
T.
Charakteryzuje ona przepuszczalność
ośrodka. Logarytm dziesiętny
odwrotności, a więc log(I/I
0
) określono
mianem,
absorbancji
A:
Stosunek natężeń promieniowania
padającego i przechodzącego przez
ośrodek absorbujący ilościowo można
określić na podstawie
doświadczalnego pomiaru absorbancji
lub transmitacji.

Drugie prawo absorbcji (
Lamberta-Beera
):
Jeśli współczynnik absorbcji rozpuszczalnika
jest równy zero, to wiązka promieniowania
monochromatycznego, po przejściu przez
jednorodny roztwór substancji absorbującej
o stężeniu c ulega osłabieniu wg równania:
kbc
e
I
I
0
bc
A
abc
I
I
A
0
log
ε – molowy współczynnik absorbcji

Prawo addytywności absorbancji
dotyczy
roztworów i mieszanin wieloskładnikowych.
Wyraża ono absorbancję całkowitą środowiska, A,
jako sumę niezależnych absorbancji
poszczególnych składników (A
1
, A
2
, A
3
, ..., A
n
), co
można przedstawić matematycznie w następujący
sposób:
czyli
lub
n
i
i
n
A
A
A
A
A
1
2
1
...
n
i
i
i
n
n
bc
a
bc
a
bc
a
bc
a
A
1
2
2
1
1
...
n
i
mi
i
mn
n
m
m
bc
bc
bc
bc
A
1
2
2
1
1
...

Chromofory
W początkowym okresie rozwoju spektroskopii, kiedy
relacje między właściwościami specyficznej absorbcji
cząsteczek i ich strukturą chemiczną ustalano
doświadczalnie, dla substancji barwnych stwierdzono,
że barwne związki odznaczają się charakterem
nienasyconym. Wprowadzono pojęcie
chromoforu
jako
grupy atomów połączonych wiązaniem wielokrotnym,
której obecność decyduje o barwie związku, np.
=c=cc=; =c=o; -N=N-; -C≡C-; -C≡N
We współczesnym rozumieniu chromofor stanowi
izolowaną grupę funkcyjną, nienasyconą, łatwo
polaryzowalną, zdolną do selektywnej absorpcji
promieniowania elektromagnetycznego w zakresie
180-800 nm. Innymi słowy jest to grupa zawierająca
zespół elektronów n wykazujących specyficzny układ
chmury elektronowej, zarówno w stanie podstawowym
jak i w stanie wzbudzonym.

Przejście ze stanu
podstawowego do stanu
wzbudzonego związane jest
z wystąpieniem
charakterystycznego pasma
w widmie absorbcyjnym.
Tablica.
Typowe proste chromofory nieorganiczne
e
max>
Rozpuszcza
l-
Chromofor
Związek
A
max
,
n
m
1-moH-cnr-
1
nik*
(przybliżony)
-Cl
CH
3
C1
173
200
V
-Br
CH
3
Br
204
230
V
-I
CH3I
258
365
p
-S
C2H31SH
225
875
-
|
(CH
3
)
2
S
229
875
-
-N-
CH
3
NHj
215
600
-
|
(CH
3
)
3
N
227
900
-
-O-
H
2
0
167
1480
V
(CH3)
2
0
184
1000
-

Kolorymetria
Podstawą do powstania kolorymetru stało się drugie
prawo Lamberta-Beer’a.
Istotną cechą absorpcji promieniowania zakresu
widzialnego jest możliwość wizualnej obserwacji
zjawiska. Barwa obserwowana stanowi przy tym barwę
dopełniającą do zakresu zaabsorbowanego. Oko ludzkie
jest w stanie ocenić nie tylko rodzaj zabarwienia, ale i
jego natężenie, dlatego w najprostszych metodach
kolorymetrycznych zwanych wizualnymi wykorzystuje
się oko jako przyrząd pomiarowy natężenia
promieniowania przepuszczanego. Aby uniezależnić się
od indywidualnych cech oka zastosowano do pomiaru
na tężenia promieniowania komórki fotoelektryczne i
ogniwa fotoelektryczne, za pomocą których
dokonujemy pomiaru obiektywnego. W związku z tym
stosuje się czasem nazwę
kolorymetrii obiektywnej
.

Kolorymetry fotoelektryczne dzieli się na dwie
grupy:
jedno- i dwuwiązkowe
. W kolorymetrach
jednowiązkowych w bieg tej samej wiązki
promieniowania wstawia się kolejno odnośnik i
roztwór badany mierząc ich absorpcję, w
aparatach dwuwiązkowych wiązka promieniowania
zostaje rozdzielona na dwie równoległe wiązki, z
których jedna przechodzi przez odnośnik, druga
przez roztwór badany. Każda pada na osobny
detektor, zaś przyrząd pomiarowy mierzy różnicę
prądów wytwarzanych w obu detektorach.
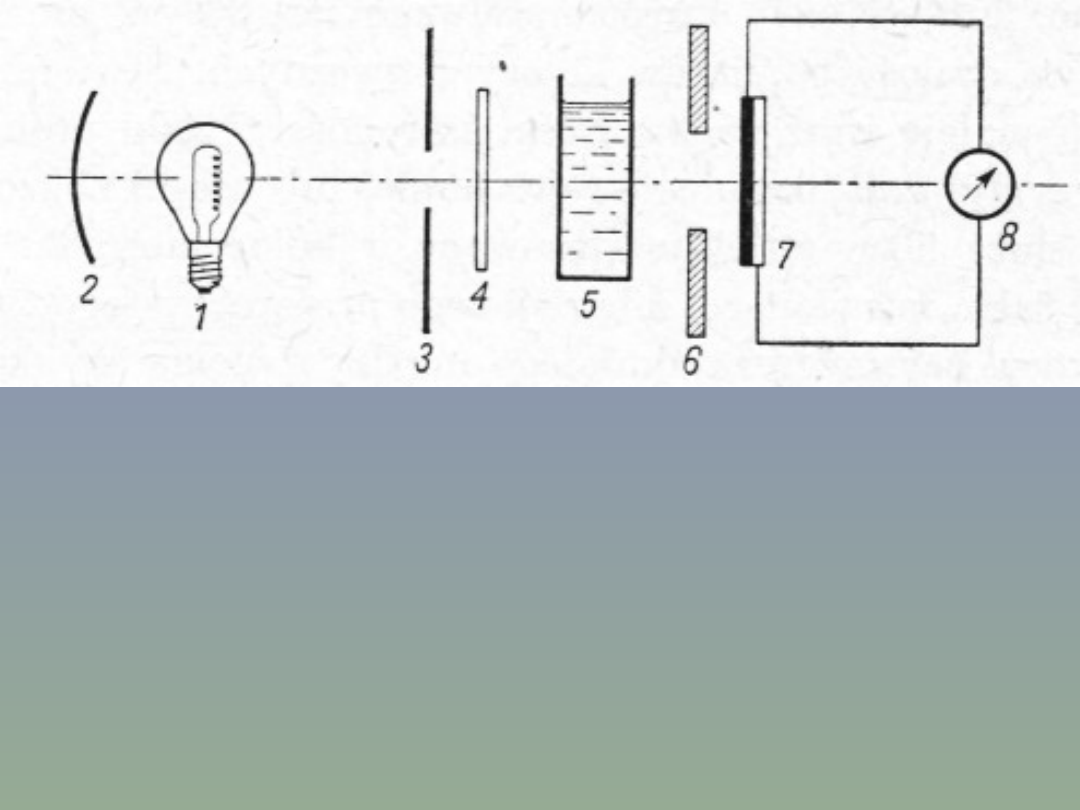
Schemat kolorymetru fotoelektrycznego
jednowiązkowego.
Na rysunku powyżej pokazano schemat kolorymetru jedno
wiązkowego. Promieniowanie żarówki wolframowej 1 odbite od
reflektora 2 pada na diafragmę (przesłonę) 3 z ciągłą regulacją
wielkości otworu (np. tzw. diafragma irysowa). Wyodrębniona w ten
sposób wiązka promieniowania przechodzi przez filtr 4, kuwetę z
roztworem 5 i pada na powierzchnię fotoogniwa 7. Galwanometr 8,
który mierzy prąd wytwarzany przez fotoogniwo, jest zwykle
wyskalowany w jednostkach przepuszczalności (T) lub i
przepuszczalności (T) i absorpcji (A).
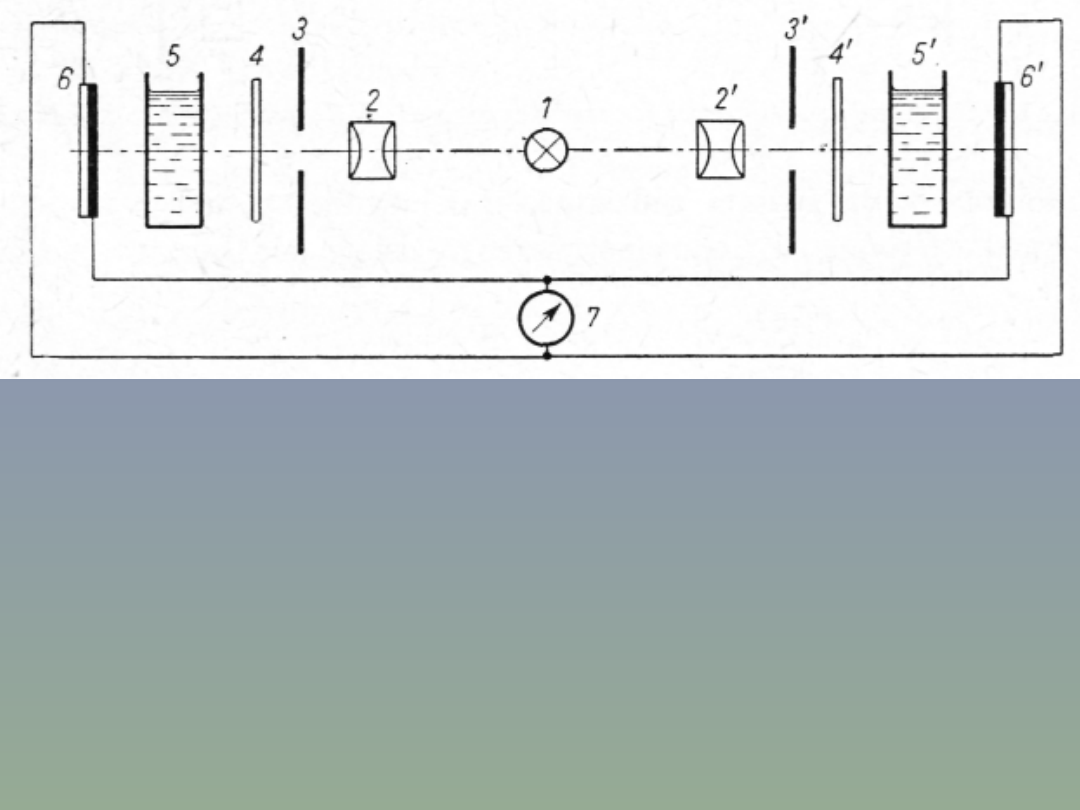
Schemat kolorymetru fotoelektrycznego dwuwiązkowego.
Zasada działania kolorymetru fotoelektrycznego
dwuwiązkowego pokazanego powyżej polega na wydzieleniu ze
wspólnego źródła światła 1 dwu jednakowych wiązek promieniowania,
z których każda przechodzi kolejno przez kondensory 2, 2',
regulowane przesłony 3, 3', identyczne filtry 4, 4' i kuwety 5, 5'. Po
przejściu przez kuwety wiązki promieniowania padają na fotoogniwa
6, które wytwarzają fotoprąd. Różnica fotoprądów wskazywana jest
przez galwanometr 7. Zaletą, przyrządów dwuwiązkowych jest
możliwość wyeliminowania zmian napięcia zasilającego źródło
światła. Zmiany te w znacznie mniejszym stopniu wpły wają na
różnicę fotoprądów obu fotoogniw niż na wskazania każdego z nich z
osobna.
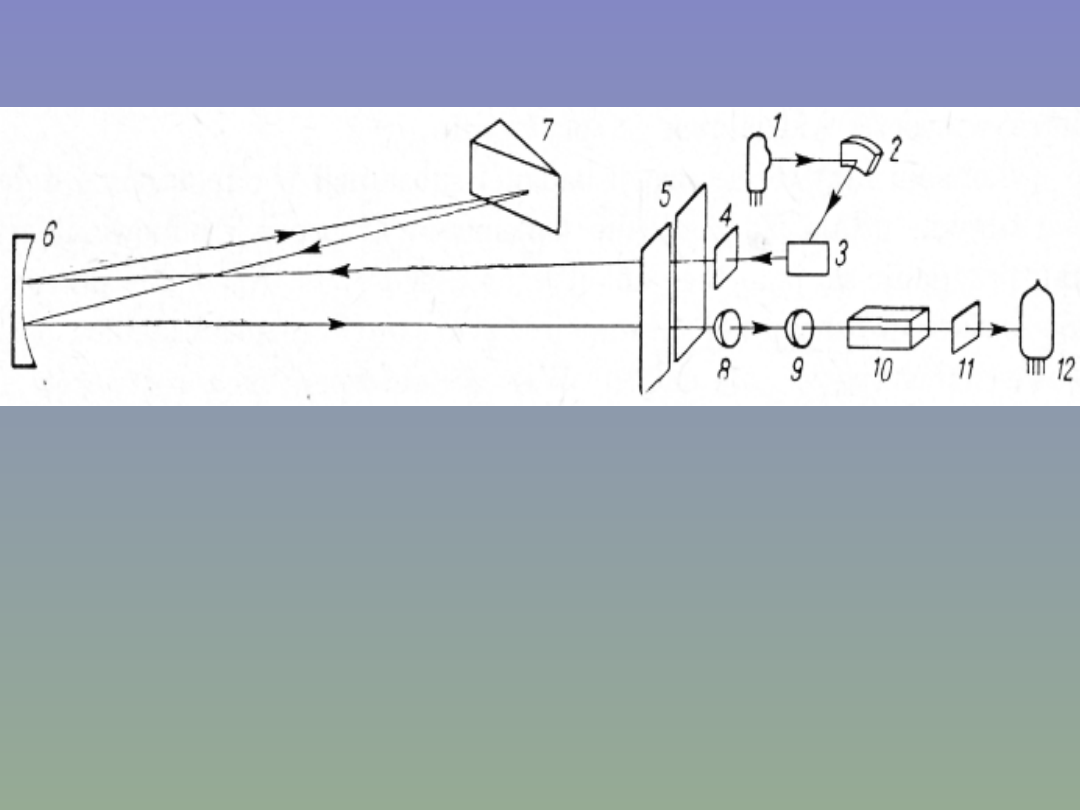
Spektrofotometr UV/VIS
Promieniowanie lampy wodorowej 1 po przejściu przez kondensor 2 i
od biciu od zwierciadła 3 trafia na szczelinę 5 chronioną płytką
kwarcową 4. Następnie zwierciadło 6 kieruje je na pryzmat kwarcowy
7, w którym następuje rozszczepienie i odbicie. Wiązka
rozszczepionego promieniowania wraca przez odbicie w zwierciadle 6
do szczeliny 5, a przez soczewkę 8 i ew. dodatkowy filtr 9 trafia na
kuwetę 10. Po przejściu następnie przez okienko kwarcowe 11 wiązka
trafia na katodę fotokomórki 12. Obrót pryzmatu 7 pozwala kierować
na szczelinę promieniowanie o coraz to innej długości fali.
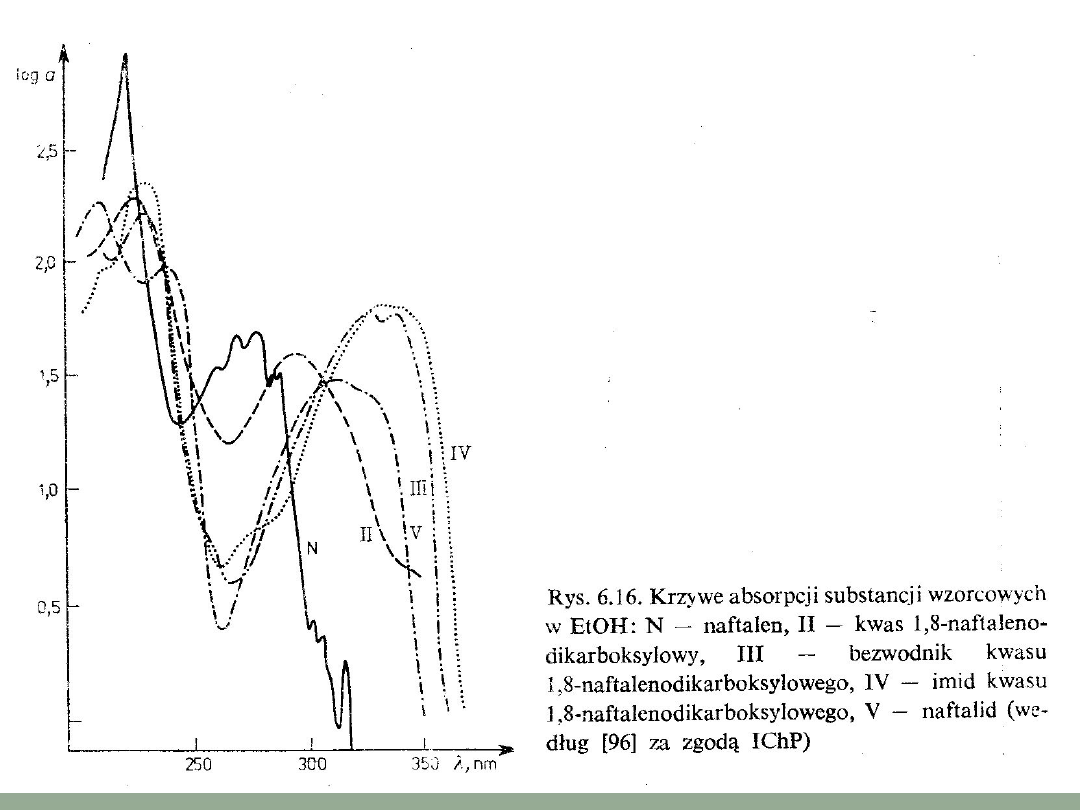
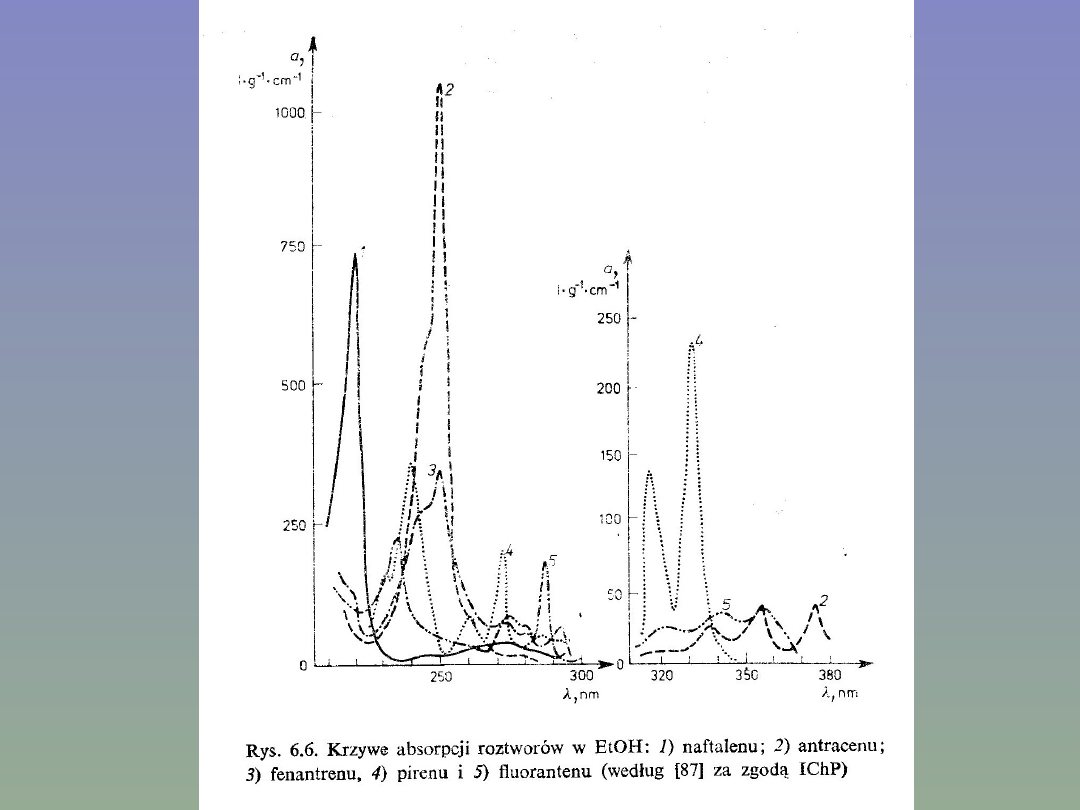

Zastosowanie
spektrofotometrii.
Spektrofotometria UV — Vis należy do najczęściej wykorzystywanych metod instrumentalnych w
analizie ilościowej. Główne zalety tej metody, to:
a)
Dobra czułość
Obiektywnym liczbowym wykładnikiem czułości metod spektrofoto-metrycznych jest molowy
współczynnik absorpcji ε.
b)
Dobra precyzja oznaczeń
Precyzja oznaczeń zależy od zakresu oznaczanych stężeń i od klasy stosowanych, aparatów. W
metodach spektrofotometrycznych można uzyskać wyniki, których błąd nie przekracza ± 0,2%.
c)
Selektywność oznaczeń
Jest uwarunkowana selektywnością absorpcji z jednej strony i selektywnością odczynników
wywołujących barwną reakcję z substancją oznaczaną z drugiej strony. Te dwa czynniki pozwalają
na osiągnięcie dobrej selektywności w szczególności w oznaczeniach kationów metali.
Możliwości praktycznych zastosowań metod spektrofotometrycznych UV—Vis są różnorakie. A oto
kilka przykładów takich zastosowań:
1)
W analizie ilościowej kationów metali
Opracowano procedury oznaczeń dla wszystkich kationów metali i to na wiele sposobów. Kationy
metali oznacza się najczęściej w postaci barwnych kompleksów chelatowych z odczynnikami
organicznymi, barwnych kompleksów par jonowych, a także barwnych kompleksów z prostymi
ligandami nieorganicznymi, np. z tiocyjanianami (Fe3 + , Co3 + , Nb5 + , Mob + , Re7 + , W6+),
jodkami (Pd2 + , Bi3 + , Sb3\ Pt4+) lub nadtlenkami (Ti4+).
2)
W analizie ilościowej anionów nieorganicznych
Metody spektrofotometrii UV — Vis należą do głównych metod w analizie anionów nieorganicznych.
Procedury oznaczeń obejmują wszystkie aniony, aie najczęściej oznacza się azotany(V) i
azotany(III) (azotyny) (również obok siebie), fosforany, fluorki i krzemiany.
3)
W analizie ilościowej związków organicznych
Spektrofotometria, w szczególności w zakresie nadfioletu, jest stosowana w analizie ilościowej
związków organicznych.
4)
Do badania równowag reakcji chemicznych
Spektrofotometrię UV —Vis wykorzystuje się w szczególności do:
a) wyznaczania stałych dysocjacji kwasów i zasad,
b) ustalania składu i stałych trwałości związków kompleksowych.

Dziękujemy za uwagę.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
Spektrofotometria promieni uv vis
materiały spektroskopia UV VIS
Spektrofotometria UV VIS Zastosowanie spektrofotometrii w Biochemii
spektrometria UV VIS spektrofluorymetria
Spektrofotometria UV-VIS 4
Wykresy zależności dla spektrofotometrii UV VIS
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Spektroskopia UV-VIS kompleksów metali przejściowych-ćwiczenia, matury z chemii
Spektrofotometria UV VIS
spektroskopia uv vis, spektroskopia ir
materiały spektroskopia UV VIS
spektrometria UV VIS spektrofluorymetria
Instrukcja spektroskopia UV VIS
Spektroskopia UV Vis
Spektroskopia UV Vis
Promieniowanie UV, Kosmetologia
Mechanizm wyzwalania reakcji biologicznych pod wpływem działania promieni UV
więcej podobnych podstron