I. Cel ćwiczenia:
Celem ćwiczenia było otrzymanie izomerów cis i trans o wzorze sumarycznym
oraz wyznaczenie parametrów kinetycznych, transformacji izomeru trans w cis z pomiarów spektroskopowych w zakresie widzialnym.
Reakcja zachodząca podczas syntezy:
……………………………………………………………………………………………..
II. Wzór Strukturalny dla izomeru cis i trans:
III.WYKONANIE:
Do pierwszej kolby miarowej na 50cm3 przeniesiono 0,1701g izomeru cis i następnie uzupełniono kolbę wodą destylowaną do kreski. Do drugiej kolby miarowej dodano 0,1900g izomeru trans i uzupełniono woda destylowaną do kreski. Po rozpuszczeniu związku w obydwóch kolbach miarowych zarejestrowano widma w zakresie 350-700nm. Pomiary przeprowadzono w temperaturze 22°C.
Z otrzymanego widma nr1 przedstawiającego wodne roztwory izomerów cis i trans odczytano położenie maksimów.
Izomer cis
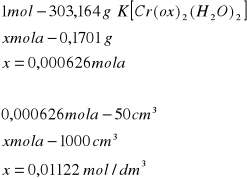
λ [nm] |
A |
415 |
0,747 |
565 |
0,524 |
Izomer trans
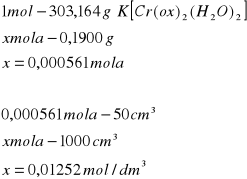
λ [nm] |
A |
410 |
0,259 |
545 |
0,236 |
Korzystając z prawa Lamberta-Beera, odpowiednio przekształcając wzór obliczono molowe współczynniki absorbancji.
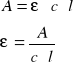
Izomer cis
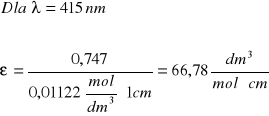
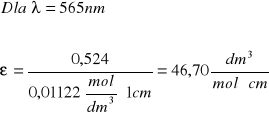
Izomer trans
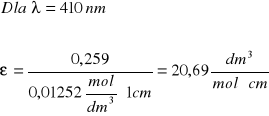
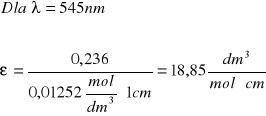
IV. POMIAR SZYBKOŚCI IZOMERYZANCJI KOMPLEKSU TRANS W CIS
W kolbie miarowej na 50cm3 rozpuszczono 0.2000g izomeru trans w 0,0001mol/dm3 HClO4. Zaraz po rozpuszczeniu związku rejestrowano widma w zakresie 350-700 nm, początkowo co 2 minuty, a później zwiększono odstępy czasowe do 3-4 minut. Następnie z otrzymanej serii widm (nr2 i nr3) odczytano wartości absorbancji przy długości fali 415nm. Po upływie ok.. 2 godzin od rozpuszczenia kompleksu zmierzono ostatnie widmo wyznaczając ![]()
. Wyniki zestawiono tabeli nr.1.
LP |
Czas [s] |
A |
|
ln( |
1/( |
1 |
240 |
0,242 |
0,485 |
-0,723 |
2,062 |
2 |
720 |
0,297 |
0,430 |
-0,844 |
2,326 |
3 |
840 |
0,318 |
0,409 |
-0,894 |
2,445 |
4 |
1020 |
0,332 |
0,395 |
-0,929 |
2,532 |
5 |
1200 |
0,352 |
0,375 |
-0,981 |
2,667 |
6 |
1380 |
0,370 |
0,357 |
-1,030 |
2,801 |
7 |
1560 |
0,388 |
0,339 |
-1,082 |
2,950 |
8 |
1740 |
0,404 |
0,323 |
-1,130 |
3,096 |
9 |
1920 |
0,419 |
0,308 |
-1,178 |
3,247 |
10 |
2100 |
0,434 |
0,293 |
-1,228 |
3,413 |
11 |
2280 |
0,448 |
0,279 |
-1,276 |
3,584 |
12 |
2520 |
0,466 |
0,261 |
-1,343 |
3,831 |
13 |
2760 |
0,483 |
0,244 |
-1,410 |
4,098 |
14 |
3000 |
0,498 |
0,229 |
-1,474 |
4,367 |
15 |
3240 |
0,513 |
0,214 |
-1,542 |
4,673 |
16 |
3480 |
0,527 |
0,200 |
-1,609 |
5,000 |
17 |
3720 |
0,540 |
0,187 |
-1,677 |
5,348 |
18 |
3960 |
0,552 |
0,175 |
-1,743 |
5,714 |
19 |
4200 |
0,563 |
0,164 |
-1,808 |
6,098 |
![]()
Tab.1. Wyniki pomiarów kinetycznych reakcji izomeryzacji.
Pomiary przeprowadzono w temperaturze 22° C.
V. Sporządzono wykresy krzywych zależności, odpowiadające różnym równaniom kinetycznym:
Dla reakcji rzędu zerowego:
Dla reakcji rzędu pierwszego:
Dla reakcji rzędu drugiego:
VI. WNIOSKI:
Na podstawie otrzymanych wykresów dla poszczególnych zależności stwierdzono, iż reakcja izomeracji izomeru trans w cis jest rzędu pierwszego, ponieważ krzywa regresji jest najlepiej dopasowana, a jej kwadrat jest najbardziej zbliżony ku wartości 1.
Z nachylenia prostej wyznaczono stałą szybkości dla reakcji izomeryzacji trans w cis.
k= 0,000275 ![]()
VII. Obliczono czas połowicznej przemiany izomeru trans w cis.
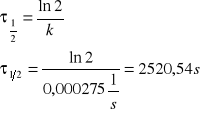
Czas połowicznej przemiany izomeru trans w cis wynosi 2520,54 s
1
Wyszukiwarka
Podobne podstrony:
materiały spektroskopia UV VIS
Spektrofotometria UV VIS Zastosowanie spektrofotometrii w Biochemii
spektrometria UV VIS spektrofluorymetria
Spektrofotometria UV-VIS 4
Wykresy zależności dla spektrofotometrii UV VIS
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Spektrofotometria UV VIS
spektroskopia uv vis, spektroskopia ir
materiały spektroskopia UV VIS
spektrometria UV VIS spektrofluorymetria
badanie właściwości chemicznych prostych akwa, amina, chloro i hydrokso kompleksów metali przejściow
Instrukcja spektroskopia UV VIS
Spektroskopia UV Vis
Spektroskopia UV Vis
Spektrofotometria promieni UV Vis
Analiza wielopierścieniowych węglowodorów aromatycznych (WWA) metodą HPLC z detektorem UV Vis ćwicze
Spektrofotometria promieni uv vis
więcej podobnych podstron