
1
Problemy do rozważenia...
• Jak tworzą się wiązania?
• Jakiego rodzaju wiązania?
• Jakie własności wynikają z rodzaju wiązań?
WIĄZANIA MIĘDZYATOMOWE
I WŁASNOŚCI MATERIAŁÓW
Ciekawy przykład - węgiel:
Dwie odmiany:
grafit
i
diament
grafit – miękki, "smarujący"
diament – najtwardszy znany materiał

2
Struktura Atomowa (Chemia)
• atom –
electrony
– 9.11 x 10
-31
kg
protony
neutrony
• Liczba atomowa Z
= liczba protonów w jądrze atomu
N
= liczba elektronów (atom obojętny)
liczba neutronów może być różna (
izotopy
)
• Masa atomowa
A
= masa 6.023 x 10
23
atomów
• Jednostka masy atomowej
= jma = u = 1/12 masy
12
C
(A = 12.0000)
A = Z + N
1 jma/atom = 1g/mol
C 12.011
H 1.008 etc.
}
1.67 x 10
-27
kg
3
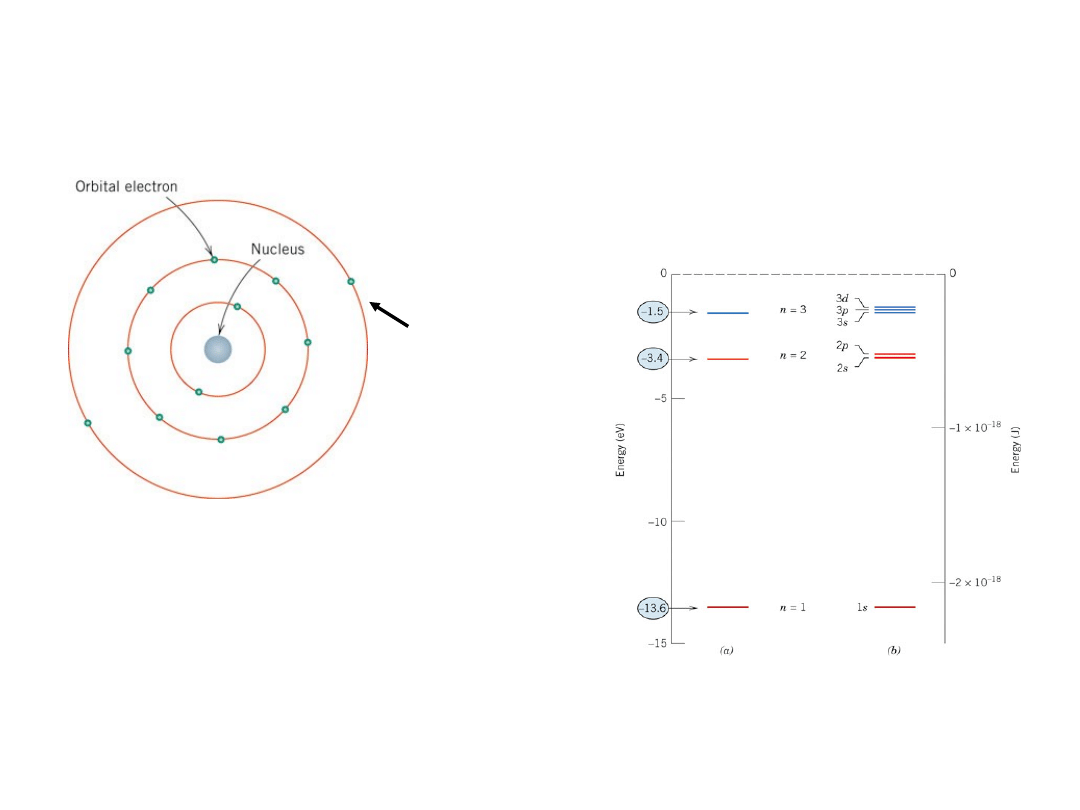
Model atomu wg Bohra
jądro – protony +
neutrony
Energie elektronów są skwantowane
Wartości energii (stany) – ściśle określone
wartości
Dozwolone stany
energetyczne dla
wodoru
Bardziej dokładny jest
model falowy – mechanika
kwantowa
Elektrony
walencyj
ne
4
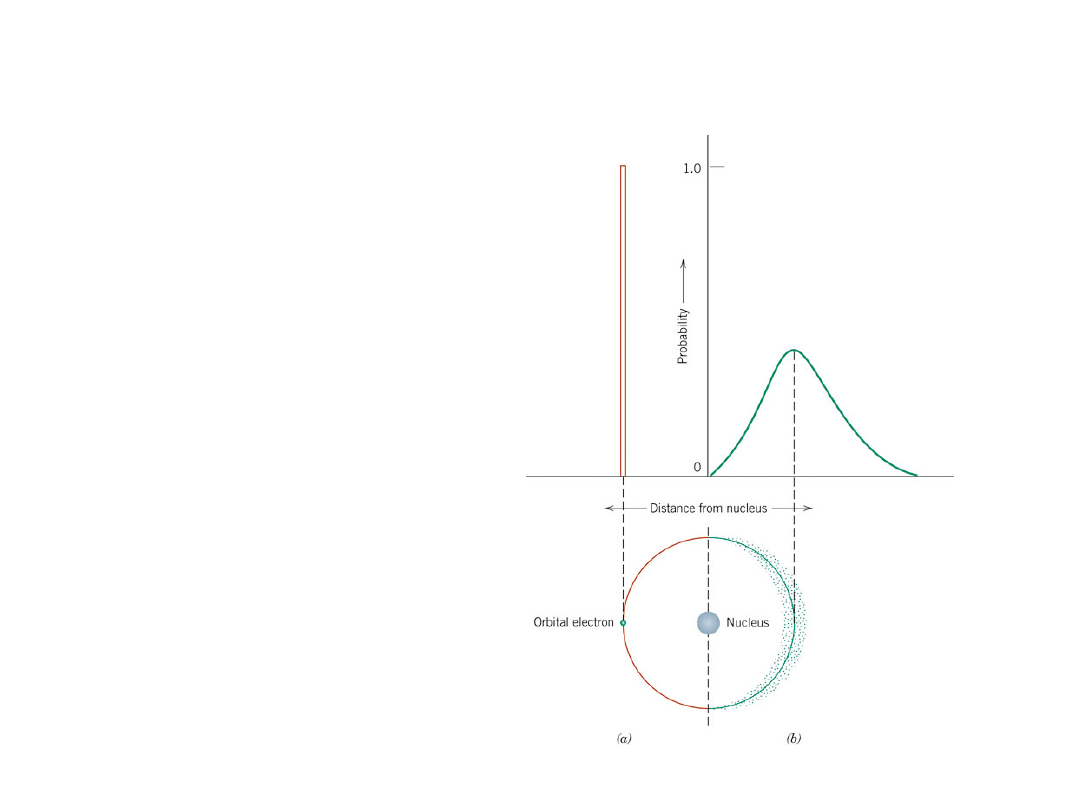
Model falowy
Elektrony wykazują
zarówno właściwości
falowe jak i
czasteczkowe
Położenie pojedynczego
elektronu jest
traktowane jako rozkład
prawdopodobieństwa
wokół jądra
Zasada Pauliego - w
atomie nie może być
więcej niż 2 elektronów
znajdujących się w tym
samym stanie

5
Struktura Elektronowa
• Elektrony mają właściwości falowe i
korpuskularne + zasada Pauli'ego:
– Elektrony zajmują ścisle określone stany
energetyczne zdefiniowane przez
prawdopodobieństwo
(orbitale)
.
– Każdy orbital ma dyskretny poziom energii
określony przez
liczby kwantowe
.
Liczby kwantowe Oznaczenie
n = główna (określa powłokę)
K, L, M, N, O (1, 2, 3, etc.)
l = poboczna (podpowłoka)
s, p, d, f (0, 1, 2, 3,…, n
-1)
m
l
= magnetyczna
1, 3, 5, 7 (-l to +l)
m
s
= spin ½, -½
6
Stany Energetyczne
Elektronów
Elektrony zajmują kolejne orbitale na
kolejnych powłokach tak aby atom jako
całość posiadał jak najniższą energię.
Znając
liczbę atomową
danego pierwiastka
można łatwo samemu ustalić jego
konfigurację elektronową
Reguły:
1.
Najpierw zapełnieniu ulegają orbitale "s",
potem "p", potem "d" i na końcu "f".
2.
Orbitale z wyższych warstw są zapełniane
dopiero po całkowitym zapełnieniu warstw
niższych.
3.
Na orbitalach s mogą być tylko 2
elektrony, na p 6, na d 10 i na f 14
4.
W pierwszej powłoce jest tylko orbital s, w
drugiej są orbitale s i p, w trzeciej s, p i d i
w końcu w czwartej i piątej pojawiają się
jeszcze orbitale f.
7
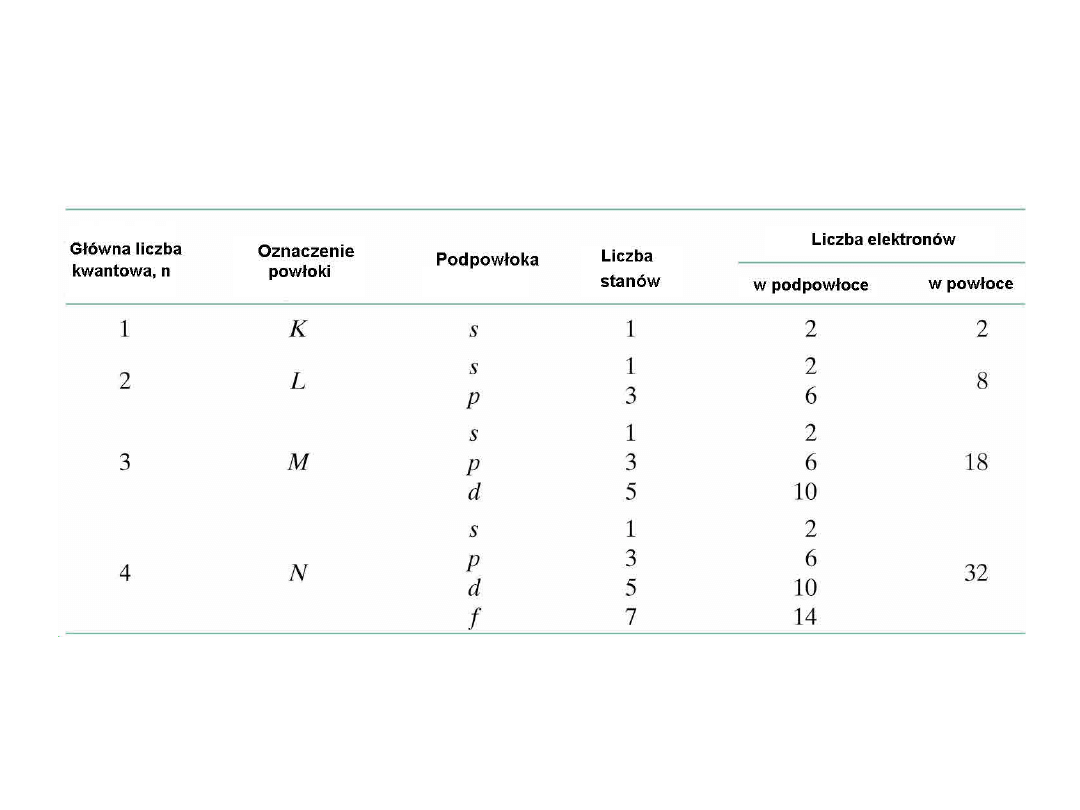
Liczba możliwych stanów elektronów w
poszczególnych powłokach i
podpowłokach
8
Większość pierwiastków ma konfigurację elektronową niestabilną
PRZEGLĄD PIERWIASTKÓW
Konfiguracja electronowa
(stabilna)
...
...
1s
2
2s
2
2p
6
3s
2
3p
6
(stabilna)
...
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
(stabilna)
Z
18
...
36
Pierwiastek
1s
1
1
Wodór
1s
2
2
Hel
1s
2
2s
1
3
Lit
1s
2
2s
2
4
Beryl
1s
2
2s
2
2p
1
5
Bor
1s
2
2s
2
2p
2
6
Węgiel
...
1s
2
2s
2
2p
6
(stabilna)
10
Neon
1s
2
2s
2
2p
6
3s
1
11
Sód
1s
2
2s
2
2p
6
3s
2
12
Magnez
1s
2
2s
2
2p
6
3s
2
3p
1
13
Aluminium
...
Argon
...
Krypton

9
Elektrony
• Elektrony walencyjne
–
elektrony w
najdalszej (zewnętrznej) powłoce, biorą udział
w tworzeniu wiązań międzyatomowych
• Elektrony walencyjne
wpływają
(poprzez wiązania) na nastepujące własności:
1)Chemiczne
2)Electryczne
3)Cieplne
4)Optyczne
Powłoka walencyjna
nie jest zwykle w
pełni obsadzona elektronami
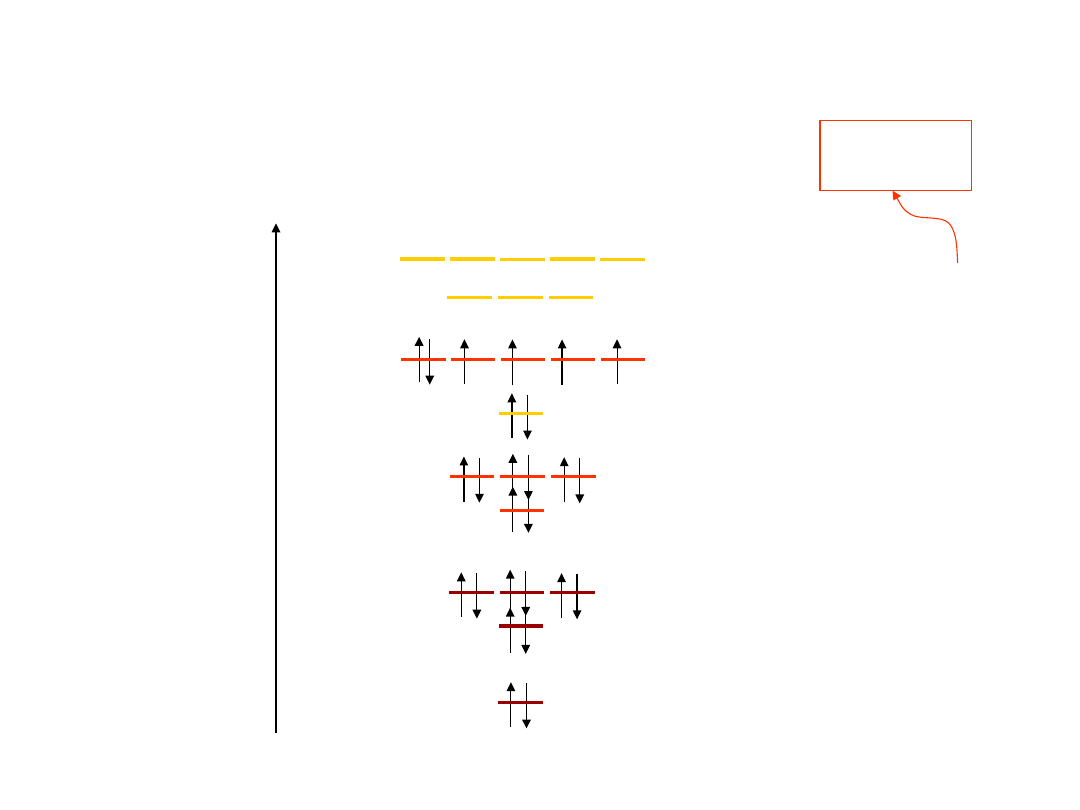
10
Konfiguracje Elektronowe
np: Fe, Z
=
26
Elektrony
walencyjne
1s
2s
2p
K n = 1
L n = 2
3s
3p
M n = 3
3d
4s
4p
4d
Energia
N n = 4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
11
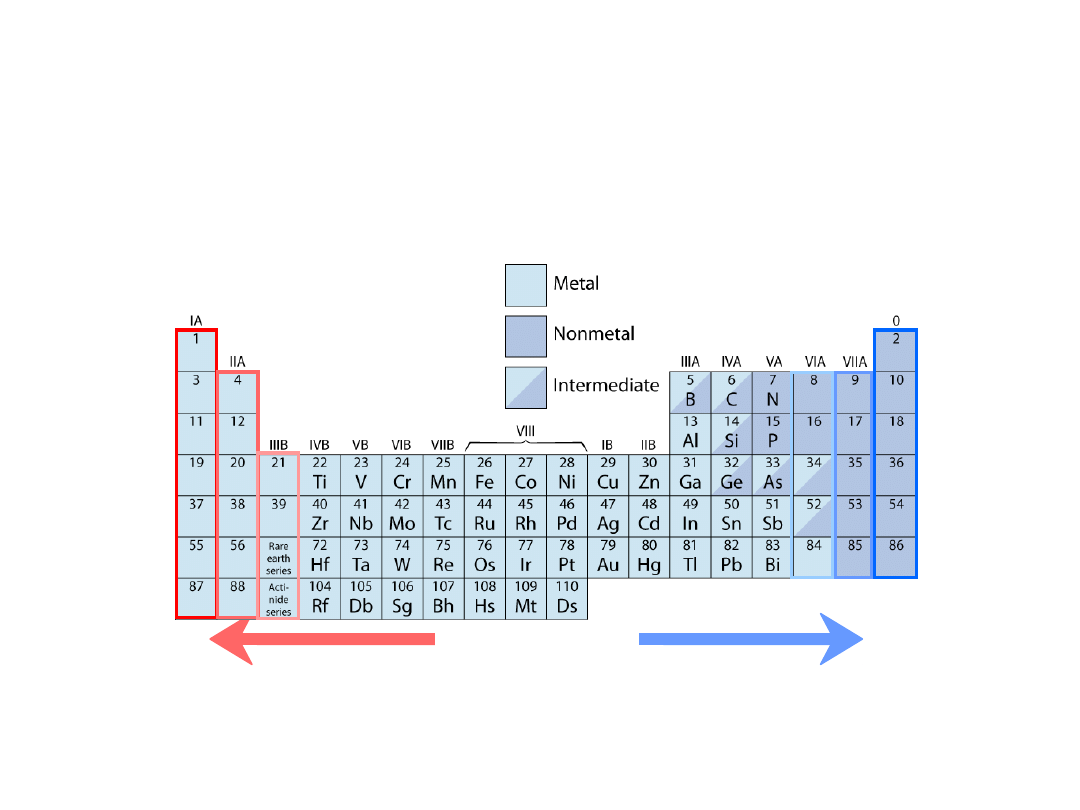
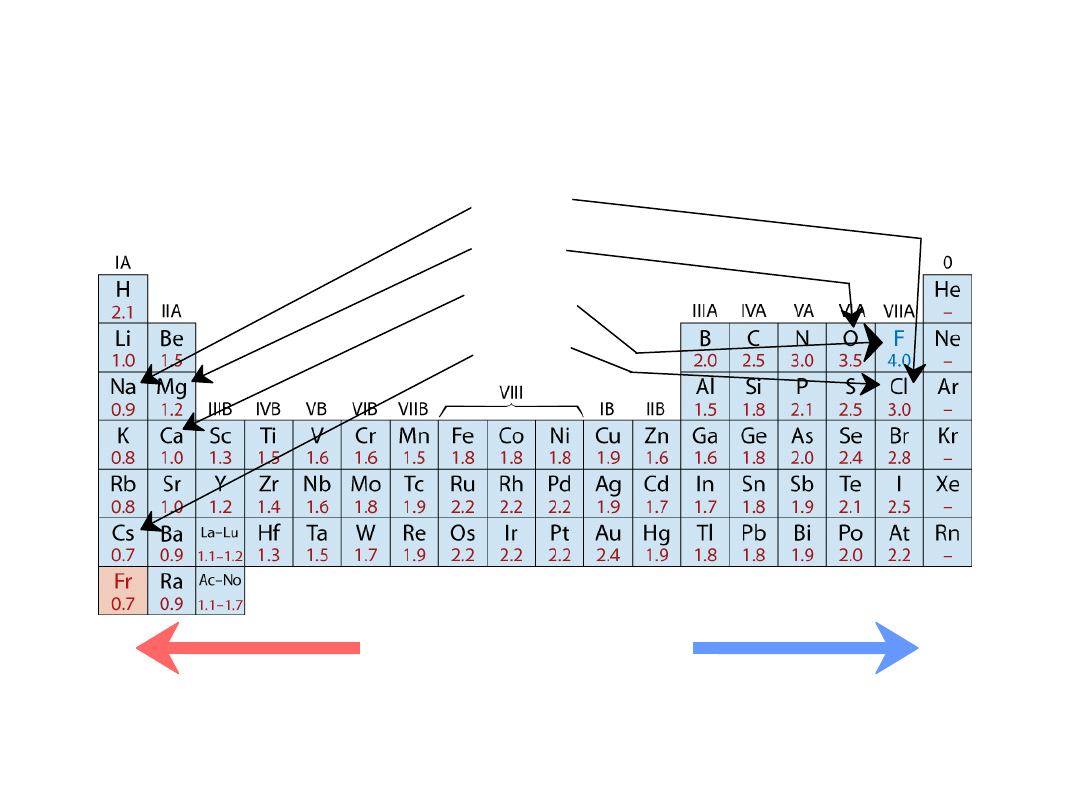
Układ okresowy pierwiastków
Kolumny:
Podobna struktura
walencyjna
Pierwiastki electrododatnie:
chętnie oddają elektrony
i stają się jonami dodatnimi
Pierwiastki electroujemne:
chętnie pobierają elektrony i stają się
jonami ujemnymi
o
d
d
a
je
1
e
o
d
d
a
je
2
e
o
d
d
a
je
3
e
g
a
z
d
o
s
k
.
p
rz
y
jm
u
je
1
e
p
rz
y
jm
u
je
2
e
O
Se
Te
Po At
I
Br
He
Ne
Ar
Kr
Xe
Rn
F
Cl
S
Li
Be
H
Na
Mg
Ba
Cs
Ra
Fr
Ca
K
Sc
Sr
Rb
Y
12
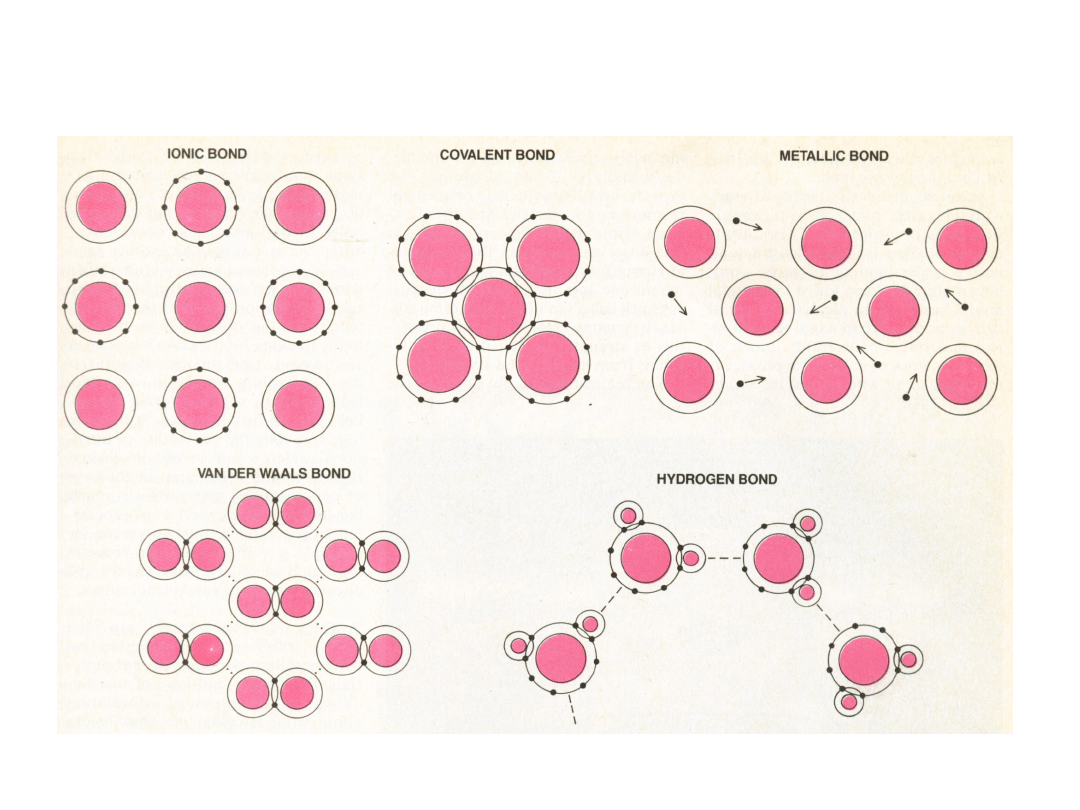
Wiązanie jonowe –
metal
+
niemetal
dostarcza
przyjmuje
elektrony
elektrony
Różne elektroujemności
Np.:
Mg
O
Mg
1s
2
2s
2
2p
6
3s
2
O
1s
2
2s
2
2p
4
[Ne] 3s
2
Mg
2+
1s
2
2s
2
2p
6
O
2-
1s
2
2s
2
2p
6
[Ne]
[Ne]
13
• Występuje pomiędzy
+
i
-
jonami
• Wymaga
transferu electronów
• Wymagana duża różnica w elektroujemności
• Przykład:
NaCl
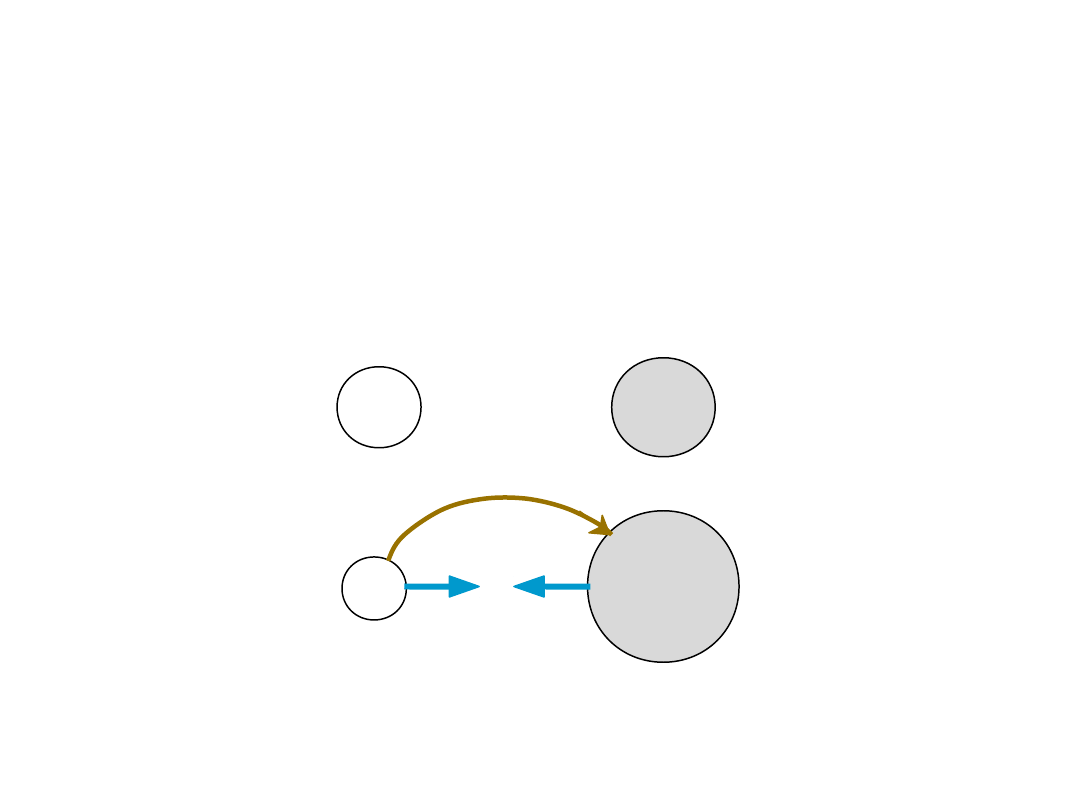
Wiązanie jonowe
Na (metal)
niestabilny
Cl (niemetal)
niestabilny
electron
+
-
Przyciąganie
coulombowskie
Na (kation)
stabilny
Cl (anion)
stabilny
14
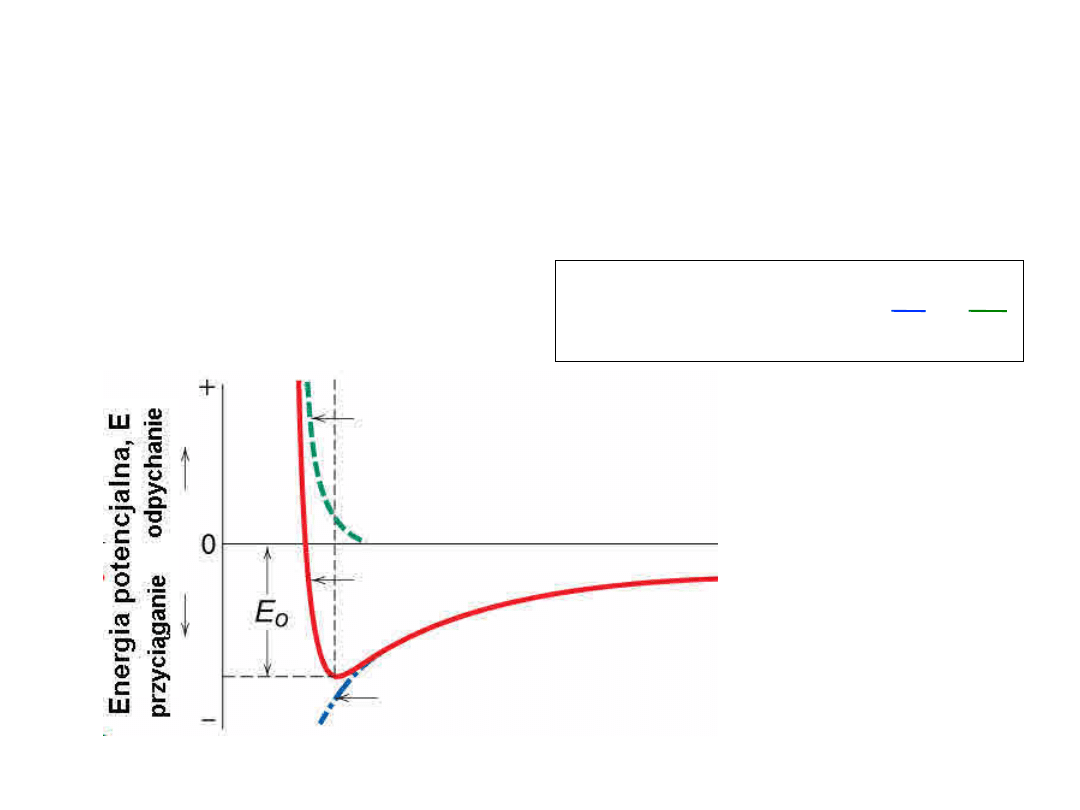
Wiązanie jonowe
Energia – minimum energii, najbardziaj stabilny
układ
– Równowaga pomiędzy
przyciąganiem
a
odpychaniem
r
A
n
r
B
E
N
=
E
A
+
E
R
=
Energia odpychania
E
R
Energia wypadkowa, E
N
Energia przyciągania, EA
Odległość międzyatomowa, r
15
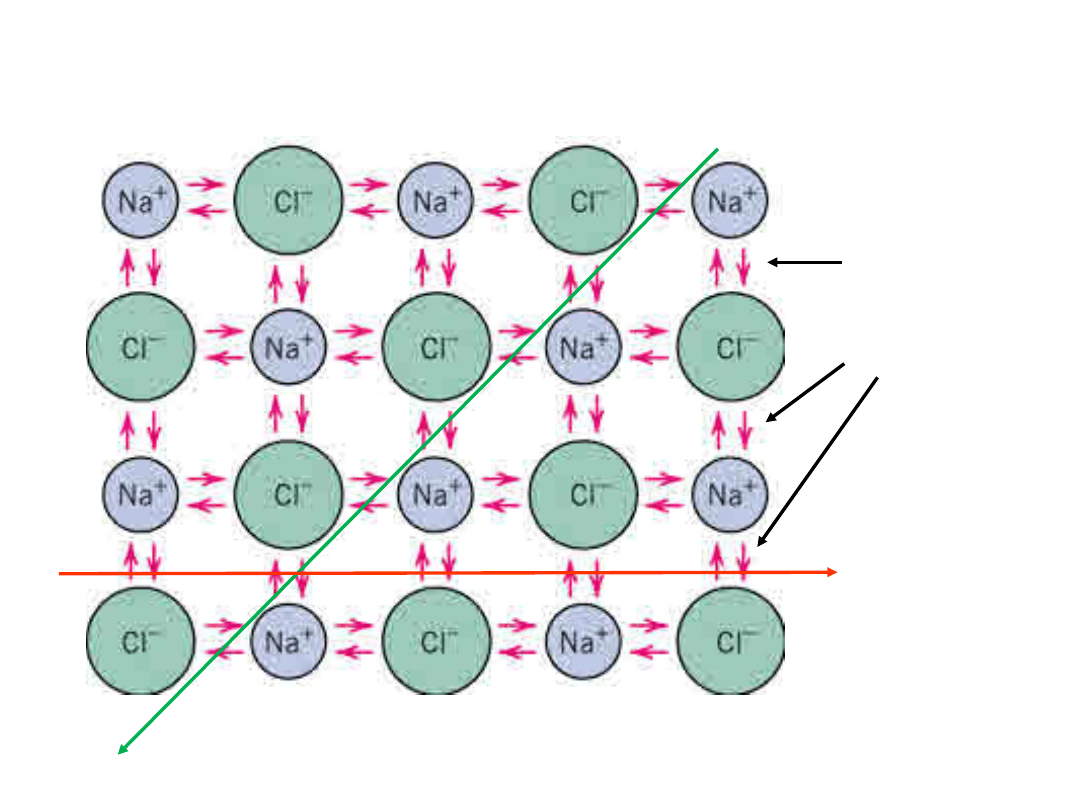
Wiązanie jonowe w NaCl
Siły
Coulomb
a
16
Dominujące wiązanie w
Ceramikach
Przykłady wiązań jonowych
Oddają elektrony
Przyjmują elektrony
NaCl
MgO
CaF
2
CsCl
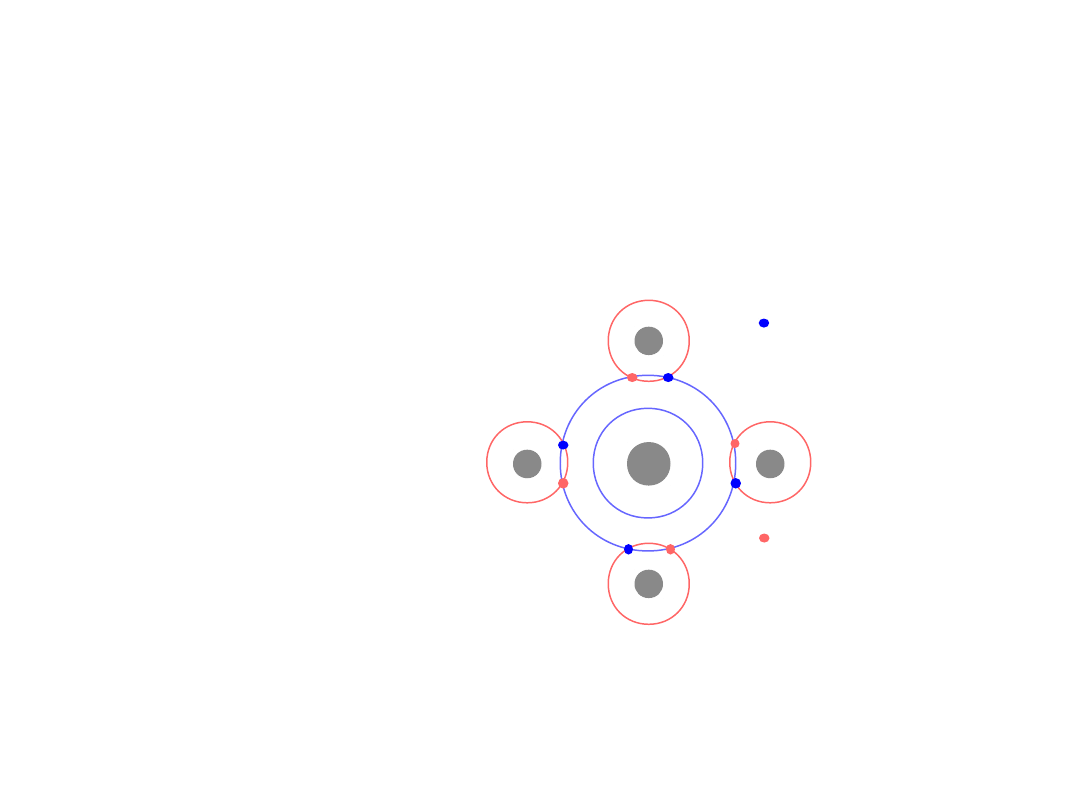
17
C: ma 4 el. walencyjne e
-
,
potrzebuje jeszcze 4
H: ma 1 el. walencyjny e
-
,
potrzebuje jeszcze 1
Elektroujemności są
porównywalne
Wiązanie kowalencyjne
• podobna
elektroujemność
wspólne elektrony
• Wiązania tworzą elektrony z orbitali
s
&
p
• Przykład:
CH
4
(metan)
Elektrony od atomu
węgla
Elektrony od
atomów wodoru
H
H
H
H
C
CH4
Wiązanie kowalencyjne jest
kierunkowe
18
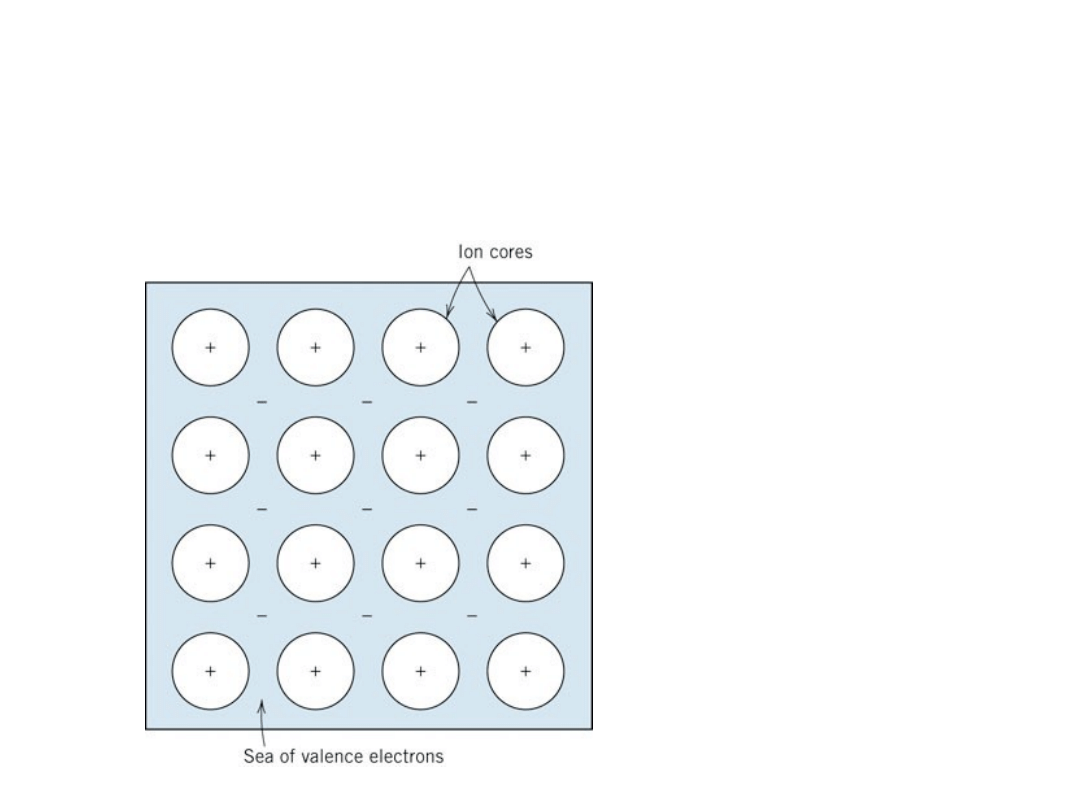
Wiązanie metaliczne
Wiązanie metaliczne
– chmura elektronów nie
związana z żadnym konkretnym jonem
Wiązanie
metaliczne nie ma
charakteru
kierunkowego
19
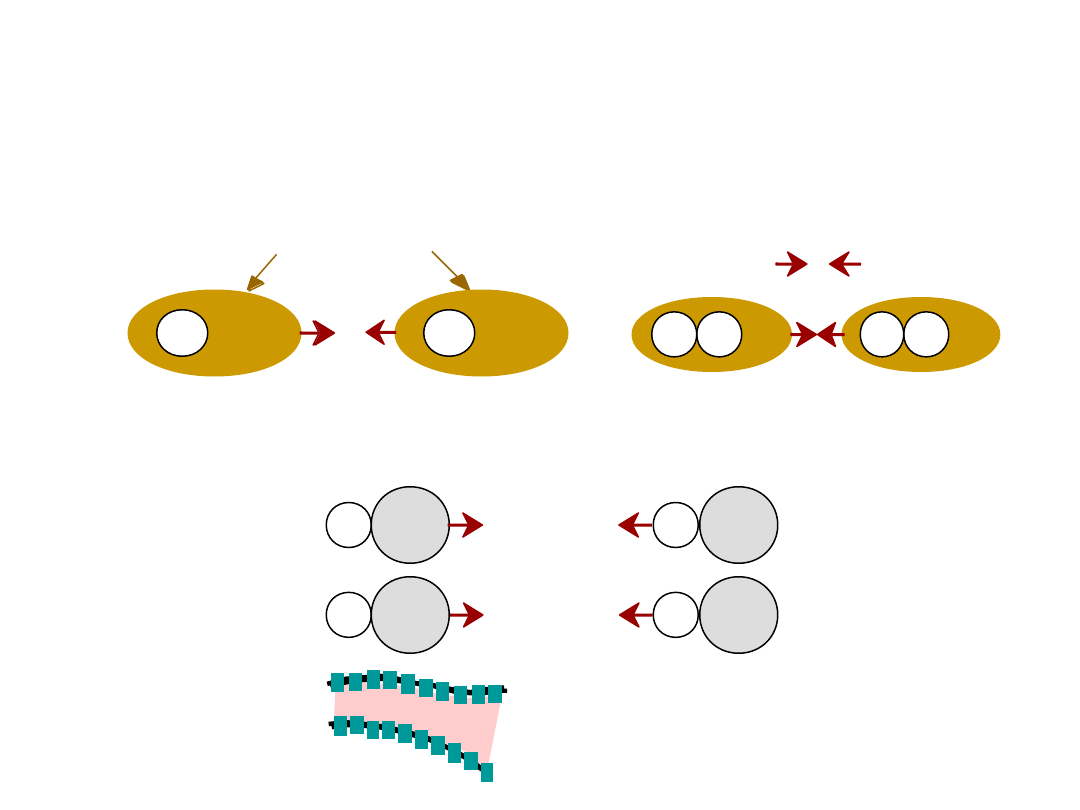
Wynika z oddziaływania pomiędzy
dipolami
•
Dipole trwałe
- cząsteczki
•
Dipole fluktuacyjne (chwilowe)
przypadek ogólny:
ciekły HCl
polymer
WIĄZANIA WTÓRNE – Van der
Waalsa
asymetryczna chmura
elektronów
+
-
+
-
wiązanie
wtórne
H
H
H
H
H2
H2
wiązanie
wtórne
np: ciekły
H
2
H Cl
H Cl
wiązanie
wtórne
wiązanie
wtórne
+ -
+
-
Wiązanie w
tórne
20
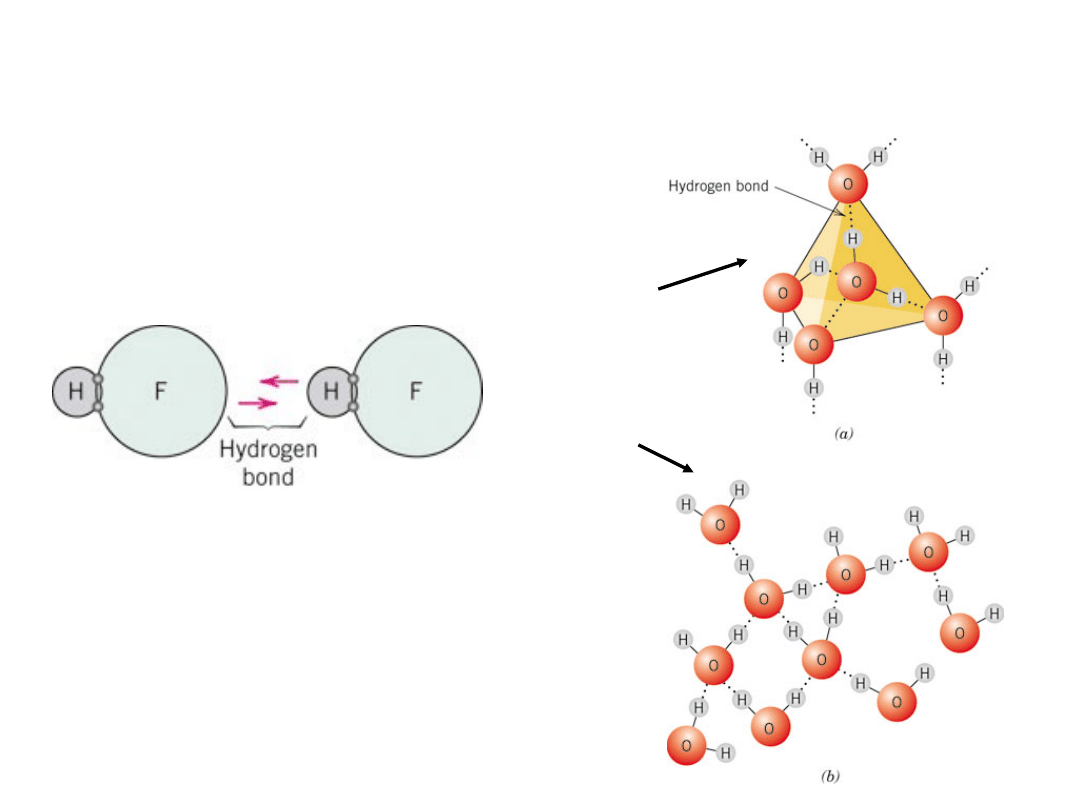
Wiązanie wodorowe
Wiązanie wodorowe w
HF
lód
woda
Szczególny przypadek wiązania
wtórnego, występuje pomiędzy
cząsteczkami zawierającymi
wodór
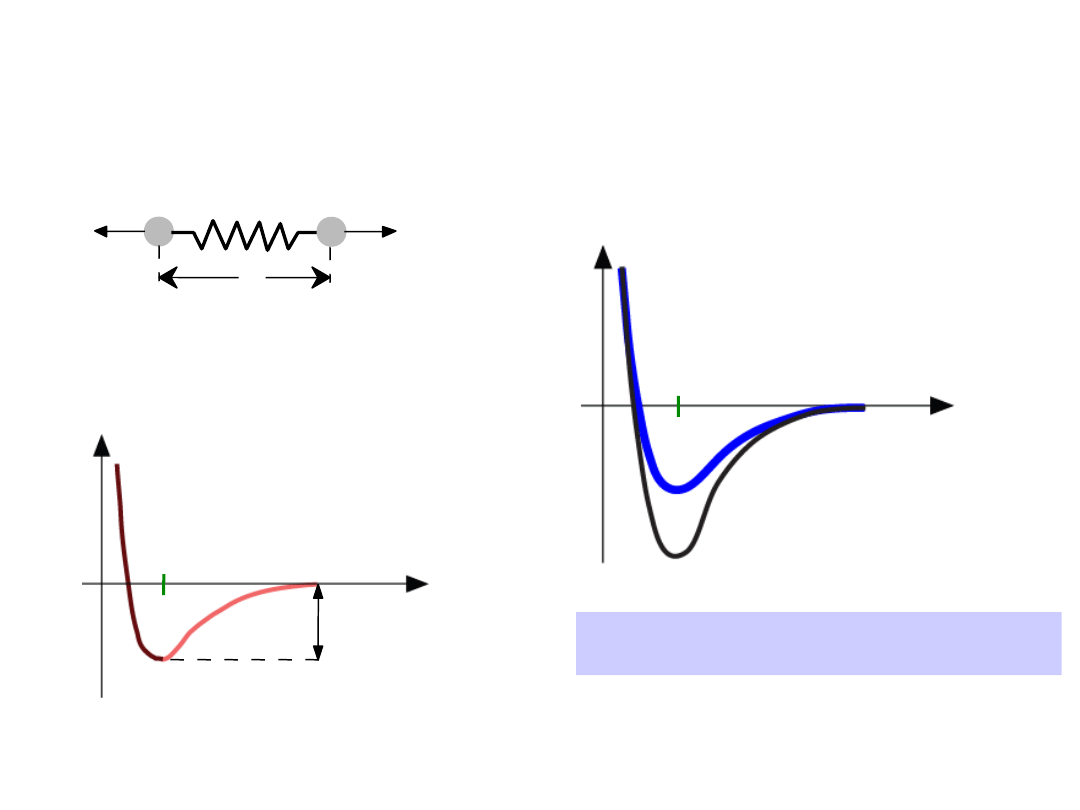
21
•
Długość wiązania
, r
•
Energia wiązania,
E
o
•
Temperatura topnienia
, T
m
T
m
jest większa, gdy E
o
jest większa
Własności zależne od typu
wiązania: T
m
r
o
r
Energia
r
większa T
m
mniejsza T
m
E
o
=
“energia wiązania”
Energia
r
o
r
Odległość
22
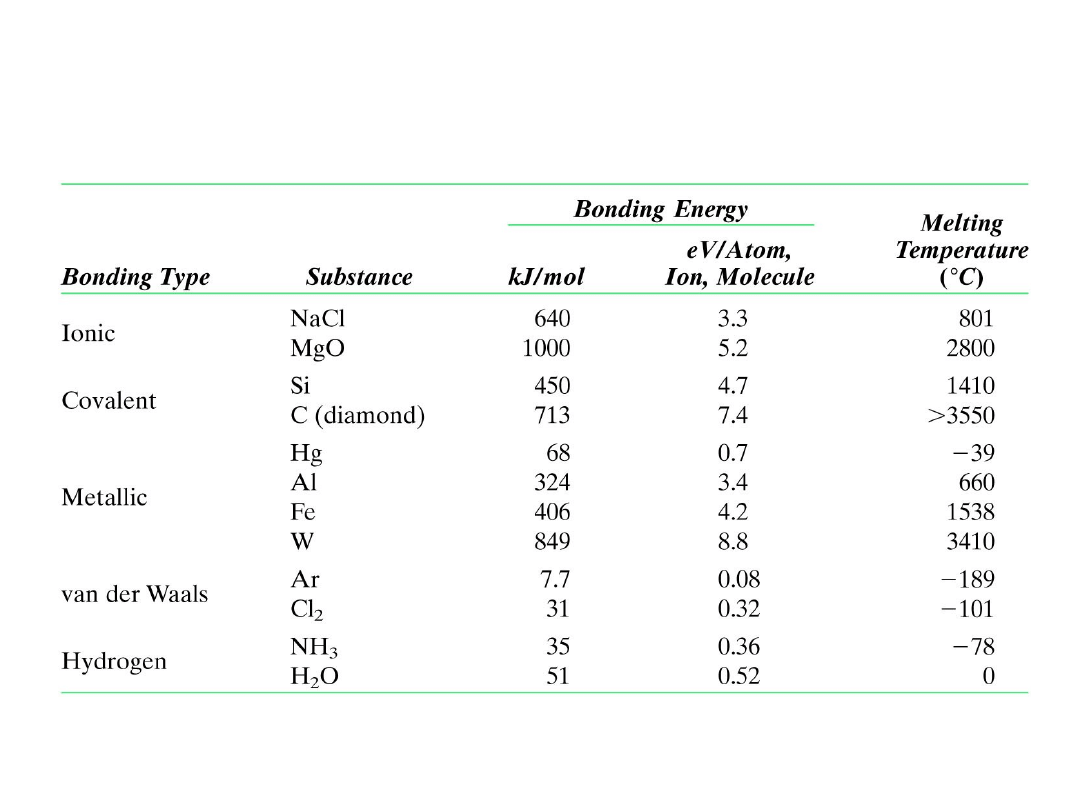
Energie wiązania i temperatury topnienia
dla niektórych substancji
23
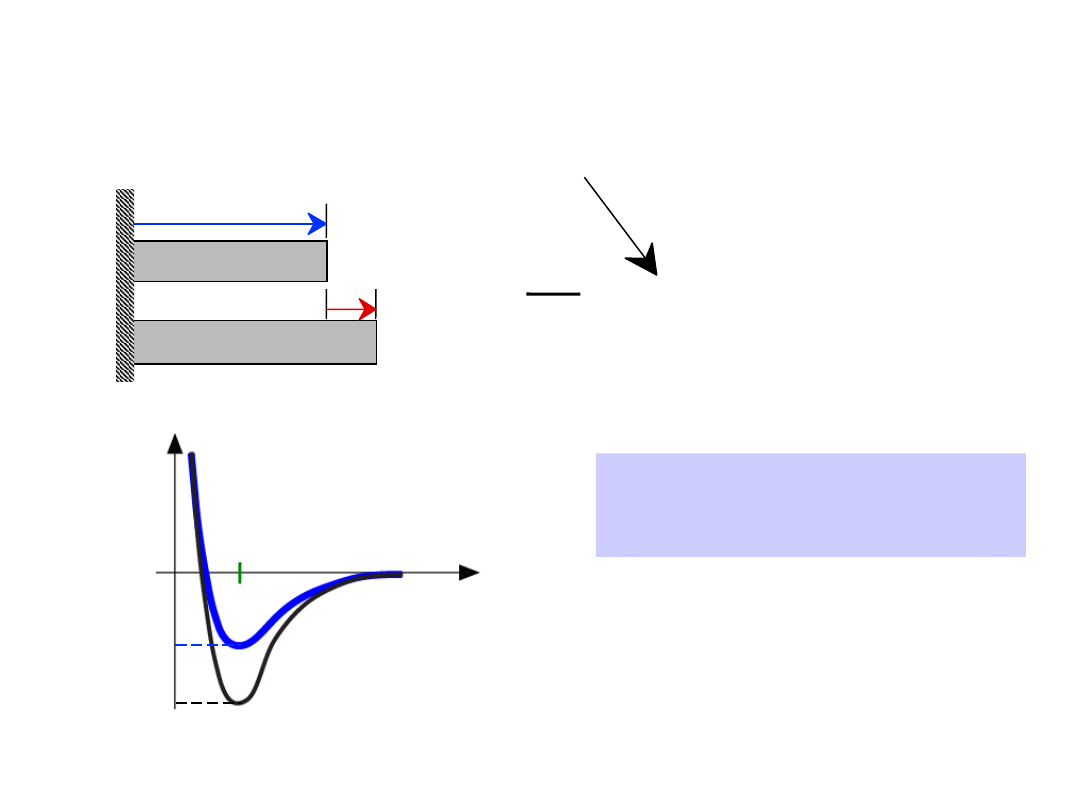
•
współczynnik rozszerzalności cieplnej
,
mniejsze, gdy E
o
jest
mniejsza
Własności zależne od typu
wiązania:
= (
2
T
)
L
T
-
1
L
o
L
długość,
Lo
Temp. T1
Temp. T2
r
o
r
większe
mniejsze
Energia
długość
E
o
E
o
24
Podsumowanie

25
Ceramiki
(jonowe & kowalencyjneg):
Metale
(metaliczne):
Polimery
(kowalencyjne i wtórne):
Duża energia wiązania
wysoka T
m
mały wsp.
Zmienna energia wiązania
średnia T
m
średni
Własności kierunkowe
Wiązania wtórne dominują
niska T
m
duży wsp.
Podsumowanie: Wiązania
pierwotne
Wiązanie w
tórne

26
Typ
Jonowe
Kowalencyjne
Metaliczne
Wtórne
Energia
Duża!
Zmienna
Duża-Diament
mała-Bismut
Zmienna
duża-Wolfram
mała-Rtęć
najmniejsza
Uwagi
Bezkierunkowe (
ceramiki
)
Kierunkowe
(półprzewodniki,
ceramiki
łańcuchy polimerowe
)
Bezkierunkowe (
metale
)
Kierunkowe
Między łańcuchami (
polymer
)
Pomiędzy cząsteczkami
Podsumowanie
Document Outline
- WIĄZANIA MIĘDZYATOMOWE I WŁASNOŚCI MATERIAŁÓW
- Struktura Atomowa (Chemia)
- f01_02_pg18
- Model falowy
- Struktura Elektronowa
- Stany Energetyczne Elektronów
- Liczba możliwych stanów elektronów w poszczególnych powłokach i podpowłokach
- PRZEGLĄD PIERWIASTKÓW
- Elektrony
- Konfiguracje Elektronowe
- Układ okresowy pierwiastków
- Wiązanie jonowe – metal + niemetal
- Wiązanie jonowe
- Slide 14
- Wiązanie jonowe w NaCl
- Przykłady wiązań jonowych
- Wiązanie kowalencyjne
- Wiązanie metaliczne
- WIĄZANIA WTÓRNE – Van der Waalsa
- Wiązanie wodorowe
- Własności zależne od typu wiązania: Tm
- Energie wiązania i temperatury topnienia dla niektórych substancji
- Własności zależne od typu wiązania: a
- Podsumowanie
- Podsumowanie: Wiązania pierwotne
- Slide 26
Wyszukiwarka
Podobne podstrony:
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wyklad 1 Wiazania
Wyklad wiazania
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wyklad 8 Wiazania chemiczne
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
notatek pl wiazanie peptydowe i jego cechy wyklad
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
wiązania, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
4.Teoria wiązań, AGH różne, chemia wykłady
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
więcej podobnych podstron