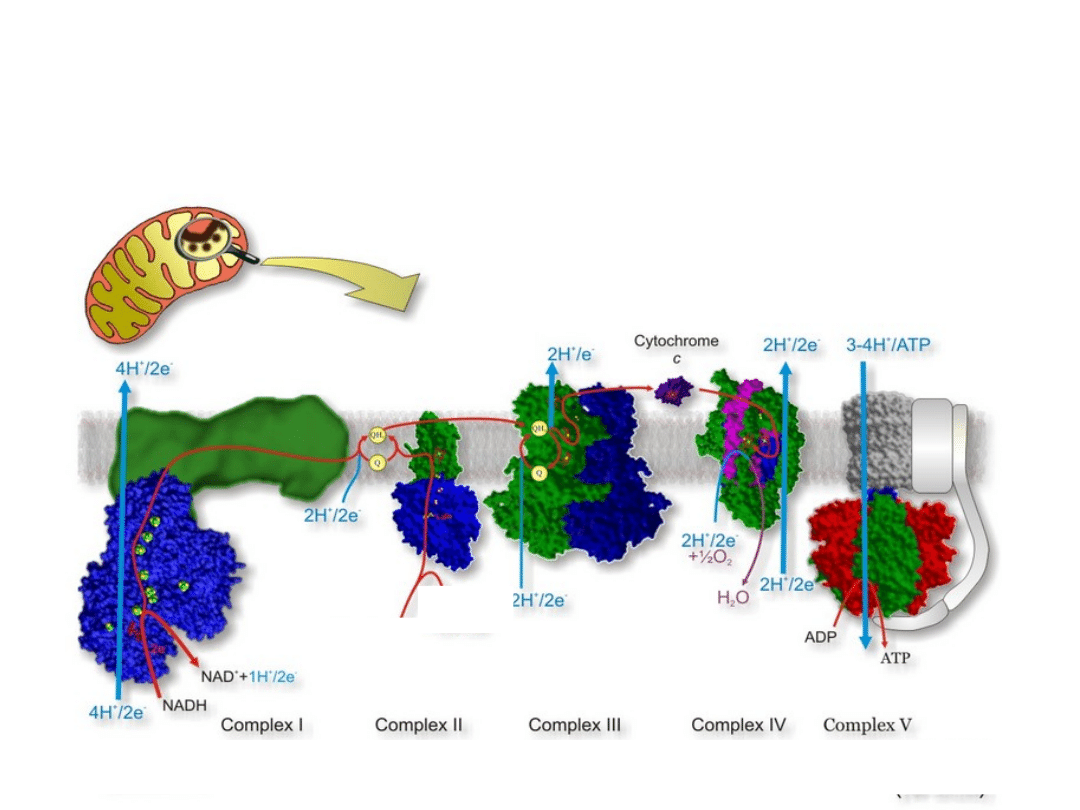
Aktywny transport protonów
napędzany reakcjami redoksowymi
łańcucha oddechowego,
czyli
formowanie gradientu H
+
Bursztyni
an
Fumara
n
Przestrzeń
międzybłonowa
Matriks (wnętrze mitochondrium)

Cztery wielkocząsteczkowe
kompleksy białkowe + koenzym Q
i cytochrom C, są podstawowymi
komponentami Mitochondrialnego
Łańcucha Oddechowego:
Koenzym Q przemieszcza się
swobodnie w hydrofobowej dwuwarstwie
lipidowej wewnętrznej błony
mitochondrialnej, pomiędzy jego miejscami
wiążącymi, w odpowiednich kompleksach
białkowych.
Cytochrome C jest zlokalizowany w
przestrzeni międzybłonowej. Wiąże się z
kompleksem III i IV przenosząc elektrony.
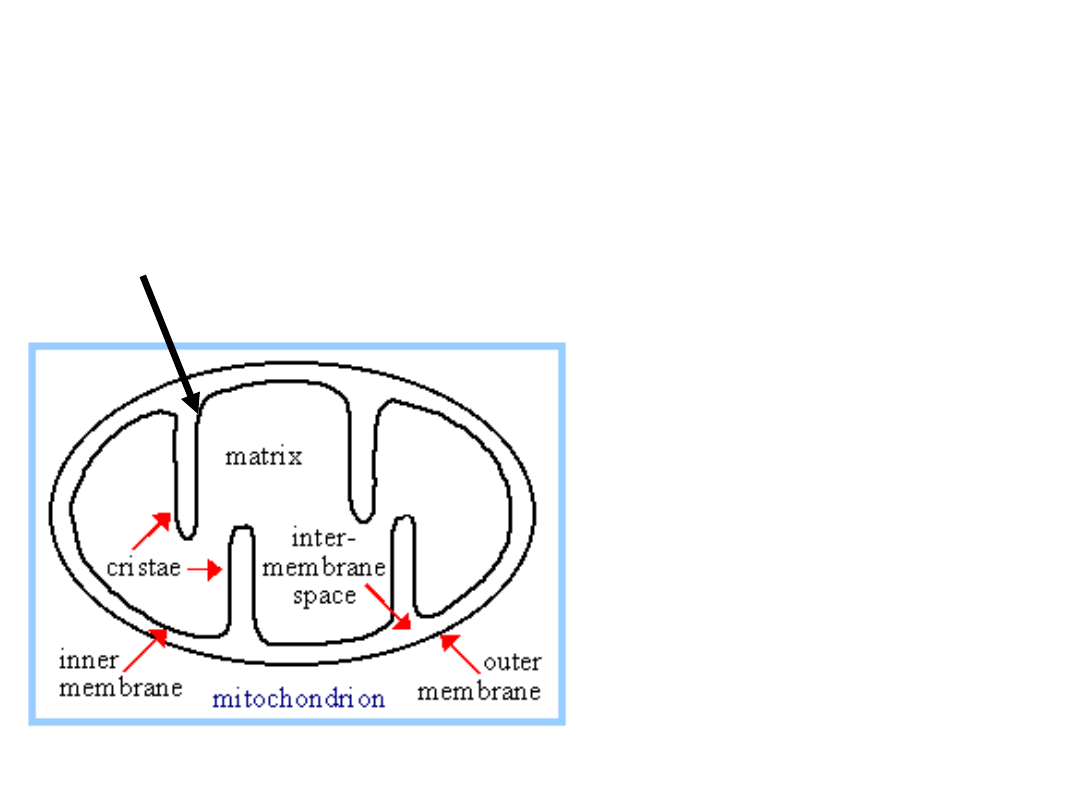
Łańcuch oddechowy
Łańcuch oddechowy
wewnętrznej błony
mitochondrialnej jest
głównym źródłem
energii komórek
eukariotycznych.
Składa się z czterech
białkowych
„generatorów energii”,
które przekształcają
chemiczną energię
reakcji redoksowych w
trans-membranowy
potencjał electro-
chemiczny gradientu
protonowego.
Błona
wewnętrzna
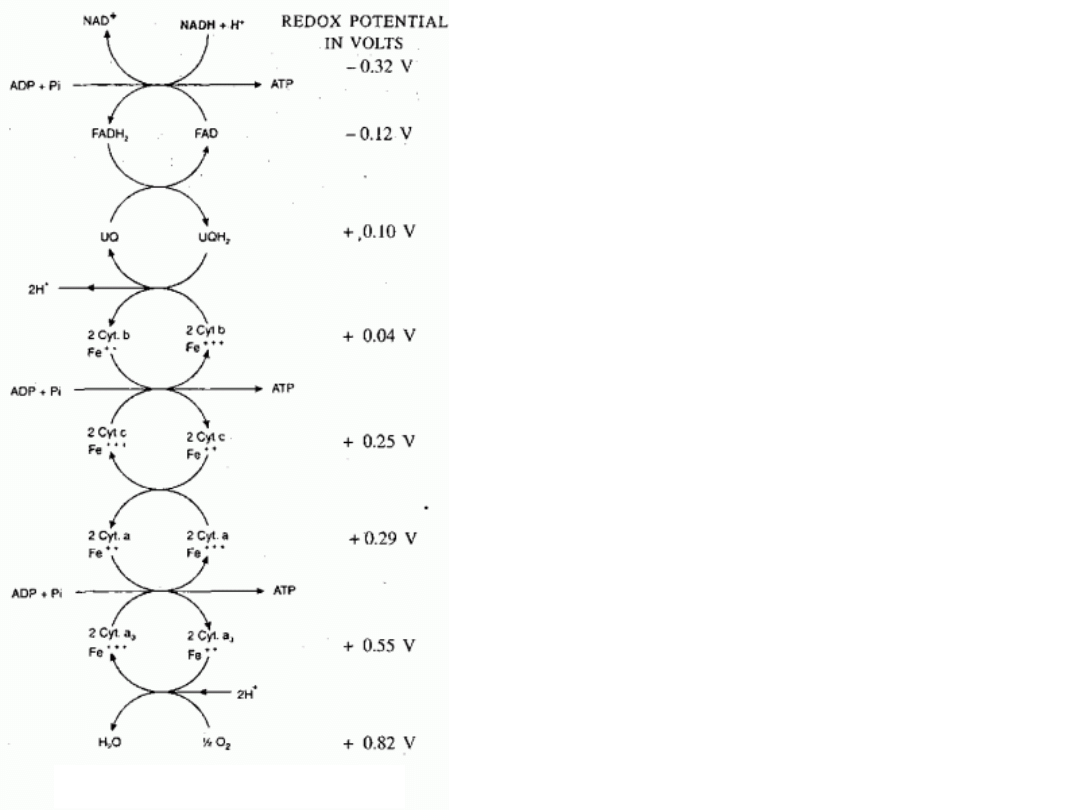
Różnica potencjału
redoksowego pomiędzy
poziomem NADH a
poziomem H
2
O wynosi:
0,82 V-(-0,32V) = 1.14
Volta
Zastosuj powyższą
wielkość (E) do
obliczenia energii Gibbsa
dla całego łańcucha
oddechowego.
(patrz przezrocze nr
6 wykładu z energetyki
Schemat ogólny
reakcji łańcucha
oddechowego
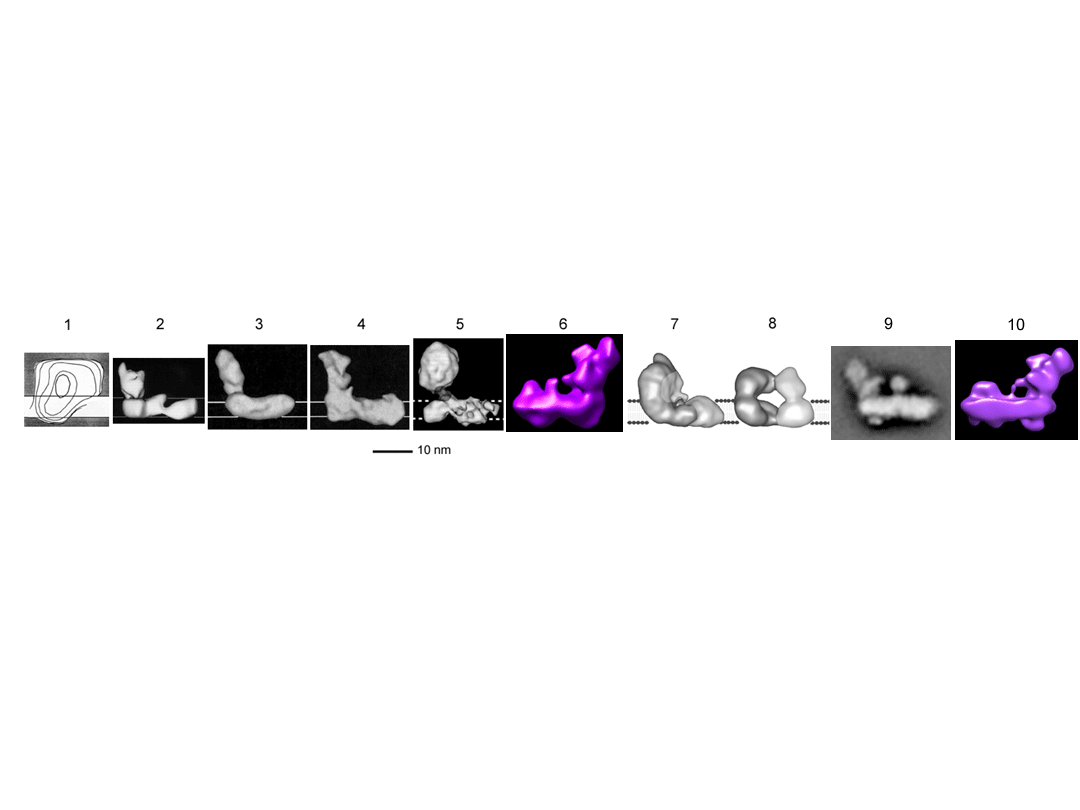
1. N. crassa. (Leonard et al., 1987)
2. N. crassa. (Hofhaus et al., 1991)
3. N. crassa (Guénebaut et al., 1997)
4. E. coli NDH-1 (Guénebaut et al., 1998)
5. Bydlęca – z m. sercowego (Grigorieff, 1998)
6. Y. lipolytica (Radermacher et al., 2006)
7 i 8. E. coli (Böttcher et al., 2002); 7 jest postacią „nieaktywną”, 8
"aktywną".
9. Arabidopsis (Dudkina et al., 2005)
10. Bydlęca (Clason et al., 2010)
Kompleks I , Dehydrogenaza NADH – Koenzym Q.
Patrz 3D modele dla 10 różnych gatunków. Uderzające
podobieństwo kształtu pomiędzy bakteryjnymi a
mitochondrialnymi kompleksami, zarówno zwierzęcymi
jak i roślinnymi.
Skład: 46 podjednostek białkowych (7 z nich to
produkty autonomicznych genów
mitochondrialnych), FMN oraz 9 zespołów Fe-S.

Dehydrogenaza NADH (kont.)
Ogólnie, reakcja katalizowana przez ten kompleks
polega na odebraniu dwóch elektronów z NADH i ich
przeniesieniu na ubichinon (Q). Powstały produkt,
ubiquinol (QH
2
) swobodnie dyfunduje wewnątrz błony a
energia uwolniona w tym procesie redoksowym służy do
translokacji czterech protonów (H
+
) na zewnątrz błony.
Kompleks nr I jest także jednym z miejsc, gdzie może
dojść do przedwczesnego przecieku elektronów na tlen,
co prowadzi do powstania szkodliwych nadtlenków.
Sam przepływ elektronów wewnątrz kompleksu
odbywa się wielostopniowo, przy udziale dodatkowych
przenośników: Flawino-mononukleotydu oraz zespołów
Fe-S. Z nich elektrony pojedynczo przechodzą na
ubichinon (Q), tworząc kolejno semichinol a następnie
ubichinol.
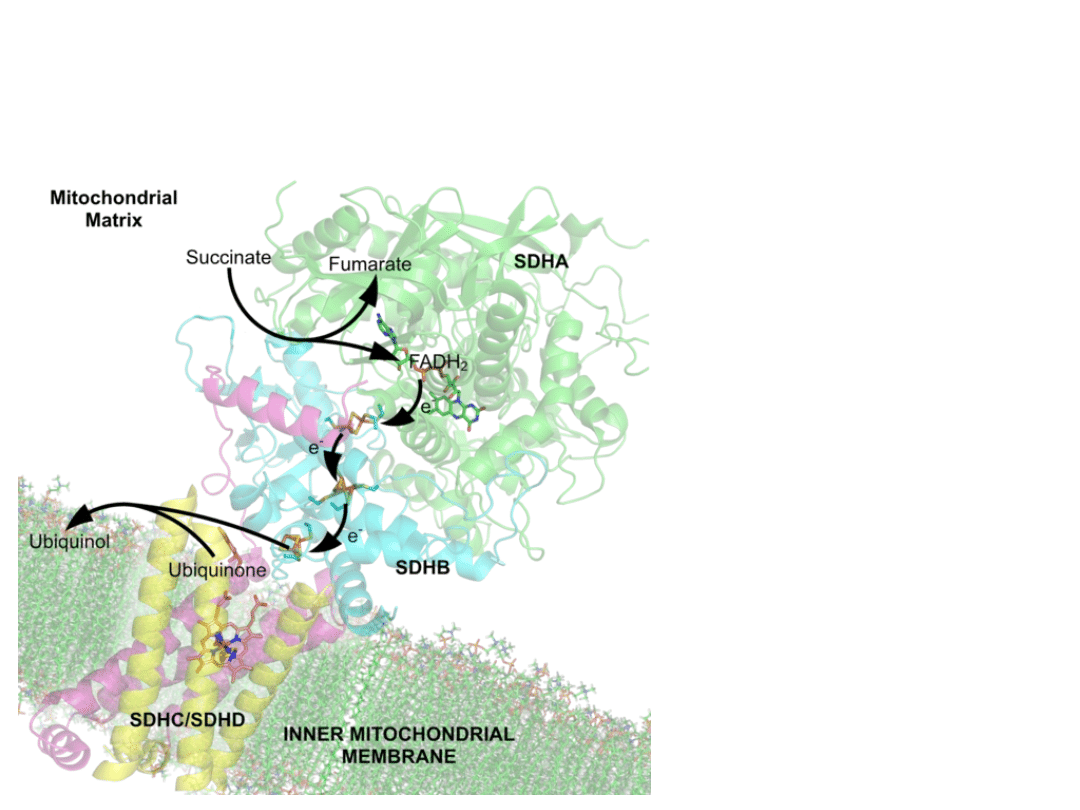
Dehydrogenaza
bursztynianowa
(SDH, Kompleks II)
Skład: Cztery
podjednostki
białkowe (A,B,C,D)
oraz następujące
przenośniki
elektronów:
FADH
2
,
zespoły Fe-S,
hem b
560
,
ubichinon.

Dehydrogenaza
bursztynianowa
lub
Oksydoreduktaza Bursztynian - Koenzym Q
Kompleks II jest enzymem wnętrza mitochondrium,
lecz mocno osadzonym w wewnętrznej błonie
mitochondrialnej eukariontów lub w błonach komórek
bakteryjnych.
Jest jedynym enzymem biorącym bezpośredni udział
zarówno w cyklu Krebsa jak i w łańcuchu transportu
elektronów.
W ósmym etapie cyklu kwasów trikarboksylowych
(Krebsa), SDH katalizuje utlenienie bursztynianu do
fumaranu we wnętrzu mitochondrium, oraz sprzęga tą
reakcję z redukcją ubichinonu do ubichinolu wewnątrz
lipidowej błony mitochondrialnej.
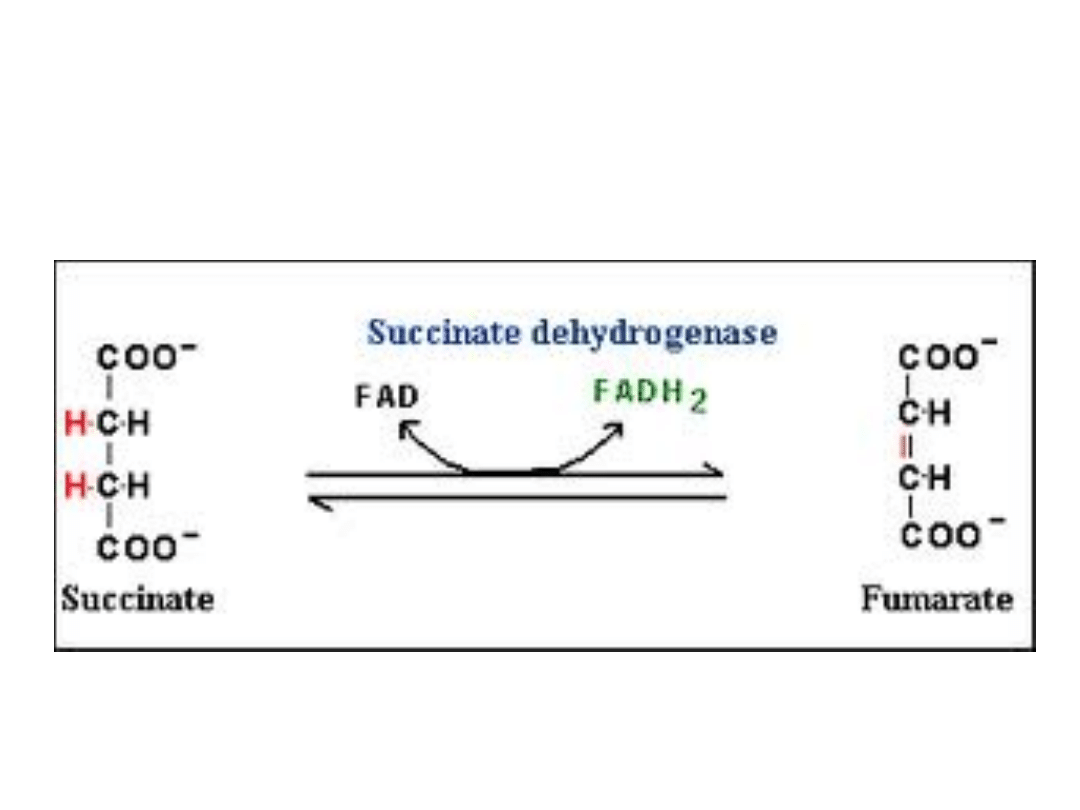
Reakcja mitochondrialnej
matriks katalizowana przez
kompleks SDH
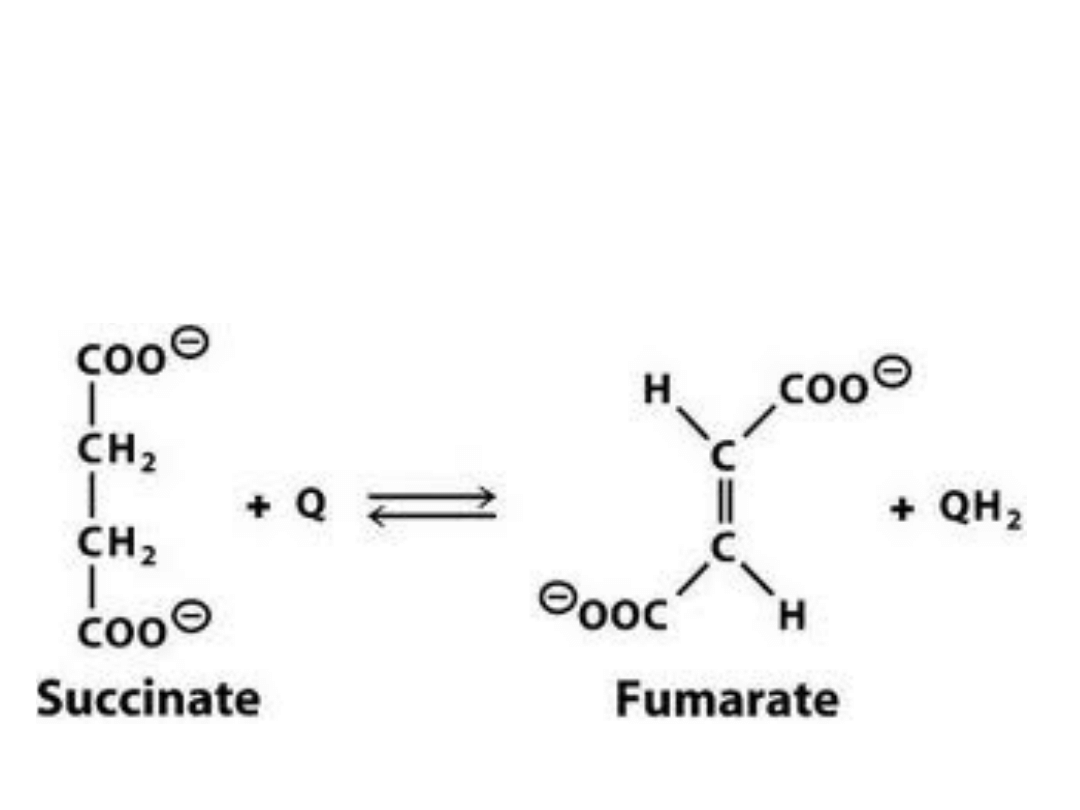
Cała reakcja (netto)
katalizowana przez
kompleks II

Kompleks III.
Oksydoreduktaza Koenzym Q –
Cytochrom C
Skład: 11 podjednostek białkowych (w
tym jedna kodowana przez
mitochondrialne DNA), oraz 3 centra
redoksowe:
Cytochromy bH and bl, Cytochrom c1,
Zespół Fe-S Rieske’go (niezwykły zespół
Fe-S w którym dwie reszty histydynowe
zastępują reszty cysteinowe w
mocowaniu jednego z atomów żelaza).

Reakcje kompleksu III:
Dwa elektrony odebrane od QH
2
(w miejscu jego wiązania Q
o
)
są kolejno przenoszone na dwie cząsteczki cytochromu c,
przenośnika ulokowanego w fałdach przestrzeni międzybłonowej.
Dwa inne elektrony są również kolejno przenoszone do
drugiego miejsca wiązania ubichinonu (Q
i
), gdzie dochodzi do
częściowej redukcji chinonu do chinolu.
Pompowanie protonów odbywa się dzięki utlenieniu dwóch
cząstek chinolu w miejscu Q
o
tak, aby utworzyć jeden chinol w
miejscu Q
i
. W sumie, sześć protonów jest przeniesionych: dwa z
nich redukują chinon do chinolu a cztery zostają uwolnione po
stronie zewntrznej.
Kompleks bc1 pomaga więc w formowaniu gradientu
protonowego dzięki asymetrycznemu wychwytywaniu i
uwalnianiu protonów.
Uszkodzenia funkcji kompleksu III (np. przez aktynomycynę)
mogą również prowadzić do powstawania szkodliwych
nadltenków.

Kompleks IV – oksydaza
cytochromowa
Skład: 13 podjednostek białkowych
(3 kodowane przez mitochondrialny
DNA), 3 atomy miedzi i dwie
cząsteczki hemu A (w cytochromach
a i a
3
), które służą jako grupy
prostetyczne, bezpośrednio
zaangażowane w transport
elektronów.

Reakcje kompleksu IV
Cztery elektrony, usuwane z czterech
cząsteczek cytochromu c i
przenoszone na tlen cząsteczkowy
(O
2
), dają dwie cząsteczki wody.
Równocześnie, cztery protony są
aktywnie transportowane przez błonę,
przyczyniając się do formowania
gradientu protonowego. Aktywność
tego kompleksu jest nieodwracalnie
hamowana przez cyjanki.

Efektywność łańcucha
oddechowego
Energia uwolniona przez parę elektronów
wędrujących przez cały łańcuch oddechowy, może
być wyliczona z wielkości potencjału
redoksowego (1,14 Voltów), i wynosi w
przybliżeniu 220 kJ/mol. Natomiast liczba
cząsteczek ATP syntetyzowana i zmagazynowana
po użyciu tej energii wynosi 2.5. Taka ilość ATP
jest równoważna ok. 75 kJ. Zatem maksymalna
wydajność syntezy ATP w mitochondiach wynosi
około 35% .
Jeśli jednak para elektronów odbywa krótszą
drogę (z poziomu FAD) ilość zmagazynowanej
energii jest mniejsza (tylko 1,5 cząsteczek ATP).

Przerzut elektronów z
cytozolowych układów
redoksowych to mitochondrium
NADH nie jest w stanie penetrować błony
mitochondrialnej, ale istnieją dwa specjalne mechanizmy
(czółenka), przeznaczone do przerzucania elektronów z
cytozolu do mitochondrium:
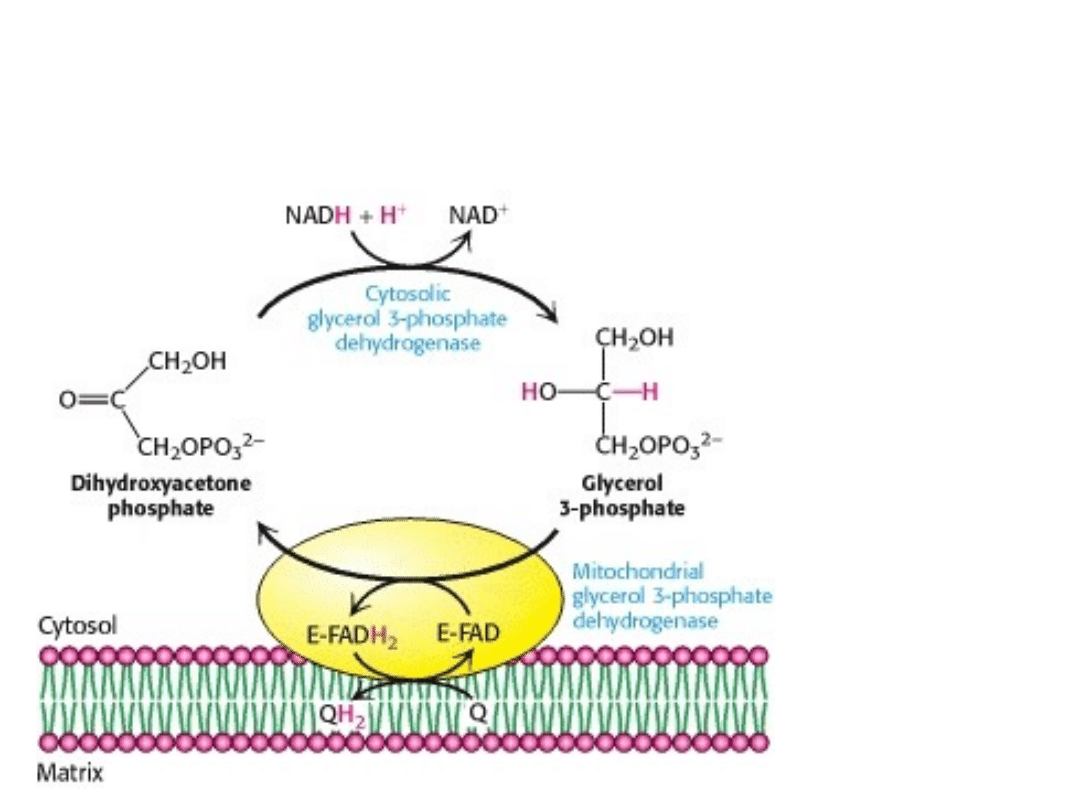
1. Czółenko glicerofosforanowe (mózg, mięśnie
szkieletowe i inne tkanki) jest w stanie przenieść dwa
elektrony z cytozolu do dwuwarstwy lipidowej
wewnętrznej błony mitochondrialnej, gdzie ich
akceptorem jest cząsteczka FAD.
oraz
2. Czółenko jabłczanowo - asparaginianowe
(mięsień sercowy i wątroba) które jest w stanie przenieść
parę electronów na akceptorową cząsteczkę NAD,
zlokalizowaną w mitochondrialnej matriks
Czółenko
glicerofosforanowe
Ponieważ FAD
jest tu
akceptorem, para
elektronów
przerzucana przez
ten układ, może
przejść przez tylko
dwa kompleksy
pompujące
protony (III i IV) w
łańcuchu
oddechowym.
Zatem tylko 1,5
cząsteczki ATP
może powstać
dzięki uwolnionej
energii.
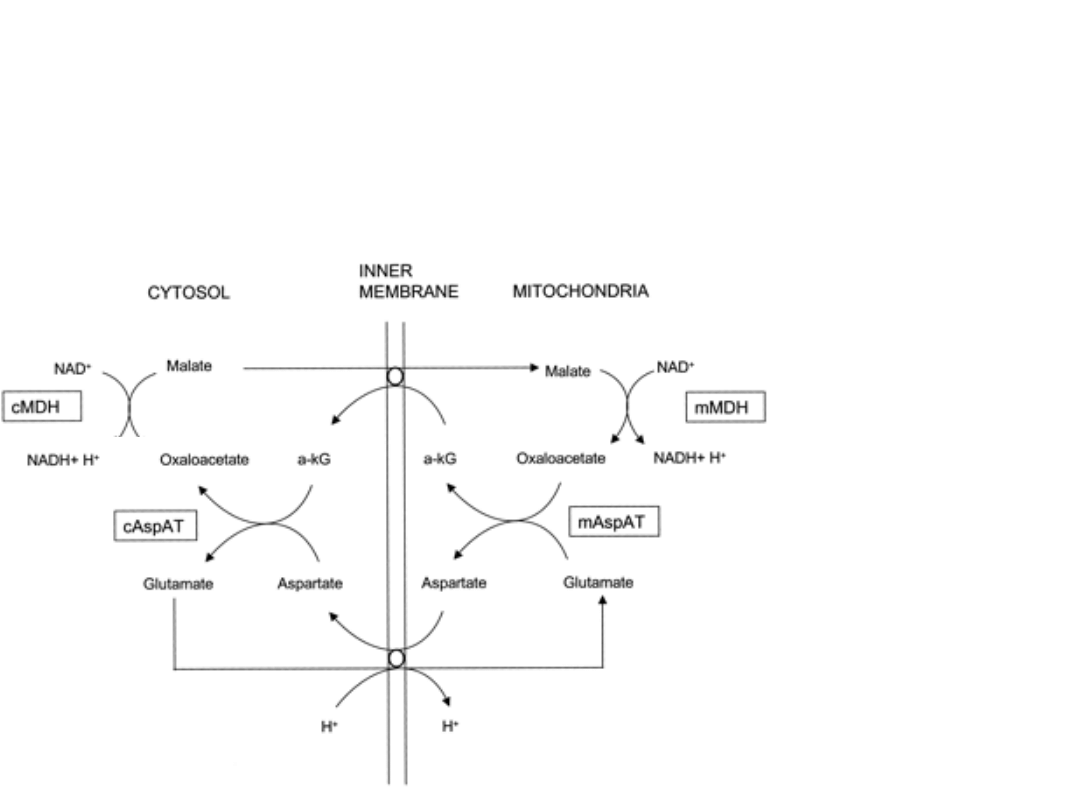
Czółenko jabłczanowo
-asparaginianowe
W tym czółenku,
wewnątrz
-mitochondrialna
cząsteczka NAD
jest użyta jako
akceptor pary
elektronowej.
Wtedy wszystkie
trzy pompy H
+
(I,
III i IV) są
sprzęgane z
procesem
tworzenia
gradientu
protonowego.
Zatem para
elektronów daje
tutaj 2,5
cząsteczki ATP

Podsumowanie
M
itochondrialny łańcuch oddechowy polega
na serii egzoergicznych reakcji redoksowych, w
wyniku których dochodzi do przemieszczenia
elektronów od pierwszego donora (NADH lub
QH
2
) na tlen jako końcowy acceptor. Niektóre z
tych reakcji są sprzężone z procesem formowania
gradientu protonowego w poprzek wewnętrznej
błony mitochondrialnej.
Trzy spośród czterech kompleksów
katalizujących te procesy (I, III i IV) są pompami
protonowymi. Gradient protonowy jest następnie
użyty do produkcji ATP i do innych celów
omawianych na wykładzie z energetyki.
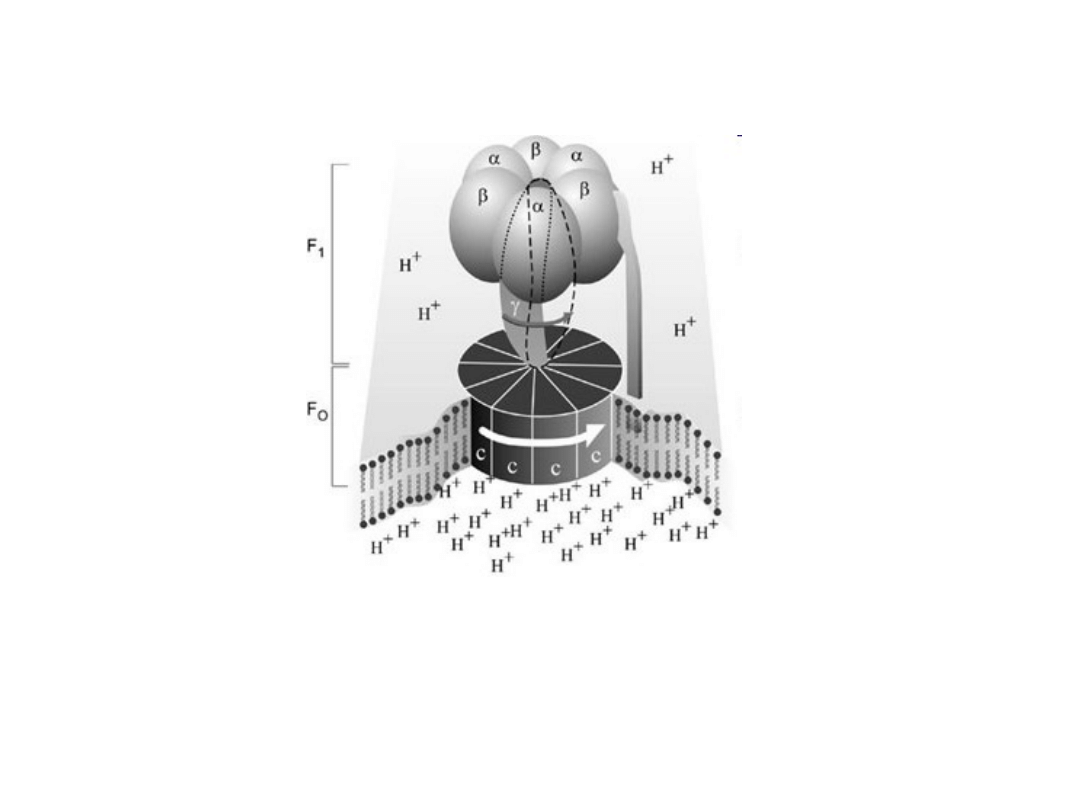
Ogólny schemat struktury mitochondrialnej syntazy
ATP
Jest ona jednym z dwóch poznanych dotąd
biologicznych mechanizmów wykorzystujących
ruch obrotowy.
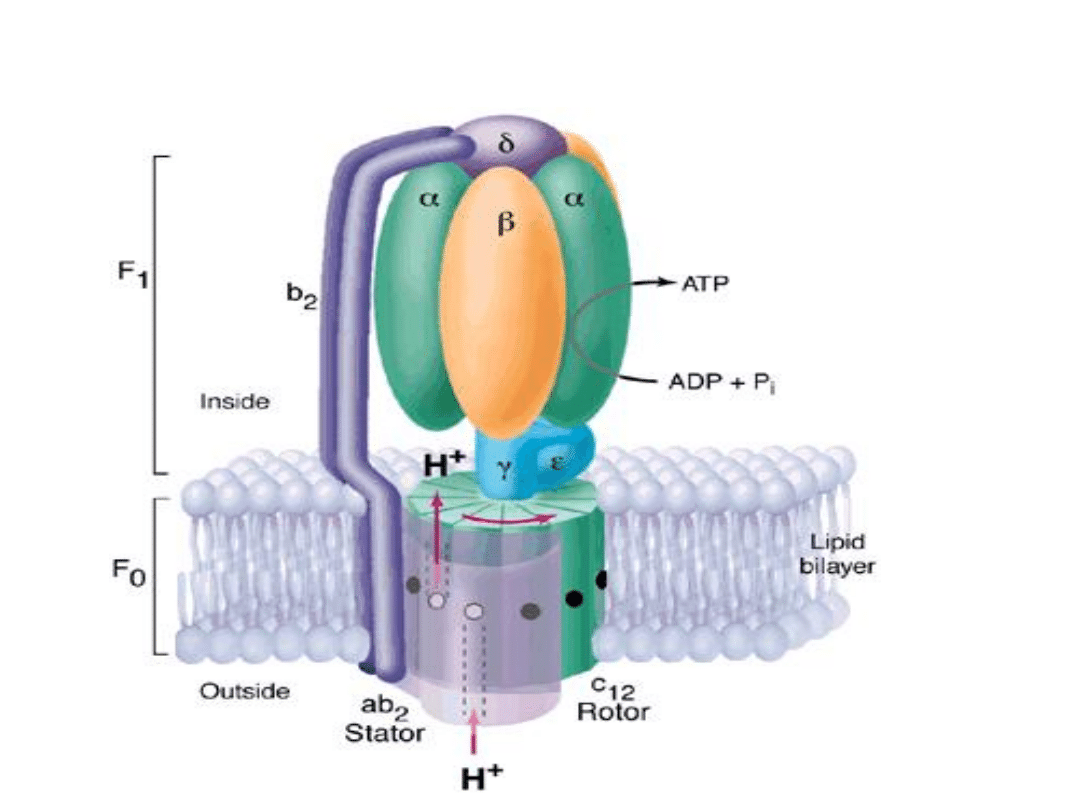
Kompleks syntazy ATP jest silnikiem obrotowym na poziomie
molekularnym, napędzanym przepływem protonów
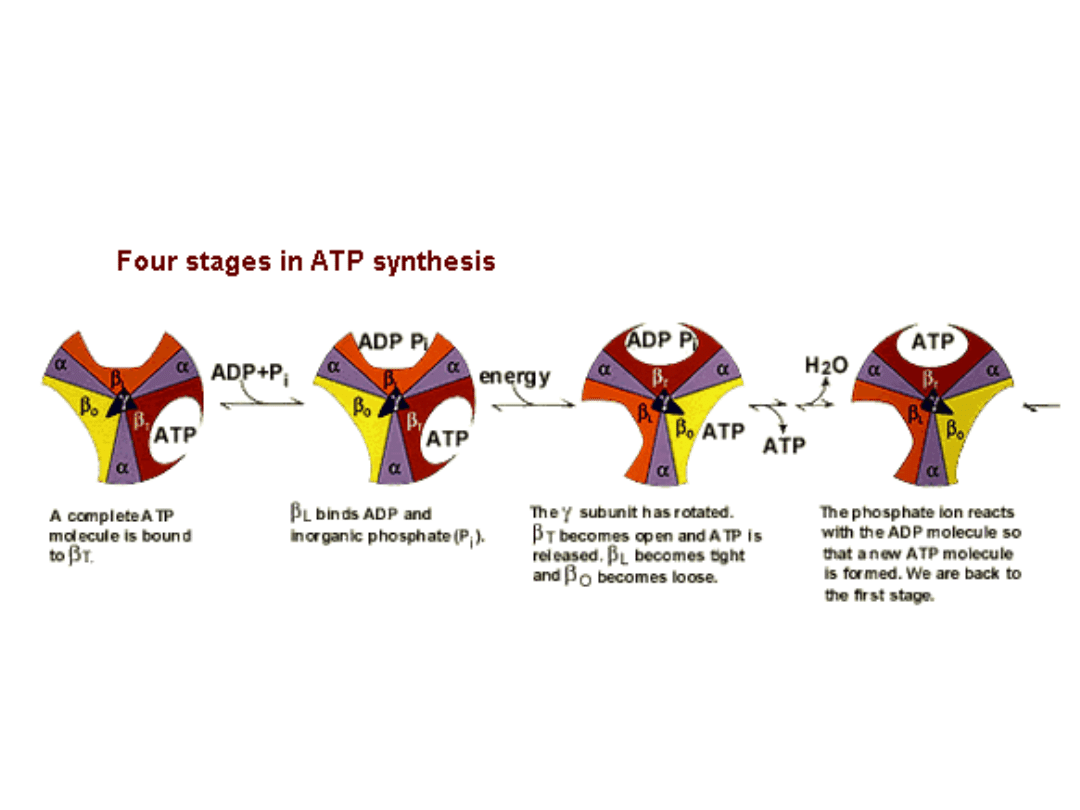
Cztery etapy syntezy ATP
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
lancuch oddechowy, Biomechanika kliniczna
CKT, łańcuch oddechowy(1)
łańcuch oddechowy
Łańcuch oddechowy
Łańcuch oddechowy, fosforylacja oksydacyjna
lancuch oddechowy
Biochemia wykład 6 Łańcuch oddechowy
5 Wstep do metabolizmu; cykl Krebsa i lancuch oddechowy
inhibitory łańcucha oddechowego
Lancuch oddechowy, Weterynaria Lublin, Weterynaria 1, Biochemia, Biochemia
Materiały, 7 2 ŁAŃCUCH ODDECHOWY
łańcuch oddechowy
06 BIOCHEMIA lancuch oddechowyid 6261 ppt
Łańcuch oddechowy, biochemia
Wykład łańcuch oddechowy
Łańcuch oddechowy i fosforylacja oksydacyjna
Łańcuch oddechowy, ✔ ★Weterynaria, weta, dump
łańcuch oddechowy, SGGW, biochemia
więcej podobnych podstron