

Nieustannie szerokie zainteresowanie
wśród biotechnologów budzą enzymy
wyizolowane z termo- i hipertermofili m.in.
Ze względu na ich termostabilność i
aktywność w wysokich temperaturach.
W niektórych syntezach ważna jest podwyższona
temperatura. Rośnie w niej rozpuszczalność wielu reagentów,
szczególnie polimerów. Zwiększa to dostępność substratu, co
skutkuje szybszym tempem reakcji.
W wysokich temperaturach spada też ryzyko zakażenia
mikroorganizmami w czasie procesów produkcyjnych.
W szczególności poszukiwane są: polimerazy, proteazy,
lipazy
oraz enzymy degradujące polimery – celulazy, chitynazy i
amylazy.
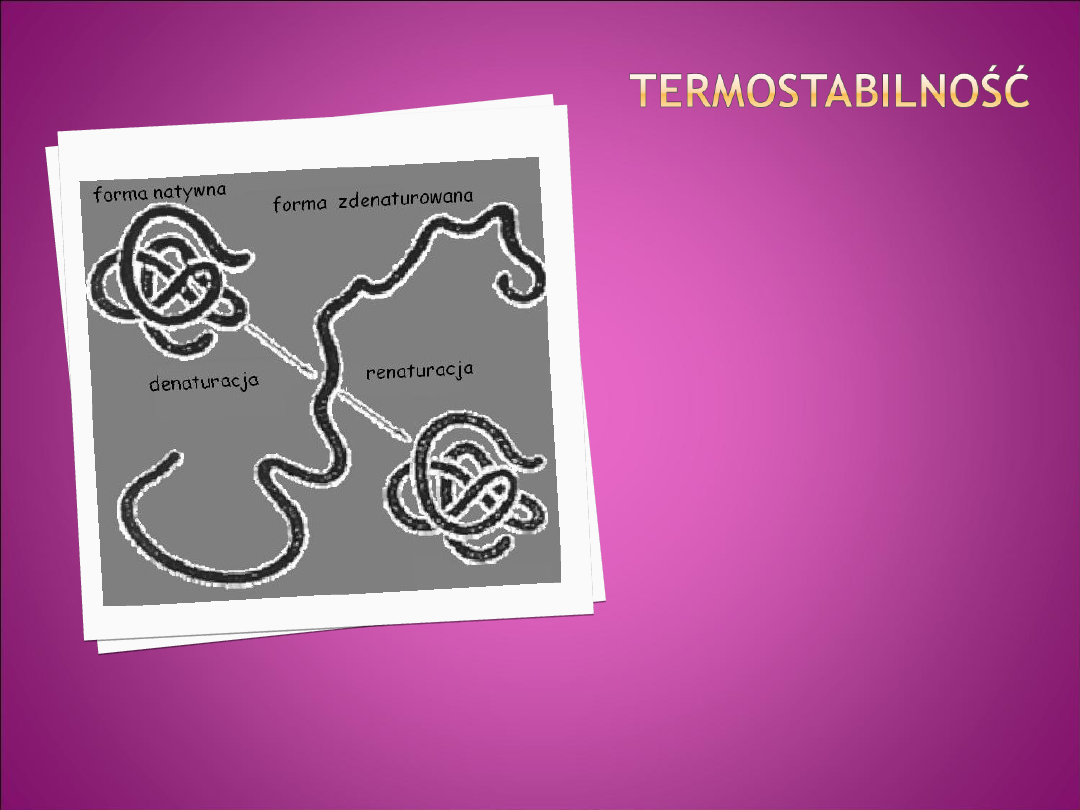
Termostabilność białek jest
cechą fizyczną, która nadaje im
oporność na wysoką
temperaturę.
Większość enzymów
mikroorganizmów mezofilnych
pełni swoje funkcje w zakresie
temperatur 30-40 °C.
Powyżej temperatury
maksymalnej ulegają one
denaturacji – zostają zerwane
wiązania wodorowe, wskutek
czego ich budowa przestrzenna
ulega zmianie i zanika
aktywność biologiczna.
W większości przypadków
denaturacja białek jest
procesem nieodwracalnym.
Zwiększona termostabilność
enzymów wynika z:
* zastąpienia w rdzeniu
hydrofobowym dużych,
niepolarnych reszt
aminokwasowych, małymi
niepolarnymi aminokwasami
(np. Leu Val)
* posiadanie zwiększonej ilości
mostków dwusiarczkowych,
* duża ilość polarnych reszt
aminokwasowych tworzących
korzystne dla stabilności
wiązania wodorowe lub mostki
solne
* zwiększona ilość oddziaływań
jonowych

Enzymy termostabilne charakteryzują się
zwiększoną sztywnością strukturalną, wynikającą
z większej liczby oddziaływań
wewnątrzcząsteczkowych.
Prowadzi to do zmniejszenia rozmiarów i
ograniczenia jamistości w cząsteczce oraz
ściślejszego przestrzennego upakowania
łańcucha polipeptydowego, czego efektem jest
wzrost termostabilności białka.
Wzrost sztywności jest niezbędny dla zachowania
ich katalitycznie aktywnej struktury w podwyższonych
temperaturach. Zwiększona sztywność chroni białko
przed rozfałdowaniem. Poprawa sztywności przejawia
się:
- zmniejszoną podatnością na degradację
proteolityczną i na chemiczne denaturanty
- zmniejszoną podatnością na termiczne
rozfałdowanie
- zredukowanym tempem deuterowania białka
(wymiana izotopowa wodoru na deuter powoduje
nieznaczny spadek energii wiązań wodorowych,
wiązania typu D mają mniejszą siłę niż H, stąd
dochodzi do rozrywania wiązań, w ciężkiej wodzie
zamiera wszelkie życie),

Przeprowadzono eksperyment dotyczący tempa wymiany wodór-
deuter we względnie stabilnej kinazie adenylowej z Sulfolobus
acidocaldarius oraz mniej stabilnym enzymie cytozolowym
pochodzącym od świni.
W 20°C została wymieniona znacznie mniejsza frakcja
protonów amidowych (53%) w kinazie adenylowej, niż w przypadku
enzymu cytozolowego (83%). Wymiana została zakończona w
temperaturze 97°C w przypadku kinazy, co ukazuje znacznie
wolniejsze tempo wymiany, gdyż w enzymie cytozolowym wymiana
ta została zakończona w temperaturze 56°C.
Ściślejsze przestrzenne upakowanie łańcucha polipeptydowego
może podwyższyć poziom termostabilności białka.
Może być osiągnięte poprzez skrócenie jednej lub większej
ilości pętli, zwiększenie ilości atomów schowanych w
cząsteczce, a tym samym ukrycie ich przed rozpuszczalnikiem,
optymalne upakowanie łańcuchów bocznych wewnątrz
cząsteczki oraz ograniczenie jamistości poprzez eliminację
nieprzydatnych szczelin.

Przeprowadzono dwa eksperymenty udowadniające stwierdzenie iż wyższy
poziom upakowania białka zwiększa jego termostabilność.
Mutacje Ala31Ile i Lys35Met u Methanobacterium formicicum zwiększyły
Tm (ang. melting temperature- temperatura denaturacji) o 11 i 14 °C, podczas
gdy mutacje Ile31Ala i Met35Lys zmniejszyły Tm o 4 i 17 °C u Methanotermus
fervidus.
Oddziaływania hydrofobowe są głównymi czynnikami zwijania (fałdowania) i
termostabilności białek, a zastąpienie alaniny bardziej hydrofobową izoleucyną
oraz zamiana hydrofilowej metioniny na hydrofobową lizynę zwiększyły ilość
oddziaływań hydrofobowych.
Trzy syntazy cytrynianowe z: Pyrococcus furiosus (optimum wzrostu 100°C),
Thermoplasma acidophilum (50°C) oraz świńska (37°C) miały podobną strukturę,
ale różną termostabilność. Enzymy te różniły się głównie stopniem
upakowania,zwięzłością podjednostek oraz obecnością par jonowych
między podjednostkami .
Porównanie sekwencji aminokwasowych enzymów pochodzących z
mikroorganizmów termofilnych i mezofilnych wykazało wiele różnic w składzie
aminokwasowym enzymów.
Najczęstszymi zamianami aminokwasów w termofilnych enzymach były:
Lys→Arg (dwa aminokwasy o najdłuższych łańcuchach bocznych, hydrofilowe,
jednak Arg ma większą zdolność do tworzenia wiązań wodorowych), Ser→Ala
(Alanina hydrofobowa, grupa metylowa łańcucha bocznego alaniny wykazuje
skłonność do tworzenia α-helis), Gly→Ala (glicyna występuje częściej w β-
zwrotach, destabilizuje α-helisę), Ser→Thr (treonina posiada większą zdolność
tworzenia wiązań wodorowych) i Val→Ile (bardziej hydrofobowa).
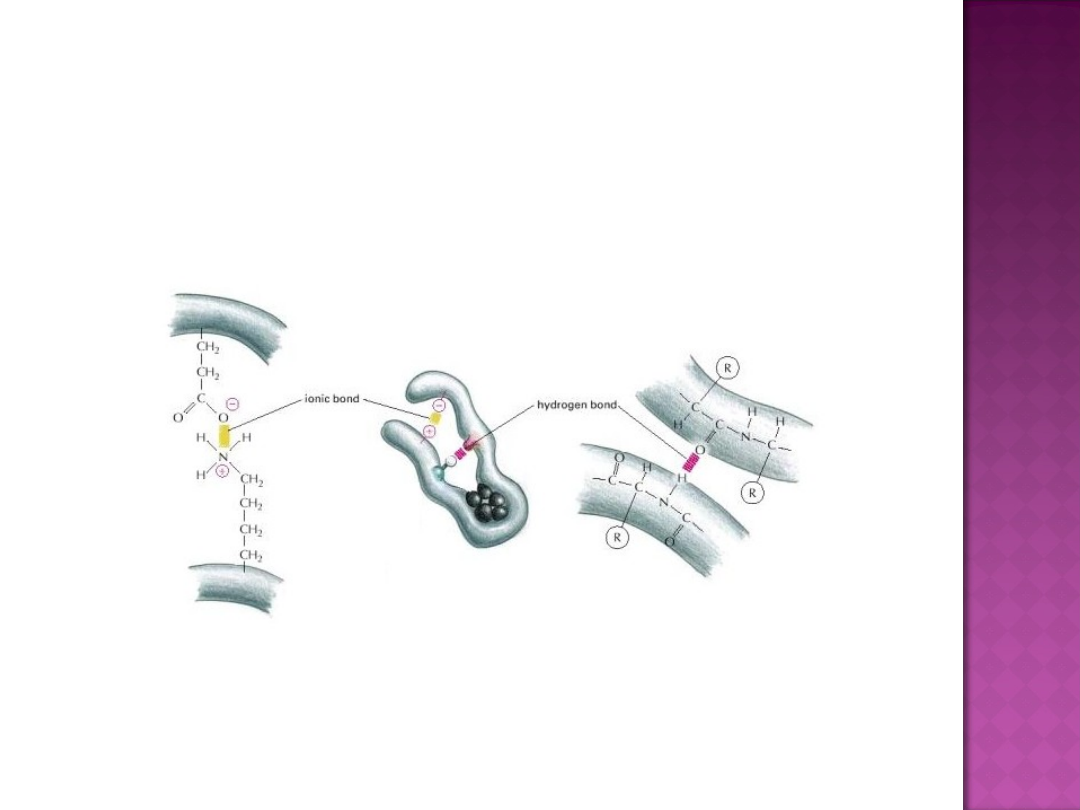
Korzyścią płynącą z zamiany aminokwasów w termofilnych
białkach jest możliwość utworzenia większej ilości wiązań
wodorowych i mostków solnych (wiązanie tworzące się dzięki
przyciąganiu elektrostatycznemu między grupami kationowymi i
anionowymy - kwasowymi i zasadowymi).

Stabilizacja α-helisy może być osiągnięta poprzez zastąpienie
aminokwasowych łańcuchów bocznych z niską skłonnością do
tworzenia α-helisy aminokwasowymi resztami bocznymi z dużą
tendencją do tworzenia tej struktury.
Łańcuchy boczne Val, Ile i Thr, mające tendencję do
uczestniczenia w niciach β, powodują destabilizację α-helisy.
Porównano rentgenogramy trzynastu termofilnych białek z
ich mezofilnymi homologami.
Ukazano iż w termostabilnych białkach o helisach α nie
występowały aminokwasy z łańcuchami bocznymi
mającymi tendencję do tworzenia nici β (Val, Ile, Thr).
α-helisa posiada duży moment dipolowy (3.5D), N-koniec
dodatni, C-koniec ujemny. Może być ona stabilizowana poprzez
negatywnie naładowane aminokwasowe łańcuchy boczne (np.
Glu) na N-końcu, jak również pozytywnie naładowanymi
łańcuchami bocznymi (np. Lys) na końcu C.
Wprowadzenie pożądanych łańcuchów bocznych na końcach
α-helisy może zwiększyć stabilność enzymów.

Oddziaływania między α-helisami (dipolami) są bardzo ważne w
stabilizacji heliakalnych motywów. W niektórych białkach,
antyrównoległe ułożenie sąsiadujących helis nadaje im wyższą
stabilizację.
Dowiedziono również iż strategiczne ulokowanie proliny
zwiększa stabilizację enzymu. Porównano N-końcową domenę
polimerazy DNA z hipertermofilnej bakterii Thermus aquaticus z
polimerazą E.coli. Pierwsza polimeraza posiadała 13 prolin,
stanowiących 10% wszystkich aminokwasów tej domeny, podczas gdy
mezofilna polimeraza posiadała jedynie 6 prolin (3%). Cykliczna
struktura łańcucha bocznego proliny w znacznym stopniu wpływa na
architekturę białka, prolina jest znajdowana często w zagięciach
pofałdowanego białka, powodując przestrzenne zamknięcie białka.
Wartość Tm rośnie wraz ze zwiększeniem zawartości proliny.
Również białka histonopodobne oraz enzymy odwrotna gyraza i
topoizomeraza, zwiększając stopień upakowania cząsteczki enzymu
przyczyniają się do stabilizacji kwasów nukleinowych.
Gyraza wprowadza dodatnie superskręty, które stabilizują helisę.

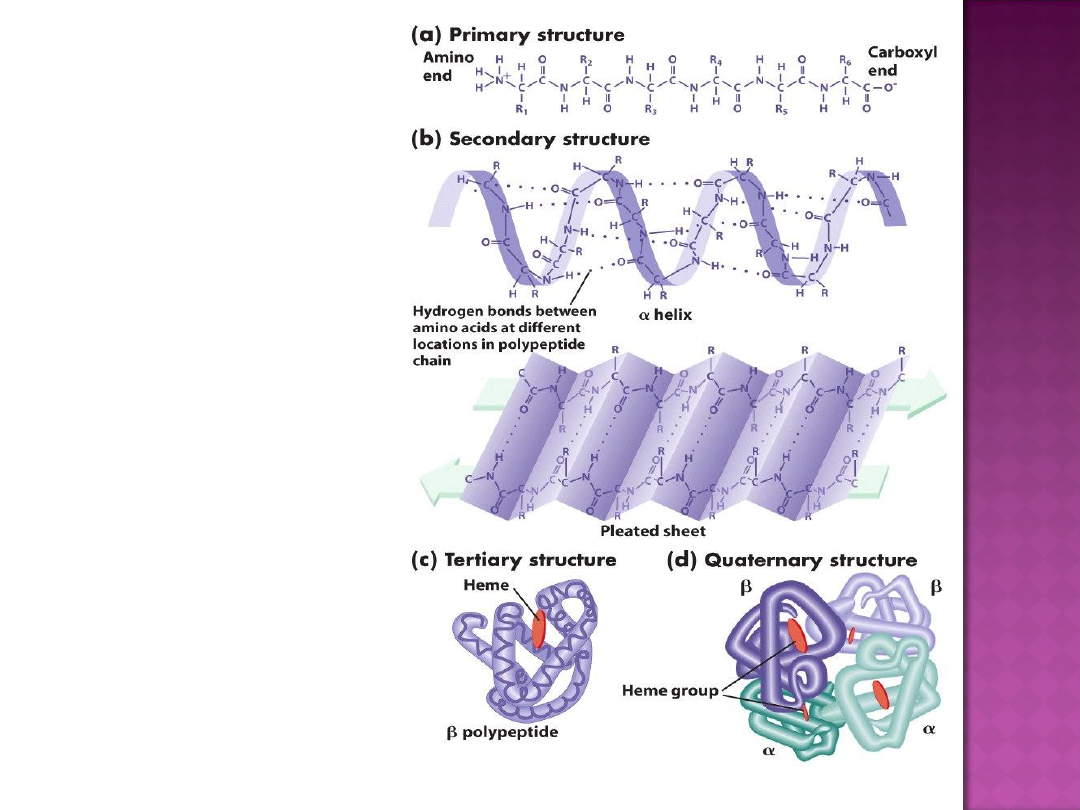
Wiązania wodorowe występują nie tylko w łańcuchach
polipeptydowych i między nimi. W pierwszym przypadku grupa CO
każdego aminokwasu wiąże się wiązaniem wodorowym z grupą NH
aminokwasu, zajmującego w sekwencji liniowej pozycję wysuniętą do
przodu o 4 reszty aminokwasowe, w rezultacie wszystkie grupy NH i
CO łańcucha głównego łączą się wiązaniami wodorowymi - α-helisa, w
drugim przypadku wiązania wodorowe występują między wiązaniami
peptydowymi różnych łańcuchów polipeptydowych- β-kartka.
Wiązania wodorowe dotyczą także środowiska wodnego w
którym enzym się znajduje.
Termostabilność białek jest skorelowana z liczbą wiązań
wodorowych wewnątrz cząsteczki oraz dostępnością polarnej
powierzchni, co zwiększa ilość wiązań wodorowych z otaczającym
środowiskiem wodnym.
Analiza porównawcza struktury BLA (amylaza Bacillus
licheniformis) oraz BSTA (amylaza Bacillus stearothermophilus), przy
czym BLA jest bardziej stabilna, wykazała iż BSTA posiada o 9 mniej
wiązań wodorowych niż BLA, jest to jednym z głównych czynników
względnie mniejszej stabilności BSTA.

Stabilność neutralnej proteinazy z Bacillus stearothermophilus
wzrosła o 0.7°C po zastąpieniu Ala170 seryną (grupa hydroksylowa
seryny sprawia, że aminokwas ten jest bardziej hydrofilowy i
reaktywny niż alanina, jest on donorem i akceptorem w wiązaniach
wodorowych, Stryer 2005). Wskutek zastąpienia Ala170 przez
Ser170 dochodzi do utworzenia dodatkowego wiązania
wodorowego. (Eijsink i in. 1992)
Typowe oddziaływanie między resztami aminokwasowymi
naładowanymi dodatnio (np. Lys) a resztami aminokwasowymi
naładowanymi ujemnie (np. Asn) nazywamy mostkiem solnym
(Stryer 2005). Termiczna stabilizacja enzymów zależy również od
oddziaływań między jonami.
Porównano sekwencje homologiczne białek 127
mikroorganizmów mezofilnych oraz termofilnych. Badanie
wykazało, że istnieje wyraźna preferencja stabilizacji poprzez
oddziaływania jonowe.(Alsop i in. 2003) Sekwencja aminokwasowa
mezofilnej i termofilnej alkalicznej endo-1,4-β-glukanazy
alkalofilnego Bacillus sp. (KSM-64 i KSM-S237) jest bardzo podobna
i wykazano, iż obecność łańcuchów bocznych lizyny (zasadowy R) w
pozycjach 137, 179 oraz 194 w termozymie była odpowiedzialna za
jego termiczną stabilność. Zastąpienie Glu137 (kwasowy R, w pH
fizjologicznym jest niemal zawsze ujemnie naładowany) Asn179 (R
nie posiada ładunku) i/lub Asp194 (kwasowy R, w pH fizjologicznym
jest niemal zawsze ujemnie naładowany) lizyną poprzez
ukierunkowaną mutagenezę sprawiło, iż mezofilny enzym stał się
bardziej termostabilny. (Hakamada i in. 2001)

Zwiększenie ilości mostków solnych prowadzi do wzrostu
termotolerancji białek u organizmów hipertermofilnych.
Ilość Glu, Lys i Arg jest większa w białkach mikroorganizmów
termofilnych. Wzrost ilości naładowanych łańcuchów bocznych
skutkuje wytworzeniem większej ilości mostków solnych u
mikroorganizmów termofilnych niż w ich odpowiednikach
mezofilnych.
Hydrofobowość białka jest wyrażona jako stosunek schowanej
hydrofobowej przestrzeni do całkowitej niepolarnej przestrzeni
cząsteczki. Oddziaływania hydrofobowe są głównymi czynnikami
zwijania (fałdowania) i termostabilności białek.
Istnieje bezpośredni związek między całkowitą hydrofobowością
białka a jego termostabilnością. Szacuje się, że średni wzrost
stabilności osiąga się poprzez każdą dodatkową grupę metylową
wewnątrz cząsteczki, powstałą podczas fałdowania białka. (Pace,
1992)
Rybonukleaza HI z E.coli posiada zagłębienie blisko Val74
występującej w rdzeniu enzymu. Temperatura topnienia dwóch
mutantów enzymu (V74L i V74I) wzrosła o 2.1-3.7°C .
Wprowadzenie dodatkowych grup metylowych do zagłębienia
powoduje wzrost oddziaływań hydrofobowych wewnątrz rdzenia
białka i tym samym zwiększa termostabilność. (Ishikawa i in., 1993)
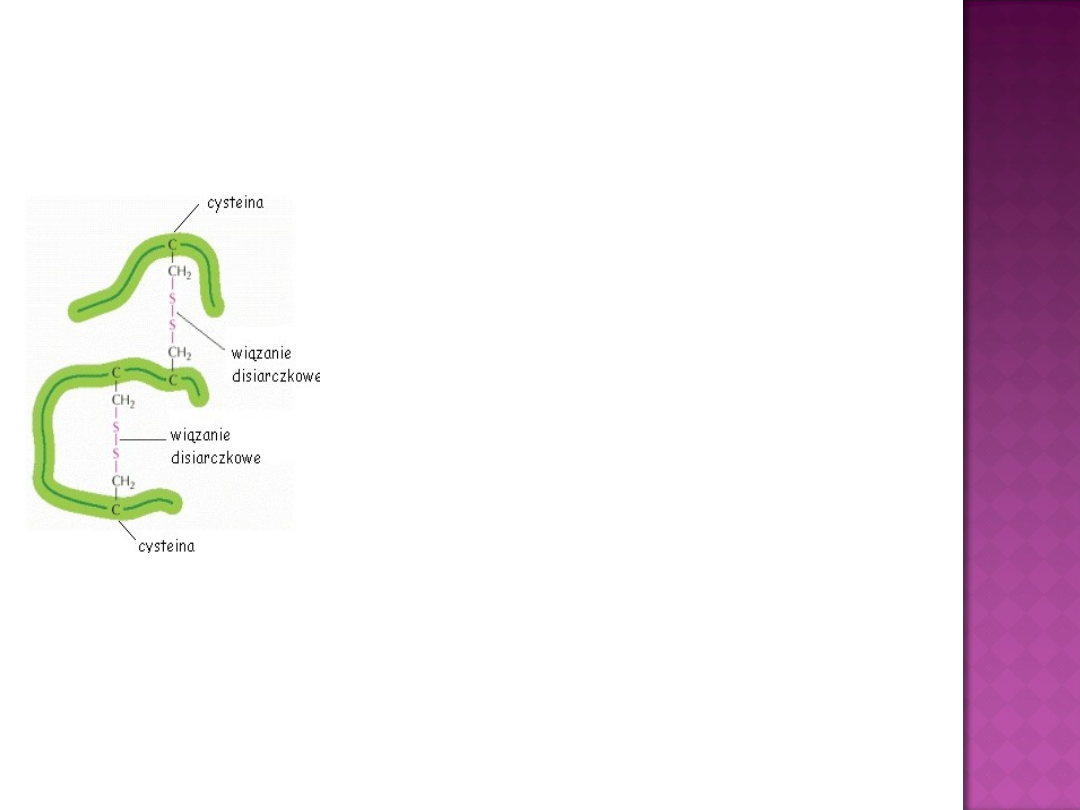
Uważa się, iż mostki dwusiarczkowe
stabilizują białka poprzez efekt entropowy, czyli
zmniejszenie entropii białka.
Efekt stabilizacji dzięki mostkom
dwusiarczkowym został potwierdzony wieloma
badaniami nad mutagenezą, zawierającymi
wprowadzanie disiarczkowych wiązań w enzymie.
Na przykład łańcuchy boczne Cys zostały
wprowadzone na pozycję 61 (Gly) i 98 (Ser) w
subtylizynie E przez ukierunkowaną mutagenezę.
Okres półtrwania zmutowanego enzymu był 2-
3 razy dłuższy oraz jego temperatura topnienia
wzrosła o 4.5°C. (Takagi i in., 1990)
Mutacja N20C/A27C w glukoamylazie
Aspergillus awamori zwiększyła termostabilność
poprzez wzrost energii aktywacji o 1.5kJ/mol w
65°C. Pojedyncza mutacja A27C nieznacznie
zwiększyła termostabilność, natomiast mutacja
N20C zmniejszyła ją. Wiązanie dwusiarczkowe
między pozycją 20 a 27 połączyło C-końce helisy 1 i
następującego β-zwrotu, co sugeruje iż region ten
jest ważny dla termostabilnośi glukoamylazy.

Zaobserwowano, iż w obecności Ca
2+
wszystkie konstrukty
celobiohydrolazy CbhA z Clostridium thermocellum wykazały
wysoką odporność na termiczne rozfałdowanie oraz wysoką
wewnętrzną stabilność w Tm równej około 80°C, co zwiększyło
optymalną temperaturę wzrostu bakterii o 20°C.
Usunięcie Ca
2+
destabilizowało polipeptydy. (Kataeva i in., 2003)
Świadczy to o istnieniu zależności termostabilności również od
czynników zewnętrznych.
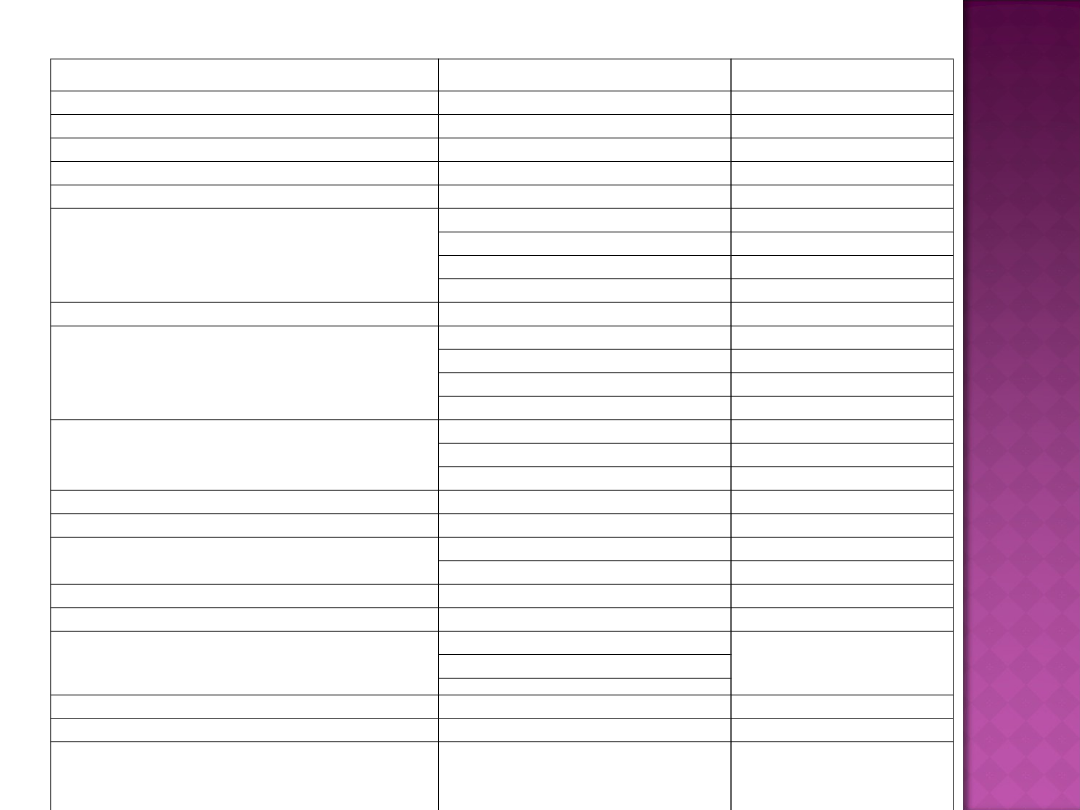
Enzym
Mikroorganizm
Temp.optymalna (°C)
Aldolaza 2-keto-3-dezoksyglukonowa
Sulfolobus solfataricus
100
Aldolaza fruktozy typ II
Thermus aquaticus
90
ATPaza
Thermotoga maritima
74
Dehydrogenaza alkoholowa
Pyrococcus furiosus
85
Dehydrogenaza L-treoniny
Pyrococcus horikoshii
100
Egzoglukanazy
Thermotoga maritima MSB8
95
Anaerocellum thermophilum
Thermotoga sp. FjSS3-B.1
115
Pyrococcus furiosus
100
Endoglukanaza
Thermotoga neapolitana
85
Endoksylanaza
Pyrodictum abyssi
110
Thermotoga sp. FjSS3-B.1
105
Thermotoga thermarum
80
Thermotoga neapolitana
85
Esteraza
Pyrococcus furiosus
100
Bacillus acidocaldarius
70
Archaeoglobus fulgidus
70
Lakkaza
Thermus thermophilus
92
Liaza gellanu
Geobacillus stearothermophilus
70
Lipaza
Bacillus stearothermophilus
68
Bacillus thermocatenulatus
70
Oksydoreduktaza dwusiarczkowa
Pyrococcus horikoshii
100
Proteazy kwaśne
Sulfolobus acidocaldarius
90
Proteazy serynowe
Desulfurococcus mucosus
95
Thermococcus celer
Thermococcus litoralis
Proteazy tiolowe
Pyrococcus sp. KOD1
110
Pullulanaza typ I
Fervidobacterium pennavorans Ven5
85
Pullulanaza typ II
Thermococcus aggregans
Desulfurococcus mucosus
Pyrococcus woesei
Pyrodictium abyssi
100
Syntaza T-6P
Thermus thermophilus
100
Trehalaza
Rhodotermus marinus
88
α- amylaza
Desulfurococcus mucosus Pyrococcus woesei
Thermococcus aggregans
100
Pyrococcus sp. KOD1
Thermococcus celer
Dictyoglomus thermophilum
90
Zestawienie termozymów

Hipertermofile, inaczej ekstremalne termofile, są to
mikroorganizmy, których optymalna temperatura wzrostu zaczyna
się od 80
°
C, minimalna temperatura wzrostu to 60
°
C, natomiast
maksimum wzrostu wynosi nawet 121
°
C.
Z powodu słabej rozpuszczalności tlenu w gorących wodach są
one zwykle beztlenowcami.
Zaliczamy do nich archeony (Sulfolobus acidocaldarius,
Methanocaldococcus vulcanius, M.janashii, Sulfurococcus mirabilis,
Archaeoglobus profundus, Methanopyrus kandleri, Pyrobaculum
islandicum, Pyrococcus furio sus, Pyrolobus fum arii, Thermococcus
litoralis, Szczep 121) i nieliczne bakterie (Thermus aquaticus,
T.thermophilus, Thermotoga maritima, Thermomicrobium roseum).
Najmniejszy z dotychczas opisanych drobnoustrojów, ziarniak
Nanoarchaeum equitans, o średnicy 0,4nm jest również
hipertermofilnym archeonem, którego wyizolowano na głębokości
120m z kanału hydrotermalnego.

Archeonem o najwyższej opisanej temperaturze maksymalnej
równej 121
°
C jest Szczep 121, przejściowo nazwany Geogemma
barossii. Został on wyizolowany w 2003 roku, z komina
hydrotermalnego w północno-wschodnim Pacyfiku, na głębokości ok.
2400m.
Na drugim miejscu znajduje się Pyrolobus fumarii, z maksymalną
temperaturą wzrostu 113
°
C.
Archeony różnią się znacznie od bakterii.
Ich ściana komórkowa nie zawiera peptydoglikanu. Jest on
zastąpiony pseudomureiną, białkami lub polisacharydami. Tłumaczy to
brak wrażliwości archeonów na niektóre antybiotyki na przykład
penicylinę, cefalosporyny czy D-cykloserynę. Antybiotyki te natomiast
działają na ścianę komórki bakteryjnej.
W błonie cytoplazmatycznej zamiast estrów kwasów
tłuszczowych z glicerolem występują etery gliceroli izoprenoidów
alkilowych z resztami C
20
-fitanylowymi lub C
40
-bifitanylowymi. Zawiera
także lipidy obojętne w postaci węglowodorów izoprenoidowych.
Polimerazy RNA zależne od DNA zawierają więcej niż cztery
podjednostki, są odporne na ryfampicynę i streptolidyginę.
Rybosomowe 16S RNA i 5S RNA ma znacząco inną sekwencję
nukleotydową w stosunku do RNA bakteryjnych. Chloramfenikol nie
wpływa na translację u archeonów, natomiast jest ona hamowana
toksyną błoniczą, nie wpływającą na translację u bakterii.

Mikroorganizmy ekstremalnie termofilne są izolowane ze
środowisk o podwyższonej temperaturze, do których należą:
geotermalne i wulkaniczne obszary, posiadające gorące źródła,
gejzery, kanały i kominy hydrotermalne (ang. Black smokers) na
dnie oceanów, gorące prądy morskie, fumarole i solfatary (otwory w
Ziemi przy czynnych i drzemiących wulkanach , przez które
wydobywają się gazy: CO
2
, H
2
, HCl, HF i H
2
S, a także para wodna o
temperaturze 300
°
C w przypadku fumaroli i poniżej 200
°
C dla
solfatarów, w których wytrącają się znaczne ilości elementarnej
siarki).
Hipertermofile zasiedlają również gorące hałdy miału
węglowego, ogrzewane geotermicznie złoża ropy i szyby wiertnicze.
Siedliska mikroorganizmów ekstremalnie termofilnych
znajdują się w Narodowym Parku Yellowstone (USA), Nowej
Zelandii, Japonii, w gorących, płytkich wodach Islandii, Kenii, na
Azorach oraz na terenach rzecznych Portugalii, Wielkiej Brytanii,
Rosji, Tajlandii i Czech


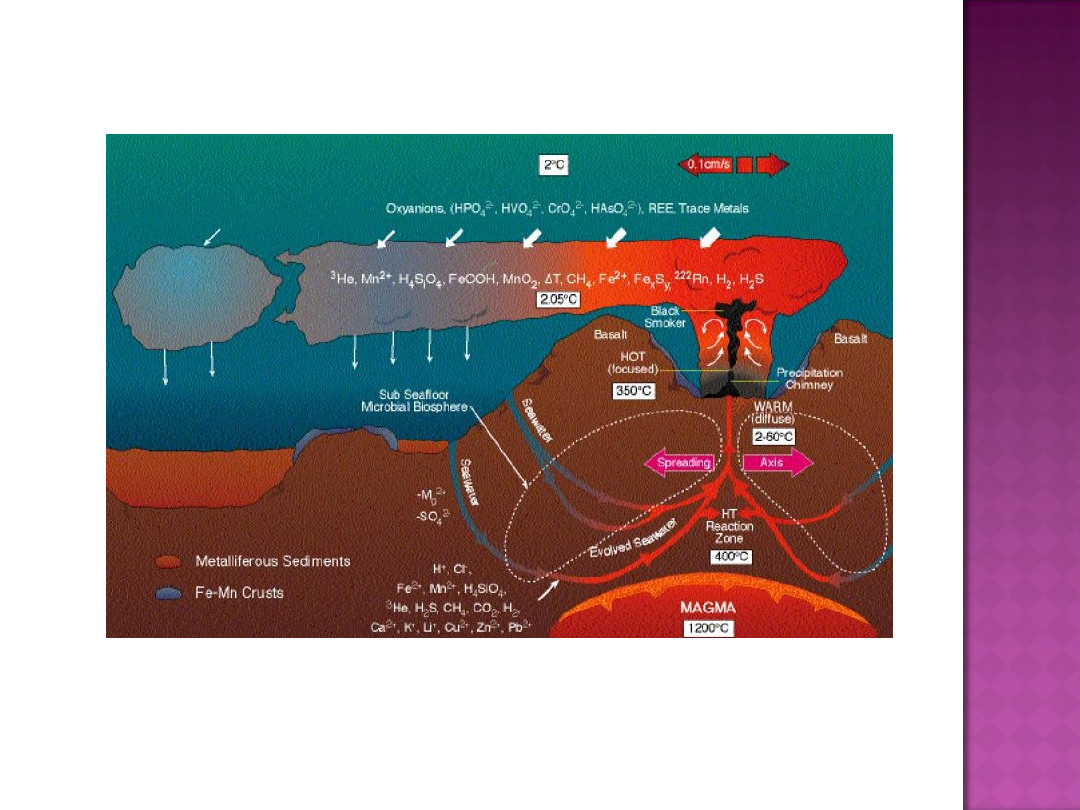

Hipertermofile w swoich naturalnych siedliskach charakteryzują się
złożonością zależności pokarmowych. Mikroorganizmy wykorzystujące
reakcję utleniania i redukcji związków nieorganicznych jako źródło
energii – chemolitotrofy, pełnią rolę producentów. Dwutlenek stanowi
dla nich źródło węgla wykorzystywanego do budowy komórek.
Donorami elektronów są różne związki nieorganiczne.
Większość hipertermofili to ścisłe beztlenowce.
Thermococcus stetteri i Pyrococcus furiosus rosną w obecnośći
bakterii metanogennych na przykład Methanococcus lithotrophicus, M.
jannaschii, które utylizują wodór, będący głównym produktem fermentacji
a jednocześnie inhibitorem wzrostu mikroorganizmów fermentujących.
Gdy wodór cząsteczkowy jest donorem elektronów (substrat pokarmowy),
akceptorami elektronów (substraty oddechowe) są wówczas: siarka
elementarna, siarczany, siarczyny, azotany, azotyny i dwutlenek węgla czy
nawet arseniany.
Ferroglobus placidus, hipertermofilny archeon zamiast wodoru
wykorzystuje jony żelaza jako donory elektronów przy redukcji azotanów.
Związki metali ciężkich mogą być dla beztlenowych hipertermofili
akceptorami elektronów, na przykład Pyrobaculum redukuje jony żelaza do
magnetytu. Koegzystencja z mikroorganizmami, które utleniają żelazo jak
na przykład Ferroglobus placidus prowadzi do powstania zamkniętego
cyklu przemian żelaza. Niektóre archeony potrafią ługować metale ciężkie
z ich rud, na przykład typ Sulfolobales. Wymienione wyżej cechy
mikroorganizmów ekstremalnie termofilnych ukazują iż pełnią one ważne
ekologiczne funkcje w procesach biogeochemicznch.

Ze względu na bytowanie w podwyższonej temperaturze istotne jest
zabezpieczenie transkrypcji, translacji i szlaków metabolicznych przed
dezorganizacją.
Mikroorganizmy hipertermofilne posiadają stale białka szoku cieplnego
– HSP (ang. heat shock proteins), ułatwiające prawidłowe fałdowanie się
łańcuchów polipeptydowych cząseteczek enzymów i innych białek, ponadto
przeprowadzają reanaturację częściowo rozfałdowanych cząsteczek oraz
degradację poprzez proteolizę cząsteczek denaturowanych całkowicie
(aktywowana ATP proteaza serynowa)
Zwiększenie ilości par C+G, oddziaływania jonowe wytworzone z
udziałem Mg
2+
oraz występowanie 5-metylo-2-tiourydyny w miejsce
tymidyny przyczynia się do wzrostu termostabilności tRNA.
W komórkach hipertermofili występują również poliaminy (putrescyna,
spermidyna (->spermina), kadaweryna), jest akumulowany
wewnątrzkomórkowy potas i niektóre rozpuszczalne substancje na
przykład 2,3 – difosfoglicerynian – sprzyja to większej stabilności białek.
U niektórych hipertermofili zaobserwowano, iż produkcja poliamin
podwyższa temperaturę topnienia DNA, a w niektórych przypadkach
chroni rybosomy przed dezaktywacją.
Hipertermofile zawierają znaczne ilości specjalnych soli
stabilizujących strukturę DNA (difosfoinozytolu potasu i
difosfoglicerynianu potasu).
Odporność podwójnej helisy DNA na temperaturę jest dodatkowo
zwiększona dzięki odwrotnej gyrazie. Gyraza wprowadza dodatnie
superskręty, które stabilizują helisę
Trehaloza (1-α-D-glukopiranozylo-1,1-α-Dglukopiranozyd), disacharyd,
również pełni funkcję stabilizującą cząsteczki. Pełni funkcję uszczelniacza i
zabezpiecza błony biologiczne oraz stabilizuje wiązania wodorowe w
białkach.

Błona cytoplazmatyczna u hipertermofili jest znacznie
sztywniejsza, lipidy zawierają większą ilość reszt
długołańcuchowych nasyconych nierozgałęzionych kwasów
tłuszczowych. Hipertermofilne archeony zawierają w błonie
cytoplazmatycznej nietypowe lipidy – archeole i kaldarcheole,
będące pochodnymi glicerolu, fitolu i bifitolu. Występują w nich
znacznie bardziej trwałe wiązania eterowe w miejsce wiązań
estrowych występujących w fosfolipidach błonowych, co jest
przyczyną zwiększonej stabilności.
Hipertermofilne archeony posiadają również na powierzchni
komórki parakrystaliczną otoczkę – warstwę S, która zawiera
glikoproteiny i pełni funkcję bariery ochronnej.

Problematyka izolacji i hodowli hipertermofili
Standardowe otrzymywanie nowych enzymów opiera
się na ich izolowaniu z próbek biotopów obejmujących
mikroorganizmy, wzbogacaniu ich właściwości, izolacji
i namnażaniu scharakteryzowanych fenotypowo i
genotypowo mikroorganizmów.
W przyrodzie występuje od 1 do 10 mln szczepów
mikroorganizmów, podczas gdy obecnie znamy ok.
5000. Taki stan rzeczy spowodowany jest tym, iż
znaczna większość mikroorganizmów to drobnoustroje
niehodowlane. Dotyczy to przede wszystkim biotopów
ekstremalnych, do których niewątpliwie zaliczają się
obszary podwyższonych temperatur.

W niektórych przypadakach enzymy hipertermofili po ich
ekspresji w komórkach mezofili zmieniają lub tracą aktywność oraz
uzyskują mniejszą termostabilność. Główną tego przyczyną jest
nieprawidłowość modyfikacji potranslacyjnych spowodowana m.in.
Zanikiem tworzenia wewnątrz- i/lub międzycząsteczkowych wiązań
disulfidowych oraz innych oddziaływań stabilizujących cząsteczki.
Innym powodem ukształtowania nieprawidłowej konformacji
cząsteczek może też być brak w komórkach mezofilnego
gospodarza odpowiednich białek opiekuńczych. Uformowanie
prawidłowej konformacji i uzyskanie pierwotnych właściwości
katalitycznych zapewnia często inkubacja enzymu w podwyższonej
temperaturze, zbliżonej do temperatury środowiska rozwoju
macierzystego hipertermofila. Należy też unikać izolowania i
przechowywania termostabilnych enzymów w zbyt niskiej
temperaturze. Kilkugodzinna inkubacja alfa – glukozydazy z
Pyrococcus furiosus lub ekstraktu bezkomórkowego, służącego do
jej otrzymywania w 4 st. C zmniejszyła aktywność enzymu prawie o
50%, prawdopodobnie wskutek niepożądanej agregacji cząsteczek
białka.

Niewielka wydajność produkcji biomasy przez hipertermofile
wytwarzające termostabilne enzymy o pożądanych właściwościach,
konieczność prowadzenia hodowli w podwyższonej
temperaturze w warunkach beztlenowych, oraz często
spotykane wydzielanie toksycznych i działających korozyjnie
metabolitów znacznie utrudniają pozyskanie biomasy
mikrorganizmów w ilości wystarczającej do przemysłowej produkcji
tych enzymów. Wyeliminowanie tych niedogodności oraz zwiększenie
wytwarzania enzymu w komórkach umożliwia ekspresja
odpowiednich genów hipertermofili w mikroorganizmach
mezofilnych.
Komórki drożdży Saccharomyces cerevisiae transformowane
plazmidem z genem alfa – glukozydazy z Thermococcus
hydrothermalis wytwarzały enzym o gorszej termostabilności od
wyizolowanego z macierzystej bakterii.
Próby ekspresji rozmaitych genów hipertermofili w
mikroorganizmach mezofilnych są zazwyczaj udane, a wytworzone
enzymy uzyskują prawidłową konformację zapewniającą oczekiwane
właściwosći katalityczne pomimo znacznie niższej temperatury
cytoplazmy, w której przebiegają modyfikacje potranslacyjne.
Otrzymywanie w
mikroorganizmach
mezofilnych

Większość mikroorganizmów ekstremalnie termofilnych jest nieosiągalna do
poznania, głównie ze względu na brak możliwości odtworzenia w warunkach
laboratoryjnych charakterystycznych parametrów, składu chemicznego oraz
złożonych zależności troficznych, charakteryzujących naturalne środowisko
występowania ekstremalnych termofili. Fakt ten doprowadził do rozwoju i
wykorzystania nowoczesnych technik biologii molekularnej do oceny rzeczywistej
różnorodności mikroorganizmów danego środowiska. Dzięki nim nie ma
konieczności izolacji indywidualnych czystych kultur drobnoustrojów, a ocena
opiera się na badaniu DNA, które jest izolowane bezpośrednio z próbek materiału
środowiskowego na przykład z wody. Do technik tych zaliczają się: elektroforeza
kwasów nukleinowych w gradiencie denaturującym DGGE (ang. denaturing
gradient gel electrophoresis) oraz w gradiencie temperatury TTGE (ang. temporal
temperature gel electrophoresis), analiza polimorfizmu konformacyjnego DNA
jednoniciowego SSCP (ang. single strand conformation polymorphism), analiza
polimorfizmu długości fragmentów restrykcyjnych T-RFLP (ang. terminal restriction
fragment lenght polymorphism), analiza sekwencji fragmentu DNA
zlokalizowanego pomiędzy bakteryjnymi genami 16S rRNA i 23S rRNA ARISA (ang.
automated ribosomal intergenic spacer analisis), analiza restrykcyjna rRNA
amplifikowanego techniką PCR ARDRA (ang. amplified ribosomal DNA restriction
analysis), hybrydyzacja in situ sond fluorescencyjnych z rRNA FISH (ang.
fluorescence in situ hybrydization), zastosowanie mikrochipów DNA do
bezpośredniej analizy drobnoustrojowego rDNA.
Istnieje również alternatywna droga dla wyżej wymienionych metod, która
ocenia zarazem różnorodność mikroorganizmów w danym środowisku oraz
różnorodność ich enzymów oraz innych biocząsteczek. Jest to metoda konstrukcji
metagenomów - środowiskowych bibliotek genomowego DNA tzw. eDNA
(environmental DNA), a następnie poszukiwanie w nich określonych genów oraz
ekspresja w odpowiednio dobranych gospodarzach. Zaletą tej metody jest to, iż
DNA z którego konstruuje się biblioteki metagenomowe pochodzi potencjalnie od
wszystkich mikroorganizmów znajdujących się w badanym środowisku.
Metody badania środowisk ekstremalnych otwierają całkowicie nowe
perspektywy, dzięki którym będzie można poznać potencjał mikrorganizmów
ekstremalnie termofilnych oraz innych ekstremofili, co przyczyni się do
rozszerzenia listy ich zastosowań w różnych dziedzinach życia.(Libudzisz, 2007,
Nicklin, 2007)

Po raz pierwszy enzym został
wprowadzony do przemysłowego użytku w
1915 roku. Stał się składnikiem
detergentów piorących i do tej pory
alkaliczne proteinazy wykorzystywane
głównie w pralnictwie stanowią 30%
światowej produkcji białek
katalitycznych. Wartość globalnego rynku
enzymów ocenia się na około 5mld USD.,
wzrasta ona rokrocznie o 10%. Rynek ten
jest ciągle jeszcze zdominowany przez
enzymy drobnoustrojów mezofilnych.
Zastosowanie i
perspektywiczne
znaczenie

Enzymy pochodzące z mikroorganizmów ekstremalnie termofilnych
mogą być wykorzystane m.in. w inżynierii genetycznej, do
produkcji żywności, farmaceutyków, kosmetyków, tekstyliów,
chemikaliów, detergentów i wyrobów papierniczych.
Termofilnym enzymem produkowanym na skalę przemysłową,
stosowanym do detergentów piorących jest na przykład celulaza
BCE 113.
Do marmurkowania jeansu wykorzystywany jest
wieloenzymatyczny preparat DeniMaxCombi 113-140.
W przemyśle spożywczym stosuje się termostabilne β-
galaktozydazy (katalizują reakcję hydrolizy laktozy) do wytwarzania
bezlaktozowych produktów mlecznych na przykład dietetycznego
mleka i jego przetworów, syropów glukozowo – galaktozowych,
bezlaktozowej serwatki wykorzystywanej do produkcji lodów,
fermentowanych napojów oraz paszy dla zwierząt. Laktoza powoduje
wiele problemów podczas procesów technologicznych oraz wywołuje u
niektórych ludzi zaburzenia pokarmowe tzw. nietolerancja laktozy.
β-galaktozydazy

Stosując β-galaktozydazę zapobiega się skutkom
nietolerancji laktozy oraz problemom technologicznym
związanym z występowaniem laktozy w mleku i
serwatce.
Dzięki zastosowaniu termostabilnych β-galaktozydaz
hamuje się wzrost niepożądanych drobnoustrojów
podczas przeprowadzanego procesu technologicznego w
bioreaktorze z enzymem.
Zaletą termostabilnych β-galaktozydaz jest również to iż w
przeciwieństwie do ich mezofilnych odpowiedników są mniej
podatne na hamowanie reakcji wytwarzaną podczas
hydrolizy galaktozą, a glukoza jest często ich
aktywatorem.

Thermus sp.T2 wytwarza enzym o aktywności β-
galaktozydazy, osiąga on największą aktywność w
temperaturze 80°C przy pH 5.0. Inną termostabilną β-
galaktozydazę wyizolowano w Nowej Zelandii ze szczepu
Thermus sp. 4-1A. Charakteryzuje się ona dużą
termostabilnością, po 20h inkubacji zachowuje 83%
początkowej aktywności. Podobne właściwośći posiada β-
galaktozydaza wyizolowana w Japonii, z gorących źródeł
Atagawa, gdzie bytuje termofilna bakteria Thermus sp. A4,
która zachowuje początkową aktywność nawet po 20h
inkubacji w temperaturze 70°C i pH 6,5.
Stosowanie termostabilnych β-galaktozydaz jest również
użyteczne do produkcji laktulozy i innych prebiotyków.
Dzięki tym termozymom można prowadzić reakcję w
temperaturze zapewniającej wzrost wydajności
transgalaktozylacji oraz zwiększyć stężenie laktozy w
roztworach. Thermus aquaticus YT-I wytwarza β-
galaktozydazę o dużej aktywności transgalaktozylacyjnej w
temperaturze 80°C i pH 5,5. (Sinkiewicz, Synowiecki, 2009,
Wanarska, Kur, 2005)

α-amylazy
Druga grupa enzymów termostabilnych stosowanych w przemyśle
na dużą skalę to α-amylazy. Są one stosowane w browarnictwie,
gorzelnictwie, w produkcji wyrobów cukierniczych i
piekarskich, mleka w proszku, napojów, keczupów, mrożonej
żywności, maltozy, glukozy i alkoholi wielowodorotlenowych do
upłynniania skrobii podczas wytwarzania maltodekstryn i
syropów skrobiowych, maltotetraozowych, maltozowych i
glukozowych, stosowanych jako zamienniki cukru.
Termostablina α-amylaza jest izolowana ze szczepu Thermus filiformis
Ork A2, jej optymalna temperatura działania wynosi 95°C, a czas
połowicznej inaktywacji w 85°C wynosi 8 godzin. Enzym ten jest
wykorzystywany podczas upłynniania skrobi. Dzięki zastosowaniu
termostabilnej α-amylazy można zredukować niekorzystny wzrost
lepkości (30-40%) zawiesiny ziaren skrobiowych, które ulegają
intensywnemu kleikowaniu oraz umożliwia strącenie resztek białek,
które powodują zmętnienie wytwarzanych syropów.

W procesie scukrzania skrobi stosuje się obecnie glukoamylazę z
Aspergillus Niger lub β-amylazę z jęczmienia. Wadą działania tych
enzymów jest to iż ich inaktywacja następuje w temperaturze 60-65°C
i zanim rozpocznie się scukrzanie trzeba oziębić roztwór
maltodekstryn wytworzonych z udziałem α-amylazy. Problem ten
można wyeliminować zastępując glukoamylazy termostabilnymi α-
glukozydazami działającymi w podobnych warunkach jak α-amylazy.
Są one wytwarzane przez Thermus thermophilus, ich zaletą jest
zachowanie około 80% maksymalnej aktywności w zakresie pH 5,8 do
6,9 – dzięki temu możliwe jest zastosowanie rekombinowanej α-
amylazy z Pyrococcus woesei.
Pullulanazę z Thermus aquaticus YT1 lub z Thermus caldophilus
GK-24 można wykorzystać do usuwania rozgałęzień cząsteczek
amylopektyny w zaawansowanej hydrolizie skrobi katalizowanej
termostabilnymi enzymami. Okres połowicznej inaktywacji
odpowiednio w temperaturach 95-98°C i 75°C wynosi 4,5h.
Dzięki zastąpieniu izomeraz ksylozowych wytwarzanych przez
Sterptomyces, Bacillus, Arthrobacter, Actinoplanes ich
termostabilnymi analogami z Thermus thermophilus lub Thermus
caldophilus można zwiększyć temperaturę procesu wytwarzania
syropów fruktozowych, co poprawi wydajność enzymatycznej
izomeryzacji glukozy.

Następną grupą enzymów termostabilnych stosowanych w
przemyśle są enzymy proteolityczne na przykład
metaloproteinazy i proteinazy serynowe należące do
subtylizyn. Enzymy te wykorzystuje się w przemyśl
farmaceutycznym, spożywczym, tekstylnym i skórzanym,
w produkcji detergentów. Przykładem termostabilnej
proteinazy jest produkowana przez Thermus thermophilus
HB8 metaloproteinaza, zawierająca w kieszeni katalitycznej
atom cynku. Działa aktywnie tylko na denaturowane białka,
rozszczepia ich wiązania peptydowe składające się z
hydrofobowych aminokwasów.
Również w chemioterapii można wykorzystać
termostabilne enzymy. Na przykład aminohydrolaza L-
asparaginy z Thermus thermophilus HB8. Prowadzi ona do
letalnego dla komórek nowotworowych deficytu L-
asparaginy. Komórki nowotworowe nie są zdolne do
syntezy tego aminokwasu.
enzymy proteolityczne

lipazy, esterazy
Termostabilne lipazy/esterazy produkowane przez
Thermus aquaticus i Thermus thermophilus HB27
umożliwiają hydrolizę lipidów, reakcje estryfikacji i trans
estryfikacji w temperaturze wyższej niż temperatura
topnienia substratu. Dzięki temu nie trzeba stosować
rozpuszczalników organicznych.
Najbardziej popularnym w biotechnologii enzymem
termostabilnym jest polimeraza Taq. Zastosowanie jej
pozwoliło na usprawnienie reakcji PCR (ang. Polymerase
Chain Reaction), wyeliminowało konieczność dodawania
świeżego enzymu po każdym wysokotemperaturowym cyklu
amplifikacji DNA. Została ona wykorzystana do jednej z
najważniejszych technik stosowanych w biologii molekularnej
i w inżynierii genetycznej – łańcuchowej reakcji polimerazy
PCR (ang. polymerase chain reaction). Obecnie produkowane
są bardziej stabilne polimerazy Pyrococcus woesi i
Pyrococcus furiosus.

termostabilne enzymy w
biologii molekularnej
•
Polimerazy DNA są kluczowymi enzymami w procesie replikacji DNA. Obecnie,
termostabilne polimerazy są stosowane między innymi w amplifikacji DNA,
sekwencjonowaniu, znakowaniu.
•
Najbardziej popularną techniką stosowaną w biologii molekularnej do amplifikacji fragmentu
DNA jest reakcja PCR (ang. Polymerase Chain Reaction – reakcja łańcuchowa polimerazy) w
której stosowana jest termostabilna polimeraza Taq. Zastosowanie jej pozwoliło na
usprawnienie reakcji PCR , wyeliminowało konieczność dodawania świeżego enzymu po
każdym wysokotemperaturowym cyklu amplifikacji DNA. Polimeraza Taq osiągnęła największy
sukces komercyjny. Po 96 minutach ogrzewania w temperaturze 95°C zachowuje 50%
aktywności. Mikroorganizm, z którego pozyskano polimerazę Taq to Thermus aquaticus. Został
on wyizolowany w 1966r., z gorącego źródła Narodowego Parku Yellowstone w USA.
(Sinkiewicz, Synowiecki, 2009) Termostabilne polimerazy DNA mogą być również stosowane w
procesie odwrotnej transkrypcji, w którym RNA jest użyte jako matryca do syntezy nici cDNA
(ang. complementary DNA – komplementarne DNA). Technikę odwrotnej transkrypcji stosuje
się do tworzenia bibliotek cDNA. Polimeraza DNA z Thermus thermophilus HB8 jest stosowana
w rekacji odwrotnej transkrypcji.
•
Zastosowanie termostabilnej polimerazy DNA w sekwencjonowaniu pozwoliło na opracowanie
metody cyklicznego sekwencjonowania. Przy użyciu termostabilnej polimerazy wymagana jest
znacznie mniejsza ilość matrycy DNA, nie trzeba przeprowadzać osobnego procesu
przyłączania startera oraz niepożądane drugorzędowe struktury ulegają rozpadowi pod
wpływem wysokiej temperatury w której przebiega proces.
•
Ligazy DNA katalizują łączenie się polinukleotydów. Pierwsza termostabilna ligaza została
pozyskana z Thermus thermophilus HB8 w 1984 roku. Termostabilne ligazy stosuje się w
reakcji łańcuchowej ligazy LCR (ang. Ligase Chain Reaction). W procesie tym ligaza DNA
tworzy chemiczne wiązanie między dwoma sondami tworząc z nich jedną cząsteczkę DNA.
Metoda ta stosowana jest do wykrywania specyficznych fragmentów kwasów nukelinowych.
•
Do oczyszczania DNA przed amplifikacją PCR stosuje się termostabilną proteazę Pretaq,
pochodzącą z bakterii rodzaju Thermus.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
enzymy
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
enzymy
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
enzymy
Enzymy
12 POMIAR CZASU KRZEPNIECIA ODLEWU I PARAMETROW TERMOFIZYCZNYCH FORMY PIASKOWEJ(1)
biochemia enzymy2
Enzymy podział na klasy
07 Enzymy 1
08 Enzymy 2
enzymy restrykcyjne
więcej podobnych podstron