Biochemia erytrocytów
Dr hab. I.Rahden-Staroń
Katedra i Zakład Biochemii

Co jest wyjątkowego w
metabolizmie
erytrocytów?
Jakie enzymy ochronne są
obecne w erytrocycie i
jaka jest ich funkcja?

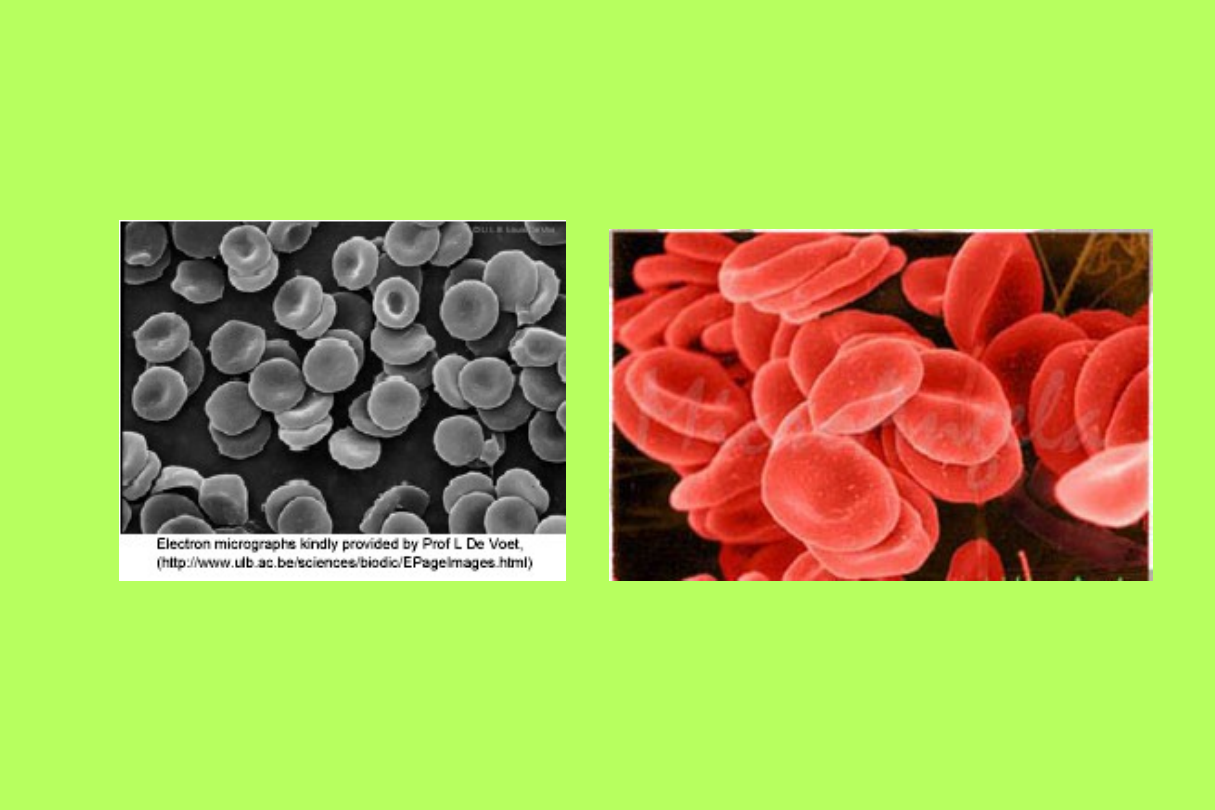
Budowa
Erytrocytów
• Błona komórkowa erytrocyta:
Odgrywa ważną rolę w utrzymaniu
kształtu krwinki czerwonej.
Jej odkształcalność jest istotną
cechą, jako że erytrocyt musi
przenikać przez włośniczki
Istnieje ok. 10 głównych białek
błonowych erytrocyta

Budowa Erytrocytów
W błonie znajdują się białka
strukturalne (spektryna i aktyna) oraz
ATPazy transporujące aktywnie jony do
komórki.
Białka te są potrzebne do utrzymania
właściwego wewnątrzkomórkowego
stężenia elektrolitów.
Niezbędna do wytwarzania ATP energia
pochodzi z beztlenowej glikolizy

Budowa Erytrocytów
• Znajdujące się na błonie
komórkowej węglowodany są
związane z białkami lub lipidami.
• Reszty węglowodanowe
glikoprotein tworzą antygeny
grupowe AB0, Rh i innych układów
grupowych krwi.

Funkcje Erytrocytów
• Erytrocyty nie mogą pełnić
normalnych funkcji
komórkowych, nie
mają też mechanizmu, który mógłby
naprawiać powstające w nich z
czasem uszkodzenia, dlatego też giną
po kilku miesiącach (około 120 dni)
- brak mitochondriów i jądra
komórkowego
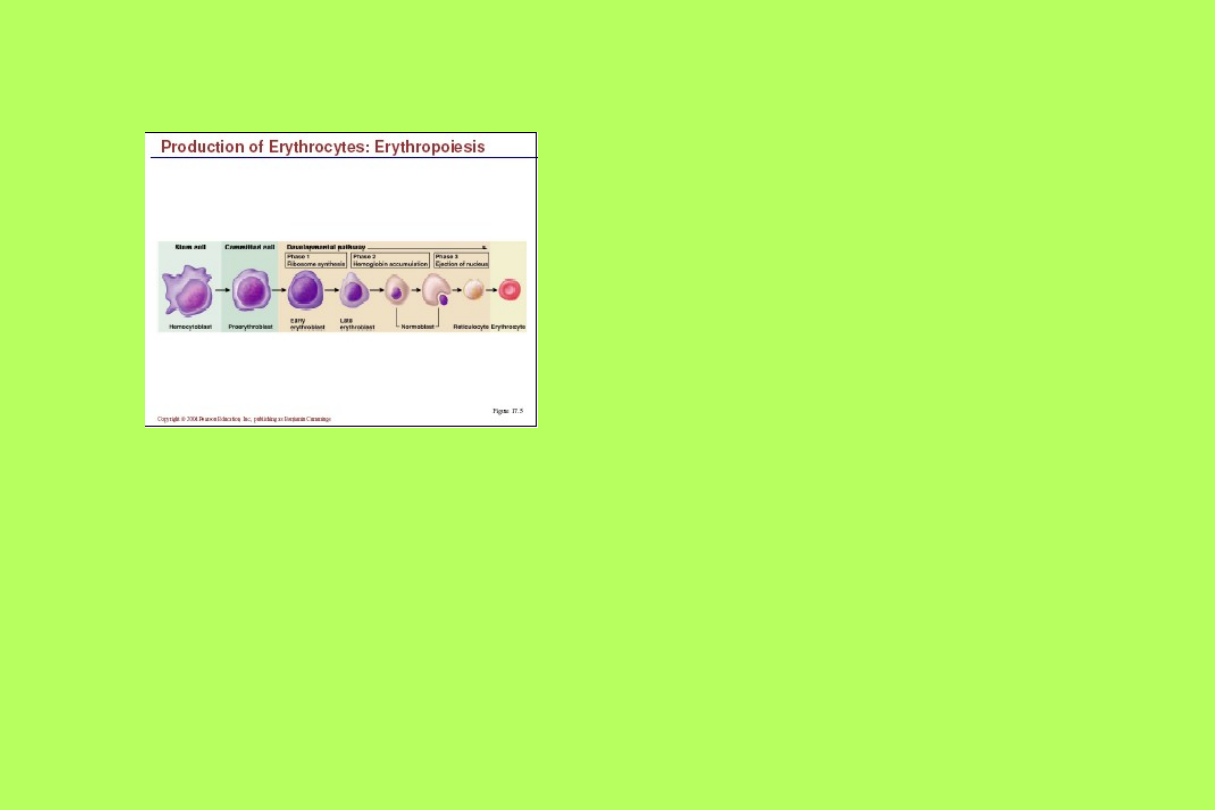
Erytropoeza
• produkowanych jest 25 bilionów/dobę
– retikulocyty powinny stanowić 1% całej
populacji krążących erytrocytów
– erytrocyty po ~120 dniach są niszczone w
śledzionie
– liczba produkowanych erytrocytów powinna
być równa liczbie niszczonych

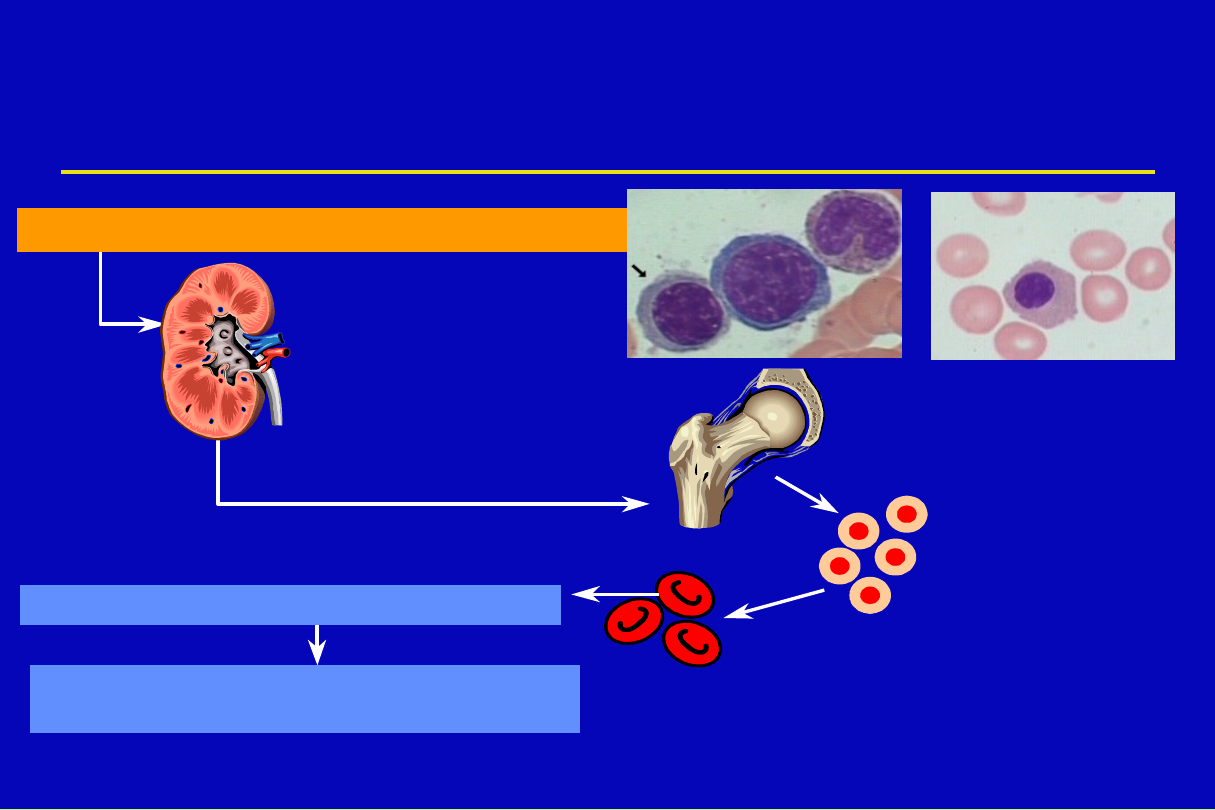
Czynniki niezbędne do
erytropoezy
• 1. Erytropoetyna
• 2. Żelazo
• 3. Witamina B
12
(cyjanokobalamina)
• 4. Kwas foliowy (folacyna)
• 5. Kwas askorbinowy (Witamina C)
• 6. Pirydoksyna (Witamina B
6
)
• 7. Aminokwasy
F
i
z
j
o
l
o
g
i
c
z
n
a
r
o
l
a
e
r
y
t
r
o
p
o
e
t
y
n
y
u
o
s
ó
b
z
d
r
o
w
y
c
h
Z
m
n
i
e
j
s
z
o
n
e
d
o
s
t
a
r
c
z
a
n
i
e
t
l
e
n
u
d
o
n
e
r
e
k
W
z
m
o
ż
o
n
e
d
o
j
r
z
e
w
a
n
i
e
p
r
o
e
r
y
t
r
o
b
l
a
s
t
ó
w
w
s
z
p
i
k
u
d
o
s
t
a
d
i
u
m
r
e
t
i
k
u
l
o
c
y
t
a
-
5
d
n
i
W
z
m
o
ż
o
n
a
r
e
t
i
k
u
l
o
c
y
t
o
z
a
w
e
k
r
w
i
Z
w
i
ę
k
s
z
o
n
a
l
i
c
z
b
a
e
r
y
t
r
o
c
y
t
ó
w
w
e
k
r
w
i
P
o
p
r
a
w
a
u
t
l
e
n
o
w
a
n
i
a
t
k
a
n
e
k
i
n
a
r
z
ą
d
ó
w
P
o
w
r
ó
t
d
o
n
o
r
m
a
l
n
e
j
h
o
m
e
o
s
t
a
z
y
w
p
r
z
y
p
a
d
k
u
p
o
p
r
a
w
y
u
t
l
e
n
o
w
a
n
i
a
n
e
r
e
k
E
P
O
W
z
r
o
s
t
s
e
k
r
e
c
j
i
e
r
y
t
r
o
p
o
e
t
y
n
y
d
o
k
r
w
i
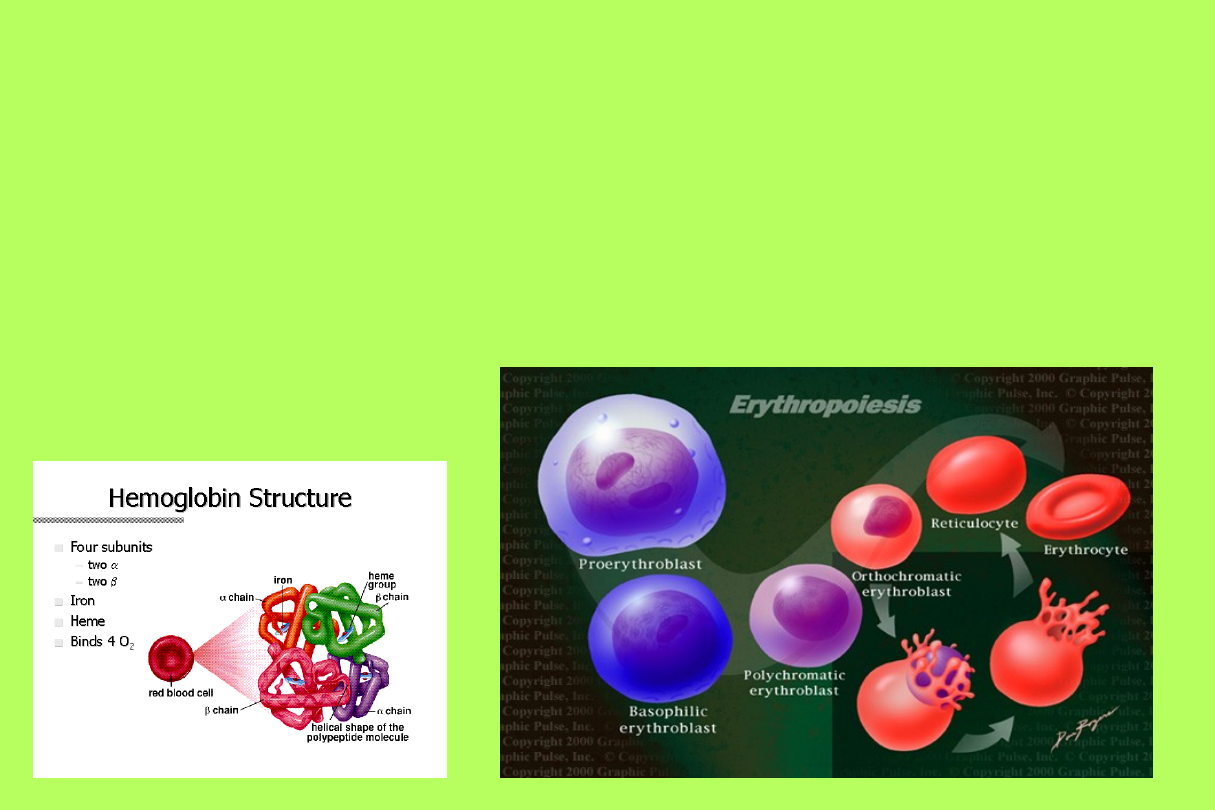
Hemoglobina
• Synteza hemoglobiny pojawia się w
proerytroblastach i jest zakończona
w retikulocycie
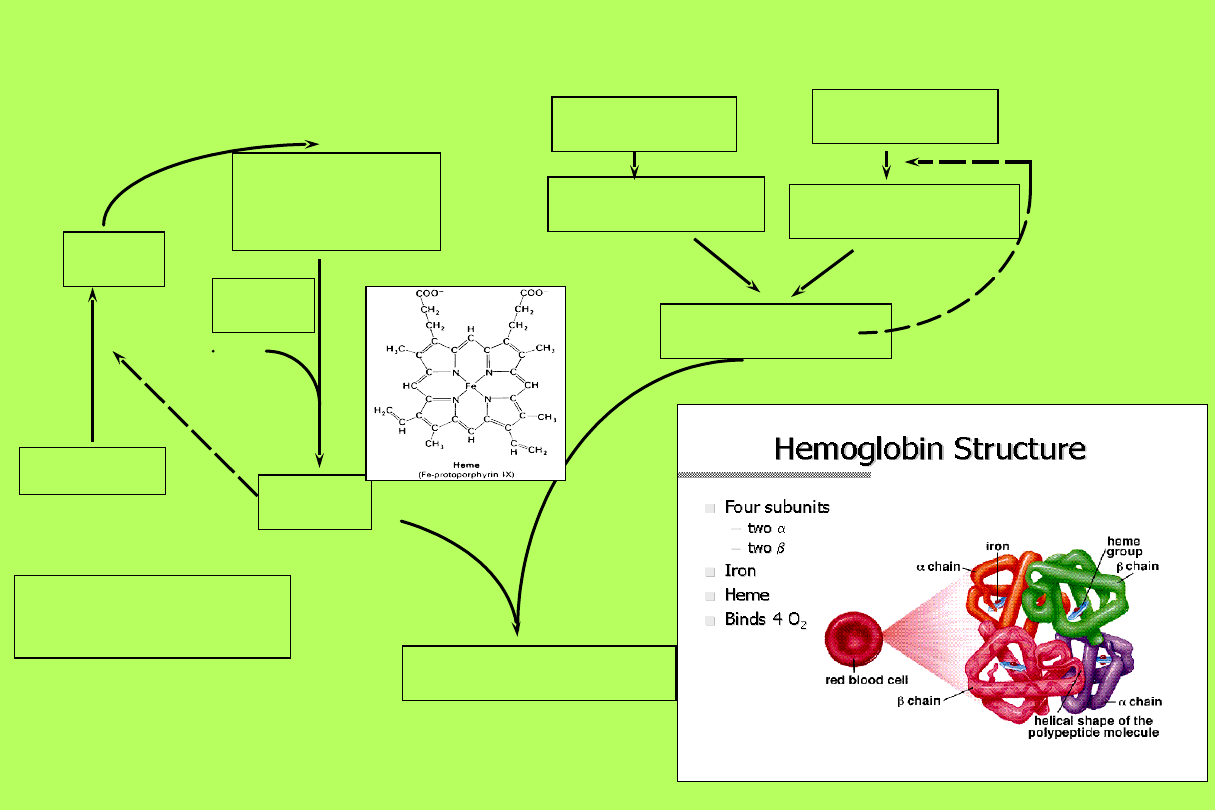
Biosynteza hemoglobiny
α-mRNA
β-mRNA
łańcuch α
łańcuch β
α, β-dimer
ALA
proto-
porfiryna
HEM
Glicyna
+
Bursztynylo~C
oA
Fe
+2
Hb-tetramer

REGULACJA TRANSLACJI
1) ODWRACALNA
FOSFORYLACJA eIF2
(INICJACJA SYNTEZY).
FOSFORYLACJA MOŻE BYĆ KATALIZOWANA PRZEZ
KINAZĘ
REGULOWANĄ PRZEZ INHIBITOR ZALEŻNY OD HEMU.
KINAZA
JEST AKTYWOWANA PRZEZ AUTOFOSFORYLACJĘ
W
NIEOBECNOŚCI HEMU
.
BRAK SYNTEZY GLOBINY.
2)
SPECYFICZNE GENY:
Dla: FERRYTYNY (TRANSPORT ŻELAZA)
SYNTAZY KWASU δ-AMINOLEWULINOWEGO (ALA) (SYNTEZA HEMU)
TRANSLACJA JEST REGULOWANA PRZEZ 5’ LUB 3’ IRE
(iron-responsive element) OBECNE W ODPOWIEDNICH mRNA.

Zaburzenia syntezy Hb
Wymagana jest ścisła koordynacja syntezy
globiny i syntezy hemu.
Upośledzenie syntezy hemu może być
spowodowane:
- Zaburzeniami w gospodarce żelazem.
- Zaburzeniami w procesie syntezy porfiryn
w szpiku
- Niedobór wit. B12 i/lub kwasu foliowego.
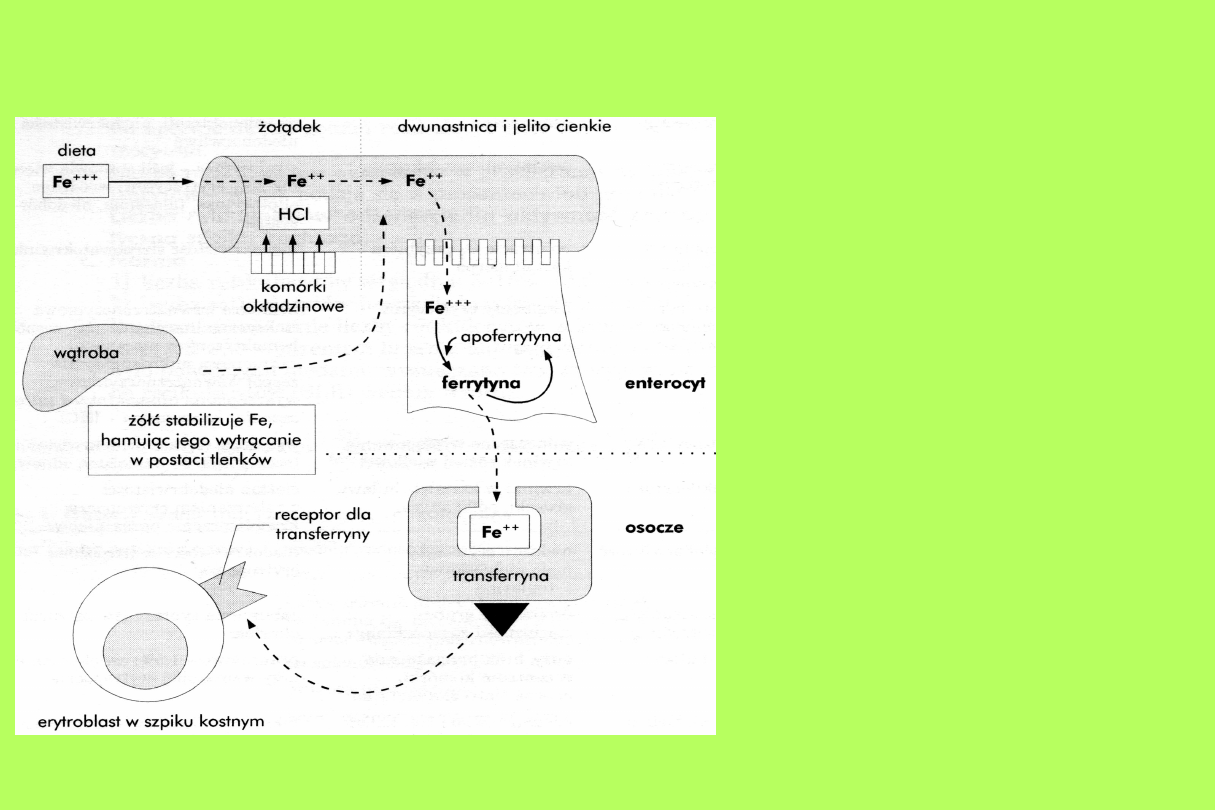
Wchłanianie i metabolizm żelaza
Wchłanianie i metabolizm żelaza
Ok. 3/4 żelaza
wykorzystywanego w
przemianach pochodzi z
rozpadłych krwinek
czerwonych. Pozostała
część pochodzi z żelaza
zapasowego i w znacznie
mniejszym stopniu z
żelaza wchłoniętego.
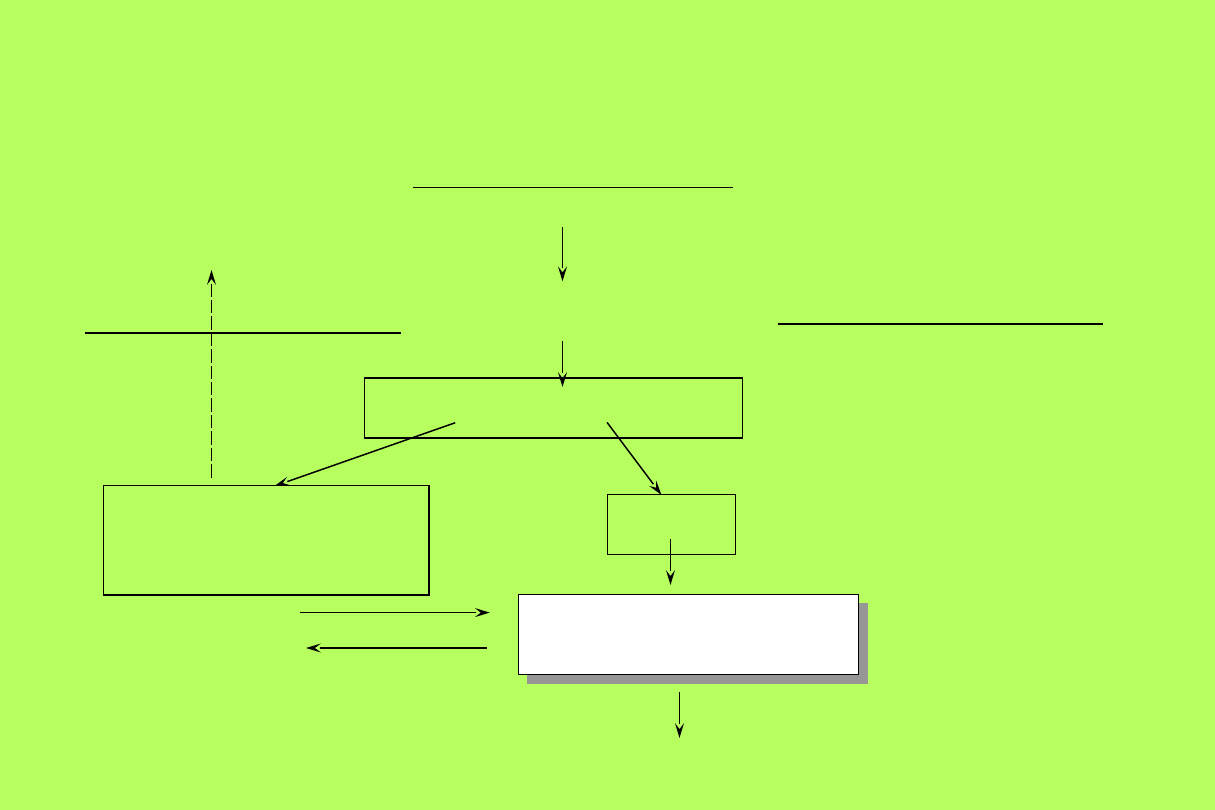
Pula żelaza w komórce
TRANSFERYNA OSOCZA
(30% WYSYCENIA ŻELAZEM)
RECEPTORY KOMÓRKOWE
RECEPTOSOMY
APOTRANSFERYNA
ŻELAZO
WEWNĄTRZKOMÓRKOWA
MOBILNA PULA ŻELAZA
SYNTEZA ŻELAZOPORFIRYN
FERRYTYNA

Gospodarka żelazem
Gospodarka żelazem
1.
Zawartość żelaza w organizmie mężczyzny
wynosi 50mg/kg, u kobiety 35mg/kg. Około 30%
stanowią magazyny tj. 1g u mężczyzn i 200-
400mg u kobiet.
2.
Codziennie mężczyzna i niemiesiączkująca
kobieta tracą 0,6-1,6mg żelaza, średnio 1mg.
Kobiety tracą od 0,006mg-0,025mg/kg/dzień.
Kobieta w ciąży traci 3,5 razy więcej.
3.
Zwykle w diecie codziennej znajduje się 6mg
żelaza na 1000 kalorii lub od 10-30mg.

Żelazo hemowe i
niehemowe
• Żelazo hemowe jest łatwo
wchłaniane. Obecne w mięśniach
jako część mioglobiny.
• Żelazo niehemowe jest słabo
wchłaniane – stanowi większość
żelaza w diecie.

Najczęstsze przyczyny niedoboru
Najczęstsze przyczyny niedoboru
żelaza
żelaza
•
z macicy, z przewodu pokarmowego, z nerek, nosa, płuc, długotrwała hemodializa, nawracające
krwawienia w przebiegu krwawiączki lub innych skaz krwotocznych, nadmierna eksploatacja
krwiodawców, krwioupusty, umyślne skrwawianie się, pobieranie krwi do badań
Utrata krwi (przewlekłe krwawienia)
Utrata krwi (przewlekłe krwawienia)
•
stany po resekcji żołądka lub gastroenterostomii, żołądkowa przepuklina przeponowa,
achlorhydria, przewlekłe biegunki, zespoły upośledzonego wchłaniania
Nieprawidłowe wchłanianie żelaza pokarmowego
Nieprawidłowe wchłanianie żelaza pokarmowego
•
liczne ciąże i porody, zwłaszcza bliźniacze, karmienie piersią okres szybkiego wzrostu,
krwiodawstwo
Zwiększone zapotrzebowanie na żelazo
Zwiększone zapotrzebowanie na żelazo
•
dieta uboga w żelazo (wcześniaki, noworodki karmione piersią), dieta roślinna, spaczone
łaknienie lub brak łaknienia (anorexia nervosa)
Niedostateczny dowóz żelaza
Niedostateczny dowóz żelaza
•
atranferynemia, przeciwciała przeciw receptorowi transferryny
Zaburzenie transportu żelaza
Zaburzenie transportu żelaza

Zaburzenia syntezy Hb
Wymagana jest ścisła koordynacja syntezy
globiny i syntezy hemu.
Upośledzenie syntezy hemu może być
spowodowane:
- Zaburzeniami w gospodarce żelazem.
- Zaburzeniami w procesie syntezy porfiryn
w szpiku
- Niedobór wit. B12 i/lub kwasu foliowego.
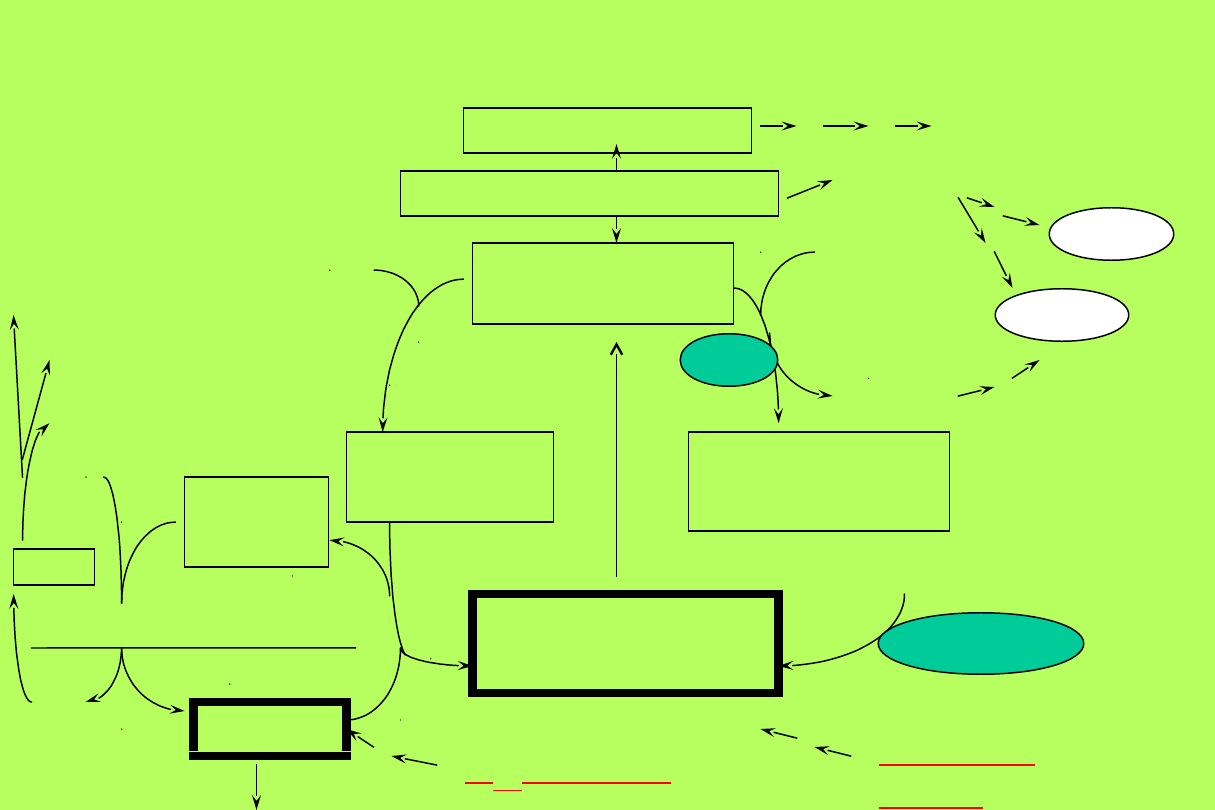
REAKCJE ZALEŻNE OD WITAMINY B
12
I KWASU FOLIOWEGO
N10-
FormyloTHF
N5, N10-Metenylo
THF
N5, N10-
Metyleno
THF
PURYNY
(d)AMP i
(d)GMP
DHF
(Dihydrofolia
n)
THF
(Tetrahydrofolian
)
N5-
Metylo-
THF
Metyl
o-
B
12
OH
-
B
12
syntaza metioninowa
B
12
z diety
reduktaza
dihydrofolianowa
Folian z
diety
Pirymidy
na
d
U
MP
dTMP
syntaza
tymidylanowa
Homo-
cystei
na
-SH
Metylo
-
S-
[Metionin
a]
SAM
-CH3
adenozyna
NADPH
Reduktaza
metyleno THF
PUŁAPKA -CH3
FOLIANOWA
ATP
RNA
DNA
5-FU
Metotreksat

Zużycie glukozy
-
Glukoza jest
jedynym substratem
energetycznym
.
- Energia zużywana jest przede
wszystkim na
utrzymanie gradientu stężeń
elektrolitów.
- Dobowe zużycie glukozy przez
erytrocyty
wynosi ok. 26 g.
- Główną drogą przemiany jest
glikoliza z
mleczanem jako produktem
końcowym.
- Ok.
10% glukozy zostaje zużyte w
cyklu
heksozo-monofosforanowym
.
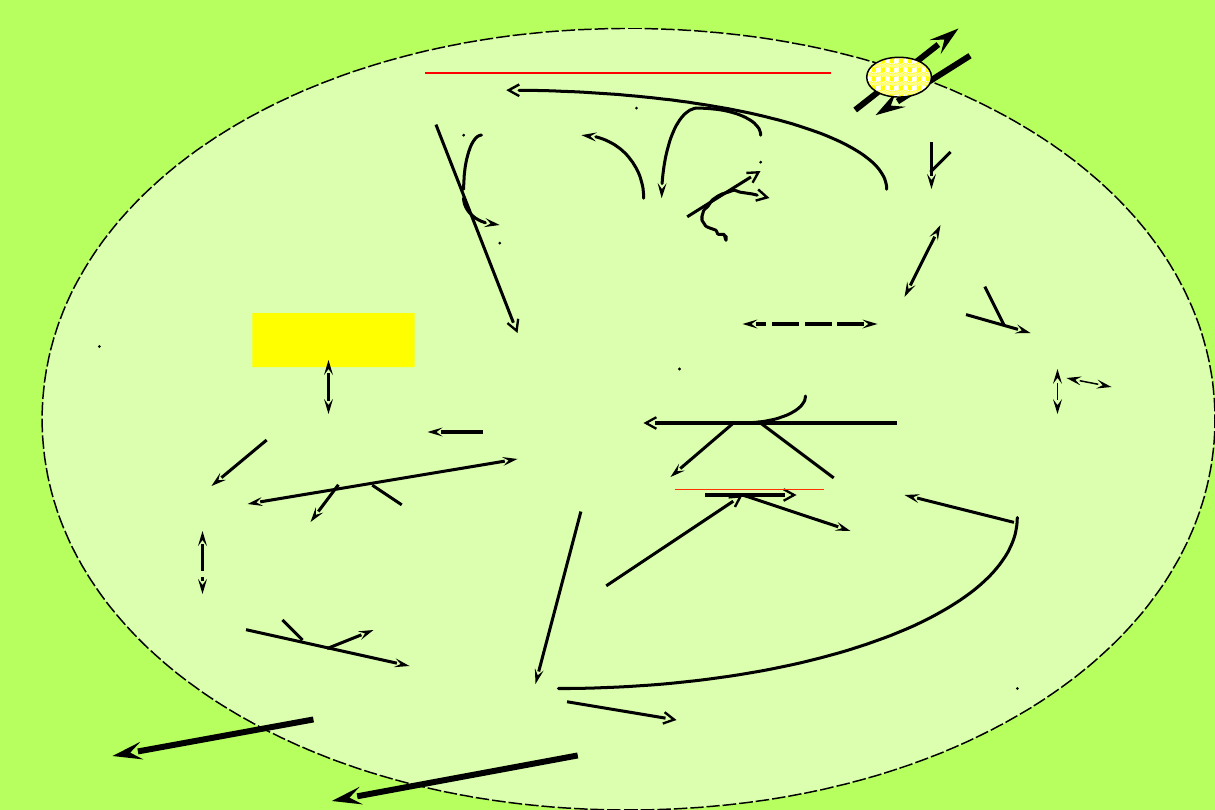
glukoz
a
glukoza
G6P
ATP
F6P
6-PG
NADP+
Rybulozo-5-
P
NADPH + H+
NADP+
GSSG
GSH
F(1,6)P
3-P-aldehyd glicerynowy
1,3-DPG
2,3-
DPG
DPG-Hb
DPG-Hb
Pi
ATP
PHA
3-PG
ATP
ADP
NADH+H+
NAD+
methemoglobina
Hemoglobina
PEP
pirogronian
mlecza
n
ADP ATP
dehydrogenaza G6P
reduktaz
a
Przemiany energetyczne
-
Beztlenowa glikoliza.
- Wychwytywanie glukozy jest niezależne od
insuliny i
transport nie stanowi czynnika
ograniczającego
metabolizm.
- Charakterystycznym elementem jest
obecność
dużych ilości 2,3-bisfosfoglicerynianu (2,3-
DPG).
4-5 mmol/l krwinek czerwonych, bliskim
stężenia Hb.
Stosunek molowy 2,3-DPG do Hb wynosi ok.
0,8-0,9.

Przemiany energetyczne c.d.
- 2,3-DPG powstaje w nieodwracalnej
reakcji,
katalizowanej przez swoistą mutazę:
1,3-DPG + 3-PG 2,3-DPG + 3-
PG
- fizjologiczne znaczenie 2,3-DPG w
krwinkach
czerwonych dotyczy mechanizmów
kontrolujących transport tlenu
.
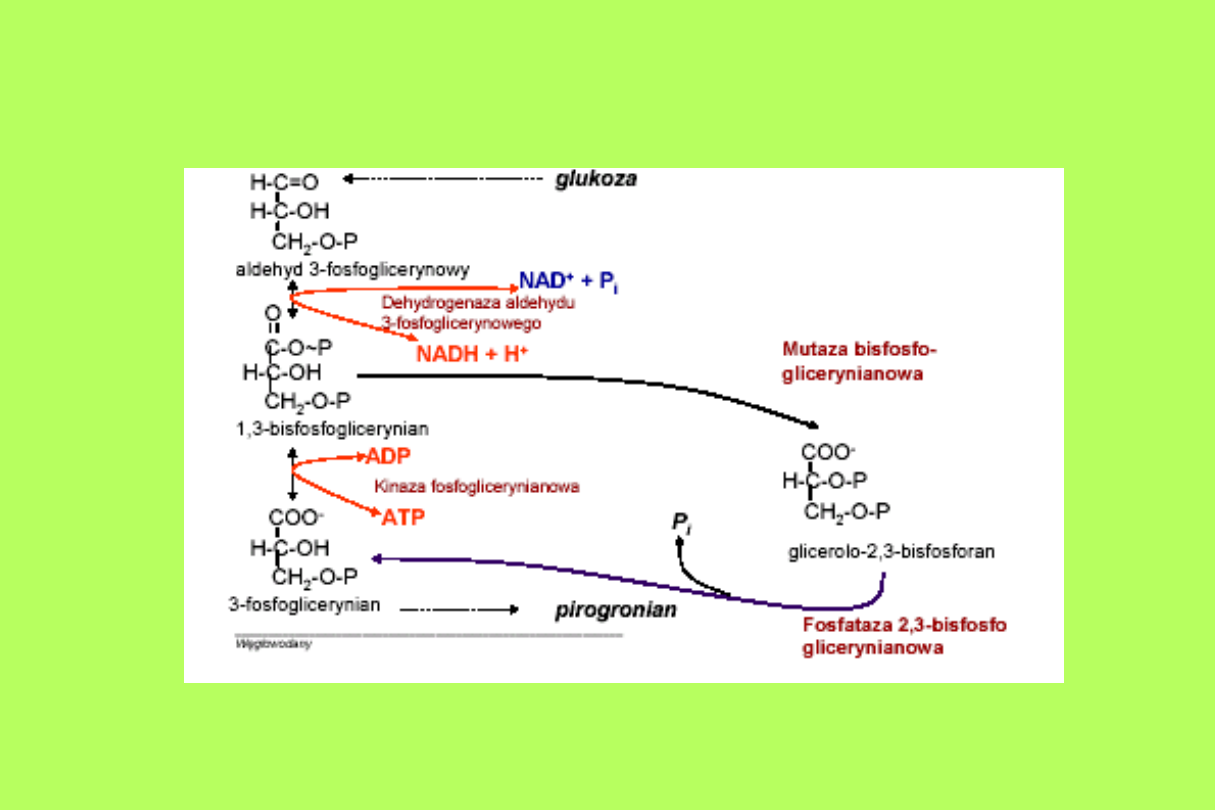
Synteza 2,3-bisfosforanu
NUKLEOTYDY ADENYLOWE
ISTOTNE ZNACZENIE DLA PRZEMIAN ENERGETYCZNYCH ERYTRO-
CYTÓW MA UTRZYMANIE
STAŁEJ WIELKOŚC
I PULI NUKLEOTYDÓW
ADENYLOWYCH. AMP STANOWI 1-3% PULI NUKLEOTYDÓW KRWI-
NEK, PODLEGA JEDNAK STALE PRZEMIANOM KATABOLICZNYM.
AMP
ADENOZYNA
swoista kinaza Km bardzo niskie
ATP
INOZYNA
deaminaza
IMP
swoista
deaminaza
fosfatazy
nukleotydaz
y
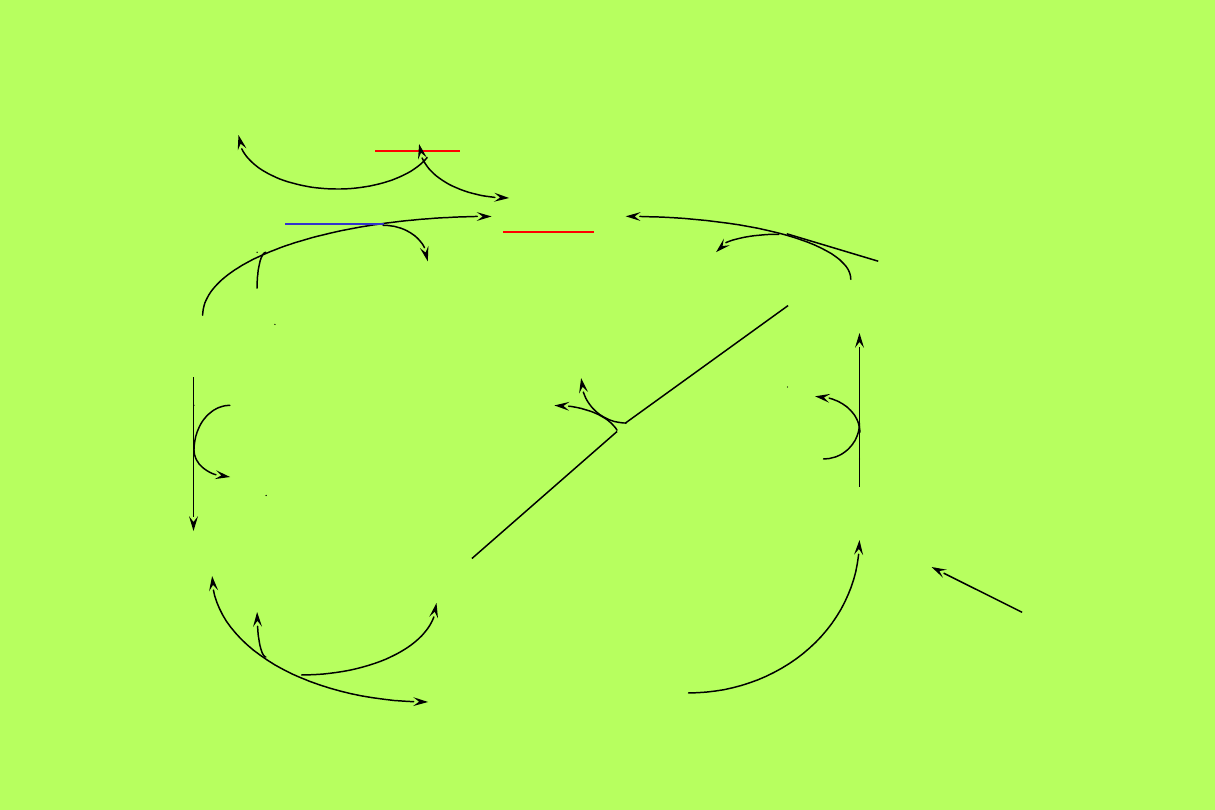
SYNTEZA NUKLEOTYDÓW
ADENYLOWYCH
AMP
PRPP
RYBOZO 5-
P
RYBOZO 1-P
ADENOZYNA
INOZYN
A
PP
i
fosforybozylotransferaza
adeninowa
ADENINA
HIPOKSANTYNA
P
i
fosforylaza
nukleozydowa
H
2
O
NH
3
deaminaza
adenozynowa
kinaza
adenozynow
a
AMP
ATP
cykl pentozo-
fosforanowy
fosforybomutaza
PP
i
IMP
fosfo-
rybozylo
transferaz
a
ATP
ADP
(2)
ATP
ADP
(glikoliza)
adenylanowa

wolne rodniki tlenowe
utlenienie
hemoglobiny to
methemoglobiny
(erytrocyt jest „pełny“ antyoksydantów)
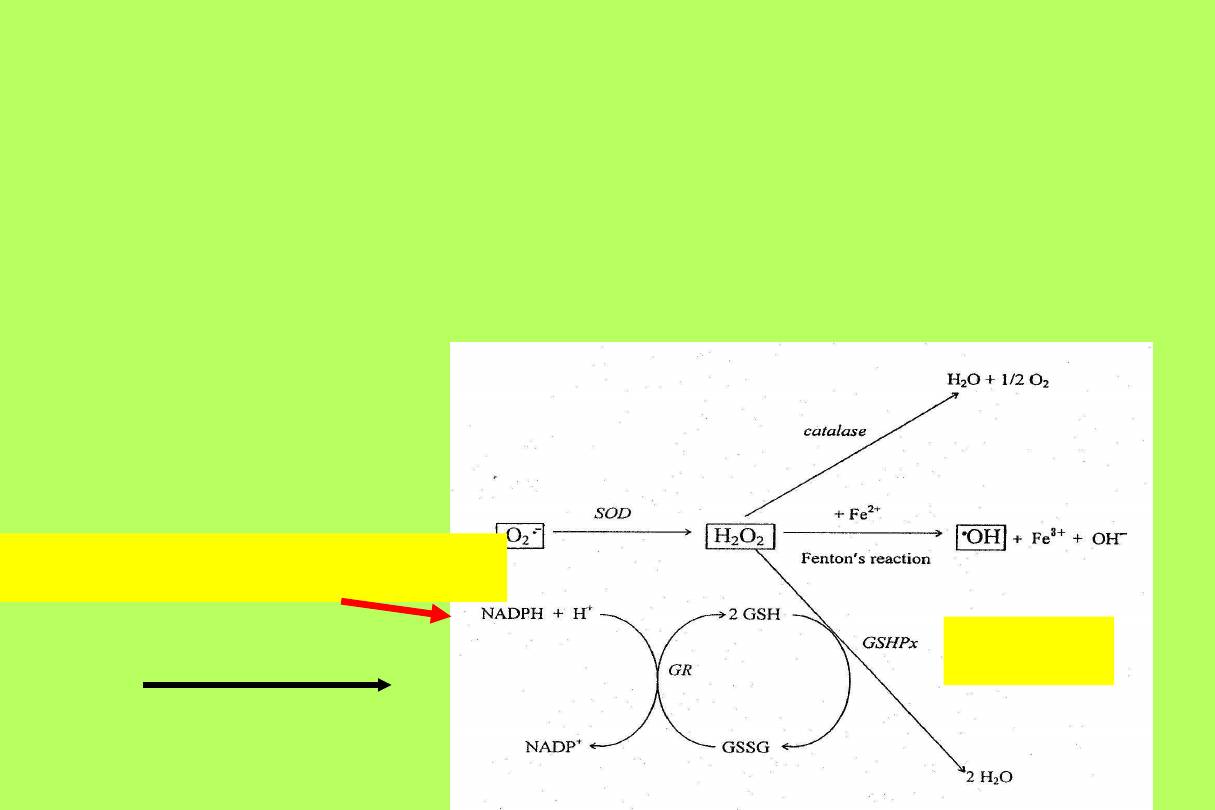
• Związki drobnocząsteczkowe
(glutation)
• Enzymy
(SOD, GSH-Px, katalaza)
Mechanizmy ochronne
Dehydrogenza G6P
Selen
G6P
6PG

Glutation -
niskocząsteczkowy
antyoksydant
• glutation
(GSH, GSSG)
we wszystkich komórkach ssaków (1-10 mmol/l)
Ważny bufor redox
2 GSH GSSG + 2e
-
+ 2H
+
Eliminacja ROS, stabilizacja w zredukowanej
formie
(SH- grupy)
substrat dla peroksydazy glutationowej

Peroksydaza glutationowa
eliminacja wodoronadtlenków i H
2
O
2
2 GSH + ROOH
GSSH + H
2
O + ROH
• Selen
Se = hemoliza erytrocytów, synteza
methemoglobiny

Dysmutaza ponadtlenkowa
Cu
2+
/Zn
2+
SOD (SOD 2)
2O
2. -
+ 2H
+
H
2
O
2
+ O
2
dimer, Cu =
redox
centrum
erytrocyt

NIEDOKRWISTOŚCI
NIEDOKRWISTOŚCI
N
N
iedokrwistość jest stanem,w którym liczba
iedokrwistość jest stanem,w którym liczba
krwinek czerwonych i stężenie Hb zmniejszają
krwinek czerwonych i stężenie Hb zmniejszają
się poniżej wartości optymalnych dla
się poniżej wartości optymalnych dla
organizmu (poniżej granic normy dla płci i
organizmu (poniżej granic normy dla płci i
wieku ).
wieku ).
Kryteria niedokrwistości mężczyźni
Kryteria niedokrwistości mężczyźni
kobiety
kobiety
Stężenie hemoglobiny
< 13,5 g/dl < 11,5
g/dl
Liczba krwinek czerwonych <4,3 T/l <
3,9 T/l
Wskaźnik hematokrytowy < 40%
<
37,0 %

Podział niedokrwistości wg etiologii:
Podział niedokrwistości wg etiologii:
1.
Zmniejszone wytwarzanie ( RBC i/lub Hb)
•
niedoborowe (Fe, B12, kw. foliowy, EPO)
•
nieefektywna hematopoeza
2.
Wzmożony rozpad erytrocytów - hemoliza
•
defekty wewnątrzkrwinkowe (błony komórkowej,
enzymatyczne, hemoglobinopatie)
•
przeciwciała p-krwinkowe
3.
Niedokrwistość pokrwotoczna

Anemia: zmniejszona ilość
hemoglobiny
Anemia związana z niedoborem żelaza
jest:
- wtórnym efektem anemii krwotocznej
- skutkiem spożywania żywności zawierającej
nieodpowiednie ilości żelaza
- skutkiem nieprawidłowego wchłaniania
żelaza
Anemia złośliwa jest wynikiem
:
- niedoboru witaminy B12
- braku „czynnika wewnętrznego”
niezbędnego do wchłaniania B12

Przyczyny niedokrwistości
Przyczyny niedokrwistości
hemolitycznych
hemolitycznych
1. Przyczyny wewnątrzkrwinkowe
•
defekty błony komórkowej: sferocytoza
•
defekty enzymatyczne
:
dehydrogenazy G6P
- różne mutacje w
genie dehydrogenazy G6P (związane z chromosomem X)
•
kinazy pirogronianowej
- różne mutacje w genie izoenzymu R (Red
cell)
•
reduktazy methemoglobinowej
– nieprawidłowa budowa (HbM)
•
hemoglobinopatie (anemia sierpowata, talasemie)
Anemia sierpowata
– wynik uszkodzonego genu kodującego HbS
- HbS ma jeden zmieniony aminokwas w łańcuchu
(Wal Glu)
- ta zmiana powoduje odkształcenie erytrocyta w warunkach niskiego
stężenia tlenu
Talasemie:
nieobecność lub nieprawidłowy łańcuch globiny
w Hb
- erytrocyty są cienkie, delikatne i mają zbyt mało Hb
-TALASEMIE - mutacje w genie -globiny
-TALASEMIE - mutacje w genie -globiny
Enzymopatie krwinkowe
- Wada dotyczy jednego z enzymów glikolitycznych lub enzymów
katalizujących pierwsze etapy w cyklu heksozo-monofosforanowym.
- Nie mają one żadnego znaczenia dla ogólnoustrojowej gospodarki
węglowodanowej. Powodują jednak istotne zaburzenia w obrębie erytrocytów.
- Blok przemiany glikolitycznej powoduje niedobór ATP.
- Blok pierwszych etapów cyklu heksozo-monofosforanowego
powoduje niedobór zredukowanego NADP (NADPH).
- Oba te czynniki mają istotne znaczenie w utrzymaniu prawidłowej
struktury i czynności błony erytrocytów.
- Objawy: niedokrwistość typu hemolitycznego.

Przyczyny niedokrwistości
Przyczyny niedokrwistości
hemolitycznych
hemolitycznych
2. Przyczyny zewnątrzkrwinkowe
• poprzetoczeniowa, konflikt Rh
• polekowe - powstaje HbM – nitroprusydek
sodu, fenacetyna, sulfonamidy, lidokaina,
paracetamol
• wywołane czynnikami fizycznymi lub
chemicznymi (sztuczne zastawki, oparzenia,
jad żmiji, azotany, azotyny, anilina, chloryny)
• infekcje - malaria (Plasmodiumm species),
Mykoplazma
• zatrucie ołowiem

Przyczyny niedokrwistości makrocytowych
Przyczyny niedokrwistości makrocytowych
(megaloblastycznych)
(megaloblastycznych)
Grup
Grup
a
a
Przyczyna
Przyczyna
Niedobór kobalaminy
Niedobór kobalaminy
(witaminy B
(witaminy B
12
12
)
)
Niedobór kwasu
Niedobór kwasu
foliowego
foliowego
(kw.
(kw.
pteroiloglutaminowego)
pteroiloglutaminowego)
I
Niedobory
pokarmowe
1.
Wegetarianizm
2.
Brak lub niedobór pokarmów pochodzenia zwierzęcego
3.
Zespoły wieloniedoborowe
1.
Brak świezych, surowych
pokarmów roślinnych
2.
Długotrwałe gotowanie
3.
Zespoły wieloniedoborowe
II
Zaburzenia
wchłaniania
1.
Choroba Addisona-Biermera
2.
Stan po gastrektomii
3.
Zapalenie żołądka z alkaliczną treścią (zanikowy,
histaminooporny nieżyt żołądka)
4.
Nowotwory przewodu pokarmowego (rak żołądka)
5.
Przewlekła niewydolność zewnątrzwydzielnicza trzustki
6.
Choroby jelita cienkiego
a) sprue (psilosis)
b) celiakia
c) przewlekłe zapalenia przewodu pokarmowego
d) ileitis terminalis
e) stany po radioterapii w zakresie jamy brzusznej
f) nowotwory
g) przetoki
7.
Niepełnowartościowy czynnik wewnętrzny (IF)
8.
Brak receptora jelitowego dla IF/kobalaminy (np. choroba
Imerslund-Grasbecka)
1.
Choroby jelita cienkiego ze złym
wchłanianiem kwasu foliowego
a) sprue (psilosis)
b) celiakia
c) stany po zabiegach
chirurgicznych
d) zespół ślepej pętli
2.
Alkoholizm

Przyczyny niedokrwistości makrocytowych
Przyczyny niedokrwistości makrocytowych
(megaloblastycznych)
(megaloblastycznych)
1.
Metotreksat
2.
Trimetoprim
3.
Fenobarbital i jego pochodne
(niekiedy)
4.
Doustne środki antykoncepcyjne
5.
Sulfonamidy
6.
Antagoniści puryn
1.
Pochodne guanidyny, tzw. Biguanidy
2.
Neomycyna
3.
Kolchicyna
4.
Nadtlenek azotu
B. Wady metaboliczne
A. Zaburzenia polekowe
(w przypadkach równoczesnego stosowania leków)
Niedostateczne
wykorzystanie
III
1.
Niedobór enzymów związanych z
metabolizmem kwasu foliowego
2.
Działanie tzw. antymetabolitów
kwasu foliowego
1.
Niedobór transkobalaminy II (TcII)
2.
Niedobór enzymów zależnych od witaminy
B
12
Niedobór kwasu foliowego
Niedobór kwasu foliowego
(kw. pteroiloglutaminowego)
(kw. pteroiloglutaminowego)
Niedobór kobalaminy
Niedobór kobalaminy
(witaminy B
(witaminy B
12
12
)
)
Przyczyna
Przyczyna
Grup
Grup
a
a

Przyczyny niedokrwistości makrocytowych
Przyczyny niedokrwistości makrocytowych
(megaloblastycznych)
(megaloblastycznych)
1.
Zespoły mieloproliferacyjne
2.
Zespoły limfoproliferacyjne
3.
Niedokrwistości hemolityczne
4.
Ciąża
5.
Intensywny wzrost
6.
Nadczynność gruczołu
tarczowego
7.
Nowotwory złośliwe (tzw. „lite”) z
przerzutami
8.
Nadmierna hemoliza
1.
Zespoły mieloproliferacyjne
2.
Szpiczak mnogi
3.
Zużycie przez bakterie jelitowe lub
pasożyty
a) bruzdogłowiec szeroki
4.
Karmienie długotrwałe piersią przez matki
z niedokrwistością Addisona-Biermera
Zwiększone
zapotrze-
bowanie
IV
Niedobór kwasu
Niedobór kwasu
foliowego
foliowego
(kw.
(kw.
pteroiloglutaminowego)
pteroiloglutaminowego)
Niedobór kobalaminy
Niedobór kobalaminy
(witaminy B
(witaminy B
12
12
)
)
Przyczyna
Przyczyna
Grup
Grup
a
a

Przyczyny niedokrwistości makrocytowych
Przyczyny niedokrwistości makrocytowych
(megaloblastycznych)
(megaloblastycznych)
Wzmożona wybitnie odnowa z hiperretykulocytozą:
- po krwotoku
- w przełomie hemolitycznym
Wzmożon
a
erytropoe
za
V
1.
Niedoczynność gruczołu tarczowego
2.
Przewlekłe choroby wątroby z zaburzonym metabolizmem wit. B
12
3.
Czynniki mielotoksyczne (powodujące aplazję szpiku kostnego)
Inne
VI
Niedobór kwasu
Niedobór kwasu
foliowego
foliowego
(kw.
(kw.
pteroiloglutaminowego)
pteroiloglutaminowego)
Niedobór kobalaminy
Niedobór kobalaminy
(witaminy B
(witaminy B
12
12
)
)
Przyczyna
Przyczyna
Grup
Grup
a
a
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
biologia, pytania (1), PARAZYTOLOGIA II WL, III ROK
mikroby kolo III (2009)
Kowolwium-III-r.-2009
Filozoficzne zagadnienia fizyki wspczesnej, Filozofia 2007-2010, Rok III (2009-2010), Filozoficzne z
Kalendarz przygotowań do matury z WOS III c 2009(1)
krwinkomocz, SEMESTR III, Interna- lek.Sawicki
kinezjologia - wykład ( 15.III.2009), Studia, Studia medyczne
Krwinki biale, III ROK, diagnostyka laboratoryjna
kinezjologia - wykład ( 1.III.2009), Studia, Studia medyczne
Kowolwium III r 2009 doc
tematy OŚ (III 2009, tematyX 85)
tematy SOWiG, SOA (III 2009, tematy 1 57)
wyklad z etyki i?ontologii lekarskiej dla WL III r
WL test 2009
CMPPP Raport niepelnosprawni w oswiacie III 2009
Zagadnienia do egzaminu z wodociągów, studia I stopnia, zaoczne, rok III, 2009 2010
prezentacja klasy I III 25 III 2009
treść referatu z dnia 5 III 2009
więcej podobnych podstron