
dr W. Markowski 2005/2006
ZCHF ANALITYKA
1
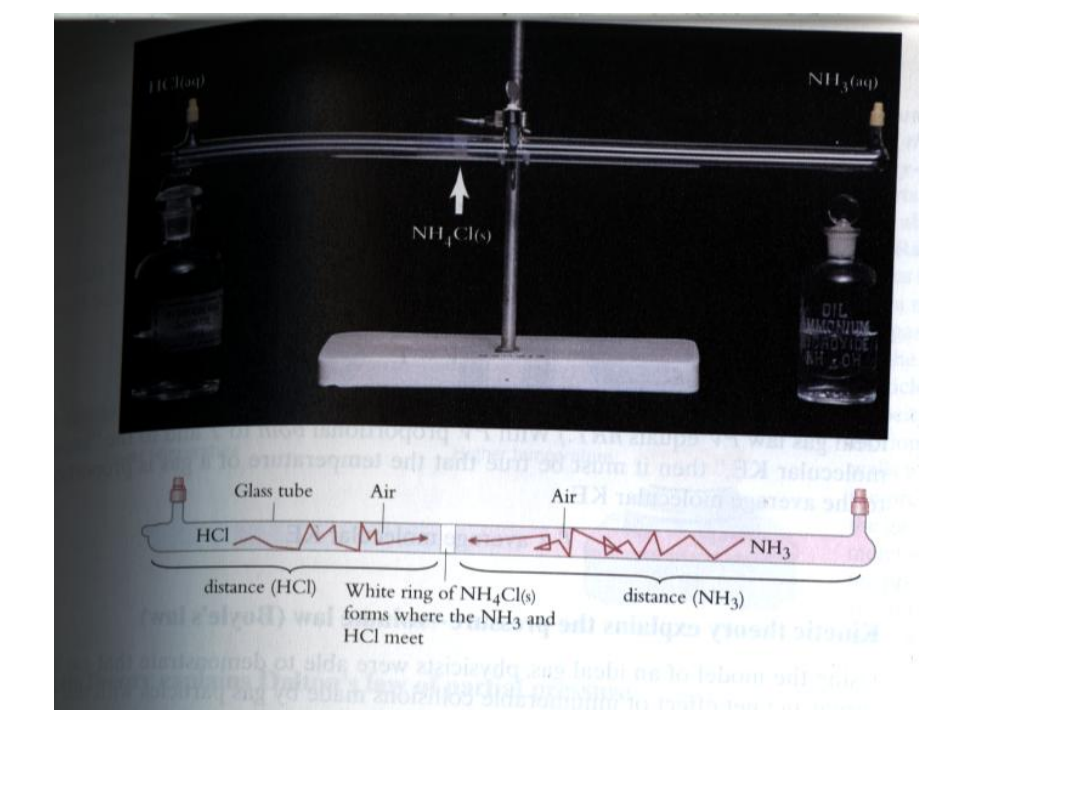
Wykorzystanie efuzji
• Izotopy uranu
• U
235
– paliwo w reaktorach atomowych
• Niskie stężenie w rudzie 0.72%
• U
238
stanowi przeważający%
• Należy wzbogacić do 2-5%
• Właściwości obu identyczne
• Metoda oparta na różnicy mas

dr W. Markowski 2005/2006
ZCHF ANALITYKA
2
Paliwo nuklearne
•
235
UF
6
i
238
UF
6
odpowiednio 349 i
352
• Zatem szybkość efuzji różna –
1,0043 razy więcej
• 1400 zbiorników do osiągnięcia
niezbędnego stopnia wzbogacania.
dr W. Markowski 2005/2006
ZCHF ANALITYKA
3

dr W. Markowski 2005/2006
ZCHF ANALITYKA
4
Gazy rzeczywiste
• Gazy rzeczywiste wykazują pewne
odstępstwa od praw stanu gazu
doskonałego.
• Odstępstwa te są tym większe, im
gaz rzeczywisty znajduje się pod
wyższym ciśnieniem, a jego
temperatura jest bliska temperatury
skroplenia.
• Z czego wynikają te odstępstwa ?

dr W. Markowski 2005/2006
ZCHF ANALITYKA
5
Gazy rzeczywiste
• Przede wszystkim cząsteczki nie są
masami punktowymi, lecz mają
określone wymiary.
• Oznacza to, że cząsteczki nie mogą
swobodnie poruszać się w całej
objętości V.
• Wynikiem tego jest zmniejszenie
swobodnej objętości V

dr W. Markowski 2005/2006
ZCHF ANALITYKA
6
Gazy rzeczywiste
• Drugą przyczyną odchylenia od
zachowania się gazu doskonałego jest
istnienie sił przyciągania między
cząsteczkami.
• Siły takie istnieją w przypadku bardzo
małych odległości między atomami,
cząsteczkami (siły Van der Waalsa).
.

dr W. Markowski 2005/2006
ZCHF ANALITYKA
7
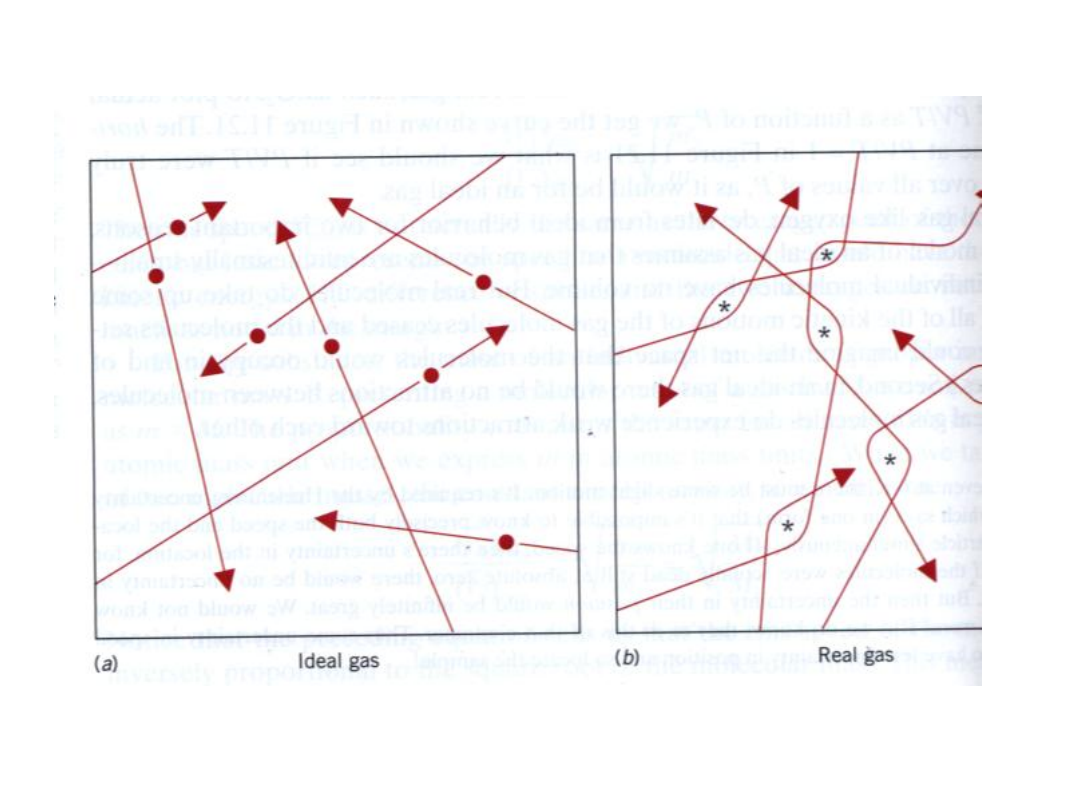
Oddziaływania
• Gazy doskonałe λ > d
• Średnia droga swobodna > od
odległości maksymalnego
zbliżenia(odległości warunkującej
zderzenia)
• Nie ma udziału energii potencjalnej
w energii całkowitej.
dr W. Markowski 2005/2006
ZCHF ANALITYKA
8

dr W. Markowski 2005/2006
ZCHF ANALITYKA
9
Gazy rzeczywiste
• W rzeczywistości wszystkie
cząsteczki oddziałują nawzajem, o
ile tylko znajdą się dostatecznie
blisko siebie.
• Model uwzględniający wyłącznie
energię kinetyczną stanowi tylko
przybliżenie.

dr W. Markowski 2005/2006
ZCHF ANALITYKA
10
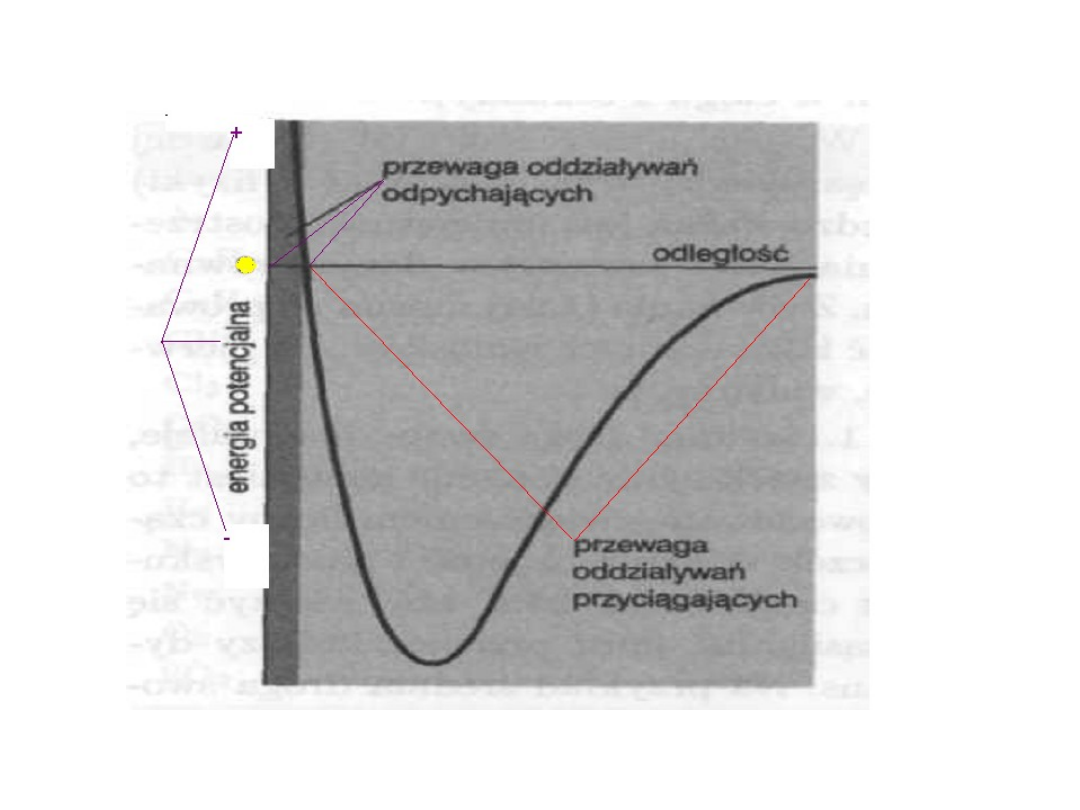
Oddziaływanie
międzycząsteczkowe
• Dwa udziały:
• Przyciągania l~ kilku średnicom
• Odpychania l ~ rzędu średnicy
cząsteczek

dr W. Markowski 2005/2006
ZCHF ANALITYKA
11
Przyciąganie
• Odpowiada za skraplanie gazu
(odpowiednia temperatura)
• Temperatura niska – taka że
energia kinetyczna jest już
niewystarczająca do pokonania sił
przyciągania

dr W. Markowski 2005/2006
ZCHF ANALITYKA
12
Odpychanie
• Odpowiada, że ciecze i ciała stałe mają
skończoną objętość
• Odpowiadają za pojawienie się udziału
energii potencjalnej w całkowitej energii.
• Przyciąganie wnosi ujemny wkład
(energia potencjalna ujemna)
• Odpychanie – energia potencjalna
dodatnia
dr W. Markowski 2005/2006
ZCHF ANALITYKA
13

dr W. Markowski 2005/2006
ZCHF ANALITYKA
14
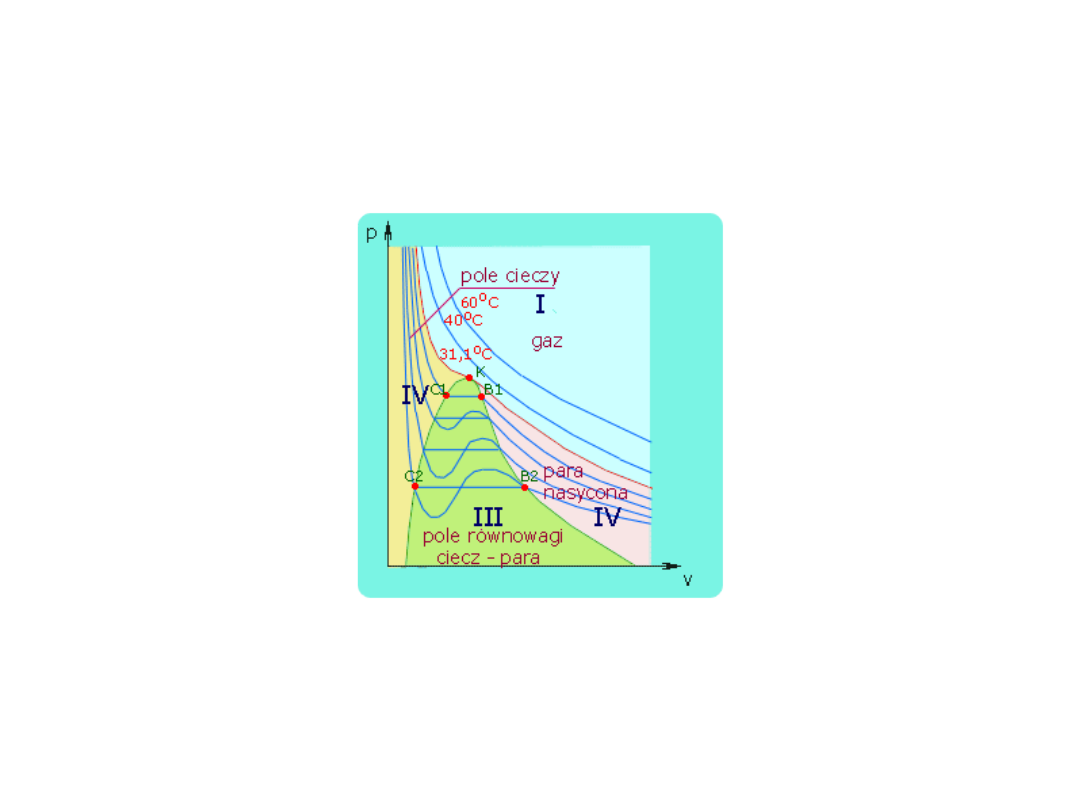
Makroskopowy przejaw
oddziaływań
• Wpływ oddziaływań przejawia się
w makroskopowych
właściwościach.
• Kształt izoterm gazów
rzeczywistych odbiega od
przewidzianego prawem Boyle’a
(kiedy p >> 0) następny
rysunek:
dr W. Markowski 2005/2006
ZCHF ANALITYKA
15
Gazy rzeczywiste

dr W. Markowski 2005/2006
ZCHF ANALITYKA
16
Izotermy ditlenku węgla
• W wyższej temperaturze przypominają
izotermy gazu doskonałego
• Izoterma w temp. 20 C występuje
odcinek poziomy co oznacza
możliwość skroplenia przy
zastosowaniu odpowiedniego ciśnienia
• Rozpatrzmy co się dzieje w pkt A, B,C
D, E, F na przedstawionym poprzednio
rysunku.

dr W. Markowski 2005/2006
ZCHF ANALITYKA
17
Skraplanie
• Od punktu C do E – nie wymagamy
zastosowania zwiększenia ciśnienia
• Od punktu E znaczne zwiększenie
ciśnienia potrzebne do
zmniejszenia objętości
• Faktycznie punkt E odpowiada
odległości cząsteczek w cieczach

dr W. Markowski 2005/2006
ZCHF ANALITYKA
18
Gazy rzeczywiste
• Siły te maleją ze wzrostem
temperatury, ponieważ jej wzrost
polega na zwiększeniu stopnia
nieuporządkowania wskutek
przypadkowego ruchu cząsteczek,
których prędkość wzrasta wraz ze
wzrostem temperatury.
•
dr W. Markowski 2005/2006
ZCHF ANALITYKA
19

dr W. Markowski 2005/2006
ZCHF ANALITYKA
20
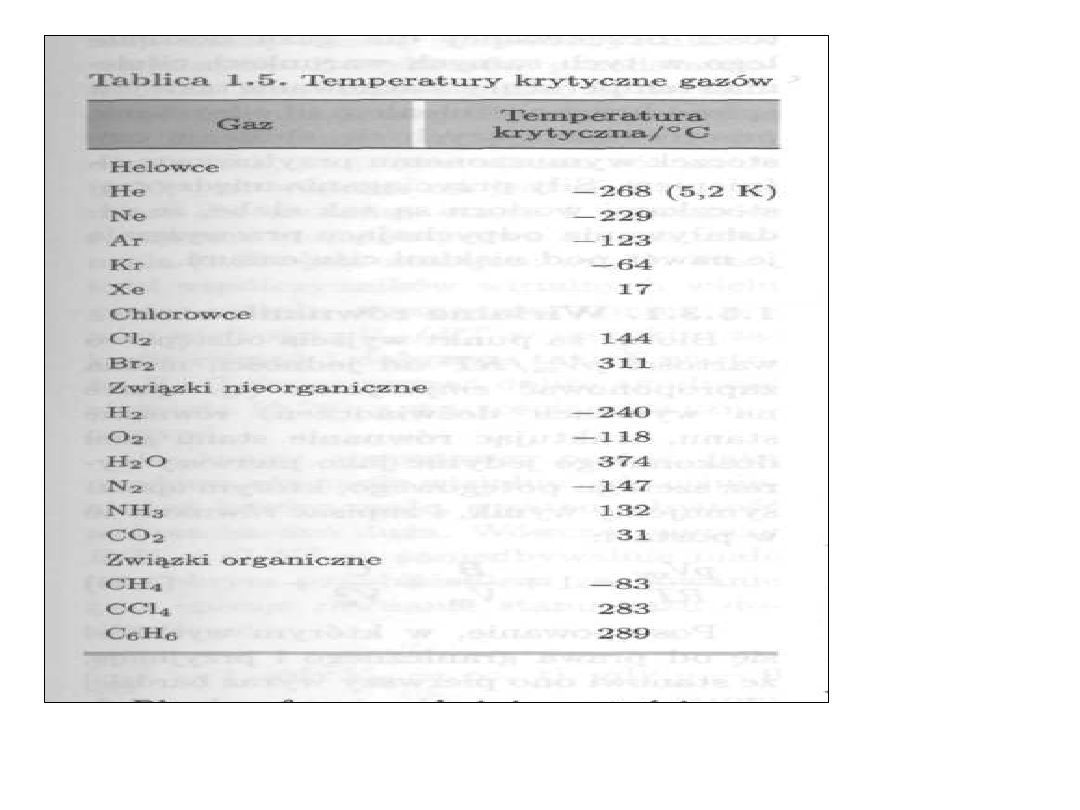
Temperatura krytyczna
• Niemożliwe jest skroplenie gazu
na ciecz przez jego sprężenie, o
ile temperatura jest wyższa od
temperatury krytycznej

dr W. Markowski 2005/2006
ZCHF ANALITYKA
21
Zanik granicy fazowej
• Ogrzewanie cieczy w zamkniętym
zbiorniku
• rośnie gęstość gazu
• Maleje gęstość cieczy
• W temperaturze krytycznej
zanikają dwie fazy

dr W. Markowski 2005/2006
ZCHF ANALITYKA
22
Stan nadkrytyczny
• Płynna faza o dużej gęstości powstaje , gdy
spręży się gaz w temperaturze wyższej od T
kr
• Nie można uznać za ciecz, gdyż nie tworzy
powierzchni swobodnej oddzielającej od jej
pary.
• Fazy nadkrytyczne stosowane są jako
rozpuszczalniki .
• np.. Nadkrytyczną fazę dwutlenku węgla
ekstrahuje się kofeinę w produkcji kawy
bezkofeinowej. Smak i brak toskyczności.
dr W. Markowski 2005/2006
ZCHF ANALITYKA
23

dr W. Markowski 2005/2006
ZCHF ANALITYKA
24
Równanie stanu gazów
rzeczywistych
• Napiszmy równanie gazu w
postaci:
1
nRT
pV
RT
pV
m
m

dr W. Markowski 2005/2006
ZCHF ANALITYKA
25
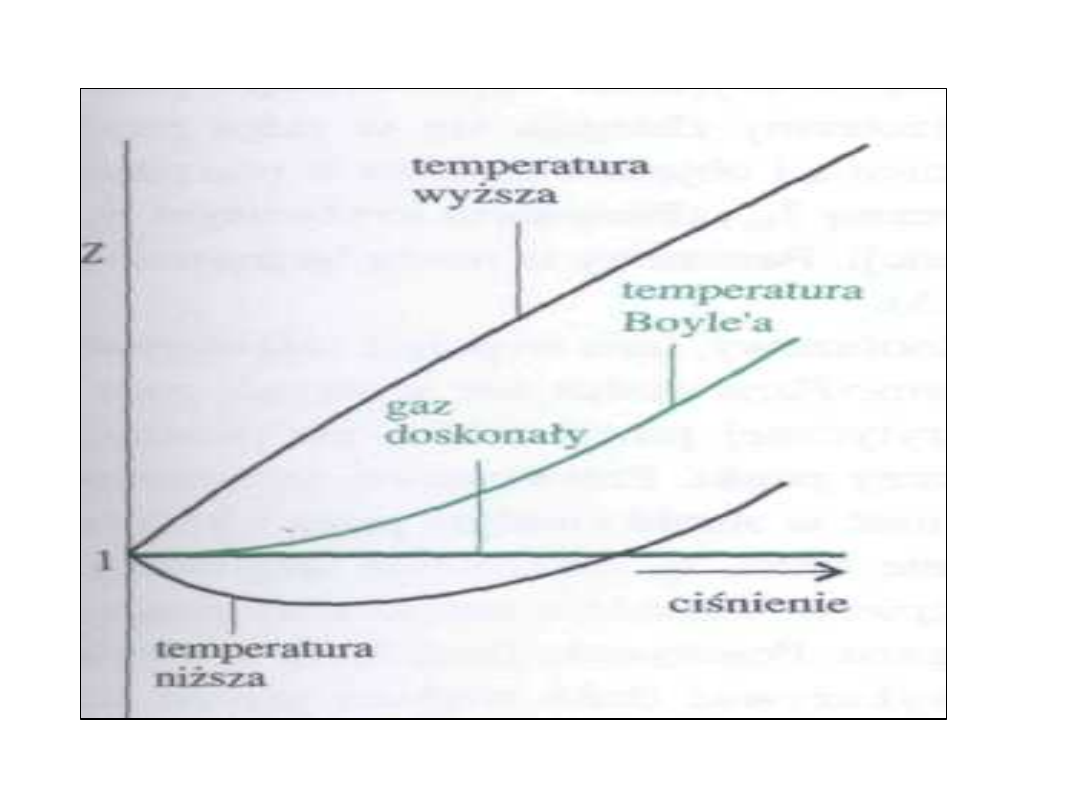
Współczynnik ściśliwości
• Poprzednie równanie sugeruje
wartość jeden dla wszystkich gazów.
• W rzeczywistości wartość ta różni się
od jedności i zależy od ciśnienia.
• Odchylenia są wywołane
oddziaływaniami
międzycząsteczkowymi.
dr W. Markowski 2005/2006
ZCHF ANALITYKA
26

dr W. Markowski 2005/2006
ZCHF ANALITYKA
27
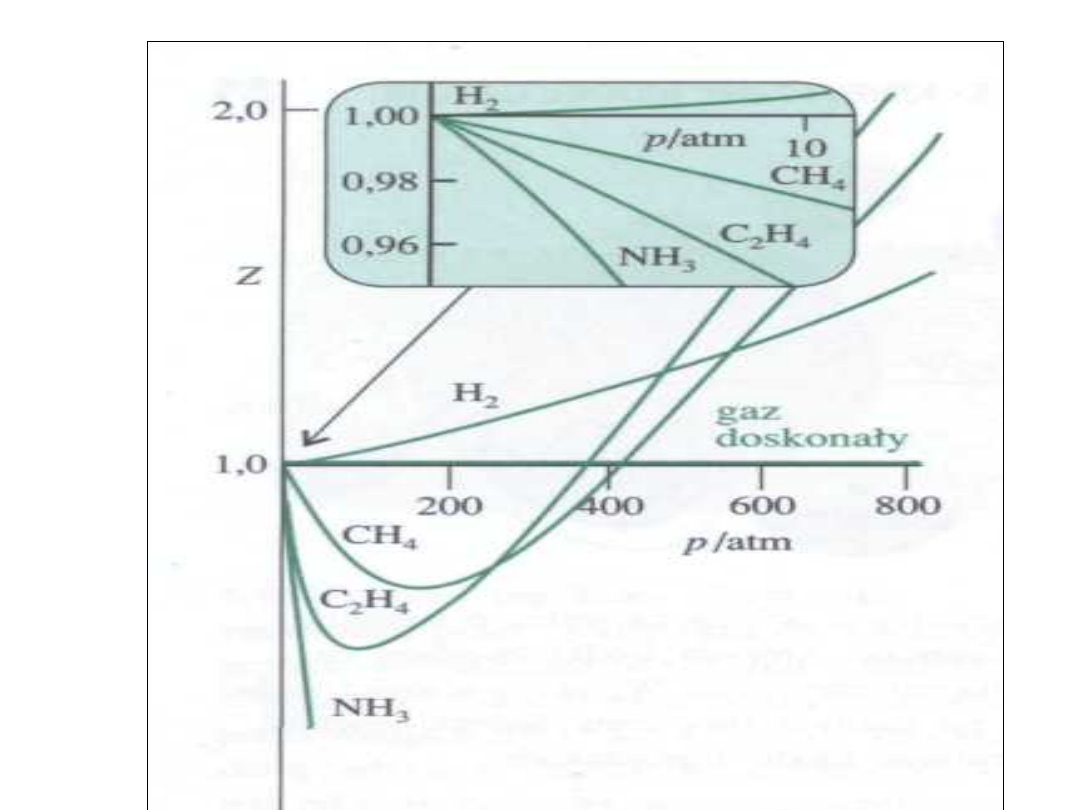
Z- odstępstwa od 1
• Wykres przedstawia z = f(p) dla
temperatury 0 C.
• Wodór wykazuje z >1 zawsze
• Pozostałe gazy z < 1 w początkowej
fazie i z > 1 przy wysokich
ciśnieniach
• Z > 1 oznacza V
m
> od wartości
oczekiwanej (siły odpychania)
dr W. Markowski 2005/2006
ZCHF ANALITYKA
28

dr W. Markowski 2005/2006
ZCHF ANALITYKA
29
Współczynnik wirialny
• Wirialne równanie:
...
1
2
m
m
m
V
C
V
B
RT
pV

dr W. Markowski 2005/2006
ZCHF ANALITYKA
30
Prawo graniczne
• Postępowanie, w którym wychodzi
się od prawa granicznego i
przyjmuje, że stanowi ono
pierwszy wyraz bardziej złożonego
wyrażenia, jest w chemii fizycznej
dość powszechne

dr W. Markowski 2005/2006
ZCHF ANALITYKA
31
Gazy rzeczywiste
• Van der Waals wprowadził poprawki
do gazowego równania stanu
gazowego uwzględniające wzajemne
oddziaływanie cząsteczek i objętość
własną cząsteczek.
• Dla 1 mola gazu rzeczywistego
równanie van der Waalsa ma postać
• (p + a/V
2
)(V-b) = RT /6-14/

dr W. Markowski 2005/2006
ZCHF ANALITYKA
32
Gazy rzeczywiste
• gdzie: V - oznacza objętość gazu
rzeczywistego, p - ciśnienie, R -
stała gazowa, T - temperatura w
Kelvinach, a i b - stałe
charakterystyczne dla danego
gazu rzeczywistego

dr W. Markowski 2005/2006
ZCHF ANALITYKA
33
Gazy rzeczywiste
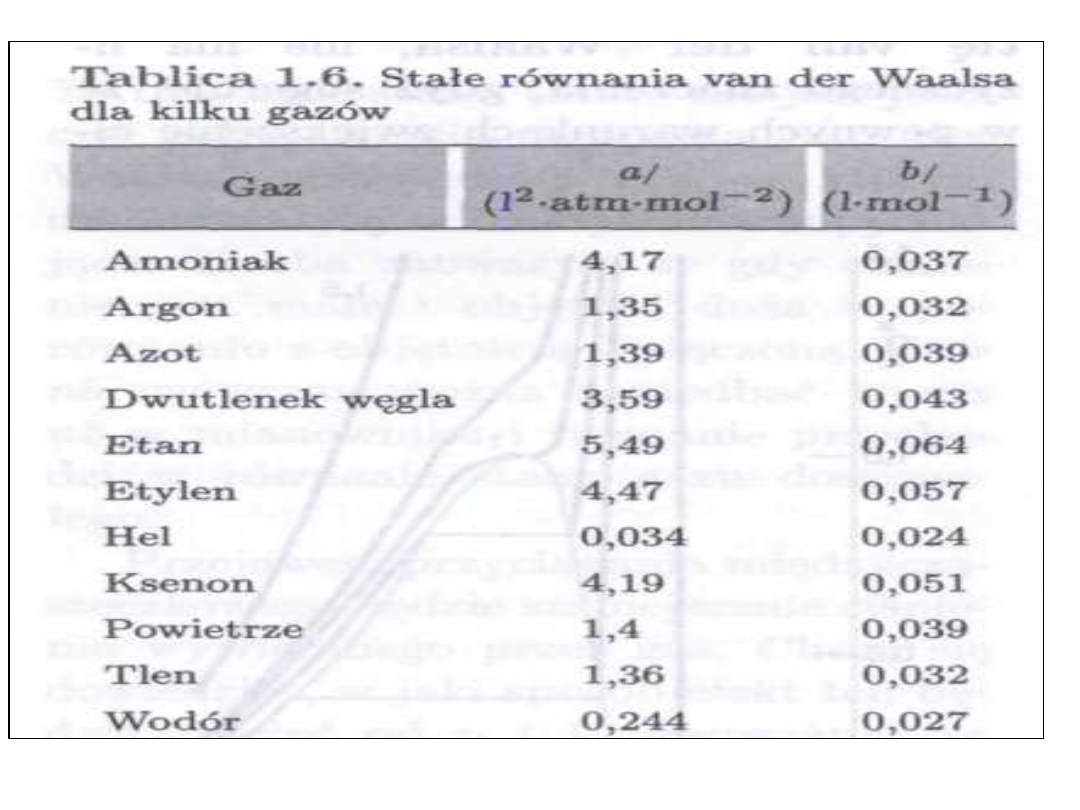
• Wartość a jest stałą wynikająca z
istnienia sił przyciągania
międzycząsteczkowego, natomiast
b jest poprawką związaną z
objętością własną cząsteczek gazu.

dr W. Markowski 2005/2006
ZCHF ANALITYKA
34
Gazy rzeczywiste
• Poprawka a/V
2
nosi nazwę
ciśnienia wewnętrznego gazu.
Dodaje się ją do ciśnienia
zewnętrznego p dlatego, że
ciśnienia te mają zgodny kierunek
działania.

dr W. Markowski 2005/2006
ZCHF ANALITYKA
35
Gazy rzeczywiste
• Poprawka b zależy od wielkości i kształtu
cząsteczki gazu rzeczywistego, oznacza
tzw sferę działania cząsteczek i jest
równa w przybliżeniu poczwórnej
objętości własnej cząsteczek. Poprawkę b
wynikającą z istnienia objętości własnej
cząsteczek odejmuje się od całkowitej
objętości v zajmowanej przez gaz.
dr W. Markowski 2005/2006
ZCHF ANALITYKA
36

dr W. Markowski 2005/2006
ZCHF ANALITYKA
37
Gazy rzeczywiste
• Zachowanie się gazu
rzeczywistego poddanego
sprężaniu w różnych
temperaturach można przedstawić
graficznie. Na rysunku 6.5
przedstawiono szereg izoterm
otrzymanych doświadczalnie dla
CO
2
w różnych temperaturach.

dr W. Markowski 2005/2006
ZCHF ANALITYKA
38
PODSUMOWANIE
• Barometr, manometr, jednostki ciśnienia
• Prawa gazowe –równanie Clasiusa –
Clapeyrona
• Warunki standardowe STP
• Stała gazowa i stała Boltzmana
• Ułamek molowy
• Prawo Daltona i ciśnienia cząstkowe
• Prawo Grahama efuzji

dr W. Markowski 2005/2006
ZCHF ANALITYKA
39
Przykładowe zadania
• Zad 1.
• Przelicz 1,26 atm na Torr.
• Zad.2 Zakładając, że skonstruowano
barometr stosując ciecz o gęstości
1,22 g/mL, Jaki będzie poziom
cieczy w barometrze, jeżeli
ciśnienie atmosferyczne wynosiło
755 Torr. Gęstość rtęci 13,6 g/mL

dr W. Markowski 2005/2006
ZCHF ANALITYKA
40
Zadania
• Wzór h
B
=h
A
x d
A
/d
B
• Zad.3
• Oblicz wartość stałej gazowej w następujących
jednostkach mL x Torr x mol
-1
x K
-1
• Zad. 4
• Jaki jest skład procentowy powietrza
wewnątrz płuc jeżeli ciśnienie cząstkowe
wynoszą:
• N
2
= 570 Torr, O
2
= 103 Torr, CO
2
= Torr

dr W. Markowski 2005/2006
ZCHF ANALITYKA
41
Zadania
• Zad. 5
• Gęstość CO
2
wynosi 1,96 gL
-1
i
gęstość N
2
1,25 gL
-1
. Który z
gazów wypływa szybciej? Jaki
będzie stosunek szybkości efuzji
azotu do ditlenku węgla.
•
A
B
A
B
B
A
M
M
d
d
v
v
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
Wyszukiwarka
Podobne podstrony:
Goethe Zertifikat B2 MODELLSATZ Kandidatenblätter
NG1 KARTA AROWA AR B2
SEKCJA B2, Dokumenty MON, Album sprzętu bojowego
teoria b2, OTŻ, AGROFIZYKA
KRAKÓW OLSZANICA 4 TABLICA B2
B2 Maksimum
belka B2
b2
b2 4
B2 Poprawnosc Gramatyczna
B2 016 lepkospr polimery id 755 Nieznany (2)
22 12 10 02 12 55 Egz podst Ana2 B2
Lista słownictwa poziom B2
B2
i love polish, b2 przyimki miejscownik1
ZD B2, B2
B2 Wyznaczanie siły elektromotorycznej i oporu wewnętrznego
więcej podobnych podstron