
Hemoglobin
Hemoglobin
a –
a –
właściwości
właściwości
i regulatory
i regulatory
allosteryczn
allosteryczn
e, efekt
e, efekt
Bohra
Bohra

Białko allosteryczne
Białko allosteryczne
białko, w którym mogą wystąpić
oddziaływania między przestrzennie
oddalonymi miejscami w cząsteczce,
powodujące zmianę konformacji i
zaburzenia jego aktywności
biologicznej; najlepiej poznanym
białkiem allosterycznym jest
hemoglobina (konsekwencja IV-
rzędowej struktury); właściwości białek
allosterycznych ma też wiele enzymów,
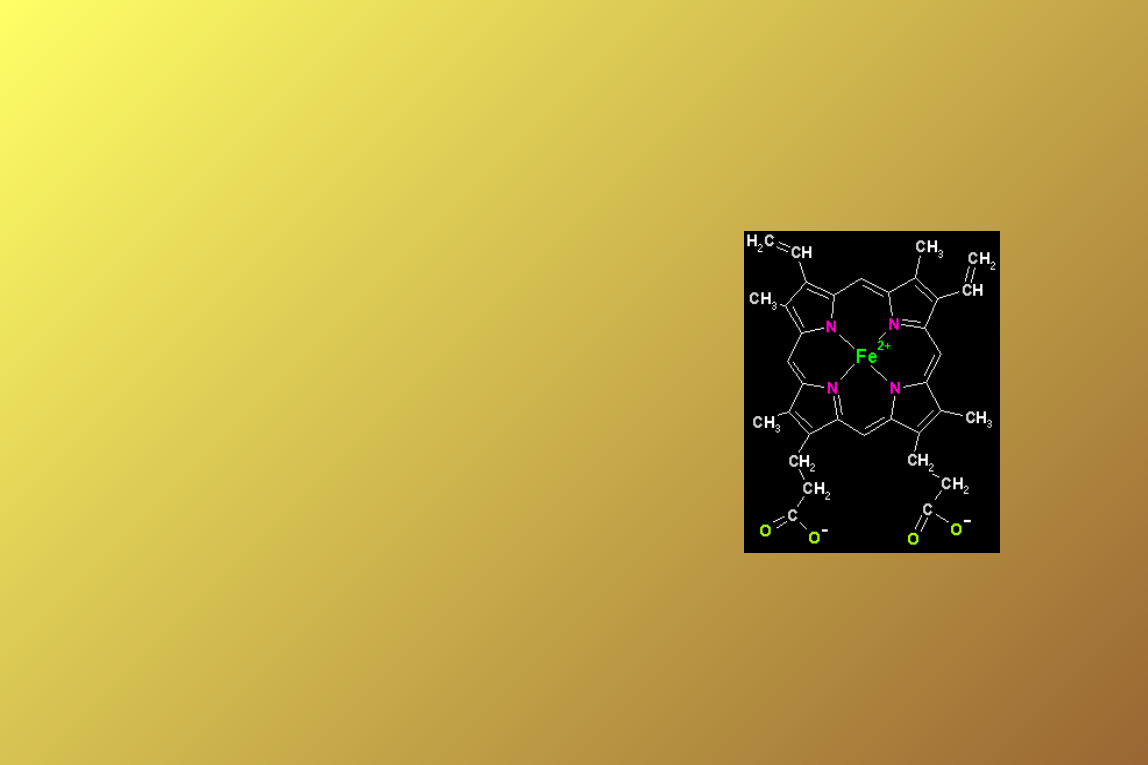
2 pary łańcuchów
polipeptydowych + 4
cząsteczki hemu,
III- i II-rzędowa struktura
podobna do mioglobiny
(ułożenie hemu,
podobieństwo aminokwasów
i ilości odcinków helikalnych),
Fe(II)- żelazo na drugim
stopniu utlenienia umożliwia
wiązanie tlenu (1
hemoglobina- 4 częsteczki
tlenu),
Hemoglobin
Hemoglobin
a
a
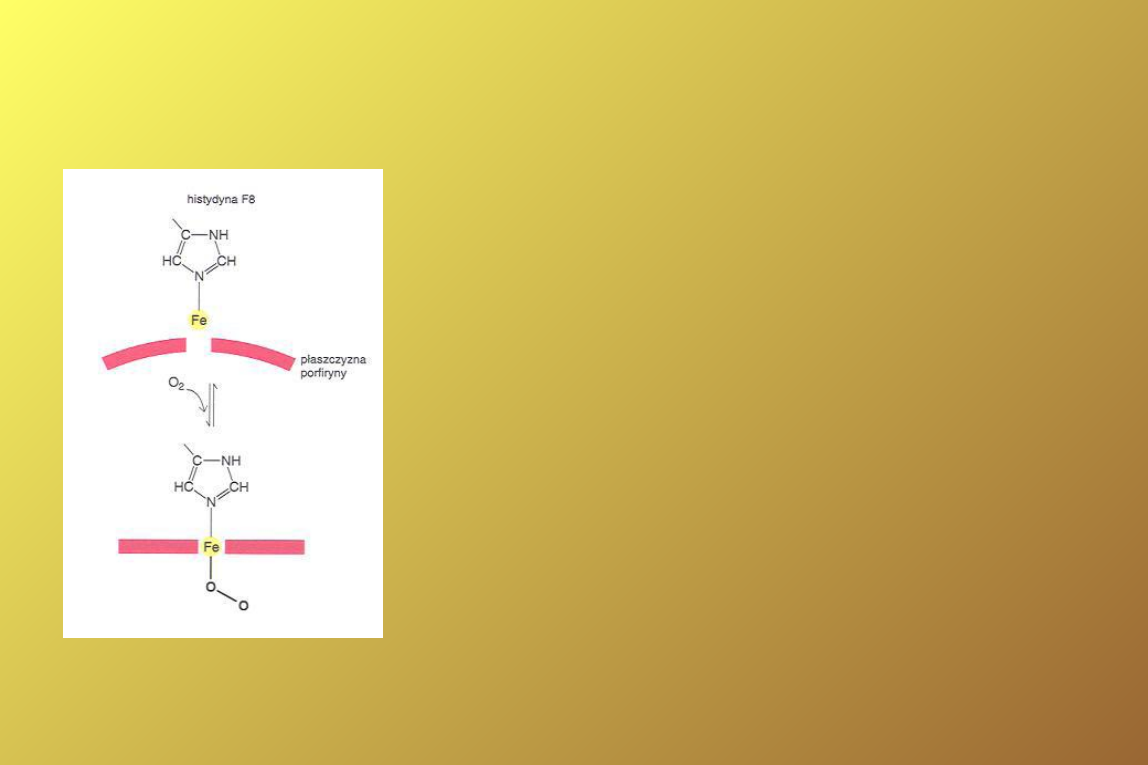
Zmiany konformacji
Zmiany konformacji
Podczas wiązania O
2
do
deoksyHb, atom Fe wsuwa się w
płaszczyznę hemu, pociągając
za sobą histydynę proksymalną
i reszty aminokwasowe,
Następuje zerwanie mostków
solnych między podjednostkami
hemoglobiny,
Para podjednostek α/β obraca
się w stosunku do drugiej pary o
15° (forma Ti R),

Regulatory allosteryczne
Regulatory allosteryczne
Czynniki regulujące wiązanie tlenu
przez hemoglobinę,
1. kationy wodoru H
+
(pH) → efekt
Bohra
2. dwutlenek węgla CO
2
3. 2,3- bisfosfoglicerynian (BPG)

1. Efekt Bohra
Odwracalne zjawisko wiązania 2O
2
i protonu wodoru,
W TKANKACH : Odłączeniu O
2
towarzyszy wiązanie
protonu, (skąd proton?) CO2+ H2O ↔ H2CO3↔ H++
HCO-3
W PŁUCACH : Przyłączanie O
2
powoduje uwolnienie
protonu, (co z protonem? Równanie wyżej, przy
użyciu anhydrazy węglanowej)
Protony wodoru powstają z mostków solnych po
przyłączeniu tlenu do formy T hemoglobiny. Zmiana
w R hemoglobinę powoduje rozerwanie owych
mostków

2. CO
2
5-30% CO
2
transportowany przy użyciu
hemoglobiny,
Reakcja z końcowymi grupami aminowymi
podjednostek hemoglobiny → karbaminian
CO
2
+ Hb-NH
3
+
↔ 2H
+
+ Hb-NH-COO
-
Zmiana ładunku umożliwia tworzenie
mostków, oddawanie tlenu,

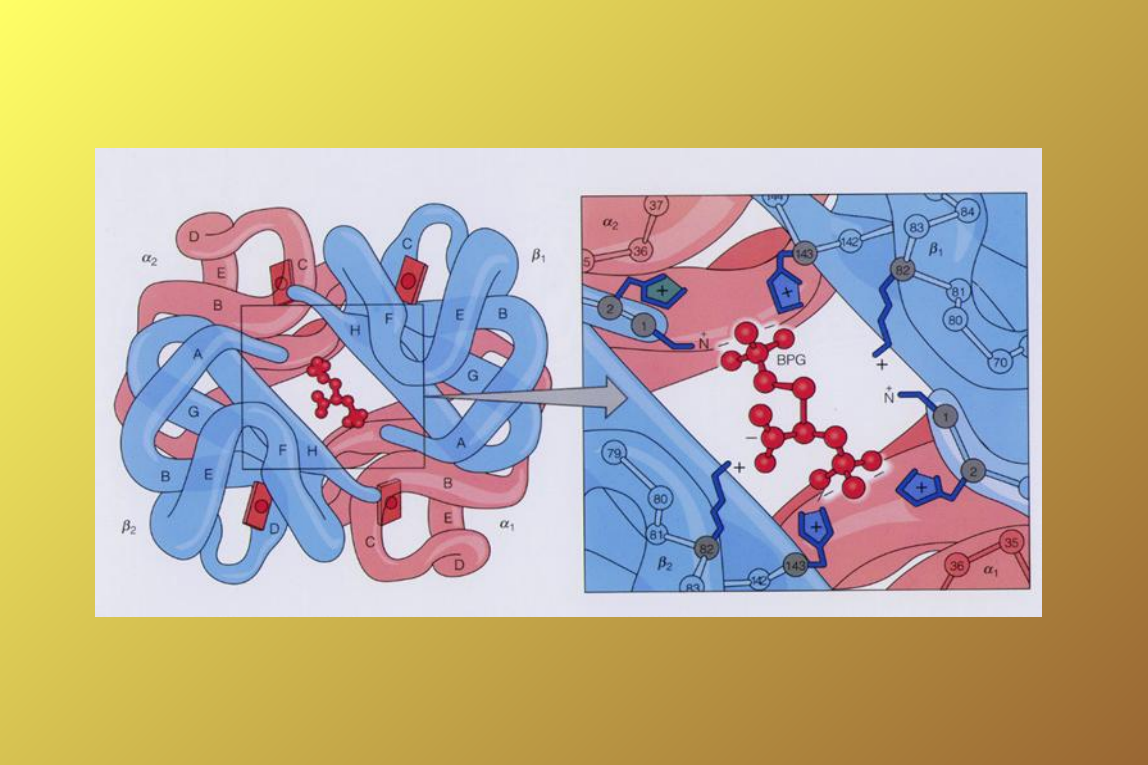
3. BPG
Syntetyzowany w erytrocytach z 1,3 –
bisfosfoglicerynianu (pochodzi z
glikolizy),
1 BPG na 1 cząsteczkę hemoglobiny,
Zajmuje centrum cząsteczki, mieści się
tylko w formie T, łączy sę za pomocą
mostków solnych ( udział N-końcowych
grup aminowych)
Document Outline
Wyszukiwarka
Podobne podstrony:
hemoglobina
Hemoglobina
Hemoglobina+PUŁAP TLEN+ ZMECZENIE.prv, fizjologia notatki
Odtworzono hemoglobinę mamuta
hemoglobina
WYKLADY CWICZENIA TESTY, CWICZENIE II HEMOGLOBINA, ĆWICZENIE II
lista 4 hemoglobina 1
hemoglobina 1
Czynniki wpływające na stopień wysycenia hemoglobiny tlenem, BILOGIA, FIZJOLOGIA CZŁOWIEKA
hemoglobina
Wykres zależności?sorpcji od długości?li dla roztworu hemoglobiny
4. Hemoglobina ilość, Lekarski WLK SUM, lekarski, biochemia, cykl crebsa, puryny i pirymidyny
KREW-koniec hemoglobina, STUDIA, Fizjologia
Hemoglobina jako modelowe białko czynnościowe(1)
więcej podobnych podstron