
Hemoglobina
Hemoglobina
jako modelowe
jako modelowe
białko
białko
czynnościowe.
czynnościowe.

•
Hemoglobina
Hemoglobina
(skrót-
(skrót-
Hb
Hb
lub
lub
HGB
HGB
) -
) -
czerwony barwnik krwi, białko zawarte w
czerwony barwnik krwi, białko zawarte w
erytrocytach, którego zasadniczą funkcją jest
erytrocytach, którego zasadniczą funkcją jest
przenoszenie tlenu - przyłączanie go w
przenoszenie tlenu - przyłączanie go w
płucach i uwalnianie w tkankach.
płucach i uwalnianie w tkankach.
•
Możliwe jest to dzięki podjednostkowej
Możliwe jest to dzięki podjednostkowej
budowie hemoglobiny.
budowie hemoglobiny.
•
Właściwości allosteryczne hemoglobiny
Właściwości allosteryczne hemoglobiny
stanowią ponadto model do zrozumienia
stanowią ponadto model do zrozumienia
innych białek allosterycznych.
innych białek allosterycznych.

•
Wśród kompleksów spotykanych
Wśród kompleksów spotykanych
w przyrodzie do najważniejszych
w przyrodzie do najważniejszych
zaliczyć możemy kompleks
zaliczyć możemy kompleks
żelazo-porfirynowy, obecny w
żelazo-porfirynowy, obecny w
hemie hemoglobiny i
hemie hemoglobiny i
mioglobiny- białkach wiążących
mioglobiny- białkach wiążących
tlen we krwi i w mięśniach.
tlen we krwi i w mięśniach.
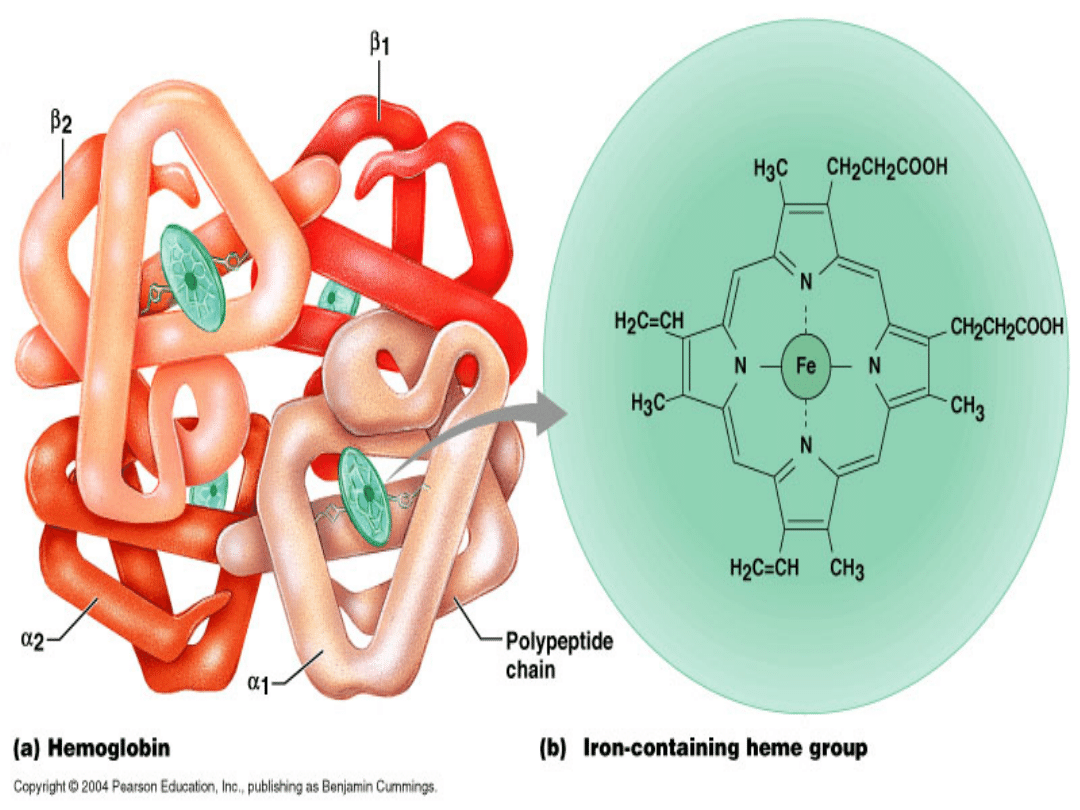

•
Hemoglobina jest białkiem złożonym, więc
Hemoglobina jest białkiem złożonym, więc
przyjmuje strukturę IV rzędową. Zbudowana
przyjmuje strukturę IV rzędową. Zbudowana
jest z czterech podjednostek (dwóch alfa
jest z czterech podjednostek (dwóch alfa
złożonych ze 141 aminokwasów i dwóch beta
złożonych ze 141 aminokwasów i dwóch beta
złożonych ze 146 aminokwasów), nazywamy
złożonych ze 146 aminokwasów), nazywamy
ją tetramerem. Kodowana jest przez dwa
ją tetramerem. Kodowana jest przez dwa
geny. Każda z podjednostek tworzy osiem
geny. Każda z podjednostek tworzy osiem
alfa helis i zawiera swoją własną
alfa helis i zawiera swoją własną
prostetyczną grupę hemową, zatem może
prostetyczną grupę hemową, zatem może
wiązać w sumie cztery cząsteczki tlenu.
wiązać w sumie cztery cząsteczki tlenu.

•
Przyłączenie O2 przez jeden z hemów
Przyłączenie O2 przez jeden z hemów
ułatwia wiązanie kolejnych cząsteczek
ułatwia wiązanie kolejnych cząsteczek
O2 przez pozostałe
O2 przez pozostałe
grupy hemowe.
grupy hemowe.
To
To
kooperatywne wiązanie tlenu z
kooperatywne wiązanie tlenu z
hemoglobiną jest właściwością
hemoglobiną jest właściwością
pozwalającą na wiązanie maksymalnej
pozwalającą na wiązanie maksymalnej
ilości O2 w płucach i uwalnianie
ilości O2 w płucach i uwalnianie
maksymalnej ilości O2 w tkankach
maksymalnej ilości O2 w tkankach
.
.

Utlenowaniu
Utlenowaniu
hemoglobiny
hemoglobiny
towarzyszą zmiany
towarzyszą zmiany
konformacji białka:
konformacji białka:

•
Przyłączeniu O2 towarzyszy rozerwanie wiązań
Przyłączeniu O2 towarzyszy rozerwanie wiązań
poprzecznych między końcami karboksylowymi
poprzecznych między końcami karboksylowymi
wszystkich czterech podjednostek hemoglobiny
wszystkich czterech podjednostek hemoglobiny
co powoduje zmiany w drugo- , trzecio- i
co powoduje zmiany w drugo- , trzecio- i
czwartorzędowej strukturze białka.
czwartorzędowej strukturze białka.
•
Czwartorzędową strukturę częściowo
Czwartorzędową strukturę częściowo
utlenowanej hemoglobiny określa się jako
utlenowanej hemoglobiny określa się jako
stan
stan
T(naprężony)
T(naprężony)
a całkowicie utlenowanej
a całkowicie utlenowanej
hemoglobiny (HbO2) jako
hemoglobiny (HbO2) jako
stan
stan
R(rozluźniony).
R(rozluźniony).

•
Oprócz transportu tlenu z płuc do tkanek ,
Oprócz transportu tlenu z płuc do tkanek ,
hemoglobina bierze udział w przenoszeniu
hemoglobina bierze udział w przenoszeniu
CO2 z tkanek do płuc, skąd jest on usuwany
CO2 z tkanek do płuc, skąd jest on usuwany
podczas oddychania. Bezpośrednio po
podczas oddychania. Bezpośrednio po
odłączeniu tlenu cząsteczka hemoglobiny
odłączeniu tlenu cząsteczka hemoglobiny
wiąże CO2 w ilości stanowiącej ok.15% CO2
wiąże CO2 w ilości stanowiącej ok.15% CO2
transportowanego przez krew. CO2 wchodzi w
transportowanego przez krew. CO2 wchodzi w
reakcje z końcowymi grupami
reakcje z końcowymi grupami
-aminowymi
-aminowymi
hemoglobiny tworząc karbaminian. Tworzeniu
hemoglobiny tworząc karbaminian. Tworzeniu
karbaminianu towarzyszy uwolnienie protonów
karbaminianu towarzyszy uwolnienie protonów
współodpowiedzialnych za efekt Bohra.
współodpowiedzialnych za efekt Bohra.

Reakcja
Reakcja

•
W warunkach niedoboru tlenu w tkankach
W warunkach niedoboru tlenu w tkankach
zwiększa się zawartość 2,3-
zwiększa się zawartość 2,3-
bifosfoglicerynianu(BPG). Związek ten tworzy
bifosfoglicerynianu(BPG). Związek ten tworzy
się z 1,3-bifosfoglicerynianu , będącego
się z 1,3-bifosfoglicerynianu , będącego
metabolitem pośrednim glikolizy. BPG wiąże
metabolitem pośrednim glikolizy. BPG wiąże
się z hemoglobiną w stosunku 1 cząsteczka
się z hemoglobiną w stosunku 1 cząsteczka
BPG na tetrametryczną cząsteczkę
BPG na tetrametryczną cząsteczkę
hemoglobiny a miejscem wiązania jest
hemoglobiny a miejscem wiązania jest
przestrzeń między czterema podjednostkami,
przestrzeń między czterema podjednostkami,
znajdująca się w centrum cząsteczki
znajdująca się w centrum cząsteczki
hemoglobiny.
hemoglobiny.

•
Przebywaniu na dużych wysokościach
Przebywaniu na dużych wysokościach
towarzyszą takie zmiany fizjologiczne,
towarzyszą takie zmiany fizjologiczne,
jak wzrost liczby erytrocytów, stężenia
jak wzrost liczby erytrocytów, stężenia
hemoglobiny oraz BPG. Wzrost
hemoglobiny oraz BPG. Wzrost
stężenia BPG powoduje zmniejszenie
stężenia BPG powoduje zmniejszenie
powinowactwa hemoglobiny do tlenu i
powinowactwa hemoglobiny do tlenu i
w konsekwencji wzrost zdolności
w konsekwencji wzrost zdolności
hemoglobiny do uwalniania tlenu w
hemoglobiny do uwalniania tlenu w
tkankach.
tkankach.

•
Hemoglobina pełni też
Hemoglobina pełni też
funkcje układu buforowego
funkcje układu buforowego
chroniącego organizm przed
chroniącego organizm przed
szkodliwym wpływem
szkodliwym wpływem
zwiększenia kwasowości krwi.
zwiększenia kwasowości krwi.
•
Mamy tu do czynienia z
Mamy tu do czynienia z
efektem Bohra.
efektem Bohra.

•
Najczęściej występujące
Najczęściej występujące
hemoglobiny mają następujący skład
hemoglobiny mają następujący skład
tetrameru: Hba (podstawowa
tetrameru: Hba (podstawowa
hemoglobina prawidłowa u ludzi
hemoglobina prawidłowa u ludzi
dorosłych) , HbF(hemoglobina
dorosłych) , HbF(hemoglobina
płodowa), HbS (hemoglobina
płodowa), HbS (hemoglobina
sierpowatych krwinek czerwonych)
sierpowatych krwinek czerwonych)
HbA2 (hemoglobina prawidłowa u
HbA2 (hemoglobina prawidłowa u
ludzi dorosłych stanowiąca ok. 2,5%
ludzi dorosłych stanowiąca ok. 2,5%
Hb całkowitej).
Hb całkowitej).

Bibliografia:
Bibliografia:
•
Murray K. R., Granner K. D., Mayes A.
Murray K. R., Granner K. D., Mayes A.
P., Rodwell W. V.
P., Rodwell W. V.
Biochemia Harpera.
Biochemia Harpera.
Warszawa, Wydawnictwo Lekarskie
Warszawa, Wydawnictwo Lekarskie
PZWL, 1994
PZWL, 1994
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
Afera FOZZ jako modelowy przykład funkcjonowania zakulisowych wymiarów transformacji ustrojowej w Po
2 Program jako zestaw planowanych czynnoòci pedagogicznych
E nawigacja jako proces modelowania
Psychologia dziecka Rozdział 8 Modelowanie czynności umysłowych
referat czynnosci nauczyciela i uczniow podczas pokazu jako metody ksztalcenia, Podręczniki, Pedagog
Diagnozowanie struktury motywacji jako determinanty modelowania zachowań organizacyjnych
czynnosci nauczyciela i uczniow podczas dyskusji jako metody ksztalcenia, Podręczniki, Pedagogika,
drozdze jako organizm modelowy08, genetyka
Przeszukanie jako czynność procesowa, Szkoła, Edukacja Policyjna
referat czynnosci nauczyciela i uczniow podczas pogadanki jako metody kształcenia
15-06, W postępowaniu administracyjnym rozumianym jako ciąg czynności procesowych podejmowanych prze
ROZWÓJ MOWY CZYNNOŚCI JĘZYKOWYCH I KOMUNIKACYJNYCH JAKO CZYNNIK ROZWOJU SPOŁECZNEGO U DZIECI W WIEKU
Wózek inwalidzki jako proteza czynnościowa
POZNANIE JAKO CZYNNOŽĂ ŽWIADOMA, Filozofia, Materiały do zajęć, Epistemologia
E nawigacja jako proces modelowania
więcej podobnych podstron