
Potencjometr
Potencjometr
ia
ia
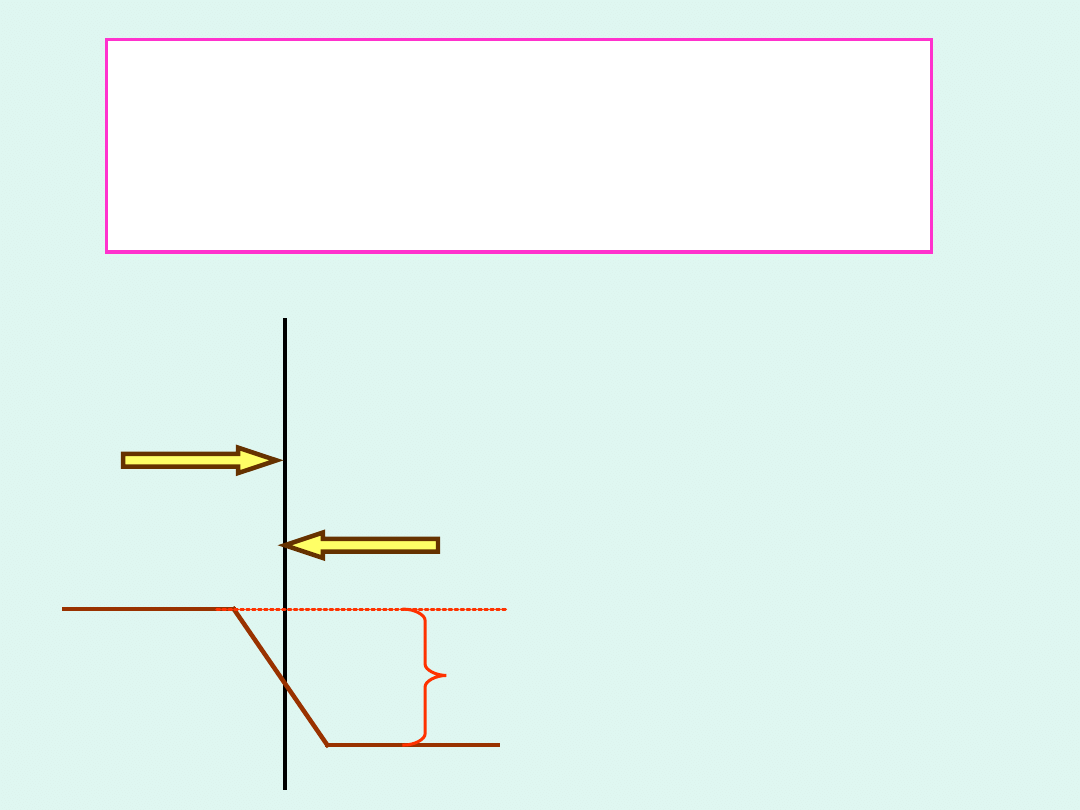
Półogniwo
to układ złożony z
przewodnika elektronowego (metalu)
i przewodnika jonowego (roztworu
elektrolitu).
Przez
granicę
międzyfazową następuje
przepływ ładunku w
obie strony. W stanie
równowagi
prądy
wymiany w obie strony
są jednakowe :
i
+
= |i
-
|
a
na
granicy
międzyfazowej
ustala
się
równowagowy
rozkład ładunku i skok
potencjału
elektrycznego.
met
al
roztwór
elektrolitu
i
+
i
-
+
+
+
+
+
-
-
-
-
-

Ogniwo galwaniczne
Ogniwo
galwaniczne
to
układ
złożony z dwu półogniw, w którym
entalpia swobodna reakcji chemicznej
red-oks zamieniana jest na pracę
elektryczną, a wymiana elektronów
pomiędzy reagentami nie zachodzi
bezpośrednio, a poprzez przewodnik
metaliczny łączący elektrody obu
półogniw.
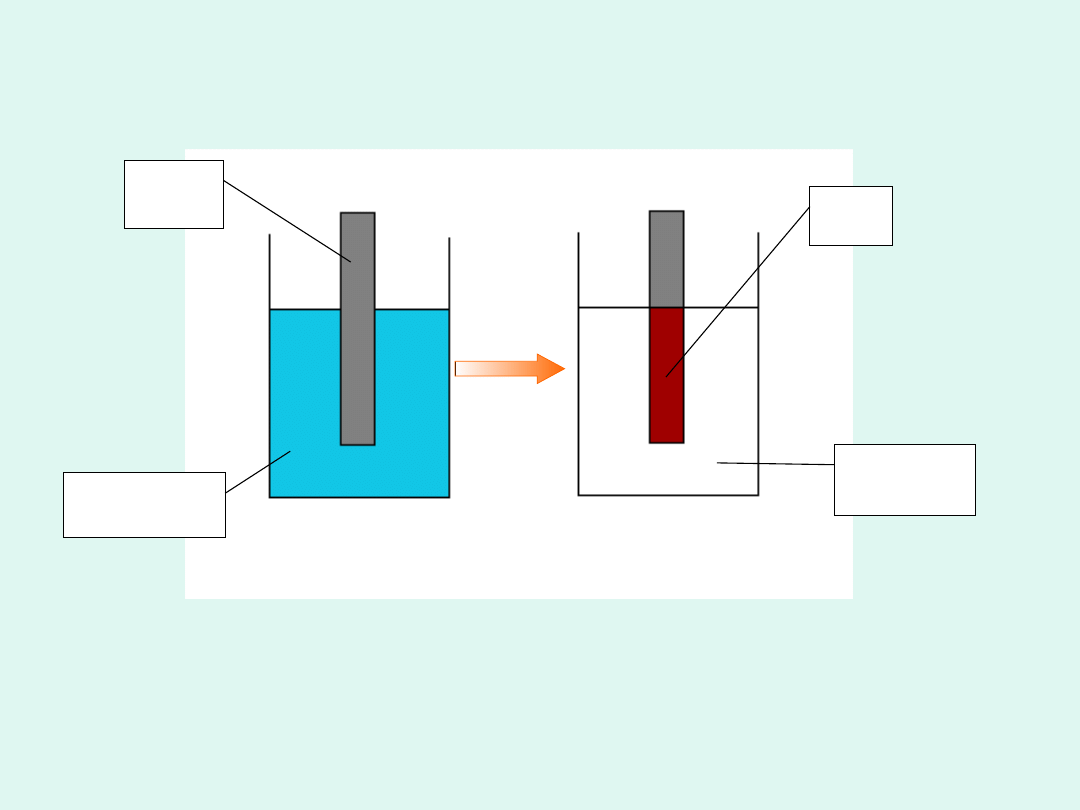
Wyjaśnienie definicji ogniwa
galwanicznego
CuSO
4
Zn
Cu
ZnSO
4
( )
( )
( )
( )
2
2
s
s
aq
aq
Zn
Cu
Zn
Cu
+
+
+
�
+
W tym układzie zachodzi w sposób
nieodwracalny reakcja :
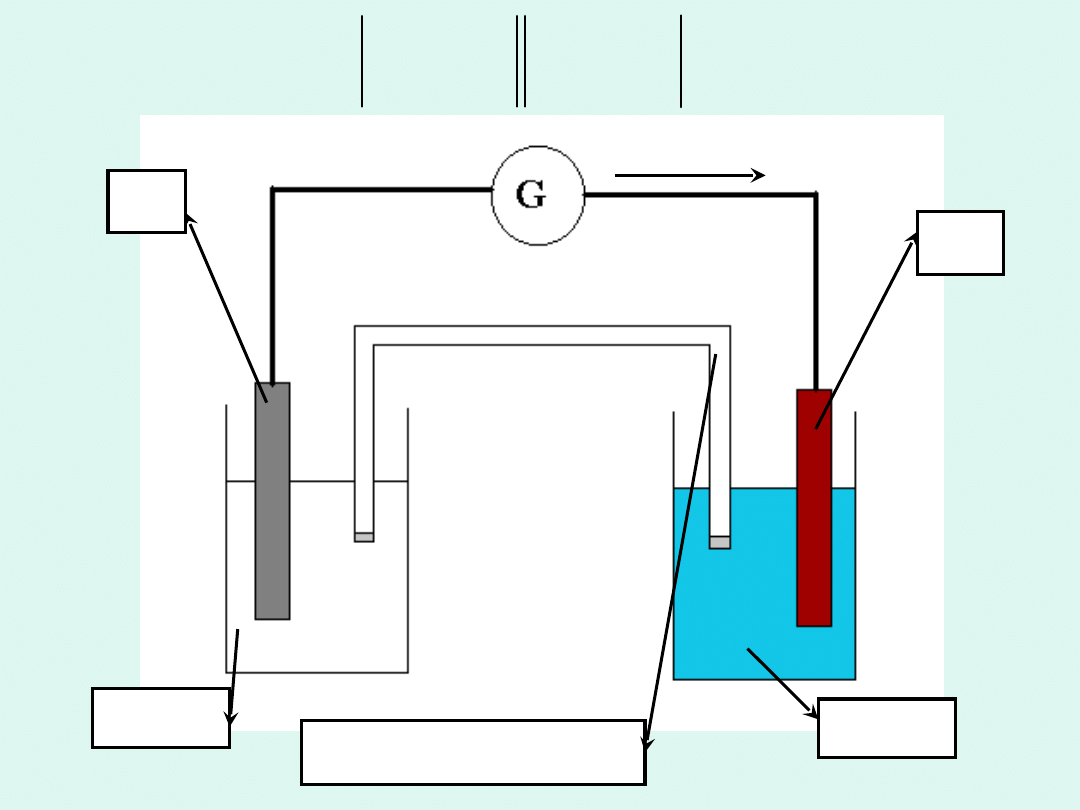
e
Zn
ZnSO
4
Cu
CuSO
4
klucz
elektrolityczny
s
2
aq
2
aq
s
Cu
Cu
Zn
Zn

Siła elektromotoryczna ogniwa
Siła elektromotoryczna ogniwa
jest to
różnica
potencjałów
pomiędzy
elektrodami, gdy ogniwo nie pracuje (jest
otwarte), to znaczy opór zewnętrzny jest
nieskończenie wielki, a natężenie prądu
płynącego przez ogniwo wynosi zero.
I 0
E limU
�
=
W tak zdefiniowanych warunkach zostaje zachowany
równowagowy
skok
potencjału
na
granicach
międzyfazowych w obu półogniwach. Definicja siły
elektromotorycznej wskazuje, jakie warunki muszą być
spełnione przy jej pomiarze – przez ogniwo nie może
przepływać prąd.

Metody pomiaru siły
elektromotorycznej
Metoda kompensacyjna Poggendorfa
Metoda bezpośrednia
Metoda kompensacyjna ma obecnie znaczenie
historyczne, gdyż współczesne woltomierze mają
bardzo duże opory wewnętrzne i zapewniają, że
pomiar jest w zasadzie bezprądowy.
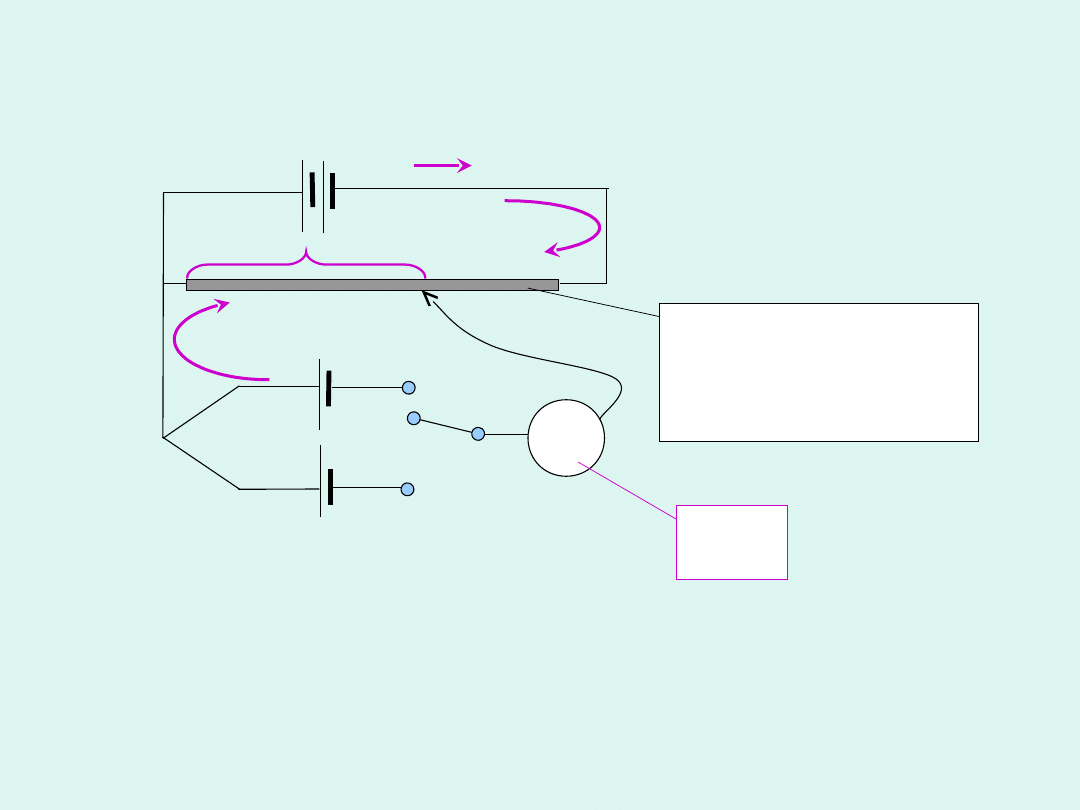
Metoda kompensacyjna
Poggendorfa
Poszukuje się takiego oporu na potencjometrze, aby
galwanometr pokazywał zerowy prąd. Wówczas
spadek napięcia na potencjometrze jest równy co do
wartości sile elektromotorycznej ogniwa, ale z
przeciwnym znakiem.
G
potencjometr
(opornik o
zmiennym
oporze)
C
K
S
X
I
I =
0
U=I·R

wz
x
wz
x
x
x
wz
wz
R
R
E
E
I
R
E
I
R
E
U
E
Pomiar siły elektromotorycznej tą metodą jest
pomiarem porównawczym.
Dla ogniwa
wzorcowego
Dla ogniwa
badanego
Jako ogniwa wzorcowego używa się
ogniwa
Westona
.
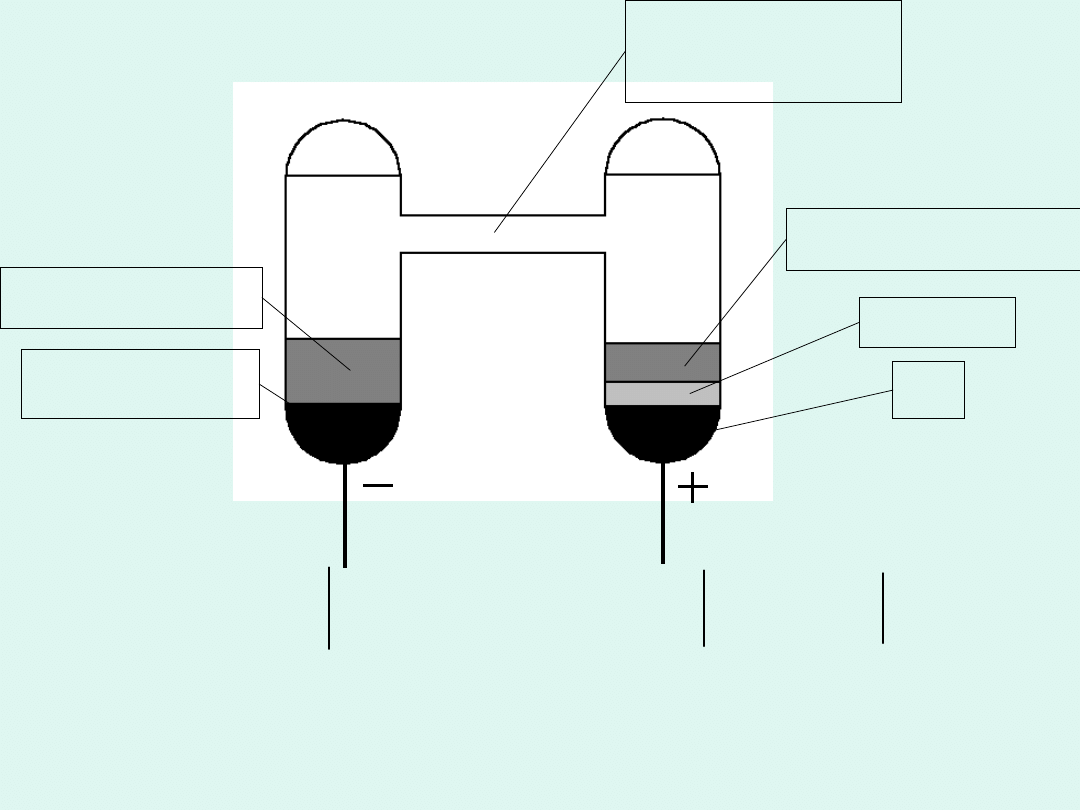
CdSO
4
·8/3
H
2
O
(
)
(
)
( )
( )
( )
( )
( )
( )
4
2
4
12,5% w Hg
roztwór nasycony
s
2
2
2
Hg
4 s
aq
4 aq
c
Cd
CdSO
Hg SO
Hg
Cd
Hg SO
Cd
SO
2Hg
+
-
+
�
+
+
(
)
(
)
(
)
[ ]
2
3
o
5
7
9
E
1,01830 4,075 10
t 20 9,444 10
t 20
9,8 10
t 20 V
-
-
-
=
-
�
-
-
�
-
+
�
-
nasycony
roztwór
CdSO
4
Cd
(Hg)
12,5%
CdSO
4
·8/3 H
2
O
Hg
Hg
2
SO
4
Ogniwo Westona
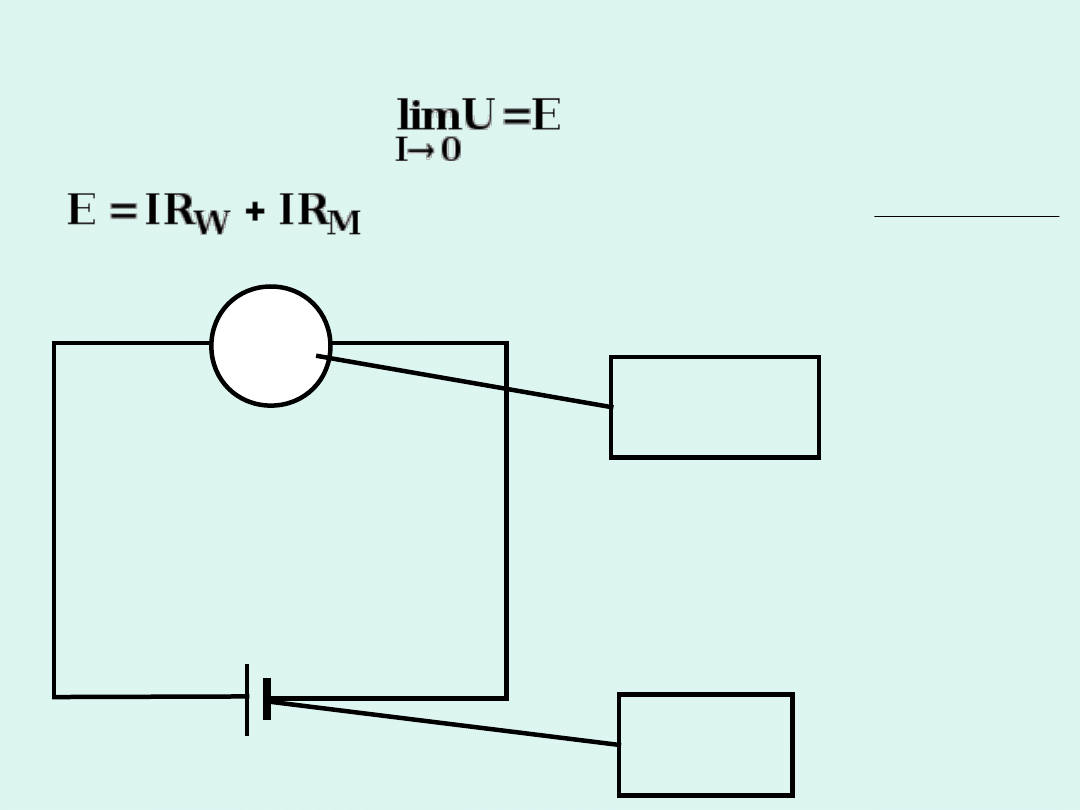
V
woltomier
z
R
M
ogniwo
R
W
E
Metoda bezpośrednia
W
M
W
W
M
R
R
R
E
E
IR
E
IR
U
Gdy
R
M
» R
W
,
to
I → 0
i
U → E

Zapis reakcji w ogniwie -
konwencja
Jeżeli mamy schemat ogniwa, to w
prawym
półogniwie
zachodzi
redukcja
(pobieranie
elektronów), a w
lewym półogniwie
–
utlenianie
(oddawanie elektronów.
Jeśli mamy reakcję i rozłożymy ją na
redukcję i utlenianie, to schemat ogniwa
zapisujemy tak, aby redukcja zachodziła w
prawym półogniwie, a utlenianie w lewym
półogniwie.
Siła elektromotoryczna ogniwa jest różnicą
potencjałów prawego i lewego półogniwa.
L
P
E
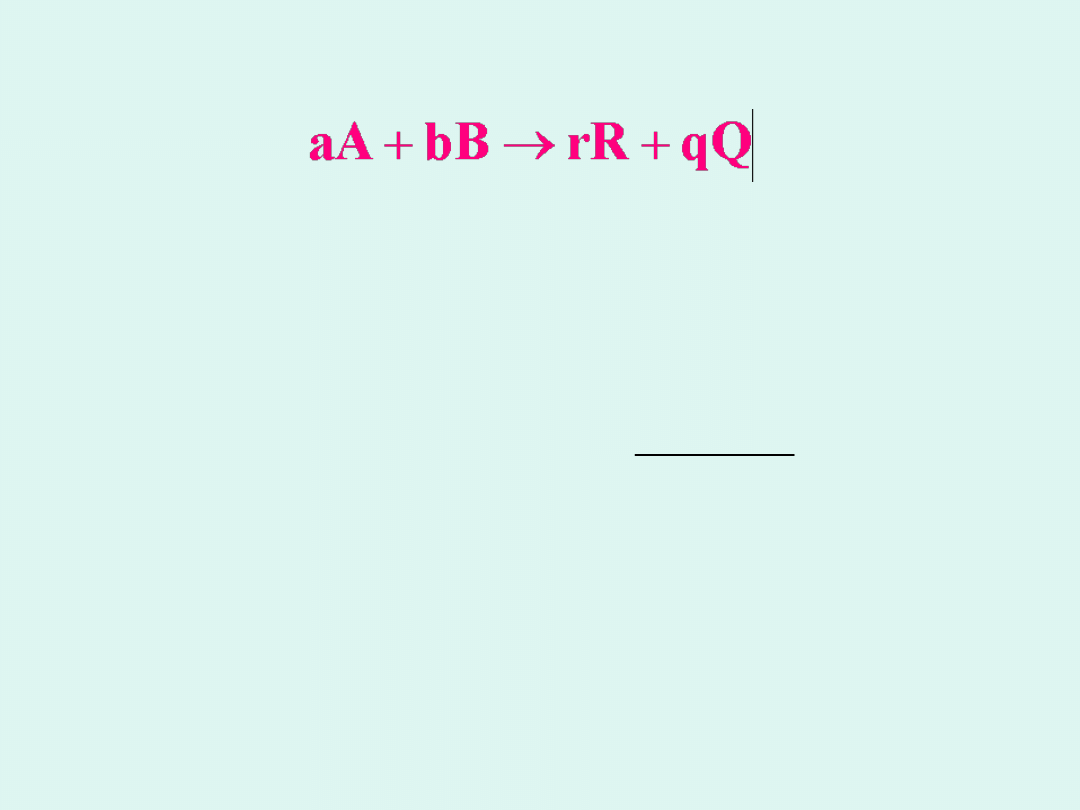
Wzór Nernsta
Jeżeli w układzie zamkniętym zachodzi reakcja
chemiczna w stałej temperaturze i przy stałym
ciśnieniu (
p,T = const
), to siłą napędową procesu
jest entalpia swobodna wyrażona
izotermą van’t
Hoffa
:
b
B
a
A
q
Q
r
R
o
r
r
a
a
a
a
RT
G
G
ln
Jeśli reakcja zachodzi w sposób odwracalny, to zmiana
entalpii swobodnej jest równa pracy nieobjętościowej –
w przypadku ogniwa pracy polegającej na
przeniesieniu ładunku w polu elektrycznym o różnicy
potencjałów równej sile elektromotorycznej.

q
U
w
w
G
el
el
p
T
,
Gdy liczba postępu reakcji zmieni się o 1, to ładunek
przeniesiony w ogniwie wynosi :
E
U
zF
q
z
– liczba elektronów wymienianych w reakcji
b
B
a
A
q
Q
r
R
o
r
b
B
a
A
q
Q
r
R
o
r
a
a
a
a
zF
RT
F
z
G
E
F
z
a
a
a
a
RT
G
E
F
z
ln
ln

Wzór Nernsta
Jeżeli
E > 0
to reakcja w ogniwie przebiega w
sposób samorzutny z lewa na prawo (tak jak jest
zapisana).
Jeżeli
E < 0
to reakcja w ogniwie przebiega w
sposób samorzutny z prawa na lewo (w odwrotnym
kierunku niż jest zapisana).
Jeżeli
E = 0
to reakcja osiągnęła stan równowagi.
o
o
r
E
F
z
G
E
o
to
standardowa
siła
elektromotoryczna ogniwa, w którym
aktywności wszystkich reagentów są
równe jedności.
b
B
a
A
q
Q
r
R
o
a
a
a
a
zF
RT
E
E
ln
Termodynamika reakcji
przebiegającej w ogniwie
o
a
a
o
r
zFE
K
RT
K
RT
G
ln
ln
RT
zFE
K
o
a
ln
Standardowa entalpia swobodna reakcji
przebiegającej w ogniwie :
o
o
r
zFE
G
Powyższy wzór pozwala na obliczenie stałej
równowagi reakcji na podstawie standardowych
potencjałów półogniw.
o
L
o
P
o
E

o
r
p
o
o
r
p
o
r
S
T
zFE
S
T
G
p
o
o
r
T
E
zF
S
Standardowa entropia reakcji przebiegającej
w ogniwie.
Aby wyznaczyć standardową entropię reakcji
przebiegającej w ogniwie, należy zmierzyć
standardową siłę elektromotoryczną ogniwa
w kilku temperaturach, następnie dopasować
funkcję
opisującą
zależność
E
o
od
temperatury
i
obliczyć
jej
pierwszą
pochodną.

Znając standardową entalpię swobodną i
standardową entropię można wyznaczyć
standardową entalpię reakcji przebiegającej
w ogniwie.
p
o
o
o
r
o
r
o
r
o
r
o
r
o
r
o
r
T
E
T
E
zF
H
S
T
G
H
S
T
H
G

Standardowy potencjał półogniwa
to
standardowa
siła
elektromotoryczna
ogniwa
zbudowanego
z
półogniwa
badanego po prawej stronie i półogniwa
wodorowego po lewej stronie, w którym
wyeliminowano
potencjał
dyfuzyjny.
Standardowy
potencjał
półogniwa
wodorowego w dowolnej temperaturze
przyjmujemy jako równy zero.
Standardowy potencjał półogniwa

Rodzaje półogniw
odwracalne względem
kationu
Pierwszego rodzaju
odwracalne względem
anionu
Drugiego rodzaju (odwracalne względem anionu)
Red-ox
Specjalne (membranowe)
Półogniwa pierwszego rodzaju
Składają się z pierwiastka i prostych jonów
tego pierwiastka w roztworze.
Odwracalne względem
kationu
Np. srebrowe
Np. wodorowe
s
aq
s
ag
Ag
e
Ag
Ag
Ag
g
2
aq
g
2
aq
H
e
2
H
2
Pt
H
H
Odwracalne względem
anionu
Np. chlorowe
aq
g
2
g
2
aq
Cl
2
e
2
Cl
Pt
Cl
Cl

Półogniwa drugiego rodzaju
Składają się z metalu, pokrytego trudno
rozpuszczalną solą tego metalu, a w
roztworze zawarte są aniony tej soli.
Np. chlorosrebrowe
Np. kalomelowe
aq
s
s
s
s
aq
Cl
Ag
e
AgCl
Ag
AgCl
Cl
aq
c
s
2
2
c
s
2
2
aq
Cl
2
Hg
2
e
2
Cl
Hg
Pt
Hg
Cl
Hg
Cl
Do
półogniw
drugiego
rodzaju
należą
półogniwa tlenkowe
, składające się z metalu
pokrytego cienką warstwą tlenku, zanurzone
w roztworze zawierającym jony OH
-
.
Np. antymonowe
Np. irydowe
aq
s
c
2
s
3
2
s
s
3
2
aq
OH
6
Sb
3
O
H
3
e
6
O
Sb
Sb
O
Sb
OH
aq
s
c
2
s
2
s
s
2
aq
OH
4
Ir
O
H
2
e
4
IrO
Ir
IrO
OH

Półogniwa red-ox
Składają się z metalu obojętnego chemicznie
(platyna, złoto) zanurzonego w roztworze, w
którym znajduje się para red-ox (np. jony
metalu na dwu różnych stopniach utlenienia).
Przykłady :
2
aq
3
aq
2
aq
3
aq
Fe
e
Fe
Pt
Fe
,
Fe
c
2
2
aq
aq
aq
4
aq
2
aq
aq
4
O
H
4
Mn
H
8
e
5
MnO
Pt
H
,
Mn
,
MnO
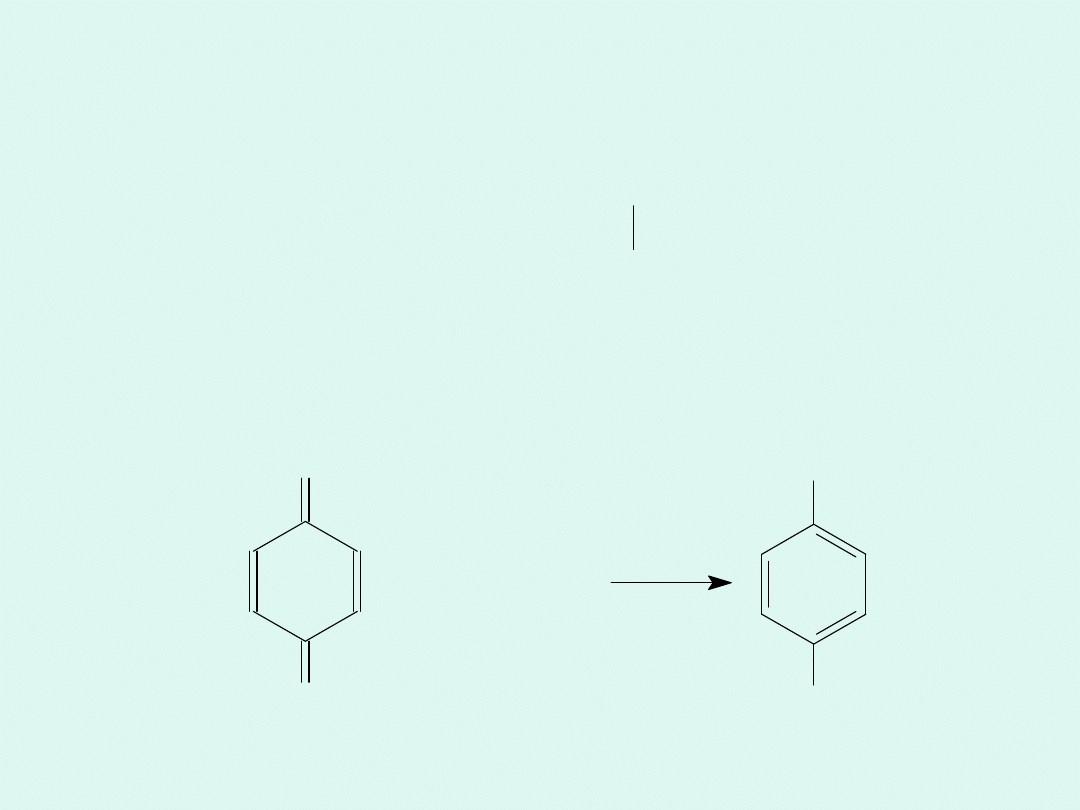
Półogniwa red-ox mogą zawierać parę red-ox
organiczną, np. półogniwo chinhydronowe.
Pt
H
,
QH
,
Q
aq
aq
2
aq
aq
2
4
6
aq
aq
2
4
6
OH
H
C
e
2
H
2
O
H
C
chinon (Q)
hydrochinon (Q)
O
O
+ 2 H
+
+ 2 e
OH
OH

Wyznaczanie pH
Do wyznaczania pH mogą służyć
półogniwa :
Wodorowe
Tlenkowe (antymonowe, irydowe)
Chinhydronowe
W praktyce najczęściej stosowana jest
elektroda szklana należąca do grupy
półogniw specjalnych
(membranowych).
H
a
lg
pH

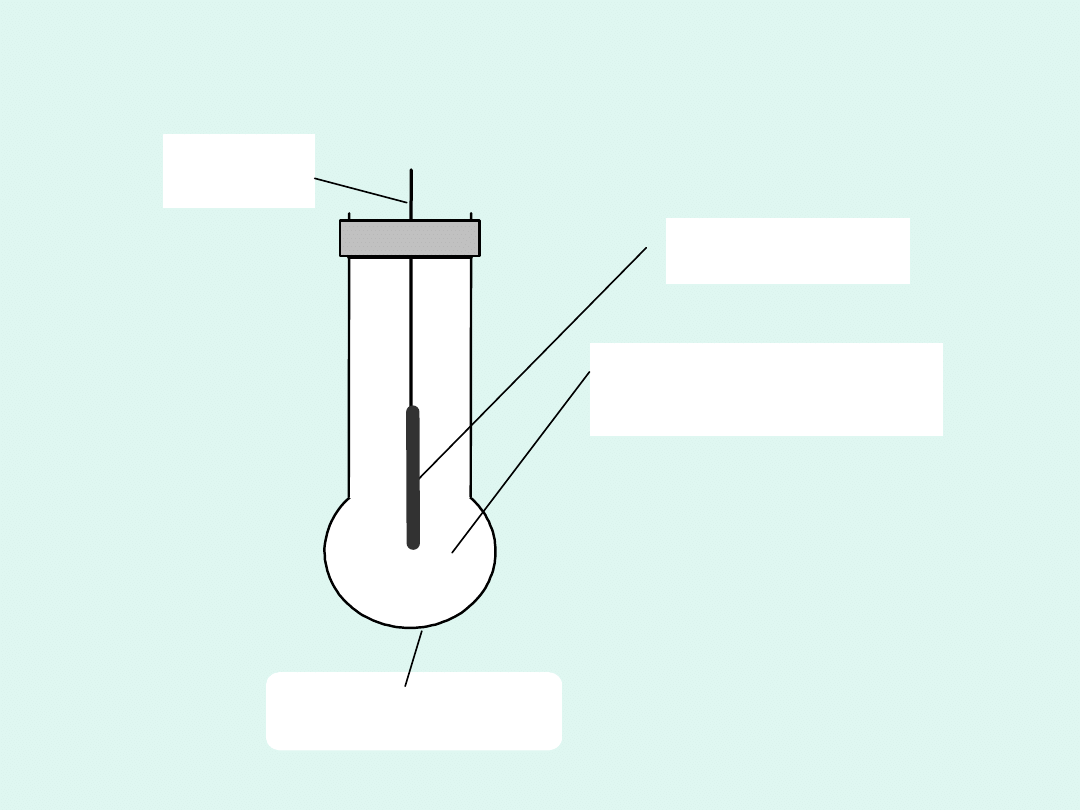
drut Ag
membrana szklana
warstewka AgCl
roztwór HCl (0,1 M)
Budowa elektrody szklanej
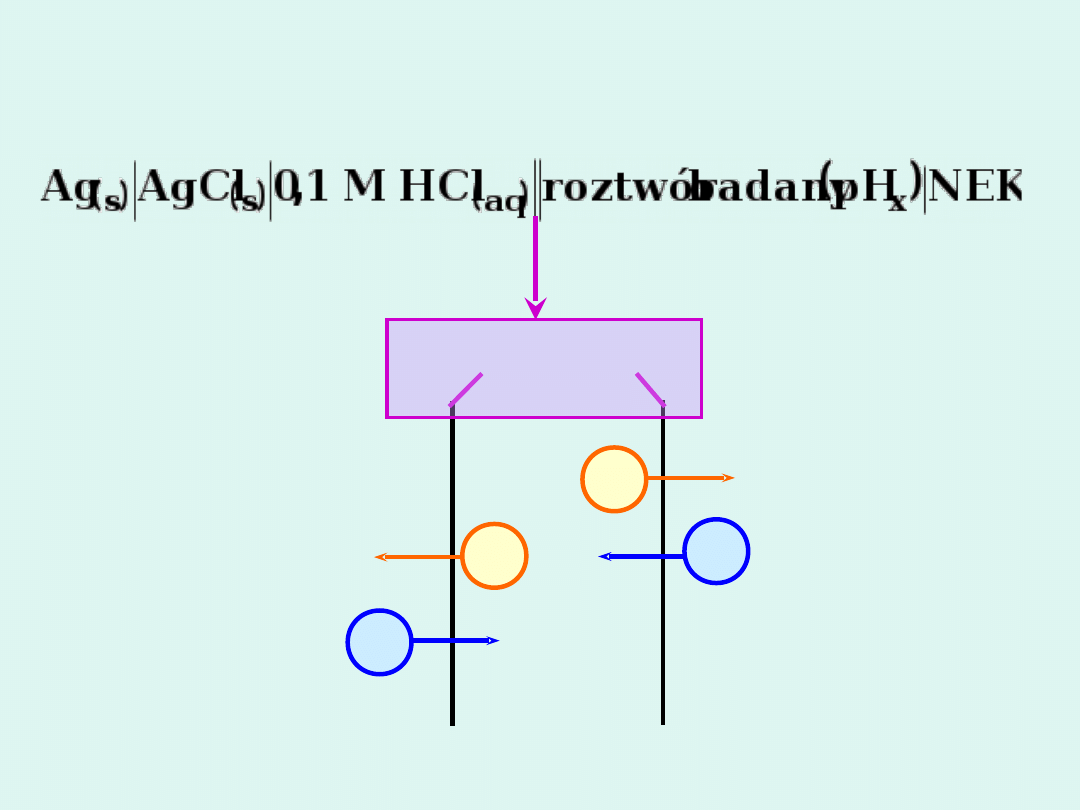
Schemat ogniwa do pomiaru pH przy
użyciu elektrody szklanej
szkło
0,1 M
HCl
roztwór badany
(pH
x
)
H
+
H
+
Na
+
Na
+
E
m1
= const E
m2
–
zmienne
membrana
szklana
NEK
–
nasycona
elektroda
kalomelowa

Potencjał membranowy – wzór
Nikolsky’ego
( )
( )
aq
aq
m
H
H Na
Na
RT
E
ln a
K
a
F
+
+
+
+
�
�
=-
+
�
�
�
�
�
�
�
Zwykle
i potencjał membranowy jest liniową funkcją pH
( )
( )
aq
aq
H
H Na
Na
a
K
a
+
+
+
+
>>
�
m
H
RT
RT
E
lna
ln10 pH
F
F
+
@-
=
�
( )
( )
aq
aq
H
H Na
Na
a
K
a
+
+
+
+
<
�
W środowisku zasadowym
i pojawia się błąd sodowy
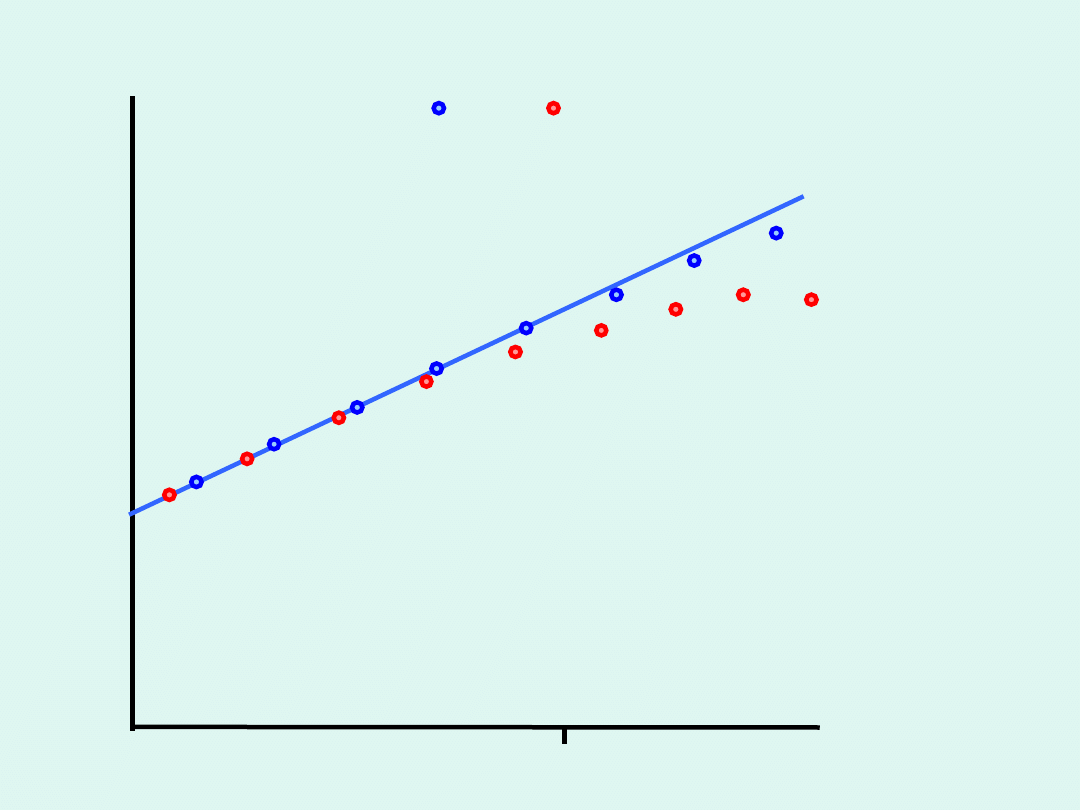
E
p
H
1
0
Błąd sodowy
Na
+
K
+







Podział ogniw

Ogniwa z przenoszeniem
to takie, w
których
istnieje
bezpośrednia
granica
kontaktu
dwu
różnych
roztworów
elektrolitów.
W
ogniwach bez przenoszenia
brak jest
granicy kontaktu pomiędzy dwoma różnymi
roztworami elektrolitów
W ogniwach z przenoszeniem, na granicy
pomiędzy dwoma roztworami elektrolitu dochodzi
do powstania gradientu stężenia na skutek różnej
ruchliwości poszczególnych jonów i różnych ich
stężeń. W efekcie ustala się równowagowy rozkład
ładunku i równowagowy skok potencjału zwany
potencjałem dyfuzyjnym
, który dodaje się do
siły elektromotorycznej ogniwa.
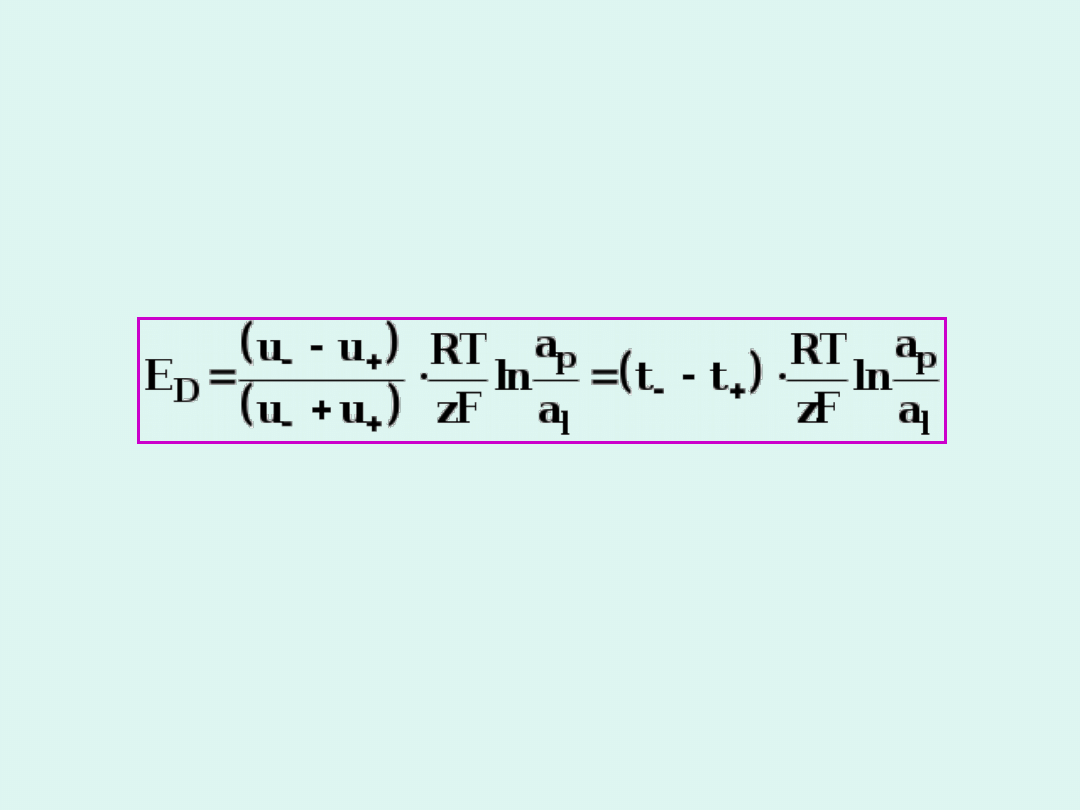
Potencjał dyfuzyjny
Wielkość potencjału dyfuzyjnego na granicy
pomiędzy dwoma roztworami tego samego
elektrolitu o różnych stężeniach jest określony
równaniem Hendersona.
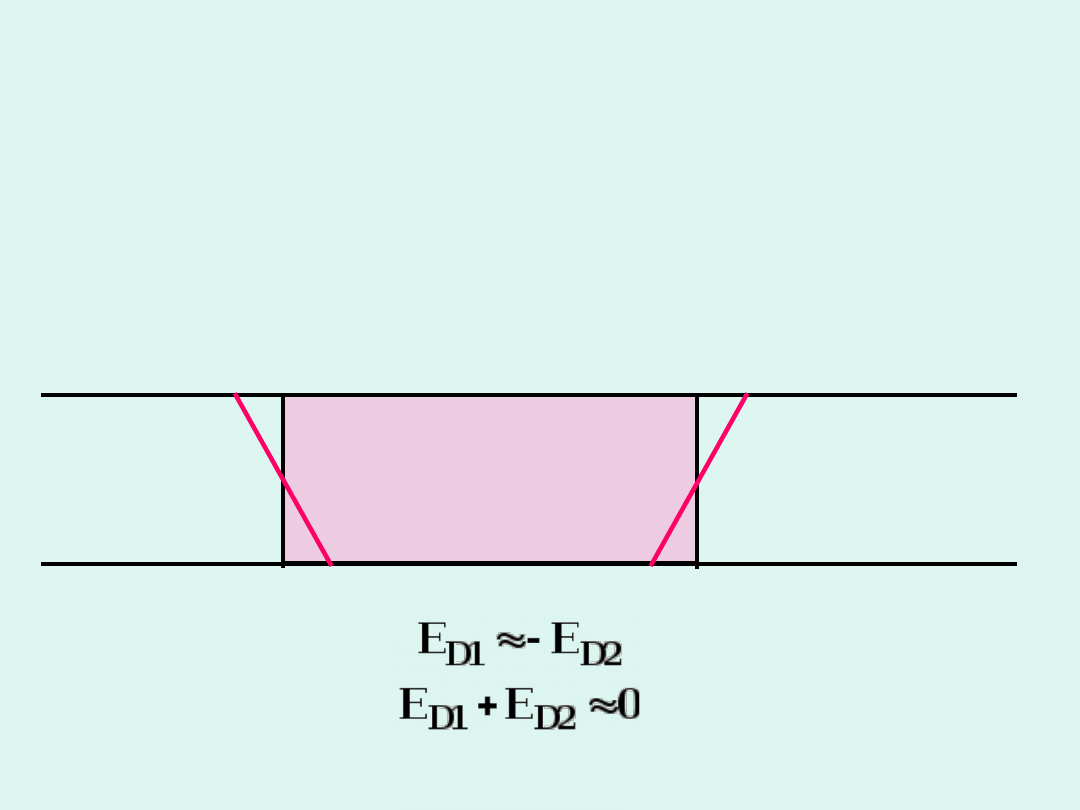
Eliminacja potencjału
dyfuzyjnego – klucz
elektrolityczny
Klucz elektrolityczny to U-rurka wypełniona
stężonym roztworem KCl lub KNO
3
(często z
dodatkiem agaru, aby zawartość miała postać żelu),
na obu końcach zamknięta szkłem porowatym.
klucz
elektrolityczny
lewe
półogniw
o
prawe
półogniw
o
E
D1
E
D2

Miareczkowanie
potencjometryczne
Miareczkowanie
potencjometryczne
polega
na
pomiarze
siły
elektromotorycznej
odpowiednio
dobranego ogniwa w czasie miareczkowania. Ogniwo
używane w takim miareczkowaniu musi składać się
zawsze z
półogniwa odniesienia
o stałym potencjale
i
półogniwa wskaźnikowego
(roboczego), którego
potencjał zależy od aktywności oznaczanej substancji.
Miareczkowanie potencjometryczne może być
zastosowane do każdego typu miareczkowania
znanego z chemii analitycznej :
kwasowo-zasadowego
strąceniowego
redox
kompleksometrycznego
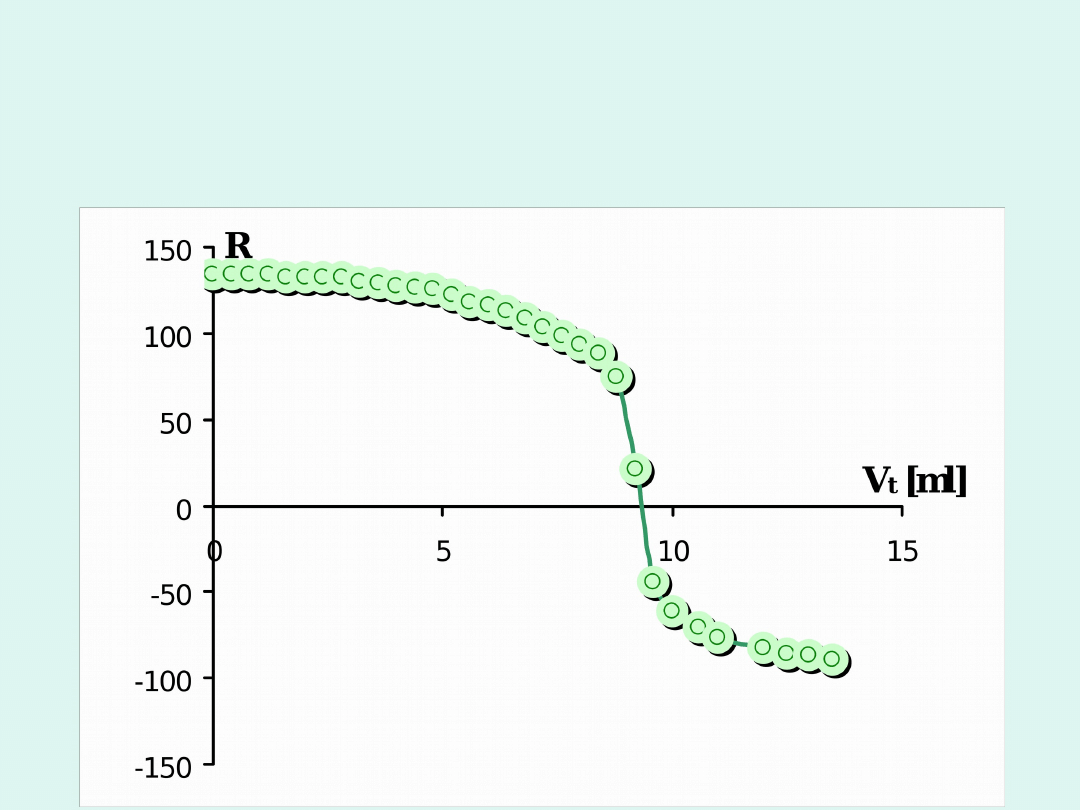
Miareczkowanie potencjometryczne
Przykład potencjometrycznego miareczkowania
strąceniowego (Oznaczanie jonów Ag
+
przez
miareczkowanie 0,05 M roztworem NaCl; SEM
mierzone metodą kompensacyjną).
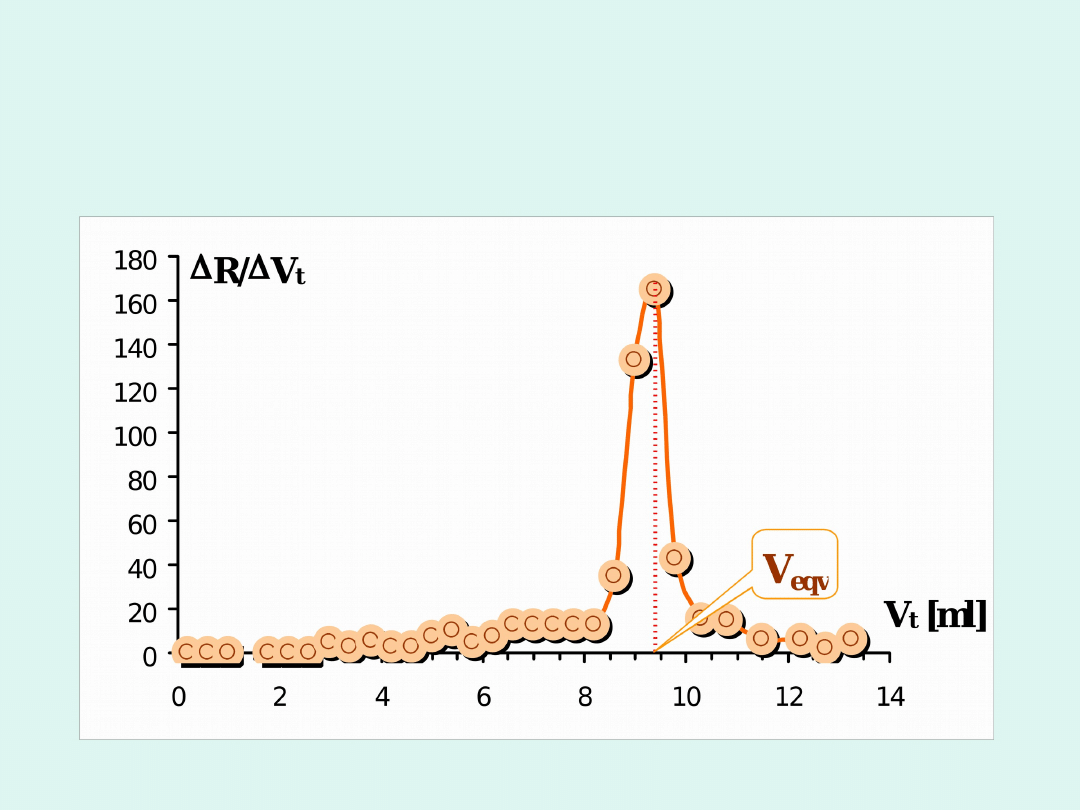
W celu dokładniejszego wyznaczenia punktu
równoważnikowego
zwykle
wykreśla
się
pierwszą pochodną SEM po objętości titranta.

Miareczkowanie pH-
metryczne
Miareczkowanie pH-metryczne jest odmianą
miareczkowania potencjometrycznego.
Polega na pomiarze pH w czasie
miareczkowania kwasowo-zasadowego z
wykorzystaniem elektrody pH-metrycznej
(zwykle szklanej).
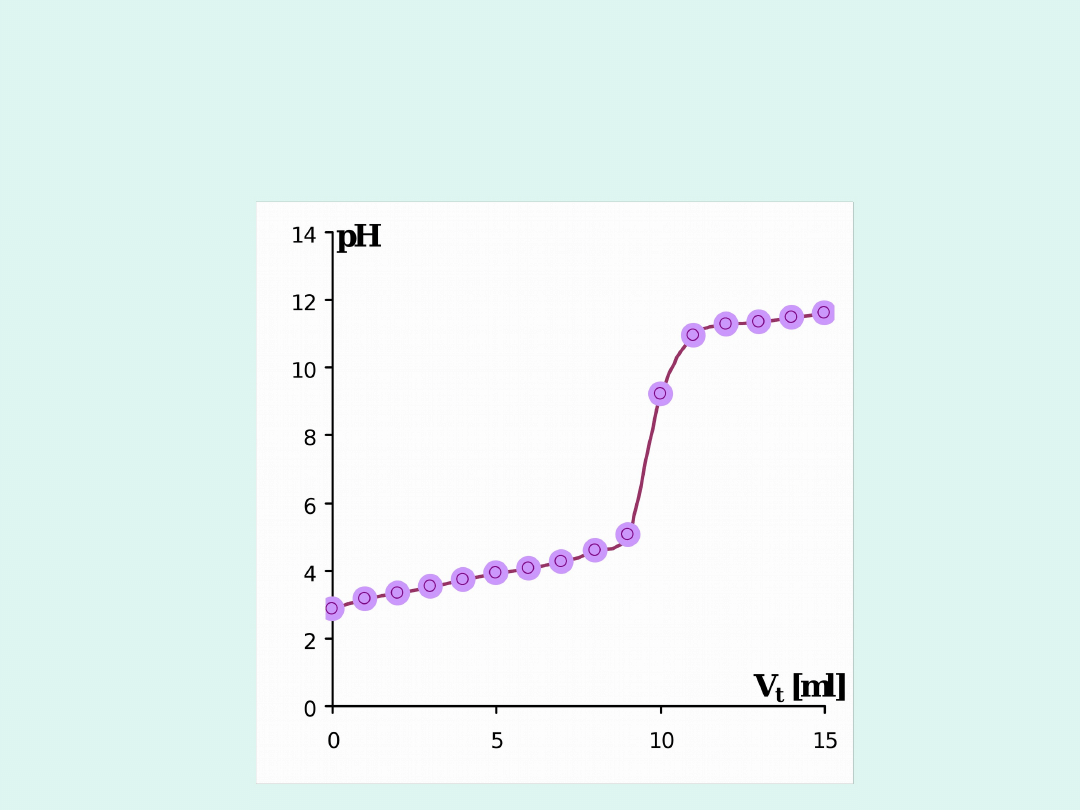
Miareczkowanie pH-metryczne
Krzywa
miareczkowania
próbki
kwasu
mlekowego przy użyciu 0,05 M roztworu
NaOH.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
14 Hydrodynamika 2id 15300 ppt
14 Zachowanie Przy Wypadkach 1 13 2id 15592 ppt
14 BIOCHEMIA cykl kwasu cytrynowego 2id 15387 ppt
14 zdrowie Polaków 2id 15678 ppt
06 Kwestia potencjalności Aid 6191 ppt
11 Resusc 2id 12604 ppt
1 GENEZA KOMERCYJNEGO RYNKU OCHRONY W POLSCE 2id 9262 ppt
20 2id 21226 ppt
08 BIOCHEMIA mechanizmy adaptac mikroor ANG 2id 7389 ppt
(1)Zarzadzanie instytucjami kredytowymi 2id 781 ppt
16 2id 16615 ppt
1Wstep i historia 2id 19223 ppt
więcej podobnych podstron