POLITECHNIKA WROCŁAWSKA
Wydział Chemiczny
CHEMIA NIEORGANICZNA – PODSTAWY
WYKŁAD
META
LE

Wykład 8 – METALE
Przemysłowe źródła podstawowych metali (Fe, Cu, Zn, Al)
Fe
Rudy tlenkowe
Rudy siarczkowe
Rudy węglanowe
Magnetyt Fe
3
O
4
Hematyt Fe
2
O
3
Limonit Fe
2
O
3·
xH
2
O
Piryt FeS
2
Syderyt FeCO
3

Wykład 8 – METALE
Przemysłowe źródła podstawowych metali (Fe, Cu,
Zn, Al)
Rudy siarczkowe
Cu
Chalkozyn Cu
2
S
Chalkopiryt CuFeS
2

Wykład 8 – METALE
Przemysłowe źródła podstawowych metali (Fe, Cu, Zn, Al)
Wurcyt ZnS
Blenda cynkowa ZnS
Rudy siarczkowe
Zn

Wykład 8 – METALE
Przemysłowe źródła podstawowych metali (Fe, Cu, Zn, Al)
Rudy tlenkowo - wodorotlenkowe
Al
Boksyt
Gibbsyt Al(OH)
3
Bemit γ-AlO(OH)
Diaspor AlO(OH)
Wykład 8 – METALE
Otrzymywanie metali z ich rud
Magnetyt Fe
3
O
4
+2, +3
Hematyt Fe
2
O
3
+3
Limonit Fe
2
O
3·
xH
2
O +3
Piryt FeS
2
+2
Syderyt FeCO
3
+2
Chalkozyn Cu
2
S
+1
Chalkopiryt CuFeS
2
+2, +2
Wurcyt ZnS
+2
Blenda cynkowa ZnS
+2
Gibbsyt Al(OH)
3
+3
Bemit γ-AlO(OH)
+3
Diaspor AlO(OH)
+3
MINERAŁ
ST. UT. METALU
METAL
REDUKCJA
C
u
Al
Z
n
F
e
Pirometalurgia
Hydrometalurgia
Biometalurgia
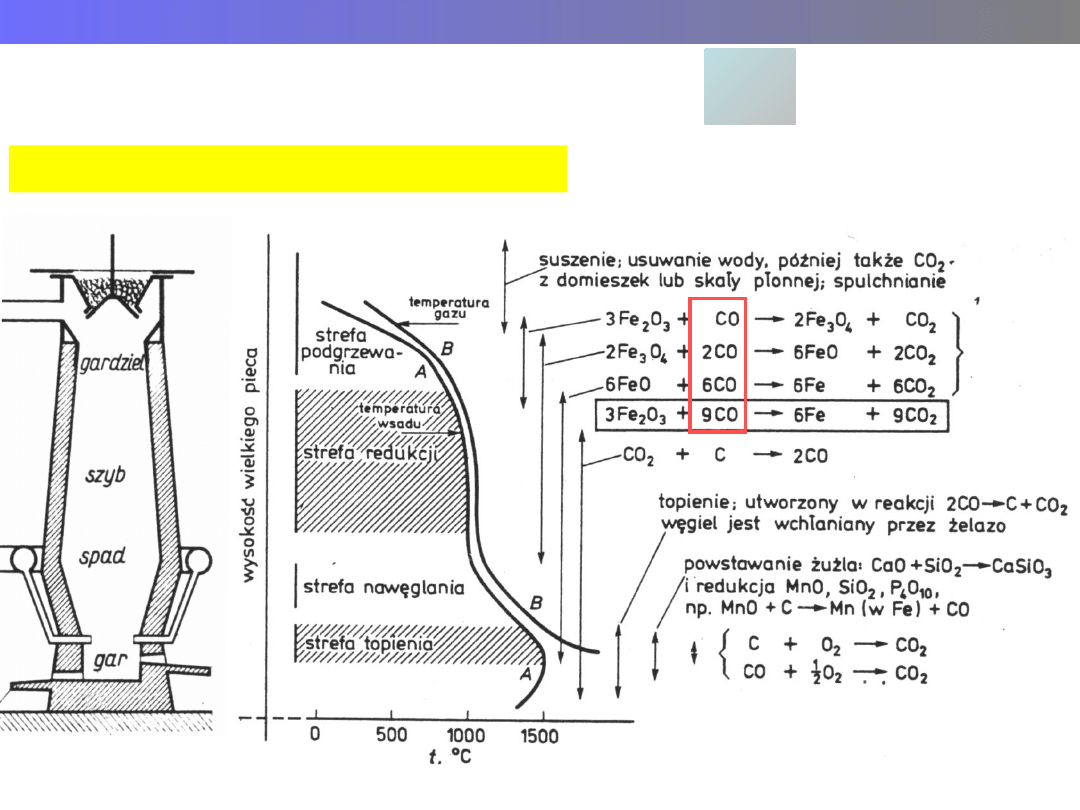
Wykład 8 – METALE
Metalurgia żelaza
Fe
Proces hutniczy - pirometalurgiczny
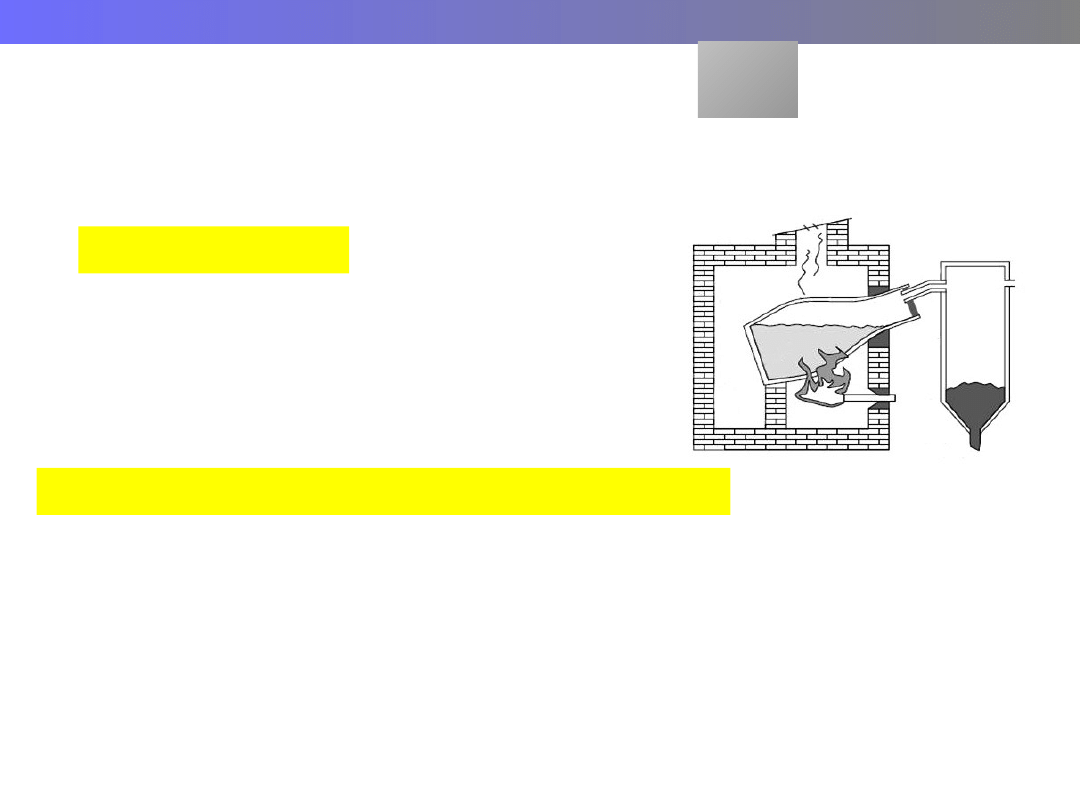
Wykład 8 – METALE
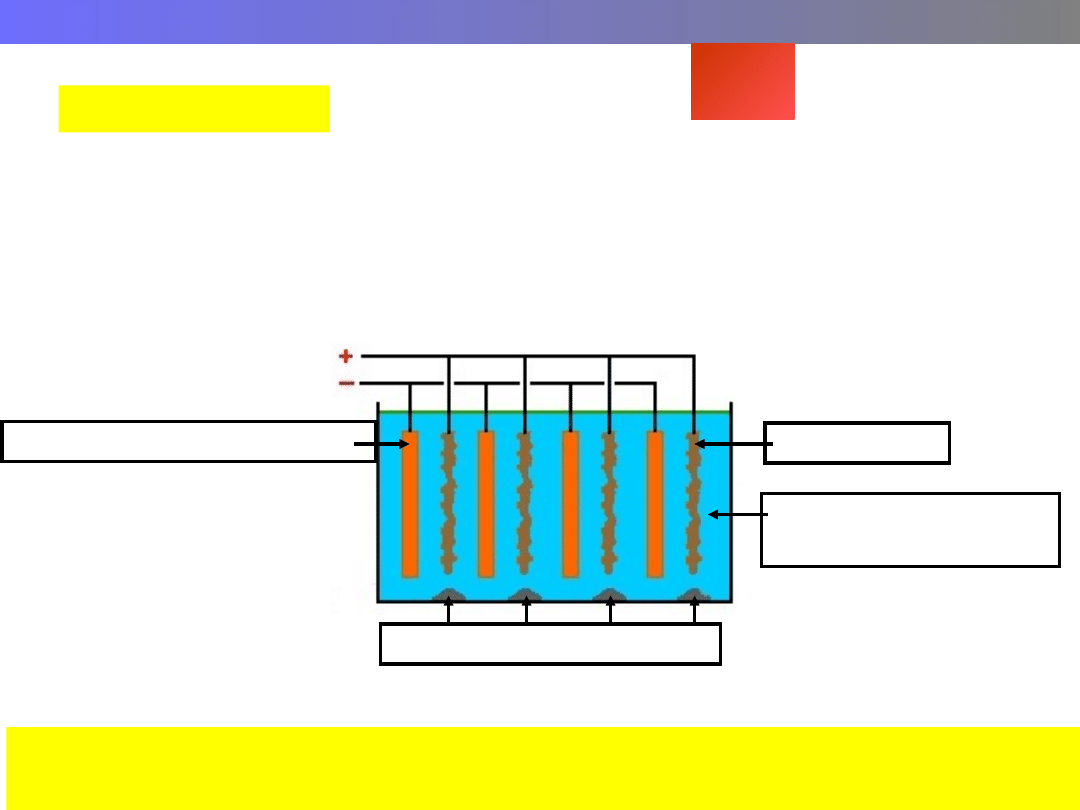
Metalurgia cynku
Zn
1. Prażenie rudy cynkowej
2ZnS + 3O
2
= 2ZnO + 2SO
2
2. Redukcja węglem
ZnO + C = Zn + CO
3. Destylacja metalu (t.wrz.= 1180 K)
Metoda hydrometalurgiczna - elektrolityczna
ZnO + H
2
SO
4
= ZnSO
4
+ H
2
O
1. Roztwarzanie ZnO w H
2
SO
4
2. Elektroliza
Katoda (–)
Zn
2+
+ 2e
–
= Zn
4OH
–
= O
2
+
2H
2
O + 4e
–
Anoda (+)
Metoda hutnicza
Wykład 8 – METALE
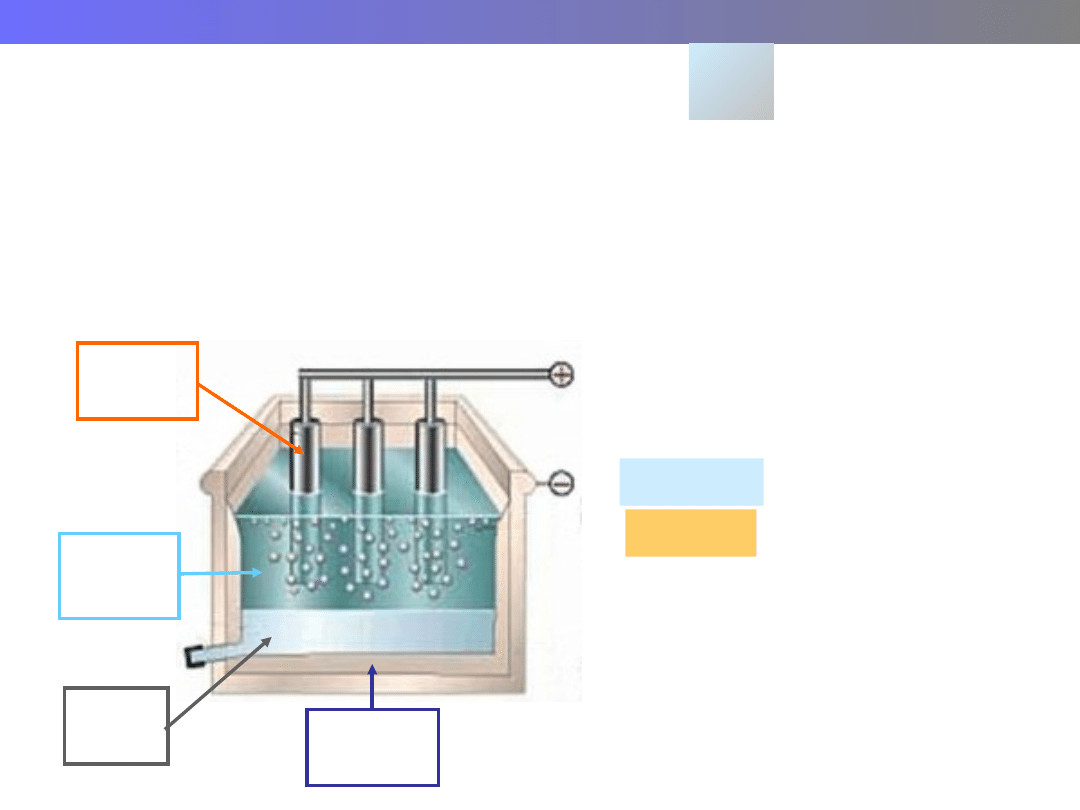
Metalurgia miedzi
Cu
1. Flotacja rudy (wzbogacanie)
2Cu
2
S + 3O
2
= 2Cu
2
O + 2SO
2
2. Prażenie i redukcja
Metoda hutnicza
2Cu
2
O + Cu
2
S = 6Cu + SO
2
3. Elektrorafinacja (oczyszczanie)
Miedź surowa
Miedź elektrolityczna 99,99%
Elektrolit: H
2
SO
4
Cu
2+
Ni
2+
Co
2+
Zn
2+
Fe
2+
Pb
2+
Szlam anodowy: Ag, Au, Pt
Cu [t] Ag [t] Pb [t] CuSO
4
[t] NiSO
4
[t] H
2
SO
4
[t] Au[kg]
560255 1244 21050 6769 2027 621570 713
Produkcja KGHM w roku 2005
Bakterie
Do otrzymania metalicznej miedzi poprzez elektrolizę lub
cementację potrzebna jest rozpuszczalna sól tego metalu
Cementacja cynkiem
Cu
2+
+ Zn = Cu + Zn
2+
Użyteczne minerały miedzi są trudnorozpuszczalne
I
r
(Cu
2
S) = 2·10
–47
Przeprowadzanie
Cu
2
S
w dobrze rozpuszczalny
CuSO
4
- siarczan
miedzi(II)
Cu
2
S + H
2
SO
4
+ 5/2O
2
2CuSO
4
+ H
2
O
Bakterie:
Thiobacillus ferrooxidans
Cu
2
S
CuSO
4
H
2
S
O
4
T.ferroox
.
Wykład 8 – METALE
Biometalurgia miedzi
Wykład 8 – METALE
Metalurgia glinu
Al
1. Prażenie i oczyszczanie boksytu
Al(OH)
3
+ AlO(OH) → Al
2
O
3
2. Elektroliza Al
2
O
3
w stopionym kriolicie, Na
3
AlF
6
(T=1220 K)
Al
3+
+ 3e
–
= Al
2O
2–
= O
2
+ 4e
–
KATODA
ANODA
ANODA
(grafit)
KATODA
(grafit)
Al
2
O
3
Na
3
AlF
6
Ciekły
glin
Wykład 8 – METALE
Roztwarzanie metali w kwasach, zasadach i w wodzie
KWASY
K Ca Na Al Zn Cr Fe Ni Pb
H
Cu Ag Hg
Au
Szereg napięciowy metali
0
Ox/Re
E
Metale nieszlachetne –
H
+
jako utleniacz
Metale szlachetne
Fe + 2HCl = FeCl
2
+ H
2
Fe + 2H
+
= Fe
2+
+ H
2
Zn + H
2
SO
4
= FeSO
4
+ H
2
Zn + 2H
+
= Zn
2+
+ H
2
2Al + 2H
3
PO
4
= 2AlPO
4
+ 3H
2
2Al + 6H
+
= 2Al
3+
+ 3H
2
3Cu + 8HNO
3
=
= 3Cu(NO
3
)
2
+ 2NO + 4H
2
O
Cu + 2H
2
SO
4
(st.) =
= CuSO
4
+ SO
2
+ 2H
2
O

Wykład 8 – METALE
Roztwarzanie metali w kwasach, zasadach i w wodzie
ZASADY
2Al + 2NaOH + 6H
2
O = 2Na[Al(OH)
4
] + 3H
2
3Fe + 4H
2
O = Fe
3
O
4
+ 4H
2
T ~500 K
WODA
2Na + 2H
2
O = 2NaOH + H
2

Wykład 8 – METALE
Stopy metali
Stopy – stałe roztwory metali, powstające po stopieniu dwóch lub
więcej metali, wziętych w odpowiednich proporcjach
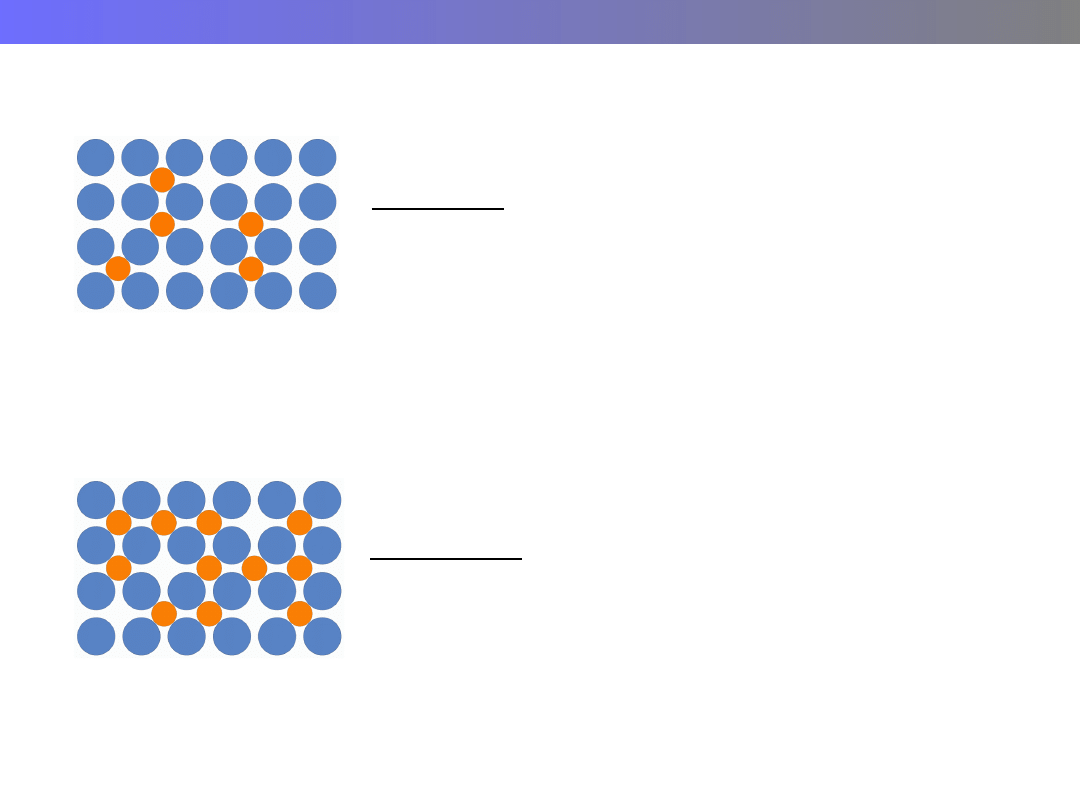
Rodzaje stopów
Substytucyjny
nieuporządkowany
Substytucyjny
uporządkowany
Warunki tworzenia stopów substytucyjnych:
a) równopostaciowość (ten sam typ sieci krystalicznej) składników A i B)
b) zbliżone promienie atomowe (różnica do 15%)
c) zbliżone właściwości chemiczne składników A i B
Wykład 8 – METALE
Substrakcy
jny
Śródwęzło
wy
Warunek: Atomy wchodzące w luki muszą
być dostatecznie małe (H, B, C, N) w
stosunku do atomów tworzących sieć (Fe,
Ti, W).
Przyczyna: Stosunek zawartości składników
A i B wymusza nie obsadzenie niektórych
pozycji (luk).

Wykład 8 – METALE
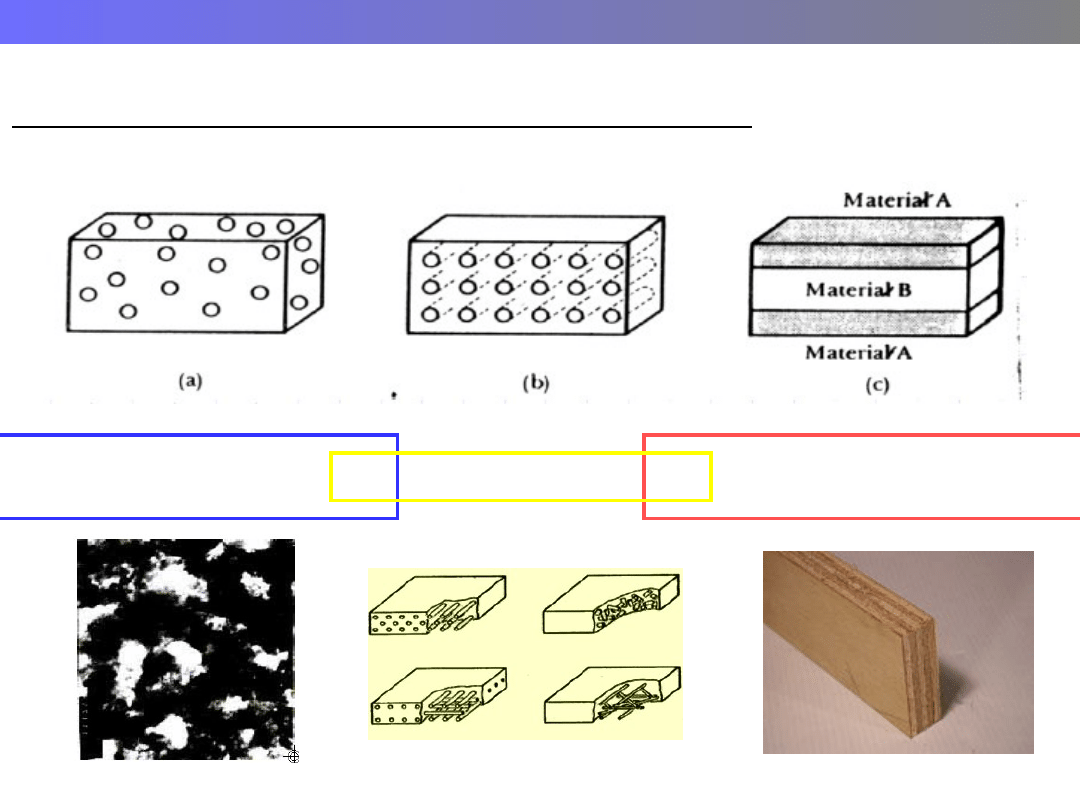
Materiały kompozytowe
Materiał kompozytowy (lub kompozyt) - materiał o
strukturze
niejednorodnej, złożony z dwóch lub więcej
komponentów (faz)
o różnych właściwościach.
Skład
kompozytu:
Osnowa – najczęściej polimer, może być także
metal
( np. tytan, glin, miedź) lub ceramika ( np. tlenek
glinu).
Zbrojenie – silne włókna takie jak: metaliczne, szklane, kwarcowe,
polimerowe, węglowe, dające materiałowi dużą odporność na
rozciąganie.
●utrzymuje razem zbrojenie
●zapewnia wytrzymałość na ściskanie
●przenosi naprężenie zewnętrzne na
zbrojenie,
●zatrzymuje rozprzestrzenianie się
pęknięć,
●nadaje wyrobom żądany kształt.
●poprawa właściwości mechanicznych i/lub użytkowych
●zmniejszenie kosztu materiałów
Wykład 8 – METALE
Klasyfikacja kompozytów ze względu na budowę
c) Kompozytu warstwowe
(laminaty)
a) Kompozyty ziarniste
(cząstkowe)
b) Kompozyty włókniste
Cząstki Al w Ge

Wykład 8 – METALE
•żelazo-beton (Żelbet)
Przykłady:
•szkło zbrojone siatką metalową
•kompozyty metalowe typu osnowa metalowa - włókna
metalowe (np. miedź-wolfram, aluminium-bor) lub osnowa
metalowa - włókna ceramiczne, np. tytan-węglik krzemu
(Ti/SiC).
•włókna metalowe w innym metalu
•włókna Ti w SiC

Wykład 8 – METALE
Przykłady: - kompozyty w lotnictwie
Grafit
Wzmocniony grafit
Włókna
szklane
K.mieszane
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
FP w 08
08 Elektrownie jądrowe obiegi
archkomp 08
02a URAZY CZASZKOWO MÓZGOWE OGÓLNIE 2008 11 08
ankieta 07 08
08 Kości cz Iid 7262 ppt
08 Stany nieustalone w obwodach RLCid 7512 ppt
2009 04 08 POZ 06id 26791 ppt
08 BIOCHEMIA mechanizmy adaptac mikroor ANG 2id 7389 ppt
depresja 08 09
W15 08 II
Szkol Ogólne 08 1pomoc
08 NIEDZIELA ZWYKŁA B
08 md wykl8
więcej podobnych podstron